Contents
Nasal vaccines for respiratory infections.
https://doi.org/10.1038/s41586-025-08910-6
接收日期:2024年5月28日
接受日期:2025年3月18日
在线发表日期:2025年5月7日
检查更新
广志小野12.3.4 & 彼得·B·恩斯特1,2,3.5
自爱德华·詹纳发现天花疫苗以来,不断扩充的病原体疫苗库挽救了许多生命。在COVID-19大流行期间,一种革命性的mRNA注射用疫苗出现,有效控制了SARS-CoV-2引起的疾病严重程度。该疫苗诱导出强效的抗原特异性中和血清IgG抗体,但限制了其阻止病毒侵入呼吸道表面的能力。鼻喷疫苗作为一种潜在策略引起了关注,用于抗击呼吸道感染并为未来的大流行做准备。来自微生物学、生物材料学、生物工程学和化学等学科的输入补充了免疫学,创建了创新的递送系统。这种疫苗递送方法产生了能诱导分泌型IgA以及血清IgG抗体的鼻喷疫苗,预计能阻止病原体侵入,从而减少传播和疾病严重程度。要使鼻喷疫苗成功,必须考虑相关解剖、生理和免疫属性的复杂性,包括中枢神经系统与鼻腔的接近程度。在这篇中,我们讨论了过去和当前的努力,以及未来开发安全有效的鼻喷疫苗以预防呼吸道感染的方向。
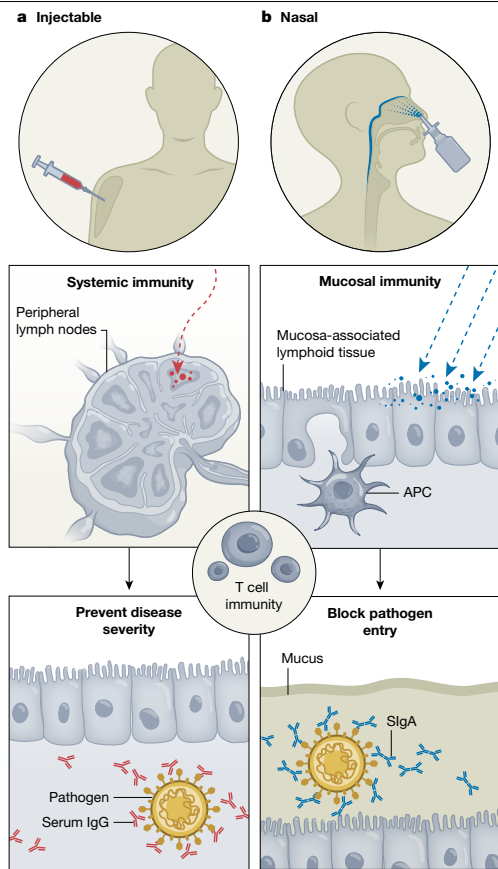
覆盖呼吸道和消化道的粘膜表面不断暴露于许多吸入或摄入的微生物挑战1-3。因此,这些表面需要一个高度适应的粘膜免疫系统,该系统能够独立于全身免疫反应被诱导和协调。多年来,人们一直在尝试减少粘膜感染的影响。中国在十世纪时就有实践,即对小痘病灶的痂皮进行鼻部给药4。更近期,有证据显示含有活流感病毒的鼻部疫苗比注射疫苗更有效,基于约10,000名日本学生的缺勤显著减少5。尽管鼻部疫苗通过流行病学证据被证实有效,但它尚未成为控制呼吸道感染的普遍方法。
COVID-19大流行使粘膜免疫重新成为疫苗开发策略的前沿。广泛使用的注射疫苗——包括SARS-CoV-2 mRNA疫苗——诱导出针对病原体的特异性血清IgG中和抗体,预防大多数严重疾病(例如,在肺部)7。然而,注射疫苗在诱导粘膜IgA反应方面效果较差,因此无法在病原体入侵部位提供保护8-11。相比之下,鼻部疫苗不仅能够诱导全身免疫反应(例如,IgG),还能诱导针对病原体的特异性粘膜免疫(例如,分泌型IgA(SIgA)),从而提供全面的免疫12,13(图1)。尽管研究较少,鼻内疫苗也能在呼吸道组织诱导CD4+和CD8+ T常驻记忆(TRM)细胞。肺部的 T_{RM} 细胞提供长期免疫和保护作用14,15。此外,呼吸道的 CD8+ T_{RM} 细胞减少感染细胞以及病毒的传递,甚至还有抗体16。因为呼吸道感染是在气道的粘膜帮助表面开始的,鼻内疫苗接种被认为是诱导针对如SARS-CoV-2、流感病毒、呼吸道合胞病毒(RSV)、肺炎链球菌等病原体的保护的合理手段17-20。
鼻内疫苗开发的考虑因素
呼吸道粘膜提供了一个生理和免疫学屏障,保护宿主1,6,19,21,22。这些表面被纤毛上皮细胞覆盖,有助于排除吸入的物质22。上皮杯状细胞分泌粘液,粘液捕获吸入的颗粒,然后通过纤毛运动从腔体中清除23,24。因此,鼻腔的屏障功能有助于通过呼吸道粘膜表面尽量减少病原体进入体内。同样,这些生理屏障会妨碍鼻内疫苗抗原的有效递送。
气道粘膜还包括鼻咽相关淋巴组织(NALT),这是诱导对吸入抗原的抗原特异性免疫反应的部位1,6,25(图2)。人类不成对的鼻咽扁桃体(腺样体)和成对的腭扁桃体(瓦尔德耶尔环)构成了NALT结构。与人类鼻咽组织不同,啮齿动物的NALT(鼻咽相关淋巴组织)在腔道的基底外侧发育,这在解释小鼠鼻部疫苗接种研究结果时可能是一个重要考虑因素。NALT包含启动和调节抗原特异性免疫反应所必需的所有细胞,包括针对致命病毒感染的大噬细胞、B细胞和T细胞。例如,在没有病毒特异性辅助性T细胞的情况下,调节性T细胞、滤泡辅助性T细胞(TFH细胞)等。
以及常驻记忆B细胞,这些细胞在健康成年人中随时间是稳定的。在含有B和T细胞的腺样体中观察到活跃的生发中心形成,为IgA诱导提供必要元素。
鼻副腺被一层含有腔内抗原清除微皱褶细胞(M细胞)的上皮覆盖。吸入的抗原被M细胞捕获并立即转移到下面的抗原呈递细胞以激活产生IgA类别转换和增强细胞因子的局部T细胞(例如,TGFβ1和IL-5)。这有助于生成抗原特异性的IgA+ B细胞(见图2)。鼻副腺衍生的IgA+ B细胞主要表达CCR10,并聚集在鼻甲和腺状鼻窦组织中,在那里CCR10配体CCL28被表达。获得趋化因子受体——如CCR9和CCR10——使它们能够定位到表达相应配体CCL25和CCL28的黏膜效应部位(参考文献20、32-34)。这种定向迁移构成了共同粘膜免疫系统(见图2)。当CCR3-CXCL9/CXCL10介导的IgA浆细胞迁移到嗅觉粘膜,阻断病原体向嗅球和中枢神经系统(CNS)的传播时,就展示了这种归巢的效果(见图2)。
抗原特异性的IgA+ B细胞迁移到鼻粘膜后分化成浆细胞。一旦成为浆细胞,它们就会产生聚合型IgA(见图2)。聚合型IgA与多聚免疫球蛋白受体结合后,该复合物通过上皮细胞运输并被分泌到腔道中,形成分泌型IgA(SIgA)(见图2)。分泌型免疫球蛋白A(SIgA)利用多个Fab抗原结合位点捕获病原体,并阻止它们粘附于黏膜表面。通过检查感染SARS-CoV-2个体的病毒脱落情况,证实了SIgA的重要性41。针对SARS-CoV-2刺突(S)蛋白的特异性SIgA抗体降低了病毒RNA载量和传染性。当从四个针对S蛋白受体结合域(RBD)的中和性单克隆IgG抗体工程改造出重组单体、二聚体和SIgA1抗体,并将它们的活性与其亲本抗体进行比较时,改造出的二聚体和SIgA1抗体对包括奥密克戎谱系BA.1、BA.2和BA.4/5在内的几种变体表现出更高的中和活性42。因此,开发能有效诱导局部抗原特异性SIgA以阻止病原体初步入侵的鼻用疫苗是一种引人注目的策略。
除了由鼻咽淋巴组织(NALT)启动的抗原特异性免疫外,鼻甲黏膜层含有一层含有呼吸型M细胞的单层上皮32、43。这为鼻部给药的抗原提供了另一种抗原摄取部位。此外,鼻部给药的抗原可以直接被树突细胞吞噬,这些树突细胞的树突延伸至上皮细胞之间以及鼻腔内44。抗原被吞噬后,这些细胞迁移至区域淋巴结(例如,颈部淋巴结),以启动抗原特异性免疫6、19、20,见图2。因此,鼻腔是一个高效的抗原采样部位,能够增强粘膜抗原特异性免疫反应的诱导,使其成为疫苗输送的一个合理目标。
对鼻用疫苗的需求
鼻用疫苗相比注射剂型具有实际优势19,20:(1)由于侵入性较小,避免了患者与针头相关的疼痛和焦虑;(2)可以自我接种,从而便于大规模接种疫苗;(3)鼻部疫苗接种能有效诱导粘膜和全身免疫,从而预防病原体侵入气道和其他地方病情的严重性;以及(4)鼻途径能诱导交叉反应的IgA抗体45,46。后一点通过使用流感的小鼠模型得到证实,该模型中,仅鼻部而非全身接种重组流感神经氨酸酶蛋白能诱导来自组织驻留型IgA产生细胞的交叉反应IgA抗体。这提供了针对异源和同源病毒感染的防护46。
2003年对FluMist的人类临床试验显示,其对于三种不同亚型——甲型流感A/德克萨斯州/36/91(H1N1)、甲型流感A/山东/9/93(H3N2)以及乙型流感B/巴拿马/45/90——的感染提供了比注射用三价灭活疫苗更广泛的保护47。FluMist是美国食品药品监督管理局(FDA)批准的唯一鼻内疫苗。FluMist现在是四价、减毒的流感鼻部疫苗,其效力与流感疫苗相当。批准不包括年龄小于2岁或大于50岁的人,或者免疫力低下或怀孕的人。尽管如此……
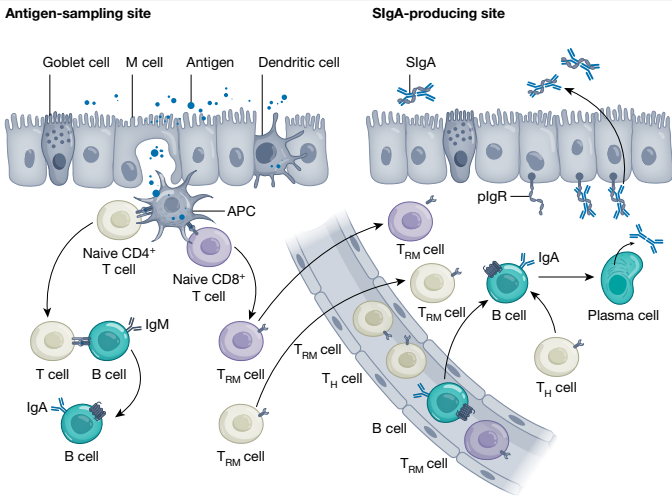
然后迁移到区域淋巴结(尤其是扁桃体)以启动抗原特异性免疫。因此,鼻腔富含多样化的抗原采样系统,用于启动抗原特异性的黏膜抗体和T细胞介导的免疫。抗原特异性的淋巴细胞,包括组织化的淋巴结构(鼻相关淋巴组织NALT和颈部淋巴结)中的IgA+B细胞和T细胞,也获得黏膜印记分子,包括归巢和趋化因子受体,并迁移到黏膜效应部位以生成分泌型IgA(SIgA)抗体。人们认为,在抗原采样部位诱导出TRM细胞后,其中一些会停留,而其他一些则迁移到SIgA产生部位。抗原特异性淋巴细胞迁移进入呼吸道粘膜固有层,包括鼻腔后,IgA+B细胞通过抗原特异性TH2细胞产生的细胞因子分化成IgA浆细胞。这些IgA浆细胞产生聚合形式的IgA,然后与位于上皮细胞基底膜上的聚合免疫球蛋白受体(pIgR)结合,并作为SIgA抗体被运输到腔道。
需要处方,FluMist的一个主要优势是父母和照顾者可以在医疗环境之外给予这种疫苗(https://www.fda.gov/vaccines-blood-biologics/vaccines/flumist)。
另一种鼻内活减毒流感疫苗(阿斯利康,2018/19配方)已证明能在人体黏膜和血液中诱导出不同的IgA和IgG反应。黏膜IL-33与鼻部免疫后第1天和第7天的 2型免疫以及不同的CD8+ T细胞和循环细胞反应相关。此外,这些反应被认为是鼻部疫苗接种诱导的保护作用的相关指标。补充图1总结了目前流感疫苗鼻部疫苗开发的现状。
鼻部疫苗成功的秘诀
为了成功,鼻部疫苗必须解决鼻腔内的独特生理环境19,20。鼻部疫苗抗原容易被鼻部分泌物稀释并由纤毛上皮清除,可能会妨碍抗原的结合、采样和处理23,24,49。鼻部分泌物还含有能降解疫苗抗原的蛋白酶和氨基肽酶50。在人类中,鼻部给予的液体疫苗配方的体积限制在大约200微升。这些物理和生理特性必须考虑在内。为此,免疫学载体和其他学科的专家的综合努力已经创建了新型递送系统(例如,复制型和非复制型形式)以推进鼻部疫苗的发展19,52(图3)。
鼻部疫苗的复制型递送系统
复制型递送系统包括重组腺病毒、流感病毒、副流感病毒和疱疹病毒,它们在宿主体内复制以持续递送疫苗抗原53,54。这些系统提供了抗原蛋白的稳定表达,并且能够无佐剂诱导局部细胞毒性T细胞反应。一项在血清阴性的成人中进行的临床试验,使用编码呼吸道合胞病毒F抗原的活病毒载体副流感病毒5型(PIV5)鼻用疫苗(BLB201),结果显示没有副作用且具有良好的免疫原性。检测到了鼻部和血清中的呼吸道合胞病毒F特异性抗体反应以及抗原特异性的CD4+和CD8+ T细胞。除了这些系统外,还研究了包括乳酸杆菌、沙门氏菌和李斯特菌在内的细菌载体。乳酸杆菌是非致病的相对安全的载体,在针对假结核耶尔森氏菌、结核分枝杆菌和严重急性呼吸综合征冠状病毒2型的鼻用疫苗测试中被认为是有前途的候选者58,59。
非复制性和生物相容性递送系统
非复制性病毒载体解决了与鼻用疫苗成功开发相关的安全问题,因为它能够快速表达并增加疫苗抗原的生产,同时刺激先天性和适应性免疫。
减毒病毒疫苗

缺点
● 存在病毒回复突变体( revertant)的可能性
● 对免疫力低下者禁用
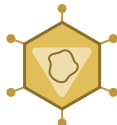
优点
● 复制缺陷型
● 包括细胞毒性T细胞反应在内的强烈免疫应答
亚单位疫苗

优点
● 使用纯化抗原
● 针对病原体特定成分的体液免疫反应
● 禁忌症
● 需要高生物安全级别
● 通常需要加强剂
● 先天性获得性
免疫接种
● 通过黏膜屏障进行疫苗递送
图3 | 鼻部疫苗配方的比较。为了开发一种成功的针对呼吸道病毒感染的鼻部疫苗,疫苗的配方,包括递送系统,必须应对鼻腔独特的解剖特性。通常,已考虑了三种鼻部疫苗形式:减毒活病毒、病毒载体和基于亚单位的配方。一种经典的病毒疫苗形式,可用于鼻部接种,是全杀灭病毒或逆向基因改造病毒。包括腺病毒、流感病毒、副流感病毒和疱疹病毒在内的活病毒载体已被证明是有效的复制型递送系统。为了克服复制型病毒载体的安全性问题,已开发了非复制型病毒载体,它们能快速表达并增加所需抗原的产生,用于诱导抗原特异性免疫。关于疫苗的安全性,普遍认为亚单位型抗原制剂(或纯化抗原)是合适的候选物。在将亚单位配方应用于鼻部疫苗时的一个关键问题是开发对抗原递送载体,使其对鼻腔的恶劣环境使其能够有效地将疫苗抗原递送至呼吸道粘膜免疫系统。为此,生物材料与纳米材料科学的结合促成了疫苗递送聚合物和化合物的开发,这些聚合物和化合物在尺寸、生物可接受性和安全性方面可控。
这些载体是一种有前途的疫苗平台,因为它们不需要共同给予的佐剂。
其他非复制型疫苗递送系统整合了由天然和合成的聚合物或各种合成化合物组成的生物材料和纳米材料,这些材料在尺寸、生物可接受性和安全性方面可控61-63(图3)。因此,具有不同共价性的纳米材料可以携带抗原,从而使其具备针对目标组织的独特环境的能力19,64。例如,带有阳离子胆固醇基团普鲁兰(cCHP)的纳米凝胶是一种有前途的材料,它能够有效地将疫苗抗原递送至鼻腔粘膜表面32,6;胆固醇基团普鲁兰(CHP)纳米凝胶是一种含有癌症肽抗原纳米凝胶的可注射疫苗,由多糖普鲁兰和一个形成疏水聚集体球形结构的胆固醇基团组成1组形成疏水聚集体球形结构19,32,66。蛋白质抗原易于被纳米材料包裹,这些纳米材料充当伴侣蛋白,在重折叠成天然形态时释放抗原货物68。
由于鼻黏膜上皮细胞处于负电荷状态,因此已经将带阳离子的氨基团引入到CHP纳米凝胶中。这使得纳米凝胶能够高效地附着在黏膜表面,从而提升其作为疫苗递送系统的应用(图4)。
鉴于它们作为鼻部疫苗递送系统的潜力,正在开发几种基于cCHP的疫苗,针对各种呼吸道感染。特别是由所有肺炎链球菌血清型表达的肺炎链球菌表面蛋白A(PspA),是一种具有吸引力的候选疫苗抗原,因为它能在不同血清型之间诱导交叉反应性免疫应答。为了开发一种能针对所有肺炎链球菌血清型的疫苗,已经配制并在小鼠和非人灵长类动物中测试了含有PspA的cCHP纳米凝胶(cCHP-PspA)。当经鼻给予小鼠时,cCHP-PspA在鼻灌洗液中诱导出特异于PspA的SIgA和IgG抗体。为了开发一种针对鼻腔和肺部细菌的疫苗。这导致了对致死性肺炎链球菌呼吸道挑战的保护作用。cCHP-PspA鼻部疫苗还在恒河猴中进行了测试,其中鼻部免疫诱导出了高滴度的特异于PspA的血清IgG和黏膜IgA抗体,并为不同肺炎链球菌血清型的气管内挑战提供了保护性免疫。这些临床前研究确定了cCHP-PspA鼻部疫苗作为未来用于人体临床试验的有前途的候选者。采用共轭热休克蛋白(cCHP)系统来针对由不可分型流感嗜血杆菌(NTHi)引起的耳部感染。由于P6蛋白在90%的NTHi菌株中保守,因此将其纳入cCHP纳米凝胶(cCHP-P6)中。cCHP-P6能有效诱导鼻或血清中的特异性IgA抗体(见图4)。最初,一种非阳离子型的疫苗被开发出来用于预防与耳部感染、鼻窦炎相关的NTHi衍生感染。
基于cCHP的鼻内给药策略还被应用于儿童和老年人,特别是儿童78-80和老年人81。一种使用融合前F蛋白抗原的可注射呼吸道合胞病毒(RSV)疫苗已获得许可,用于老年人和孕妇82。尽管该疫苗在诱导全身免疫方面有效,但考虑到RSV感染的途径,开发一种在感染实际部位阻断病毒入侵的鼻部疫苗是有道理的。一项研究使用了另一种抗原,即RSV的一种跨膜表面蛋白小疏水蛋白(SHe)的外端结构域,用于诱导保护性免疫83。SHe与载体蛋白PspA(SHe-PspA)结合成疫苗抗原,并使用cCHP纳米凝胶进行配制84。用含有SHe-PspA的cCHP对小鼠和棉鼠进行鼻内免疫,能诱导出特异性的粘膜IgA和血清IgG抗体。在棉鼠这一人类RSV感染的优选模型中,这些鼻部疫苗诱导的SHe特异性抗体控制了呼吸道粘膜和肺部的病毒感染84。本研究表明,含有SHe-PspA的环状胞质DNA(cCHP-[SHe-PspA])能够诱导两种病毒感染的免疫反应。对于这种鼻用疫苗开发的明显策略是确定是否可以将双价形式用于疫苗。
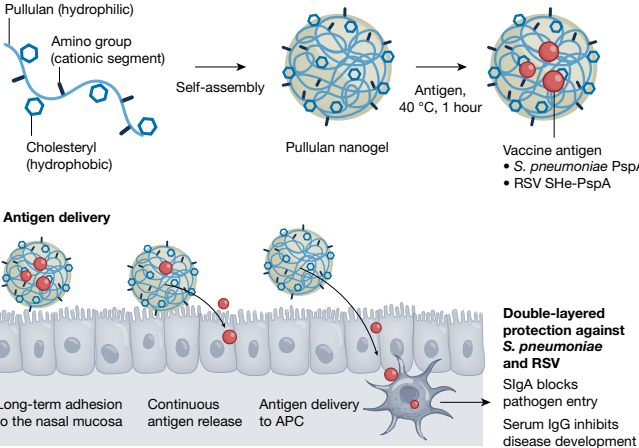
粘膜表面在较长时间内持续释放抗原,使疫苗能够传递给树突状细胞等抗原呈递细胞(APC),进入下面的鼻上皮。含有候选疫苗抗原的cCHP纳米凝胶(如来自肺炎链球菌的PspA和呼吸道合胞病毒的SHe)有效地将疫苗抗原传递给抗原呈递细胞,以启动针对特定抗原的免疫反应。因此,含有疫苗抗原的cCHP纳米凝胶能同时诱导产生系统性(IgG)和粘膜性(分泌型IgA,SIgA)免疫反应,形成双重保护屏障,抵御呼吸道病原体。正在开发针对多种呼吸道感染(包括呼吸道合胞病毒、肺炎链球菌、非典型肺炎克雷伯菌、严重急性呼吸综合征冠状病毒2型和季节性流感)的鼻用疫苗。
cCHP-[SHe-PspA]鼻用疫苗可以同时诱导对病毒(呼吸道合胞病毒)和细菌(肺炎链球菌)感染的免疫防御。
其他有前途的生物相容材料,可将亚单位疫苗抗原传递至鼻腔粘膜表面,包括一种基于脂质的传递载体。脂质体是由磷脂和胆固醇组成的双层脂质膜的小人造囊泡。它们已被证明是有效的免疫载体。脂质体内抗原的两亲性质。可根据候选疫苗抗原的特性定制脂质体的各种物理化学性质,包括脂质组成、结构和大小,以最大化其免疫原性。由于用于脂质体制备的磷脂来源于食物来源(如蛋黄和大豆),这种传递系统被认为是安全的,除了对那些饮食抗原过敏的个体外。已经开发了带阳离子脂质体和表面修饰了具有粘附聚合物脂质体,以增强在鼻腔免疫后的粘膜粘附性和持久性。例如,使用钴卟啉磷脂(CoPoP)脂质体的重组流感血凝素三聚体的鼻部给药有效诱导了血凝素特异性免疫应答。CoPoP脂质体正在临床试验中评估COVID-19疫苗(临床试验网注册编号:NCT04783311)。
壳聚糖具有良好的生物特性,适合粘膜给药,包括良好的可降解性和低毒性。其他优点还有其粘附性质以及能够松弛上皮紧密连接,从而促进抗原摄取。该传递系统在小鼠中通过鼻部免疫后诱导了平衡的抗原特异性TH1和TH2介导的抗体应答,使用了负载壳聚糖的基于蛋白质的抗原。然而,其溶解度差需要在酸性条件下溶解后再进行水解。这可能成为壳聚糖作为实际粘膜疫苗的一个缺点。对壳聚糖进行化学修饰以提高亲水性,以及对配体进行修饰以靶向特定细胞。正在研究提高细胞摄取(如半乳糖、甘露糖和肽修饰)的方法,以提高基于壳聚糖的RS诱导抗原特异性脂质体的适用性。研究表明,这种脂质体被包封后具有良好的耐受性和免疫原性,能够诱导产生……
SpyCage是一种自组装的60亚基I3-01蛋白质支架,它共价装饰有重组蛋白抗原,为通过鼻部免疫诱导黏膜免疫提供了额外的原理验证支持。用SARS-CoV-2S蛋白的受体结合域(RBD)包覆的SpyCage与来自热不稳定大肠杆菌肠毒素(缺乏颅神经毒性)的黏膜佐剂LTA1共同给药,具有高度免疫原性,并增强了叙利亚仓鼠鼻子和肺部的清除率。
针对COVID-19的鼻部疫苗
目前肌内注射的COVID-19疫苗在诱导防止继发感染或限制传播给他人的黏膜免疫方面效果不佳。由于SARS-CoV-2在呼吸道开始感染,因此使用第二代COVID-19疫苗直接针对呼吸免疫系统非常重要。一项对血清阴性的成人进行的人类SARS-CoV-2挑战研究显示,早期黏膜IgA和CD8+ T细胞反应相关的免疫反应与病毒负荷控制密切相关。
该研究支持鼻部疫苗的作用,即减少感染和传播。
在鼻部给予基于病毒载体的疫苗配方后出现了令人鼓舞的结果。当表达SARS-CoV-2 S蛋白的禽副粘病毒3型(APMV3)疫苗载体通过鼻内途径一次性给予仓鼠时,它诱导了特异于S的IgG和IgA抗体反应,这些抗体不仅对SARS-CoV-2分离株WA1/2020具有中和活性,还对α和β变体具有中和活性。这些经鼻免疫的仓鼠在呼吸道全程未出现肺部炎症或病毒复制。此外,表达融合前稳定的SARS-CoV的活减毒副流感病毒3型(B/HPIV3)被评价用于免疫原性。本研究表明,S特异性气道粘膜IgA和IgG以及S特异性血清抗体被诱导出来,这些抗体对SARS-CoV-2 Alpha、Beta和Delta谱系具有中和活性,但对Omicron亚系活性较低。在挑战后,用表达融合前S的B/HPIV3鼻内免疫的恒河猴在其呼吸道和肺组织中检测不到SARS-CoV-2。采用类似策略,开发并测试了一种表达SARS-CoV-2抗原的B/HPIV3候选疫苗。仓鼠通过鼻内途径接种一次活性的、具有复制能力的嵌合型B/HPIV3,该疫苗表达融合前稳定的S蛋白,诱导出特异于病毒的IgG和IgA,这些抗体对SARS-CoV-2 A、B.1.1.7和B.1.35198具有中和活性。在病毒挑战后,鼻腔和肺部未检测到病毒。另一项研究考察了基于腺病毒的ChAdOx1nCoV-19/AZD1222疫苗,这是一种获批的BQ注射用SARS-CoV-2疫苗(已知研究表明,恒河猴肌内接种ChAdOx1nCoV-19/AZD1222可预防肺炎,但并未减少上呼吸道的病毒排出)。然而,随后对恒河猴和仓鼠进行鼻内免疫接种后,在挑战感染后呼吸道病毒的检测减少。
值得注意的是,鼻内给予的基于腺病毒的疫苗不仅诱导广泛反应的IgG和IgA应答,还在呼吸道诱导了病毒特异性的记忆CD8+T细胞。一项单中心、开放标签的I期临床试验对健康成人进行了鼻内接种ChAdOx1 nCoV-19的研究,其中鼻内给予ChAdOx1 nCoV-19作为对两组先前接受过两剂ChAdOx1nCoV-19或BNT162b2注射的小规模参与者的单独加强剂。这项I期研究显示鼻内ChAdOx1nCoV-19疫苗具有可接受的耐受性。然而,在少数参与者中观察到可检测的黏膜抗体,且全身抗体反应最小。由于用于这种鼻内疫苗的ChAdOx1载体源自猿腺病毒血清型,可能对人类呼吸上皮细胞的感染力较差,导致SARS-CoV-2抗原表达水平低。为了进一步检验基于腺病毒的COVID-19鼻喷疫苗的适用性,一项独立研究比较了表达SARS-CoV-2刺突蛋白的复制缺陷型腺病毒和单周期复制型腺病毒疫苗。与复制缺陷型配方相比,单周期复制型配方产生了更高水平的S特异性抗体。单次鼻内或肌内接种单周期复制型腺病毒可以减少SARS-CoV-2病毒载量和肺部损伤,与接种复制缺陷型腺病毒相比。是否反复使用基于载体的疫苗接种会导致产生抗载体免疫反应,从而降低未来病毒载体的感染性和疫苗抗原递送能力尚待确定。这些研究共同支持基于病毒载体的鼻喷疫苗对SARS-CoV-2的适用性,通过展示其高免疫原性和保护性免疫。然而,这种基于病毒载体的鼻喷给药用于人类的安全性和免疫原性需要进一步研究。
另一项研究进一步强调了鼻喷疫苗策略的重要性,通过开发一种完全减毒且复制能力的SARS-CoV-2疫苗候选物sCPD9-DFCS作为鼻喷疫苗,并将其与注射用单价mRNA疫苗BNT162b2进行比较,以预防SARS-CoV-2变异体B.1和Omicron的传播。sCPD9-DFCS在预防病毒传播方面优于注射用mRNA疫苗,进一步突显了鼻喷疫苗相对于注射疫苗的优势。
许多人已经接种了注射用mRNA疫苗,该疫苗能够诱导针对严重COVID-19疾病的全身性保护免疫。一种“主-刺突”(P&S)策略已被提出,其中使用前融合稳定的(Hexapro)、三聚体的重组SARS-CoV-2刺突蛋白(B/HPIV3/S-6P)在非人灵长类动物中显示出了有效性。通过鼻内加强剂(刺突)与预融合稳定的(Hexapro),三聚体的重组SARS-CoV-2刺突蛋白105。该P&S策略在实验鼠中引发了强烈的黏膜细胞和体液免疫反应,包括组织驻留记忆CD8+ T细胞以及IgA和IgG抗体。疫苗诱导的免疫在接种几个月后保护小鼠免受病毒挑战,证明了疫苗的持久性。P&S疫苗接种策略的有效性进一步通过免疫接种的仓鼠的保护效果得到证实,包括阻断病毒传播。一项灵长类动物研究进一步证实了使用双价Ad26基SARS-CoV-2疫苗候选物进行气管内加强诱导具有中和活性的黏膜体液免疫反应和提供几乎完全保护的细胞免疫,以抵御SARS-CoV-2的挑战106。这相当于Covishield疫苗。先前的研究证实了针对异源XBB.1的保护性免疫反应,并支持开发可以阻断呼吸道病毒在气道黏膜入侵的黏膜疫苗的可行性。
作为P&S策略广泛相关性和持久性的证据,该策略诱导了针对异源XBB.1的保护性免疫。在非人灵长类动物中,接种了含有一种混合型黑猩猩腺病毒载体疫苗的鼻部加强剂或一种注射用编码SARS-CoV-2刺突蛋白(WA1和BA.5)或XBB.1.16S蛋白的双价mRNA的加强剂后五个月,研究了16挑战。鼻部疫苗接种引发了持久的气道IgG和IgA反应,在上呼吸道和下呼吸道的病毒复制均很少。相比之下,注射用mRNA疫苗仅限于在下呼吸道产生系统性B细胞介导的保护作用。该研究进一步支持了鼻部疫苗在预防SARS-CoV-2感染方面的广泛效果。
根据预期,鼻部疫苗可以诱导出强大的免疫力以预防SARS-CoV-2的侵入和传播,因此正在大量研究候选鼻部疫苗。截至2023年3月30日世界卫生组织COVID-19疫苗追踪系统(https://www.who.int/teams/blueprint/covid-19/covid-19-vaccine-tracker-and-landscape)发布的信息,包括16种鼻部、1种气溶胶型和2种吸入器型的共19种针对气道的疫苗候选物正处于不同阶段的临床评估中(补充图1)。这些通过气道给药的SARS-CoV-2疫苗大多为复制型或减毒病毒载体。例如,基于复制型流感病毒载体的鼻部疫苗,针对SARS-CoV-2刺突蛋白受体结合域(RBD),以及基于新城疫病毒和腺病毒载体的鼻部疫苗,表达S蛋白,正在2/3期试验中进行评估。针对COVID-19的非复制型载体疫苗包括一种基于PIV5的腺病毒载体疫苗,该疫苗表达武汉(祖先株WA1)的S蛋白,目前正处于Ⅰ期临床试验阶段,以评估其在健康成人和年轻志愿者中的安全性、反应原性和免疫原性111,112。一种用RSV载体表达S蛋白的减毒活疫苗MV-014-212 113——目前正在进行Ⅰ期试验,以评估其在健康成人中的安全性和免疫原性。此外,一种减毒的SARS-CoV-2鼻部疫苗COVI-VAC正在进行临床研究,以评估其在健康成人中的安全性和有效性114。
除了这些活减毒病毒或病毒载体疫苗候选物外,也在努力开发基于重组蛋白(或亚单位)的鼻部疫苗。最近的一项研究表明,使用含有肥大细胞激活肽7(肥大细胞激活寡肽)佐剂的SARS-CoV-2RBD亚单位疫苗经鼻部给药,可以优先诱导多功能中枢记忆T细胞(TcM细胞)115。鼻部诱导的TcM细胞反应是T细胞内在的,并且在转移到无经验的宿主后仍然保持,以促进在肺抗原挑战时在引流臂淋巴结和肺部增强的记忆检索。与注射接种相同抗原和佐剂相比,TcM细胞反应产生的抗体对多种变体具有广泛的中和活性。因此,鼻部疫苗接种在仓鼠挑战模型中能够保护免受临床疾病侵害,并减少肺部组织病理学变化。该研究为鼻喷疫苗的有效性提供了支持性证据,并证明了除了抗体反应之外,T细胞免疫的关键重要性。尽管疫苗领域历史上一直关注体液免疫(例如,抗体)作为保护性免疫的有信息参数,但SARS-CoV-2感染的经验再次强调了T细胞介导的免疫在诱导记忆和抵御病原体的保护性免疫中的关键重要性。即使在缺乏中和抗体的情况下,已显示T细胞免疫能够控制病毒感染。显然,在疫苗开发中仍需评估T细胞的贡献。
许多国家为COVID的鼻部免疫接种贡献了新的方法。在古巴,CIGB-669是一种蛋白质亚单位候选疫苗,含有SARS-CoV-2 S蛋白RBD和乙型肝炎病毒的核壳抗原,已推进到临床试验阶段,正在单独或结合肌内疫苗接种进行鼻部给药评估。另一种正在评估的COVID-19亚单位鼻喷疫苗候选产品是ACM-001,它由通过聚合物囊泡技术形成的人造鼻细胞膜中的SARS-CoV-2佐剂组成。
由于这些全球努力,至少四个国家——中国、印度、伊朗和俄罗斯——已批准了黏膜疫苗的紧急使用授权,包括吸入式疫苗。在中国,已批准表达S蛋白122的5型腺病毒载体和活疫苗、减毒流感病毒表达的基于RBD的鼻喷疫苗。在印度,一种编码免疫前融合稳定的S蛋白的复制缺陷型黑猩猩腺病毒疫苗已被批准作为成人鼻喷疫苗。与油包水型佐剂系统RAS-0结合的重组S蛋白基鼻喷疫苗已被证明能安全有效地诱导保护性免疫,并在伊朗被批准用于紧急使用。俄罗斯也据报道批准了使用异源重组腺病毒rAd26和rAd5基疫苗进行鼻喷接种,该疫苗最初是作为注射疫苗开发的。
鼻部mRNA疫苗的现实情况
鉴于COVID-19大流行期间基于mRNA疫苗的成功,未来大流行的准备需要考虑黏膜递送mRNA疫苗。正在开发创新的mRNA鼻部递送系统,以保护mRNA免遭鼻分泌物中酶的降解,并防止其穿过黏膜屏障被清除。一种基于阳离子聚乙烯亚胺的鼻部疫苗递送载体因其生物相容性环糊精而有助于mRNA穿过鼻上皮细胞,该环糊精能最小化黏膜损伤并暂时打开紧密连接。因此,已测试了与编码HIVgp120的阴离子mRNA复合的阳离子环糊精-聚乙烯亚胺2k共轭复合物用于鼻部mRNA疫苗接种。这导致了强大的黏膜和全身性TH1、TH2和TH17免疫反应的诱导。采用类似的策略,但使用髓样阳离子脂质体配方,已被考虑用于鼻部递送预防和治疗神经系统疾病的基于核酸的治疗方法。尽管在鼻腔恶劣环境中维持mRNA稳定性存在障碍,但在生物工程、黏膜免疫学和疫苗学领域的专业知识融合正引领着新型鼻部免疫接种载体的开发,以针对呼吸道病原体。例如,已研究了一种可吸入的、可生物降解的多胺共酯聚复合物,用于向肺部递送编码SARS-CoV-2 S蛋白的mRNA。这些聚复合物经鼻部给药后,实现了整个肺部的高转染率,包括上皮细胞和抗原呈递细胞,从而在小鼠中引发了针对致死病毒挑战的细胞和体液保护性免疫。另一项研究评估了鼻部mRNA包封脂质纳米颗粒(mRNA-LNP)疫苗针对SARS-CoV-2在叙利亚金黄仓鼠中的免疫原性和保护效果。鼻部mRNA-LNP疫苗接种诱导出特异于S蛋白的中和性IgG和IgA抗体,减少了呼吸道病毒载量,降低了肺部病变,并防止了在SARS-CoV-2挑战后体重减轻。综上所述,有理由对鼻部mRNA疫苗诱导人体保护性免疫抱有乐观态度。
摘要与未来问题
正如本及其他文献135,136所述,越来越多的证据表明鼻喷疫苗是安全的,可以预防病原体入侵并在黏膜表面和全身部位抑制严重疾病12,13,19,20。目前仅有一些鼻喷疫苗获得批准并在临床上使用137。如上所述,FluMist四价疫苗是一种活病毒减毒流感疫苗138,是目前唯一获得FDA批准用于2至49岁健康人群的鼻喷疫苗。然而,即使可以通过降低病毒的毒力来制造一种减毒疫苗,它也未被批准用于免疫学上蛋白质被CpG包封的活疫苗,因为活疫苗的注射可能会引起不良反应139。
在开发鼻喷疫苗的过程中必须考虑其安全性140。例如,含有完整病原体的疫苗可能被批准用于鼻喷疫苗。两种疫苗似乎比活疫苗更安全,但纯化的重组蛋白(或亚单位)抗原往往引发相对较弱的免疫反应,通常需要与佐剂一起使用,如氢氧化铝AS04、MF59、AS01B和含CpG的复合水溶液佐剂系统RAS-0已被证明是安全的衍生物(例如,单磷脂A和AGP(RC-529,一种合成型酰化单糖))以及颗粒型佐剂(例如,ISCOMS(一种由皂苷和脂质构成的结构复合物)和聚乳酸-共-乙二醇酸)144。这些候选物质可能被纳入鼻喷亚单位疫苗配方中。
鼻喷疫苗开发的一个主要关注点是鼻腔与中枢神经系统(CNS)的接近程度。上鼻道与嗅觉球相连,后者由专门连接到大脑的神经元组成。因此,通过鼻道给予的抗原可以通过上皮细胞或相邻的嗅觉球被运输至大脑,并可能对神经元功能产生不利影响。通常用于疫苗开发的实验用小鼠和大鼠近50%的鼻表面被嗅觉上皮覆盖。在人类中,呼吸上皮覆盖了大约90%的鼻腔内衬,而嗅觉上皮则覆盖了剩余的10%。尽管与啮齿类动物相比,人类嗅觉上皮的表面积较小,但其在CNS附近的接近程度在开发安全的鼻喷疫苗时必须予以考虑。此外,鼻喷疫苗不应影响支持嗅觉神经元的嗅觉上皮中的支柱细胞,因为研究表明这些细胞通过吸引细胞到嗅觉上皮,在病原体感染期间引发炎症性细胞因子的产生,从而导致炎症。作为风险的一个例子,一种与基因解毒的大肠杆菌耐热肠毒素变体联合使用的灭活鼻喷流感疫苗作为佐剂已被批准使用。上市后的监测发现面部神经麻痹作为不良反应的案例,导致该疫苗被停用。此外,含有佐剂ASO3的灭活流感疫苗Pandemrix增加了儿童、青少年和成人的嗜睡症风险。霍乱毒素在结构上与肠产毒大肠杆菌的热敏性肠毒素相似,已被实验性地用作支持诱导黏膜疫苗抗原特异性免疫反应的黏膜佐剂。在小鼠模型中,经鼻给予的天然霍乱毒素可以通过嗅球被运输至中枢神经系统,在那里它在中枢神经系统中引起神经损伤。因此,与鼻疫苗的开发同步,必须验证疫苗抗原和/或佐剂是否通过嗅球上皮细胞转移至中枢神经系统。候选鼻疫苗必须继续仔细评估,以确保所有成分在启动临床试验前都是安全的,并且不会对中枢神经系统产生不良效应。
总结来说,鼻疫苗开发需要考虑几个关键问题,包括:(1) 开发安全稳定的mRNA和亚单位疫苗配方及递送系统的努力;(2) 根据感染(或免疫)前后生成的人类免疫谱数据,确定打击目标病原体所需的免疫类型——体液、细胞介导、组织驻留和/或循环记忆,单独或联合使用;(3) 创建最佳鼻疫苗配方及递送载体,以及适当佐剂的优势;以及(4) 确保鼻疫苗的整体安全性。
Hits: 115
