Contents
- 1 介绍
- 2 背景
- 3 给药
- 4 RSV 免疫预防和疫苗接种
- 5 帕利珠单抗预防指南
- 6 影响指南修订的注意事项
- 7 总结
- 8 主要作者
- 9 传染病委员会,2022-2023
Palivizumab Prophylaxis in Infants and Young Children at Increased Risk of Hospitalization for Respiratory Syncytial Virus Infection
Hits: 32
- 心脏病成人的疫苗接种指南
- 用于检测治疗性蛋白制品的免疫原性的检测法开发和验证行业指南
- 肺部疾病成人的疫苗接种指南
- 快速响应:截至 2024 年 12 月在非大流行背景下人类接种禽流感疫苗的初步指南
- 糖尿病成人的疫苗接种指南
- 慢性肝病或慢性肝脏感染成人的疫苗接种指南
- 人类免疫缺陷病毒(HIV)感染者成人疫苗接种指南
- 65 岁及以上成人流感疫苗接种补充指南
- 2013 年美国感染病学会(IDSA)免疫功能低下人群疫苗接种临床实践指南
- 针对公共卫生紧急情况的猴痘检测政策
- 卫生保健机构手部卫生指南
- 环境感染控制指南 保健设施
- 2025 年 4 月 30 日的 NACI 声明摘要:关于 2025-2026 年季节性流感疫苗的声明
- 更新了老年人呼吸道合胞病毒 (RSV) 疫苗指南,包括扩大 RSVPreF3 在 50-59 岁人群中的使用以及使用新的 mRNA-1345 疫苗
- 孕期梅毒感染筛查:美国预防服务工作组重申建议声明
- 2025 年 5 月 14 日的 NACI 声明摘要:关于免疫功能低下成人带状疱疹疫苗接种的最新建议
- 2022 美国动物卫生协会犬类疫苗接种指南(2024年更新)
- 2020 年 AAHA/AAFP 猫科动物疫苗接种指南
- 2025 年 5 月 15 日的 NACI 声明摘要:关于使用 Imvamune 预防 mpox 的更新指南的快速响应
- 2025 年 2 月 13 日 NACI 声明摘要:关于麻疹暴露后预防的更新建议
- 从 2025 年 7 月 1 日起完成常规免疫接种计划(英国)
- 2025 年 1 月 10 日的 NACI 声明摘要:2025 年至 2026 年夏季 COVID-19 疫苗使用指南
- 麻疹暴露后预防更新建议的增编
- 使用 Imvamune 预防猴痘的更新指南
- 免疫功能低下成人带状疱疹疫苗接种的最新建议
- 推荐使用帕利珠单抗减少婴儿呼吸道合胞病毒感染的并发症
- 登革热防控方案(2025年版)
- 关于防止节肢动物叮咬的个人防护措施的声明 – 更新
- CATMAT 关于在 65 岁或以上人群中使用基孔肯雅热减毒活疫苗 (IXCHIQ) 的指南
- 关于在授权旅行者使用 QDENGA(登革热疫苗)的司法管辖区使用的建议
- 基于暴露的干预措施,用于管理整个生命周期中高度针头恐惧的个体:临床实践指南,呼吁进一步研究
- mRNA COVID-19 疫苗接种后患有心肌炎和心包炎的青少年的临床指南
- 归国国际旅客发热初步评估指南
- NACI 快速响应:在持续的猴痘疫情背景下更新了关于 Imvamune 的临时指南
- 关于管理耐多药沙门氏菌感染的临时指南
- 家长免疫接种指南
- 英国旅行者接种基孔肯雅热疫苗:JCVI 建议
- 针对 80 岁及以上成年人的呼吸道合胞病毒 (RSV) 免疫计划:JCVI 建议,2025 年 7 月 16 日
- JCVI 关于 2026年秋季和 2027 年春季 COVID-19 疫苗接种的声明
- CATMAT 关于播散性类圆线虫病的声明
- 成人免疫接种指南
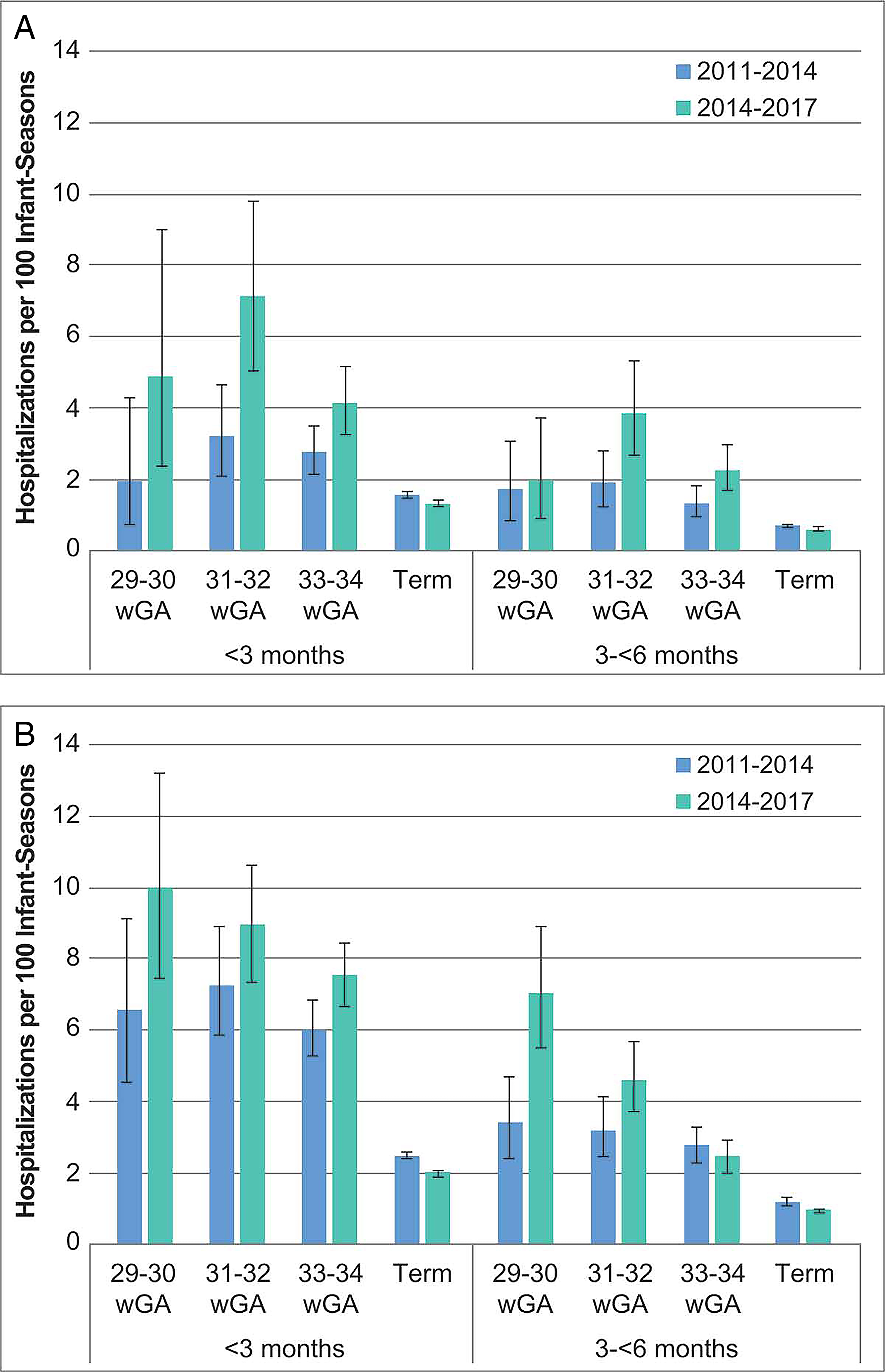
- 针对呼吸道合胞病毒感染住院高风险婴幼儿的帕利珠单抗预防更新指南
- 针对呼吸道合胞病毒感染住院高风险婴幼儿的帕利珠单抗预防
- JCVI 关于 2026 年至 2027 年流感疫苗的声明
- 有关打算探亲访友的国际旅客的声明摘要
- 青少年疫苗接种指南
- 免疫接种状态不确定或不完全的个人疫苗接种:2025 年 7 月 1 日起
- 从 2025 年 7 月 1 日起进行常规儿童免疫接种(2024 年 7 月 1 日出生的婴儿)
- 加拿大关于在疫苗短缺期间使用分次剂量黄热病疫苗的临时建议
- 寨卡病毒预防和治疗建议
- 带状疱疹免疫接种计划:医护人员资讯
- 带状疱疹疫苗接种指南
- 儿童和青少年接种COVID-19疫苗
- 印度旅行疫苗接种:2025 年循证健康指南
- 旅行者疟疾预防和治疗指南
- 登革热:给明智旅行者与移居者的详尽旅行指南
- 旅行者伤寒:预防和保护完整指南
- 美国儿科学会 2025 年 8 月 19 日发布的推荐18 岁及以下儿童与青少年免疫接种程序
- 隐藏的敌人:旅行者立克次体感染完整指南
- 心脏病发作症状:旅行者的基本医疗指南
- 真菌性皮肤感染:类型、治疗和预防完整指南
- 热带医学和旅行咨询委员会 (CATMAT) 关于国际旅行者和伤寒的声明
- 2025 年简明临床指南:ACC 关于成人免疫接种作为心血管护理一部分的专家共识声明:美国心脏病学会解决方案集监督委员会的报告
- 产科-妇科护理中的 COVID-19 疫苗接种注意事项
- 妊娠期流感:预防和治疗
- 母体呼吸道合胞病毒疫苗接种
- 疫苗预防和控制季节性流感:免疫实践咨询委员会的建议——美国,2025-26 年流感季节
- 用Clesrovimab预防婴儿严重呼吸道合胞病毒相关下呼吸道感染:免疫实践咨询委员会的建议 — 美国,2025年
- 健康怀孕指南
- 关于预防婴幼儿呼吸道合胞病毒感染的建议:政策声明
- 过敏反应定义、概述和临床支持工具:2024 年共识报告 – GA2LEN项目
- 人狂犬病免疫球蛋白(human rabies immunoglobulin, HRIG)使用临时建议
- 如何与我们的心脏病患者讨论成人疫苗接种
- 2025 年秋季疫苗指南
- 疫苗佐剂非临床研究技术指导原则
- 完整的常规免疫接种计划 英国 2025年9月1日期
- 2025 年至 2026 年国家流感免疫接种计划信函
- 恰加斯病:基本旅行指南
- 创新型疫苗临床试验申请申报资料要求
- 远离结核病的旅行者指南
- 更顺畅的免疫接种体验指南
- 您的免疫预约指南:充满信心地完成整个过程
- 联合疫苗临床前和临床研究技术指导原则
- 疫苗接种预约指南:预期事项与准备方法
- 旅行时如何保护儿童免受水痘侵害:专家指南
- 家长互联网免疫接种信息指南
- 您的无缝免疫接种与健康服务指南
- 2025年病毒爆发与旅行警告:专家友好指南
- 结合疫苗质量控制和临床研究技术指导原则
- 预防用含铝佐剂疫苗技术指导原则
- 生物制品稳定性研究技术指导原则(试行)
- 常见传染病的暴露后预防
- 无缝接种预约指南
- 开发用于预防全球传染病的疫苗的一般原则
- 关于预防性疾病的联合疫苗评估:生产、测试和临床研究
- 关于组合疫苗及免疫学兽用药品(IVMPs)联合使用的指导原则
- 世界卫生组织关于疫苗非临床评价的指南
- 确保基于DT的组合疫苗的质量、安全和有效性的建议
- 沙特 疫苗生产和质量控制指南
- 疫苗接种预约指南:流程与准备事项
- 儿童与青少年疫苗接种时间指南
- 聚焦预防 | 美国心脏病学会简化心血管疾病免疫接种建议
- 精通疫苗接种诊所:提高效率与优化患者护理的内部指南
- 临床医生呼吸道疫苗共同临床决策指南
- 你的疫苗接种顺利体验指南
- 美国传染病学会关于A组链球菌性咽炎的临床实践指南更新
- 更顺畅疫苗接种体验终极指南
- 婴幼儿和青少年COVID-19疫苗接种建议:政策声明
- IDSA 2025年关于在免疫功能低下患者中使用疫苗预防季节性新冠病毒、流感和呼吸道合胞病毒感染的指南
- 无脾成人的疫苗接种指南
- 花生过敏预防的积极趋势:预防指南的实际影响
- 2025–2026年儿童流感预防与控制建议:技术报告
- 您的疫苗诊所指南:像专业人士一样导航系统
- 带状疱疹疫苗临床试验技术指导原则
- PIDS/IDSA 2023年儿童急性细菌性关节炎诊断和管理指南
- 预防节肢动物叮咬的个人防护措施声明
- 异维甲酸与疫苗诊所:保持防护的内部指南
- IDSA 2024年抗微生物药物耐药革兰氏阴性菌感染治疗指南
- 重组糖蛋白激素类产品药学研究与评价技术指导原则
- 流感病毒疫苗临床试验技术指导原则(征求意见稿)
- 重组表达单克隆抗体类生物制品制造及检定规程撰写指南(征求意见稿)
- 归国国际旅行者发热初始评估指南
- 中国流感疫苗预防接种技术指南(2025—2026)
- 成人癌症相关免疫抑制患者抗菌药物预防临床实践指南:ASCO/IDSA更新版
- 免疫功能低下旅行者
- 全国镰状细胞中心联盟关于镰状细胞病健康维护的共识建议共识声明
- 多联疫苗临床试验技术指导原则
- 曲霉病诊断和管理临床实践指南:IDSA 2016年更新版
- 养老院感染预防与控制多学会指南
- 关于跨国收养的声明
- 美国传染病学会 (IDSA) 发布的《念珠菌病管理临床实践指南:2016 年更新版》
- 流感疫苗完全指南
- IWGDF/IDSA糖尿病相关足部感染诊疗指南
- 热带病与旅行咨询委员会:老年旅行者声明
- 疫苗临床试验不良事件分级标准指导原则(修订版)
- ATS/CDC/IDSA临床实践指南:成人和儿童结核病的诊断
- 用于人乳头瘤病毒检测的自行收集阴道标本及筛查终止指南:美国癌症协会宫颈癌筛查指南更新
- 热带医学与旅行咨询委员会关于儿童旅行者的声明
- 成人导管相关性尿路感染的诊断、预防和治疗:美国传染病学会2009年国际临床实践指南
- HIVMA/IDSA 2014年更新版:HIV感染患者慢性肾病管理临床实践指南
- 对免疫状况不明或未完成的人员进行疫苗接种:自2026年1月1日起
- SHEA/IDSA 发布的《成人艰难梭菌感染管理临床实践指南:2021 年更新》
- 加拿大传染病报告:孕期旅行声明
- 成人和儿童艰难梭菌感染临床实践指南:美国医疗保健流行病学学会/美国感染病学会2017年更新版
- 关于旅行者与狂犬病疫苗的声明
- IDSA 2016 年球孢子菌病治疗临床实践指南
- 免疫接种者袖珍指南:孕期与哺乳期
- 成人社区获得性肺炎的诊断和治疗:美国胸科学会和美国传染病学会官方临床实践指南
- CATMAT 关于播散性粪类圆线虫病的声明:预防、评估和管理指南
- 3个月以上婴幼儿社区获得性肺炎的管理:儿科传染病学会和美国传染病学会临床实践指南
- 复杂性尿路感染(cUTI):治疗和管理临床指南
- 自行采集阴道标本用于人乳头瘤病毒检测及筛查退出指南:美国癌症协会宫颈癌筛查指南更新
- 旅行者结核病风险评估与预防
- IDSA 新型冠状病毒肺炎患者治疗和管理指南
- 热带病与旅行咨询委员会(CATMAT) 致旅行者及关于黄热病的声明
- 预防用疫苗佐剂药学研究技术指导原则(试行 )
- 隐球菌病治疗临床实践指南: 美国感染病学会2010年更新
- 儿童常规免疫接种计划
- ASM/ECMM/ISHAM 隐球菌病诊断和治疗全球指南
- 加拿大各省及地区婴幼儿常规(及补种)疫苗接种时间表(截至2025年12月)
- 美国儿科学会推荐的青少年及年轻成人疫苗
- IDSA 脑炎管理指南
- 加拿大各省和地区针对健康且先前已接种疫苗的成年人的常规疫苗接种计划
- 美国2026年儿童和青少年免疫接种计划建议
- 美国心脏协会成人感染性心内膜炎指南:诊断、抗菌治疗和并发症处理
- IDSA 2008 年老年长期护理机构居民发热和感染评估临床实践指南更新
- 癌症成人患者的疫苗接种:ASCO指南
- 癌症患者治疗前的乙型肝炎病毒筛查与管理:美国临床肿瘤学会临时临床意见更新
- CEPI 生物安全政策
- IDSA 关于 A 组链球菌(GAS)咽炎的临床实践指南更新
- 2026 年美国 18 岁及以下儿童和青少年推荐免疫接种程序
- 2025-2030 年美国人膳食指南
- AASLD/IDSA 2023 年丙型肝炎病毒感染检测、管理和治疗临床实践指南更新
- 关于接受度普利尤单抗治疗的患者使用疫苗的系统评价和专家德尔菲共识建议:美国过敏、哮喘和免疫学会立场文件
- 常规推荐的孕产妇疫苗接种汇总
- SHEA/APIC/IDSA/PIDS 多学会联合立场文件:提高标准——有效医疗机构感染预防和控制计划所需的资源和结构
- 美国医疗机构中感染乙型肝炎、丙型肝炎或人类免疫缺陷病毒的医护人员管理办法
- 医护人员疫苗接种咨询四步法指南
- IDSA 2017 年医疗相关性脑室炎和脑膜炎临床实践指南
- AASLD ISDA 慢性乙型肝炎治疗实践指南
- 美国传染病学会 2025 年组织胞浆菌病临床实践指南更新:成人、儿童和孕妇无症状组织 胞浆菌肺结节(组织胞浆菌瘤)及轻度或中度急性肺组织胞浆菌病的治疗
- 呼吸中心:您的 GoodRx 指南