Charting targeted courses for vaccination
自然生物医学工程 volume9,pages149–150 (2025)
针对更广泛但有针对性的免疫刺激的抗原设计和优化,以及靶向抗原递送,正在重塑传染病和癌症疫苗的开发。
为了有效对抗持久性呼吸道病毒和抗生素耐药细菌,并开发有效的预防性癌症疫苗,广泛但靶向不足的免疫刺激(根据“分离、灭活和注射”范式1)经常达不到要求。现代疫苗开发正在转向精确工程的构建体,以平衡免疫刺激的广度和特异性,这是在对抗原加工和呈递以及免疫激活动力学的不断理解的推动下,以及计算设计和基于靶向纳米颗粒的递送的进步。通过利用低温电子显微镜(以及其他结构生物学技术)、计算生物信息学和机器学习,设计包含多个表位的抗原(例如,靶向保守的病毒区域或跨癌症类型共享)变得越来越可能。这导致候选疫苗能够引发强大、持久和交叉反应的免疫。
然而,实现将疫苗高效、特异性地递送至所需的免疫细胞是一个核心挑战。传统的全身给药通常会导致脱靶摄取,例如肝脏隔离、“稀释”免疫反应或引起副作用2.最先进的解决方案利用脂质纳米颗粒 (LNP)、病毒样颗粒或免疫细胞靶向配体来穿越生物屏障、保护抗原并将有效载荷引导至树突状细胞或淋巴结。
有效的抗原设计也可能是一个障碍。病原体和肿瘤通过抗原多样性逃避免疫,从而使单靶点疫苗过时。克服抗原逃逸的策略包括鉴定和靶向保守的表位(如流感的血凝素柄和 HIV-1 的糖蛋白 41 亚基)以增强交叉反应性免疫;抗原的计算优化以提高其稳定性和免疫原性;以及多价设计,例如显示 SARS-CoV-2 刺突蛋白变体或肿瘤抗原阵列的纳米颗粒。可以利用这些策略来平衡免疫刺激的抗原广度和精确度(例如,通过避免非保护性表位的免疫优势)。此外,佐剂还可以设计为进一步引导免疫反应(例如,Toll样受体激动剂增强T辅助1细胞和细胞毒性T淋巴细胞对细胞内病原体或癌症的激活3).
这些策略反映在本期《自然生物医学工程》杂志上的研究中,该研究重点介绍了靶向树突状细胞和增强淋巴系统通路的递送载体、经过计算优化的抗原以对沙贝科病毒产生广泛反应性,以及佐剂和利用抗原降解途径以实现高效抗原呈递的新方法。
具体来说,Anderson 和合著者报告了一种多佐剂 mRNA 疫苗,它通过两种互补策略增强免疫反应:佐剂 mRNA 编码的抗原本身和修饰 LNP 中的可电离脂质以增强其免疫刺激特性。通过将抗原的 mRNA 序列与源自 C3 补体蛋白的天然佐剂融合,由于表达补体受体的抗原呈递细胞增加抗原摄取和呈递,抗原特异性免疫激活得到改善,mRNA 剂量减少。同时,作者通过筛选包含 480 种可生物降解脂质的组合文库来优化 LNP 制剂的可电离脂质成分,通过该文库,他们确定了一种环胺头基,该头基可改善 mRNA 转染并增强先天免疫刺激。结合使用,对于编码 SARS-CoV-2 刺突蛋白或受体结合域的 mRNA,与缺乏与佐剂融合的相同疫苗制剂相比,这两种策略导致抗体滴度增加了 10 倍。疫苗的鼻内给药还诱导了强大的抗体反应,这表明多效佐剂策略可能适用于针对呼吸道病原体的粘膜保护。
另一篇由 Jonathan Heeney 及其同事撰写的文章描述了一种抗原的合理设计,该抗原可促进针对 SARS-CoV-2 和相关沙贝科病毒的更广泛的免疫反应。研究人员通过整合系统发育分析和结构生物信息学,基于 SARS-CoV-2 的受体结合域计算工程了单一抗原,以选择保守和免疫优化的序列。他们还通过修饰关键表位来改进抗原,包括使用糖基化来掩盖免疫显性但高度可变的区域,从而将免疫反应引导到保守和交叉反应的表位。该抗原在小鼠、兔子和豚鼠中引起广泛的体液免疫,产生针对 SARS-CoV、SARS-CoV-2(包括关注的变体)和相关蝙蝠冠状病毒的中和抗体。当作为 DNA 疫苗进行测试时,该抗原在由已批准的针对 SARS-CoV-2 的病毒载体疫苗引发的小鼠模型中提供了保护。
尽管优化的抗原设计增强了免疫特异性,但确保抗原到达并激活正确的免疫细胞也至关重要。在另一项研究中,Yujia Cai、Jiaxu Hong 及其同事报告了一种树突状细胞靶向病毒样颗粒的开发,旨在增强 mRNA 抗原的呈递和免疫激活。该团队设计了用糖蛋白(来自辛德比斯病毒)进行假型的病毒样颗粒,该糖蛋白被设计为与树突状细胞上的受体进行特异性结合。在小鼠中,与传统 LNP 制剂和非靶向病毒样颗粒相比,封装编码 SARS-CoV-2 刺突蛋白的 mRNA 的病毒样颗粒诱导了更高、更持久的免疫球蛋白 G 刺突特异性滴度和更强大的 T 细胞反应。此外,病毒样颗粒促进树突状细胞成熟和向淋巴结的迁移。在脚垫中注射疫苗的小鼠表现出对 SARS-CoV-2 攻击的增强保护,包括肺部和气管中的病毒载量减少。该疫苗在鼻内给药时也具有免疫原性。
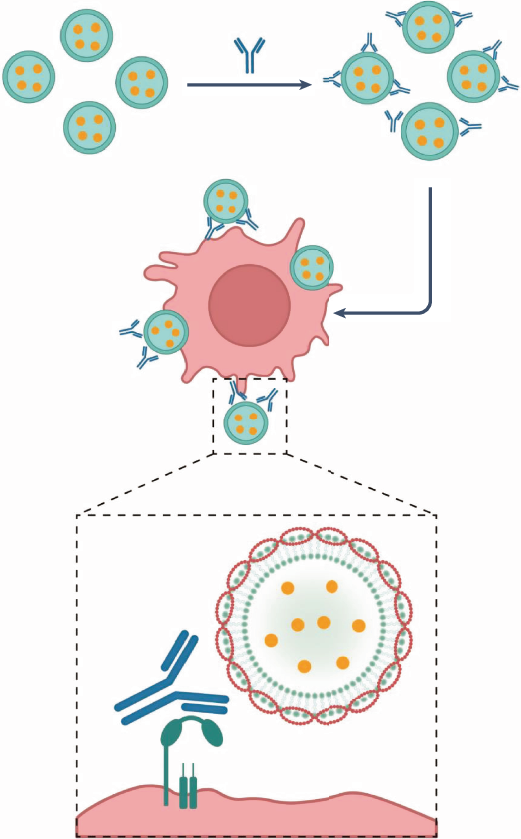
将疫苗靶向树突状细胞也可以通过利用异种移植排斥过程中发生的免疫识别机制来实现。Xing-Jie Liang、Ningqiang Gong 及其合著者使用异种细胞膜衍生囊泡,该囊泡从受体循环中预先存在的异种抗体中获取免疫球蛋白 G 的冠状元,使树突状细胞能够接受 Fc 受体并增强抗原呈递(图 1)。1). 囊泡封装肿瘤来源的肽抗原或编码肿瘤抗原的 mRNA,导致黑色素瘤和胸腺瘤小鼠模型中的树突状细胞成熟、强大的抗原特异性 T 细胞激活和有效的肿瘤生长抑制。当与封装编码 SARS-CoV-2 刺突蛋白的 mRNA 的 LNP 杂交时,该疫苗引起的抗刺突抗体和中和抗体的滴度比基于商业 LNP 的 mRNA 疫苗高得多。
免疫球蛋白 G 与抗原负载的异种细胞膜衍生囊泡结合,使树突状细胞能够在 Fc 受体介导下摄取囊泡。改编自 Springer Nature Ltd. 的 Wang 等人的文章。
诱导多能干细胞的膜可用作癌症疫苗的肿瘤相关抗原来源,正如 Ruifang Zhao、Guangjun Nie、Bing Han 及其同事所表明的那样。研究人员通过将诱导多能干细胞膜制成的囊泡与封装在核壳结构中的佐剂(包括 CpG 和 R848)组合整合在一起,创造了一种纳米颗粒疫苗。该设计旨在利用两种类型细胞膜之间共享的肿瘤相关抗原的广泛库。该疫苗强烈刺激小鼠先天免疫,逃避抗原特异性耐受性并诱导强烈的 B 细胞和 T 细胞反应。值得注意的是,预防性疫苗接种可引起全身肿瘤特异性免疫并抑制各种癌症的进展。此外,研究人员从共享抗原中鉴定出免疫原性表位,并表明单独接种这些肽就足以引发抗肿瘤免疫,这为疫苗的作用机制提供了支持。
正如 Qiaobing Xu 及其同事所描述的那样,树突状细胞的抗原交叉呈递可以通过靶向抗原降解来实现。他们的工作依赖于蛋白水解靶向嵌合体,其中肿瘤抗原与配体预偶联,配体与 E3 泛素连接酶结合,然后被封装在淋巴结靶向 LNP 中。预偶联标记抗原进行泛素化,靶向其在树突状细胞内进行蛋白酶体介导的降解(所得肽片段加载到主要组织相容性复合物 I 类分子上,以呈递给细胞毒性 T 细胞)。该疫苗导致肿瘤抗原的更有效交叉呈递和效应 T 细胞的更强激活。在患有不同类型癌症的小鼠中,该疫苗可显着抑制肿瘤生长,特别是与免疫检查点阻断相结合时。
用于癌症免疫治疗的肿瘤相关抗原、新抗原和病毒抗原的编码可以受益于小环状 RNA (circRNA) 的使用。Guizhi Zhu及其同事报告说,circRNA在LNP中的封装使其能够有效地递送至引流淋巴结中的抗原呈递细胞,并在小鼠中产生有效而持久的T细胞反应。与传统的 mRNA 疫苗不同,circRNA 疫苗具有高稳定性,细胞毒性低,蛋白激酶 R(一种参与抗病毒防御和炎症的长双链 RNA 传感器)的激活最小,从而在细胞内实现持久的抗原翻译。事实上,circRNA 疫苗产生的抗原特异性 T 细胞是线性 mRNA 疫苗(未修饰和修饰形式)的十倍,并且比较大的 circRNA 构建体保持翻译效率的时间更长。circRNA疫苗与免疫检查点抑制相结合,减少了肿瘤诱导的免疫抑制,抑制了免疫原性差肿瘤的生长。
总而言之,未来用于产生针对高诱变病原体和异质性癌症的强大、持久和广泛保护性免疫的疫苗设计可能涉及结合其中许多策略:编码结构优化抗原的靶向递送载体,并辅以多种佐剂和免疫调节元件增强,以增强淋巴结运输、补体激活和 Fc 受体介导的摄取。从佐剂 mRNA 构建体和具有保守表位的抗原,到树突状细胞靶向病毒样颗粒和由蛋白水解靶向嵌合体驱动的抗原降解,很明显,疫苗有许多途径可以诱导体液和细胞反应,这些反应是有效且精确定向的,并且副作用更少。尽管如此,对抗不断演变的病原体和异质性肿瘤需要的不仅仅是提高免疫精确度的技术独创性;必须战略性地指导全球在可扩展制造、公平获取和快速部署(需要时)方面的努力,以确保疫苗广泛而有效的覆盖。
Hits: 17