Contents
- 1 更新历史
- 2 2023年IDSA AMR指南文件的重要更新
- 3 摘要
- 4 引言
- 5 一般管理建议
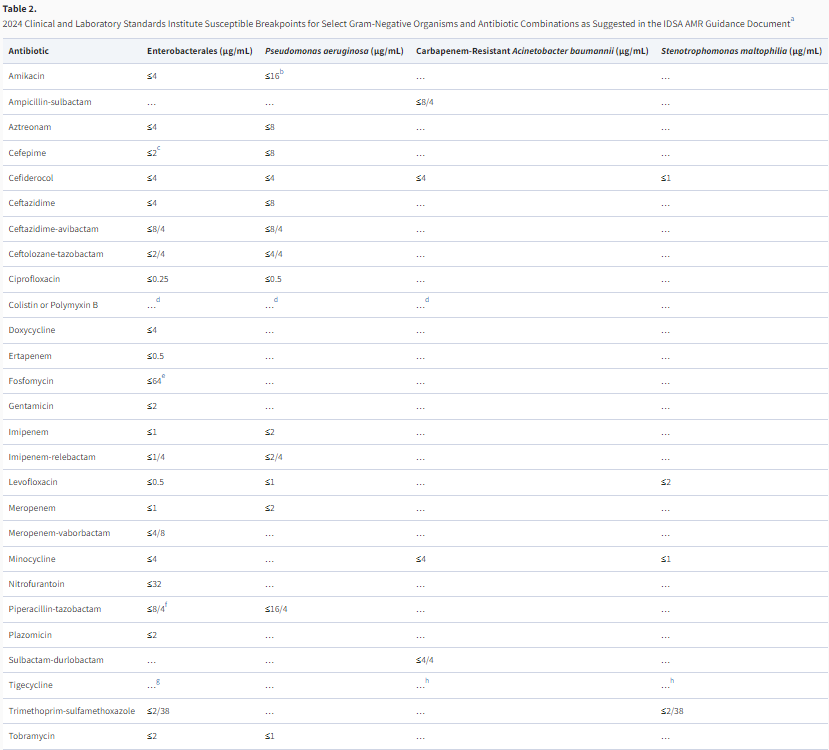
- 6 表1和表2
- 7 第1节:产超广谱β-内酰胺酶肠杆菌目细菌
- 7.1 问题1.1:治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的非复杂性膀胱炎,首选抗生素是什么?
- 7.2 问题1.2:治疗由产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的肾盂肾炎或复杂性尿路感染(cUTI)时,首选抗生素是什么?
- 7.3 问题1.3:治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的泌尿道外感染时,首选抗生素是什么?
- 7.4 问题1.4:哌拉西林-他唑巴坦在治疗产超广谱β-内酰胺酶(ESBL)细菌引起的感染中是否有作用?
- 7.5 问题1.5:头孢吡肟在治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的感染中是否有作用?
- 7.6 问题1.6:头孢霉素在治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的感染中是否有作用?
- 7.7 问题1.7:较新的β-内酰胺-β-内酰胺酶抑制剂复方制剂和头孢地尔在治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的感染中起到什么作用?
- 8 第2节:产AmpC β-内酰胺酶的肠杆菌目细菌
- 8.1 问题2.1:哪些常见的肠杆菌科菌种应被视为具有临床显著诱导型ampC产生的中度风险?
- 8.2 问题2.2:对于因诱导型ampC基因而具有临床显著AmpC产生中等风险的微生物引起的感染,在选择抗生素时应考虑哪些特征?
- 8.3 问题2.3:对于因诱导型ampC基因而具有临床显著AmpC产生中等风险的肠杆菌科细菌引起的感染,头孢吡肟的作用是什么?
- 8.4 问题2.4:对于因诱导型ampC基因而具有临床显著AmpC产生中等风险的肠杆菌科细菌引起的感染,头孢曲松的作用是什么?
- 8.5 问题2.5:对于因诱导型ampC基因而具有临床显著AmpC产生中度风险的肠杆菌科细菌引起的感染,哌拉西林-他唑巴坦的治疗作用是什么?
- 8.6 问题2.6:对于因诱导型ampC基因而具有临床显著AmpC产生中度风险的肠杆菌科细菌引起的感染,新型β-内酰胺-β-内酰胺酶抑制剂复方制剂和头孢地尔的作用是什么?
- 8.7 问题2.7:对于因诱导型ampC基因而具有临床显著AmpC酶产生中等风险的肠杆菌科细菌引起的感染,非β-内酰胺类疗法的作用是什么?
- 9 第3节:耐碳青霉烯类肠杆菌科细菌
- 9.1 问题3.1:治疗由CRE引起的非复杂性膀胱炎,首选抗生素是什么?
- 9.2 问题3.2:治疗由CRE引起的肾盂肾炎或复杂性尿路感染(cUTI)的首选抗生素是什么?
- 9.3 问题3.3:对于由非产碳青霉烯酶的CRE引起的尿路外感染,首选的抗生素是什么?
- 9.4 问题3.4:如果存在KPC产生,治疗由CRE引起的泌尿道外感染的首选抗生素是什么?
- 9.5 问题3.5:如果存在NDM或其他MBL产生,治疗由CRE引起的泌尿道外感染时,首选的抗生素是什么?
- 9.6 问题3.6:如果存在OXA-48样酶的产生,治疗由CRE引起的泌尿道外感染时,首选的抗生素是什么?
- 9.7 问题3.7:在用于治疗CRE感染时,CRE分离株对新型β-内酰胺类药物产生耐药性的可能性有多大?
- 9.8 问题3.8:四环素衍生物在治疗CRE引起的感染中起什么作用?
- 9.9 问题3.9:多粘菌素在治疗CRE引起的感染中发挥什么作用?
- 9.10 问题3.10:联合抗生素治疗在治疗CRE引起的感染中起到什么作用?
- 10 第4节:具有难治性耐药性的铜绿假单胞菌
- 10.1 问题4.1:治疗多重耐药铜绿假单胞菌引起的感染时,首选抗生素是什么?
- 10.2 问题4.2:在现有的β-内酰胺类药物中,针对DTR 铜绿假单胞菌的活性百分比是否存在差异?
- 10.3 问题4.3:治疗由DTR铜绿假单胞菌引起的非复杂性膀胱炎,首选抗生素是什么?
- 10.4 问题4.4:治疗由DTR铜绿假单胞菌引起的肾盂肾炎或复杂性尿路感染(cUTI)时,首选抗生素是什么?
- 10.5 问题4.5:治疗由DTR铜绿假单胞菌引起的泌尿道外感染,首选抗生素是什么?
- 10.6 问题4.6:治疗产金属β-内酰胺酶的DTR铜绿假单胞菌(P. aeruginosa)时,首选抗生素是什么?
- 10.7 问题4.7:当使用新型β-内酰胺类药物治疗多重耐药铜绿假单胞菌感染时,多重耐药铜绿假单胞菌分离株对这些新型β-内酰胺类药物产生耐药性的可能性有多大?
- 10.8 问题4.8:联合抗生素治疗在由DTR铜绿假单胞菌引起的感染治疗中起到什么作用?
- 10.9 问题4.9:雾化抗生素在治疗由耐多药铜绿假单胞菌引起的呼吸道感染中起到什么作用?
- 11 第5节:耐碳青霉烯类鲍曼不动杆菌
- 11.1 问题5.1:治疗CRAB引起的感染的一般方法是什么?
- 11.2 问题5.2:舒巴坦-杜洛巴坦在治疗CRAB引起的感染中发挥什么作用?
- 11.3 问题5.3:氨苄西林-舒巴坦在治疗CRAB引起的感染中起什么作用?
- 11.4 问题5.4:联合抗生素治疗在治疗CRAB引起的感染中起什么作用?
- 11.5 问题5.5:多粘菌素在治疗CRAB引起的感染中起到什么作用?
- 11.6 问题5.6:四环素衍生物在治疗CRAB引起的感染中起到什么作用?
- 11.7 问题5.7:头孢地尔治疗CRAB引起的感染时,其作用是什么?
- 11.8 问题5.8:延长输注美罗培南或亚胺培南-西司他丁在治疗耐碳青霉烯类鲍曼不动杆菌(CRAB)引起的感染中起什么作用?
- 11.9 问题5.9:利福霉素类药物在治疗CRAB引起的感染中发挥什么作用?
- 11.10 问题5.10:雾化抗生素在治疗CRAB引起的呼吸道感染中起什么作用?
- 12 第6节:嗜麦芽窄食单胞菌
- 13 结论
- 14 注释
- 15 参考文献
- 16 补充材料
- 17 出版物免责声明
IDSA 2024 Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections
发布时间2024年7月12日
2024年7月12日
美国传染病学会(IDSA)致力于提供有关抗微生物药物耐药性(AMR)感染治疗的最新指南。这份第四次更新的指南文件重点关注由产超广谱β-内酰胺酶肠杆菌科(ESBL-E)、产AmpC β-内酰胺酶肠杆菌科(AmpC-E)、耐碳青霉烯类肠杆菌科(CRE)、具有难治性耐药性的铜绿假单胞菌(DTR铜绿假单胞菌)、耐碳青霉烯类鲍曼不动杆菌(CRAB)以及嗜麦芽窄食单胞菌引起的感染。本更新文件替代了该指南文件的先前版本。
请通过发送电子邮件至PracticeGuidelines@idsociety.org提交您对AMR指南的反馈和意见。
由CID发布,2024年8月7日 | 《临床传染病》,ciae403,https://doi.org/10.1093/cid/ciae403
普拉尼塔·D·塔玛*、艾米丽·L·海尔、朱莉·安·胡斯托、埃米·J·马瑟斯、迈克尔·J·萨特林、罗伯特·A·博诺莫,
*通讯作者:普拉尼塔·D·塔玛医学博士、卫生科学硕士,美国马里兰州巴尔的摩市约翰斯·霍普金斯大学医学院儿科;ptamma1@jhmi.edu
关键词:超广谱β-内酰胺酶;AmpC酶;耐碳青霉烯类肠杆菌科;铜绿假单胞菌;耐碳青霉烯类鲍曼不动杆菌;嗜麦芽窄食单胞菌
更新历史
2023年7月18日
该指南的3.0版本已发布。
2023年IDSA AMR指南文件的重要更新
建议读者查阅完整的《抗菌药物耐药性指南》文件,因为几乎所有问题都已进行编辑,并补充了最新的临床前和临床数据。以下是2023年美国传染病学会《抗菌药物耐药性指南》文件的部分主要变更。
ESBL-E
- 磷霉素仍不建议用于肾盂肾炎和复杂性尿路感染(cUTI);然而,根据最新的临床数据,额外剂量的口服磷霉素对这些适应症的附加益处存在不确定性,这一点已得到强调。
- 阿莫西林-克拉维酸仍然不是治疗非复杂性产超广谱β-内酰胺酶(ESBL)膀胱炎的首选药物;不过,人们认识到,在某些情况下,如果耐药性或毒性使得其他口服抗生素无法使用,且倾向于避免静脉注射抗生素时,可能会开具该药物。需要提醒患者,若为此适应症使用阿莫西林-克拉维酸,可能会增加感染复发的风险。
- 文中还提供了关于哌拉西林-他唑巴坦预计对产超广谱β-内酰胺酶细菌感染无效的机制原因的更多细节。
- 哌拉西林-他唑巴坦仍然不推荐用于肾盂肾炎和复杂性尿路感染的治疗;然而,有观点认为,如果因肾盂肾炎或复杂性尿路感染而启动哌拉西林-他唑巴坦治疗且患者出现临床改善,那么在决定继续使用哌拉西林-他唑巴坦时,应了解到从理论上讲,这种治疗方式可能会增加微生物学治疗失败的风险。
- 对现有数据和较新数据的重新审查表明,头孢洛扎-他唑巴坦可能对产超广谱β-内酰胺酶肠杆菌(ESBL-E)有效;然而,研究建议应保留这种药物用于治疗多重耐药铜绿假单胞菌(aeruginosa)或混合感染(例如,多重耐药铜绿假单胞菌(P. aeruginosa)和产超广谱β-内酰胺酶肠杆菌(ESBL-E)的混合感染)。
安培C-E
- “中高风险”具有临床意义的AmpC产生这一术语在全文中被替换为“中等风险”。
- 已经明确,即使AmpC的产生没有上调,具有诱导型ampC表达的微生物所产生的基础水平的AmpCβ-内酰胺酶也会导致其对氨苄西林、阿莫西林-克拉维酸、氨苄西林-舒巴坦以及第一、二代头孢菌素具有内在耐药性。
- 有建议称,由于担心在头孢吡肟MIC为4-8 µg/mL的范围内会增加超广谱β-内酰胺酶(ESBL)产生的风险,因此不建议将头孢吡肟用于头孢吡肟MIC为4-8 µg/mL的阴沟肠杆菌(Enterobacter cloacae)、弗氏柠檬酸杆菌(Citrobacter freundii)和产气克雷伯菌(Klebsiella aerogenes)。但根据新的数据以及对现有数据的重新审查,这一建议已被删除。
CRE
- 美国公认产金属β-内酰胺酶(MBL)的CRE分离株(如NDM、VIM、IMP)的流行率有所上升。
- 本文讨论了一种经临床和实验室标准协会(CLSI)认可的方法(即肉汤纸片洗脱法),用于检测头孢他啶-阿维巴坦与氨曲南联合用药对产MBL肠杆菌科细菌的活性。
- 头孢他啶-阿维巴坦联合氨曲南的给药建议已在表1和补充材料中更新。为便于临床实践中同时给药,两种药物均建议每8小时给药一次。
DTR铜绿假单胞菌
- 对于由对任何碳青霉烯类药物不敏感但对传统β-内酰胺类药物(如头孢吡肟)敏感的铜绿假单胞菌分离株引起的感染,仍建议采用高剂量延长输注疗法使用传统药物,不过鉴于这种药敏谱出现的频率,专家组不再强调在使用传统药物前对初始分离株重复进行药敏试验的重要性。
- 新增了一个问题(即问题4.2):“不同可用的β-内酰胺类药物对DTR 铜绿假单胞菌的活性百分比是否存在差异?”文中描述了DTR 铜绿假单胞菌对较新的β-内酰胺类药物的敏感性百分比差异,以及导致其中一些差异的耐药性酶机制的区域差异。
- 鉴于妥布霉素和阿米卡星在肾皮质中作用持续时间较长,且每日一次给药方便,这两种药物已被新增为每日一次给药的替代治疗方案,用于治疗由DTR铜绿假单胞菌引起的肾盂肾炎或复杂性尿路感染。
耐碳青霉烯类不动杆菌
- 舒巴坦-杜洛巴坦联合美罗培南或亚胺培南-西司他丁被列为治疗CRAB感染的首选药物。
- 如果无法获得舒巴坦-杜洛巴坦,大剂量氨苄西林-舒巴坦联合至少一种其他药物的方案已从首选方案改为替代方案。
- 大剂量氨苄西林-舒巴坦的建议给药剂量已调整为每日27克氨苄西林-舒巴坦(18克氨苄西林,9克舒巴坦)。
嗜麦芽窄食单胞菌
- 问题已调整为按偏好顺序列出药物(即头孢地尔[至少初始时联合第二种药物]、头孢他啶-阿维巴坦联合氨曲南、米诺环素[联合第二种药物]、复方磺胺甲噁唑[联合第二种药物]或左氧氟沙星[联合第二种药物])。
- 本文讨论了一种经临床和实验室标准协会(CLSI)认可的方法(即肉汤纸片洗脱法),用于测试头孢他啶-阿维巴坦与氨曲南联合对嗜麦芽窄食单胞菌(maltophilia)的活性。
- 替加环素已不再作为联合治疗的组成部分。
- 已添加临床和实验室标准协会(CLSI)的最新指南,该指南建议不要对嗜麦芽窄食单胞菌感染进行头孢他啶检测。
摘要
背景:美国传染病学会(IDSA)致力于提供有关抗微生物药物耐药性(AMR)感染治疗的最新指南。本指南文件重点关注产超广谱β-内酰胺酶肠杆菌科(ESBL-E)、产AmpCβ-内酰胺酶肠杆菌科(AmpC-E)、耐碳青霉烯类肠杆菌科(CRE)、具有难治性耐药性的铜绿假单胞菌(DTR铜绿假单胞菌)、耐碳青霉烯类鲍曼不动杆菌(CRAB)以及嗜麦芽窄食单胞菌引起的感染。本更新文件替代了该指南文件的先前版本。
方法:由6名在抗微生物药物耐药性感染管理方面具有专业知识的传染病专家组成的小组,针对产超广谱β-内酰胺酶肠杆菌(ESBL-E)、产AmpC酶肠杆菌(AmpC-E)、耐碳青霉烯类肠杆菌(CRE)、多重耐药铜绿假单胞菌(DTR 铜绿假单胞菌)、耐碳青霉烯类鲍曼不动杆菌(CRAB)和嗜麦芽窄食单胞菌引起的感染治疗提出了相关问题。由于全球范围内 antimicrobial resistance(AMR, antimicrobial resistance)的流行病学特征以及特定抗感染药物的可及性存在差异,本文件重点关注美国的AMR感染治疗。
结果:假设已确定病原体且已知抗生素敏感性结果,本文提供了首选和替代的建议治疗方案及相应理由。文中简要讨论了经验性治疗方法、转为口服治疗、治疗持续时间以及其他管理注意事项。建议的方案适用于成人和儿科人群,但仅提供了成人的建议抗生素剂量。
结论:抗生素耐药性(AMR)领域的发展变化十分迅速。建议在治疗抗生素耐药性感染时咨询传染病专科医生。本文件截至2023年12月31日为最新版本,并将定期更新。本文件的最新版本(包括发布日期)可在www.idsociety.org/practice-guideline/amr-guidance/获取。
引言
耐药性(AMR)感染是一场全球性危机。在国际上,2019年估计约有130万人的死亡直接归因于耐药性病原体1。根据美国疾病控制与预防中心(CDC)的《美国抗生素耐药性威胁报告》2,2012年至2017年期间,美国每年因耐药性病原体导致的感染超过280万例,死亡超过3.5万人。
作为临床实践指南的替代方案,美国传染病学会(IDSA)已批准制定更有针对性的指导文件,用于治疗那些数据可能不够充分且仍在快速变化的感染(例如抗生素耐药性感染)。指导文件由小型专家团队编写,他们基于对文献的全面(但不一定是系统性的)回顾、临床经验和专家意见来解答治疗相关问题。这些文件会在网上发布,并每年更新。
本文件提供了关于产超广谱β-内酰胺酶肠杆菌科细菌(ESBL-E)、产AmpCβ-内酰胺酶肠杆菌科细菌(AmpC-E)、耐碳青霉烯类肠杆菌科细菌(CRE)、具有难治性耐药性的铜绿假单胞菌(DTR铜绿假单胞菌)、耐碳青霉烯类鲍曼不动杆菌(CRAB)以及嗜麦芽窄食单胞菌感染的治疗指南。美国疾病控制与预防中心(CDC)已将其中许多病原体列为紧急或严重威胁2。每种病原体都会引发多种感染,在美国各类规模的医院中均有出现,并会导致严重的发病率和死亡率。
指南以针对每种病原体的一系列临床问题的答案形式呈现。
尽管本文档包含了对重要临床试验、耐药机制和抗菌药物敏感性试验(AST)方法的简要描述,但并未对这些主题进行全面综述。本文档未采用GRADE方法(即推荐意见的分级、评估、制定与评价)。由于国际上耐药性的分子流行病学以及特定抗生素的可获得性存在差异,本文中的治疗建议主要针对美国的抗微生物药物耐药性(AMR)感染。本指南适用于成人和儿科人群。在假设肾功能和肝功能正常的情况下,成人抗微生物药物耐药性感染的建议抗生素剂量见表1。本文未提供儿科剂量。本文档内容截至2023年12月31日是最新的。IDSA本指南文件的最新版本及相应的发布日期可在以下网址查询:www.idsociety.org/practice-guideline/amr-guidance.
一般管理建议
本指导文件中建议的治疗方案假定已确定致病微生物,且已证实抗生素的体外活性。如果两种抗生素疗效相同,选择特定药物时的重要考量因素包括安全性、成本、便利性以及当地 formulary 的可获得性。
复杂性尿路感染的定义
在本文件中,术语cUTI指的是与泌尿生殖系统结构或功能异常相关的尿路感染,或青少年及成年男性发生的任何尿路感染。总体而言,专家组建议cUTI的治疗所使用的药物和疗程应与肾盂肾炎相似。对于源头已得到控制(例如,拔除导尿管)且不再存在尿潴留或留置泌尿器械相关持续问题的cUTI,选择与非复杂性膀胱炎相似的抗生素及疗程是合理的,治疗第1天为源头控制实施之日。
经验性治疗
经验性治疗决策不在本指南文件的范围内。然而,一般来说,经验性治疗应参考最可能的病原体、患者的病情严重程度、可能的感染源以及任何其他患者特异性因素(例如,严重青霉素过敏、严重免疫功能低下、慢性肾病)。在为特定患者确定经验性治疗方案时,临床医生还应考虑:(1)过去12个月内从该患者身上识别出的既往病原体及相关的抗菌药物敏感性试验(AST)数据³;(2)过去3个月内的抗生素暴露情况³;(3)最可能病原体的本地AST模式。治疗决策应根据病原体的种类和AST谱,以及已识别出的任何显著β-内酰胺酶基因进行调整。
对于所有生物体,尤其是对于DTR 铜绿假单胞菌、CRAB和嗜麦芽窄食单胞菌,区分细菌定植和感染至关重要,因为不必要的抗生素治疗只会进一步促进耐药性的发展,并可能对患者造成不必要的抗生素相关伤害。通常选择的经验性抗生素方案对CRAB和嗜麦芽窄食单胞菌感染通常无效。在经验性抗生素方案中决定针对CRAB和/或嗜麦芽窄食单胞菌进行治疗时,应在回顾既往培养结果、临床表现、个体宿主风险因素以及特定抗生素的不良事件特征后,进行仔细的风险-获益分析。
治疗持续时间与转为口服治疗
未提供关于治疗持续时间的建议,但临床医生应注意,对于由耐药表型微生物引起的感染,其治疗持续时间不应与由更敏感表型微生物引起的感染有所不同⁴。当获得抗菌药物敏感性试验(AST)结果后,可能会发现经验性启动的抗生素治疗是无效的。这可能会影响治疗持续时间。例如,非复杂性膀胱炎通常是一种轻度感染⁵。如果针对非复杂性膀胱炎,经验性使用了对致病菌无活性的抗生素,但患者的临床症状仍有所改善,通常无需重复尿培养、更换抗生素方案或延长计划的治疗疗程。然而,对于所有其他感染,如果AST结果显示经验性启动的药物可能无效,建议更换为有效的治疗方案,并完成全疗程治疗(从有效治疗开始时计算)。此外,与治疗任何细菌感染一样,在确定耐抗生素(AMR)感染的治疗持续时间时,应考虑与免疫状态、实现感染源控制的能力以及对治疗的总体反应相关的重要宿主因素。最后,在可能的情况下,应考虑转为口服治疗(假设最初开具的是静脉注射治疗),特别是当满足以下标准时:(1)已证实对适当的口服药物敏感;(2)患者血流动力学稳定;(3)已采取合理的感染源控制措施;(4)不存在肠道吸收不足的担忧⁶。
表1和表2
正常的肾和肝功能1,2
IDSA AMR指南文件1中建议的抗生素联合用药方案
第1节:产超广谱β-内酰胺酶肠杆菌目细菌
ESBLs是一类能使大多数青霉素类、头孢菌素类和氨曲南失活的酶。ESBL-E通常对碳青霉烯类药物仍然敏感。ESBLs不会使非β-内酰胺类药物(如环丙沙星、复方磺胺甲噁唑[TMP-SMX]、庆大霉素)失活。然而,携带ESBL基因的微生物往往还含有其他基因或基因发生突变,这使其对多种抗生素的耐药性增强。
任何革兰氏阴性菌都有可能携带超广谱β-内酰胺酶(ESBL)基因,不过这些基因在大肠杆菌、肺炎克雷伯菌、产酸克雷伯菌和奇异变形杆菌中最为常见7-9。在美国,CTX-M型酶(尤其是CTX-M-15型)是最常见的ESBLs9。此外,还存在其他具有独特水解能力的ESBLs,包括带有氨基酸取代的TEM型和SHV型β-内酰胺酶变体,但对它们的临床研究不如对CTX-M型酶的研究深入10-14。大多数临床微生物实验室不进行常规的ESBL检测15,16。相反,对头孢曲松的不敏感性(即头孢曲松的最低抑菌浓度[MICs]≥2μg/mL)常被用作ESBL产生的替代指标,不过该阈值在特异性方面存在局限性,因为那些并非因产生ESBL而对头孢曲松不敏感的菌株可能会被误判为ESBL产生菌17,18。在本指南文件中,ESBL-E指的是推定或确认产ESBL的大肠杆菌、肺炎克雷伯菌、产酸克雷伯菌或奇异变形杆菌。关于ESBL-E感染的治疗建议,均假定推荐及替代抗生素的体外活性已得到证实。
问题1.1:治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的非复杂性膀胱炎,首选抗生素是什么?
建议方案:呋喃妥因和复方新诺明(TMP-SMX)是治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的非复杂性膀胱炎的首选药物。环丙沙星、左氧氟沙星和碳青霉烯类药物是治疗产超广谱β-内酰胺酶肠杆菌引起的非复杂性膀胱炎的替代药物。尽管这些药物有效,但在呋喃妥因或复方新诺明有效的情况下,不建议使用它们。氨基糖苷类药物(单剂量)和口服磷霉素(仅适用于大肠杆菌)也是治疗产超广谱β-内酰胺酶肠杆菌引起的非复杂性膀胱炎的替代疗法。
理由
呋喃妥因和复方新诺明(TMP-SMX)已被证实是治疗非复杂性膀胱炎(包括非复杂性产超广谱β-内酰胺酶肠杆菌科细菌(ESBL-E)膀胱炎)的有效选择5,19,20,21。尽管碳青霉烯类药物以及氟喹诺酮类药物(环丙沙星或左氧氟沙星)是治疗产ESBL-E膀胱炎的有效药物22,23,但在有其他有效选择的情况下,不建议将其用于非复杂性膀胱炎。限制这些药物的使用可以保留其活性,以便在未来治疗选择可能更有限的感染时使用。此外,限制它们的使用可降低相关毒性风险,尤其是氟喹诺酮类药物,其与QTc间期延长、肌腱炎和肌腱断裂、主动脉夹层、癫痫发作、周围神经病变以及艰难梭菌感染的风险增加相关24-27。
单剂量静脉注射氨基糖苷类药物是单纯性产超广谱β-内酰胺酶肠杆菌(ESBL-E)膀胱炎的一种替代治疗选择。氨基糖苷类药物几乎完全通过肾脏途径排泄。单剂量静脉注射通常对单纯性膀胱炎有效,毒性极小,但缺乏可靠的临床试验数据28。口服磷霉素是仅适用于由大肠杆菌(E. coli)引起的单纯性产超广谱β-内酰胺酶肠杆菌膀胱炎的替代治疗选择。大多数临床微生物实验室不会常规检测大肠杆菌(E. coli)对磷霉素的敏感性,但在美国,大肠杆菌(E. coli)对磷霉素的耐药性仍然罕见29,30。临床和实验室标准协会(CLSI)仅为大肠杆菌(E. coli)制定了磷霉素的折点。不建议使用磷霉素治疗肺炎克雷伯菌(K. pneumoniae)和其他几种革兰氏阴性菌引起的感染,这些细菌常携带fosA(fosA)水解酶基因,可能导致临床治疗失败31,32。一项随机开放标签试验表明,对于单纯性膀胱炎,单剂量口服磷霉素的临床失败率高于为期五天的呋喃妥因疗程19。尽管该试验并非仅限于大肠杆菌(E. coli)膀胱炎,但在仅针对大肠杆菌(E. coli)感染的亚组分析中,磷霉素组的结局仍然较差,磷霉素组第14天的临床失败率为50%,而呋喃妥因组为22%19。对于单纯性膀胱炎,额外剂量口服磷霉素的附加效益尚不明确,但正如针对复杂性尿路感染(cUTI)所建议的那样,这可能是一个合理的选择33(问题1.2)。
不建议使用阿莫西林克拉维酸治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)性膀胱炎。一项随机临床试验比较了370例非复杂性大肠杆菌膀胱炎女性患者接受3天阿莫西林克拉维酸(500mg/125mg,每日两次)与3天环丙沙星(250mg,每日两次)治疗的效果。结果显示,随机分配到阿莫西林克拉维酸组和环丙沙星组的女性临床治愈率分别为58%和77%。阿莫西林克拉维酸组的较高失败率似乎与持续性阴道细菌定植有关,该组和环丙沙星组中出现持续性阴道细菌定植的患者比例分别为45%和10%。该试验中感染产超广谱β-内酰胺酶肠杆菌菌株的女性比例尚不明确。值得注意的是,两种药物的给药剂量均低于一般建议剂量(表1)。尽管有数据表明克拉维酸在体外对超广谱β-内酰胺酶有效,但这可能无法转化为临床疗效。目前缺乏有力数据表明口服阿莫西林克拉维酸对产超广谱β-内酰胺酶肠杆菌引起的非复杂性膀胱炎有效。虽然阿莫西林克拉维酸不是治疗非复杂性产超广谱β-内酰胺酶膀胱炎的首选药物,但如果因耐药性或毒性而无法使用其他口服抗生素,且倾向于避免静脉使用抗生素而开具此药时,应告知患者使用阿莫西林克拉维酸可能会增加感染复发的风险。
专家组建议避免使用多西环素治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的非复杂性膀胱炎。近50年前发表的两项临床结局研究表明,口服四环素类药物可能对尿路感染(UTIs)的治疗有效37,38。然而,这两项研究均主要关注铜绿假单胞菌(P. aeruginosa),而该菌对口服四环素类药物不敏感,这使得抗生素治疗对临床治愈的影响受到质疑。多西环素主要通过肠道排泄39,尿排泄量有限(35%-60%)39。在获得更有说服力的、证明口服多西环素治疗产超广谱β-内酰胺酶肠杆菌膀胱炎临床有效性的数据之前,专家组建议不将多西环素用于该适应症。哌拉西林-他唑巴坦、头孢吡肟和头霉素类药物在非复杂性膀胱炎治疗中的作用分别在问题1.4、问题1.5和问题1.6中讨论。
问题1.2:治疗由产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的肾盂肾炎或复杂性尿路感染(cUTI)时,首选抗生素是什么?
建议方案:复方新诺明(TMP-SMX)、环丙沙星或左氧氟沙星是治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的肾盂肾炎或复杂性尿路感染(cUTIs)的首选药物。当对复方新诺明或氟喹诺酮类药物存在耐药性或其毒性使其无法使用时,厄他培南、美罗培南和亚胺培南-西司他丁是首选药物。氨基糖苷类药物是治疗产超广谱β-内酰胺酶肠杆菌肾盂肾炎或复杂性尿路感染的替代选择。
理由
甲氧苄啶-磺胺甲噁唑(TMP-SMX)、环丙沙星和左氧氟沙星是产超广谱β-内酰胺酶肠杆菌(ESBL-E)肾盂肾炎或复杂性尿路感染(cUTIs)患者的首选治疗方案,前提是已证实这些药物在体外具有敏感性,这是基于它们能在尿液中达到足够且持续的浓度、临床试验结果以及临床经验40-42。当甲氧苄啶-磺胺甲噁唑或氟喹诺酮类药物因耐药性或毒性而无法使用时,或者患者病情危重时在治疗初期,碳青霉烯类药物也是首选药物(问题1.3)。如果已开始使用碳青霉烯类药物,且证实患者对甲氧苄啶-磺胺甲噁唑、环丙沙星或左氧氟沙星敏感,那么转为这些药物的口服制剂比完成碳青霉烯类药物的疗程更可取。减少碳青霉烯类药物的使用将保留其对未来耐药菌感染的活性,而复杂性尿路感染患者常出现此类感染43。
氨基糖苷类药物是肾盂肾炎和复杂性尿路感染的替代治疗选择。尽管其疗效值得期待,但由于存在相关的肾毒性风险,它们被视为替代药物。动物模型显示,氨基糖苷类药物会在肾实质中积聚44。在一项针对609名接受普拉佐米星治疗复杂性尿路感染的成人患者的临床试验中,普拉佐米星组和美罗培南组的临床复发率分别为2%和7%,血清肌酐水平较基线升高≥0.5mg的患者比例分别为7%和4%45。总体而言,与其他氨基糖苷类药物相比,更高比例的肠杆菌科临床分离株对普拉佐米星敏感46。如果药敏试验显示敏感,其他氨基糖苷类药物治疗产超广谱β-内酰胺酶肠杆菌引起的肾盂肾炎或复杂性尿路感染可能同样有效45,47,48。值得注意的是,2023年美国临床和实验室标准协会修订了肠杆菌科对庆大霉素、妥布霉素和阿米卡星的折点16(表2)。考虑到氨基糖苷类药物在肾皮质中作用持续时间较长,且每日一次给药方便,它们或许适合用于完成治疗疗程(例如,从其他药物过渡到末期剂量)47,48(表1、补充材料)。所有氨基糖苷类药物都应考虑其与疗程相关的肾毒性风险49,50。
由于磷霉素在肾实质中的浓度有限,不建议将其用于肾盂肾炎或复杂性尿路感染(cUTI)的治疗。需要更多数据来评估口服磷霉素在肾盂肾炎或复杂性尿路感染患者中的作用,特别是在采用多剂量方案以及在首选治疗数天后使用的情况下。 在一项针对97名大肠杆菌肾盂肾炎女性患者(约半数患者伴有菌血症)的临床试验中,患者先接受了长达5天的静脉治疗,随后转为每日一次3克剂量的口服磷霉素或每日两次500毫克剂量的口服环丙沙星,总抗生素治疗时长为10天。两组的临床治愈率相近(分别为75%和65%)。然而,仅约6%的分离菌株为产超广谱β-内酰胺酶(ESBL)菌株,这限制了该结果对耐药表型引起的肾盂肾炎的普适性。此外,由于肾盂肾炎的治疗通常7天就足够,额外天数使用口服磷霉素或环丙沙星的归因效益尚不明确。 另一项临床试验将51名复杂性尿路感染患者在接受至多两天的静脉治疗后,随机分配至每日3克磷霉素组或每日750毫克左氧氟沙星组,治疗5-7天。治疗结束时,两组的临床治愈率相近(分别为69%和68%)。在这项研究中,63%的感染由大肠杆菌引起,但每组中仅各有一株分离菌株为产ESBL菌株。
在美国,静脉用磷霉素尚未投入临床使用。尽管有部分数据表明,静脉用磷霉素可能对除大肠杆菌以外的微生物也有活性,但考虑到口服磷霉素生物利用度有限且每日剂量较低,很难将静脉用磷霉素的数据外推至口服磷霉素。在建议支持或反对将每日口服磷霉素用于治疗产超广谱β-内酰胺酶大肠杆菌(ESBL-E)引起的肾盂肾炎或复杂性尿路感染(cUTI)之前,还需要对这种转换疗法进行进一步研究;不过,当其他首选或替代口服药物不可用时,它可能是一个合理的选择。
当首选药物(如碳青霉烯类、复方磺胺甲噁唑或氟喹诺酮类)无法耐受或药敏试验显示不敏感时,磷霉素是治疗产超广谱β-内酰胺酶(ESBL)大肠杆菌所致前列腺炎的替代选择53-59。在一项观察性研究中,44例慢性细菌性前列腺炎男性患者接受磷霉素治疗(口服3g/天,持续1周,随后改为每48小时口服3g,持续6至12周),其中36例(82%)达到临床治愈53。由于除大肠杆菌外的其他革兰氏阴性菌可能携带fosA基因,该基因可使磷霉素失活,因此不建议将磷霉素用于治疗这些细菌引起的前列腺炎(问题1.1)。
呋喃妥因在肾实质中无法达到足够浓度,不建议用于肾盂肾炎或复杂性尿路感染(cUTI)的治疗。多西环素由于其尿排泄量有限,也不建议用于产超广谱β-内酰胺酶肠杆菌(ESBL-E)所致肾盂肾炎或复杂性尿路感染的治疗(问题1.1)39。哌拉西林-他唑巴坦、头孢吡肟和头霉素类药物在肾盂肾炎或复杂性尿路感染治疗中的作用,分别在问题1.4、问题1.5和问题1.6中讨论。
问题1.3:治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的泌尿道外感染时,首选抗生素是什么?
建议方案:美罗培南、亚胺培南-西司他丁或厄他培南是治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的泌尿道外感染的首选药物。对于危重症患者和/或存在低白蛋白血症的患者,美罗培南或亚胺培南-西司他丁是首选的碳青霉烯类药物。在获得适当的临床疗效后,若证实病原体对药物敏感,应考虑转为口服复方磺胺甲噁唑(TMP-SMX)、环丙沙星或左氧氟沙星进行治疗。
理由
根据一项大型临床试验的数据(如下所述60),碳青霉烯类药物被推荐作为尿路外产超广谱β-内酰胺酶肠杆菌科细菌(ESBL-E)感染的一线治疗药物。美罗培南、亚胺培南-西司他丁或厄他培南是首选药物;当没有口服治疗方案时,对于需要在门诊继续接受碳青霉烯类药物治疗的患者,厄他培南是更便捷的选择。
对于病情危重和/或存在低白蛋白血症的患者,美罗培南或亚胺培南-西司他丁是首选的碳青霉烯类药物。与美罗培南和亚胺培南不同,厄他培南与蛋白质的结合率高,导致血清半衰期相对较长。在低白蛋白血症患者中,厄他培南的游离部分会增加,这会使厄他培南的清除率上升,该药物的血清半衰期显著缩短,因此每日给药可能并非最佳选择。一项针对279例肠杆菌科感染患者的观察性研究发现,对于低白蛋白血症(定义为血清白蛋白<2.5g/dL)患者,接受厄他培南治疗者30天死亡率的比值比约为接受美罗培南或亚胺培南-西司他丁治疗者的5倍。关于在危重患者中使用厄他培南与其他碳青霉烯类药物的临床文献有限且存在矛盾。然而,鉴于危重患者存在已知的药代动力学(PK)改变,且厄他培南的药代动力学和药效学(PK/PD)特征存在局限性,专家组建议,对于产超广谱β-内酰胺酶肠杆菌(ESBL-E)感染的危重患者,初始治疗应选用美罗培南或亚胺培南-西司他丁,而非厄他培南。较高剂量的厄他培南(如1.5克)或更频繁的给药(如每12小时一次)或许能分别解决肥胖患者和低白蛋白血症危重患者中厄他培南的目标达成概率问题,但这些替代给药策略的数据有限。
这项确立碳青霉烯类疗法作为产超广谱β-内酰胺酶肠杆菌科(ESBL-E)血流感染首选治疗方案的临床试验,将391例头孢曲松不敏感的大肠杆菌或肺炎克雷伯菌患者(87%后来证实携带ESBL基因)随机分配至哌拉西林-他唑巴坦组(4.5g静脉注射,每6小时一次)或美罗培南组(1g静脉注射,每8小时一次),两组均采用标准输注方式(即30分钟内完成输注)。主要结局指标30天死亡率在哌拉西林-他唑巴坦组和美罗培南组中分别为12%和4%。随后,研究人员仅纳入了那些通过微量肉汤稀释法(抗菌药物敏感性试验的参考标准)检测显示哌拉西林-他唑巴坦最低抑菌浓度(MIC)≤16μg/mL的临床分离株患者,对试验数据进行了重新分析。对320例(82%)可进行复测的临床分离株患者的数据重新分析后发现,哌拉西林-他唑巴坦组和美罗培南组的30天死亡率分别为9%和4%。尽管在重新分析中,绝对风险差异有所减小且不再显著(即95%置信区间为-1%至11%),但专家组仍建议将碳青霉烯类疗法作为产超广谱β-内酰胺酶菌血流感染的首选治疗方案,原因是风险差异存在明显的趋势。哌拉西林-他唑巴坦的局限性在问题1.4中有进一步描述。目前尚无可比的临床试验数据用于
其他身体部位的产超广谱β-内酰胺酶肠杆菌(ESBL-E)感染。尽管如此,专家组建议将产超广谱β-内酰胺酶肠杆菌血流感染的证据外推至其他常见感染部位,如腹腔内感染、皮肤和软组织感染以及肺炎。同样,尽管该试验评估了美罗培南,但专家组建议将研究结果扩展到亚胺培南-西司他丁和厄他培南,其中厄他培南仅限于血清白蛋白正常的患者和非危重症患者。
观察性研究的数据支持,在达到适当的临床里程碑后,对肠杆菌科血流感染(包括由耐抗生素菌株引起的感染)采用口服降阶梯疗法73,74。基于口服复方新诺明(TMP-SMX)和氟喹诺酮类药物的高生物利用度和持续的血清浓度,对于产超广谱β-内酰胺酶肠杆菌(ESBL-E)感染患者,若满足以下条件,这些药物可作为治疗选择:(1)已证实对其中一种药物敏感;(2)患者血流动力学稳定;(3)已实现合理的感染源控制;(4)不存在肠道吸收不足的担忧6。
对于产超广谱β-内酰胺酶肠杆菌(ESBL-E)血流感染,临床医生应避免口服转换为呋喃妥因、磷霉素、阿莫西林-克拉维酸、奥马环素或多西环素进行治疗。呋喃妥因和磷霉素的血清浓度较低。而关于阿莫西林-克拉维酸、奥马环素和多西环素用于治疗产超广谱β-内酰胺酶肠杆菌血流感染的支持性数据有限。
问题1.4:哌拉西林-他唑巴坦在治疗产超广谱β-内酰胺酶(ESBL)细菌引起的感染中是否有作用?
建议方案:如果哌拉西林-他唑巴坦被用作经验性治疗药物,用于治疗由后来被确认的产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的非复杂性膀胱炎,且患者临床症状有所改善,则无需更改或延长抗生素治疗。专家小组建议,对于产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的肾盂肾炎或复杂性尿路感染(cUTI),使用复方新诺明(TMP-SMX)、环丙沙星、左氧氟沙星或碳青霉烯类药物,而非哌拉西林-他唑巴坦,尽管已知使用哌拉西林-他唑巴坦治疗的临床失败风险可能较低。即使显示病原体对哌拉西林-他唑巴坦敏感,也不建议将其用于治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的尿路以外的感染。
理由
哌拉西林-他唑巴坦在体外常对产超广谱β-内酰胺酶(ESBL)的菌株表现出活性75。然而,关于他唑巴坦作为有效β-内酰胺酶抑制剂的能力存在几个问题。首先,当存在ESBL酶或其他β-内酰胺酶(如OXA-1)时,哌拉西林-他唑巴坦的最低抑菌浓度(MIC)检测可能不准确且/或重现性差,这使得无法确定检测为对该药物敏感的菌株是否确实可靠敏感72,76-79。其次,体外数据表明,在某些临床感染(如脓肿)中可能存在细菌接种量增加的情况,此时与美罗培南相比,使用哌拉西林-他唑巴坦时产ESBL菌株更有可能重新生长;这些发现的临床意义尚不明确80-82。第三,对于ESBL酶表达增加的菌株,或存在多种ESBL酶或其他β-内酰胺酶(如AmpC酶)的菌株,他唑巴坦的有效性可能会降低83。这部分可能是由于他唑巴坦的浓度相对于哌拉西林较低。例如,在4.5克剂量的哌拉西林-他唑巴坦中,哌拉西林与他唑巴坦的比例为8:1(即4克哌拉西林和0.5克他唑巴坦)。相比之下,在3克剂量的头孢洛扎中,头孢洛扎与他唑巴坦的比例为2:1。哌拉西林-他唑巴坦中他唑巴坦剂量较低可能会限制其作为抑制剂的能力,这一说法是合理的84。最后,肠杆菌科细菌对哌拉西林-他唑巴坦的折点主要基于哌拉西林给药策略的药代动力学/药效学(PK/PD)考虑,而非检测孔中4μg/ml的固定他唑巴坦浓度是否能反映常用他唑巴坦剂量在存在ESBL酶情况下恢复哌拉西林活性的能力84,85。
如果哌拉西林-他唑巴坦被用作经验性治疗药物,用于治疗由后来被确定为产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的非复杂性膀胱炎,且患者病情出现临床改善,那么无需更改或延长抗生素治疗,因为非复杂性膀胱炎往往可自行痊愈。确定哌拉西林-他唑巴坦在治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)所致肾盂肾炎或复杂性尿路感染(cUTI)中的作用则更具挑战性。多项观察性研究发现,在比较哌拉西林-他唑巴坦与碳青霉烯类药物治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)所致肾盂肾炎或复杂性尿路感染(cUTI)的疗效时,两者的临床结局相似86-88,89,90。针对这一问题,还开展了一项随机、开放标签的临床试验91。该试验纳入了66例由产超广谱β-内酰胺酶的大肠杆菌(经确认存在超广谱β-内酰胺酶基因)引起的肾盂肾炎或复杂性尿路感染患者,将其随机分配至哌拉西林-他唑巴坦组(4.5g静脉注射,每6小时一次)或厄他培南组(1g静脉注射,每24小时一次)。两组的临床成功率相近,哌拉西林-他唑巴坦组为94%,厄他培南组为97%。这些研究表明,在治疗肾盂肾炎或复杂性尿路感染方面,哌拉西林-他唑巴坦并不劣于碳青霉烯类药物。在上述临床试验中,231例由 urinary 来源引起的产超广谱β-内酰胺酶肠杆菌(ESBL-E)血流感染亚组患者(问题1.3)中,哌拉西林-他唑巴坦组的死亡率更高(7%对3%)60,尽管这一差异未达到统计学显著性。综合所有数据,专家组更倾向于采用碳青霉烯类药物治疗(或若病原体敏感,可采用口服复方新诺明、环丙沙星或左氧氟沙星)来治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)所致肾盂肾炎或复杂性尿路感染,但也承认,根据现有的比较效果研究结果(问题1.2),为这些感染开具哌拉西林-他唑巴坦处方可能是合理的。如果哌拉西林-他唑巴坦被用作经验性治疗药物,用于治疗由后来被确定为产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的肾盂肾炎或复杂性尿路感染,且患者病情出现临床改善,那么在决定继续使用哌拉西林-他唑巴坦时,应认识到从理论上讲,这种方法可能会增加微生物学治疗失败的风险。
关于哌拉西林-他唑巴坦治疗产超广谱β-内酰胺酶肠杆菌科(ESBL-E)血流感染的有效性,观察性研究得出了相互矛盾的结果86-88,91-103。一项针对产超广谱β-内酰胺酶肠杆菌科血流感染的临床试验表明,与碳青霉烯类疗法相比,哌拉西林-他唑巴坦的疗效更差(问题1.3)60。第二项研究哌拉西林-他唑巴坦在产超广谱β-内酰胺酶肠杆菌科血流感染治疗中作用的试验正在进行中104。
2022年,美国临床和实验室标准协会(CLSI)降低了肠杆菌目细菌对哌拉西林-他唑巴坦的折点。最低抑菌浓度(MIC)≤8/4 µg/mL被视为敏感,最低抑菌浓度16 µg/mL被视为剂量依赖性敏感(表2)105。在问题1.3中提到的临床试验中,若采用修订后的哌拉西林-他唑巴坦折点,94%的分离株会被视为对哌拉西林-他唑巴坦敏感或剂量依赖性敏感,这表明在产超广谱β-内酰胺酶(ESBL)的情况下,对哌拉西林-他唑巴坦的敏感性可能与临床疗效不相关60,72。
问题1.5:头孢吡肟在治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的感染中是否有作用?
建议方案:如果头孢吡肟被用作经验性治疗药物,用于治疗由后来被确定为产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的非复杂性膀胱炎,且患者病情出现临床改善,则无需改变或延长抗生素治疗。专家小组建议避免使用头孢吡肟治疗肾盂肾炎或复杂性尿路感染(cUTI)。即使显示对头孢吡肟敏感,也不建议使用头孢吡肟治疗由产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的泌尿道外感染。
理由
ESBLs通常会水解头孢吡肟83,106。此外,即使产ESBL的分离株检测显示对头孢吡肟敏感,使用商业化的AST方法进行头孢吡肟MIC检测也可能不准确和/或重现性较差107。目前尚未开展旨在比较使用头孢吡肟或碳青霉烯类药物治疗ESBL-E血流感染患者疗效的临床试验。
如果头孢吡肟最初被用作经验性治疗药物,用于治疗由后来被确定为产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的非复杂性膀胱炎,且患者临床症状有所改善,则无需改变或延长抗生素治疗,因为非复杂性膀胱炎通常可自行痊愈。关于头孢吡肟与碳青霉烯类药物在治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)所致肾盂肾炎和复杂性尿路感染(cUTI)中的作用,现有评估数据有限91,108 89。一项评估经分子学证实的产超广谱β-内酰胺酶肠杆菌(ESBL-E)肾盂肾炎和复杂性尿路感染(cUTI)治疗方案的临床试验,因头孢吡肟(静脉注射2克,每12小时一次)的临床失败率较高而提前终止了头孢吡肟组的试验,尽管所有分离株的头孢吡肟最低抑菌浓度(MIC)均为1-2微克/毫升91。在有更可靠的比较效果研究来明确头孢吡肟的作用之前,专家组建议避免使用头孢吡肟治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)所致肾盂肾炎或复杂性尿路感染(cUTI)。
尚未开展比较头孢吡肟与碳青霉烯类药物治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)血流感染的临床试验。不过,一项针对医院获得性肺炎的随机试验比较了头孢吡肟(静脉注射,每次2克,每8小时一次)与亚胺培南-西司他丁(静脉注射,每次500毫克,每6小时一次)的疗效,结果显示,在头孢吡肟组中,13例由ESBL-E引起的肺炎患者中有4例(31%)出现临床治疗失败,而亚胺培南-西司他丁组的10例患者中无一例(0%)出现临床治疗失败109。比较头孢吡肟和碳青霉烯类药物治疗侵袭性ESBL-E感染的观察性研究表明,两者在治疗结局上要么没有差异,要么头孢吡肟的治疗结局更差110-113。基于这些原因,专家组建议避免使用头孢吡肟治疗侵袭性ESBL-E感染。
问题1.6:头孢霉素在治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的感染中是否有作用?
建议方案:在获得更多使用头孢西丁或头孢替坦的临床结局数据并确定最佳给药剂量之前,不建议使用头孢霉素治疗产超广谱β-内酰胺酶菌感染。
理由
头霉素类属于头孢菌素类,通常能够抵抗超广谱β-内酰胺酶(ESBL)的水解作用114,115。美国现有的头霉素类药物包括头孢西丁和头孢替坦,二者均为静脉用药物。至少有10项观察性研究对比了使用头霉素类药物与碳青霉烯类药物治疗产ESBL肠杆菌(ESBL-E)感染患者的临床结局,这些感染主要为尿路感染或源于泌尿道的血流感染116-125。在这10项研究中,有8项发现两组的临床结局无差异116,118-120,122,123;有2项研究显示头霉素类药物组的结局更差117,121。其中一项研究纳入了57例肺炎克雷伯菌血流感染患者,头霉素类药物组和碳青霉烯类药物组的14天死亡率分别为55%和39%117。另一项研究是迄今为止已发表的规模最大的研究,纳入了380例大肠杆菌和肺炎克雷伯菌血流感染患者,头霉素类药物(即氟氧头孢)组和碳青霉烯类药物组的30天死亡率分别为29%和13%121。重要的是,所有8项研究均为观察性研究,纳入的感染来源多样,存在明显的选择偏倚,且使用的头霉素类药物种类不同,在剂量、疗程和给药频率上也存在差异。
专家组不建议将头孢霉素用于产超广谱β-内酰胺酶肠杆菌(ESBL-E)感染的治疗,包括产超广谱β-内酰胺酶肠杆菌引起的非复杂性膀胱炎。观察性研究中所调查的许多头孢霉素在美国并未上市。已发表的研究中,接受头孢西丁或头孢替坦治疗的患者数量有限119,123,126。专家组认为,在提倡使用这些药物治疗产超广谱β-内酰胺酶肠杆菌感染之前,需要更多与之相关的临床数据,包括最佳给药剂量和给药频率。有数据表明,高剂量持续输注头孢西丁(即每日6克持续输注)的治疗效果更理想123,126,但这种给药方式实施起来存在难度。由于头孢替坦和头孢西丁均仅能静脉给药,且半衰期相对较短,因此在治疗产超广谱β-内酰胺酶肠杆菌感染时,与首选药物相比,使用这些药物似乎并不具备可行性优势。
问题1.7:较新的β-内酰胺-β-内酰胺酶抑制剂复方制剂和头孢地尔在治疗产超广谱β-内酰胺酶肠杆菌(ESBL-E)引起的感染中起到什么作用?
建议方法:专家小组建议,头孢他啶-阿维巴坦、美罗培南-瓦博巴坦、亚胺培南-西司他丁-雷利巴坦、头孢洛扎-他唑巴坦和头孢地尔应优先保留用于治疗由表现出碳青霉烯耐药性的微生物引起的感染。
理由
头孢他啶-阿维巴坦、美罗培南-法硼巴坦、亚胺培南-西司他丁-雷利巴坦、头孢洛扎-他唑巴坦和头孢地尔对产超广谱β-内酰胺酶菌株(ESBL-E)具有活性127-129。阿维巴坦能够通过结合并抑制超广谱β-内酰胺酶的功能,成功保护头孢他啶免受水解9,130。临床试验数据的亚组分析支持头孢他啶-阿维巴坦对产超广谱β-内酰胺酶菌株感染的有效性131-135。
美罗培南-瓦博巴坦和亚胺培南-西司他丁-瑞来巴坦中的碳青霉烯成分即使不添加β-内酰胺酶抑制剂,也对产超广谱β-内酰胺酶肠杆菌科细菌(ESBL-E)具有足够的活性。
头孢洛扎-他唑巴坦对产超广谱β-内酰胺酶肠杆菌(ESBL-E)的抗菌活性似乎比哌拉西林-他唑巴坦更强,头孢洛扎的最低抑菌浓度(MIC)比哌拉西林的最低抑菌浓度低数个稀释度,这得益于他唑巴坦的加入136-141。此外,与哌拉西林相比,头孢洛扎对常见超广谱β-内酰胺酶(如CTX-M-15)的水解作用表现出更强的稳定性,这使得头孢洛扎对他唑巴坦抑制特性的依赖程度低于哌拉西林142,143。另外,头孢洛扎-他唑巴坦中β-内酰胺与他唑巴坦的比例为2:1,与哌拉西林-他唑巴坦(8:1)相比,这一比例使他唑巴坦的浓度更高。
在一项随机临床试验中对72例产超广谱β-内酰胺酶肠杆菌(ESBL-E)腹腔内感染患者进行的亚组分析显示,头孢洛扎-他唑巴坦与美罗培南的临床治愈率相近144。在一项比较头孢洛扎-他唑巴坦与美罗培南治疗肺炎的随机临床试验中,84例接受头孢洛扎-他唑巴坦治疗的产超广谱β-内酰胺酶肠杆菌肺炎患者亚组的28天死亡率(21%)与73例接受美罗培南治疗的患者(29%)相近145,146。头孢洛扎-他唑巴坦组与美罗培南组的临床治愈率和微生物清除率也相似。
尽管头孢他啶-阿维巴坦、美罗培南-瓦博巴坦、亚胺培南-西司他丁-雷利巴坦、头孢洛扎-他唑巴坦和头孢地尔预计对产超广谱β-内酰胺酶肠杆菌(ESBL-E)感染有效,但专家小组建议,这些药物应优先保留用于治疗碳青霉烯类耐药菌感染或包含碳青霉烯类耐药菌的混合感染(例如,头孢洛扎-他唑巴坦可用于同时感染多重耐药铜绿假单胞菌和产超广谱β-内酰胺酶肠杆菌的情况)。
第2节:产AmpC β-内酰胺酶的肠杆菌目细菌
AmpC β-内酰胺酶是多种肠杆菌科细菌和非发酵葡萄糖革兰氏阴性菌以基础水平产生的酶。它们的主要功能是协助细胞壁的循环利用147。AmpC β-内酰胺酶能够水解多种β-内酰胺类药物(水解程度可使药物失效),其中一些在基础水平AmpC产生的情况下(如头孢唑林),另一些则在AmpC产生增加的情况下(如头孢曲松)。肠杆菌科细菌AmpC产生增加通常通过以下三种机制之一实现:(1)诱导性染色体基因表达;(2)稳定的染色体基因去抑制;(3)组成型表达的ampC基因(常携带于质粒上,但有时会整合到细菌染色体中)147-149。
在特定抗生素存在的情况下,可诱导的ampC表达会导致AmpC酶的产生增加,使得周质空间中出现足够量的AmpC酶,从而提高对某些抗生素(如头孢曲松、头孢噻肟、头孢他啶、氨曲南和哌拉西林-他唑巴坦)的最低抑菌浓度(MIC)。在这种情况下,一种肠杆菌目分离株最初检测对头孢曲松敏感,但在开始使用头孢曲松治疗后,可能会表现出对该药物的不敏感性。本指南文件中,此类微生物被描述为具有产生临床意义显著的AmpC酶的中度风险。即使仅使用几剂头孢曲松、头孢噻肟或头孢他啶,也可能观察到因ampC诱导而产生的耐药性150。
对于另外两种机制(即稳定的染色体去抑制或组成型过表达ampC基因),AmpC的产生量总是会增加。具有这两种机制中任意一种的分离株,预计对头孢曲松、头孢噻肟和/或头孢他啶的检测结果为不敏感。因此,与由具有诱导型ampC表达的分离株引起的感染相比,由具有这些耐药机制的微生物引起的感染通常在治疗上的困境较小。关于这两种机制中的第一种,一些肠杆菌科分离株(例如,某些大肠杆菌和志贺菌属)在ampC或其他相关基因(例如,ampD、ampR、ampG)的启动子或衰减子中存在突变,从而稳定地解除对基因表达的抑制151。对于第二种机制,会出现ampC基因(例如,blaCMY、blaFOX、blaDHA、blaACT、blaMIR)的组成型表达152。这些ampC基因既可以存在于质粒上(例如,大肠杆菌中的blaCMY),也可以整合到细菌染色体中(例如,弗氏柠檬酸杆菌中的blaCMY)。在本文献中,我们将重点关注具有中等可能性存在诱导型ampC基因表达的肠杆菌科物种所引起感染的治疗(即三种机制中的第一种)153,154。
问题2.1:哪些常见的肠杆菌科菌种应被视为具有临床显著诱导型ampC产生的中度风险?
建议方法:阴沟肠杆菌复合体、产气克雷伯菌和弗氏柠檬酸杆菌是临床上显著诱导型AmpC产生风险中等的最常见肠杆菌目细菌。
理由
量化不同细菌物种中ampC诱导的可能性,最好通过以下方式来定义:系统识别最初对某些β-内酰胺类药物(如头孢曲松)敏感的微生物,这些微生物在后续分离(以及接触β-内酰胺类药物后)会产生耐药性,再通过基因分型和表达研究确认回收的是同一微生物,且AmpC的产生显著增加。遗憾的是,这类研究目前尚未开展。
常用于表示有产生AmpC风险的微生物的缩写(如SPACE、SPICE、ESCPM)掩盖了革兰氏阴性菌中广泛存在的ampC诱导潜力,并且忽略了细菌属内的差异147,148。例如,弗氏柠檬酸杆菌(C. freundii)携带染色体ampC,而克氏柠檬酸杆菌(Citrobacter koseri)则不携带155-157。因此,当前的缩写可能过于简单,既可能“低估”也可能“高估”个别细菌种类产生具有临床意义的AmpC的可能性。再举一个例子,“吲哚阳性变形杆菌(Proteus)种”通常包含在现有的缩写中。目前,吲哚阳性变形杆菌(Proteus)种指的是普通变形杆菌(P. vulgaris)等微生物,这类微生物通常不含有染色体ampC基因。“吲哚阳性变形杆菌(Proteus)种”这一术语以前包括雷氏变形杆菌(Proteus rettgeri)和摩氏变形杆菌(Proteus morganii)(后分别更名为雷氏普罗威登斯菌(Providencia rettgeri)和摩氏摩根菌(Morganella morganii))158,这使得在表示具有中度AmpC产生风险的微生物的助记符中包含“吲哚阳性变形杆菌(Proteus)种”不再准确。
在抗生素治疗期间,临床相关的ampC表达的出现最常见于阴沟肠杆菌复合体(为简便起见,本文中简称阴沟肠杆菌)、产气克雷伯菌(原名产气肠杆菌)和弗氏柠檬酸杆菌。临床报告表明,在接触头孢曲松等药物后,由这些微生物引起的感染中,约20%可能会出现耐药性150,159-163。这些临床观察结果与体外突变率分析相符,后者也表明这些微生物可能会过度表达ampC164。因此,当在临床培养物中(非复杂性膀胱炎的尿培养除外)分离出阴沟肠杆菌、产气克雷伯菌或弗氏柠檬酸杆菌时,专家小组建议通常避免使用头孢曲松、头孢噻肟或头孢他啶进行治疗,即使分离株最初检测对这些药物敏感(问题2.2)。即使AmpC的产生未被上调,这些微生物中AmpCβ-内酰胺酶的基础产量也会导致其对氨苄西林、阿莫西林-克拉维酸、氨苄西林-舒巴坦以及第一和第二代头孢菌素具有固有耐药性16。
相比之下,历来被认为具有中度风险产生临床意义上ampC表达的其他微生物,如粘质沙雷菌、摩氏摩根菌和普罗威登斯菌属,根据体外分析164,165和临床报告150,159,166,其过度表达ampC的可能性显著较低。现有数据表明,在这些微生物中,产生具有临床意义的AmpC的比例不到5%。当从临床培养物中分离出粘质沙雷菌、摩氏摩根菌或普罗威登斯菌属时,专家组建议根据药敏试验结果选择抗生素治疗。AmpCβ-内酰胺酶的基础表达使这些微生物对氨苄西林、阿莫西林-克拉维酸以及第一、二代头孢菌素具有固有耐药性16。
一些不太常见的临床病原体(例如,蜂房哈夫尼亚菌、杨氏柠檬酸杆菌、小肠结肠炎耶尔森菌)携带可诱导的染色体ampC基因,但其尚未经过深入研究164,167-169。因此,关于它们产生具有临床意义的AmpC的潜力的描述非常有限。如果在临床培养中发现这些病原体,使用抗菌药物敏感性试验(AST)结果来指导治疗决策是合理的(例如,如果对头孢曲松敏感,则使用头孢曲松)。当治疗由这些不太常见的病原体(或由粘质沙雷菌、摩根摩根菌或普罗威登斯菌属)引起的、细菌负荷高且感染源控制有限的感染(例如,心内膜炎、中枢神经系统感染)时,另一种合理的做法是考虑使用头孢吡肟而非头孢曲松,即使该病原体检测对头孢曲松敏感。与所有感染一样,如果在开始适当剂量的抗生素治疗并采取必要的感染源控制措施后,未观察到充分的临床反应,临床医生应考虑最初处方药物出现耐药性的可能性。
问题2.2:对于因诱导型ampC基因而具有临床显著AmpC产生中等风险的微生物引起的感染,在选择抗生素时应考虑哪些特征?
建议方法:几种β-内酰胺类抗生素具有诱导ampC基因的中等风险。诱导ampC基因的能力以及药物对AmpC水解作用的相对稳定性,都应作为抗生素选择的参考依据。
理由
β-内酰胺类抗生素在诱导ampC基因方面的潜力各有不同。氨基青霉素(即阿莫西林、氨苄西林)、窄谱(即第一代)头孢菌素和头孢霉素是强效的ampC诱导剂170,171。然而,无论是处于低风险(如粘质沙雷菌)还是中等风险(如阴沟肠杆菌)的菌株,即使在ampC基因基础表达水平下,也会水解这些抗生素,从而产生具有临床意义的ampC诱导作用。因此,此类产AmpC酶(AmpC-E)的分离株通常对这些药物表现出耐药性,或者由于其固有的耐药性而不建议进行药敏测试,这在一定程度上避免了治疗困境。亚胺培南也是一种强效的ampC诱导剂,但由于其能形成稳定的酰基酶复合物,通常不易被AmpC酶水解170。厄他培南和美罗培南的诱导潜力尚未经过正式研究,但与亚胺培南类似,它们通常也不易被AmpC酶水解172,173。头孢曲松、头孢噻肟、头孢他啶、哌拉西林-他唑巴坦和氨曲南是相对较弱的ampC诱导剂171,174。现有证据表明,尽管这些药物诱导ampC基因的能力有限,但由于它们易被水解,因此对于治疗由具有中等风险、可产生具有临床意义的AmpC酶的菌株引起的感染,效果往往不佳173,175-177。不过,对于产具有临床意义的AmpC酶风险较低的肠杆菌科细菌(如粘质沙雷菌),这些药物仍是合理的治疗选择。
头孢吡肟的优势在于,它既是ampC的弱诱导剂,又能通过形成稳定的酰基酶复合物抵抗AmpCβ-内酰胺酶的水解作用178,179。因此,头孢吡肟通常是治疗AmpC-E感染的有效药物180。复方新诺明(TMP-SMX)、氟喹诺酮类、氨基糖苷类、四环素类以及其他非β-内酰胺类抗生素不会诱导ampC,也不是AmpC水解的底物。
问题2.3:对于因诱导型ampC基因而具有临床显著AmpC产生中等风险的肠杆菌科细菌引起的感染,头孢吡肟的作用是什么?
建议方案:对于由具有中等产AmpC酶风险的微生物(即阴沟肠杆菌复合体、产气克雷伯菌和弗氏柠檬酸杆菌)引起的感染,建议使用头孢吡肟进行治疗。
理由
头孢吡肟是一种肟基头孢菌素,对AmpC酶相对稳定,且诱导ampC的潜力较低178,179,181,182。目前尚无比较头孢吡肟与碳青霉烯类药物治疗AmpC酶产生菌(AmpC-E)感染患者临床结局的临床试验。然而,多项观察性研究表明,头孢吡肟的临床结局与碳青霉烯类药物治疗相似163,183,184,185,186。此外,一项包含7项研究的荟萃分析比较了头孢吡肟与碳青霉烯类药物治疗肠杆菌属(Enterobacter spp.)、柠檬酸杆菌属(Citrobacter spp.)和沙雷菌属(Serratia spp.)血流感染患者的临床结局,发现这些治疗方案的临床结局无差异180。不过,研究之间存在显著的异质性,病情较重的患者更可能接受碳青霉烯类药物治疗,且不同纳入菌种产生具有临床意义的AmpC酶的风险也有所不同。鉴于头孢吡肟作为一种化合物的优势,以及文献中在治疗AmpC-E感染时未出现明确的临床失败信号,专家组建议头孢吡肟作为阴沟肠杆菌(E. cloacae)、产气克雷伯菌(K. aerogenes)和弗氏柠檬酸杆菌(C. freundii)感染的首选治疗方案(表1)。
虽然头孢吡肟可能对AmpC酶产生菌(AmpC-E)感染有效,但对于超广谱β-内酰胺酶产生菌(ESBL-E)引起的感染,其疗效仍不理想。如果肠杆菌科细菌可能产生这两种酶,这一点就需要加以考虑(问题1.5)。中国台湾的一项研究显示,在头孢吡肟最低抑菌浓度(MIC)为4-8μg/mL(即剂量依赖性敏感)的阴沟肠杆菌(E. cloacae)分离株中,89%为产超广谱β-内酰胺酶(ESBL)菌株111。该研究还对217例阴沟肠杆菌(E. cloacae)血流感染患者进行了评估,结果发现,10例感染由头孢吡肟MIC为4-8μg/mL的产ESBL菌株引起且接受头孢吡肟治疗的患者,均在30天内死亡。相比之下,6例感染由头孢吡肟MIC为4-8μg/mL的非产ESBL菌株引起且接受头孢吡肟治疗的患者,在30天内均未死亡111。
在美国,对于具有临床显著AmpC产生中等风险的肠杆菌目细菌,其超广谱β-内酰胺酶(ESBL)产生频率的数据尚不完整。2019-2020年对美国66家医院的211株连续分离的阴沟肠杆菌进行的评估显示,3%的菌株携带blaCTX-M基因8。匹兹堡的一项研究发现,2003-2005年收集的45株阴沟肠杆菌血流分离株中,有15株(33%)产生SHV型ESBLs187。ESBL的产生与头孢吡肟的最低抑菌浓度(MIC)之间没有关联。巴尔的摩的一项研究发现,2018-2021年收集的血流分离株中,22%的产气克雷伯菌(4/18)、14%的阴沟肠杆菌(7/51)携带ESBL基因,而弗氏柠檬酸杆菌中未发现(0/8 [0%])188。ESBL基因的存在与头孢吡肟MIC之间没有相关性;所有产ESBL的分离株的头孢吡肟MIC均未达到4-8 µg/mL188。
需要美国特有的当代数据,以更好地了解在具有临床显著AmpC产生中等风险的肠杆菌科细菌中,超广谱β-内酰胺酶(ESBLs)的产生频率。现有数据并未表明头孢吡肟敏感剂量依赖性最低抑菌浓度(即最低抑菌浓度为4-8μg/mL)与ESBL产生之间存在明确关联16。头孢吡肟敏感剂量依赖性最低抑菌浓度基于每8小时2克的头孢吡肟剂量,持续3小时输注,该给药策略建议用于治疗头孢吡肟最低抑菌浓度在此范围内的肠杆菌科感染186(表2)。
问题2.4:对于因诱导型ampC基因而具有临床显著AmpC产生中等风险的肠杆菌科细菌引起的感染,头孢曲松的作用是什么?
建议方案:对于由具有临床显著AmpC酶产生中等风险的微生物(例如,阴沟肠杆菌复合体、产气克雷伯菌和弗氏柠檬酸杆菌)引起的侵袭性感染,不建议使用头孢曲松(或头孢噻肟或头孢他啶)进行治疗。当这些微生物对头孢曲松敏感时,头孢曲松可用于治疗由其引起的非复杂性膀胱炎。
理由
关于在治疗具有临床显著ampC诱导中等风险的肠杆菌科细菌感染期间,头孢曲松耐药性出现的频率,临床报告存在差异。在解读试图解决这一问题的研究时,存在若干挑战。首先,临床分离株中AmpC的检测尚无CLSI认可的方法,这使得对其产生量的量化变得困难。其次,这些微生物可能因其他原因(如产生ESBL)而对头孢曲松表现出耐药性;然而,在临床研究中,除了大肠杆菌(E. coli)、肺炎克雷伯菌(K. pneumoniae)、产酸克雷伯菌(K. oxytoca)和奇异变形杆菌(P. mirabilis)外,对其他微生物的此类机制很少进行研究。第三,研究常常将AmpC大量产生低风险微生物(如粘质沙雷菌(S. marcescens)、摩根摩根菌(M. morgannii))与高风险微生物(如阴沟肠杆菌(E. cloacae)、弗氏柠檬酸杆菌(C. freundii))的评估结果合并,这模糊了对具有临床显著AmpC产生中等风险的微生物中头孢曲松耐药性出现频率的理解189。第四,评估头孢曲松暴露后表现出头孢曲松不敏感性的分离株比例的研究,并未包括对初始分离株和后续分离株遗传相关性的确认。此外,许多AmpC临床研究使用的是2010年前的CLSI头孢曲松折点(即头孢曲松MIC≤8µg/mL),这使得将流行率估计值转换为当前CLSI头孢曲松敏感性折点(≤1µg/mL)变得困难16,189。最后,除了选择偏倚外,各研究在感染源、疾病严重程度、既往疾病状况、其他抗生素的联合使用以及头孢曲松的剂量和疗程方面存在显著异质性,这使临床数据的解读变得复杂。
尽管存在这些局限性,但现有数据表明,在接触头孢曲松后,由阴沟肠杆菌(E. cloacae)、产气克雷伯菌(K. aerogenes)或弗氏柠檬酸杆菌(C. freundii )引起的感染中,约20%会出现耐药性150,159-163,190-192。针对疑似产AmpC酶感染管理的比较效果研究,大多聚焦于头孢曲松耐药性的出现,而非临床结局。目前尚无临床试验比较使用头孢曲松与其他替代药物(如头孢吡肟)治疗疑似产AmpC酶肠杆菌感染患者的结局。多项观察性研究比较了使用头孢曲松与其他β-内酰胺类药物治疗由阴沟肠杆菌(E. cloacae)、产气克雷伯菌(K. aerogenes)和弗氏柠檬酸杆菌(C. freundii )引起的感染患者的临床结局160,190,191,193-197。在比较使用头孢曲松与碳青霉烯类药物治疗的患者时,这些研究大多未发现临床结局存在差异,但存在上述局限性。
然而,现有数据表明,当头孢曲松(或其他第三代头孢菌素)用于治疗由具有中等AmpC酶产生风险的微生物(即由阴沟肠杆菌、产气克雷伯菌、弗氏柠檬酸杆菌引起的感染)所致感染时,存在耐药性出现的合理风险,因此专家组建议在治疗由这些微生物引起的感染时,通常应避免使用第三代头孢菌素。基于非复杂性膀胱炎的轻微特性以及头孢曲松在尿液中的充分排泄,头孢曲松可能足以治疗AmpC酶阳性菌引起的非复杂性膀胱炎。对于其他相对非复杂性的感染,在临床症状明显改善后,且不存在持续的感染源(如脓肿、留置导管)的情况下,可考虑转为使用头孢曲松,此时需权衡每日一次头孢曲松给药的便利性与耐药性出现风险可能增加的问题。
问题2.5:对于因诱导型ampC基因而具有临床显著AmpC产生中度风险的肠杆菌科细菌引起的感染,哌拉西林-他唑巴坦的治疗作用是什么?
建议方案:对于由具有临床显著诱导型AmpC酶产生中等风险的肠杆菌目引起的侵袭性感染,不建议使用哌拉西林-他唑巴坦进行治疗。
理由
与阿维巴坦、瑞来巴坦和瓦博巴坦等较新的β-内酰胺酶抑制剂相比,他唑巴坦在保护β-内酰胺类药物免受AmpC水解方面的效果较差149,173,174,198。哌拉西林-他唑巴坦在治疗具有临床显著AmpC产生中度风险的肠杆菌目细菌感染中的作用仍不明确。2019年的一项荟萃分析总结了八项观察性研究的结果,发现在治疗由肠杆菌属、柠檬酸杆菌属或沙雷菌属引起的菌血症时,使用哌拉西林-他唑巴坦与碳青霉烯类药物的患者在死亡率上没有差异189。然而,研究间存在显著的异质性,且可能存在因适应症导致的混淆(即病情较重的患者更可能被开具碳青霉烯类药物)。在该荟萃分析纳入的两项观察性研究中,接受哌拉西林-他唑巴坦治疗的患者30天死亡率在数值上高于接受碳青霉烯类药物治疗的患者(分别为15% [41例患者中6例] 对7% [41例患者中3例]199,以及45% [22例患者中10例] 对11% [45例患者中5例])194。至少另有两项分别包含103例和81例已知携带染色体ampC基因的肠杆菌目细菌引起血流感染的患者的观察性研究表明,与头孢吡肟或碳青霉烯类药物治疗相比,接受哌拉西林-他唑巴坦治疗的患者临床结局显著更差192,200。
一项开放性试点临床试验比较了72例由肠杆菌属、产气克雷伯菌、弗氏柠檬酸杆菌、摩氏摩根菌、普罗威登斯菌属或粘质沙雷菌引起的血流感染患者的结局,这些患者被随机分配接受哌拉西林-他唑巴坦(4.5克静脉注射,每6小时一次,标准输注)或美罗培南(1克静脉注射,每8小时一次,标准输注)治疗201。两组在主要结局(包括30天死亡率、临床失败、微生物学失败或微生物学复发的复合结局)方面无显著差异。然而,在该复合结局的各个组成部分中观察到一些值得注意且看似矛盾的结果:哌拉西林-他唑巴坦组和美罗培南组的死亡率分别为0%和6%(p=0.13);临床失败率分别为21%和12%(p=0.29);微生物学失败率分别为13%和0%(p=0.03);微生物学复发率分别为0%和9%(p=0.06)。该试验的结果难以解释,需要更大规模的试验来更明确地确定哌拉西林-他唑巴坦在治疗具有临床显著ampC诱导中等风险的微生物时的作用。
鉴于他唑巴坦在体外保护哌拉西林免受AmpC水解的能力有限,且至少有四项观察性研究表明,接受哌拉西林-他唑巴坦治疗的患者临床结局较差191,194,199,200,专家组建议不要为AmpC酶介导的严重感染开具哌拉西林-他唑巴坦处方。
哌拉西林-他唑巴坦可能是治疗轻度感染(如非复杂性膀胱炎)的合理选择,不过通常更倾向于使用窄谱药物。对于其他相对非复杂性感染,在考虑到哌拉西林-他唑巴坦治疗可能增加治疗失败风险后,若患者对首选药物出现不良反应(例如,与头孢吡肟相关的神经毒性)或存在其他患者特异性因素(例如,混合感染),转为使用哌拉西林-他唑巴坦可能是合理的。只有在患者临床症状已得到改善,且不存在持续感染源(如脓肿、留置导管)相关担忧的情况下,才建议采用这种做法。
问题2.6:对于因诱导型ampC基因而具有临床显著AmpC产生中度风险的肠杆菌科细菌引起的感染,新型β-内酰胺-β-内酰胺酶抑制剂复方制剂和头孢地尔的作用是什么?
建议方案:专家小组建议,头孢他啶-阿维巴坦、美罗培南-伐博巴坦、亚胺培南-西司他丁-雷利巴坦和头孢地尔应优先保留用于治疗由表现出碳青霉烯耐药性的微生物引起的感染。专家小组不建议将头孢洛扎-他唑巴坦用作AmpC酶感染的治疗选择。
理由
头孢他啶-阿维巴坦、美罗培南-伐博巴坦和亚胺培南-西司他丁-雷利巴坦通常对AmpC酶产生的肠杆菌科细菌(AmpC-E)表现出体外活性130,202-204。头孢他啶-阿维巴坦可能有效治疗由AmpC-E引起的感染205。尽管其发生频率尚不明确,但已有研究描述AmpC-E对头孢他啶-阿维巴坦耐药性的出现,这通常是由于AmpC酶的ω环区域发生氨基酸改变所致206-208。碳青霉烯类药物通常不易被AmpC-E水解;由此推断,美罗培南-伐博巴坦和亚胺培南-西司他丁-雷利巴坦有望成为治疗AmpC-E感染的有效选择。
头孢地尔在体外对AmpC酶(AmpC-E)具有活性129,209,且在临床实践中可能有效,不过一些病例报告显示AmpC-E有可能对该药物产生耐药性206,207。尽管头孢他啶-阿维巴坦、美罗培南-伐博巴坦、亚胺培南-西司他丁-瑞来巴坦和头孢地尔可能对AmpC-E感染有效,但专家小组建议,这些药物应优先保留用于治疗碳青霉烯类耐药菌引起的感染,因为在这类感染中对它们的需求更大。
与早期头孢菌素相比,头孢洛扎的研发旨在提高对假单胞菌产生的AmpC头孢菌素酶水解作用的抵抗力;然而,关于头孢洛扎-他唑巴坦对AmpC酶产生菌(AmpC-E)的活性,人们了解较少。与阿维巴坦、瑞来巴坦和法硼巴坦等新型β-内酰胺酶抑制剂相比,他唑巴坦在保护β-内酰胺类药物免受AmpC酶水解方面的效果较差149,173,174,198。虽然一些体外数据表明头孢洛扎-他唑巴坦对AmpC-E有活性210,但至少有一项研究显示,该药物对19%的产中等水平AmpC酶的阴沟肠杆菌分离株有活性211。头孢洛扎-他唑巴坦治疗AmpC-E感染的临床结局数据有限;目前正在进行一项评估该问题的临床试验212。基于有限的现有数据,专家小组不建议将头孢洛扎-他唑巴坦用作AmpC-E感染的治疗选择。
在分离出DTR铜绿假单胞菌和AmpC酶的混合微生物感染中,在权衡这种方法的利弊后,可以考虑使用头孢洛扎-他唑巴坦,以减少对多种药物的暴露及其相关毒性。然而,如果采用这种方法,建议密切监测患者的临床反应是否恰当。
问题2.7:对于因诱导型ampC基因而具有临床显著AmpC酶产生中等风险的肠杆菌科细菌引起的感染,非β-内酰胺类疗法的作用是什么?
建议方案:呋喃妥因和复方新诺明是治疗由AmpC酶产生菌引起的非复杂性膀胱炎的首选药物。环丙沙星、左氧氟沙星或氨基糖苷类药物(单剂量)是治疗由AmpC酶产生菌引起的非复杂性膀胱炎的替代方案。复方新诺明、环丙沙星或左氧氟沙星是治疗由AmpC酶产生菌引起的肾盂肾炎或复杂性尿路感染的首选药物。
当因耐药性或毒性而无法使用复方新诺明(TMP-SMX)或氟喹诺酮类药物时,氨基糖苷类药物可作为肾盂肾炎或复杂性尿路感染(cUTI)的替代选择。对于泌尿道外的AmpC酶(AmpC-E)感染,若显示敏感,应考虑从头孢吡肟转为口服复方新诺明、环丙沙星或左氧氟沙星。
理由
AmpC酶阳性(AmpC-E)非复杂性膀胱炎的首选治疗方案包括呋喃妥因19或复方磺胺甲噁唑42,213。如问题1.1所述,环丙沙星、左氧氟沙星或单剂量静脉注射氨基糖苷类药物是AmpC-E非复杂性膀胱炎的替代治疗方案。
如问题1.2所述,复方磺胺甲噁唑(TMP-SMX)、环丙沙星或左氧氟沙星是治疗由AmpC酶产生菌(AmpC-E)引起的肾盂肾炎或复杂性尿路感染(cUTIs)的首选治疗方案。当复方磺胺甲噁唑或氟喹诺酮类药物因耐药性或毒性而无法使用时,头孢吡肟是治疗肾盂肾炎或复杂性尿路感染的首选药物。如问题1.2所讨论的,氨基糖苷类药物是治疗AmpC酶产生菌引起的肾盂肾炎或复杂性尿路感染的替代选择。
甲氧苄啶-磺胺甲噁唑(TMP-SMX)或氟喹诺酮类药物在治疗泌尿道外AmpC酶产生菌(AmpC-E)感染中的作用尚未在临床试验中得到正式评估。然而,TMP-SMX和氟喹诺酮类药物均不是AmpC水解的底物。研究表明,在达到适当的临床里程碑后,转为口服TMP-SMX或氟喹诺酮类药物对肠杆菌科血流感染(包括由AmpC-E引起的感染)是有效的73,74。如果符合问题1.3中描述的条件,这些药物是AmpC-E感染患者的合理治疗选择。
第3节:耐碳青霉烯类肠杆菌科细菌
CRE被定义为肠杆菌目成员中对至少一种碳青霉烯类抗生素(即厄他培南、美罗培南、亚胺培南、多利培南)耐药或产生碳青霉烯酶的菌株214。对于本身对亚胺培南敏感性较低的细菌(如变形杆菌属、摩根菌属物种、普罗威登斯菌属物种),则要求其对除亚胺培南外的至少一种碳青霉烯类抗生素耐药214。
CRE是一组异质性病原体,包含多种耐药机制,大致分为不产碳青霉烯酶的菌株和产碳青霉烯酶的菌株。不产碳青霉烯酶的CRE可能是由于非碳青霉烯酶β-内酰胺酶基因(如超广谱β-内酰胺酶基因)扩增,同时伴随外膜孔蛋白破坏所致215。在美国,产碳青霉烯酶的分离株占CRE病例的35%-83%,当将CRE的定义限定为对美罗培南或亚胺培南耐药时,这一比例更高216-218。
在美国,最常见的碳青霉烯酶是肺炎克雷伯菌碳青霉烯酶(KPCs),其并不局限于肺炎克雷伯菌分离株。其他碳青霉烯酶包括新德里金属β-内酰胺酶(NDMs)、维罗纳整合子编码金属β-内酰胺酶(VIMs)、亚胺培南水解金属β-内酰胺酶(IMPs)和苯唑西林酶(如OXA-48型)218-220。NDM、VIM和IMP碳青霉烯酶统称为金属β-内酰胺酶(MBLs)221。
美国疾病控制与预防中心(CDC)对2017至2019年间收集的42,000多株CRE分离株进行了特征分析,发现美国约35%的CRE临床或监测分离株携带五种主要碳青霉烯酶基因中的一种216。在这些产碳青霉烯酶的分离株中,按碳青霉烯酶基因家族划分的具体流行情况如下:blaKPC(86%)、blaNDM(9%)、blaVIM(<1%)、blaIMP(1%)或blaOXA-48样(4%)216。近期一项研究纳入了2019至2021年间来自美国各地的261株连续临床CRE分离株(定义为对美罗培南或亚胺培南耐药),结果发现83%的分离株产碳青霉烯酶(blaKPC [80%]、blaNDM [15%]、blaIMP [5%]、blaOXA-48样 [7%]);2019至2021年间,blaKPC的比例从74%降至57%,而携带MBL基因(如blaNDM、blaVIM、blaIMP)的分离株比例从4%升至20%,携带blaOXA-48样基因的分离株比例从1%升至8%218。
当在临床分离株中发现CRE时,了解其产生的碳青霉烯酶对于指导治疗决策非常重要,因为特定的新型β-内酰胺类抗生素对特定的碳青霉烯酶具有活性。诸如改良碳青霉烯灭活试验等表型试验可区分产碳青霉烯酶和非产碳青霉烯酶的CRE,但通常无法提供关于存在的特定碳青霉烯酶的信息16,222。鉴于碳青霉烯酶的流行病学不断演变,这一信息变得越来越重要。强烈建议临床微生物实验室采用核酸检测或抗原检测,以确定临床CRE分离株所产生的特定碳青霉烯酶的存在情况。以下列出的CRE感染治疗建议均假设已证实首选和替代抗生素的体外活性。
问题3.1:治疗由CRE引起的非复杂性膀胱炎,首选抗生素是什么?
建议方案:呋喃妥因、复方磺胺甲噁唑(TMP-SMX)、环丙沙星或左氧氟沙星是治疗CRE引起的非复杂性膀胱炎的首选药物,尽管这些药物对CRE的敏感性可能较低。氨基糖苷类(单剂量)、口服磷霉素(仅适用于大肠杆菌)、粘菌素、头孢他啶-阿维巴坦、美罗培南-瓦博巴坦、亚胺培南-西司他丁-瑞来巴坦或头孢地尔可作为治疗CRE引起的非复杂性膀胱炎的替代方案。
理由
目前尚无评估治疗非复杂性CRE膀胱炎首选药物疗效的临床试验数据。然而,由于呋喃妥因、复方新诺明(TMP-SMX)、环丙沙星或左氧氟沙星在尿液中均能达到较高浓度,因此若分离出的菌株对这些药物敏感,预计它们对非复杂性CRE膀胱炎会有疗效5,19,20,22,23。
单剂量氨基糖苷类药物是治疗非复杂性CRE膀胱炎的替代选择,原因如问题1.1所述。总体而言,与其他氨基糖苷类药物相比,更高比例的CRE临床分离株对普拉佐米星敏感46。口服磷霉素是仅用于治疗由大肠杆菌引起的非复杂性膀胱炎的替代治疗选择,包括对碳青霉烯类耐药的菌株,如问题1.119中所讨论的。
黏菌素(市售肠外非活性前药黏菌素甲磺酸钠的活性形式)是治疗非复杂性CRE膀胱炎的替代药物。黏菌素在泌尿道中会转化为其活性形式223。临床医生应意识到相关的肾毒性风险。多粘菌素B不应被用作非复杂性CRE膀胱炎的治疗药物,因为与氨基糖苷类药物相比,其主要通过非肾脏途径清除,且成功率较低224,225。头孢他啶-阿维巴坦、美罗培南-瓦博巴坦、亚胺培南-西司他丁-雷利巴坦和头孢地尔是治疗非复杂性CRE膀胱炎的替代选择131,226-230。
问题3.2:治疗由CRE引起的肾盂肾炎或复杂性尿路感染(cUTI)的首选抗生素是什么?
建议方案:如果产碳青霉烯酶肠杆菌(CRE)对复方磺胺甲噁唑(TMP-SMX)、环丙沙星或左氧氟沙星敏感,那么这些药物是治疗CRE引起的肾盂肾炎或复杂性尿路感染(cUTI)的首选方案。头孢他啶-阿维巴坦、美罗培南-伐博巴坦、亚胺培南-西司他丁-雷利巴坦和头孢地尔也属于肾盂肾炎或复杂性尿路感染的首选治疗药物。氨基糖苷类药物可作为治疗CRE引起的肾盂肾炎或复杂性尿路感染的替代方案。
理由
尽管预计少数CRE仍对复方新诺明、环丙沙星或左氧氟沙星敏感,但如果证实敏感,这些药物都是治疗CRE肾盂肾炎或复杂性尿路感染的首选药物40-42。基于临床试验显示,头孢他啶-阿维巴坦、美罗培南-伐博巴坦、亚胺培南-西司他丁-瑞来巴坦和头孢地尔在治疗CRE引起的肾盂肾炎和复杂性尿路感染方面不劣于常见的尿路感染对照药物,因此它们是此类感染的首选治疗方案131,226-230。这些试验中纳入的分离株绝大多数对碳青霉烯类药物敏感。
如问题1.2所述,氨基糖苷类药物被建议作为治疗CRE肾盂肾炎或复杂性尿路感染的替代药物45,47,48,231。
鉴于磷霉素在肾实质中的浓度有限,不建议将其用于肾盂肾炎或复杂性尿路感染(cUTI)的治疗。需要更多数据来评估口服磷霉素在肾盂肾炎或复杂性尿路感染患者中的作用,特别是在采用多剂量方案给药以及在首选治疗数天后使用的情况,如问题1.2中进一步描述的那样。值得注意的是,在问题1.2中描述的两项临床试验中,均无患者存在CRE感染33,51。
问题3.3:对于由非产碳青霉烯酶的CRE引起的尿路外感染,首选的抗生素是什么?
建议方案:对于由不产碳青霉烯酶且对美罗培南和亚胺培南敏感(即最低抑菌浓度≤1μg/mL)但对厄他培南不敏感(即最低抑菌浓度≥1μg/mL)的肠杆菌科分离株引起的感染,建议使用延长输注美罗培南(或亚胺培南-西司他丁)。对于由不产碳青霉烯酶且对任何碳青霉烯类药物均不敏感的肠杆菌科分离株引起的感染,头孢他啶-阿维巴坦、美罗培南-法硼巴坦和亚胺培南-西司他丁-瑞来巴坦是首选治疗方案。
理由
对于由不产碳青霉烯酶的肠杆菌科分离株引起的感染,这些分离株对美罗培南和亚胺培南敏感(即最低抑菌浓度≤1μg/mL),但对厄他培南不敏感(即最低抑菌浓度≥1μg/mL),建议采用延长输注美罗培南(或亚胺培南-西司他丁)的方案(表1)。对提交给美国疾病控制与预防中心(CDC)的耐碳青霉烯肠杆菌科(CRE)分离株进行的评估显示,在1249株对厄他培南耐药但对美罗培南和亚胺培南敏感的分离株中,仅有不到3%携带碳青霉烯酶基因232。对于非复杂性膀胱炎,采用标准输注美罗培南或亚胺培南-西司他丁可能是合理的(表1)。
对于那些不产碳青霉烯酶、对美罗培南敏感但对亚胺培南不敏感(反之亦然)的分离株,在缺乏指导最佳治疗方案的数据的情况下,专家小组建议根据患者的病情严重程度和感染部位来制定治疗决策。例如,在这种情况下,美罗培南可能是治疗尿路感染的合理选择,但不适用于复杂的腹腔内感染。专家小组不建议使用美罗培南-瓦博巴坦或亚胺培南-西司他丁-雷利巴坦来治疗厄他培南耐药、美罗培南敏感且亚胺培南敏感的感染,因为与单纯延长输注美罗培南或亚胺培南-西司他丁相比,这些药物不太可能带来任何实质性益处。
以前,对于由美罗培南最低抑菌浓度(MIC)高达8-16 µg/mL的CRE分离株引起的感染,标准治疗方案是采用美罗培南延长输注联合第二种药物(通常是多粘菌素或氨基糖苷类)233。药代动力学/药效学(PK/PD)数据表明,美罗培南延长输注可能会达到足够的药物浓度,以治疗碳青霉烯类MIC在此范围内的病原体引起的感染234-236。然而,后续的观察性研究和试验数据显示,与较新的β-内酰胺-β-内酰胺酶抑制剂类药物相比,基于多粘菌素或氨基糖苷类的方案在治疗CRE感染时,会增加死亡率和额外的肾毒性237-251。因此,专家组建议,当未证实病原体对美罗培南或亚胺培南敏感时,不建议使用碳青霉烯类延长输注(无论是否加用第二种药物)来治疗CRE感染252,253。有理由认为,即使在没有碳青霉烯酶的分离株中,由于可能过度产生其他β-内酰胺酶(如超广谱β-内酰胺酶(ESBLs)),添加瓦博巴坦或瑞来巴坦可能会降低美罗培南或亚胺培南的MIC253。
替加环素或厄他培南是治疗不涉及血流或泌尿道的CRE感染的替代选择(问题3.8)。它们的活性与碳青霉烯酶的存在或类型无关。
问题3.4:如果存在KPC产生,治疗由CRE引起的泌尿道外感染的首选抗生素是什么?
建议方案:美罗培南-瓦博巴坦、头孢他啶-阿维巴坦以及亚胺培南-西司他丁-瑞来巴坦是产KPC肠杆菌科细菌感染的首选治疗方案。头孢地尔是备选方案。
理由
治疗产KPC感染的首选药物包括美罗培南-瓦博巴坦、头孢他啶-阿维巴坦或亚胺培南-西司他丁-雷利巴坦。在美国,这三种药物对产KPC的肠杆菌目细菌的活性似乎均超过95%254。尽管这三种药物都是治疗产KPC感染的首选药物,但根据现有的临床结局数据(即亚胺培南-西司他丁-雷利巴坦的临床数据最少)和耐药性出现的可能性(即头孢他啶-阿维巴坦出现耐药性的可能性最高),专家组略微倾向于美罗培南-瓦博巴坦,其次是头孢他啶-阿维巴坦,然后是亚胺培南-西司他丁-雷利巴坦255。与以前用于治疗产KPC感染的方案(通常以多粘菌素或氨基糖苷类为基础)相比,这些药物能改善临床结局并降低毒性237-246,249-251,256。目前尚无比较这些药物(即美罗培南-瓦博巴坦与头孢他啶-阿维巴坦)治疗产KPC感染的临床试验。
一项观察性研究比较了接受美罗培南-瓦博巴坦或头孢他啶-阿维巴坦治疗至少72小时的CRE感染患者的临床结局²⁵⁷。碳青霉烯酶状态在很大程度上未被报告。26名接受美罗培南-瓦博巴坦治疗的患者和105名接受头孢他啶-阿维巴坦治疗的患者中,临床治愈率和30天死亡率(仅限于分离株对所使用药物敏感的患者)分别为85%和61%,以及12%和19%。尽管这些差异无统计学意义,但从数值上看,美罗培南-瓦博巴坦更具优势。在发生CRE感染复发的患者中,接受美罗培南-瓦博巴坦治疗的患者中0%(3人中有0人)、接受头孢他啶-阿维巴坦治疗的患者中20%(15人中有3人)的后续CRE分离株对初始治疗产生耐药性。该研究存在诸多重要局限性:由于其观察性研究的性质可能存在选择偏倚、患者数量相对较少、CRE感染部位各异、超过一半的患者存在混合感染,且超过一半的患者接受了额外的抗生素治疗。尽管存在这些局限性,该研究表明,美罗培南-瓦博巴坦和头孢他啶-阿维巴坦均是产KPC感染的合理治疗选择,不过头孢他啶-阿维巴坦治疗更易出现耐药性(问题3.7)。至少有两个研究小组发表了他们使用头孢他啶-阿维巴坦和美罗培南-瓦博巴坦治疗CRE感染的临床经验,其中KPC是主要的碳青霉烯酶,他们同样发现,与接受头孢他啶-阿维巴坦治疗的患者相比,接受美罗培南-瓦博巴坦治疗的患者临床治愈和存活的可能性略高,且耐药性出现的风险更低²⁵⁸⁻²⁶¹。
关于亚胺培南-西司他丁-雷利巴坦治疗产KPC肠杆菌科细菌感染的临床数据有限。一项临床试验纳入了由对亚胺培南不敏感的革兰氏阴性菌引起感染的患者,将其分为两组,分别接受亚胺培南-西司他丁-雷利巴坦治疗,以及亚胺培南-西司他丁联合黏菌素治疗240。在肠杆菌科细菌感染患者中,接受亚胺培南-西司他丁-雷利巴坦治疗的患者中40%(5例中的2例)获得了良好的临床反应,而接受亚胺培南-西司他丁联合黏菌素治疗的患者中这一比例为100%(2例中的2例)240。由于样本量较小,很难从这些数据中得出有意义的结论。然而,亚胺培南-西司他丁-雷利巴坦在体外对产KPC肠杆菌科细菌的活性262-266、亚胺培南-西司他丁的临床应用经验,以及雷利巴坦作为β-内酰胺酶抑制剂的稳定性267表明,如果病原体检测为敏感,亚胺培南-西司他丁-雷利巴坦可能对产KPC肠杆菌科细菌感染有效。
头孢地尔被建议作为尿外CRE感染的替代治疗选择。头孢地尔是一种合成结合物,由头孢菌素部分和铁载体组成,铁载体可与铁结合,并通过活性铁转运蛋白促进细菌细胞进入268。进入周质空间后,头孢菌素部分与铁分离,主要与PBP3结合,从而抑制细菌细胞壁的合成269。超过95%的产KPC肠杆菌目细菌对头孢地尔敏感270。目前尚无专门评估头孢地尔在产KPC肠杆菌目细菌感染中作用的可靠比较有效性数据。由于临床结局数据有限,且为了将其保留用于治疗产MBL肠杆菌目细菌或非发酵葡萄糖革兰氏阴性菌引起的感染,头孢地尔被建议作为治疗产KPC病原体的替代药物。
替加环素或厄他培南是治疗不涉及血液或泌尿道的产KPC感染的替代选择(问题3.9)。它们的活性与碳青霉烯酶的存在或类型无关。
问题3.5:如果存在NDM或其他MBL产生,治疗由CRE引起的泌尿道外感染时,首选的抗生素是什么?
建议方案:头孢他啶-阿维巴坦联合氨曲南,或头孢地尔单药治疗,是产NDM及其他产MBL肠杆菌科细菌感染的首选治疗方案。
理由
目前尚无美国食品药品监督管理局(FDA)批准的对产MBL肠杆菌目细菌有活性的β-内酰胺/β-内酰胺酶抑制剂,不过有几种前景良好的化合物正处于研发后期或已完成临床试验。针对产NDM肠杆菌目细菌(或其他产MBL的细菌),首选的抗生素方案包括头孢他啶-阿维巴坦联合氨曲南,或头孢地尔单药治疗。NDM可水解青霉素类、头孢菌素类和碳青霉烯类抗生素,但不能水解氨曲南。尽管氨曲南不会被NDM水解,但它可能被产NDM菌株常同时产生的其他丝氨酸β-内酰胺酶(如ESBLs、AmpCs、KPCs或OXA-48样酶)水解。阿维巴坦通常能有效抑制这些其他β-内酰胺酶的活性。根据目前在美国尚未上市的氨曲南-阿维巴坦的预估数据推断,头孢他啶-阿维巴坦与氨曲南联合使用时,对约90%的产MBL肠杆菌目菌株有活性271-276。临床和实验室标准协会(CLSI)已认可使用肉汤纸片洗脱法来评估产MBL肠杆菌目细菌对头孢他啶-阿维巴坦/氨曲南联合用药的敏感性16,277。
2018-2019年期间,一项针对102名由产MBL肠杆菌科细菌(其中82名由产NDM细菌)引起血流感染的成人患者开展的观察性研究,对比了52名接受头孢他啶-阿维巴坦联合氨曲南治疗的患者与50名接受其他药物联合治疗(主要是多粘菌素或替加环素为基础的治疗)的患者的结局278。头孢他啶-阿维巴坦/氨曲南组的30天死亡率为19%,另一组为44%,在倾向评分匹配分析中,前者的死亡风险显著更低。另一项在2019-2022年期间针对产MBL肠杆菌科细菌感染(328例为产NDM细菌感染,58%为血流感染)的观察性研究,纳入了215名接受头孢他啶-阿维巴坦/氨曲南治疗的患者、33名接受头孢地尔治疗的患者以及26名接受含粘菌素方案治疗的患者279。头孢他啶-阿维巴坦/氨曲南组、头孢地尔组和含粘菌素方案组的未调整30天死亡率分别为22%、33%和50%279。与基于粘菌素的方案相比,头孢他啶-阿维巴坦/氨曲南与30天死亡率降低相关。
关于头孢他啶-阿维巴坦与氨曲南联合用药的给药策略,已在表1和 补充材料 280-282中进行了综述。应密切监测患者的肝酶升高情况,在一项1期研究中,约40%的患者出现了这种情况283。在少数情况下,若无法使用头孢地尔或头孢他啶-阿维巴坦与氨曲南的联合疗法(例如,存在过敏或不耐受情况),在确认不存在OXA型碳青霉烯酶的前提下,可考虑采用氨曲南与美罗培南-法硼巴坦或亚胺培南-西司他丁-雷利巴坦的联合疗法284,285。但有关这种疗法的临床研究数据较为有限286。
治疗NDM及其他产MBL肠杆菌科细菌感染的第二个首选方案是头孢地尔。2014-2019年对200株北美和欧洲产MBL肠杆菌科细菌的研究显示,约92%的分离株对头孢地尔敏感287。然而,已有研究描述了产NDM肠杆菌科细菌对头孢地尔的耐药性,无论是否有头孢地尔暴露史,因此应确认其敏感性288-291。一项纳入产MBL肠杆菌科细菌感染患者的临床试验显示,接受头孢地尔治疗的患者临床治愈率为80%(10例中8例),而接受替代疗法(主要是多粘菌素类疗法)的患者临床治愈率为0%(4例中0例)292。两组患者的28天死亡率分别为10%(10例中1例)和75%(4例中3例)292。目前尚无比较头孢他啶-阿维巴坦/氨曲南与头孢地尔的临床试验数据,这两种药物均被视为治疗产MBL肠杆菌科细菌感染的首选药物。
替加环素或厄他培南是治疗不涉及血液或泌尿道的产NDM感染的替代选择(问题3.9)。它们的活性与碳青霉烯酶的存在或类型无关。
问题3.6:如果存在OXA-48样酶的产生,治疗由CRE引起的泌尿道外感染时,首选的抗生素是什么?
建议方案:头孢他啶-阿维巴坦是产OXA-48型肠杆菌科细菌感染的首选治疗药物。头孢地尔是备选治疗药物。
理由
如果某株肠杆菌科临床分离株产生OXA-48型酶,那么首选头孢他啶-阿维巴坦293,头孢地尔可作为替代选择294。超过95%的产OXA-48型酶肠杆菌科分离株对头孢他啶-阿维巴坦和头孢地尔均敏感270,295。美罗培南-瓦博巴坦和亚胺培南-西司他丁-雷利巴坦对产OXA-48型酶分离株的作用有限,因为瓦博巴坦和雷利巴坦不太可能抑制OXA-48型酶,因此不建议使用,即便体外试验显示敏感262,296-298。
目前尚无比较头孢他啶-阿维巴坦与头孢地尔的临床试验数据。
此外,关于使用这两种药物治疗OXA-48样感染患者的临床结局,目前可获得的临床数据有限。一项纳入171例感染产OXA-48样酶肠杆菌科细菌且接受头孢他啶-阿维巴坦治疗(无对照组)的观察性研究发现,22%的患者在30天内死亡299。在一项针对76例产OXA-48样酶肠杆菌科细菌血流感染患者的观察性研究中,接受头孢他啶-阿维巴坦治疗的患者和接受其他治疗(如多粘菌素)的患者在30天内的死亡率分别为12%和26%293。在两项临床试验中,对10例感染OXA-48阳性肠杆菌科细菌且接受头孢地尔治疗的患者进行亚组分析,结果显示所有患者在第28天均存活,其中7例达到临床治愈294。尽管头孢他啶-阿维巴坦和头孢地尔均被认为对产OXA-48样酶的感染有效,但由于头孢地尔的已发表临床数据较少,且为了将其保留用于治疗产MBL的肠杆菌科细菌或非发酵葡萄糖革兰氏阴性菌引起的感染,因此建议将头孢地尔作为替代药物。
替加环素或厄他培南是治疗不涉及血液或泌尿道的产OXA-48样酶感染的替代选择(问题3.8)。它们的活性与碳青霉烯酶的存在或类型无关。
问题3.7:在用于治疗CRE感染时,CRE分离株对新型β-内酰胺类药物产生耐药性的可能性有多大?
建议方案:在所有用于治疗CRE感染的β-内酰胺类药物中,耐药性的出现都是一个值得关注的问题。现有数据表明,头孢他啶-阿维巴坦的耐药性发生频率可能最高。
理由
与任何β-内酰胺类药物一样,使用新型β-内酰胺类药物(即头孢他啶-阿维巴坦、美罗培南-瓦博巴坦、亚胺培南-西司他丁-雷利巴坦或头孢地尔)治疗CRE感染,会增加后续导致感染的分离株无法再用这些药物有效治疗的可能性。关于CRE对新型药物耐药性出现的大部分数据集中在产KPC的分离株上。对头孢他啶-阿维巴坦耐药性的出现最常见的原因是blaKPC基因发生突变,导致KPC碳青霉烯酶的氨基酸改变,并增强了对头孢他啶的水解作用。这些变化可能会恢复对碳青霉烯类药物的敏感性,但这一发现的临床意义尚不明确300-321。外膜通透性和外排系统的改变是对美罗培南-瓦博巴坦260,309,313,322-328和亚胺培南-西司他丁-雷利巴坦329-331耐药性出现的主要驱动因素。blaKPC拷贝数的增加与对所有这些药物的耐药性相关332-334。
已有研究描述了肠杆菌目细菌对头孢地尔的多种耐药机制335,336,包括TonB依赖性铁转运系统的突变288,290,337-340、AmpCβ-内酰胺酶的氨基酸改变206,207以及NDM表达增加341。与对头孢他啶-阿维巴坦敏感的肠杆菌目分离株相比,对头孢他啶-阿维巴坦耐药的分离株中头孢地尔耐药率显著更高(83%对7%)342。不断有报道称,在产NDM的大肠杆菌分离株中,头孢地尔和氨曲南的活性结合位点PBP3出现氨基酸插入316,343-345,导致没有可用的β-内酰胺类治疗方案。此类报道在美国仍较为罕见272,291,346。最后,人们日益认识到,在对头孢他啶-阿维巴坦耐药的产KPC肠杆菌目中存在头孢地尔耐药性,因此如果在这种情况下使用头孢地尔,应始终确认其敏感性(PMID: 34462816)。
临床接触头孢他啶-阿维巴坦和美罗培南-伐博巴坦后,耐药性出现的估计比例分别约为10-20%241,245,261,304和<5%257,260,347。头孢他啶-阿维巴坦的相关数据最为丰富,部分原因是它是首个获得美国食品药品监督管理局(FDA)批准的、对碳青霉烯类耐药肠杆菌科细菌(CRE)有效的新型β-内酰胺类药物。关于CRE对亚胺培南-西司他丁-瑞来巴坦和头孢地尔耐药性出现的频率,现有数据有限。
对于既往感染过碳青霉烯类耐药肠杆菌科细菌(CRE)的患者,若出现类似脓毒症的表现,提示可能为新发感染或复发感染时,建议对新型β-内酰胺类抗生素重复进行药敏试验(AST)。此外,若患者近期接受过头孢他啶-阿维巴坦治疗,且出现类似脓毒症的症状,建议至少在获得培养和药敏试验结果之前,考虑使用另一种新型β-内酰胺类药物,尤其是当既往感染的药敏试验结果显示存在其他有效的β-内酰胺类药物时。例如,若一名产KPC(克雷伯菌肺炎碳青霉烯酶)的血流感染患者在一个月前接受过头孢他啶-阿维巴坦疗程治疗,现因疑似感染症状就医,在获得病原菌和药敏试验结果之前,可考虑使用美罗培南-瓦博巴坦等药物。
问题3.8:四环素衍生物在治疗CRE引起的感染中起什么作用?
建议方案:尽管β-内酰胺类药物仍是治疗CRE感染的首选,但当β-内酰胺类药物无效或患者无法耐受时,替加环素和埃拉环素可作为替代选择。不建议使用四环素衍生物治疗CRE尿路感染或血流感染。
理由
四环素衍生物的作用不依赖于碳青霉烯酶的存在或类型。更具体地说,产碳青霉烯酶(如KPC、NDM、OXA-48样碳青霉烯酶)和不产碳青霉烯酶的CRE都可能对这些药物敏感348-350。四环素衍生物类药物给药后能迅速分布到组织中,导致尿液和血清中的浓度较低351。不建议将四环素衍生物用于治疗尿路感染和血流感染,至少有一项观察性研究表明,在治疗CRE血流感染时,与其他替代药物相比,使用四环素衍生物会增加死亡率352。当采用最佳剂量时,替加环素或依拉环素可被视为腹腔内感染、皮肤和软组织感染、骨髓炎及呼吸道感染的替代治疗选择(表1)。据报道,接受四环素衍生物治疗的患者中,高达20%-40%会出现恶心和呕吐353-355。值得注意的是,CLSI尚未制定替加环素或依拉环素针对肠杆菌科细菌的折点,但FDA已制定相关折点356(表2)。中空纤维模型357和临床结局数据352表明,CRE分离株对替加环素的MIC≥0.5时,治疗结局较差。
与依拉环素相比,替加环素在治疗CRE感染方面有更多已发表的经验358-361。一项对15项临床试验的荟萃分析表明,替加环素单药治疗与用于治疗肺炎(不仅限于肠杆菌科引起的肺炎)的其他方案相比,死亡率更高362。后续研究表明,当开具高剂量替加环素(静脉注射200mg单次给药,随后每12小时静脉注射100mg)时,替加环素与对照药物之间的死亡率差异可能不再明显363-365。因此,如果开具替加环素治疗CRE感染,专家组建议使用高剂量366(表1)。
一些研究中描述的替加环素和厄他环素之间MIC分布差异的临床相关性尚不明确,这是因为这些药物的药代动力学/药效学特征存在差异367-369。在研究厄他环素疗效的临床试验中,纳入的CRE感染患者不到5名358,370,且描述其治疗CRE感染疗效的上市后临床报告也较为有限371。
关于米诺环素治疗CRE感染疗效的临床数据也较少372,373,但有数据表明,对米诺环素敏感的CRE分离株比例低于替加环素或厄他环素350。专家组建议谨慎使用米诺环素治疗CRE感染。评估奥马环素(一种兼具静脉和口服制剂的四环素衍生物)抗CRE活性的数据显示,其效力低于其他四环素衍生物,且药代动力学/药效学特征不佳(问题1.3)374-377。不建议使用奥马环素治疗CRE感染。
问题3.9:多粘菌素在治疗CRE引起的感染中发挥什么作用?
建议方案:不建议使用多粘菌素B和粘菌素治疗碳青霉烯类耐药肠杆菌(CRE)引起的感染。粘菌素可作为非复杂性CRE膀胱炎的替代药物。
理由
观察性和临床数据表明,与对照药物相比,基于多粘菌素的治疗方案会增加死亡率和额外的肾毒性237-245,251。由于对多粘菌素的临床有效性、药代动力学/药效学数据以及多粘菌素敏感性测试准确性的担忧,临床和实验室标准协会(CLSI)取消了粘菌素和多粘菌素B的敏感类别378。专家组建议,在治疗CRE感染时应避免使用这些药物,但粘菌素可作为治疗CRE膀胱炎的替代药物除外。由于多粘菌素B主要通过非肾脏途径清除,因此不应将其用于CRE膀胱炎的治疗224。
问题3.10:联合抗生素治疗在治疗CRE引起的感染中起到什么作用?
建议方案:不建议采用联合抗生素治疗(即使用β-内酰胺类药物联合氨基糖苷类、氟喹诺酮类、四环素类或多粘菌素)来治疗由CRE引起的感染。
理由
尽管经验性联合抗生素治疗增加了为有CRE感染风险的患者使用至少一种有效治疗药物的可能性,但数据表明,一旦β-内酰胺类药物已显示出体外活性,继续联合治疗并不能带来任何额外益处379。相反,持续使用第二种药物会增加抗生素相关不良事件的发生几率379。此外,目前缺乏表明联合治疗能防止耐药性出现的临床数据。
目前尚无比较新型β-内酰胺类药物单药治疗与联合治疗(例如,头孢他啶-阿维巴坦 vs 头孢他啶-阿维巴坦联合妥布霉素)的随机试验数据。现有的有限观察性数据并未发现联合治疗能改善结局250,258,299,380。一项观察性研究比较了165例接受头孢他啶-阿维巴坦治疗的患者和412例接受头孢他啶-阿维巴坦联合第二种药物治疗产KPC感染患者的临床结局258。两组患者的30天死亡率基本相同,均约为25%。
根据现有的疗效数据、临床经验以及与氨基糖苷类、氟喹诺酮类、四环素类和多粘菌素类药物相关的已知毒性,专家组建议,当碳青霉烯类耐药肠杆菌科细菌感染对首选的β-内酰胺类药物敏感时,不采用联合治疗。
第4节:具有难治性耐药性的铜绿假单胞菌
多重耐药(MDR)铜绿假单胞菌的定义是,铜绿假单胞菌对至少三类抗生素中的至少一种不敏感,而这几类抗生素通常被认为对铜绿假单胞菌有效,包括青霉素类、头孢菌素类、氟喹诺酮类、氨基糖苷类和碳青霉烯类<sup>381</sup>。2018年,有人提出了“难治性”耐药的概念<sup>382</sup>。在本指南文件中,难治性耐药(DTR)被定义为铜绿假单胞菌对以下所有药物均不敏感:哌拉西林-他唑巴坦、头孢他啶、头孢吡肟、氨曲南、美罗培南、亚胺培南-西司他丁、环丙沙星和左氧氟沙星。
多重耐药(MDR)铜绿假单胞菌或耐碳青霉烯类(DTR)铜绿假单胞菌的进化通常是多种耐药机制共同作用的结果,包括外膜孔蛋白(如OprD)表达降低、假单胞菌来源的头孢菌素酶(PDC酶,通常称为假单胞菌AmpC酶)产量增加或发生氨基酸取代、外排泵(如MexAB-OprM)上调、青霉素结合蛋白(PBP)靶位突变,以及产超广谱β-内酰胺酶(如blaOXA-10)等383,384。在美国,产碳青霉烯酶是铜绿假单胞菌分离株对碳青霉烯类耐药的一个相对少见的原因385,386,但在世界其他地区的耐碳青霉烯类铜绿假单胞菌中,这一情况占比很高(例如,拉丁美洲为69%,亚洲为57%),这通常是由于存在blaKPC或blaVIM酶所致385,387-392。这些数据表明,未来几年美国产碳青霉烯酶铜绿假单胞菌的 prevalence 将会上升。此外,在美国患者的铜绿假单胞菌分离株中,还偶尔发现其他β-内酰胺酶(如圭亚那超广谱β-内酰胺酶[GES]、越南超广谱β-内酰胺酶[VEB]、假单胞菌扩展耐药[PER]酶、KPCs和NDMs),这些酶可能会使β-内酰胺类药物(包括一些新型β-内酰胺类药物)的最低抑菌浓度(MIC)升高13,385,393。
鉴于在美国的铜绿假单胞菌分离株中,碳青霉烯酶并不常见,因此对多重耐药(DTR)铜绿假单胞菌进行碳青霉烯酶检测,其重要性不及在美国医院中对耐碳青霉烯类肠杆菌科(CRE)临床分离株进行碳青霉烯酶检测。不过,该专家组鼓励所有临床微生物实验室对多重耐药(MDR)和多重耐药(DTR)铜绿假单胞菌分离株,针对较新的β-内酰胺类药物(即头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦和头孢地尔)进行药敏试验(AST)。当药敏试验结果尚未得出时,了解当地多重耐药(DTR)铜绿假单胞菌的药敏试验情况,对于指导经验性抗生素的使用决策至关重要。针对多重耐药(DTR)铜绿假单胞菌感染的治疗建议,是基于已证实的首选和替代抗生素的体外活性。
问题4.1:治疗多重耐药铜绿假单胞菌引起的感染时,首选抗生素是什么?
建议方案:当铜绿假单胞菌分离株对传统非碳青霉烯类β-内酰胺类药物(即哌拉西林-他唑巴坦、头孢他啶、头孢吡肟、氨曲南)和碳青霉烯类药物均敏感时,优先选择前者而非碳青霉烯类药物治疗。对于由对任何碳青霉烯类药物不敏感但对传统β-内酰胺类药物敏感的铜绿假单胞菌分离株引起的感染,建议采用传统药物的高剂量延长输注疗法。对于重症患者或感染源控制不佳的患者,其感染的铜绿假单胞菌分离株对碳青霉烯类药物耐药但对传统β-内酰胺类药物敏感,使用该铜绿假单胞菌分离株经检测敏感的新型β-内酰胺类药物(如头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦)也是合理的治疗方案。
理由
一般来说,当铜绿假单胞菌分离株对传统β-内酰胺类药物(即哌拉西林-他唑巴坦、头孢他啶、头孢吡肟、氨曲南)、氟喹诺酮类药物(即环丙沙星、左氧氟沙星)或碳青霉烯类药物敏感时,专家组更倾向于开具前两类药物,而非碳青霉烯类药物,以保留碳青霉烯类药物的活性,用于未来日益增多的耐药性感染。
对碳青霉烯类药物(如美罗培南或亚胺培南-西司他丁,MIC≥4 µg/mL)不敏感但对其他传统β-内酰胺类药物敏感的铜绿假单胞菌约占耐碳青霉烯类铜绿假单胞菌分离株的20%至60%394-400。这种表型通常是由于OprD的产生缺乏或有限,OprD通常促进碳青霉烯类药物通过铜绿假单胞菌的外膜进入周质空间,但不促进其他β-内酰胺类药物的进入396-399。目前尚无比较效果研究来指导由对碳青霉烯类耐药但对传统非碳青霉烯类β-内酰胺类敏感的铜绿假单胞菌引起的感染的治疗决策。如果分离株对传统非碳青霉烯类β-内酰胺类药物(如头孢吡肟)敏感,专家组的首选方法是给予高剂量延长输注的非碳青霉烯类药物治疗(如头孢吡肟2g静脉注射,每8小时一次,输注时间至少3小时)401,402(表1)。
另一种方法是使用更新型的β-内酰胺类药物(例如,头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦)。这种方法被视为一种替代选择,目的是保留新型β-内酰胺类药物的有效性,以应对未来日益增多的耐药菌感染。然而,对于危重患者或感染源控制不佳的患者,对于对碳青霉烯类耐药但对非碳青霉烯类β-内酰胺类敏感的铜绿假单胞菌感染,使用新型β-内酰胺类药物是合理的考虑。无论使用哪种抗生素,感染铜绿假单胞菌的患者都应受到密切监测,以确保临床症状改善,因为铜绿假单胞菌在接触抗生素治疗时,具有不断表达额外耐药机制的显著能力。例如,一项对767例铜绿假单胞菌菌血症病例的分析发现,30天内对传统β-内酰胺类药物出现耐药性的可能性如下:哌拉西林-他唑巴坦(8%)、头孢他啶(12%)、美罗培南(14%)和亚胺培南(27%)403。建议临床医生对从同一患者获得的后续多重耐药铜绿假单胞菌分离株进行重复药敏试验,以监测耐药性的发展。
问题4.2:在现有的β-内酰胺类药物中,针对DTR 铜绿假单胞菌的活性百分比是否存在差异?
建议方法:铜绿假单胞菌(P. aeruginosa)分离株对新型β-内酰胺类药物的敏感性百分比存在差异,部分原因是耐药性酶机制存在地区差异。
理由
头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-瑞来巴坦和头孢地尔均为β-内酰胺类抗生素,可能对多重耐药(DTR)铜绿假单胞菌临床分离株具有活性。美国监测数据汇总显示,头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-瑞来巴坦和头孢地尔对碳青霉烯类不敏感的铜绿假单胞菌分离株的活性分别约为90%、85%、86%和99%270,404;而来自囊性纤维化患者的分离株对这些药物的敏感性百分比更低405,406。专家组建议,对于多重耐药铜绿假单胞菌感染,应始终获取这四种新型β-内酰胺类药物的药敏试验(AST)结果,以指导治疗决策。
不同地区对新型抗菌药物的敏感性估计存在差异,这通常是由于基于酶的耐药机制的流行程度不同所致。例如,由于头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦以及亚胺培南-西司他丁-雷利巴坦均对产金属β-内酰胺酶(MBL)的铜绿假单胞菌(如产VIM、NDM酶的菌株)没有活性,因此在这些酶由铜绿假单胞菌产生的地区(如拉丁美洲、中东),所有这些药物的活性百分比都会降低385。由于头孢洛扎-他唑巴坦对产KPC酶的铜绿假单胞菌仍然无效,因此在世界上KPC酶更常由铜绿假单胞菌产生的地区(如拉丁美洲、中国),其活性百分比会降低。同样,虽然头孢他啶-阿维巴坦对产GES酶的铜绿假单胞菌通常仍然有效,但亚胺培南-雷利巴坦在存在GES酶的情况下效果较差;在产GES酶的地区(如西班牙),头孢他啶-阿维巴坦的敏感性百分比可能高于头孢洛扎-他唑巴坦和亚胺培南-西司他丁-雷利巴坦391,392,407。
与头孢他啶相比,头孢洛扎更重的侧链能增强空间位阻,从而限制PDC介导的水解作用408,409。此外,与头孢他啶相比,在孔蛋白缺失的情况下,头孢洛扎的细菌进入受到的影响极小。头孢洛扎不需要依赖抑制剂来恢复原本无活性的β-内酰胺类药物的敏感性(即头孢洛扎对DTR 铜绿假单胞菌具有独立活性,不需要依赖其β-内酰胺酶抑制剂来维持这种活性)。根据定义,头孢他啶和亚胺培南对DTR 铜绿假单胞菌均无活性。阿维巴坦和瑞利巴坦主要通过抑制PDCs来扩大这些药物的活性范围127。
专家组不建议对耐多药铜绿假单胞菌分离株进行美罗培南-瓦博巴坦的活性检测。瓦博巴坦对恢复美罗培南针对耐多药铜绿假单胞菌的活性作用甚微391。目前尚无临床和实验室标准协会(CLSI)或美国食品药品监督管理局(FDA)制定的美罗培南-瓦博巴坦针对铜绿假单胞菌的折点。如果将CLSI规定的美罗培南-瓦博巴坦针对肠杆菌科细菌的敏感折点(≤4 µg/mL)应用于铜绿假单胞菌分离株,部分铜绿假单胞菌分离株可能会表现出对美罗培南-瓦博巴坦敏感,而对美罗培南不敏感。这可能是由于美罗培南-瓦博巴坦的标准给药方案为每8小时静脉注射2克,输注时间超过3小时所致。美罗培南的折点(即≤2 µg/mL)是基于每8小时静脉注射1克、输注30分钟的给药方案制定的16。如果美罗培南以每8小时静脉注射2克、输注3小时的方式给药,其达到目标浓度的可能性可能与美罗培南-瓦博巴坦相近(即约8 µg/mL)410。
如问题3.4中所讨论的,头孢地尔由头孢菌素部分和一个铁载体组成,后者通过主动铁转运蛋白促进细菌细胞进入<sup>268</sup>。综合监测研究中1500株碳青霉烯类不敏感的铜绿假单胞菌分离株的数据,超过97%的分离株对头孢地尔表现出敏感性(即最低抑菌浓度≤4μg/mL)<sup>129,209,411-416</sup>。
问题4.3:治疗由DTR铜绿假单胞菌引起的非复杂性膀胱炎,首选抗生素是什么?
建议方案:对于由DTR 铜绿假单胞菌引起的非复杂性膀胱炎,首选治疗药物为头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦和头孢地尔。妥布霉素或阿米卡星(单剂量)是由DTR 铜绿假单胞菌引起的非复杂性膀胱炎的替代治疗选择。
理由
基于临床试验显示,头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-瑞来巴坦和头孢地尔对非复杂性多重耐药铜绿假单胞菌膀胱炎的疗效不劣于治疗尿路感染的常用对照药物,因此它们是此类感染的首选治疗方案131,228-230,417。目前尚无足够数据支持在治疗非复杂性膀胱炎时,这些药物中的某一种优于其他药物;现有的试验通常不包括感染具有多重耐药表型病原体的患者。对于由确认产金属β-内酰胺酶(如blaVIM)的多重耐药铜绿假单胞菌分离株引起的非复杂性膀胱炎,其建议治疗方法在问题4.6中进行了综述。
对于由DTR铜绿假单胞菌引起的非复杂性膀胱炎,单剂量妥布霉素或阿米卡星是一种替代选择。单剂量静脉注射妥布霉素或阿米卡星可能对非复杂性膀胱炎有效,因为氨基糖苷类药物几乎完全以活性形式通过肾脏途径排泄,毒性极小,但缺乏有力的临床数据28。截至2023年,铜绿假单胞菌的庆大霉素已不再有折点16(表2)。妥布霉素对铜绿假单胞菌的折点是存在的,无论其来源如何(敏感≤1μg/mL);然而,阿米卡星对铜绿假单胞菌的折点仅适用于源自泌尿道的感染(敏感≤16μg/mL)16。普拉佐米星对铜绿假单胞菌既没有CLSI折点,也没有FDA折点。监测研究表明,如果其他所有氨基糖苷类药物都已出现耐药性,那么普拉佐米星不太可能对DTR铜绿假单胞菌产生任何额外的疗效418。
黏菌素(而非多粘菌素B)可作为多重耐药铜绿假单胞菌膀胱炎的替代治疗选择,因为它能在泌尿道中转化为活性形式223。临床医生应始终意识到其相关的肾毒性风险。专家组不建议将口服磷霉素用于多重耐药铜绿假单胞菌膀胱炎,因为这可能与较高的临床失败率相关。部分原因是存在fosA基因,该基因几乎存在于所有铜绿假单胞菌分离株的基因组中31。
问题4.4:治疗由DTR铜绿假单胞菌引起的肾盂肾炎或复杂性尿路感染(cUTI)时,首选抗生素是什么?
建议方案:对于由耐多药铜绿假单胞菌引起的肾盂肾炎或复杂性尿路感染,首选治疗药物为头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-瑞来巴坦和头孢地尔。每日一次的妥布霉素或阿米卡星可作为治疗耐多药铜绿假单胞菌所致肾盂肾炎或复杂性尿路感染的替代药物。
理由
基于显示这些药物不劣于常用对照药物的临床试验,头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦和头孢地尔是治疗多重耐药(DTR)铜绿假单胞菌肾盂肾炎和复杂性尿路感染(cUTI)的首选治疗方案131,228-230,417。目前尚无足够数据支持在肾盂肾炎或复杂性尿路感染的治疗中,这些药物中的某一种优于其他药物。现有试验通常不包括感染具有多重耐药表型的铜绿假单胞菌的患者。经确认产金属β-内酰胺酶(如blaVIM)的多重耐药铜绿假单胞菌分离株引起的肾盂肾炎和复杂性尿路感染的建议治疗方法在问题4.6中进行了综述。每日一次的妥布霉素或
阿米卡星是治疗DTR铜绿假单胞菌肾盂肾炎或复杂性尿路感染的替代药物419,尽管存在与疗程相关的肾毒性风险49,50。考虑到它们在肾皮质中作用时间较长,且每日一次给药较为方便,可能有助于完成治疗疗程(例如,从其他药物过渡到终末剂量)47,48(表1、补充材料)。2023年实施的氨基糖苷类药物折点变化在问题4.3中进行了回顾。
问题4.5:治疗由DTR铜绿假单胞菌引起的泌尿道外感染,首选抗生素是什么?
建议方案:对于由多重耐药(DTR)铜绿假单胞菌引起的泌尿道外感染,首选头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦和亚胺培南-西司他丁-雷利巴坦。头孢地尔可作为由多重耐药(DTR)铜绿假单胞菌引起的泌尿道外感染的替代治疗方案。
理由
基于体外活性研究138,139,141,264,266,329,420-458、观察性研究459-464以及临床试验数据131,135,145,240,465-469,头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦和亚胺培南-西司他丁-雷利巴坦是治疗尿路外耐多药铜绿假单胞菌感染的首选药物。在临床试验中,绝大多数接受新型β-内酰胺类药物治疗的患者并未感染耐多药铜绿假单胞菌。目前缺乏新型药物之间(如头孢洛扎-他唑巴坦与头孢他啶-阿维巴坦)的对比临床试验。相反,现有研究主要集中于新型β-内酰胺类药物与旧药(如头孢洛扎-他唑巴坦与多粘菌素)的比较,且通常针对多重耐药铜绿假单胞菌,而非耐多药铜绿假单胞菌。对于已确认产金属β-内酰胺酶(如blaVIM)的耐多药铜绿假单胞菌引起的尿路外感染,其建议治疗方法在问题4.6中进行综述。
一项纳入200例多重耐药铜绿假单胞菌感染患者的观察性研究,比较了接受头孢洛扎-他唑巴坦治疗与接受多粘菌素或氨基糖苷类药物治疗患者的结局459。接受头孢洛扎-他唑巴坦治疗的患者中,81%获得了良好的临床结局,而接受多粘菌素或氨基糖苷类药物治疗的患者这一比例为61%,该差异具有统计学意义。来自五项临床试验的汇总数据探讨了95例多重耐药铜绿假单胞菌感染患者接受头孢他啶-阿维巴坦与接受碳青霉烯类药物治疗时的临床应答差异,两组治疗组的良好临床应答率分别为57%(56例患者中的32例)和54%(39例患者中的21例)470。仅66%的分离株对头孢他啶-阿维巴坦敏感,这使得结果的解读存在难度470。一项观察性研究比较了100例接受头孢洛扎-他唑巴坦治疗和100例接受头孢他啶-阿维巴坦治疗的多重耐药铜绿假单胞菌感染患者,两组的死亡率均约为40%471。然而,该研究存在一些局限性(例如,并非所有纳入的分离株都进行了药敏试验,40%的患者接受了联合治疗,50%为混合感染,菌血症或肺炎患者不足50%,头孢洛扎-他唑巴坦的给药剂量欠佳)。
一项纳入24例感染亚胺培南不敏感铜绿假单胞菌(P. aeruginosa)患者的临床试验显示,接受亚胺培南-西司他丁-雷利巴坦治疗的患者中,81%(16例中的13例)获得了良好的临床应答,而接受亚胺培南-西司他丁联合黏菌素治疗的患者中这一比例为63%(8例中的5例)240。尽管未达到统计学显著性(可能由于样本量较小),但数值差异表明,与基于黏菌素的方案相比,使用亚胺培南-西司他丁-雷利巴坦可改善治疗结局。
一项临床试验比较了使用头孢地尔与替代疗法(主要为多粘菌素类疗法)治疗碳青霉烯类耐药菌感染患者的疗效230。该试验纳入了22名独特患者,他们共发生29例碳青霉烯类耐药铜绿假单胞菌感染230。对于感染铜绿假单胞菌的患者,头孢地尔组和替代疗法组在治疗结束时的死亡率均为18%。该试验表明,头孢地尔的疗效与多粘菌素类方案相当,但可能无法像某些新型β-内酰胺-β-内酰胺酶抑制剂那样改善治疗结局240,459。有观察性数据表明头孢地尔可能适用于治疗高度耐药(DTR)铜绿假单胞菌感染,但这些数据受限于样本量小且缺乏非头孢地尔治疗组472,473。专家组建议,当新型β-内酰胺-β-内酰胺酶抑制剂存在活性不足、患者不耐受或无法获得等情况时,可将头孢地尔作为替代选择。
问题4.6:治疗产金属β-内酰胺酶的DTR铜绿假单胞菌(P. aeruginosa)时,首选抗生素是什么?
建议方案:对于感染产MBL的DTR 铜绿假单胞菌分离株的患者,首选治疗药物为头孢地尔。
理由
产生金属β-内酰胺酶(MBLs)的铜绿假单胞菌在美国并不常见385,386。此类分离株在世界其他地区更为常见266,385,392,474-476。对所有可用的β-内酰胺-β-内酰胺酶抑制剂(即头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦和亚胺培南-西司他丁-雷利巴坦)均表现出耐药性的多重耐药(DTR)铜绿假单胞菌分离株,应怀疑其可能产生金属β-内酰胺酶。产生金属β-内酰胺酶的铜绿假单胞菌分离株通常对头孢地尔仍敏感270。
关于使用头孢地尔治疗产MBL的铜绿假单胞菌的临床数据有限。两项头孢地尔临床试验纳入了7例产MBL的铜绿假单胞菌感染患者292。尽管有限的体外数据477和个别病例报告478,479表明,头孢他啶-阿维巴坦与氨曲南联合使用在治疗产MBL的铜绿假单胞菌感染方面可能取得临床成功,但对于产MBL的铜绿假单胞菌感染,这种联合用药相比单独使用氨曲南似乎不太可能带来显著的增量效益273,387。虽然阿维巴坦可能有助于降低PDC酶的活性,但广泛存在于多重耐药(DTR)铜绿假单胞菌中的多种其他非酶机制可能会阻碍氨曲南到达其PBP3靶点的能力。通过外推氨曲南-阿维巴坦的数据,预计头孢他啶-阿维巴坦与氨曲南联合对不到10%的产MBL的铜绿假单胞菌有活性273。
问题4.7:当使用新型β-内酰胺类药物治疗多重耐药铜绿假单胞菌感染时,多重耐药铜绿假单胞菌分离株对这些新型β-内酰胺类药物产生耐药性的可能性有多大?
建议方法:在用于治疗多重耐药(DTR)铜绿假单胞菌感染的所有β-内酰胺类药物中,耐药性的出现都是一个令人担忧的问题。现有数据表明,头孢洛扎-他唑巴坦和头孢他啶-阿维巴坦的耐药发生频率可能最高,不过关于亚胺培南-西司他丁-雷利巴坦和头孢地尔的这一问题,可用的研究数据较少。
理由
与大多数抗生素药物一样,使用任何较新的β-内酰胺类药物(即头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦或头孢地尔)治疗DTR 铜绿假单胞菌,会增加后续感染无法再用这些药物有效治疗的可能性。头孢洛扎-他唑巴坦耐药性的出现最常见的原因是PDC中的氨基酸替换、插入或缺失409,423,480-491。这些改变最常发生在PDC的一个特定区域(称为ω环)内或其附近。同样,铜绿假单胞菌对头孢他啶-阿维巴坦获得性耐药的最常见原因也是PDC的改变480,482,483,485,488,490-493。
导致铜绿假单胞菌对亚胺培南-西司他丁-雷利巴坦耐药的机制尚不太明确,通常推测与OprD缺失和外排泵(如MexAB-OprM和/或MexEF-OprN)过表达有关329,494,495。已有研究描述了铜绿假单胞菌对头孢地尔耐药的多种不同机制336,496,包括TonB依赖性铁转运系统的突变337-339,497、青霉素结合蛋白(PDCs)的氨基酸改变,以及PBP3靶点的修饰497-499。
根据目前可得的数据,铜绿假单胞菌(P. aeruginosa )对较新型β-内酰胺类抗生素耐药性的出现,在头孢洛扎-他唑巴坦和头孢他啶-阿维巴坦中表现得最为明显。这至少部分原因可能是,在临床实践中,这些药物的处方频率高于亚胺培南-西司他丁-雷利巴坦和头孢地尔500。由于结构相似,头孢洛扎-他唑巴坦和头孢他啶-阿维巴坦之间的交叉耐药性较高。在一组28例患有多重耐药(DTR)铜绿假单胞菌(P. aeruginosa )感染且接受头孢洛扎-他唑巴坦治疗的患者中,在治疗开始后再次分离出多重耐药铜绿假单胞菌(P. aeruginosa ),经过中位15天的治疗后,50%的后续分离菌株对头孢洛扎-他唑巴坦不再敏感491。超过80%的初始分离菌株对头孢他啶-阿维巴坦敏感的患者,在接触头孢洛扎-他唑巴坦后(且未接触头孢他啶-阿维巴坦的情况下),后续分离菌株出现了对头孢他啶-阿维巴坦的耐药性。另一项队列研究纳入了14例在接受头孢洛扎-他唑巴坦治疗后有初始和后续铜绿假单胞菌(P. aeruginosa )分离菌株的患者,结果显示79%的配对分离菌株出现了治疗期间产生的耐药性490。考虑到那些没有铜绿假单胞菌(P. aeruginosa )感染复发的患者(因此未被纳入队列)可能不太容易产生对头孢洛扎-他唑巴坦耐药的铜绿假单胞菌(P. aeruginosa )分离菌株,这两项单中心研究的结果可能高估了对头孢洛扎-他唑巴坦耐药性出现的可能性。尽管如此,头孢洛扎-他唑巴坦和头孢他啶-阿维巴坦耐药性出现的预估情况仍然令人担忧。
关于亚胺培南-西司他丁-雷利巴坦耐药性出现频率的数据有限。然而,一份报告指出,在接受亚胺培南-西司他丁-雷利巴坦治疗的铜绿假单胞菌感染患者中,26%(19人中有5人)对这种药物出现了不敏感性494。值得注意的是,在两项临床试验中,31名接受亚胺培南-西司他丁-雷利巴坦治疗的铜绿假单胞菌感染患者均未出现治疗相关性耐药240,468。
同样,关于铜绿假单胞菌对头孢地尔耐药性出现频率的估计尚不完整,但在一项临床试验中,接受头孢地尔治疗的铜绿假单胞菌分离株中有6%(1/17)对该药物产生了耐药性230。另一项研究表明,在14株对头孢洛扎-他唑巴坦产生治疗相关性耐药的分离株中,有3株(21%)出现了对头孢地尔的交叉耐药性496。
专家组建议,当既往感染过碳青霉烯类耐药(DTR)铜绿假单胞菌的患者出现类似脓毒症的表现,提示可能发生新的感染或感染复发时,应始终对四种较新的β-内酰胺类抗生素重复进行药敏试验。此外,如果患者近期接受过头孢洛扎-他唑巴坦或头孢他啶-阿维巴坦治疗,且因反复感染症状就医,专家组建议考虑使用亚胺培南-西司他丁-雷利巴坦或头孢地尔,特别是如果其中一种药物此前检测为敏感的话,至少在获得培养和药敏试验(AST)数据之前应如此。
问题4.8:联合抗生素治疗在由DTR铜绿假单胞菌引起的感染治疗中起到什么作用?
建议方案:如果已确认对头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦或头孢地尔敏感,那么不建议对由DTR 铜绿假单胞菌引起的感染采用联合抗生素治疗。
理由
虽然对于有多重耐药铜绿假单胞菌感染风险的患者,经验性联合抗生素治疗(例如,在β-内酰胺类药物基础上加用妥布霉素)以提高至少有一种有效药物的可能性是合理的,但数据表明,一旦β-内酰胺类药物已显示出体外活性,继续联合治疗并不比单用β-内酰胺类抗生素更具额外益处379。相反,继续使用第二种药物会增加抗生素相关不良事件的发生可能性379。此外,也缺乏表明联合治疗可防止耐药性出现的临床数据。
目前尚无比较头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-瑞来巴坦或头孢地尔作为单药治疗以及作为联合治疗组成部分的生存率的临床试验(例如,头孢他啶-阿维巴坦与头孢他啶-阿维巴坦联合妥布霉素的比较)。观察性研究未发现联合治疗具有生存优势472,501,502。基于氨基糖苷类和多粘菌素的毒性,以及临床结局数据未显示联合治疗对铜绿假单胞菌感染有益379,专家组建议,当已证实对β-内酰胺类药物敏感时,不常规对多重耐药铜绿假单胞菌感染采用联合治疗。
如果没有β-内酰胺类药物对多重耐药铜绿假单胞菌(DTR P. aeruginosa)表现出活性,那么在妥布霉素(若显示敏感)可考虑与头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁-雷利巴坦或头孢地尔中的任意一种联合使用,优先选择最低抑菌浓度(MIC)最接近其敏感 breakpoint的β-内酰胺类药物。例如,如果头孢洛扎-他唑巴坦和头孢他啶-阿维巴坦对某株多重耐药铜绿假单胞菌(DTR P. aeruginosa)的MIC均>128/4 µg/mL(高度耐药),而亚胺培南-西司他丁-雷利巴坦的MIC为4/4 µg/mL(中介类别),则优先选择亚胺培南-西司他丁-雷利巴坦联合妥布霉素。目前缺乏数据证明这种方法的益处,因此应将其视为最后的手段。建议采用这种方法是因为它可能会提高治疗方案中至少包含一种活性药物的可能性。
如果妥布霉素的药敏试验结果为不敏感,可考虑将多粘菌素B与新型β-内酰胺类药物联合使用。对于非尿路感染,多粘菌素B比粘菌素更受青睐,因为它并非作为前药给药,因此能达到比粘菌素更可靠的血浆浓度,且其肾毒性风险可能更低,不过各项研究存在局限性,无法准确确定二者在肾毒性风险上的差异503-508。
问题4.9:雾化抗生素在治疗由耐多药铜绿假单胞菌引起的呼吸道感染中起到什么作用?
建议方法:专家小组不建议使用雾化抗生素治疗由DTR 铜绿假单胞菌引起的呼吸道感染。
理由
在观察性研究中,关于雾化抗生素治疗革兰氏阴性菌肺炎的临床有效性存在相互矛盾的结果509-536。至少有三项临床试验对比了雾化抗生素与安慰剂治疗革兰氏阴性菌呼吸机相关性肺炎患者的疗效,这三项试验均允许使用全身性抗生素。简而言之,第一项试验对比了100例肺炎成人患者(34%由铜绿假单胞菌引起)接受雾化粘菌素与安慰剂治疗的效果537;第二项试验对比了142例肺炎成人患者(22%由铜绿假单胞菌引起)接受雾化阿米卡星/磷霉素与安慰剂治疗的效果538;第三项试验对比了508例肺炎成人患者(32%由铜绿假单胞菌引起)接受雾化阿米卡星与安慰剂治疗的效果539。这三项临床试验均未显示,在治疗呼吸机相关性肺炎时,雾化抗生素相较于安慰剂能改善临床结局或带来生存获益,包括对耐药病原体感染患者的亚组分析也是如此537-539。一项对13项试验(包含1733例呼吸机相关性肺炎成人患者)的荟萃分析表明,与对照组相比,加用雾化抗生素至少与感染临床症状的部分缓解相关;然而,不同研究中涉及的病原体以及临床应答的定义存在显著异质性540。接受雾化抗生素治疗的患者在生存获益、缩短重症监护病房住院时间或减少机械通气天数方面均未观察到改善540。
现有试验中雾化抗生素缺乏临床获益的原因尚不明确。在一项药代动力学/药效学(PK/PD)建模研究中,向危重症患者雾化递送黏菌素前药,在肺部上皮衬液中达到了较高的活性药物浓度541。然而,雾化抗生素可能无法充分渗透和/或分布到整个肺组织以发挥显著的杀菌活性542,这可能部分是由于使用了非肠道制剂,而这些制剂并非专为在喷射雾化器等不理想的递送装置中吸入而设计543,544。专业学会对于雾化抗生素作为静脉抗生素辅助治疗的作用存在分歧545-547。鉴于临床试验中未观察到获益、对感染肺部分布不均的担忧,以及对使用雾化抗生素可能引发支气管痉挛等呼吸系统并发症的担忧,专家组不建议将雾化抗生素用作多重耐药铜绿假单胞菌肺炎的辅助治疗548。
第5节:耐碳青霉烯类鲍曼不动杆菌
耐碳青霉烯类鲍曼不动杆菌(CRAB)感染在医疗环境中带来了重大挑战549,550。在本指南文件中,为简便起见,我们将使用“CRAB”这一术语,因为我们认识到,大多数临床微生物实验室可能无法准确区分耐碳青霉烯类鲍曼不动杆菌与鲍曼不动杆菌-醋酸钙复合体中的其他菌种551。
CRAB感染的管理存在难度,原因有几个方面。首先,CRAB最常见于呼吸道标本或伤口中。在因潜在宿主因素而患病的病情复杂患者(例如需要机械通气的患者、大面积烧伤患者)中,从呼吸道或伤口培养中分离出的CRAB是定植菌还是真正的病原体,这一点并不总是明确的,这导致对抗生素治疗的必要性存在不确定性。出于同样的原因,很难确定CRAB感染患者临床结局不佳是归因于抗生素治疗不理想,还是潜在的宿主因素。
其次,一旦鲍曼不动杆菌(A. baumannii)表现出碳青霉烯类耐药性,它通常会对大多数其他本应对野生型鲍曼不动杆菌(A. baumannii)有效的抗生素产生耐药性,从而留下极少的治疗选择。OXA型碳青霉烯酶(如OXA-23、OXA-24/40)的产生会介导对包括碳青霉烯类和舒巴坦在内的β-内酰胺类药物的耐药性551,552。耐碳青霉烯类鲍曼不动杆菌分离株通常还会产生其他丝氨酸β-内酰胺酶(如鲍曼不动杆菌(Acinetobacter baumannii)来源的头孢菌素酶[ADCs]),这进一步限制了常见β-内酰胺类药物的应用。舒巴坦耐药性主要由β-内酰胺酶的存在引起,也可通过针对青霉素结合蛋白(即PBP1a/1b和PBP3)的突变产生553-555。氨基糖苷类修饰酶或16S rRNA甲基转移酶通常使氨基糖苷类药物无法成为耐碳青霉烯类鲍曼不动杆菌的治疗选择556-558。染色体编码的喹诺酮类耐药决定区的突变通常会介导对氟喹诺酮类药物的耐药性557。
最后,目前尚无明确的CRAB感染“标准治疗”抗生素方案,可用于评估各种治疗方案的有效性。常用药物之间的有力对比有效性研究十分有限。支持优先选择具有CRAB活性的特定药物,或常用联合方案对CRAB感染具有叠加益处的数据仍不完整。本指南文件侧重于中重度CRAB感染的治疗。
问题5.1:治疗CRAB引起的感染的一般方法是什么?
建议方案:建议使用包含舒巴坦的抗生素方案治疗CRAB感染。首选方案为舒巴坦-杜洛巴坦联合碳青霉烯类药物(即亚胺培南-西司他丁或美罗培南)。若舒巴坦-杜洛巴坦不可用,替代方案为高剂量氨苄西林-舒巴坦(舒巴坦成分每日总剂量9克)联合至少一种其他药物(即多粘菌素B、米诺环素>替加环素或头孢地尔)。
理由
治疗CRAB感染的一般方法是采用至少两种药物联合治疗,至少持续到观察到适当的临床反应为止,因为支持任何单一抗生素疗效的数据有限。通常还建议,联合用药中至少有一种是基于舒巴坦的药物。首选的基于舒巴坦的药物是舒巴坦-杜洛巴坦,联合亚胺培南-西司他丁或美罗培南(问题5.2)。当舒巴坦-杜洛巴坦不可及时,另一种方法是使用高剂量氨苄西林-舒巴坦(舒巴坦成分的每日总剂量为9克)作为联合治疗的一部分(问题5.3)。如问题5.2和问题5.3所述,体外研究559-561、动物模型562以及临床结局数据563-568均观察到舒巴坦对鲍曼不动杆菌分离株具有独特的活性。当使用高剂量舒巴坦时,建议采用联合治疗,尽管在七项临床试验中,只有一项发现联合抗生素治疗CRAB感染可改善临床结局563,569-574(问题5.4)。值得注意的是,这项显示联合治疗有益的临床试验是唯一一项在联合治疗组中纳入高剂量氨苄西林-舒巴坦的试验563。可考虑与高剂量氨苄西林-舒巴坦联合使用的其他药物包括多粘菌素B(问题5.5)、米诺环素(问题5.6)、替加环素(问题5.6)或头孢地尔(问题5.7)。不建议将磷霉素和利福平作为联合治疗的组成部分571,573,574(问题5.3,问题5.9)。
由于两项大型临床试验并未显示,高剂量延长输注碳青霉烯类药物联合粘菌素治疗CRAB感染有获益569,570,因此不建议将美罗培南或亚胺培南-西司他丁作为CRAB常规治疗方案的组成部分,但值得注意的例外情况是,当它们与舒巴坦-杜洛巴坦联用时(问题5.8)。不建议将雾化抗生素作为CRAB肺炎的辅助治疗,原因是临床试验中未观察到获益537-539,且存在感染肺部分布不均的问题,以及可能出现支气管痉挛等呼吸系统并发症542-544,548(问题5.10)。
问题5.2:舒巴坦-杜洛巴坦在治疗CRAB引起的感染中发挥什么作用?
建议方案:舒巴坦-杜洛巴坦是治疗CRAB感染的首选药物,建议与亚胺培南-西司他丁或美罗培南联合使用。
理由
舒巴坦-杜洛巴坦于2023年5月获得美国食品药品监督管理局(FDA)批准。杜洛巴坦是一种β-内酰胺酶抑制剂,能有效抑制A类(如TEM-1)、C类(如ADC)和D类β-内酰胺酶(如OXA-24/40、OXA-23)。它不能抑制B类金属β-内酰胺酶(如NDM),这类酶在美国的耐碳青霉烯类鲍曼不动杆菌(CRAB)分离株中很少产生,但在世界其他地区的问题日益严重(例如,2017-2019年拉丁美洲至少5%的CRAB分离株含有blaNDM,而目前的估计可能更高)575,576。杜洛巴坦通过结合并抑制A类、C类和D类β-内酰胺酶,降低舒巴坦被水解的可能性,使舒巴坦能够成功到达其青霉素结合蛋白(PBP)靶点577。舒巴坦-杜洛巴坦的给药方式为每6小时给予1克舒巴坦和1克杜洛巴坦(总计2克),通过3小时静脉输注578(表1)。对于舒巴坦-杜洛巴坦最小抑菌浓度(MIC)≤4/4 µg/mL(FDA和临床实验室标准化协会(CLSI)的折点)的鲍曼不动杆菌(A. baumannii)分离株,这种给药策略能实现超过90%的药代动力学/药效学(PK/PD)目标达标率578。
一项临床试验对舒巴坦-杜洛巴坦在治疗由鲍曼不动杆菌引起的肺炎或血流感染患者中的效果进行了研究568。患者被随机分配至舒巴坦-杜洛巴坦组或黏菌素组;所有患者还接受亚胺培南-西司他丁治疗,剂量为每6小时1克亚胺培南。研究对125例耐碳青霉烯类鲍曼不动杆菌感染患者的28天死亡率这一主要结局进行了评估。舒巴坦-杜洛巴坦组患者的死亡率为19%(12/63),黏菌素组为32%(20/62),达到了预先设定的非劣效性标准。次要结局也显示舒巴坦-杜洛巴坦更具优势,包括临床治愈(62%对40%)、治愈访视时的微生物学应答(68%对42%),以及更低的肾毒性风险(13%对38%)。需要注意的是,本试验中的对照组(即黏菌素联合亚胺培南-西司他丁)并非耐碳青霉烯类鲍曼不动杆菌感染的首选治疗方案。
亚胺培南-西司他丁相对于舒巴坦-杜洛巴坦的额外临床获益尚不明确。一些研究表明,舒巴坦-杜洛巴坦与亚胺培南-西司他丁联合使用可使舒巴坦-杜洛巴坦的最低抑菌浓度(MIC)降低1-2倍579-581。这种潜在获益可能与多种β-内酰胺类药物针对额外的青霉素结合蛋白(PBPs)有关(即舒巴坦优先结合PBP1和PBP3,而亚胺培南优先结合PBP2)580,582。在杜洛巴坦的保护下,舒巴坦和亚胺培南均更有可能成功到达其青霉素结合蛋白靶点。此外,亚胺培南可能作为OXA碳青霉烯酶介导水解的底物,这可能使更多舒巴坦能够到达其青霉素结合蛋白靶点。在中空纤维感染模型中,在舒巴坦-杜洛巴坦中添加碳青霉烯类药物可增强对细菌生长的抑制作用583。目前尚无研究舒巴坦-杜洛巴坦在不联合亚胺培南-西司他丁时治疗耐碳青霉烯类鲍曼不动杆菌(CRAB)感染获益的临床数据。基于现有的体外数据,建议将亚胺培南-西司他丁作为舒巴坦-杜洛巴坦的辅助治疗药物。鉴于美罗培南与亚胺培南-西司他丁的青霉素结合蛋白靶点相似,美罗培南可能是亚胺培南-西司他丁的合理替代药物580,581。对于需要长期治疗的患者(例如耐碳青霉烯类鲍曼不动杆菌骨髓炎),在临床症状改善后停用碳青霉烯类药物可能是合理的。随着舒巴坦-杜洛巴坦在临床实践中的应用日益广泛,我们对其耐药机制的理解也将不断深入。现有数据表明,舒巴坦-杜洛巴坦的高水平耐药通常是由金属β-内酰胺酶(MBL)或PBP3突变体引起的553,579,584。在舒巴坦-杜洛巴坦耐药的情况下(即MIC≥16/4μg/mL),专家组建议考虑使用最佳剂量的非舒巴坦类联合方案(即头孢地尔、米诺环素、替加环素、多粘菌素B),因为基于舒巴坦的治疗不太可能具有显著的治疗价值。
问题5.3:氨苄西林-舒巴坦在治疗CRAB引起的感染中起什么作用?
建议方案:高剂量氨苄西林-舒巴坦作为联合疗法的一部分,被建议作为碳青霉烯类耐药鲍曼不动杆菌(CRAB)的替代药物。仅在无法获得舒巴坦-杜洛巴坦而无法使用时,才建议采用此方案。
理由
如问题5.2所述,舒巴坦是一种竞争性、不可逆的β-内酰胺酶抑制剂,高剂量时可饱和鲍曼不动杆菌分离株的PBP1a/1b和PBP3553,585。通过药代动力学/药效学研究559-561,586-591、动物模型562,592和临床结局数据563-567,已证实舒巴坦对鲍曼不动杆菌分离株具有独特的活性。专家组建议将高剂量氨苄西林-舒巴坦(舒巴坦成分的每日总剂量为9克)作为碳青霉烯类耐药鲍曼不动杆菌感染联合治疗的组成部分(表1)。
对现有药代动力学/药效动力学(PK/PD)数据的回顾表明,舒巴坦每日总剂量为9克时,对于舒巴坦最低抑菌浓度(MIC)高达16-32 µg/mL的鲍曼不动杆菌分离株(即舒巴坦耐药株),很可能达到足够的游离药物浓度超过最低抑菌浓度的时间百分比(fT>MIC)(无论fT>MIC阈值是40%还是60%)593。值得注意的是,杜洛巴坦能有效抑制耐碳青霉烯类鲍曼不动杆菌(CRAB)常产生的A类、C类和D类酶584,594,这使得较低剂量的舒巴坦就能在杜洛巴坦的保护下成功作用于其青霉素结合蛋白(PBP)靶点。氨苄西林-舒巴坦没有类似杜洛巴坦的β-内酰胺酶抑制剂提供额外保护。氨苄西林-舒巴坦采用2:1的配方,例如,3克氨苄西林-舒巴坦由2克氨苄西林和1克舒巴坦组成。建议氨苄西林-舒巴坦的每日总剂量为27克(相当于9克舒巴坦),采用延长输注或持续输注的方式(例如,每8小时静脉输注9克[含3克舒巴坦],输注时间超过4小时)559,560,563,564,587,595。
少于50%的CRAB分离株对氨苄西林-舒巴坦检测呈敏感状态596,597。目前尚无足够数据来确定标准剂量的氨苄西林-舒巴坦与高剂量的氨苄西林-舒巴坦,在治疗对氨苄西林-舒巴坦敏感的分离株引起的CRAB感染时是否具有同等疗效。专家组更倾向于使用高剂量氨苄西林-舒巴坦,因为从理论上讲,它有利于使舒巴坦的青霉素结合蛋白(PBP)靶点达到饱和,尤其是考虑到该药物的大量成分可能在到达PBP靶点之前就被β-内酰胺酶水解,而且常用的CRAB氨苄西林-舒巴坦药敏试验(AST)方法可能存在不准确性(即,除参考肉汤微量稀释法外,使用其他AST方法得出的“敏感”结果实际上可能并非真正的“敏感”)598,599。
两项荟萃分析评估了针对CRAB感染的各种治疗方案的观察性和临床试验数据566,567。2021年发表的一项荟萃分析纳入了18项研究和1835名患者,发现氨苄西林-舒巴坦(舒巴坦成分的每日总剂量至少为6克)联合第二种药物是降低感染CRAB的危重患者死亡率的最有效方案566。2017年发表的一项较早的荟萃分析纳入了23项观察性研究或临床试验,涉及2118名CRAB感染患者567。该分析在评估基于舒巴坦、基于多粘菌素或基于四环素的方案时,发现舒巴坦在降低死亡率方面的效果最为显著。
至少有五项评估CRAB感染患者死亡率的临床试验在其中一个治疗组中纳入了舒巴坦600。在这些试验中,比较基于粘菌素的治疗组与基于舒巴坦的治疗组的死亡率,结果如下:42%对33%601、82%对42%602、63%对50%563、38%对17%603、32%对19%568。尽管只有其中一项试验602中死亡率的差异达到了统计学显著性,但所有试验均显示基于舒巴坦的治疗组在死亡率上有数值上的降低,这表明在治疗方案中加入舒巴坦可能具有益处。综合评估体外、动物和临床数据,专家组认为,当无法获得舒巴坦-杜洛巴坦时,高剂量氨苄西林-舒巴坦联合第二种药物可作为治疗CRAB感染的替代方案。
问题5.4:联合抗生素治疗在治疗CRAB引起的感染中起什么作用?
建议方案:由于支持任何单一抗生素的临床数据有限,因此建议在可能的情况下,采用至少两种药物的联合疗法治疗CRAB感染,至少持续到观察到临床改善为止。
理由
对于CRAB感染的治疗,建议采用联合疗法,即使单一药物显示出活性。在可能需要长期治疗的情况下(例如骨髓炎),可以考虑转为单一活性药物的降阶梯治疗。体外研究和动物研究的结果存在矛盾,但多项研究表明,各种联合方案能增强对细菌的杀灭作用560,604-612。有许多观察性研究评估了联合疗法与单药疗法在CRAB感染治疗中的作用,但结果各异612-633。患者人群的异质性、感染源、定植菌株的纳入、所用抗生素及其剂量的差异、样本量小以及治疗组间的不平衡,使得对其中多项研究的解读存在难度。
至少有7项试验研究了联合疗法在CRAB感染中的作用,在这7项试验中,只有1项表明联合疗法可能具有益处559,563,570-574,634。值得注意的是,由于研究中报告的粘菌素剂量不一致且不明确,专家组决定不报告各试验中使用的粘菌素剂量。在这7项包含多粘菌素组的试验中,没有一项研究多粘菌素B的作用,而多粘菌素B的药代动力学特征比粘菌素更优224。这些试验中只有1项在治疗组中使用了舒巴坦。以下是这7项试验的总结,其中多项试验因样本量小而存在局限性。
一项纳入210例患有侵袭性CRAB感染的ICU患者的试验,比较了单独使用黏菌素与黏菌素联合利福平(在美国称为rifampin)的患者结局,发现两组30天死亡率无差异,均为43%572。第二项试验纳入了43例CRAB肺炎患者,同样比较了黏菌素单药治疗与黏菌素联合利福平的效果573。黏菌素组的住院死亡率为73%,黏菌素-利福平组为62%,未达到统计学意义。第三项研究将9例黏菌素耐药的鲍曼不动杆菌(碳青霉烯类药物敏感性状态未描述)患者随机分组,发现黏菌素组与黏菌素联合利福平组的30天死亡率无差异(分别为20%和33%)574。
第四项试验纳入了多种CRAB感染患者,将94名患者随机分配至单独接受粘菌素治疗组或粘菌素联合磷霉素治疗组571。粘菌素单药治疗组和粘菌素-磷霉素联合治疗组的28天内死亡率分别为57%和47%。静脉用磷霉素目前在美国尚未获批,因此该试验结果与本指南文件的相关性有限。
两项大型试验评估了粘菌素单药治疗与粘菌素联合美罗培南的作用570,635。在第一项研究中,312例CRAB菌血症、肺炎或尿路感染患者被随机分配至粘菌素单药治疗组与粘菌素联合美罗培南治疗组(美罗培南2克静脉注射,每8小时一次,3小时输注完毕)570。两组间28天死亡率无差异(分别为46%和52%)570。第二项试验纳入329例耐药性鲍曼不动杆菌血流感染或肺炎患者,随机分为粘菌素单药治疗组与粘菌素联合美罗培南治疗组(美罗培南1克静脉注射,每8小时一次,30分钟输注完毕)635。粘菌素单药治疗组和联合治疗组的28天死亡率分别为46%和42%635。在这两项试验中,对于重症CRAB感染患者,在粘菌素基础上加用美罗培南并未提高生存率。
第七项试验纳入了39例CRAB肺炎患者,其临床分离株对粘菌素和舒巴坦均敏感563。患者被随机分配至粘菌素单药治疗组与粘菌素联合高剂量舒巴坦治疗组(舒巴坦成分每日总剂量为8克)563。结果显示,到第5天,粘菌素组和粘菌素-舒巴坦组的临床改善率分别为16%和70%,差异具有统计学意义。两组患者的28天死亡率分别为63%和50%。研究人员知晓患者的治疗分配情况。此外,患者在第5天后可转用其他抗生素,这使得无法准确比较两组间的临床失败率或死亡率。
尽管在针对CRAB感染的联合治疗的7项临床试验中,仅有1项显示出具有统计学意义的获益,但专家组仍倾向于对CRAB感染采用联合治疗,原因如下:(1)绝大多数临床试验所采用的联合方案在临床实践中并不常用(例如黏菌素联合利福平),这使得试验结果的适用性有限;(2)除舒巴坦-杜洛巴坦外,缺乏强有力的临床数据支持任何单一具有抗CRAB体外活性的药物可用于治疗CRAB感染;使用两种药物可能会提高至少有一种活性药物发挥作用的可能性;(3)由于常见的经验性抗生素方案通常对CRAB无效,有效治疗的启动几乎普遍存在延迟,因此CRAB感染的细菌负荷预计会很高。考虑到CRAB感染相关的高死亡率,使用两种药物的获益可能超过其风险。除大剂量氨苄西林-舒巴坦外,可考虑作为联合治疗组成部分的潜在选择包括:四环素衍生物(其中米诺环素的使用经验最丰富)、多粘菌素B或头孢地尔(问题5.3至5.6)。优先选择某一种药物而非另一种的决定应基于患者和感染的具体因素(例如,多粘菌素B可能对慢性肾病患者吸引力较低[问题5.5],米诺环素可能对血流感染吸引力较低[问题5.6])。
问题5.5:多粘菌素在治疗CRAB引起的感染中起到什么作用?
建议方案:多粘菌素B可考虑与至少一种其他药物联合用于治疗CRAB感染。
理由
多粘菌素类药物(包括粘菌素和多粘菌素B)对CRAB分离株具有可靠的体外活性,大多数已发表的文献都聚焦于粘菌素560,561。专家组在考虑基于多粘菌素的治疗方案时,优先推荐多粘菌素B,因为其药代动力学特征比粘菌素更优224,546,636。粘菌素更适用于CRAB尿路感染,因为它能在泌尿道中转化为活性形式。相比之下,多粘菌素B在尿液中的排泄量极少(4%)3。对于多粘菌素抗鲍曼不动杆菌</b0,临床和实验室标准协会(CLSI)没有设定敏感类别;当多粘菌素的最低抑菌浓度(MIC)>2 µg/mL时,其疗效可能会降低637。由于多粘菌素的某些化学特性(如通过琼脂的扩散性差、对微量滴定板的吸附性强),获得准确的多粘菌素MIC值存在一定难度638。
专家组不建议采用多粘菌素单药治疗,原因如下:首先,常规给药方案所达到的血清中多粘菌素浓度变异度极大,可能不足以产生有效的杀菌活性224。同样,静脉注射多粘菌素在肺上皮衬液中的活性欠佳,通常无法实现肺部细菌的充分杀灭639-641。其次,治疗全身性感染所需的剂量接近肾毒性阈值,导致治疗窗极其狭窄(即可能需要约2μg/mL的浓度才能使细菌生长减少1个对数级,但这也是与肾毒性相关的阈值)642。最后,在评估粘菌素单药治疗作用的最大规模临床试验(每项试验超过300名患者)中,两项试验的死亡率均较高,达46%569,570。
问题5.6:四环素衍生物在治疗CRAB引起的感染中起到什么作用?
建议方案:对于碳青霉烯类耐药鲍曼不动杆菌(CRAB)感染,可考虑大剂量米诺环素或大剂量替加环素联合至少一种其他药物进行治疗。专家组更倾向于米诺环素而非替加环素,原因是米诺环素具有长期的临床应用经验,且有临床和实验室标准协会(CLSI)的折点可供参考。
理由
几种四环素衍生物在体外对CRAB具有活性,包括米诺环素、替加环素和埃拉环素643,644。CRAB分离株对这些药物产生耐药性的频率尚不明确,但耐药性的产生与多种RND型转运蛋白过表达引起的药物外排有关645,646。四环素衍生物的一个普遍问题是,给药后它们会迅速分布到组织中,导致尿液和血清中的浓度有限39。不建议将四环素衍生物作为血流感染的单药治疗方案。
自20世纪60年代米诺环素问世以来,其临床应用经验已相当丰富647。它有口服和静脉注射两种市售剂型。研究人员利用接受单剂量200毫克米诺环素的危重症患者数据,建立了群体药代动力学模型;结果预测,对于最小抑菌浓度(MIC)>1微克/毫升的病原体,每12小时静脉注射200毫克米诺环素会导致药代动力学/药效学(PK/PD)特征不理想648。认识到这一点很重要,因为临床和实验室标准协会(CLSI)规定米诺环素针对鲍曼不动杆菌的折点为≤4微克/毫升16。对于最小抑菌浓度为2-4微克/毫升的耐碳青霉烯类鲍曼不动杆菌(CRAB)分离株,使用米诺环素时需谨慎,虽然可能报告为敏感,但感染部位的抗生素浓度可能并不理想。国际监测数据显示,米诺环素对约60-80%的耐碳青霉烯类鲍曼不动杆菌分离株有效,但考虑到采用的敏感折点为≤4微克/毫升,这一比例可能被高估649,650。尽管已有一些关于米诺环素用于治疗耐碳青霉烯类鲍曼不动杆菌感染的病例系列报道373,651-654,但它尚未经过严格的临床试验验证。从这些观察性报告中得出米诺环素疗效的结论存在难度,因为它们存在重要局限性(如样本量小、选择偏倚、定植与感染区分不足、感染部位异质性等)。尽管现有数据存在局限性,但专家组认为,当米诺环素作为联合方案的一部分时,可用于治疗耐碳青霉烯类鲍曼不动杆菌感染(剂量为每日两次,每次200毫克,静脉注射或口服)(表1)。
替加环素是一种四环素衍生物,仅有一种静脉制剂。对于鲍曼不动杆菌分离株,临床和实验室标准协会(CLSI)和美国食品药品监督管理局(FDA)均未制定替加环素的折点;由于不同四环素衍生物的敏感性可能性存在差异,不能用米诺环素的最低抑菌浓度(MIC)来预测替加环素的最低抑菌浓度。多项观察性研究以及一项包含15项试验的荟萃分析表明,在肺炎治疗中,替加环素单药治疗的死亡率高于其他替代方案,且并非仅限于耐碳青霉烯类鲍曼不动杆菌(CRAB)肺炎。后续研究表明,当使用高剂量替加环素(静脉注射200mg作为单次负荷剂量,随后每12小时静脉注射100mg)时,替加环素与对照药物之间的死亡率差异不再明显。与米诺环素类似,根据来自危重症患者的药代动力学(PK)数据,当最低抑菌浓度>1μg/mL时,替加环素的疗效可能会受到限制。如果开具替加环素用于治疗耐碳青霉烯类鲍曼不动杆菌感染,专家组建议使用高剂量(表2)。与米诺环素一样,对于耐碳青霉烯类鲍曼不动杆菌感染,建议替加环素与至少一种其他药物联合使用。这两种药物在20%-50%的患者中会引起恶心,且高剂量时这种情况可能更为常见。
尽管对于耐碳青霉烯类鲍曼不动杆菌(CRAB),依拉环素的最低抑菌浓度(MIC)通常比替加环素低2至8倍655,659,660,但由于替加环素和依拉环素的药代动力学(PK)特征存在差异,这些药物之间MIC分布差异的临床相关性尚不明确。与替加环素一样,临床和实验室标准协会(CLSI)也未为依拉环素制定折点。研究依拉环素疗效的临床试验中仅纳入了少量患有CRAB感染的患者358,370。目前关于其治疗CRAB感染疗效的上市后临床报告有限661,662。在一项针对93例CRAB肺炎患者的观察性研究中,与其他替代方案相比,使用依拉环素与更长的机械通气时间(11天 vs 7天)和更高的30天死亡率(33% vs 15%)相关662。接受依拉环素治疗的4例CRAB血流感染患者均死亡。鉴于支持使用依拉环素的临床数据有限,专家组建议仅在其他药物无效、无法耐受或无法获得时,才考虑使用依拉环素。
评估Omadacycline(一种具有静脉和口服制剂的四环素衍生物)活性的临床前数据表明,与其他四环素衍生物相比,其对CRAB分离株的疗效有所降低。药代动力学/药效学特征显示,Omadacycline对CRAB分离株的活性非常有限374-377。临床数据仅限于小型、非对照的病例系列663。专家组不建议使用Omadacycline治疗CRAB感染。
问题5.7:头孢地尔治疗CRAB引起的感染时,其作用是什么?
建议方案:头孢地尔应仅限于治疗对其他抗生素耐药的CRAB感染,或在对其他药物不耐受或耐药而无法使用这些药物的情况下使用。当使用头孢地尔治疗CRAB感染时,专家组建议将其作为联合方案的一部分开具处方。
理由
头孢地尔是一种与铁载体结合的头孢菌素,其针对CRAB分离株的作用已有临床前和临床数据支持。国际监测研究表明,使用CLSI的≤4 µg/mL breakpoint,约95%的CRAB分离株对头孢地尔敏感270,664(表2)。然而,确定CRAB对头孢地尔的敏感性存在一定挑战,部分原因是培养基中的铁浓度存在差异。此外,不同方法得出的MIC结果并非总能重现,可能会出现异质性耐药,且微量肉汤稀释法的结果可能难以解读,因为拖尾终点、浑浊现象或悖论效应可能会干扰判读665-667。再者,临床前数据显示,鲍曼不动杆菌所需的头孢地尔药代动力学/药效学(PK/PD)目标高于其他革兰氏阴性菌,且在鲍曼不动杆菌感染动物模型中,头孢地尔的杀菌活性存在差异668-671。
一项包含54例CRAB感染患者的临床试验发现,在研究结束时,头孢地尔组的死亡率为49%(39例患者中有19例),而替代治疗组(主要由多粘菌素类方案组成)的死亡率为18%(17例患者中有3例)230。在患有肺炎和血流感染的患者中,观察到头孢地尔治疗的结局不佳。第二项试验纳入了47例CRAB肺炎亚组患者,结果显示头孢地尔组14天死亡率为22%(23例患者中有5例),美罗培南组为17%(24例患者中有4例)——这表明头孢地尔与一种相对低效的药物在治疗结局上相似672。由于第一项试验中替代治疗组所用方案存在异质性,且两项试验合并后CRAB患者数量相对较少,因此对结果进行情境化解读存在一定难度268。
在一项观察性研究中,124例CRAB感染患者接受头孢地尔与多粘菌素类方案治疗,30天死亡率分别为34%和56%673。然而,头孢地尔组的CRAB感染复发率更高(17%对7%)。在头孢地尔组发生CRAB感染复发的8例患者中,50%的后续分离株对头孢地尔表现出耐药性。其他观察性数据表明,头孢地尔用于治疗CRAB感染可能是合理的,但这些研究通常受限于样本量小、缺乏对照组或对照组异质性强,以及合并COVID-19感染的比例高674-676。
结合现有数据,专家小组建议,如果开具头孢地尔用于治疗CRAB感染,应谨慎使用,并将其作为联合疗法的一部分,以提高治疗方案中至少包含一种有效药物的可能性。专家小组还建议,在其他治疗方案都已用尽后,再考虑将头孢地尔用于CRAB感染。
问题5.8:延长输注美罗培南或亚胺培南-西司他丁在治疗耐碳青霉烯类鲍曼不动杆菌(CRAB)引起的感染中起什么作用?
建议方案:美罗培南或亚胺培南-西司他丁不建议用于治疗CRAB感染,除非与舒巴坦-杜洛巴坦联合使用。
理由
体外数据表明,由(1)美罗培南、氨苄西林-舒巴坦和米诺环素或(2)美罗培南、氨苄西林-舒巴坦和多粘菌素B组成的三联疗法可能对CRAB具有微生物学疗效559-561。尽管至少有两项观察性研究表明,在三联疗法(即氨苄西林-舒巴坦、碳青霉烯类药物、粘菌素)中加入碳青霉烯类药物可获得良好结局,但这些研究并未比较三联疗法与氨苄西林-舒巴坦联合粘菌素的二联疗法的结局637,677。如问题5.4所述,两项随机试验评估了粘菌素单药治疗与粘菌素联合美罗培南的作用,且两项试验均未显示粘菌素联合美罗培南治疗CRAB感染具有益处569,570。其中一项试验的二次分析发现,即使存在体外协同作用,粘菌素联合美罗培南也未观察到临床结局的改善678。
亚胺培南-西司他丁可能对某些耐美罗培南的分离株保持活性679-681;然而,这两种药物对耐碳青霉烯类鲍曼不动杆菌(CRAB)分离株的最低抑菌浓度(MIC)几乎总是显著高于8 µg/mL570,635。由于最低抑菌浓度显著升高,美罗培南或亚胺培南-西司他丁作为联合治疗的组成部分时,似乎不太可能提供任何额外益处,但舒巴坦-杜洛巴坦是一个明显的例外(问题5.2)。
问题5.9:利福霉素类药物在治疗CRAB引起的感染中发挥什么作用?
建议方案:不建议使用利福平或其他利福霉素类药物治疗CRAB感染。
理由
利福霉素类抗生素包括利福平、利福布汀和利福喷汀等药物,它们能抑制细菌的RNA聚合酶682。数据表明,在体外和动物模型中,利福布汀对鲍曼不动杆菌均有强大的活性,其活性显著高于利福平所展现的活性683-685。
由于多粘菌素能够破坏细菌膜的通透性,这可能有助于利福霉素穿透细胞并随后抑制细菌蛋白质的合成,因此有人提出利福布汀与多粘菌素之间存在协同作用684。
三项临床试验比较了单独接受黏菌素与黏菌素联合利福平治疗的CRAB感染患者的临床结局(问题5.4)572-574。这些试验均未显示加用利福平能带来生存获益。诚然,所有这些试验都存在局限性,包括黏菌素剂量不理想和样本量小。目前尚不清楚如果用利福布汀替代利福平是否会观察到临床获益686。鉴于已知的利福霉素相关毒性和药物相互作用687,以及临床试验中未观察到获益,专家组不赞成将利福霉素用作CRAB治疗的组成部分。
问题5.10:雾化抗生素在治疗CRAB引起的呼吸道感染中起什么作用?
建议方案:不建议将雾化抗生素用于治疗由CRAB引起的呼吸道感染。
理由
关于雾化抗生素治疗革兰氏阴性肺炎的临床有效性,观察性研究得出了相互矛盾的结果509-536。至少有三项随机试验评估了革兰氏阴性呼吸机相关性肺炎患者使用雾化抗生素与安慰剂的治疗效果。这三项试验均允许治疗医师根据 discretion 使用全身性抗生素。简而言之,第一项试验比较了100例肺炎成人患者(65%由鲍曼不动杆菌引起)接受雾化黏菌素与安慰剂治疗的效果537;第二项试验比较了142例肺炎成人患者(20%由鲍曼不动杆菌引起)接受雾化阿米卡星/磷霉素与安慰剂治疗的效果538;第三项试验比较了508例肺炎成人患者(29%由鲍曼不动杆菌引起)接受雾化阿米卡星与安慰剂治疗的效果539。这三项临床试验均未显示,在治疗呼吸机相关性肺炎时,使用雾化抗生素相较于安慰剂能改善临床结局或带来生存获益,包括在耐药病原体的亚组分析中也是如此537-539。
一项对13项试验的荟萃分析(涉及1733名患有呼吸机相关性肺炎的成年人)表明,接受雾化抗生素治疗的患者在生存率、重症监护病房住院时间缩短或呼吸机使用天数减少方面均未观察到获益。
这些试验中缺乏临床获益的原因尚不明确。在一项药代动力学/药效学(PK/PD)建模研究中,向危重症患者雾化递送多粘菌素前药,在肺部的上皮衬液中达到了较高的活性药物浓度541。然而,雾化抗生素可能无法充分渗透和/或分布到整个肺组织中,从而无法发挥显著的杀菌活性542,这可能部分是由于使用了非肠道制剂,而这些制剂并非专为在喷射雾化器等不理想的递送装置中吸入而设计543,544。专业学会对于雾化抗生素作为静脉抗生素辅助治疗的作用存在意见分歧545-547。鉴于临床试验中未观察到获益、对感染肺组织中药物分布不均的担忧,以及对接受雾化抗生素治疗的患者出现支气管痉挛等呼吸系统并发症的担忧,专家组不建议将雾化抗生素用作CRAB肺炎的辅助治疗548。
第6节:嗜麦芽窄食单胞菌
嗜麦芽窄食单胞菌是一种需氧、不发酵葡萄糖的革兰氏阴性杆菌,在水环境中广泛存在<sup>688</sup>。该菌的命名长期以来不断变化,系统发育也较为复杂<sup>689-691</sup>。尽管一般认为其致病性不及许多其他医院内感染菌,但嗜麦芽窄食单胞菌会产生生物膜和毒力因子,使其能够在易感宿主中定植或引发感染,例如患有基础肺部疾病者、注射吸毒者以及血液系统恶性肿瘤患者<sup>692</sup>。
嗜麦芽窄食单胞菌(S. maltophilia)感染带来的管理挑战与CRAB感染类似。首先,尽管嗜麦芽窄食单胞菌(S. maltophilia)有可能引发严重疾病,但往往难以明确该菌(S. maltophilia)是定植菌还是真正的致病菌,尤其是在患有囊性纤维化或依赖呼吸机等基础肺部疾病的患者中693-697。嗜麦芽窄食单胞菌(S. maltophilia)常作为混合感染的一部分被检出,这进一步增加了是否需要针对该菌(S. maltophilia)进行靶向治疗的决策难度689,698。重要的是,嗜麦芽窄食单胞菌(S. maltophilia)可能是一种真正的致病菌,会导致显著的发病率和死亡率,特别是在血液系统恶性肿瘤患者中,它可能引发出血性肺炎或菌血症699-705。
其次,嗜麦芽窄食单胞菌(S. maltophilia)分离株携带的 antimicrobial 耐药基因和基因突变,阻碍了治疗方案的选择689,691,706。L1 金属β-内酰胺酶(MBL)和 L2 丝氨酸β-内酰胺酶使大多数常规β-内酰胺类药物对嗜麦芽窄食单胞菌(S. maltophilia)失效。L1 可水解青霉素类、头孢菌素类和碳青霉烯类药物,但不能水解氨曲南。L2 可水解广谱头孢菌素和氨曲南689。
嗜麦芽窄食单胞菌(S. maltophilia)通过染色体上的氨基糖苷类乙酰转移酶表现出对氨基糖苷类药物的固有耐药性707。此外,嗜麦芽窄食单胞菌(S. maltophilia)可积累多药外排泵,从而降低复方新诺明(TMP-SMX)、四环素类和氟喹诺酮类药物的活性,其染色体上的Smqnr基因还会进一步降低氟喹诺酮类药物的疗效708-711。
第三,目前尚无明确的用于比较各种治疗方案疗效的嗜麦芽窄食单胞菌(S. maltophilia)感染的“标准治疗”抗生素方案712。缺乏比较常用于治疗嗜麦芽窄食单胞菌(S. maltophilia)的药物疗效的临床试验。关于在对嗜麦芽窄食单胞菌(S. maltophilia)具有体外活性的药物中进行优先排序,以及确定常用联合治疗方案的附加效益的数据仍不完整。
最后,嗜麦芽窄食单胞菌的抗菌药物敏感性试验(AST)测定存在问题。临床和实验室标准协会(CLSI)已针对六种抗嗜麦芽窄食单胞菌药物制定了折点:头孢地尔、氯霉素、左氧氟沙星、米诺环素、替卡西林-克拉维酸以及复方磺胺甲噁唑(TMP-SMX)。截至2023年,CLSI已不再提供头孢他啶的折点,且头孢他啶不再被视为治疗嗜麦芽窄食单胞菌感染的有效选择16。替卡西林-克拉维酸已停止生产,而氯霉素由于存在显著毒性,在美国也极少使用713,因此目前仅有四种药物可向临床医生提供可解读的抗生素最低抑菌浓度(MIC)数据。对于剩余的几种药物,其MIC解释标准的可信度受到以下因素的挑战:临床实验室常用检测方法所测得MIC的重现性存在问题714,715;用于确定大多数药物折点的药代动力学/药效学(PK/PD)数据有限;以及用于确定MIC与临床结局相关性的数据不足。本指南文件侧重于中重度嗜麦芽窄食单胞菌感染的治疗。
问题6.1:治疗由嗜麦芽窄食单胞菌引起的感染的一般方法是什么?
建议方案:以下两种方案均为治疗嗜麦芽窄食单胞菌感染的首选选择:(1)使用以下两种药物:头孢地尔、米诺环素、复方磺胺甲噁唑(TMP-SMX)或左氧氟沙星;(2)头孢他啶-阿维巴坦与氨曲南联合使用。
理由
鉴于在培养物中分离出的嗜麦芽窄食单胞菌通常代表定植而非感染,因此谨慎地区分嗜麦芽窄食单胞菌定植与感染,以避免不必要的抗生素使用,这一点十分重要。在嗜麦芽窄食单胞菌感染的情况下,建议采用以下两种方法中的任意一种。一种选择是联合使用至少两种活性药物(即头孢地尔、米诺环素、复方新诺明或左氧氟沙星)——按偏好顺序列出——至少持续到观察到临床改善为止,这主要是因为任何单一药物的支持性数据都有限(问题6.2、6.4至6.6)。另一种选择是使用头孢他啶-阿维巴坦联合氨曲南,但需注意支持这种联合用药的临床数据有限(问题6.3)。
多项研究表明,与单药治疗相比,联合使用被认为对嗜麦芽窄食单胞菌(S. maltophilia)具有体外活性的药物(包括头孢地尔、米诺环素、复方新诺明和氟喹诺酮类药物)能提高对该菌的杀灭效果716-719。比较单药治疗和联合治疗临床结局的数据存在矛盾,且仅限于观察性研究,这些研究存在选择偏倚、样本量小以及患者、微生物和治疗特征存在显著异质性等问题712,720-722。一项针对307例嗜麦芽窄食单胞菌(S. maltophilia)肺炎患者的多中心观察性研究发现,与单药治疗(主要为复方新诺明或莫西沙星或左氧氟沙星)相比,联合治疗(主要为复方新诺明联合莫西沙星或左氧氟沙星)并未降低总体30天死亡率,但在免疫功能低下患者和重症患者中与死亡率降低相关723。如问题6.2、6.4至6.6所述,头孢地尔、米诺环素、复方新诺明和左氧氟沙星单药使用时,要么存在令人担忧的药代动力学/药效学数据,要么临床数据有限。专家组倾向于采用联合治疗来治疗嗜麦芽窄食单胞菌(S. maltophilia)感染,至少在患者临床症状有所改善之前应如此。
问题6.2:头孢地尔在治疗由嗜麦芽窄食单胞菌引起的感染中起到什么作用?
建议方案:头孢地尔作为联合疗法的组成部分,至少在观察到临床改善前,是治疗嗜麦芽窄食单胞菌感染的首选药物。
理由
surveillance研究表明,嗜麦芽窄食单胞菌(S. maltophilia )分离株对头孢地尔的敏感性接近100%,即使是对其他常用处方药物耐药的分离株也是如此411,413,664,718,724,725。美国临床和实验室标准协会(CLSI)针对头孢地尔抗嗜麦芽窄食单胞菌(S. maltophilia)仅设定了敏感折点,因为对头孢地尔不敏感的嗜麦芽窄食单胞菌(S. maltophilia )分离株数量极少16。值得注意的是,尽管在患者分离株中尚未发现嗜麦芽窄食单胞菌(S. maltophilia )对头孢地尔耐药性的出现,但在体外模型中已发现了耐头孢地尔的嗜麦芽窄食单胞菌(S. maltophilia )突变体,其临床意义仍不明确726,727。
中性粒细胞减少症大腿和肺部动物感染模型显示,头孢地尔对嗜麦芽窄食单胞菌具有强大的活性,并表明使用模拟人体给药时,其对嗜麦芽窄食单胞菌的体内疗效似乎与体外疗效相关671,728-730。在一项采用模拟人体剂量头孢地尔的中性粒细胞减少症兔嗜麦芽窄食单胞菌肺炎模型中,头孢地尔能够清除肺组织中的嗜麦芽窄食单胞菌,而甲氧苄啶-磺胺甲噁唑(TMP-SMX)治疗组则存在残留细菌730。此外,头孢地尔治疗组兔子的存活率为87%,而TMP-SMX治疗组兔子的存活率为25%。未治疗的兔子均未存活。
一项评估头孢地尔在碳青霉烯类耐药感染中作用的临床试验纳入了5例嗜麦芽窄食单胞菌(S. maltophilia)感染患者230,731。这5例患者均被分配至头孢地尔组,因此无法对不同治疗方案进行比较。5例患者中有4例死亡。若将分析限定于3例无鲍曼不动杆菌(A. baumannii)合并感染的嗜麦芽窄食单胞菌(S. maltophilia)感染患者,则3例中有2例死亡。评估头孢地尔治疗嗜麦芽窄食单胞菌(S. maltophilia)感染作用的其他临床数据仅限于病例报告,但有多项报告显示,在传统方案治疗失败后使用头孢地尔可获得良好结局732-737。尽管临床数据有限,但药代动力学/药效学(PK/PD)数据738以及动物模型研究671,728-730均表明,头孢地尔用于治疗嗜麦芽窄食单胞菌(S. maltophilia)感染的前景十分可观。目前尚无数据指导头孢地尔应作为联合治疗的组成部分还是单药治疗使用。鉴于头孢地尔治疗嗜麦芽窄食单胞菌(S. maltophilia)感染的临床经验有限,专家组建议,至少在观察到临床改善之前,可考虑将头孢地尔作为联合治疗的组成部分。
问题6.3:头孢他啶-阿维巴坦和氨曲南在治疗由嗜麦芽窄食单胞菌引起的感染中起到什么作用?
建议方案:头孢他啶-阿维巴坦联合氨曲南是治疗嗜麦芽窄食单胞菌感染的首选方案。
理由
头孢他啶-阿维巴坦与氨曲南(其作用类似于氨曲南-阿维巴坦)联合使用,可克服嗜麦芽窄食单胞菌(S. maltophilia)固有的L1和L2β-内酰胺酶的活性691,739-744。L1金属β-内酰胺酶可水解头孢他啶,但不能水解氨曲南。L2丝氨酸β-内酰胺酶可水解头孢他啶和氨曲南,但会被阿维巴坦灭活。因此,头孢他啶-阿维巴坦与氨曲南联合使用,可使氨曲南避开灭活作用,成功到达嗜麦芽窄食单胞菌(S. maltophilia)的目标青霉素结合蛋白。监测数据表明,氨曲南-阿维巴坦对约92%的嗜麦芽窄食单胞菌(S. maltophilia)分离株具有活性739,740,742,743。尽管该方案用于治疗嗜麦芽窄食单胞菌(S. maltophilia)感染的临床数据有限741,745-747,但头孢他啶-阿维巴坦与氨曲南联合使用280,282仍是治疗嗜麦芽窄食单胞菌(S. maltophilia)感染的首选方案。头孢他啶-阿维巴坦与氨曲南联合用药的给药策略在表1(Table 1)和补充材料( Supplemental Material)中进行了综述280-282。应密切监测患者的肝酶升高情况,在一项1期研究中,约40%的患者出现了这种情况283。临床和实验室标准协会(CLSI)认可使用肉汤纸片洗脱法来评估嗜麦芽窄食单胞菌(S. maltophilia)分离株对头孢他啶-阿维巴坦与氨曲南联合用药的敏感性16,277。
问题6.4:四环素衍生物在治疗由嗜麦芽窄食单胞菌引起的感染中起到什么作用?
建议方案:高剂量米诺环素作为联合疗法的一部分,是治疗嗜麦芽窄食单胞菌感染的一种选择。
理由
监测研究报告显示,米诺环素对约70%-90%的嗜麦芽窄食单胞菌分离株具有活性719,748-750。这些数据是使用≤4 µg/mL的米诺环素敏感性折点生成的。2023年,CLSI将嗜麦芽窄食单胞菌的米诺环素折点从≤4 µg/mL降至≤1 µg/mL16(表2),对米诺环素敏感的嗜麦芽窄食单胞菌分离株比例将会下降。在四环素衍生物中,CLSI折点仅适用于米诺环素16。在中性粒细胞减少的小鼠大腿模型中,对于MIC为1 µg/mL的微生物,每12小时静脉注射200 mg米诺环素达到与细菌停滞相关的PK/PD目标的概率>90%,但达到与1-log杀灭相关目标的概率仅为50%751。
关于四环素衍生物在治疗嗜麦芽窄食单胞菌感染中作用的临床结局数据,其解读存在一定难度。已有多项观察性研究开展,但这些研究存在样本量小、使用标准剂量而非高剂量米诺环素或替加环素、缺乏对照组、感染部位异质性大或联合使用其他抗生素等局限性752-756。包含对照组的研究显示,与复方磺胺甲噁唑(TMP-SMX)或氟喹诺酮类药物相比,四环素衍生物并未出现任何明显的治疗失败信号。
尽管在解读现有临床数据方面存在局限性,但专家组认为,当高剂量米诺环素作为联合疗法的一部分给药时,可作为嗜麦芽窄食单胞菌感染的一种治疗选择。由于米诺环素在体外数据、药代动力学/药效学数据方面略占优势,且具有口服制剂,耐受性可能也优于替加环素,因此专家组更倾向于使用米诺环素。
关于依拉环素在对抗嗜麦芽窄食单胞菌中作用的体外和体内数据较为稀少。
奥玛环素是一种具有口服和静脉制剂的四环素衍生物,与其他四环素衍生物相比,其在体外对嗜麦芽窄食单胞菌(maltophilia)的活性有限748。专家小组不建议使用依拉环素或奥玛环素治疗嗜麦芽窄食单胞菌(S. maltophilia)感染。
人们对四环素衍生物普遍存在的一个担忧是,它们在给药后会迅速分布到组织中,导致尿液和血清中的浓度有限39。因此,不建议将其用于嗜麦芽窄食单胞菌(S. maltophilia)引起的尿路感染,在用于治疗血流感染时,应谨慎使用且需作为联合疗法的一部分。据报道,接受米诺环素或替加环素治疗的患者中,有20%-40%会出现恶心和呕吐症状353-355。
问题6.5:复方新诺明在治疗由嗜麦芽窄食单胞菌引起的感染中起到什么作用?
建议方案:复方新诺明(TMP-SMX)作为联合疗法的一部分,是治疗嗜麦芽窄食单胞菌(S. maltophilia)感染的一种选择。
理由
监测研究一致表明,复方新诺明(TMP-SMX)对嗜麦芽窄食单胞菌(S. maltophilia)的体外活性可能性超过90%757,758,不过人们日益认识到,存在对复方新诺明耐药的嗜麦芽窄食单胞菌(S. maltophilia)分离株718,757,759,760。尽管在使用复方新诺明治疗嗜麦芽窄食单胞菌(S. maltophilia)感染方面有长期的临床经验,但多项药代动力学/药效学(PK/PD)研究显示,无论复方新诺明的剂量如何,其对嗜麦芽窄食单胞菌(S. maltophilia)都没有杀菌作用,即便对于甲氧苄啶(TMP)最低抑菌浓度(MIC)较低的菌株也是如此716,718,719,761,762。复方新诺明充其量可能对嗜麦芽窄食单胞菌(S. maltophilia)具有抑制其生长的潜力。
这与大肠杆菌等微生物形成对比,在类似暴露条件下,当存在复方新诺明(TMP-SMX)时,至少可以观察到1个数量级的杀灭效果761。一些体外研究表明,当复方新诺明作为联合疗法的一部分使用时,更有可能可靠地实现抑菌作用,甚至可能达到1个数量级的杀灭效果716,719。
在嗜中性粒细胞减少的兔肺嗜麦芽窄食单胞菌模型中,每日两次5 mg/kg的剂量减少了肺组织中嗜麦芽窄食单胞菌的负荷,但并未根除该细菌。相比之下,头孢地尔实现了细菌的完全清除730。此外,接受复方新诺明治疗的兔子存活率仅为25%,而接受头孢地尔治疗的兔子存活率为87%。
关于复方新诺明(TMP-SMX)治疗嗜麦芽窄食单胞菌(S. maltophilia)感染有效性的严谨临床数据较为缺乏。一项观察性研究利用行政数据库开展,纳入了1581例从呼吸道或血液培养中检出嗜麦芽窄食单胞菌(S. maltophilia)并接受复方新诺明或左氧氟沙星单药治疗的患者763。该研究表明,对于从呼吸道培养中检出嗜麦芽窄食单胞菌(S. maltophilia)的患者,与左氧氟沙星相比,使用复方新诺明治疗可能与死亡率升高相关,且复方新诺明治疗与住院时间延长相关。然而,这项研究存在显著局限性,使其结果难以解读(例如,研究间隔时间长[2005-2017年],期间临床实践可能发生了许多变化;无法区分定植与感染;无法调整源头控制;药敏试验数据不完整;纳入了混合感染病例;存在因适应症导致的残余混杂因素)。鉴于这些局限性,其对指导临床实践的适用性尚不明确。
在本研究发表之前,评估复方新诺明(TMP-SMX)治疗效果的最大规模研究是一项包含91例嗜麦芽窄食单胞菌(S. maltophilia)血流感染患者的病例系列研究,其中14天内的死亡率为25%722。该研究中接受非复方新诺明药物治疗的患者数量较少,无法进行疗效比较评估。已有几项规模相对较小的观察性研究对复方新诺明与其他药物(即四环素衍生物或氟喹诺酮类药物)进行了比较,这些研究总体显示不同治疗药物的疗效相近752,754,764-769。
鉴于复方磺胺甲噁唑(TMP-SMX)的毒性(例如,超敏反应、高钾血症、骨髓抑制、肾毒性)、尚未确立的剂量-反应关系⁷⁶¹、缺乏支持特定剂量的临床证据,以及有证据表明甲氧苄啶(TMP)剂量超过15 mg/kg/天可能会增加不良事件风险,且无额外临床获益⁷⁷⁰,对于嗜麦芽窄食单胞菌(S. maltophilia)感染患者,建议使用的复方磺胺甲噁唑(TMP/SMX)剂量范围为10-15 mg/kg(以甲氧苄啶成分计)(表1)。10-15 mg/kg/天的剂量应能对大多数敏感菌株起到抑菌作用。复方磺胺甲噁唑联合第二种药物使用时,可作为嗜麦芽窄食单胞菌(S. maltophilia)感染的治疗选择。
问题6.6:氟喹诺酮类药物在治疗由嗜麦芽窄食单胞菌引起的感染中起什么作用?
建议方案:左氧氟沙星作为联合疗法的组成部分,是治疗嗜麦芽窄食单胞菌感染的一种选择。
理由
嗜麦芽窄食单胞菌分离株常携带Smqnr耐药决定因子,这些因子会干扰氟喹诺酮类药物与促旋酶和拓扑异构酶的结合,导致氟喹诺酮类药物的最低抑菌浓度(MIC)升高691,708。由于多药耐药外排泵的过度表达,氟喹诺酮类药物的MIC可能会进一步升高757,771-773。在监测研究中,嗜麦芽窄食单胞菌对左氧氟沙星的基线敏感性百分比约为30%至80%不等718,719,774,775。多项研究表明,对左氧氟沙星敏感的嗜麦芽窄食单胞菌分离株在治疗过程中可能会出现左氧氟沙星MIC升高的情况765,766,768,776。临床和实验室标准协会(CLSI)制定了左氧氟沙星针对嗜麦芽窄食单胞菌的折点,但未制定环丙沙星或莫西沙星的折点16。2023年,CLSI在左氧氟沙星折点旁添加了一条注释,指出对于嗜麦芽窄食单胞菌感染,“不应单独使用左氧氟沙星进行抗菌治疗”16。
评估环丙沙星、左氧氟沙星和莫西沙星单药治疗的时间杀菌曲线通常表明,这些药物不足以持续抑制嗜麦芽窄食单胞菌的生长749,777-780,但表明左氧氟沙星和莫西沙星作为联合治疗的组成部分可能具有足够的活性718,719。药代动力学/药效学(PK/PD)模型数据表明,即使高剂量给药,氟喹诺酮类单药治疗也可能不足以实现嗜麦芽窄食单胞菌感染的适当目标达成率749。中性粒细胞减少小鼠模型表明,对于大量最低抑菌浓度(MIC)值在野生型分布范围内的嗜麦芽窄食单胞菌分离株,即使每日静脉注射750mg左氧氟沙星,也可能无法可靠地达到与细菌停滞或1-log杀灭相关的PK/PD目标781。在出血性嗜麦芽窄食单胞菌肺炎小鼠模型中,与安慰剂组(0%)相比,左氧氟沙星和莫西沙星均与存活率提高(50%)相关782。综上所述,这些数据表明,氟喹诺酮类药物作为单药治疗可能无法提供足够的益处,但作为联合治疗的组成部分给药时可能具有一定的附加价值。
评估氟喹诺酮类药物治疗嗜麦芽窄食单胞菌临床感染的临床数据主要集中在左氧氟沙星上。一项荟萃分析纳入了14项观察性研究中的663名患者,比较了氟喹诺酮类药物与复方新诺明(TMP-SMX)的死亡率,约50%的患者接受氟喹诺酮类药物(包括环丙沙星[34%]和左氧氟沙星[57%]),50%的患者接受复方新诺明764。汇总氟喹诺酮类药物的数据后,与复方新诺明相比,氟喹诺酮类药物在降低死亡率方面似乎有轻微的显著差异,据报道,接受氟喹诺酮类药物治疗的患者死亡率为26%,而接受复方新诺明治疗的患者死亡率为33%。当将分析限定于嗜麦芽窄食单胞菌血流感染患者(在这类患者中,区分定植和感染的问题较少)时,使用氟喹诺酮类药物的益处并不明显。
如问题6.4中所讨论的,研究人员利用一个管理数据库,对1581名在呼吸道或血液培养中发现感染嗜麦芽窄食单胞菌并接受复方新诺明(TMP-SMX)或左氧氟沙星治疗的患者进行了一项观察性研究763。尽管这项研究表明,对于从呼吸道培养中检出嗜麦芽窄食单胞菌的患者,左氧氟沙星可能具有降低死亡率的保护作用,且无论培养部位如何,其在降低死亡率方面都有一定的保护作用,但该研究存在局限性,使其结果难以解读。
几项将氟喹诺酮类药物与其他药物(即复方新诺明、替加环素)进行比较的观察性研究并未发现氟喹诺酮组的临床失败信号增加749,759,763。这些研究存在一些局限性,包括选择偏倚、样本量小、宿主和微生物数据的异质性以及额外活性药物的使用。
由于氟喹诺酮类单药治疗在体外研究中效果欠佳、已知的嗜麦芽窄食单胞菌(S. maltophilia )对氟喹诺酮类药物的耐药机制、在动物模型中达到与细菌生长停滞或1-log杀灭效果相关的全身暴露量的概率相对较低、治疗期间耐药性的出现以及观察性数据中存在的固有偏倚,专家组建议,当开具左氧氟沙星用于治疗嗜麦芽窄食单胞菌(S. maltophilia )感染时,应将其作为联合治疗的一部分。由于环丙沙星和莫西沙星缺乏折点,专家组建议在氟喹诺酮类药物中优先使用左氧氟沙星。开具该药物时,应考虑氟喹诺酮类药物使用相关的不良事件,以及在左氧氟沙星治疗期间可能出现的耐药性嗜麦芽窄食单胞菌(S. maltophilia )分离株783。
问题6.7:头孢他啶在治疗由嗜麦芽窄食单胞菌引起的感染中起到什么作用?
建议方案:由于嗜麦芽窄食单胞菌(S. maltophilia)本身存在β-内酰胺酶基因,这些基因可能会使头孢他啶失效,因此头孢他啶不被推荐作为嗜麦芽窄食单胞菌(S. maltophilia)感染的治疗选择。截至2024年,临床和实验室标准协会(CLSI)关于嗜麦芽窄食单胞菌(S. maltophilia)对头孢他啶的折点已不再提供。
理由
专家组不建议开具头孢他啶用于治疗嗜麦芽窄食单胞菌感染,因为内在的L1和L2β-内酰胺酶预计会使其失效。体外模型显示,头孢他啶无法显著抑制嗜麦芽窄食单胞菌的生长719。评估头孢他啶治疗嗜麦芽窄食单胞菌感染疗效的对比研究几乎不存在784。截至2024年,美国临床和实验室标准协会(CLSI)已不再设定头孢他啶针对嗜麦芽窄食单胞菌的药敏折点。
结论
抗生素耐药性(AMR)领域发展迅速且不断变化,抗生素耐药性感染的治疗仍将持续给临床医生带来挑战。随着针对耐药病原体的新型抗生素被应用于临床实践,我们对其有效性和耐药倾向有了更多了解。本治疗指南将每年更新一次,可在以下网址获取:https://www.idsociety.org/practice-guideline/amr-guidance/。
注释
致谢
专家小组衷心感谢科尼利厄斯·J·克兰西、塞缪尔·L·艾特肯和大卫·范杜因对本指导文件早期版本所做的所有贡献。没有他们的帮助,本指导文件的制定是不可能的。
利益冲突摘要
以下清单包含已向IDSA报告的内容。为确保完全透明,IDSA要求全面披露所有关系,无论其与指南主题是否相关。对这类关系是否构成潜在利益冲突的评估,由一套审查流程决定,其中包括由董事会派驻标准与实践指南委员会的联络人进行评估,必要时还会由利益冲突与伦理委员会参与评估。对已披露关系是否存在潜在利益冲突的评估,基于财务关系的相对权重(即金额大小)以及该关系的相关性(即独立观察者可能会将某一关联合理解读为与所考虑的主题或建议相关的程度)。IDSA要求专家组成员披露与以下方面相关的活动及财务关系/投资:咨询/顾问角色、推广演讲团、股票/债券、酬金、专家证词、所有权权益、研究资助、组织福利、知识产权、其他报酬、与其他组织的活动,以及家庭成员的相关经济利益。读者在查阅这份披露清单时应注意这一点。
太平洋夏令时间(P.D.T.)报告无利益披露。E.L.H.担任Lexi-Comp的科学顾问;担任《临床传染病》杂志的副主编;获得马里兰州卫生部门的研究资金。J.J.担任盐野义的科学顾问;获得传染病药剂师协会的研究资金;曾担任吉利德科学的科学顾问;获得临床护理选择公司的酬金;持有Vaxart的股票。A.J.M.担任Cepheid、DayZero Diagnostics和OpGen的科学顾问;获得美国疾病控制与预防中心、食品药品监督管理局和国家卫生研究院的研究资金;为由生物梅里埃公司赞助、面向法国大使馆的活动提供专家证词。M.J. S.获得默克、生物梅里埃、SNIPRBiome、Selux Diagnostics的研究资金;获得艾伯维的报酬;担任艾伯维的数据和安全监测委员会成员;获得盐野义的咨询费,并曾担任Spero Therapeutics的数据和安全监测委员会成员。R.A.B.获得国家过敏和传染病研究所、疾病控制与预防中心、退伍军人事务部以及退伍军人健康管理局优异奖的研究资金;担任退伍军人健康管理局优异奖的临床科学家研究员;获得Venatorx制药公司的研究资金;曾获得盐野义、默克、Entasis Therapeutics、Wockhardt、Allecra Therapeutics、阿斯利康、哈林顿家族基金会、Tetraphase制药、Steris和Melinta Therapeutics的研究资金;获得Unilab的酬金。
所有作者均已提交《国际医学期刊编辑委员会潜在利益冲突披露表》。编辑们认为与稿件内容相关的冲突已予以披露。
参考文献
完整的参考文献列表,请点击此处。
补充材料
出版物免责声明
© IDSA <2024>。保留所有权利。未经事先书面许可,或未经法律明确允许、获得许可或根据与相关复制权组织达成的条款,本出版物的任何部分均不得以任何形式或通过任何方式复制、存储在检索系统中、传输、用于文本和数据挖掘或用于训练人工智能。如需商业再利用,请联系reprints@oup.com获取重印本及重印本的翻译权。所有其他许可可通过《临床传染病》中本文的许可链接,通过牛津大学出版社RightsLink服务获取。如需更多信息,请联系journals.permissions@oup.com。
Hits: 109
- 心脏病成人的疫苗接种指南
- 用于检测治疗性蛋白制品的免疫原性的检测法开发和验证行业指南
- 肺部疾病成人的疫苗接种指南
- 快速响应:截至 2024 年 12 月在非大流行背景下人类接种禽流感疫苗的初步指南
- 糖尿病成人的疫苗接种指南
- 慢性肝病或慢性肝脏感染成人的疫苗接种指南
- 人类免疫缺陷病毒(HIV)感染者成人疫苗接种指南
- 65 岁及以上成人流感疫苗接种补充指南
- 2013 年美国感染病学会(IDSA)免疫功能低下人群疫苗接种临床实践指南
- 针对公共卫生紧急情况的猴痘检测政策
- 卫生保健机构手部卫生指南
- 环境感染控制指南 保健设施
- 2025 年 4 月 30 日的 NACI 声明摘要:关于 2025-2026 年季节性流感疫苗的声明
- 更新了老年人呼吸道合胞病毒 (RSV) 疫苗指南,包括扩大 RSVPreF3 在 50-59 岁人群中的使用以及使用新的 mRNA-1345 疫苗
- 孕期梅毒感染筛查:美国预防服务工作组重申建议声明
- 2025 年 5 月 14 日的 NACI 声明摘要:关于免疫功能低下成人带状疱疹疫苗接种的最新建议
- 2022 美国动物卫生协会犬类疫苗接种指南(2024年更新)
- 2020 年 AAHA/AAFP 猫科动物疫苗接种指南
- 2025 年 5 月 15 日的 NACI 声明摘要:关于使用 Imvamune 预防 mpox 的更新指南的快速响应
- 2025 年 2 月 13 日 NACI 声明摘要:关于麻疹暴露后预防的更新建议
- 从 2025 年 7 月 1 日起完成常规免疫接种计划(英国)
- 2025 年 1 月 10 日的 NACI 声明摘要:2025 年至 2026 年夏季 COVID-19 疫苗使用指南
- 麻疹暴露后预防更新建议的增编
- 使用 Imvamune 预防猴痘的更新指南
- 免疫功能低下成人带状疱疹疫苗接种的最新建议
- 推荐使用帕利珠单抗减少婴儿呼吸道合胞病毒感染的并发症
- 登革热防控方案(2025年版)
- 关于防止节肢动物叮咬的个人防护措施的声明 – 更新
- CATMAT 关于在 65 岁或以上人群中使用基孔肯雅热减毒活疫苗 (IXCHIQ) 的指南
- 关于在授权旅行者使用 QDENGA(登革热疫苗)的司法管辖区使用的建议
- 基于暴露的干预措施,用于管理整个生命周期中高度针头恐惧的个体:临床实践指南,呼吁进一步研究
- mRNA COVID-19 疫苗接种后患有心肌炎和心包炎的青少年的临床指南
- 归国国际旅客发热初步评估指南
- NACI 快速响应:在持续的猴痘疫情背景下更新了关于 Imvamune 的临时指南
- 关于管理耐多药沙门氏菌感染的临时指南
- 家长免疫接种指南
- 英国旅行者接种基孔肯雅热疫苗:JCVI 建议
- 针对 80 岁及以上成年人的呼吸道合胞病毒 (RSV) 免疫计划:JCVI 建议,2025 年 7 月 16 日
- JCVI 关于 2026年秋季和 2027 年春季 COVID-19 疫苗接种的声明
- CATMAT 关于播散性类圆线虫病的声明
- 成人免疫接种指南
- 针对呼吸道合胞病毒感染住院高风险婴幼儿的帕利珠单抗预防更新指南
- 针对呼吸道合胞病毒感染住院高风险婴幼儿的帕利珠单抗预防
- JCVI 关于 2026 年至 2027 年流感疫苗的声明
- 有关打算探亲访友的国际旅客的声明摘要
- 青少年疫苗接种指南
- 免疫接种状态不确定或不完全的个人疫苗接种:2025 年 7 月 1 日起
- 从 2025 年 7 月 1 日起进行常规儿童免疫接种(2024 年 7 月 1 日出生的婴儿)
- 加拿大关于在疫苗短缺期间使用分次剂量黄热病疫苗的临时建议
- 寨卡病毒预防和治疗建议
- 带状疱疹免疫接种计划:医护人员资讯
- 带状疱疹疫苗接种指南
- 儿童和青少年接种COVID-19疫苗
- 印度旅行疫苗接种:2025 年循证健康指南
- 旅行者疟疾预防和治疗指南
- 登革热:给明智旅行者与移居者的详尽旅行指南
- 旅行者伤寒:预防和保护完整指南
- 美国儿科学会 2025 年 8 月 19 日发布的推荐18 岁及以下儿童与青少年免疫接种程序
- 隐藏的敌人:旅行者立克次体感染完整指南
- 心脏病发作症状:旅行者的基本医疗指南
- 真菌性皮肤感染:类型、治疗和预防完整指南
- 热带医学和旅行咨询委员会 (CATMAT) 关于国际旅行者和伤寒的声明
- 2025 年简明临床指南:ACC 关于成人免疫接种作为心血管护理一部分的专家共识声明:美国心脏病学会解决方案集监督委员会的报告
- 产科-妇科护理中的 COVID-19 疫苗接种注意事项
- 妊娠期流感:预防和治疗
- 母体呼吸道合胞病毒疫苗接种
- 疫苗预防和控制季节性流感:免疫实践咨询委员会的建议——美国,2025-26 年流感季节
- 用Clesrovimab预防婴儿严重呼吸道合胞病毒相关下呼吸道感染:免疫实践咨询委员会的建议 — 美国,2025年
- 健康怀孕指南
- 关于预防婴幼儿呼吸道合胞病毒感染的建议:政策声明
- 过敏反应定义、概述和临床支持工具:2024 年共识报告 – GA2LEN项目
- 人狂犬病免疫球蛋白(human rabies immunoglobulin, HRIG)使用临时建议
- 如何与我们的心脏病患者讨论成人疫苗接种
- 2025 年秋季疫苗指南
- 疫苗佐剂非临床研究技术指导原则
- 完整的常规免疫接种计划 英国 2025年9月1日期
- 2025 年至 2026 年国家流感免疫接种计划信函
- 恰加斯病:基本旅行指南
- 创新型疫苗临床试验申请申报资料要求
- 远离结核病的旅行者指南
- 更顺畅的免疫接种体验指南
- 您的免疫预约指南:充满信心地完成整个过程
- 联合疫苗临床前和临床研究技术指导原则
- 疫苗接种预约指南:预期事项与准备方法
- 旅行时如何保护儿童免受水痘侵害:专家指南
- 家长互联网免疫接种信息指南
- 您的无缝免疫接种与健康服务指南
- 2025年病毒爆发与旅行警告:专家友好指南
- 结合疫苗质量控制和临床研究技术指导原则
- 预防用含铝佐剂疫苗技术指导原则
- 生物制品稳定性研究技术指导原则(试行)
- 常见传染病的暴露后预防
- 无缝接种预约指南
- 开发用于预防全球传染病的疫苗的一般原则
- 关于预防性疾病的联合疫苗评估:生产、测试和临床研究
- 关于组合疫苗及免疫学兽用药品(IVMPs)联合使用的指导原则
- 世界卫生组织关于疫苗非临床评价的指南
- 确保基于DT的组合疫苗的质量、安全和有效性的建议
- 沙特 疫苗生产和质量控制指南
- 疫苗接种预约指南:流程与准备事项
- 儿童与青少年疫苗接种时间指南
- 聚焦预防 | 美国心脏病学会简化心血管疾病免疫接种建议
- 精通疫苗接种诊所:提高效率与优化患者护理的内部指南
- 临床医生呼吸道疫苗共同临床决策指南
- 你的疫苗接种顺利体验指南
- 美国传染病学会关于A组链球菌性咽炎的临床实践指南更新
- 更顺畅疫苗接种体验终极指南
- 婴幼儿和青少年COVID-19疫苗接种建议:政策声明
- IDSA 2025年关于在免疫功能低下患者中使用疫苗预防季节性新冠病毒、流感和呼吸道合胞病毒感染的指南
- 无脾成人的疫苗接种指南
- 花生过敏预防的积极趋势:预防指南的实际影响
- 2025–2026年儿童流感预防与控制建议:技术报告
- 您的疫苗诊所指南:像专业人士一样导航系统
- 带状疱疹疫苗临床试验技术指导原则
- PIDS/IDSA 2023年儿童急性细菌性关节炎诊断和管理指南
- 预防节肢动物叮咬的个人防护措施声明
- 异维甲酸与疫苗诊所:保持防护的内部指南
- IDSA 2024年抗微生物药物耐药革兰氏阴性菌感染治疗指南
- 重组糖蛋白激素类产品药学研究与评价技术指导原则
- 流感病毒疫苗临床试验技术指导原则(征求意见稿)
- 重组表达单克隆抗体类生物制品制造及检定规程撰写指南(征求意见稿)
- 归国国际旅行者发热初始评估指南
- 中国流感疫苗预防接种技术指南(2025—2026)
- 成人癌症相关免疫抑制患者抗菌药物预防临床实践指南:ASCO/IDSA更新版
- 免疫功能低下旅行者
- 全国镰状细胞中心联盟关于镰状细胞病健康维护的共识建议共识声明
- 多联疫苗临床试验技术指导原则
- 曲霉病诊断和管理临床实践指南:IDSA 2016年更新版
- 养老院感染预防与控制多学会指南
- 关于跨国收养的声明
- 美国传染病学会 (IDSA) 发布的《念珠菌病管理临床实践指南:2016 年更新版》
- 流感疫苗完全指南
- IWGDF/IDSA糖尿病相关足部感染诊疗指南
- 热带病与旅行咨询委员会:老年旅行者声明
- 疫苗临床试验不良事件分级标准指导原则(修订版)
- ATS/CDC/IDSA临床实践指南:成人和儿童结核病的诊断
- 用于人乳头瘤病毒检测的自行收集阴道标本及筛查终止指南:美国癌症协会宫颈癌筛查指南更新
- 热带医学与旅行咨询委员会关于儿童旅行者的声明
- 成人导管相关性尿路感染的诊断、预防和治疗:美国传染病学会2009年国际临床实践指南
- HIVMA/IDSA 2014年更新版:HIV感染患者慢性肾病管理临床实践指南
- 对免疫状况不明或未完成的人员进行疫苗接种:自2026年1月1日起
- SHEA/IDSA 发布的《成人艰难梭菌感染管理临床实践指南:2021 年更新》
- 加拿大传染病报告:孕期旅行声明
- 成人和儿童艰难梭菌感染临床实践指南:美国医疗保健流行病学学会/美国感染病学会2017年更新版
- 关于旅行者与狂犬病疫苗的声明
- IDSA 2016 年球孢子菌病治疗临床实践指南
- 免疫接种者袖珍指南:孕期与哺乳期
- 成人社区获得性肺炎的诊断和治疗:美国胸科学会和美国传染病学会官方临床实践指南
- CATMAT 关于播散性粪类圆线虫病的声明:预防、评估和管理指南
- 3个月以上婴幼儿社区获得性肺炎的管理:儿科传染病学会和美国传染病学会临床实践指南
- 复杂性尿路感染(cUTI):治疗和管理临床指南
- 自行采集阴道标本用于人乳头瘤病毒检测及筛查退出指南:美国癌症协会宫颈癌筛查指南更新
- 旅行者结核病风险评估与预防
- IDSA 新型冠状病毒肺炎患者治疗和管理指南
- 热带病与旅行咨询委员会(CATMAT) 致旅行者及关于黄热病的声明
- 预防用疫苗佐剂药学研究技术指导原则(试行 )
- 隐球菌病治疗临床实践指南: 美国感染病学会2010年更新
- 儿童常规免疫接种计划
- ASM/ECMM/ISHAM 隐球菌病诊断和治疗全球指南
- 加拿大各省及地区婴幼儿常规(及补种)疫苗接种时间表(截至2025年12月)
- 美国儿科学会推荐的青少年及年轻成人疫苗
- IDSA 脑炎管理指南
- 加拿大各省和地区针对健康且先前已接种疫苗的成年人的常规疫苗接种计划
- 美国2026年儿童和青少年免疫接种计划建议
- 美国心脏协会成人感染性心内膜炎指南:诊断、抗菌治疗和并发症处理
- IDSA 2008 年老年长期护理机构居民发热和感染评估临床实践指南更新