Global burden of chikungunya virus infections and the potential benefit of vaccination campaigns
摘要
第一种针对基孔肯雅热病毒 (CHIKV) 的疫苗现已获得许可;然而,由于对潜在的全球负担了解有限,其减轻疾病负担的潜力仍然未知。我们使用来自血清阳性率研究、观察病例和蚊子分布的数据来量化 180 个国家和地区的潜在 CHIKV 负担,并探讨了疫苗接种活动的潜在影响。我们估计,104 个国家经历了 CHIKV 传播,覆盖 28 亿人,在流行环境中,疫情之间的平均持续时间为 6.2 年,每次疫情感染的易感人群为 8.4%。在全球范围内,每年有 3500 万例感染,主要在东南亚、非洲和美洲。假设疫苗对疾病的有效性为 70%,对感染的保护为 40%,那么在病毒传播的地点和时间为 50% 的 12 岁以上个体接种疫苗,每 100,000 剂疫苗将避免 4,436 例感染、0.34 例死亡和 17 例残疾调整生命年。这些发现凸显了基孔肯雅热的全球负担和 CHIKV 疫苗接种运动的潜力。
主要
基孔肯雅热病毒 (CHIKV) 属于 Togaviridae 家族的甲病毒属,主要由埃及伊蚊和白纹伊蚊通过人类扩增循环传播,其他蚊子种类在地方性动物病传播中也很重要1,2。人类感染的特征是皮疹和发热的急性症状。此外,据估计,大约 50% 的检测到的急性病例会发展为可持续数月的慢性关节疼痛3,4。基孔肯雅热影响所有年龄段的人,包括那些没有潜在健康并发症的人。大约每 1,000 例病例中就有 1 例导致死亡,主要发生在新生儿、婴儿和老年人中5,6。基孔肯雅热病例已在世界各地的热带和亚热带国家发现7。在许多地方,CHIKV 传播包括爆发后无传播期8、9、10。然而,也有地方性传播的报道8、9、11。几十年来,几乎没有有效的工具来对抗 CHIKV,流行病防范创新联盟 (CEPI) 的大量投资导致美国食品和药物管理局 (FDA) 和欧洲药品管理局 (EMA) 在美国和欧盟获得了第一批 CHIKV 疫苗的许可,即由 Valneva 和 VIMKUNYA 开发的 IXCHIQ (VLA1553), 由 Bavarian Nordic 开发12,13 。由于 CHIKV 流行病学的不可预测性,许可是通过保护相关性而不是传统的 3 期试验获得的。
该疫苗有可能减轻 CHIKV 感染的个人负担,并保护人群免受疫情的经济影响,由于慢性后遗症的长期和衰弱性质,这种影响可能相当大14。疫苗最佳部署的一个主要障碍是对世界各地 CHIKV 的潜在负担的了解有限,此外,对如何最好地部署疫苗的了解有限。是否使用疫苗的决定通常取决于疫苗投资案例,该案例量化了使用疫苗对避免的感染、病例和死亡数量的影响。然而,就 CHIKV 而言,人们对病毒的传播地点知之甚少,阻碍了投资案例的发展。帮助低收入国家购买疫苗的全球疫苗免疫联盟已将 CHIKV 疫苗列入学习议程,这意味着它认为没有足够的信息来就疫苗的可能影响做出明智的决定15。这种知识差距是由于对其他病原体(如登革热或流感)的频繁临床误诊以及获得确诊检测的机会有限16。此外,目前尚不清楚该病毒的流行性质是否意味着可以从库存中部署疫苗以应对检测到的疫情,而不是整合到免疫计划中。
为了量化 CHIKV 的全球负担和疫苗的潜在影响,我们进行了一项文献综述,以确定已发现疫情的国家,并利用关于伊蚊全球分布的现有知识来确定其他受影响的国家和面临风险的人群的潜在规模。然后,我们使用应用于年龄分层血清阳性率研究的数学模型来量化每个国家的年度感染、病例和死亡人数17。这使我们能够批判性地评估疫苗接种运动的潜在影响,以避免未来的感染、病例和死亡,为指导未来的疫苗部署提供证据基础。
结果
流通证据和风险人群比例
我们进行了一项文献综述,以确定曾经经历过基孔肯雅热本地传播的国家和地区(后来称为国家)。我们确定了 140 篇报道了来自 94 个国家/地区的 CHIKV 传播的参考文献,占所有考虑地点的 52%(图 D).1a 和补充表 1、2 和 4)。我们发现,一个国家是否曾经报告过 CHIKV 传播与该国埃及阿提阿輈(皮尔逊相关性:0.89)和白纹阿芥(皮尔逊相关性:0.82)的人口加权估计存在密切相关(图1b)18。
图 1:CHIKV 的局部循环和与载体存在的关联。
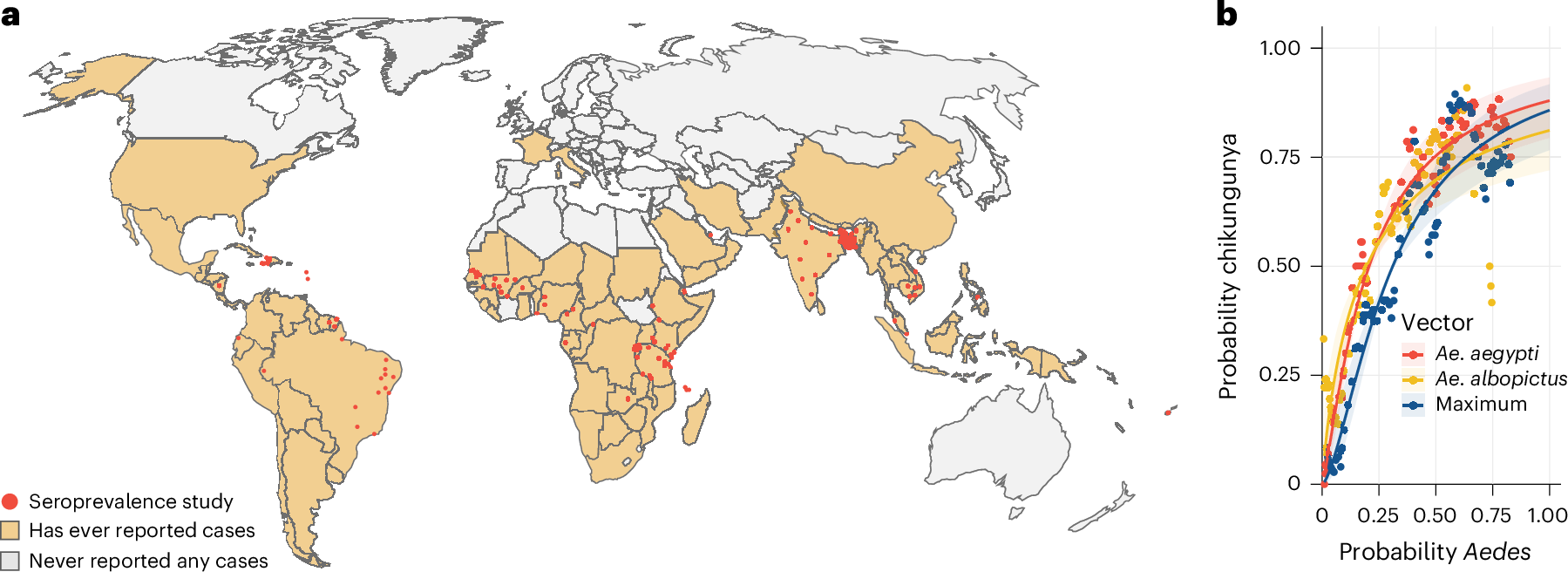
a,有 CHIKV 传播史和血清阳性率研究地点的国家。b, 一个国家埃及阿提亚蚊和白纹阿拉斯马蚊的平均估计发生率与该国曾经报道过 CHIKV 的概率之间的关系。伊蚊发生的概率是使用对全球 5 公里× 5 公里网格单元中蚊子分布的现有估计来计算的19.对于每个国家/地区,我们计算了该国的人口加权平均发生率(因此高密度地区的蚊子水平比低密度地区的蚊子水平提供更多的权重)。该图显示了在伊蚊发生率相似的地区报告过 CHIKV 疫情的国家/地区比例。我们分别考虑了埃及蚜蒿、白纹蚜蒿和“最大值”,即任何地点的埃及蚜蒿或白纹蚜蒿的最大值。这些线表示 Logistic 回归模型的拟合。
接下来,我们将国家分为“地方性”(每年都有本地传播的证据)或“流行性”(爆发频率较低),同时评估了证据的强度。我们用来定义流行病和地方病的标准见表 1。我们将 6 个国家归类为地方性传播:4 个在东非(肯尼亚、莫桑比克、卢旺达和坦桑尼亚),1 个在南美洲(巴西),1 个在亚洲(印度)。我们将另外 98 个国家归类为流行病(图 D).2 和扩展数据表 1)。其中,9 个(佛得角、东帝汶、厄立特里亚、冈比亚、几内亚比绍、科特迪瓦、南苏丹、斯威士兰和多哥)从未报告过病例,但它们的病媒水平很高,并且与邻国报告了传播。我们在 76 个国家/地区没有发现传播的证据。
表 1 用于按国家/地区定义流行病状况的标准。确诊病例是指经 PCR 或 IgM 确诊的病例
| 疫情状况 | 标准 |
|---|---|
| 地方性 – 良好证据 | 过去 5 年每年确诊的本土病例。在疾病监测较好的美洲,我们纳入了每年至少 1,000 例本地病例检测的标准。 |
| 地方性 – 证据不足 | 在过去 5 年中,至少有 3 年每年确诊本土病例和/或地方性传播的血清学证据。在疾病监测较好的美洲,我们纳入了每年至少 100 例检出病例的标准。 |
| 流行病 – 良好证据 | 自 2010 年以来的确诊病例 或 自 2010 年以来的传播血清学证据 |
| 流行病 – 证据不足 | 2010 年之前的确诊病例 或 2010 年之前传播的血清学证据 或 在 HAQ 低国家,没有确诊病例,但可能存在白纹比克图/埃及蚊 >0.5 |
| 无传播 – 证据充分 | 在 HAQ 高国家,没有确诊病例 或 在其他任何地方,没有确诊病例,可能存在白纹/埃及蚊 <0.1 |
| 无传播 – 证据质量差 | 无确诊病例,白纹/埃及蚊出现的可能性为 0.1-0.5 |
图 2:流行和流行国家地图以及证据级别定义如下。
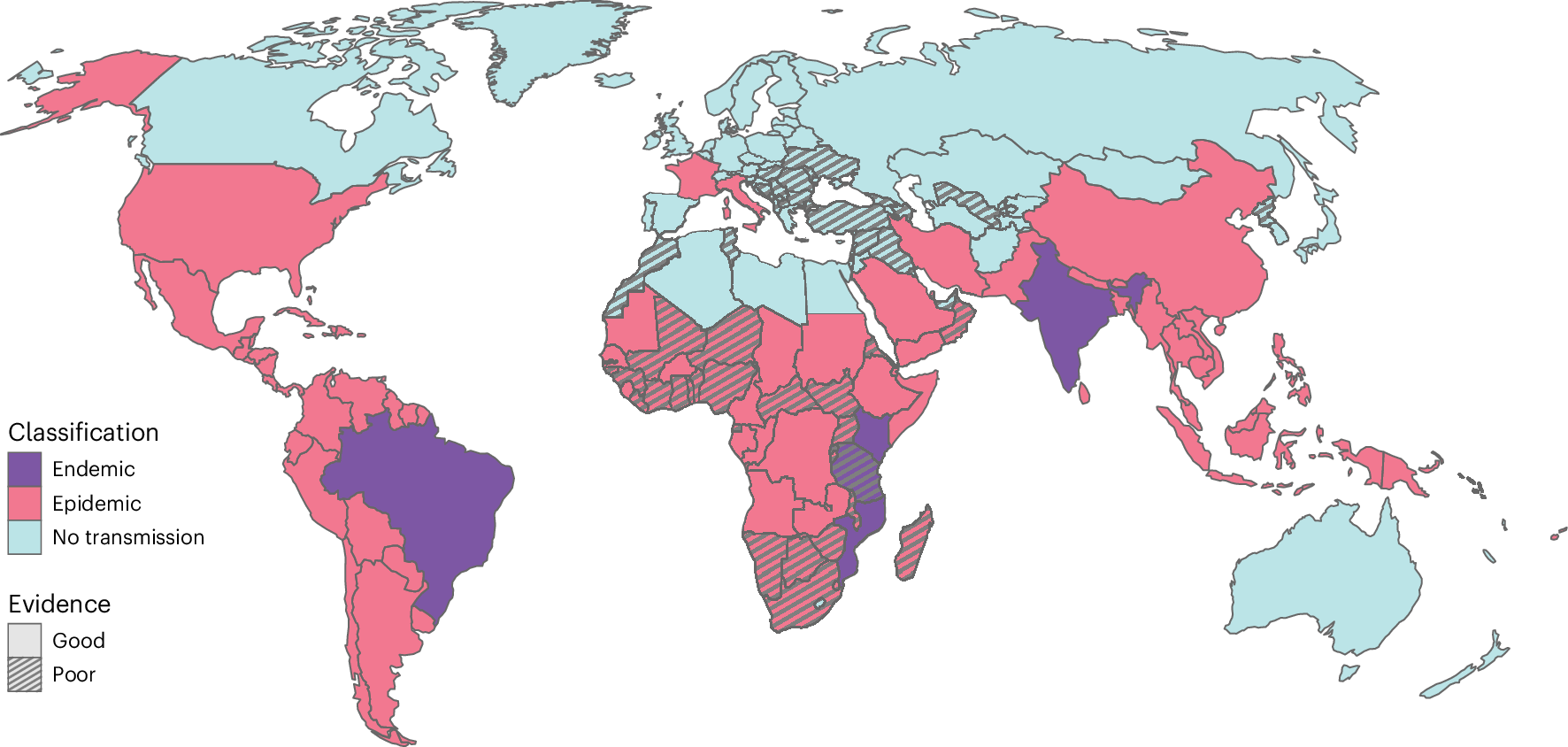
地方性流行:CHIKV 在该地区持续传播,每年都有感染发生。流行病:CHIKV 在该地区零星传播,爆发后数年未被发现传播。无传播:CHIKV 不在该地区传播。良好的证据:来自疾病监测和/或血清学数据和/或昆虫学数据的流行病学数据为给定的分类提供了强有力的证据。证据不足:流行病学、血清学和昆虫学数据不能为给定的可能分类提供强有力的证据。
使用描述世界人口分布特征的地图19、埃及 A。 aegypti 或 A。 albopictus 的分布18以及我们估计的媒介存在与 CHIKV 爆发风险之间的关联(图 D).1b),我们估计全球有 28 亿人生活在有 CHIKV 传播风险的地方(扩展数据图1)。
全球负担估计
为了估计流行和流行国家 CHIKV 传播的平均动态,我们接下来将血清催化模型与从 29 个国家收集的 49 项年龄特异性血清阳性率研究的结果拟合(扩展数据图 D).2 和补充表 2)。我们发现,在流行地区,易感人群的平均年感染概率为 0.024 (95% 置信区间 (CI):0.018-0.035),范围从 0.0017 到 0.074 在我们数据集中的 24 个不同流行地点。在流行环境中,平均年感染概率为 0.016 (95% CI: 0.013–0.024),各地范围为 0.0004 至 0.065。然而,我们发现,平均而言,大多数年份没有传播,每年爆发的概率为 0.16 (95% CI 0.13-0.20),相当于两次爆发之间的持续时间为 6.2 年 (95% CI: 5.1-7.6)。我们估计,在疫情爆发期间被感染的易感人群的平均百分比为 8.4% (95% CI: 7.2-9.1%)。
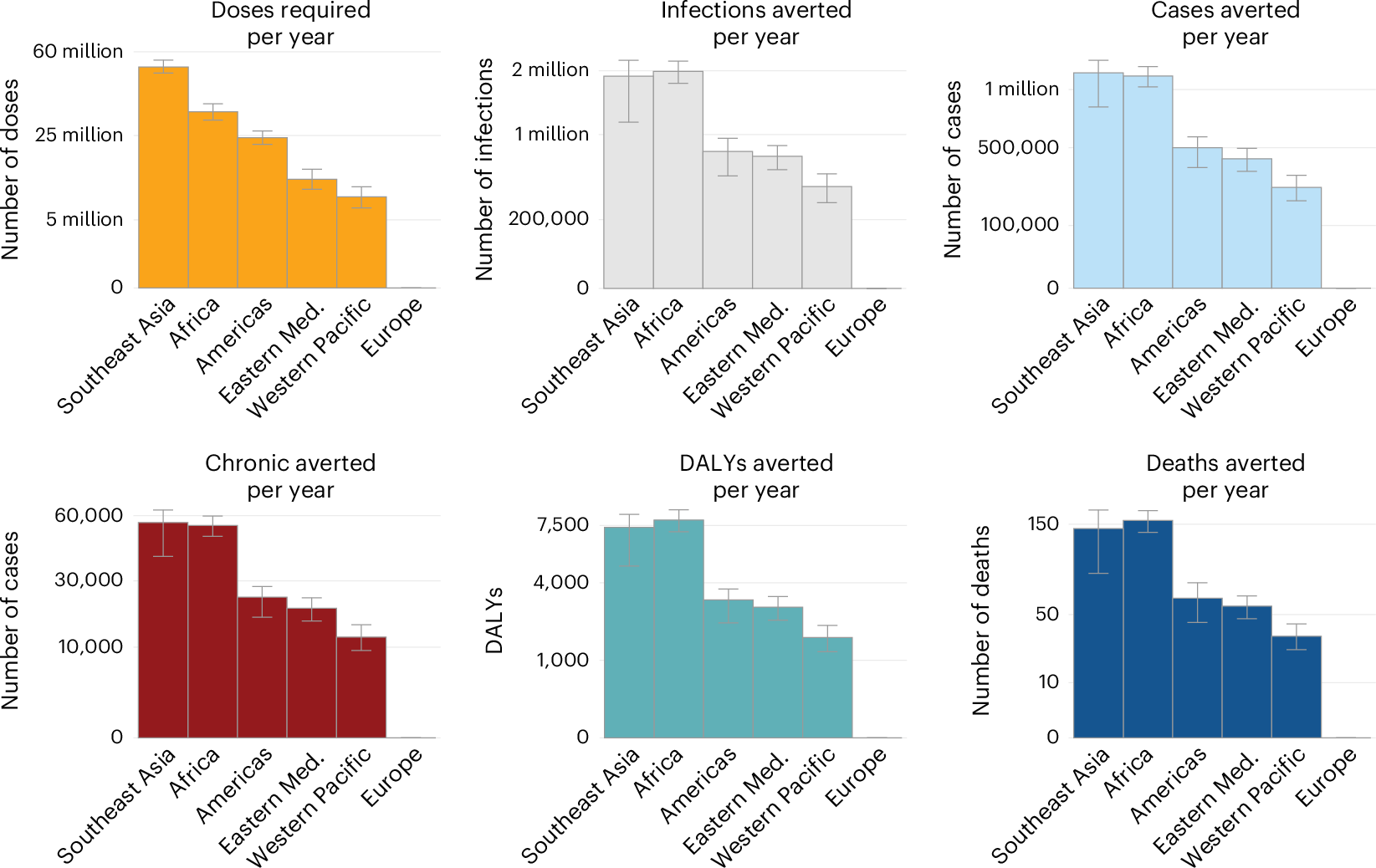
使用估计感染力 (FOI),我们计算了每个国家每年发生的平均感染人数。我们估计,全球每年有 35,300,000 例感染(95% CI:20,900,000–56,500,000)。受影响最严重的世界卫生组织 (WHO) 区域是东南亚,其次是非洲和美洲(图 D).3a, 扩展数据图1 和补充表 3)。我们估计流行国家有 13,800,000 例感染,主要由印度(每年 9,100,000 例感染)和 21,600,000 例感染(补充表 4)。我们估计,这些感染导致 17,700,000 例有症状病例、848,000 例慢性后遗症和 3,700 例死亡(95% CI:2,100–6,100)17。总体而言,我们估计每年有 121,000 个残疾调整生命年 (DALY) 损失于 CHIKV(图 D).3b)。
图 3: 负担估计。
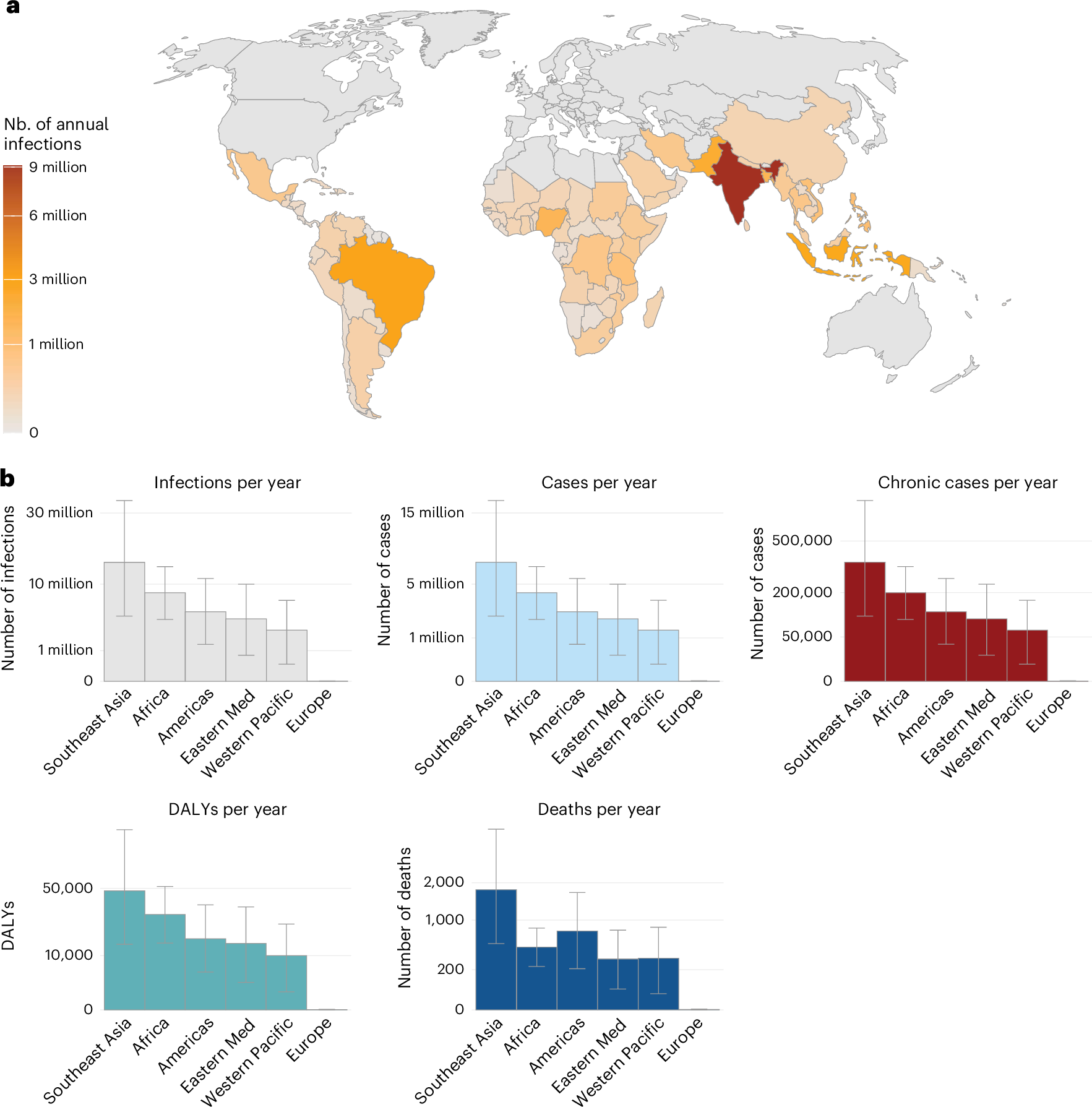
a,每个国家的年感染人数。b, 每个 WHO 区域的年度感染、病例、慢性病例、DALY 和死亡人数。误差线表示 95% 置信区间。Eastern Med、Eastern Mediterranean (东地中海);Nb., 数字.
疫苗的潜在影响
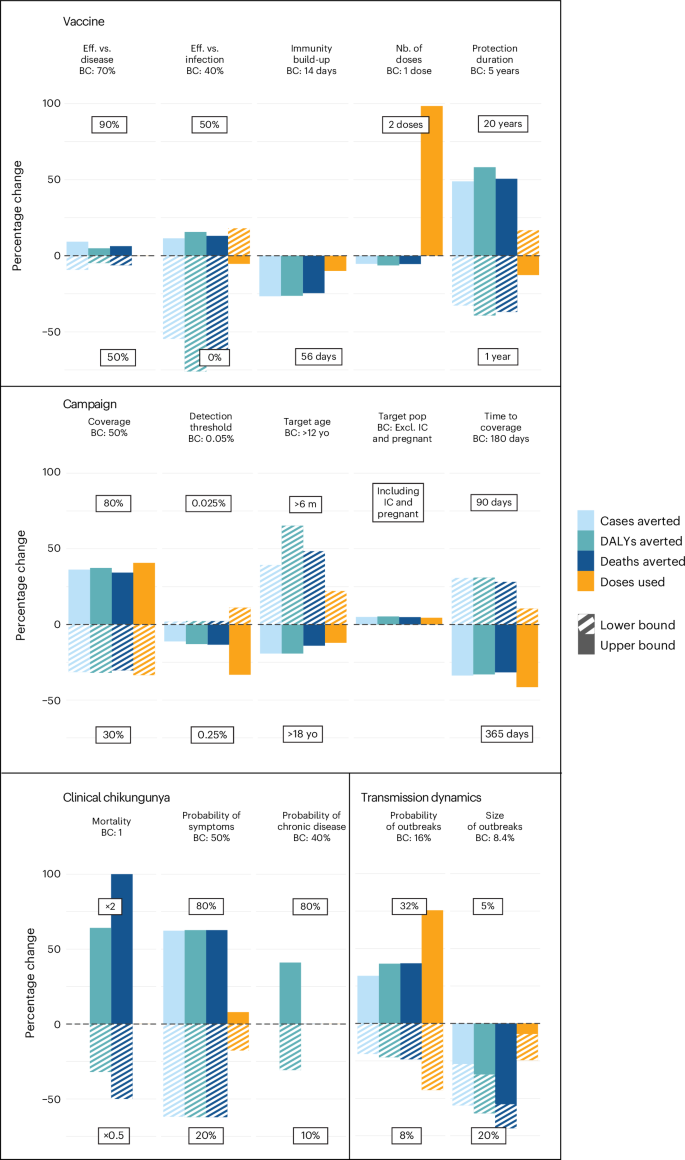
根据我们对潜在感染水平的估计,我们使用传播模型估计了疫苗对人群的潜在影响,以 IXCHIQ 为案例研究。由于目前没有关于 IXCHIQ 功效的现有测量估计,我们依靠由来自学术界、WHO、CEPI 和 Gavi 的个人组成的专家小组来获得疫苗关键特性的共识估计(扩展数据表 2)。该小组决定的假设是疫苗提供 70% 的疾病保护和 40% 的感染保护,平均保护期为 5 年。对于地方性流行环境,我们假设根据当前特定年龄的建议,通过初始运动然后每 5 年进行一次补充免疫运动,向 12 岁及以上的个体引入疫苗。我们假设每次运动都有一定比例的人口接种疫苗,而不管之前的疫苗接种状态如何。对于流行病环境,我们考虑了使用疫苗储备,即在拥有 1000 万居民的地区分发疫苗以应对疫情,延迟发现疫情(基于发生的最小病例数),并在规定的时间内进行疫苗接种。我们假设传播是季节性的。为了确保反应性活动和疫情开始之间的时间是真实的,我们将模拟的疫情校准为从巴西国家病例通知数据库检索到的流行病时间序列(扩展数据图 .3)。 每次疫情的轨迹,特别是疫情何时结束,都取决于疫苗免疫力、感染免疫力和 FOI 的季节性贡献。
我们发现,平均而言,要实现暴露于疫情爆发的人群 50% 的疫苗接种覆盖率,每年需要 1.32 亿剂疫苗(流行地区 5390 万剂,流行地区 7800 万剂)。总剂量数受到印度的强烈推动,CHIKV 在印度流行(每年 3300 万剂)。我们估计,这种疫苗接种水平每年将减少 580 万例感染,减少 168,000 例慢性病例,减少 450 例死亡,避免 22,900 例 DALY(图 D).4 和补充表 3)。平均而言,在全球范围内,每使用100,000剂疫苗,我们估计有4,400例(95% CI:3,800-4,800)例感染,2,700例(95% CI:2,400-2,800)例,0.35例(95% CI:0.30-0.37)例死亡,17例(95% CI:15-19)残疾调整生命年避免。在流行环境中的影响高于流行环境中,流行环境中每 100,000 剂可避免 5,500 例(95% CI:5,000-6,000 例)感染,而在流行环境中则避免 3,000 例(95% CI:1,600-3,400 例)。
图 4:WHO 区域对基本案例模型的影响总结。
误差线表示 95% 置信区间。Eastern Med., 东地中海。
模型结果依赖于与疫苗、流行病学和推广特征相关的几个强有力的假设。为了探索每个假设的相对重要性,我们依次改变每个参数,并将我们对感染、病例、死亡和 DALY 数量的估计与流行病情景的基本假设中估计的估计进行比较(图 D).5)。 我们发现,该模型的结论对有关疫苗特性(对感染和疾病的有效性以及保护持续时间)、推广策略(覆盖率、覆盖时间和检测疫情所需的时间)和疾病的自然史(症状的可能性)的一系列假设最敏感。减少模拟爆发的分区的规模并没有改变国家层面对负担的平均估计(扩展数据图 .3)。 我们注意到,增加和减少疫情的规模都可以减少疫苗的影响。这是由于疫苗免疫力与自然感染免疫力之间存在复杂的相互作用。我们发现,特定于大陆的估计表明,受影响地区的动态大致相似(扩展数据图唯一的例外是南美洲,其 FOI 高于其他地方。然而,CHIKV 对这片大陆来说是新的,而且,随着该病毒现在遇到了相当大的人群免疫力,我们可以预期 FOI 会下降。
讨论
在这里,我们概述了 CHIKV 感染的全球负担以及疫苗接种活动的潜在好处。我们的研究结果表明,世界上大部分地区都面临感染病原体的风险,通常是由于间隔大约 6 年的零星爆发。我们的研究结果表明,使用预先存在的库存的反应性疫苗运动可以大大减轻 CHIKV 的负担。在印度和巴西等严重流行地区,常规免疫接种也将减少病毒的影响。
使用疫苗应对 CHIKV 感染需要将疫苗整合到现有的免疫方案中。然而,对于世界许多地方来说,如果流行病不频繁且对疫苗保护的持续时间仍然知之甚少,这不太可能是一个有吸引力的前景。在这种情况下,从库存中开展响应性疫苗接种运动是一个很好的选择,就像霍乱所做的那样20。然而,基于库存的方法依赖于能够成功检测疫情,然后及时做出适当的响应。我们表明,在延迟响应的情况下,只有在发生数千例感染后才进行部署,疫苗仍然可以限制疫情的规模和病原体的负担。然而,随着进一步的延迟,疫苗运动的潜在影响会减少。此外,在许多情况下,例如在菲律宾或布基纳法索,已经表明发生了多起大规模 CHIKV 疫情,但没有报告一例病例8,9。许多国家,尤其是非洲和亚洲国家,需要改进病例检测,才能与任何基于库存的方法相辅相成。最后,即使及时发现疫情,实施大规模疫苗储备运动也将面临不容忽视的重要实际挑战。
除了检测疫情的能力外,最佳疫苗策略还将取决于一个地方的具体流行病学。我们依赖于一种简化的方法,将国家分为“流行病”和“地方病”,流行病国家实施反应性疫苗运动,而流行国家使用持续免疫计划。但是,一个国家内部将存在很大的异质性。例如,很明显,在巴西和印度,有些地区会出现零星的流行病传播,而其他地区的传播将更加持久。混合策略可能是可能的,在某些地区采用常规免疫,在另一些地区采用基于储备的方法,就像巴西的黄热病疫苗所做的那样。这种方法的可行性将取决于疫苗部署、基础设施以及其他政治和预算考虑。
我们估计,在 CHIKV 传播的地区,每年平均有 1.5% 的易感人群被感染。这些估计与之前系统评价的结果基本一致,该评价估计 FOI 中位数约为 0.7%(参考文献.17)。我们发现每年有 1780 万例有症状病例,大约是全球症状性登革热病毒 (DENV) 估计负担的五分之一,尽管受影响的地区相同21。CHIKV 和 DENV 负担的差异似乎与潜在流行病学模式的差异有关,DENV 比 CHIKV 更能够过渡到持续的地方性流行。这些固有差异的原因尚不清楚,尽管它们可能包括引起症状的倾向的潜在差异、蚊子内部的不同病毒动力学以及不同 DENV 血清型再次感染的可能性以及相关的复杂人群免疫模式22,23 。气候变化导致更大的区域适合伊蚊传播媒介,再加上更长的传播季节,进出 CHIKV 传播地点的流动性增加将导致更频繁的 CHIKV 引入和持续爆发24。
除了长期的慢性后遗症外,人们越来越意识到病原体的致命性25。我们估计每年有超过 3,500 人因 CHIKV 而丧生,比报告的还要多。这种差异可以归因于疫情的严重检测不足,尤其是在 DENV 共循环的地方,以及死因的错误归因,特别是因为大多数 CHIKV 死亡发生在老年人中,他们通常患有其他合并症26。我们对 CHIKV 疾病负担的估计依赖于对感染后症状可能性的假设。CHIKV 感染通常被认为会导致疾病;然而,菲律宾的一项定期抽血和主动疾病监测的队列研究发现,超过 80% 的感染是亚临床感染27、28、29。感染者成为检测病例的概率的异质性将由医疗保健寻求和监测系统的差异驱动。症状的可能性也可能因 CHIKV 谱系而异30。
CHIKV 疫苗使用保护相关性作为获得许可的手段31而不是来自标准的 3 期随机对照试验。这意味着不存在通常可用的疗效估计。在缺乏试验数据和长期抗体数据的情况下,我们的专家小组确定了一组关于疫苗的假设,以告知我们的模型;然而,这些最终本质上是主观的,有充分的理由认为这些假设是保守的。IXCHIQ 是一种减毒活疫苗,可产生高滴度,可保持稳定至少 2 年,甚至更长时间,并且与保护有关32,33 。自然感染导致持续数十年的持久性滴度,并且任何抗体滴度的存在都与预防感染和疾病有关票价:27,31,34 。假设对感染和疾病的 90% 保护率得到改善,将导致疫苗的影响几乎翻倍,达到每 100,000 剂避免 5,270 例(相比之下,我们的基本模型避免了 2,650 例)。我们假设 IXCHIQ 可以防止长期后遗症;然而,在没有试验的情况下,这还没有得到证明。目前计划在巴西进行的 4 期试验将帮助我们了解这些关键假设的现实性。最后,一些副作用与 IXCHIQ 有关35,36 。在一项 3 期试验中,2% 的疫苗接种者报告了严重不良事件,18% 的疫苗接种者报告了关节痛,尽管大多数关节痛是轻微的,有 0.3% 的接种者发展为严重的关节痛36。我们没有将这些副作用包括在 DALY 计算中。
我们的研究受到限制。我们对 CHIKV 潜在流行病学和疫苗潜在影响的估计必然依赖于强有力的假设。特别是,人们对基孔肯雅热传播、疾病史和新疫苗的功效了解有限。然而,我们系统地探讨了每个关键假设对我们估计的影响,使我们能够确定未来研究应该针对的具体领域。我们将所有受影响的国家分为“流行”或“地方性”,并假设所有流行国家的潜在传播水平相同,流行国家/地区的传播水平相同。尽管这种方法会忽略当地传播动态的细微差别,但这种简化的方法为一种知之甚少的病原体的整体全球风险分布提供了易于处理且有用的描述。结合当地对风险、后勤和预算限制的理解,针对具体国家的努力将有助于制定国家干预战略。我们试图通过使用全国对伊蚊发生的平均估计与 CHIKV 传播史之间的关系来解释国内有感染风险的人口规模的异质性。地方风险和国家平均风险之间的关系可能更复杂,但不太可能导致国家负担的总体估计出现重大差异。我们对感染风险的估计是基于现有的横断面血清阳性率研究。尽管我们将分析仅限于使用具有人群代表性的样本生成的数据,但它们最终将使用不同的方案和不同的测定进行。也可能有其他交叉反应性甲病毒在同一群落中传播,这会导致一些假阳性。我们假设大约五分之一的人会出现慢性症状;然而,这仍然是一个知之甚少的估计值,可能取决于年龄、性别和 CHIKV 毒株37。
总之,CHIKV 是世界大部分地区公共卫生的主要威胁。然而,有了新疫苗,就有了对抗这种威胁的真正机会。提高识别和快速应对疫情的能力将是最大限度地发挥疫苗潜力的核心。
方法
考虑的国家和地区
我们考虑了人口规模超过 200,000 名居民的国家和地区(由联合国定义)。我们纳入了地区以避免一些(尤其是岛屿)地区与该国其他地区(例如,法属圭亚那和法国大陆)处于不同的 CHIKV 风险区的问题。这导致总共有 180 个国家和地区。
文献综述
我们依次使用每个国家和地区,使用以下资源:
- Google(搜索词“基孔肯雅热 AND [国家]”)
- Google 学术搜索(搜索词“基孔肯雅热 AND [国家]”)
- PubMed(搜索词“基孔肯雅热 AND [国家]”)
- 吉迪恩
- 世卫组织/泛美卫生组织网站
- ProMED(搜索词“基孔肯雅热 AND [国家]”)
我们尽可能确定了卫生部的网站。对于每个国家和地区,我们确定了是否有 CHIKV 本土传播的证据。我们认为传播证据是病例的检测(至少有一例通过聚合酶链反应 (PCR) 或 IgM 确认)或血清阳性率研究(IgG 或 IgM)。我们考虑了 2023 年之前任何一年的疫情爆发。我们记录了 2011 年至 2022 年之间爆发的具体年份(补充表 1)。
血清阳性率检查
作为文献综述过程的一部分,我们特别强调了用于数据提取的 CHIKV 血清阳性率研究。我们的纳入标准是在普通人群中检测了 CHIKV IgG 的健康个体中进行的研究。我们排除了疑似病例的血清阳性率研究(补充表 2)。从每项检测到的研究中,我们确定了研究的地点(我们随后从中确定了坐标)、每个年龄组的人数以及 CHIKV 检测呈阳性的人数。随后,我们联系了所有已确定的血清阳性率研究的作者,以获得有关年龄和位置的更精细数据。从这一过程中,我们从涵盖 29 个国家/地区的 97 个地点的研究小组获得了 49 个年龄分层血清阳性率数据集。
伊蚊分布与 CHIKV 的关系
之前的估计使用气候数据和大型全球捕蚊器数据存储库,对世界各地 5 公里× 5 公里网格单元中埃及阿蚊和白纹阿蚊的存在进行了建模19。我们探讨了这些对埃及 A。 aegypti 和 A。 albopictus 的估计与一个国家的 CHIKV 存在相关的程度。
我们首先使用与 WorldPop 中的蚊子数据相同的网格单元中的种群密度估计分布提取了白纹 A。 albopictus 和 A。 aegypti 在国家 j 的人类种群加权平均存在 (MosqWeighted)19,38 。
其中 \({\rm{pop}}_{i,\,j}\) 是 j 国单元格 i 中的人口;\({\rm{mosq}}_{i,\,j}\) 是 Kraemer 等人得出的蚊子存在概率.18对于同一个单元格 i;\({\rm{{PO}{P}}}_{j}\) 是 j 国的总人口规模。我们之所以使用这种方法,是因为在人口众多的地方,蚊子水平与CHIKV负担的关系比在居民较少的地方更相关。
然后,我们通过计算曾经报告过疫情的国家在种群加权蚊子水平增加的国家中的比例,将这些蚊子存在的估计值与该国报告过 CHIKV 传播的概率进行了比较(图 D)。为了量化种群加权蚊子水平与 CHIKV 存在之间的关系,我们使用了 logistic 回归:
我们对埃及蚜蒿和白纹蚜蒿进行了单独的分析,然后进行了单独的分析,我们只使用了每个细胞中两个物种中较大的一个。
估计高危人群
对于给定国家/地区的每个 5 公里× 5 公里网格单元,我们使用了蚊子发生与逻辑回归中 CHIKV 爆发概率之间的拟合关系(图 D).1b) 以及居住在该单元中的人数,以获得该位置面临风险的人口规模的加权平均值。
其中 \({\rm{ProbOutbreak}}_{i,\;j}\) 是根据方程 (2) 中拟合的 Logistic 模型,在 j 国的单元格 i 中观察到疫情爆发的估计概率,其中我们使用该单元格中存在的白纹阿荨和埃及阿蛮较大的人。对于人口众多的印度、中国和美国,我们增加了一个额外的掩码,假设 CHIKV 传播仅发生在有充分证据表明持续传播的地区,来自国家血清阳性率研究(印度)或良好的病例报告(中国和美国)11。在被屏蔽的区域,\({\rm{ProbOutbreak}}_{i,\,j}\) 设置为 0。
按国家分配流行病状况
为了估计每个国家/地区病例数据的可靠性,我们使用了医疗保健可及性和质量 (HAQ) 指数,该指数根据可接受的死亡率以 0(最差)到 100(最好)的等级进行衡量39。该指数前两个十分位数(HAQ 指数 > 82.2)的国家被归类为拥有良好的监测系统39。接下来,我们使用病例发生率、血清阳性率研究和蚊子分布的数据对所有国家和地区的流行状况进行分类,如表 1 所示。每个国家和地区被归类为“地方性”(即每年有持续传播的证据)、“流行性”(即有传播的证据但未持续多年)或“无传播”。我们还评估了对每个国家分类的证据强度(表 1)。
估计 CHIKV 传播动力学
我们使用收集到的数据来告知不同的模型,并获得捕获 CHIKV 全球动态的参数的估计值。这些模型依赖于 FOI 的定义,它代表社区中易感人群被感染的比率。对于流行国家,我们使用马尔可夫链蒙特卡洛 (MCMC) 框架中的血清催化模型估计了 FOI。在流行国家,我们认为 FOI 不是恒定的,并估计了爆发的年度概率以及爆发时的年度 FOI。
我们根据血清学数据集来源国的状态分类对血清学数据集进行了子集化。使用流行病易发国家拟合单个流行病模型,以估计爆发发生的总体概率 (μ) 和平均爆发规模 (λ)。流行国家用于拟合单个流行模型,以估计时间常数 FOI 在其平均值 (λ地方病) 和标准差 (σ地方病)。
流行病模型
我们假设爆发的年概率μ发生,平均大小为 λ,标准差 σ 在不同地点相同。在每个位置,我们模拟了爆发模式,并保留了生成最可能模式的全局参数。如果某个地点的暴发模式与从该地点的年龄分层血清阳性率推断出的年龄特异性累积 FOI 相近,则该模式是合适的。
对于给定的位置 r 和给定的年龄组 A,我们称 \({N}_{{pos},{rA}}\) 为 CHIKV IgG 抗体检测呈阳性的样本数,\({N}_{{tot},{rA}}\) 为检测样本总数。请注意,年龄组的规模因地区而异。我们使用二项式似然来使我们的模型与数据拟合:
其中 \({p}_{{rA}}\) 是给定年龄组 A 的个体在采集样本时被感染的概率。根据定义,在 a 岁时被感染的概率 p 遵循等于 FOI(从出生到 a 岁逃避感染)的比率指数定律。而 p拉(从出生到年龄 a 的感染人数比例)是 p 的累积分布函数。考虑到按年龄分组,我们得到:
其中 \({\underline{\varGamma }}_{rA}\) 是年龄组 A 的平均累积 FOI,我们估计它是累积 FOI Γ的平均值rN对于该年级组中包含的所有年龄段:
从出生到研究年度,任何 N 岁的个体都将暴露于累积的 FOI:
带 λ日是位置 r 在年份 (Y − i) 的年度 FOI,其中 Y 是在该位置收集血清样本的年份。
λ日在从 Beta(α, β) 中提取的迭代筛选过程中进行模拟,概率为 μ,否则设置为 0。计算 α 和 β,使分布的平均值和标准差等于 λ 和 σ。出于参数可识别目的,σ 固定为 0.0025。使用嵌入在 C 语言中的顺序蒙特卡洛 (SMC) 贝叶斯框架估计的参数为 μ 和 λ,并使用 R 和“盛况”访问40包。无信息量的均匀先验 U(0,1) 用于 λ 和 σ。总共使用了 1,000 个粒子,这些粒子被分成大小相等的块(一个按位置)来模拟爆发模式并探索参数空间。每个粒子过滤实例被复制 20 次,以估计可能性和相关的不确定性。
地方病模型
按照前面的符号,我们假设每年都会爆发,并估计了该地方病模式导致的平均 FOI。我们假设所有 λ日等于 λr使得
其中 λr是位置 r 估计的时间常数 FOI。λr取自均值 λ 的 beta 分布 Beta(α, β)地方病和标准差 σ地方病。超参数 λ地方病和 σ地方病在我们的模型中也使用无信息化的统一先验 U(0,1) 对两者进行估计。我们使用了使用 Stan 和 R 的 MCMC 贝叶斯框架。使用四条链(每链 4,500 次迭代)对所考虑参数的后验分布进行采样,每条链包括 500 次迭代的老化阶段。
疫苗模拟框架
对于每个国家,我们模拟了基孔肯雅热的传播。如果一个国家拥有超过 1000 万居民,我们认为它由几个 1000 万人口的分区构成,每个分区具有独立的 FOI 模式。
该人口的年龄结构源自 2020 年联合国世界人口展望41。他们被分为以下 12 个年龄组:0-5、6-10、11-12、13-18、19-20、21-30、31-40、41-50、51-60、61-70、71-80 和 81+。我们使用这些年龄组来允许针对特定年龄的疫苗政策(尤其是在我们考虑 12+ 和 18+ 疫苗接种策略的情况下),并允许足够的颗粒度来获得特定年龄的死亡率。
每个年龄组都有六个不同的隔间,可以根据个人的感染和疫苗接种状态将其分配到这些隔间:
- S:未接种疫苗、从未感染的个体
- I:未接种疫苗的感染者
- R:未接种疫苗的康复个体(血清阳性)
- V:已接种疫苗且从未感染的个体
- IV:接种疫苗的感染者
- RV:接种疫苗、康复个体(血清阳性)
我们运行了 20 年的模拟,在此期间我们测量了影响估计。
在第一年之前,每年的 FOI 都是绘制的。如果该国是地方性流行国家,则从平均值 λ 的 Beta 分布中得出时间常数 FOI地方病和标准差 σ地方病。如果该国流行,则每年的年度 FOI 都设置为 0(无传播事件),概率为 (1 − μ),并从平均值 λ 的 Beta 分布中提取特定位置的 FOI地方病和标准差 σ地方病的概率μ。
每年都会发生以下事件:
- 失去疫苗接种保护
- 运行确定性 SIRV 模型,其季节性传递率根据先前绘制的 FOI 计算
- 人口老龄化
失去疫苗接种
接种疫苗的人口比例呈指数衰减,衰减率为 \({v}_{\rm{dur}}^{-1}\),其中 v杜尔(基本情况 5 年)是疫苗保护持续时间。这是通过个体流从 V 到 S 区室,从房室 RV 到 R 来转换的。
疫苗接种时间表
在流行国家,疫苗接种运动每 5 年进行一次,并在 180 天内为 50% 的未接种疫苗人口 (S + R) 接种疫苗。在免疫接种活动期间,疫苗接种以固定的每日速率进行。
在流行国家,一旦检测到阈值病例数(每百万 500 例),就开始接种疫苗,并且还旨在为 50% 的未接种疫苗人口 (S + R) 接种疫苗超过 180 天。但是,如果疫情消退到每天每百万人 50 例,疫苗接种可能会提前停止。
我们假设疫苗以单剂量给药,达到保护性免疫的时间为 14 d。该疫苗提供 40% 的感染保护和 70% 的疾病保护。
SIRV 模型
使用年龄分层 SIRV 模型同时模拟人口的基孔肯雅热传播和疫苗接种,该模型由以下微分方程组描述,适用于给定年龄组 a(扩展数据图 .3):
跟:
- \(S{{tI}}_{a}=\beta (t)* \frac{{I}_{\rm{tot}}}{N}* {S}_{a}\)
- \({VtI}{V}_{a}=\beta (t)* (1-{v}_{{ei}})* \frac{{I}_{\rm{tot}}}{N}* {V}_{a}\)
- \({It}{R}_{a}=\sigma * {I}_{a}\)
- \({IVt}{{RV}}_{a}=\sigma * {{IV}}_{a}\)
- \({St}{V}_{a}\) 和 \({RtR}{V}_{a}\) 由前面描述的每日疫苗接种率决定
- \({I}_{\rm{tot}}=\sum _{a}({I}_{a}+I{V}_{a})\),感染者总数
- \(N=\sum _{a}({S}_{a}+{V}_{a}+{I}_{a}+I{V}_{a}+{R}_{a}+R{V}_{a})\)\),总人口规模
- v英是疫苗诱导的感染保护
- 1/σ 是传染性的平均持续时间
- β(t) 是季节性传播率,随时间线性下降(基线偏移的锯齿状)
人口老龄化
每年,年龄 a 的隔间中的个体都会进入年龄 a + 1 的隔间。在 0 岁时,在人群中引入一个新的完全易感个体出生队列,并将最后一个年龄区间 (100+) 的个体从人群中移除。为了保持年龄结构随着时间的推移保持不变,每个隔间都会按比例进行调整。
模型参数
由于疫苗特性和不同部署策略的可行性存在相当大的不确定性,因此召开了一次专家会议,来自世卫组织、流行病防范创新联盟、全球疫苗免疫联盟和学术界的代表参加了会议,并达成了广泛共识。这些总结在扩展数据表 2 中。
未接种疫苗的感染有 50% 的几率出现症状(专家意见),接种疫苗的感染有 50% 的×(1 种疫苗对疾病的保护)/(1 种疫苗对感染的保护)= 50% × (1-0.7) / (1-0.4) = 25% 出现症状的机会。我们假设监测系统检测到所有有症状的感染(病例数)。(扩展数据图 .4)。
有症状的感染有 88% 的几率出现轻度急性期,12% 的几率出现重度急性期6,42,43 。严重急性期有 40% 的几率出现慢性症状(关节痛)44,45,46,47 。我们假设急性期平均持续 7 d,慢性症状持续 1 年3,37,48 。
有症状感染的死亡概率(病死率 (CFR))取决于年龄,基于巴拉圭的临床数据6。
残疾寿命 (YLD) 的计算方法是假设轻度急性症状的残疾权重为 0.006,严重急性症状的残疾权重为 0.133,关节痛(慢性症状)的残疾权重为 0.23349,50,51,52,53,54。损失寿命 (YLL) 被衡量为死亡年龄与该国平均预期寿命之间的差异。在该国平均预期寿命之后死亡的个体对 YLL 的计算没有贡献(扩展数据图 .4)。
根据定义,输给基孔肯雅热的 DALY 被计算为 YLL 和 YLD 的总和。
统计分析
使用 Pearson 相关系数计算本地传播概率和媒介存在概率之间的相关系数。特定组的血清阳性率估计值计算为该组中血清阳性个体的比例,CI 使用 Wilson 评分区间计算为二项式比例 CI。有关所用贝叶斯框架的信息,包括先验和算法参数的选择,在 Methods 的特定部分中有详细说明。血清催化模型的估计值和 95% CI 是采样后验的中位数以及用于 95% CI 的 2.5% 和 97.5% 分位数。负担估计和模拟疫苗影响的结果和 95% CI 是平均值,根据 1,000 次自举模拟的结果计算出 2.5% 和 97.5% 的分位数。
包容性和道德声明
该项目是多个机构合作的结果,包括来自许多受 CHIKV 影响的国家,因此与所呈现的结果直接相关。这项研究将通过提供通过实施疫苗接种运动在当地可以避免多少这种负担的估计来具有相关性。所有合著者都从项目的早期阶段就做出了贡献。所有模型均使用匿名数据集开发。数据要么是从现有出版物中提取的,要么是由底层数据收集者提供的,没有任何个人标识符。这些数据集归功于生成它们的当地研究小组。本地和区域研究在引文中得到了应有的认可。由于目前没有关于 IXCHIQ 疫苗功效的现有测量估计,因此从由学术界、WHO、CEPI 和 Gavi 的个人组成的专家小组获得了对疫苗关键特性的共识估计。
报告摘要
有关研究设计的更多信息,请参阅本文链接的 Nature Portfolio Reporting Summary。
代码可用性
此处介绍的用于分析的所有代码都可以在以下 GitHub 存储库中公开获得:https://github。com/G-ribeiro-dos-santos/chik-global-burden。
引用
Weaver, S。 C。 & Forrester, N。 L。 基孔肯雅热:进化历史和最近的流行病传播。Antivir。 Res。 120, 32–39 (2015 年)。
Tsetsarkin, K。 A。, Chen, R。 & Weaver, S。 C。 种间传播和基孔肯雅热病毒的出现。电流。意见。病毒。 16, 143–150 (2016 年)。
O’Driscoll, M。, Salje, H。, Chang, A。 Y。 & Watson, H。 基孔肯雅热病毒感染后的关节痛消退率。Int。 J。 感染 Dis。 112, 1-7 (2021 年)。
Kang, H。 等人。地方性和流行环境中基孔肯雅热血清阳性率、感染强度和感染后慢性残疾的患病率:一项系统评价、荟萃分析和建模研究。柳叶刀感染 Dis。 24, 488–503 (2024 年)。
de Souza, WM 等人。巴西基孔肯雅热病毒的时空动力学和复发:一项流行病学研究。柳叶刀微生物 4, e319–e329 (2023)。
Pérez-Estigarribia, PE 等人。模拟疫苗运动对基孔肯雅热病毒爆发的流行传播动态的影响。Nat。 Med。 https://doi。org/10.1038/s41591-025-03684-w (2025 年)。
Lim, A。 等人。登革热、基孔肯雅热、寨卡病毒和黄热病的全球分布重叠。Nat。 Commun。 16, 3418 (2025)。
Kyungah Lim, J。 等人。布基纳法索和加蓬长期基孔肯雅热病毒传播的血清流行病学重建。J。 感染。Dis.221, 261–267 (2023 年)。
Salje, H。 等人。菲律宾 60 年基孔肯雅热流行病学重建显示,存在阵发性和局灶性传播。J。 感染 Dis。 213, 604–610 (2016 年)。
Tran, Q。 M。 等人。根据血清学数据和模型提供的信息,来自未来基孔肯雅热疫苗试验地点的预期终点。疫苗 41, 182–192 (2023)。
Kumar, MS 等人.2017 年印度基孔肯雅热病毒感染血清阳性率:基于人群的横断面血清学调查。柳叶刀微生物 2, e41–e47 (2021)。
美国食品和药物管理局,专员办公室。FDA 批准了第一种预防基孔肯雅热病毒引起的疾病的疫苗。https://www。fda。gov/news-events/press-announcements/fda-approves-first-vaccine-prevent-disease-caused-chikungunya-virus (2023 年)。
Valneva 获得世界上第一种基孔肯雅热疫苗 IXCHIQ® 在欧洲的上市许可。https://valneva。com/press-release/valneva-receives-marketing-authorization-in-europe-for-the-worlds-first-chikungunya-vaccine-ixchiq/ (2024)。
Costa, LB 等人。基孔肯雅热的流行病学和经济负担:系统文献综述。Trop。 Med。 Infect。 Dis。 8, 301 (2023 年)。
随着全球疫苗免疫联盟董事会加大努力应对倒退和抗击突发卫生事件,批准了超过 18 亿美元的支持,用于非洲疫苗生产、补助漏发儿童和大流行病防范工作。https://www。gavi。org/news/media-room/initiatives-african-vaccine-manufacturing-approved-gavi-board (2023)。
Godaert, L。 等人。基孔肯雅热病毒感染的误诊:老年人和年轻人的比较。J。 Am。 Geriatr。 Soc。 66, 1768–1772 (2018)。
Kang, H。 等人。基孔肯雅热流行病的血清流行率、感染力和慢性残疾患病率:系统评价、荟萃分析和建模研究。柳叶刀感染 Dis。 24, 488–503 (2024 年)。
Kraemer, M。 U。 G。 等人。虫媒病毒媒介埃及伊蚊和白纹伊蚊的全球分布。eLife 4, e08347 (2015)。
Lloyd, C。 T。, Sorichetta, A。 & Tatem, A。 J。 用于人口研究的高分辨率全球网格数据。科学数据 4, 170001 (2017)。
Desai, SN 等人。在全球储备时代使用灭活口服霍乱疫苗的成就和挑战。哼。免疫学。 13, 579–587 (2017 年)。
Messina, JP 等人。人类登革热病毒全球传播情况纲要。科学数据 1, 140004 (2014)。
霍尔斯特德,SB 登革热。柳叶刀 370, 1644–1652 (2007)。
Novelo, M。 等人。埃及伊蚊中的登革热和基孔肯雅热病毒载量由不同的遗传结构决定。PLoS 病原体。 19, e1011307 (2023 年)。
Ryan, S。 J。, Carlson, C。 J。, Mordecai, E。 A。 & Johnson, L。 R。 伊蚊传播病毒的全球扩张和再分布风险与气候变化。PLoS Negl。 Trop。 Dis。 13, e0007213 (2019)。
Salje, H。 & Cortés Azuero, O。基孔肯雅热病毒的致命潜力。柳叶刀感染 Dis。 24, 442–444 (2024)。
Cerqueira-Silva, T。 等人.2015-2018 年巴西 1 亿队列中基孔肯雅热病毒病后的死亡风险:匹配的队列研究和自我对照病例系列。柳叶刀感染 Dis。 24, 504–513 (2024 年)。
尹,I。-K。等。在菲律宾的前瞻性队列中,亚临床基孔肯雅热病毒感染率高,中和抗体与保护的相关性。PLoS Negl。 Trop。 Dis。 9, e0003764 (2015)。
Hennessey, MJ 等人.2014-2015 年美属维尔京群岛基孔肯雅热病毒感染的血清阳性率和症状发作率。Am。 J。 Trop。 Med。 Hyg。 99, 1321–1326 (2018 年)。
Sissoko, D。 等人.2005-2006 年印度洋马约特岛基孔肯雅热病毒感染的血清阳性率和危险因素:一项基于人群的调查。公共科学图书馆一号 3,e3066 (2008)。
Bustos Carrillo, F。 等人。不明显的基孔肯雅热病毒感染风险谱系特异性差异的流行病学证据。J。 维罗尔.93, e01622-18 (2019)。
Milligan, G。 N。, Schnierle, B。 S。, McAuley, A。 J。 & Beasley, D。 W。 C。 定义基孔肯雅病毒疫苗保护的相关性。疫苗 37, 7427–7436 (2019)。
Valneva 报告了单针基孔肯雅热候选疫苗的阳性 12 个月抗体持久性数据。https://valneva。com/press-release/valneva-reports-positive-12-month-antibody-persistence-data-for-single-shot-chikungunya-vaccine-candidate/ (2022 年)。
McMahon, R。 等人。美国成人单剂接种后长达 2 年的基孔肯雅热病毒减毒活疫苗的抗体持久性和安全性:一项单臂、多中心、3b 期研究。柳叶刀感染 Dis。 24, 1383–1392 (2024)。
尹,I。-K。等。在菲律宾队列中,预先存在的基孔肯雅热病毒中和抗体与症状感染和亚临床血清转换的风险相关。Int。 J。 感染 Dis。 95, 167–173 (2020 年)。
Buerger, V。 等人。巴西流行地区基孔肯雅热病毒减毒活疫苗的安全性和免疫原性:一项在青少年中进行的双盲、随机、安慰剂对照 3 期试验的中期结果。柳叶刀感染 Dis。 25, 114–125 (2025)。
Schneider, M。 等人。单针基孔肯雅热减毒活疫苗的安全性和免疫原性:一项双盲、多中心、随机、安慰剂对照的 3 期试验。柳叶刀 401, 2138–2147 (2023)。
Warnes, CM 等人。儿童和成人急性基孔肯雅热后相关关节痛的纵向分析:尼加拉瓜马那瓜的一项前瞻性队列研究(2014-2018 年)。PLoS Negl。 Trop。 Dis。 18, e0011948 (2024)。
Bright, E。, Coleman, P。 & Dobson, J。 E。 LandScan:用于估计处于风险中的人口的全球人口数据库。摄影学。工程遥感 66, 849–858 (2000)。
Fullman, N。 等人。衡量 195 个国家和地区以及选定地方的医疗保健可及性和质量指数的表现:来自 2016 年全球疾病负担研究的系统分析。柳叶刀 391, 2236–2271 (2018)。
King, A。 A。, Nguyen, D。 & Ionides, E。 L。 通过R包盛况对部分观察到的马尔可夫过程进行统计推断。J。 Stat。 Softw。 69, 1–43 (2016 年)。
联合国。经济发展和社会事务部,人口司。世界人口前景。https://population。un。org/wpp/
Man, O。 M。, Fuller, T。 L。, Rosser, J。 I。 & Nielsen-Saines, K。 在巴西里约热内卢州重新出现虫媒病毒疾病:2014年至2019年期间病毒同时传播的作用。One Health 15, 100427 (2022)。
Bautista-Reyes, E。, Núñez-Avellaneda, D。, Alonso-Palomares, L。 A。 & Salazar, M。 I。 基孔肯雅热:分子方面、临床结果和发病机制。Rev。 Invest。克林。 69, 299–307 (2017)。
门口的Morens, D。 M。 & Fauci, A。 S。 Chikungunya——似曾相识?N。 Engl。 J。 Med。 371, 885–887 (2014)。
Chang, A。 Y。 等人。基孔肯雅热病毒感染后慢性关节痛的频率:一项哥伦比亚队列研究。关节炎风湿醇。 70, 578–584 (2018 年)。
Cardona-Ospina, J。 A。, Rodriguez-Morales, A。 J。 & Villamil-Gómez, W。 E。哥伦比亚一个沿海省 (Sucre) 的基孔肯雅热负担:对 2014 年流行病中损失的残疾调整生命年 (DALY) 的估计。J。 感染。公共卫生 8, 644–646 (2015)。
Puntasecca, C。 J。, King, C。 H。 & LaBeaud, A。 D。 测量基孔肯雅热和寨卡病毒的全球负担:系统评价。PLoS Negl。 Trop。 Dis。 15, e0009055 (2021 年)。
Feldstein, LR 等人。与基孔肯雅热病毒爆发相关的持续性关节痛,美属维尔京群岛,2014 年 12 月至 2016 年 2 月。新兴。感染。Dis。 23, 673–676 (2017 年)。
Salomon, J。 A。 等人.2013 年全球疾病负担研究的残疾权重。柳叶刀全球。健康 3, e712–e723 (2015)。
Ruiz-Moreno, D。, Vargas, I。 S。, Olson, K。 E。 & Harrington, L。 C。 基孔肯雅热病毒在美国的动态引入建模。PLoS Negl。 Trop。 Dis。 6, e1918 (2012 年)。
Báez-Hernández, N。, Casas-Martínez, M。, Danis-Lozano, R。 & Velasco-Hernández, J。 X。墨西哥登革热和基孔肯雅热的数学模型。bioRxiv https://doi。org/10.1101/122556 (2017) 的预印本。
Pialoux, G。, Gaüzère, B。-A。, Jauréguiberry, S。 & Strobel, M。 Chikungunya,一种流行的虫媒病毒病。柳叶刀感染 Dis。 7, 319–327 (2007 年)。
Yaseen, H。 M。, Simon, F。, Deparis, X。 & Marimoutou, C。 对留尼汪岛基孔肯雅热爆发持久影响的估计。流行病学:开放获取 2, 003 (2012)。
Vidal, E。 R。 N。, Frutuoso, L。 C。 V。, Duarte, E。 C。 & Peixoto, H。 M。 2016年和2017年巴西基孔肯雅热的流行病学负担。Trop。 Med。 Int。 Health 27, 174–184 (2022)。
确认
我们感谢 R。 Collier 对文献综述和数据收集过程的贡献。我们还感谢 N。 Salez(艾克斯马赛大学,IRD,EHESP 法国公共卫生学院,EPV UMR_D 190 ‘Emergence des Pathologies Virales’,法国马赛)创建由 K。D。 H。S。 和 G。R。D。S。 共享和维护的科摩罗数据集,感谢 CEPI 和欧洲研究委员会的支持。南卡罗来纳州感谢欧盟委员会根据 EU4Health 计划 2021-2027 年赠款协议 – 项目:101102733 — DURABLE 提供的支持。
道德宣言
利益争夺
H。S。 已收到 Gavi 和 Valneva 的咨询费,以支持 IV 期试验设计。G。R。d。S。 已收到 Valneva 的咨询费,以支持 IV 期试验设计。作者声明没有其他相互竞争的利益。
同行审查
同行评审信息
Nature Medicine 感谢 William de Souza 和其他匿名审稿人对这项工作的同行评审做出的贡献。Primary Handling 编辑:Ming Yang,与 Nature Medicine 团队合作。
其他信息:
出版商注施普林格·自然 (Springer Nature) 对已发布的地图和机构隶属关系中的管辖权主张保持中立。
扩展数据
扩展数据 图 1 高危人群和 WHO 区域地图。
(a) 每个国家/地区的高危人口比例 (b) 每个国家的 WHO 区域。
扩展数据 图 2 血清催化模型和特定大陆的传输动力学估计的拟合。
(a) 血清阳性率数据和模型拟合。对于 血清预测数据,中心点是每个年龄组血清阳性个体的比例,误差线是来自二项分布的 95% 置信区间。对于模型拟合,中心线是使用后验中位数的模型拟合,丝带表示后验分布的 95% 分位数。来自(b)流行性浆液分离模型,(c)根据流行国家的数据拟合的地方性浆液分离模型,(d)根据流行国家的数据拟合的地方性浆液分离模型。对于面板 (B)、(C) 和 (D),中心点是估计的中位数,误差线是后验分布的估计 95% 分位数。
扩展数据 图 3 模拟框架的详细信息。
(a) 对人口规模对模拟爆发发生地区影响的敏感性分析。中心条表示 1000 次模拟的平均值,误差条包含 95% 的模拟输出。(b) 观察到的疫情与模拟疫情的形式和时间。自 2015 年以来巴西报告的基孔肯雅热病例按州(细黑线)和全国(纯黑线)报告的经验分布函数。具有不同感染力度的模拟爆发的经验分布函数(红线)。(c) 给定年龄组的 SIRV 模型结构 (d) 在 1000 万代表性人群中,针对基本情况疫苗接种情景模拟的一年内疫情。(缩写:S:易感者;V: 已接种疫苗;I: 感染;IV:感染者接种疫苗;R:已恢复;RV:已恢复接种疫苗)。
扩展数据 图 4 负担图。
YLD 计算的摘要图。(缩写:CFR:病死率;Dw:残疾体重;Dur:持续时间;YLDs:残疾生活年限)。
Hits: 62