Contents
Infant Antibodies After Maternal COVID-19 Vaccination During Pregnancy or Postpartum
我们描述了在怀孕期间或产后接种 2 剂或 3 剂母体疫苗后婴儿出生后前 6 个月内母源性抗体的动力学。
这项前瞻性、多中心队列研究招募了怀孕期间接种 2 剂 (n = 280) 或 3 剂(加强)单价信使 RNA 疫苗的母亲 (n = 202) 或产后接种疫苗的母亲 (n = 36) 所生的婴儿2021 年 7 月至 2022 年 1 月。在出生时以及 2 个月和 6 个月大时测量与疫苗和 Omicron BA.1/BA.5 毒株的结合(免疫球蛋白 G 与 S 和受体结合域)、假病毒和活中和抗体 (nAb) 几何平均滴度 (GMT)。评估抗体半衰期和母婴 COVID-19 感染的影响。
加强母亲的婴儿在出生和 2 个月时存在与所有抗原的结合抗体和 nAb 的 GMT 显着升高 (P < .01),并且与其他组相比,加强母亲的婴儿对疫苗株的滴度较高,但 Omicron BA.1 和 BA.5 则持续到 6 个月大 (P < .01)。分娩时和 6 个月大时较高的婴儿抗体滴度与怀孕期间的加强剂量以及母体产前和婴儿 COVID-19 感染有关。母体感染状态或疫苗接种方案不影响婴儿抗体的半衰期。
与怀孕或产后 2 剂相比,孕期母体 COVID-19 加强剂会导致婴儿的功能性抗体滴度显着升高。出生时的高滴度和母体杂交免疫导致婴儿滴度持续升高 6 个月。
关于这个主题的已知信息:
推荐在怀孕期间接种的 COVID-19 疫苗通过经胎盘抗体直接保护母亲和新生儿。婴儿中和活性、母体感染和疫苗接种状态的母源抗体的动力学和持续时间仍然很差。
本研究增加的内容:
与怀孕或产后 19 剂相比,怀孕期间的 COVID-19 加强剂会显着增加婴儿的功能性抗体。尽管滴度迅速下降,但出生时的高滴度和母体杂交免疫导致婴儿滴度持续升高 6 个月。
介绍
婴儿早期的 COVID-19 可能导致严重的疾病和并发症,包括住院和死亡。1 由于 Omicron 变体占主导地位,6 个月以下婴儿的 COVID-19 住院率在所有儿科年龄组中最高,通常是在没有基础疾病的婴儿中,并且在 2024 年他们仍然是最大的住院风险。2-4
6 个月以下的婴儿没有资格接种 COVID-19 疫苗,5 鉴于可能通过被动转移的抗体保护婴儿,因此在怀孕期间为母亲接种疫苗至关重要。在美国的 Delta 和 Omicron 时期,孕产妇接种 2 剂原始信使 RNA (mRNA) 一价疫苗与 6 个月以下婴儿住院和危重疾病的风险降低有关。6 在最近的一项分析中,这些发现是持续的,尤其是对于 3 个月以下的婴儿。7 此外,与 2 剂或不接种母体疫苗相比,怀孕期间接种第三剂或加强免疫接种可额外防止婴儿住院。8 疫苗有效性可能因新出现的变异株而异,接种原始单价疫苗对 Omicron 变异株的保护作用会降低。9 我们之前报道过,在 Omicron 占主导地位的时期,怀孕期间接种加强剂量的 mRNA 疫苗以及出生时更高的结合滴度和 nAb 大大降低了婴儿在出生后的前 2 至 6 个月内感染有症状的 COVID-19 的风险。10,11 在这里,我们描述了怀孕或产后母体接种 COVID-19 mRNA 疫苗后婴儿结合和 nAb 的动力学,并评估了怀孕期间疫苗加强剂量对婴儿抗体滴度从出生到 6 个月大的持久性的影响。我们还评估了母婴 COVID-19 感染和母乳喂养对婴儿抗体滴度随时间推移的潜在影响。
方法
临床研究设计
在美国 9 个学术地点进行了一项针对孕妇及其婴儿的前瞻性队列研究,入组时间为 2021 年 7 月 6 日至 2022 年 1 月 31 日,产后 12 个月的母婴随访 (ClinicalTrials.gov ID NCT05031468)。研究方案已在前面描述过。12 这份 COVID-19 多中心观察性母婴研究报告描述了怀孕或产后母体接种疫苗后 6 个月以下婴儿的抗体动力学。包括三个研究组:(1) 母亲在怀孕期间接受了原始单价 BNT162b2 Pfizer-BioNTech (Pfizer) 或 mRNA-1273 Moderna (Moderna) 疫苗(结果显示为联合 mRNA 疫苗)的初次 2 剂系列的婴儿,最后一剂至少在分娩前 2 周;(2) 母亲在怀孕期间和分娩前至少 2 周接种了第三剂或加强剂任一 mRNA 疫苗,并在怀孕期间或怀孕前不久接受了前 2 剂的婴儿;(3) 在产后 2 个月内接受原发性 2 剂 mRNA 系列(怀孕前或怀孕期间未接种疫苗)的母亲的婴儿,最后一剂至少在 2 个月研究访问前 2 周。描述种族和民族是为了让读者了解研究人群的特征。从分娩时母亲和婴儿出生时从 2 个月和 6 个月大的脐带血和静脉血采样中采集外周血血清。收集分娩前 6 个月内报告的孕产妇 COVID-19 感染、婴儿 COVID-19 疾病和 6 个月大的母乳喂养状况。大多数报告的有症状的母婴疾病是在进行本研究时通过家庭检测或临床提供者确认的。10
免疫原性
使用商业中尺度发现 (MSD) V-PLEX SARS-CoV-2 panel 2 测定 (MSD #K15383U) 评估血清总免疫球蛋白 G (IgG) 与 SARS-CoV-2 核衣壳 (N) 蛋白、刺突蛋白 (S) 和 S1 受体结合域 (RBD)。此处报告的 IgG 值是 MSD 值与世界卫生组织国际标准对照品(美国国家生物标准和控制研究所代码:20/136)转换后的结合抗体单位。13-16 岁直接遵循血清检测方案(参见补充信息)。使用表达荧光素酶并在病毒包膜中含有 SARS-CoV-2 刺突蛋白 (Wuhan-胡-1) 的复制无能慢病毒通过假病毒中和试验评估针对 SARS-CoV-2 的 nAb 滴度。此处报道的中和为半最大抑制浓度,其中观察到样品抗体滴度稀释抑制病毒进入和复制 50%。17 代表 SARS-CoV-2 刺突突变 D614G 和奥密克戎 BA.1.1.529 (BA.1) 和 BA.5 (BA.5) 变体的病毒的补充活病毒病灶减少中和滴度测定也被报道为实现 50% 中和所需的血清抑制稀释度(见补充信息)。18 计算经胎盘转移比率,将脐带血中的婴儿抗体滴度与分娩时母体滴度进行比较。使用 MSD 测定法检测血清 N 蛋白抗体的存在证实了参与者(包括母亲和婴儿)的 SARS-CoV-2 感染。
统计分析
使用描述性统计总结母婴特征:连续变量的 IQR 和/或范围的中位数和分类变量的数字和百分比。计算跨时间点的几何平均滴度 (GMT)。报告为低于定量下限 (LLOQ) 的滴度被估算为相当于测定 LLOQ 一半的值。
使用线性回归控制自上次疫苗接种和 COVID-19 感染(在指定时间点报告感染或 N 蛋白阳性 IgG)来控制的时间,比较疫苗组之间 SARS-CoV-2 结合 IgG 和 nAb 的滴度。
使用单变量和多变量线性回归模型评估产前母体疫苗剂量与婴儿出生和 6 个月大时 log-10 转化抗体滴度水平的相关性,针对潜在的混杂因素进行调整,包括产前特征 (3 vs 2 母体剂量、最后一次母体剂量和分娩之间的周数、母体产前感染)和婴儿产后感染。由于婴儿分娩时的滴度是先验的预期,以捕捉所有产妇剂量和产前特征,因此建立了 6 个月滴度的多变量模型,有和没有婴儿分娩时的滴度,以评估这一假设。为了说明产前剂量数对婴儿滴度随时间的影响,绘制了滴度随时间的轨迹,不包括婴儿感染后进行的测量。
为了估计抗体滴度的半衰期,我们计算了出生和 2 个月时抗体测量值的 log-2 转换值之间的差异除以这些时间点之间的时间,子集到那些在出生和 2 个月时抗体水平可测量的婴儿,在 2 个时间点之间没有感染的证据,并且在 2 个时间点之间没有抗体测量值增加。半衰期及其相应的 95% CI 是这些转换值及其相应的 95% CI 的平均值的倒数。19
所有分析均使用 SAS (9.4 版) 和 R 软件 (4.3.1 版) 生成。
结果
研究人群
在参加研究的 571 名婴儿中,有 518 名婴儿的实验室结果可纳入本分析(图 S1,配偶图)。研究人群包括 280 名母亲所生的 276 名婴儿,这些母亲在怀孕期间接受了基本的 2 剂 mRNA 疫苗系列,197 名母亲所生的 202 名婴儿接受了 2 剂系列疫苗,然后在怀孕期间接种了第三剂加强疫苗接种,以及 36 名婴儿的母亲仅在产后接种疫苗(无产前剂量)。母婴特征见表 1。
表 1. 各研究组的母婴特征
| 两剂 mRNA 疫苗 | 三剂 mRNA 疫苗 | 无需产前剂量的 mRNA 疫苗 | |
|---|---|---|---|
| 母体,n | 276 | 197 | 36 |
| 年龄、中位数(范围;IQR)、y | 34 (19–51; 31–37) | 34 (22–46; 31–37) | 32 (24–42; 30–34) |
| 种族(自我报告),% (n) | |||
| 美洲印第安人/阿拉斯加原住民 | 1.1 (3) | 0.5 (1) | 0 (0) |
| 亚裔 | 8.7 (24) | 7.1 (14) | 2.8 (1) |
| 黑人/非裔美国人 | 15.2 (42) | 2.5 (5) | 25.0 (9) |
| 白 | 69.6 (192) | 84.8 (167) | 69.4 (25) |
| 其他 | 5.4 (15) | 5.1 (10) | 2.8 (1) |
| 西班牙裔或拉丁裔,% (n) | 15.6 (43) | 8.6 (17) | 5.6 (2) |
| 最后一次产前剂量和疫苗接种后就诊之间的周数,中位数 (IQR)a | 17 (8–22) | 5.9 (3.3–8.4) | – |
| 最后一次产前给药与分娩之间的周数,中位数 (IQR)a | 22.1 (16.3–26.9) | 14.9 (9.1–21.4) | – |
| 末次产前给药的孕周,中位数 (IQR)a | 17.1 (12.4–24.1) | 25.1 (18.1–31.1) | – |
| 第一剂疫苗的产后周,中位数 (IQR) | – | – | 2.1 (0.6–3.9) |
| 最后一次产前剂量与第 2 个月就诊之间的周数,中位数 (IQR)a | 31 (24.6–35.6) | 22.4 (16.6–28.9) | – |
| 最后一次产前剂量与第 6 个月就诊之间的周数,中位数 (IQR)a | 47.6 (41.7–52.4) | 40.1 (34.1–46.9) | – |
| 2 周母乳喂养,% (n) | 97.3 (248/255) | 98.4 (184/187) | 100.0 (9/9) |
| 2 个月母乳喂养,% (n) | 87.9 (218/248) | 94.5 (172/182) | 93.9 (31/33) |
| 6 个月母乳喂养,% (n) | 68.6 (164/239) | 80.8 (139/172) | 90.0 (27/30) |
| 产前 SARS-Cov-2 感染,% (n)b | 12.3 (34) | 20.3 (40) | 8.3 (3) |
| 递送时蛋白质阳性,% (n)c | 10.5 (28/266) | 14.5 (28/193) | – |
| 2 个月时蛋白质阳性,% (n)c | 17.0 (43/253) | 22.5 (43/191) | 8.3 (3) |
| 6 个月时蛋白质阳性,% (n)c | 37.2 (89/239) | 41.7 (70/168) | 26.5 (9/34) |
| 婴儿,n | 280 | 202 | 36 |
| 种族,% (n) | |||
| 亚裔 | 4.6 (13) | 5.9 (12) | 5.6 (2) |
| 黑人/非裔美国人 | 15.0 (42) | 1.5 (3) | 27.8 (10) |
| 白 | 60.4 (169) | 86.6 (175) | 61.1 (22) |
| 其他 | 20.0 (56) | 5.9 (12) | 5.6 (2) |
| 西班牙裔或拉丁裔,% (n) | 15.7 (44) | 9.4 (19) | 13.9 (5) |
| 分娩胎龄,% (n) | |||
| 足月分娩 (≥37 周) | 92.5 (259) | 89.6 (181) | 88.9 (32) |
| 早产 (<37 周) | 7.5 (21) | 10.4 (21) | 11.1 (4) |
| 分娩时妊娠周,中位数(范围) | 39.3 (25.1–42.6) | 39.3 (29.9–41.6) | 39.0 (27.3–41.4) |
| 早产 (<37 周) | 35.6 (25.1–36.9) | 35.7 (29.9–36.9) | 32.0 (27.3–36.9) |
| 出生体重中位数,kg(范围) | 3.4 (1.7–4.9) | 3.4 (1.0–5.2) | 3.3(0.9–4.5) |
| 女性,% (n) | 51.1 (143) | 54.0 (109) | 47.2 (17) |
| 婴儿感染 | |||
| SARS-CoV-2 感染至第 2 个月就诊,% (n)d | 3.2 (9) | 4.0 (8) | 2.8 (1) |
| 血清转化的证据,ne | 6 | 5 | 0 |
| 自我报告,ne | 4 | 5 | 1 |
| SARS-CoV-2 感染至第 6 个月就诊,% (n)d | 26.4 (74) | 30.7 (62) | 25.0 (9) |
| 血清转化的证据,ne | 60 | 45 | 7 |
| 自我报告,ne | 48 | 43 | 7 |
| 婴儿保留率 | |||
| 第 6 个月就诊的出勤率,% (n) | 91.4 (256) | 92.6 (187) | 94.4 (34) |
| 第 6 个月就诊时的实验室结果,% (n)f | 79.3 (222) | 75.7 (153) | 86.1 (31) |
| 6 个月就诊前报告的疫苗接种情况,% (n) | 0 (0) | 5.0 (10)克 | 0 (0) |
缩写:抗 N、抗核衣壳;BAU/mL,结合抗体单位;IgG,免疫球蛋白 G;mRNA,信使 RNA。
各组之间的产妇年龄、婴儿分娩胎龄、出生体重和性别相似。大多数婴儿 (88.9%–92.5%) 在足月时出生 (表 1)。一般来说,初级 2 剂疫苗接种系列在妊娠中期完成,接种疫苗和分娩之间的中位间隔为 22.1 周(IQR,16.3-26.9),而第三剂加强疫苗接种是在怀孕后期接受的,从加强到分娩的中位间隔为 14.9 周(IQR,9.1-21.4)。所有组大多数婴儿在出生后的前 2 周和 2 个月内进行母乳喂养 (范围分别为 97.5%–100% 和 87.9%–94.5%)。到 6 个月时,母乳喂养婴儿的比例下降到 2 剂初级系列组的 68.6%,加强剂组的 80.8%,产后疫苗组的 90%。
在第 2 剂、加强剂和产后疫苗接受者中,通过报告或 N 蛋白阳性确认的 COVID-19 感染在分娩前 6 个月内的发生率分别为 12.3%、20.3% 和 8.3%。所有组分娩后 6 个月感染 COVID-19 的孕产妇参与者比例均增加。在婴儿中,2 个月时感染 COVID-19 的比例很小 (2.8%-4.0%),从 2 到 6 个月大时增加,所有组中 25% 至 30.7% 的婴儿在 6 个月大时被感染。我们之前报道过,我们婴儿群体的感染症状普遍较轻,在随访期间没有住院或死亡,当时 Omicron BA.1 和 BA.5 是主要的流行菌株。10
经胎盘抗体转移
IgG 结合抗体和 nAb 经胎盘转移到所有抗原的平均比率在 2 剂系列后为 1.13 至 3.93,加强疫苗接种后的平均比率在 1.68 至 2.78 之间(表 2)。在调整了从最后一次疫苗接种到分娩和分娩前孕产妇感染 COVID-19 的天数后,与 2 剂系列相比,加强疫苗接种后活 nAb 到 D614G 和 Omicron BA.1 和 BA.5 抗体的转移比率显着更高。
表 2.抗原和母体疫苗方案的结合和中和抗体转移比率
| 实验室检测 | 组 (n) | 转移比率平均值 (95% CI) | 脐带血 GMT (95% CI) | 母体血清 GMT (95% CI) | P 值a |
|---|---|---|---|---|---|
| 抗刺突 IgG | 两剂 mRNA 疫苗 (245) | 1.86 (1.77–1.96) | 568.79 (492.91–656.36) | 340.2 (291.18–397.47) | – |
| 抗刺突 IgG | 三剂 mRNA 疫苗 (172) | 1.68 (1.59–1.77) | 2916.98 (2531.14–3361.64) | 1880.36 (1608.04–2198.8) | .1898 |
| RBD IgG | 两剂 mRNA 疫苗 (245) | 1.88 (1.78–1.97) | 799.62 (685.46–932.81) | 479.9 (406.16–567.02) | – |
| RBD IgG | 三剂 mRNA 疫苗 (172) | 1.71 (1.61–1.82) | 4722.52 (4083.58–5461.44) | 3026.36 (2570.62–3562.91) | .3900 |
| 假型 WT nAb | 两剂 mRNA 疫苗 (240) | 3.93 (3.21–4.66) | 189.4 (162.37–220.92) | 88.22 (75.68–102.83) | – |
| 假型 WT nAb | 三剂 mRNA 疫苗 (171) | 2.78 (2.21–3.36) | 594.99 (493–718.09) | 339.07 (278.69–412.52) | .0792 |
| D614G 加标 nAb | 两剂 mRNA 疫苗 (229) | 1.73 (1.59–1.87) | 105.8 (89.4–125.21) | 75.77 (61.53–93.31) | – |
| D614G 加标 nAb | 三剂 mRNA 疫苗 (154) | 1.85 (1.66–2.04) | 729.13 (618.88–859.03) | 479.24 (396.52–579.21) | .0024 |
| B.1.1.529 (Omicron) 抗体 | 两剂 mRNA 疫苗 (229) | 1.2 (1.09–1.32) | 14.54 (13.06–16.2) | 13.73 (12.29–15.34) | – |
| B.1.1.529 (Omicron) 抗体 | 三剂 mRNA 疫苗 (154) | 1.89 (1.69–2.09) | 92.3 (74.79–113.91) | 61.02 (48.23–77.2) | <.0001 |
| BA.5 (Omicron) nAb 抗体 | 两剂 mRNA 疫苗 (117) | 1.13 (1–1.25) | 14.9 (12.84–17.29) | 14.62 (12.51–17.08) | – |
| BA.5 (Omicron) nAb 抗体 | 三剂 mRNA 疫苗 (130) | 1.76 (1.56–1.97) | 61.52 (49.9–75.83) | 41.79 (33.56–52.04) | <.0001 |
缩写: GMT,几何平均滴度;IgG,免疫球蛋白 G;mRNA,信使 RNA;nAb,中和抗体;RBD,受体结合结构域;WT,野生型。
可检测到抗体的婴儿比例
图 1 显示了未感染母体或婴儿的婴儿与所评估的每种抗原具有可检测结合 IgG 和 nAb 的比例。总体而言,100% 的婴儿在分娩时以及母亲在怀孕期间接受加强针时 2 个月和 6 个月时可检测到 S 和 RBD 结合抗体。6 个月时具有结合抗体的婴儿比例大于 90%,妊娠期接种 2 剂或加强疫苗接种后显著高于产后母体疫苗接种(图 1,表 S1)。当母亲接受单价疫苗加强剂时,从出生到 6 个月的婴儿中检测到 nAb(假病毒和活病毒)的比例更高(图 1,表 S2)。加强针母亲的婴儿在分娩时和 2 个月时出现 Omicron BA.1 和 BA.5 的 nAb 比例显着更高,但到 6 个月时,所有疫苗组之间的 CI 重叠。
婴儿结合和中和抗体的 GMT 和动力学
在未感染 COVID-19 且母亲在分娩前未感染 COVID-19 的婴儿中评估疫苗诱导的结合抗体和 nAb 的 GMT 和动力学(图 2 和补充信息表 S1、S2 和 S3)。尽管无论采用何种妊娠疫苗接种方案,从出生到 2 个月都观察到 GMT 大幅且迅速下降,但在怀孕期间接受加强剂的母亲的婴儿出生时和 2 个月时,结合、假病毒和活 nAb 的 GMT 显著升高与 2 剂系列或未接种疫苗相比(均 P 值<.01)(表 S3).在 6 个月时,与怀孕期间接受 2 剂系列或未接种疫苗的母亲相比,在怀孕期间接受加强剂的母亲的婴儿中针对 D614G 的结合、假病毒和活 nAb 的 GMT 显着升高 (P <.01),但针对 Omicron BA.1 和 BA.5 的活 nAb 在这个时间点没有显着差异(表 S3)。
导致婴儿分娩时和 6 个月大时抗体滴度的因素
与婴儿结合、假病毒和分娩时活 nAb 滴度显著相关的因素包括产妇产前接受 3 剂与 2 剂 COVID-19 疫苗和产妇产前感染 (均 P ≤.01;表 3A),而母体疫苗接种和分娩之间的较短间隔也与分娩时较高的结合和假病毒 nAb 滴度相关 (均 P < .01)。
表 3A.导致婴儿分娩时抗体滴度的因素
| 测定 | 协变量 | 单变量a | 多变量a | ||
|---|---|---|---|---|---|
| 估计值 (95% CI) | P 值 | 估计值 (95% CI) | P 值 | ||
| 加标 IgG | 3 与 2 产前剂量 | 0.70 (0.62–0.79) | <.001 | 0.53(−0.45 至 0.60) | <.001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.03(−0.04 至 −0.03) | <.001 | −0.02(−0.03 至 −0.02) | <.001 | |
| 母亲的产前感染与无产前感染 | 0.59 (0.45–0.73) | <.001 | 0.56 (0.47–0.66) | <.001 | |
| RBD IgG | 3 与 2 产前剂量 | 0.76 (0.67–0.85) | <.001 | 0.58 (0.50–0.66) | <.001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.03(−0.04 至 −0.03) | <.001 | −0.02(−0.03 至 −0.02) | <.001 | |
| 母亲的产前感染与无产前感染 | 0.66 (0.51–0.80) | <.001 | 0.62 (0.51–0.72) | <.001 | |
| 假病毒 nAb | 3 与 2 产前剂量 | 0.51 (0.40–0.61) | <.001 | 0.35 (0.25–0.45) | <.001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.02(−0.03 至 −0.02) | <.001 | −0.02(−0.03 至 −0.01) | <.001 | |
| 母亲的产前感染与无产前感染 | 0.56 (0.42–0.70) | <.001 | 0.55 (0.42–0.67) | <.001 | |
| 活病毒 D614G | 3 与 2 产前剂量 | 0.81 (0.33–1.29) | .002 | 0.75 (0.29–1.21) | .002 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.01(−0.04 至 0.02) | .41 | 0.00(−0.02 到 0.02) | .94 | |
| 母亲的产前感染与无产前感染 | 0.82 (0.16–1.47) | .018 | 0.71 (0.18–1.24) | .012 | |
| 奥密克戎 BA.1 | 3 与 2 产前剂量 | 0.86 (0.37–1.36) | .002 | 0.81 (0.37–1.24) | .001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.01(−0.04 至 0.02) | .47 | 0.00(−0.02 到 0.02) | .81 | |
| 母亲的产前感染与无产前感染 | 0.97 (0.31–1.62) | .006 | 0.85 (0.34–1.36) | .002 | |
| 奥密克戎 BA.5 | 3 与 2 产前剂量 | 0.62 (0.09–1.14) | .024 | 0.37(-0.05 至 0.78) | .078 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.01(−0.04 至 0.02) | .46 | −0.00(−0.02 至 0.01) | .80 | |
| 母亲的产前感染与无产前感染 | 1.06 (0.60–1.52) | <.001 | 0.93 (0.48–1.38) | <.001 | |
缩写:IgG、免疫球蛋白 G;nAb,中和抗体;RBD,受体结合结构域。
表 3B.导致婴儿 6 个月大抗体滴度的因素
| 测定 | 协变量 | 单变量a | 多变量a | 无投放滴度的多变量a | |||
|---|---|---|---|---|---|---|---|
| 估计值 (95% CI) | P 值 | 估计值 (95% CI) | P 值 | 估计值 (95% CI) | P 值 | ||
| 加标 IgG | 3 与 2 产前剂量 | 0.59(0.49 至 0.70) | <.001 | 0.01(−0.08 至 0.10) | .82 | 0.42 (0.33–0.52) | <.001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.03(−0.03 到 −0.02) | <.001 | −0.00(−0.01 至 0.00) | .58 | −0.02(−0.03 至 −0.02) | <.001 | |
| 婴儿分娩时的滴度 (log10) | 0.82 (0.76–0.88) | <.001 | 0.79 (0.70–0.88) | <.001 | – | – | |
| 母亲的产前感染与无产前感染 | 0.50 (0.34–0.66) | <.001 | 0.04(−0.07 至 0.15) | .46 | 0.46 (0.33–0.59) | <.001 | |
| 婴儿感染与无感染 | 0.32 (0.19–0.44) | <.001 | 0.32 (0.25–0.39) | <.001 | 0.30 (0.21–0.40) | <.001 | |
| RBD IgG | 3 与 2 产前剂量 | 0.69 (0.58–0.79) | <.001 | 0.04(−0.05 至 0.13) | .35 | 0.51 (0.41–0.62) | <.001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.03(−0.04 到 −0.02) | <.001 | −0.00(−0.01 至 0.00) | .74 | −0.02(−0.03 至 −0.02) | <.001 | |
| 婴儿分娩时的滴度 (log10) | 0.85 (0.80–0.91) | <.001 | 0.81 (0.73–0.90) | <.001 | – | – | |
| 母亲的产前感染与无产前感染 | 0.57 (0.40–0.74) | <.001 | 0.04(−0.07 至 0.15) | .49 | 0.52 (0.38–0.65) | <.001 | |
| 婴儿感染与无感染 | 0.22 (0.08–0.35) | .002 | 0.21 (0.14–0.28) | <.001 | 0.20 (0.10–0.30) | <.001 | |
| 假病毒 nAb | 3 与 2 产前剂量 | 0.17 (0.10–0.24) | <.001 | 0.06(−0.02 至 0.14) | .13 | 0.13 (0.06–0.20) | <.001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.01(−0.01 至 −0.00) | .008 | −0.00(−0.01 至 0.01) | .83 | −0.00(−0.01 至 0.00) | .053 | |
| 婴儿分娩时的滴度 (log10) | 0.25 (0.19–0.31) | <.001 | 0.09(−0.02 至 0.19) | .11 | – | – | |
| 母亲的产前感染与无产前感染 | 0.21 (0.11–0.31) | <.001 | 0.09(−0.02 至 0.19) | .11 | 0.19 (0.09–0.29) | <.001 | |
| 婴儿感染与无感染 | 0.14 (0.06–0.22) | <.001 | 0.15 (0.07–0.22) | <.001 | 0.13 (0.06–0.20) | <.001 | |
| 活病毒 D614G | 3 与 2 产前剂量 | 0.41 (0.31–0.51) | <.001 | −0.26(−0.89 至 0.37) | .38 | 0.33 (0.24–0.43) | <.001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.01(−0.02 到 −0.01) | <.001 | 0.01(−0.01 至 0.04) | .26 | −0.01(−0.02 至 −0.00) | .002 | |
| 婴儿分娩时的滴度 (log10) | 0.59 (0.27–0.91) | .002 | 0.74 (0.24–1.25) | .009 | – | – | |
| 母亲的产前感染与无产前感染 | 0.45 (0.30–0.59) | <.001 | −0.06(−0.73 至 0.60) | .84 | 0.43 (0.29–0.56) | <.001 | |
| 婴儿感染与无感染 | 0.12 (0.00–0.23) | .049 | 0.25(−0.28 至 0.78) | .31 | 0.09(−0.01 至 0.19) | .065 | |
| 奥密克戎 BA.1 | 3 与 2 产前剂量 | −0.06(−0.17 至 0.04) | .24 | −0.19(−0.84 至 0.47) | .53 | −0.11(−0.19 至 −0.03) | .007 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | −0.00(−0.01 至 0.01) | .76 | −0.01(−0.03 至 0.02) | .46 | −0.01(−0.01 至 −0.00) | .029 | |
| 婴儿分娩时的滴度 (log10) | 0.29(−0.15 至 0.74) | .17 | 0.37(−0.14 至 0.88) | .13 | – | – | |
| 母亲的产前感染与无产前感染 | 0.16 (0.01–0.31) | .04 | 0.31(−0.34 至 0.97) | .30 | 0.12 (0.01–0.23) | .034 | |
| 婴儿感染与无感染 | 0.70 (0.62–0.78) | <.001 | 0.81 (0.28–1.34) | .007 | 0.70 (0.62–0.78) | <.001 | |
| 奥密克戎 BA.5 | 3 与 2 产前剂量 | 0.15 (0.06–0.24) | .002 | 0.07(−0.40 至 0.54) | .73 | 0.13 (0.07–0.20) | <.001 |
| 最后一次给药和分娩之间的周数(每 1 周增加) | 0.00(−0.00 到 0.01) | .75 | 0.00(−0.02 至 0.03) | .76 | 0.00(−0.00 到 0.00) | .64 | |
| 婴儿分娩时的滴度 (log10) | −0.22 (0.98–0.53) | .52 | −0.19(−0.77 至 0.40) | .45 | – | – | |
| 母亲的产前感染与无产前感染 | 0.30 (0.17–0.43) | <.001 | 0.51(−0.23 至 1.25) | .14 | 0.22 (0.13–0.31) | <.001 | |
| 婴儿感染与无感染 | 0.68 (0.61–0.75) | <.001 | 0.88 (0.45–1.31) | .003 | 0.66 (0.60–0.73) | <.001 | |
缩写:IgG、免疫球蛋白 G;nAb,中和抗体;RBD,受体结合结构域。
与 6 个月大婴儿滴度显著相关的因素包括婴儿分娩时的滴度和出生后前 6 个月内的感染(表 3B)。当从模型中删除婴儿分娩时的滴度时,其他几个变量对 6 个月大时的婴儿滴度有显着影响,包括母体产前疫苗剂量 (3 vs 2)、妊娠期间母体接种疫苗的时间以及母亲的产前感染,表明婴儿分娩时的滴度是影响 6 个月大滴度持久性的母体产前因素的代表。
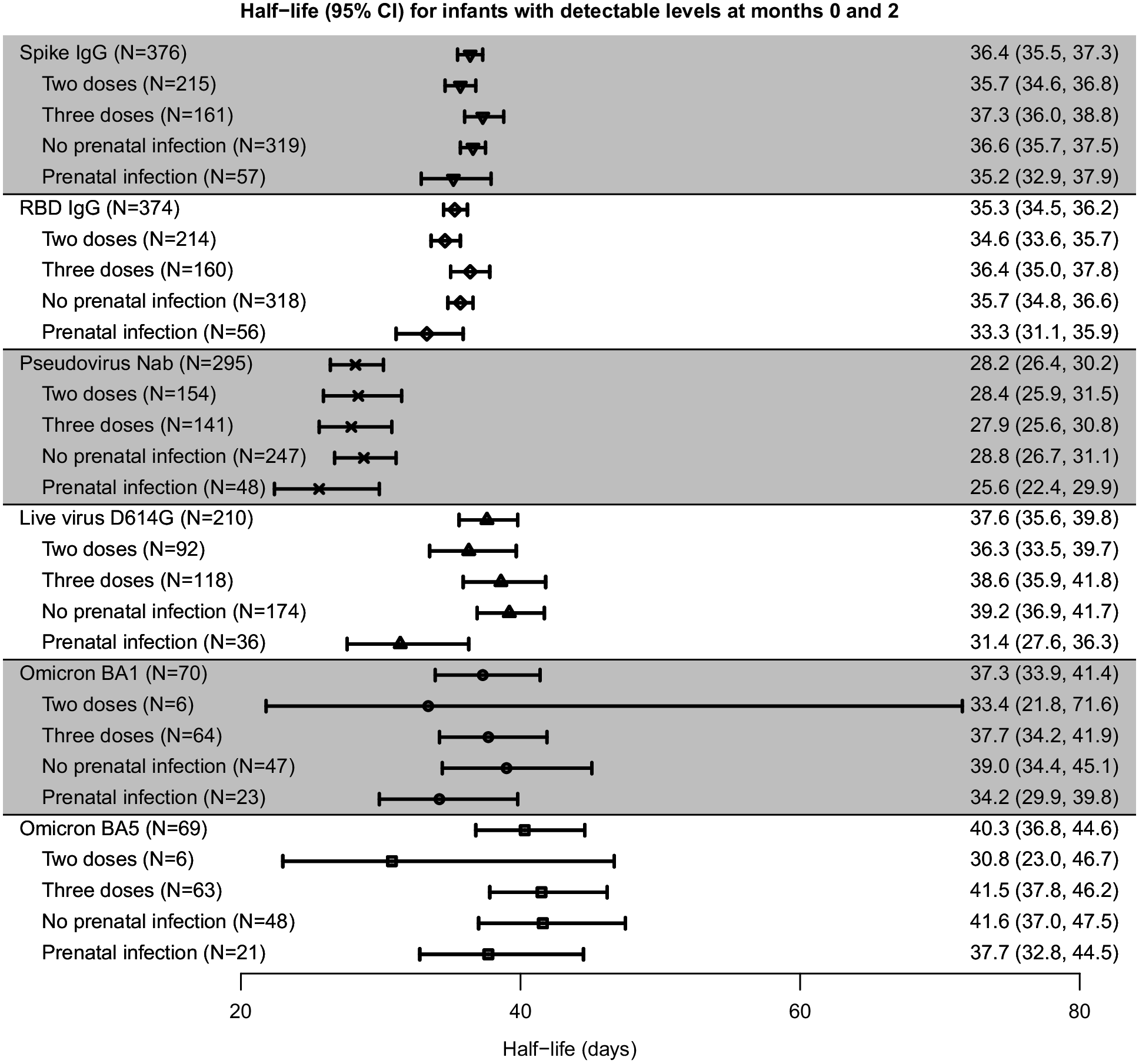
疫苗诱导的婴儿母源抗体的半衰期
婴儿疫苗诱导的刺突抗体和 RBD 结合抗体的计算半衰期总体为 36.4 天(95% CI,36.5-37.3)和 35.3 天(95% CI,34.5-36.2 天),母体疫苗接种方案或母体感染状况没有显着差异(图 3)。尽管通过假病毒检测测得的 nAb 计算半衰期略短,但 28.2 天(95% CI,26.4-30.2)天,即活 naB 的半衰期,总体上与 D614G(37.6 天;95% CI,35.6-39.8)、Omicron BA.1(37.3 天;95% CI,33.9-41.4)和 Omicron BA.5(40.3 天;95% CI,36.8-44.6)nAb 的结合抗体相似。 在 Omicron 分析中注意到更大的可变性,因为它包含的结果数量较少。由于许多因素,包括检测的动态范围、病毒变体、基于进入与基于传播的检测等,预计检测会存在差异。20,21 元
婴儿或母亲 COVID-19 感染对婴儿抗体反应的影响
与 3 剂疫苗组相比,2 剂疫苗组在 2 至 6 个月之间感染 COVID-19 的婴儿的结合和假病毒 nAb 滴度增加得更为明显(图 S2)。然而,在 2 至 6 个月之间感染的婴儿在 2 剂和 3 剂疫苗组中的 Omicron BA.1 和 BA.5 nAb 均大幅增加,这与当时主要流行的毒株一致。在所有组中观察到婴儿对感染的免疫反应,无论母体疫苗接种方案如何。
2 剂和 3 剂疫苗组在怀孕期间母体感染 COVID-19 导致婴儿在所有时间点的抗体滴度更高,这表明混合免疫增加了婴儿出生后前 6 个月的抗体持久性(图 S3)。
母乳喂养对婴儿滴度的影响
在比较母乳喂养的婴儿和非母乳喂养的婴儿时,未观察到不同时间点对婴儿血清 GMT 的显着影响(图 S4)。
讨论
我们在 COVID-19 大流行的早期阶段进行了一项观察性队列研究,涵盖 Delta 和 Omicron BA.4/BA.5 传播,当时的预防策略包括怀孕期间的常规疫苗接种和确认感染普遍的检测。
与仅接受 2 剂或产后接种疫苗的母亲的婴儿相比,在怀孕期间接受第 3 剂加强剂的母亲的婴儿在出生时和 2 个月大时对疫苗和 Omicron 变体的结合抗体和 nAb 滴度显着更高。6 个月时,结果相似,但针对 Omicron BA.1 和 BA.5 的活 nAb 在此时间点没有显著差异。与未接种产前疫苗相比,怀孕期间接种两剂疫苗也能够在出生和 2 个月时实现显着更高的结合和假病毒 nAb 滴度,但在 6 个月时则不能,与怀孕期间不接种疫苗相比,2 剂产前疫苗无法在 2 或 6 个月时实现更高的老虎对 Omicron BA.1 或 BA.5 的检测。此外,接受 2 次产前剂量的母亲的婴儿的抗体浓度大大低于加强母亲的婴儿的抗体浓度。在调整研究期间母婴感染的混杂效应后,这些发现是持续的。
导致婴儿出生时抗体滴度高的最重要因素是母亲在怀孕期间接受加强剂量的疫苗、从母亲接种疫苗到分娩的间隔较短以及怀孕期间母亲感染 COVID-19。在 6 月龄时达到持续高抗体滴度的最影响因素是婴儿分娩时滴度 (由母体疫苗接种和感染状态决定) 和婴儿感染。我们的研究结果表明,怀孕期间的加强疫苗接种和混合免疫(先前感染的母亲接种疫苗)有可能为婴儿提供更长时间的保护。
在大流行早期,在妊娠中期的初次母体疫苗接种被证明会导致强烈的母体反应和抗体有效地经胎盘传给新生儿。22,23 然而,与我们的研究结果一致,与妊娠中期相比,在妊娠晚期接受产前疫苗接种的母亲所生婴儿的抗体浓度更高。24,25 在 2021 年至 2023 年进行的一项前瞻性队列研究中,与接种 2 剂疫苗的人相比,在分娩前接种 3 剂疫苗的女性的脊髓抗刺突抗体滴度高 10 倍。25 当比较足月分娩和早产时,母体抗体滴度比出生时胎龄更能影响实现高脐带抗体浓度,作者得出结论,有早产风险的个体可以从怀孕期间额外剂量的 COVID-19 疫苗中受益。在美国疾病控制和预防中心对 2021 年接种疫苗的女性进行的一项多中心观察性免疫原性研究中,如果女性在怀孕的第三个三个月接种疫苗,nAb 到 D614G 样病毒的脐带血 GMT 高出 5 倍,并且在接近分娩时接种疫苗时也更高,滴度随着时间的推移而减弱,因此大多数婴儿在 6 个月大时没有可检测到的 nAb。26
此外,妊娠期使用 mRNA 疫苗加强疫苗接种已被证明可诱导强烈的抗刺突抗体反应,包括对 Omicron 毒株的反应。
婴儿接种疫苗后,COVID-19 抗体可以在 6 个月的生命中持续存在,27 早期研究表明,疫苗诱导的抗体比源自母体感染的抗体持续更长时间。27-30 人在我们的研究中,我们证明了妊娠期接种 mRNA COVID-19 疫苗后结合和 nAb 的高抗体经胎盘转移率 (>1),尤其是在妊娠晚期加强剂量给药后。总体而言,疫苗诱导的婴儿母源来源的 IgG 结合和 nAb 的计算半衰期为 33 至 40 天,不受母体疫苗接种方案或母体感染状态的影响。然而,2 剂和 3 剂疫苗组在怀孕期间母体感染 COVID-19 导致婴儿在所有时间点的抗体滴度更高,这表明混合免疫增加了婴儿生命前 6 个月的抗体持久性。尽管混合免疫对严重 COVID-19,特别是 Omicron 变体疾病的保护作用已在成人研究中多次描述,31-34 但混合母体免疫对婴儿出生时和出生后前 6 个月抗体滴度的影响尚不清楚。在韩国首尔进行的一项研究评估了接种疫苗的孕妇及其新生儿对 SARS-CoV2 祖先染色剂的母体和新生儿血清中和活性,结果表明,与仅感染或仅接种疫苗的个体相比,母亲和新生儿的 nAb 分别高 6 倍和 32 倍。35 尽管在本研究中 Omicron BA.5 毒株的中和活性较低,但混合免疫的有利效果仍然存在。
母源抗体在保护婴儿免受 COVID-19 症状和严重疾病侵害方面的作用先前已有描述。虽然尚未确定保护的抗体相关性,但之前从我们的研究队列中报告的数据表明,出生时较高的经胎盘结合和 nAb 滴度大大降低了婴儿在出生后前 2 个月内出现 COVID-19 症状感染的风险,第三次加强剂量放大了这种保护,因此分娩时抗 S-IgG 滴度每增加 10 倍, 婴儿感染的风险降低了 47%。10 在一项在 Delta 变体期间对 30 000 多名婴儿进行的大型研究中,接受至少 2 剂母体 COVID-19 疫苗接种对婴儿在前 6 个月内免受 SARS-CoV-2 感染和住院具有保护作用。9 在 Omicron 变体期间也观察到了这种效果,特别是如果在怀孕期间接种第三剂或加强剂,37 该剂量增强了对更具传染性的 Omicron 变体的保护。38 鉴于随着大流行的发展,妊娠期严重 COVID-19 的发病率有所下降,与早期和 Delta 大流行期相比,住院频率和不良产科结局较少,孕产妇疫苗接种的一个关键目标是保护太小而无法接种疫苗的婴儿,这些婴儿继续因 COVID-19 而患病和死亡。39 在 2022-2024 年期间,怀孕期间的 COVID-19 疫苗接种率从 18% 下降到不到 5%,但 COVID-19 相关住院网络报告称,儿科住院率最高的是 6 个月以下的婴儿(每 100 000 名婴儿 ≤23.0 人,与 65-74 岁的成年人相似),每 5 名因 COVID-19 住院的婴儿中就有 1 名需要入住重症监护病房, 每 20 人中就有 1 人需要机械通气,9 人在与 COVID-19 相关的住院治疗期间死亡。4 本报告中特别令人担忧的是,在已知母亲疫苗接种状况的住院婴儿中,87.5% 的母亲在怀孕期间没有接种 COVID-19 疫苗的记录,并且所有死亡的婴儿都是未接种疫苗的母亲所生。我们的研究结果强烈支持对以前接种疫苗或感染的母亲进行产前 COVID-19 疫苗接种,以增加婴儿从出生到 6 个月的潜在保护性抗体滴度。
局限性
这项研究受到其观察设计的限制,因为根据当代建议,参与者的疫苗接种发生在怀孕和产后的不同时间,这导致疫苗剂量之间以及最后一次疫苗接种和分娩之间的间隔不同。此外,该研究是在 Omicron 出现期间进行的,Omicron 是一种未包含在可用疫苗中的毒株。然而,密切随访和对研究访问的高度依从性允许评估导致婴儿分娩时抗体滴度和持续到 6 个月大的因素,包括母婴感染,这些因素已通过实验室测试证实。本研究并非旨在评估母乳喂养对婴儿感染的保护作用,我们无法评估含有 Omicron 的疫苗或其他加强剂对母亲的影响。
结论
怀孕期间母体 COVID-19 加强剂导致婴儿从出生到 6 个月的结合抗体和 nAb 明显高于怀孕或产后疫苗接种的 2 剂。尽管经胎盘来源的抗体滴度在出生后的前 6 个月迅速下降,但出生时较高的浓度可能会提供更长的保护时间,直到婴儿达到适龄时接种疫苗。孕产妇在妊娠期接受加强剂量的疫苗和母体独立和共同感染 (混合免疫) 导致婴儿滴度较高且持续时间更长。0 至 6 个月的婴儿仍然处于 COVID-19 重症和住院的高危人群中。这项研究支持先前接种疫苗或感染的母亲在怀孕期间接种 COVID-19 疫苗,以优化抗体滴度和从出生到 6 个月的婴儿保护。
Munoz、Cardemil、Beigi 和 Neuzil 博士构思和设计了这项研究,设计了数据收集工具,协调和监督数据收集,起草了初始手稿,并对手稿的重要知识内容进行了批判性审查和修订。Badell、Bunge、Mulligan、Parameswaran、Olson-Chen、Novak、Brady、DeFranco、Gerber 和 Piper 博士收集了数据,并对手稿进行了批判性审查和修订。Posavad、Pasetti、Shriver、Coler、Larsen、Suthar 和 Moreno 博士协调和监督数据收集,进行实验室测试,并严格审查和修改手稿。Richardson 和 Brown 博士以及 Gundacker 女士和 Sui 女士设计并进行了分析,并对手稿进行了批判性审查和修订。所有作者都批准了提交的最终手稿,并同意对工作的各个方面负责。在临床研究报告最终确定后,为该研究收集的数据将作为去识别化的患者数据集提供给其他人,由传染病临床研究联盟自行决定。数据分析,包括分阶段分析的数据,将在科学会议上展示和出版,以告知科学界。如果初步分析被认为具有公共卫生重要性或与为妊娠期 SARS-CoV-2 疫苗的研究、开发和实施提供信息相关,则可以与公共卫生官员和合作伙伴分享结果,以告知全球科学界。该研究将根据美国国立卫生研究院公共访问政策出版物和数据共享政策和法规进行。要在完成后索取研究数据,请联系 Flor Munoz 博士 (florm@bcm.edu)。
利益冲突披露:Munoz 博士是辉瑞 COVID-19 疫苗儿科研究和吉利德科学公司进行的儿科瑞德西韦研究的研究员;担任美国国立卫生研究院疫苗治疗和评估部门合同以及疾病控制和预防中心新疫苗监测网络支持的项目的调查员,担任辉瑞、莫德纳、Meissa 疫苗、Virometix 和美国国立卫生研究院进行的临床试验的数据安全监测委员会成员;并且是美国儿科学会传染病分会的成员、美国妇产科学院免疫专家组的成员,以及流行病防范创新联盟紧急 vACcines 特殊人群工作包安全平台的主席。Parameswaran 博士作为辉瑞和赛诺菲的首席研究员和子实习生获得临床试验合同支持,以及 Robert A. Winn 临床试验多样性培训计划的工资支持。Badell 博士与礼来、辉瑞和赛诺菲签订了疫苗或单克隆抗体抗 SARS-CoV-2 的合同资金,进行实验室研究和临床试验,并从默克、Meissa Vaccines, Inc 和辉瑞获得科学顾问委员会服务的个人费用。Novak 博士是吉利德的付费顾问,也是美国国立卫生研究院资助的 Moderna、Pfizer 和 Janssen 疫苗试验的研究员。Brady 博士获得了 PATH、阿斯利康和辉瑞公司对临床试验的研究资助,她担任这些公司的联合研究员。Suthar 博士曾担任 Moderna 的顾问(截至 2021 年 12 月),目前担任 Ocugen, Inc. 的顾问。Richardson 博士目前在 Gilead Sciences, Inc. 的数据安全和临床试验监测委员会任职。Neuzil 博士是世界卫生组织免疫战略咨询专家组的成员。Neuzil 博士目前担任美国国立卫生研究院 Fogarty 国际中心的主任。布朗博士在由美国国立卫生研究院和比尔&梅琳达·盖茨基金会(正在进行)以及默克公司(过去)资助的研究的数据安全和监测委员会中任职。其他作者没有相关的冲突需要披露。
资金:这项研究由传染病临床研究联盟通过美国国立卫生研究院下属的国家过敏和传染病研究所提供支持,奖励编号为 UM1AI148684、UM1AI148575、UM1AI148372、UM1AI148452、UM1AI148576、UM1AI148574、UM1AI148450、UM1AI148685、UM1AI148689 和 UM1AI148373。内容完全由作者负责,并不一定代表美国国立卫生研究院的官方观点。
临床试验注册:本文反映了 2021 年 12 月 13 日的协议版本 5.0—微生物学和传染病部 21–0004,ClinicalTrials.gov 编号 NCT05031468。招聘于 2021 年 7 月 6 日开始,并于 2022 年 1 月 31 日结束。
Hits: 23
相关文章:
- 研究显示 COVID-19 从母亲到新生儿的传播率很低
- COVID-19疫苗的有效性和较少的常见副作用是成年人是否选择接种疫苗的最重要因素
- RFK Jr 对孕妇的 COVID 疫苗的看法是错误的
- 怀孕期间接种新冠 疫苗似乎对婴儿神经发育是安全的
- 了解家庭医生特征与COVID-19疫苗接种差距之间的联系
- 冠状病毒肺炎孕期接种疫苗保护新生儿
- 人工智能模型证实疫苗接种是减少监狱新冠肺炎的关键
- 研究确定女性、心脏病是长期 COVID 危险因素,疫苗接种是保护性因素
- 现场注射:药剂师如何通过免疫诊所活动增加流感、新冠肺炎和呼吸道合胞病毒疫苗接种
- 数据显示,COVID 2024-25 疫苗对急诊室或紧急护理就诊的保护率为 33%
- 年轻人的癌症发病率在大流行之前上升,与 COVID-19 或疫苗无关,这与 Patrick Soon-Shiong 在 Tucker Carlson 采访中的说法相反
- Covid-19:在大型全球研究中发现两种罕见的疫苗副作用
- 为什么我在怀孕期间应该接种新冠肺炎疫苗?
- 以下是怀孕期间接种 COVID 疫苗背后的科学
- 哺乳期接种COVID-19疫苗注意事项
Powered by YARPP.