Contents
- 1 摘要
- 2 主要
- 3 PCV13 血清保护反应降低
- 4 对 B 型脑膜炎球菌疫苗接种的反应
- 5 抗生素改变婴儿转录组
- 6 循环免疫细胞群
- 7 抗生素对微生物群的影响
- 8 GF 小鼠 PCV13 反应受损
- 9 双歧杆菌增强 PCV13 反应
- 10 讨论
- 11 方法
- 11.1 研究设计
- 11.2 样本采集
- 11.3 疫苗接种时间表
- 11.4 肺炎球菌多糖特异性 IgG
- 11.5 白喉、破伤风和百日咳特异性 IgG
- 11.6 Hib-PRP 和 HB-sAg 特异性 IgG
- 11.7 IgA 血清学
- 11.8 疫苗反应高和低
- 11.9 多重调理吞噬方法
- 11.10 人血清杀菌活性检测
- 11.11 用于流式细胞术的婴儿血液制备
- 11.12 从血液中提取 RNA
- 11.13 RNA 文库制备
- 11.14 RNA 测序分析
- 11.15 从粪便样本中提取 DNA
- 11.16 定量实时 PCR 分析,以确定婴儿粪便样本中的细菌载量
- 11.17 宏基因组文库制备
- 11.18 宏基因组数据分析
- 11.19 临床前小鼠实验
- 11.20 小鼠的疫苗接种
- 11.21 小鼠粪便取样
- 11.22 从小鼠粪便样本中提取 DNA
- 11.23 16S rRNA 基因序列分析
- 11.24 定量实时 PCR 分析以确定细菌载量
- 11.25 小鼠抗体反应的评估
- 11.26 组织解离和流式细胞术分析
- 11.27 免疫荧光染色和成像
- 11.28 统计分析
- 11.29 报告摘要
- 12 数据可用性
- 13 代码可用性
Bifidobacteria support optimal infant vaccine responses
摘要
越来越多的证据表明,接触抗生素可能会导致疫苗反应受损1,2,3,4; 然而,这种关联背后的机制仍不为人所熟知。在此,我们前瞻性地追踪了 191 名健康的、经阴道分娩的足月婴儿,从出生一直到 15 个月大,采用系统疫苗学方法来评估接触抗生素对疫苗免疫反应的影响。在婴儿 7 个月大时,接触新生儿期(而非分娩期)的抗生素与针对 13 价肺炎球菌结合疫苗中多种多糖的抗体滴度显著降低有关,也与针对六联疫苗(Infanrix Hexa vaccine)中 b 型流感嗜血杆菌多核糖醇磷酸和白喉类毒素抗原的抗体滴度显著降低有关。接触过新生儿期抗生素的婴儿的血液在接种疫苗前呈现出炎性转录特征;此外,粪便宏基因组学研究显示,这些婴儿在接种疫苗时双歧杆菌属的丰度降低,这与 6 个月后疫苗抗体滴度降低相关。在临床前模型中,对 13 价肺炎球菌结合疫苗的反应强烈依赖于完整的微生物群,但在无菌小鼠中,通过给予一组双歧杆菌或一种已在新生儿病房广泛使用的益生菌,可恢复其免疫反应。我们的数据表明,以微生物群为靶点的干预措施可以减轻生命早期接触抗生素对疫苗免疫原性的不利影响。
其他人正在查看类似内容
主要
全球免疫规划每年防止数百万人死亡5,6;然而,由于尚不清楚的原因,对疫苗接种的免疫反应表现出很大的个体间差异,并且在感染性疾病风险最大的人群中往往表现不佳7。越来越多的证据表明,肠道微生物群是一个重要且可靶向的因素,它可能至少部分解释了对疫苗接种的免疫反应的个体间和种群间差异7,8。在小鼠中,生命早期的抗生素暴露已被证明会导致对五种不同的佐剂和减毒活肠外疫苗的抗体反应受损1。经抗生素处理和无菌 (GF) 的成年小鼠也被证明对无佐剂流感疫苗的抗体反应受损,但对活黄热病疫苗的抗体反应则不然9或 COVID-19 信使 RNA (mRNA) 疫苗10。此外,在接种无佐剂的三价流感疫苗之前随机接受抗生素治疗的成年参与者中和和结合抗体滴度显著受损;然而,在预先存在流感免疫力的成年人中未观察到这种情况11。另一方面,在随机接受抗生素治疗的成年人中,未发现口服轮状病毒疫苗免疫原性降低12。与我们之前的临床前数据一致,表明抗生素可能对生命早期对佐剂疫苗的抗体反应产生更深远的影响1,最近的一项回顾性研究发现,抗生素暴露婴儿的疫苗抗体滴度较低2。出生后第一年的累积抗生素暴露也与 12 个月时的疫苗反应降低有关3,4.
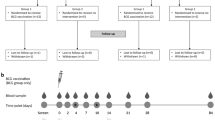
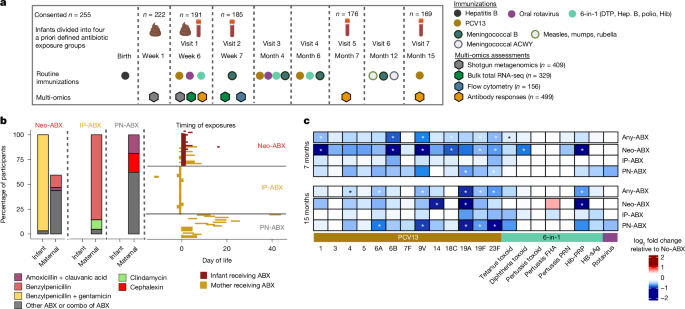
为了前瞻性评估生命早期抗生素暴露是否会影响对疫苗接种的抗体反应并更好地了解所涉及的机制,我们建立了一项前瞻性观察研究,招募了健康、足月、阴道分娩的婴儿。婴儿被定义为围产期未暴露于抗生素(no-ABX,n = 80)或暴露于抗生素(ABX,n = 111)(图 1a 和扩展数据图 1.ABX 婴儿进一步细分(图 D.1b) 分为先验定义的三个抗生素暴露组(方法.新生儿直接抗生素暴露组 (neo-ABX) 的 32 名婴儿中有 30 名 (94%) 在出生后 48 小时内开始使用抗生素,其中 31 名 (97%) 接受静脉注射 (i.v.) 苄基青霉素和庆大霉素至少 48 小时。在这些婴儿中,19 名还在产时或产后暴露于或可能暴露于母体抗生素(补充表 1.在产时抗生素暴露 (IP-ABX) 组中,49 名母亲中有 36 名 (73%) 在分娩前 48 小时内接受了静脉注射苄基青霉素,7 名 (14%) 接受了静脉注射苄基青霉素与至少一种其他口服或静脉注射抗生素的联合治疗,4 名 (8%) 接受静脉注射克林霉素,1 名接受静脉注射克林霉素加口服头孢氨苄,并且——与该组的先验定义一致, 其中包括在怀孕最后 28 天内接受抗生素治疗的母亲——其中一位在出生前第 12 天至第 10 天接受口服头孢氨苄。出生后抗生素暴露组 (PN-ABX, n = 30) 婴儿的母亲在出生后从出生到 45 天口服了各种不同的抗生素,7 名婴儿还接受了静脉注射抗生素(补充表 1.不同暴露组的母婴人口统计数据以及母乳喂养率具有可比性,但益生菌的使用量除外,ABX 组的益生菌使用量较高(扩展数据表 1.
a,AIR 研究设计概述。本研究未测量对脊髓灰质炎、麻疹、腮腺炎、风疹和脑膜炎球菌 ACWY 疫苗的反应。b,新生儿直接抗生素暴露组(Neo-ABX,n = 32 名婴儿)、产时抗生素暴露组(IP-ABX,n = 49 名婴儿)和产后抗生素暴露组(PN-ABX,n = 30 名婴儿)的婴儿及其母亲服用抗生素。 c,热图显示了 Neo-ABX(7 个月时 n = 27,15 个月时 n = 26)、IP-ABX(7 个月时 n = 43,15 个月时 n = 42)和 PN-ABX(7 个月时 n = 26,15 个月时 n = 27)婴儿收集的血清中疫苗抗原特异性抗体几何平均浓度 (GMC) 的倍数变化,相对于无 ABX 婴儿(7 个月时 n = 64, n = 65 在 15 个月时.蓝-红渐变分别表示倍数变化减少和增加。使用调整性别和基线抗体滴度的广义线性模型评估 c 的统计显着性。*P < 0.05(未调整.所有统计检验均为双侧。确切的 P 值在补充表 3a 中提供。中的图标是使用 BioRender (https://biorender.com) 创建的。DTP;白喉、破伤风和百日咳;Hep., 肝炎。
这项研究中 86% 的婴儿在出生时接种了乙型肝炎疫苗。在出生后大约 6 周,其他主要儿童疫苗的第一剂按照 2017 年澳大利亚国家免疫计划 (NIP) 计划的建议进行接种。在大约 4 个月和 6 个月大时给予进一步的初级剂量(图1a)。在基线以及 7 个月和 15 个月时测量针对 20 种不同疫苗抗原的血清 IgG 滴度和抗轮状病毒疫苗 IgA 滴度(扩展数据图 1.2a–u),使用先前验证的免疫测定13、14、15、16、17、18 。为了评估 ABX 组与抗体对疫苗接种反应之间的关系,我们使用了多变量回归调整性别和基线抗体滴度;这是因为基线滴度,正如预期的那样19,通常与后续抗体滴度呈负相关(扩展数据图 .与无 ABX 婴儿相比,在接种 13 价肺炎球菌结合疫苗 (PCV13)、6 合 1 Infanrix Hexa 和轮状病毒疫苗之前暴露于任何抗生素的婴儿对 PCV13 疫苗中六种荚膜肺炎球菌多糖(PPS1、6B、9V、18C、19F 和 23F)的 IgG 滴度显著降低 (P < 0.05),并且在 7 个月大时抗破伤风类毒素 IgG 滴度显著降低(图 D.1c 和补充表 2a)。按暴露组细分后,抗 PPS IgG 滴度的降低在 Neo-ABX 婴儿(PPS1、6B、9V、18C、19F 和 23F)中很明显,但在 IP-ABX 婴儿中则不明显(图 D.1c,扩展数据图3a-f 和补充表 3a)观察到抗 PPS4 和 PPS5 滴度降低的类似趋势(但不是其他多糖的滴度降低)(扩展数据图 1.3g-m)。针对白喉类毒素和 b 型流感嗜血杆菌 (Hib) 聚核糖基核糖醇磷酸酯 (PRP) 抗原(6 合 1 Infanrix Hexa 疫苗中的抗原)的 IgG 滴度在 7 个月大时 Neo-ABX 婴儿也显着降低(图 D.1c 和扩展数据图3n,o)。在抗破伤风类毒素 IgG 滴度中观察到类似的趋势 (P = 0.09)(扩展数据图 1.ABX 组与针对百日咳类毒素 (PT)、乙型肝炎表面抗原 (HB-sAg)、Pertactin (PRN) 或丝状血凝素 (FHA) 的 IgG 滴度或血清口服轮状病毒疫苗 IgA 滴度没有可检测到的关联(扩展数据图 1.3q–u)PN-ABX 婴儿在 7 个月时抗 PPS19A 和 23F IgG 滴度显著降低(图 D.1c),表明母亲产后抗生素暴露可能对婴儿随后对疫苗接种的反应产生影响,但影响程度小于直接给新生儿使用抗生素。
除抗破伤风类毒素 IgG 滴度外,所有评估抗原在 15 个月时抗体滴度均显著低于 7 个月,这与免疫力随时间减弱一致20(扩展数据图 .2a-u.在首次接种 PCV13、6 合 1 和轮状病毒疫苗之前使用的任何抗生素都与 15 个月时针对 PCV13 疫苗中六种不同血清型(PPS4、6A、9V、19A、19F 和 23F)和 Hib-PRP 的 IgG 滴度显著降低相关(图 .1c 和补充表 2a)按暴露组细分后,仅在此时的 Neo-ABX(PPS14、PPS19A、Hib-PRP)和 PN-ABX(PPS6A、9V、19A、19F、23F)婴儿中观察到 IgG 滴度显著降低(扩展数据图 1.4a-u 和补充表 3a)IP-ABX 婴儿无显著差异。我们还纵向分析了抗体数据(而不是分别在 7 个月和 15 个月时分析),发现 Neo-ABX 婴儿针对 13 种血清型中 9 种的 IgG 滴度显著降低(补充表 3b)。综上所述,我们的数据表明,暴露于抗生素的婴儿,尤其是那些在新生儿期直接暴露于抗生素的婴儿,对几种不同疫苗抗原的免疫原性受损,尤其是结合多糖疫苗中的抗原。
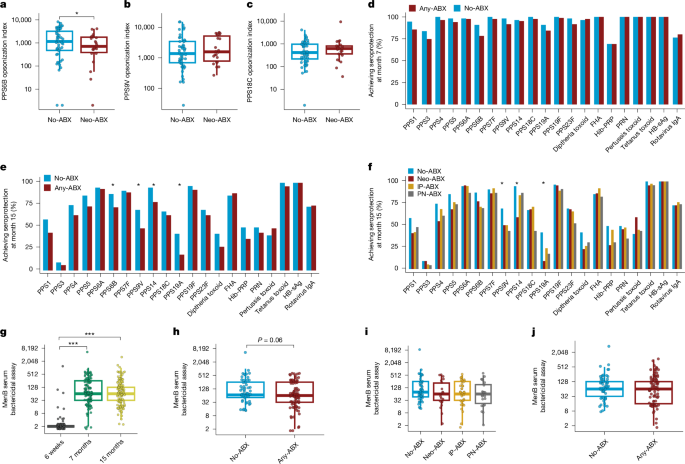
接下来,我们使用调理吞噬试验来评估针对三种 PCV13 血清型 (6B、9V 和 18C) 的抗体的功能,这些血清型在 Neo-ABX 婴儿中结合抗体滴度显著降低。与无 ABX 婴儿相比,7 个月时 Neo-ABX 婴儿血清的调理吞噬活性显著低于血清型 6B (P < 0.05),但对血清型 6V 或 18C 没有(图 1.2a-c)。这些数据表明,新生儿抗生素暴露不仅会在数月后损害疫苗诱导的结合抗体滴度,而且在某些情况下还会降低这些抗体的功能。
a-c,7 个月时从 Neo-ABX (n = 26) 和 No-ABX (n = 59) 婴儿收集的血清对 PPS6B (a) 、PPS9V (b) 和 PPS18C (c) 的自吞作用活性。d,e,在 7 (d) 和 15 (e) 个月时对每种疫苗抗原实现血清保护反应的 No-ABX (n = 55) 和 Any-ABX (n = 83) 婴儿的比例。f,No-ABX (n = 55)、Neo-ABX (n = 22)、IP-ABX (n = 38) 和 PN-ABX (n= 23) 婴儿在 15 个月时对每种疫苗抗原达到血清保护反应的比例。g,第 7 周(疫苗接种前,n= 140)和第 7 (n = 139) 和 15 (n= 138) 个月时对脑膜炎奈瑟菌 NZ98/254 的血清杀菌活性。h,7 个月时血清杀菌活性几何平均滴度 (GMT) 除以无或任何抗生素暴露(No-ABX,n= 57; Any-ABX,n = 82. i,7 个月时的血清杀菌活性 GMT 细分为指定的抗生素暴露组(No-ABX,n = 57; Neo-ABX,n = 22; IP-ABX,n = 37; PN-ABX,n = 23. j,血清杀菌活性 GMT 细分为 15 个月时无抗生素暴露或任何抗生素暴露(No-ABX,n = 56; Any-ABX,n = 82. n 表示每种情况下婴儿的样本量。对于 a-c 和 g-j 中的箱形图,箱形表示第 25 个和第 75 个百分位数,须线表示第 5 个和第 95 个百分位数,中间条形表示中位数。d-f 中的条形图以百分比表示数据。使用广义线性模型(高斯分布)评估 a-c 和 g-j 的统计显着性,使用 logistic 回归评估 d-f 的统计显着性,调整性别。*P < 0.05,***P < 0.001(未经调整.所有统计检验均为双侧。中提供了确切的 P 值。
PCV13 血清保护反应降低
接下来,我们评估了 ABX 组与抗体反应高于为每种疫苗抗原定义的血清保护阈值的婴儿比例之间的关联(补充表 2b)。在 7 个月大时,即接种三剂 PCV13 和 6 合 1 疫苗后 1 个月,大多数婴儿(69-100%,取决于疫苗抗原)实现了血清保护反应(图 D)。2d 和补充表 2b),尽管高于一种 PCV13 多糖 PPS6B 血清保护阈值的 Neo-ABX 婴儿比例显著降低(补充表 3c)。到 15 个月时,任何暴露组中保持抗体滴度高于血清保护阈值的婴儿百分比已大幅下降,几种抗原低于 50%(图 D)。尽管这种减弱,但与无 ABX 婴儿相比,所有 13 种 PCV13 血清型在 15 个月时暴露于任何抗生素的婴儿高于血清保护阈值的比例较低。四种血清型 (PPS6B 、 9V 、 14 和 19A) 的这些降低具有统计学意义,并且抗白喉类毒素滴度有趋势 (P = 0.06.PPS14 和 19A 以及 PPS9V 和 19A 的 Neo-ABX 和 PN-ABX 婴儿高于血清保护阈值的比例显着降低 (P < 0.05)(图 1.2f 和补充表 3c)。在 IP-ABX 婴儿中未观察到血清保护反应显著受损。这些分析使用了世界卫生组织接受的 PCV13 血清保护阈值 (0.35 μg ml−1).使用血清型特异性血清保护阈值对数据进行再分析21显示出相同的趋势(补充表 3d)。这些结果表明,在抗生素暴露的婴儿中,特别是那些在新生儿期直接接受抗生素治疗的婴儿,疫苗诱导的对某些肺炎球菌血清型的保护作用可能会更快地减弱。
对 B 型脑膜炎球菌疫苗接种的反应
我们研究中的婴儿还接受了四剂四组分 B 脑膜炎球菌疫苗 (4CMenB) (图 D.1a). 在 7 周时(4CMenB 疫苗接种前)、7 个月和 15 个月时具有匹配样本的婴儿血清对脑膜炎奈瑟菌 NZ98/254 的杀菌活性,脑膜炎奈瑟菌是国际公认的脑膜炎球菌血清型 B 疫苗保护的替代物,其滴度大于或等于 1:4 被认为是保护性的22。与基线相比,7 个月和 15 个月样本中疫苗接种后血清杀菌活性滴度显著增加(图 D)。尽管有这些非常高的血清保护反应,但我们观察到暴露于任何抗生素的婴儿在 7 个月时血清杀菌活性滴度降低的趋势 (P = 0.06) 。当婴儿进一步按抗生素暴露组分组时,未观察到这种情况(图 D.2i),可能是由于统计功效降低。在 15 个月时未观察到显著差异(图 D.2j) 的 4 月 1 日,在第四剂 4CMenB 给药后约 3 个月。
抗生素改变婴儿转录组
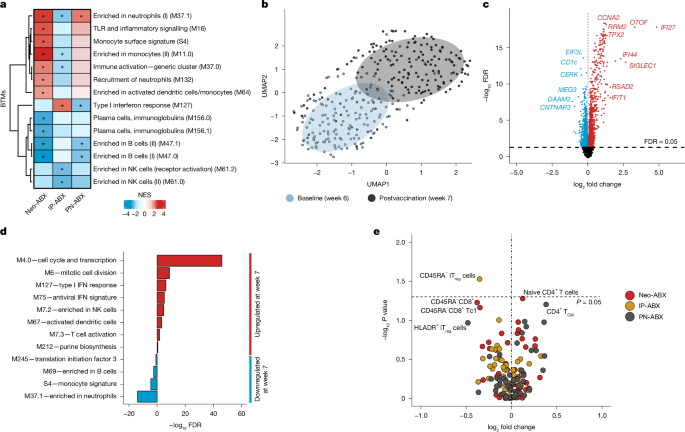
在成人中,基线或诱导的疫苗接种后血液中的转录反应已被证明与随后的疫苗特异性抗体反应相关23。在这里,我们分析了在基线和第一剂疫苗接种后约 1 周收集的 329 份婴儿血液样本中的外周血转录组(补充表 4)。基因集富集分析,一种强大的方法,可用于检测基因表达的细微但协调的变化23,24,25 元显示基线时 Neo-ABX 婴儿中几种与炎症相关的血液转录模块 (BTM) 上调(图 D.3a 和补充表 5)。在 IP-ABX 婴儿中上调的基因中发现这些 BTMs 中很少富集,这可能在功能上相关,因为在 Neo-ABX 婴儿中观察到疫苗抗体反应受损,而不是在 IP-ABX 婴儿中观察到。以前也报道过在接受抗生素混合物治疗的成人中炎症模块的上调11。相比之下,B 细胞相关和血浆细胞相关模块在 Neo-、IP- 和 PN-ABX 婴儿中经常下调。上调的单核细胞相关 BTM 的活性与 7 个月时的抗体反应呈负相关,而 B 细胞相关 BTM 的活性呈正相关(扩展数据图 1)。综上所述,这些数据表明,与疫苗接种抗体反应相关的 BTM 在基线时发生改变,尤其是在 Neo-ABX 婴儿中。值得注意的是,几种与自然杀伤细胞相关的 BTM 在 IP-ABX 婴儿下调的基因中富集,表明尽管 IP-ABX 可能与对疫苗接种的体液反应受损无关,但它可能会以其他方式改变生命早期的免疫系统。
a,热图显示了 Neo-ABX (n = 24)、IP-ABX (n= 44) 和 PN-ABX (n = 25) 婴儿与无 ABX 婴儿 (n= 66) 接种疫苗前所选 BTM 的标准化富集分数 (NES.n 表示进行 RNA 测序时每组预接种疫苗的婴儿数。蓝-红梯度分别表示相对于 No-ABX 婴儿的 BTM 活性降低和增加。b,疫苗接种前后全血基因表达数据的 UMAP 投影(n = 329 个婴儿血液样本),使用 SVAseq 根据性别和批次进行调整38。c, 疫苗接种后差异表达基因的火山图。d,在差异表达基因中统计富集的选定 BTM。e,火山图显示 Neo-ABX (n = 27)、IP-ABX (n = 40) 和 PN-ABX (n = 26) 婴儿相对于 No-ABX (n = 63) 婴儿循环免疫细胞群的倍数变化。使用 fgsea 评估统计学意义39R 封装在 a 和 d 中,并使用 edgeR40在 C 语言中打包。Benjamini-Hochberg 方法用于调整 a、c 和 d 的多重比较,FDR < 0.05 被认为表明统计学显著性。使用双尾 Wilcoxon 符号秩检验评估 e 中的统计显着性,而不调整多重比较。星号表示 FDR < 0.05。确切的 P 值可以在补充表或中找到。NK,自然杀伤;T厘米、中枢记忆 T 细胞;T注册,调节性 T 细胞。
与疫苗接种前基线相比,在接种第一剂疫苗后约 1 周,外周血转录组存在明显差异(图 D.3b),接种疫苗后鉴定出 3,089 个差异表达基因(错误发现率 (FDR) < 0.05)(图 D.3c 和补充表 6.这些差异是由疫苗接种驱动的,而不是两个时间点之间婴儿年龄的 1 周差异(扩展数据图 1.5b,c)。BTMs 在接种疫苗后上调(图 D.3d) 包括几个与成人疫苗接种反应相关的23(扩展数据图 .5d 和补充表 7)。与 B 细胞、单核细胞和中性粒细胞相关的 BTMs 在疫苗接种后下调的基因中富集。从广义上讲,不同 ABX 组对疫苗接种的转录反应幅度相似(扩展数据图5e,f)。然而,由于 Neo-ABX 婴儿在基线时改变了转录活性,因此这些婴儿在接种疫苗后与无 ABX 婴儿相比具有显着不同的 BTM 活性(扩展数据图 1.5g 和补充表 5)。
循环免疫细胞群
我们对与用于 RNA 测序的第 7 周血样同时采集的新鲜外周血样本中的 40 多种不同免疫细胞群进行了流式细胞术分析(补充表 8 和补充图1-3)。尽管 CD45RA 的数量略有减少−IP-ABX 婴儿的调节性 T 细胞(图 D.3e 和扩展数据图5h,i),与未暴露的婴儿相比,任何 ABX 组中所有其他免疫细胞群的数量和频率都没有显著差异(扩展数据图 1.5j-o 和补充表 9)。此外,我们探讨了高疫苗反应者和低疫苗反应者之间是否有任何循环免疫细胞群存在差异,但我们没有检测到任何显着差异(数据未显示.这些结果表明,在 ABX 婴儿中观察到的转录差异主要不是由主要循环免疫细胞群的频率差异驱动的。
抗生素对微生物群的影响
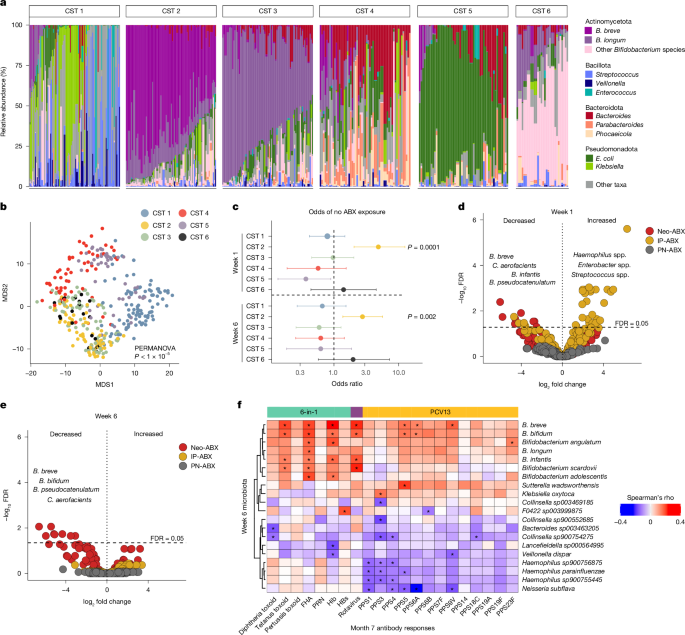
我们在第 1 周和第 6 周收集了粪便样本 (n = 409),其中 89% 的第 6 周样本是在首次接种 PCV13、6 合 1 和口服轮状病毒疫苗后 1 天内收集的。因此,这些样本的鸟枪法宏基因组测序能够对接种疫苗时这些婴儿粪便微生物群的组成有独特的见解(补充表 10)。超过 1200 万个支架被分配到 3,774 个宏基因组组装基因组 (MAG) 中,包括来自 43 个细菌科的 300 多个物种。放线菌门和假单胞菌门在这两个时间点都是最丰富的门,这与之前的研究结果一致26。ABX 组之间的细菌载量在任一时间点均无显著差异(扩展数据图 .6a)。Neo-ABX 和 IP-ABX 婴儿在第 1 周时的 α 多样性(均匀度和丰富度)显着降低 (P ≤ 0.05)(扩展数据图 1.6b,c)。从第 1 周到第 6 周,细菌载量和 α 多样性均显著增加 (P < 0.001)(扩展数据图 .6a-c)。我们还评估了抗菌素耐药基因携带,并观察到 Neo-ABX 和 IP-ABX 婴儿的携带增加(扩展数据图 1.6d,e)。
使用狄利克雷多项式混合物模型对宏基因组样本进行聚类,我们确定了六种群落状态类型 (CST)(图 D.4a,b)。CST-2 具有较高的双歧杆菌属(尤其是短双歧杆菌)的中心对数比 (CLR) 丰度,但也包括长双歧杆菌、两歧双歧杆菌和婴儿双歧杆菌,并且在第 1 周和第 6 周的无 ABX 婴儿中均显著过高(图 D.4c 和扩展数据图),值得注意的是,CST-3 没有观察到这一点,与 CST-2 相比,CST-3 的长双歧杆菌的 CLR 丰度更高。接下来,我们评估了 ABX 组之间特定细菌分类群的丰富度是否存在差异。与无ABX婴儿相比,许多分类群,包括肠杆菌属、克雷伯菌属、嗜血杆菌属、柠檬酸杆菌属和链球菌属的几个分类群,在IP-ABX婴儿在第1周时具有显著较高的CLR丰度(FDR<0.05),但在第6周时则没有(图.4d,e, 扩展数据图6g,h 和补充表 11)。相应地,IP-ABX 婴儿在第 1 周时几种不同双歧杆菌属的 CLR 丰度显著降低 (FDR < 0.05),但在第 6 周则没有(图 D.4d,e, 扩展数据图6i 和补充表 11)。与 IP-ABX 婴儿微生物群组成的变化一致,我们检测到 298 个宏基因组编码通路,这些通路在第 1 周差异丰富 (FDR < 0.05),但在第 6 周没有差异(补充表 12)。这些数据表明,产时抗生素对粪便微生物群组成和功能能力的影响是短暂的,并且在接种第一剂疫苗时已经解决。
a,通过鸟枪法宏基因组测序确定从研究婴儿收集的粪便样本 (n = 409) 的分类组成。样本按 CST 分组。b,六个 CST 的多维缩放 (MDS) 分析。c,在生命第 1 周和第 6 周,每个 CST 中样本 (n = 396) 来自未接触抗生素的婴儿的比值比。d,e,火山图显示第 1 周时 Neo-ABX、IP-ABX 和 PN-ABX 婴儿粪便微生物群中分类群的 CLR 丰度的折叠变化(No-ABX,n = 79;Neo-ABX, n = 36;IP-ABX,n = 55; PN-ABX n = 33) (d) 和第 6 周 (No-ABX, n = 80;Neo-ABX,n = 33; IP-ABX,n = 49; PN-ABX,n = 31) (e. n 表示婴儿的数量。f,热图表示第 6 周婴儿粪便微生物群中前 10 名最正相关和前 10 名最负相关分类群的 CLR 丰度与第 7 个月时对疫苗接种的抗体反应(根据性别和基线滴度调整)之间的相关性。蓝-红渐变分别表示负和正 Spearman 相关性 (n = 139,三个时间点的数据匹配.有关确切的相关系数,请参见补充表 13。c 中的误差线表示 95% 置信区间。使用 b 中的方差置换多变量分析、c 中的 Fisher 精确检验、d 和 e 中 MicrobiomeState R 包中的 LinDA 方法以及 f 中的 cor.test R 函数来评估统计显着性。所有统计检验均为双侧。Benjamini-Hochberg 方法用于调整 d 和 e 的多重比较,其中 FDR < 0.05 被认为表明具有统计学意义。*P < 0.05(未调整.d 和 e 的确切 FDR 值可以在补充表 11 中找到。
相比之下,各种双歧杆菌物种的 CLR 丰度,包括短双歧杆菌、假双歧杆菌和双歧双歧杆菌(图 D.4d,e 和扩展数据图6j–l)在第 6 周时,Neo-ABX 婴儿的几种 Collinsella 种属显着减少 (FDR < 0.05),即接种第一剂 PCV13、6 合 1 和口服轮状病毒疫苗的时间(补充表 11)。在一些但不是所有先前评估抗生素对早期肠道微生物群影响的研究中,已经报道了双歧杆菌相对丰度降低27.与 Neo-ABX 婴儿第 6 周粪便微生物群组成的持续变化一致,我们与 No-ABX 婴儿相比,在这个时间点确定了 406 个差异丰富的宏基因组编码通路 (FDR < 0.05)(补充表 12)。这些数据表明,在接种疫苗时,新生儿抗生素暴露诱导的肠道微生物群组成和编码功能的持续变化——特别是双歧杆菌种类丰度的减少——可能在这些婴儿中观察到的对疫苗接种的次优抗体反应中发挥作用。与此一致,第 6 周时几种双歧杆菌的 CLR 丰度与 7 个月时针对几种不同疫苗抗原的 IgG 滴度呈正相关(图 D.4f 和补充表 13a)。第 1 周分类群丰度与第 7 个月抗体反应之间的相关性较弱,尽管双歧杆菌物种的 CLR 丰度与抗 PPS6B IgG 滴度之间存在正相关 (P < 0.05)(扩展数据图 1.7a 和补充表 13b。鉴于这些关联,我们接下来评估了高疫苗反应者与低疫苗反应者在 6 周时双歧杆菌是否增加。在对几种不同疫苗抗原(尤其是 PPS6B)的高反应者中,短双歧杆菌、两歧双歧杆菌和长双歧杆菌的 CLR 丰度(但不是假链双歧杆菌)的 CLR 丰度显著增加(扩展数据图 7b 和补充表 13)。因果中介分析28,29 还表明短双歧杆菌和两歧双歧杆菌与 PPS6B IgG 滴度 (P < 0.05) 呈显著的正直接关系,这些滴度是由炎症相关 (BTM M11.0,P < 0.05) 介导的,而不是 B 细胞相关转录活性介导的。 这些数据表明,抗生素暴露可能会触发促炎状态,阻碍双歧杆菌定植和/或生长,从而影响最佳疫苗反应。
GF 小鼠 PCV13 反应受损
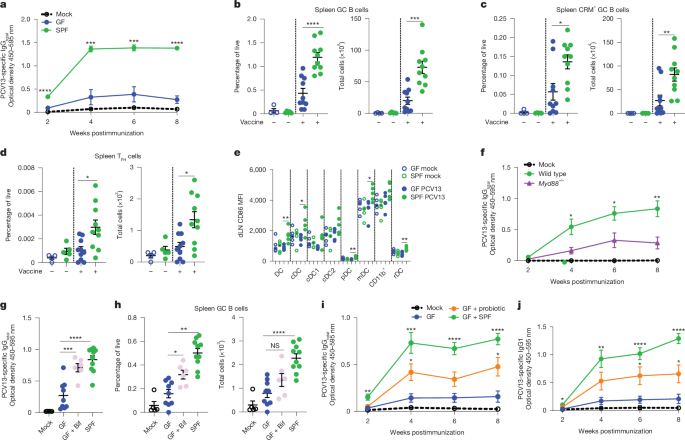
我们的临床数据表明,对 PCV13 疫苗的抗体反应可能特别依赖于来自肠道微生物群的信号。为了评估这是否也反映在临床前模型中,我们比较了从接种 PCV13 疫苗的常规无特异性病原体 (SPF) 和 GF 小鼠收集的血清中的抗体反应。在 GF 小鼠中,血清中 PCV13 特异性 IgG、IgG1、IgG2c、IgG3 和 IgM 反应明显受损(图 D.图5a 和扩展数据图8a-d),针对 PPS1、PPS3、PPS6B、PPS9V 和 PCV13 偶联蛋白 CRM197 的 IgG 滴度也是如此(扩展数据图 .8e-i)。用 6 合 1 疫苗免疫的 GF 小鼠的抗白喉类毒素和抗破伤风类毒素 IgG 反应也显着受损;然而,与我们在 Neo-ABX 婴儿中的观察类似,他们的抗百日咳类毒素反应与 SPF 小鼠没有显着差异(扩展数据图 .8j-l)GF 小鼠在接种 4CMenB 疫苗后也具有与 SPF 小鼠相当的抗体反应(扩展数据图 1)。我们最近报道了 GF 小鼠对辉瑞/BioNTech COVID-19 mRNA 疫苗的 B 细胞和 T 细胞反应,这与 SPF 小鼠的反应相当10。综上所述,这些数据表明,与接受抗生素治疗的婴儿一样,小鼠对 PCV13 的反应特别依赖于来自肠道微生物群的信号。
a, PCV13 特异性 IgG总在接种两剂 PCV13 的 GF (n = 9) 和 SPF (n = 10) 小鼠的血清中。模拟的、接种 PBS 疫苗的小鼠 (n = 3.b–d,GC B 细胞总数 (b) 或 CRM197+ 的频率和总数加强后 2 周模拟疫苗接种小鼠 (n = 9) 和接种 PCV13 的 GF (n = 10) 和 SPF (n = 10) 小鼠脾脏中的 GC B 细胞 (c);以及 T 的频率和总数FH (中文)这些小鼠脾脏中的细胞 (d.e,在 PCV13 或模拟疫苗接种后 24 小时(每组 n = 5 只小鼠),GF 和 SPF 小鼠 dLN 中指示髓系细胞群的 CD86 平均荧光强度 (MFI.f, PCV13 特异性 IgG总模拟疫苗接种小鼠 (n = 5) 和 PCV13 疫苗接种的 Myd88 血清中的抗体−/− (n = 10) 和同窝野生型 (n = 10) 小鼠。g, PCV13 特异性 IgG总在模拟疫苗接种小鼠 (n = 5) 和 PCV13 疫苗接种(腹膜内两剂,间隔 2 周)SPF (n = 10) 和 GF (n = 9) 小鼠的血清中,以及由母系出生的 GF 小鼠在怀孕期间用双歧杆菌物种联盟定植,并在出生后第 7 天和第 14 天再次施用这些菌株 (GF + Bif,n = 6. 显示的数据是在加强后 2 周。h,增强后 2 周小鼠脾脏中 GC B 细胞的频率和总数。i,j,PCV13 特异性 IgG总 (i) 和 IgG1 (j) 在出生后第 21 天用益生菌菌株嗜酸乳杆菌和两歧双歧杆菌定植的 GF 小鼠 (GF + 益生菌,n = 7) 的血清中。小鼠在出生后第 28 天接种疫苗。a-j 中的数据表示 s.e.m. ±平均值。a-d 中的数据代表三个或更多独立实验;E-J 中的数据代表了两个独立的实验。使用 Tukey 后测分析的双向方差分析评估 a、f、i 和 j 的统计显著性进行多重比较,在 b-e 中使用双尾学生 t 检验,在 g 和 h 中使用单因素方差分析与 Dunnett 后测分析进行多重比较。*P < 0.05;**P < 0.01;P < 0.001;P < 0.001;NS,不显著。中提供了确切的 P 值。
为了调查原因,我们接下来评估了在最佳 T 依赖性体液免疫反应中起关键作用的生发中心 (GC) 反应在 PCV13 免疫的 GF 小鼠中是否次优。与 SPF 小鼠相比,用两剂 PCV13 免疫的 GF 小鼠总 CRM197 和 CRM197 显著降低特异性 GC B 细胞(图 D.5b,c)和引流淋巴结 (dLN) (扩展数据图 .8n–q)。滤泡辅助性 T 的比例 (TFH (中文)) 细胞(图5d),但不在 dLN 中(扩展数据图 .8r,s)在 GF 小鼠中也显着降低。共聚焦显微镜证实 PCV13 免疫的 GF 小鼠的 GC 形成受损(扩展数据图 1.9)。这些数据表明,由于这些小鼠的最佳 GC 形成失败,PCV13 免疫的 GF 小鼠对疫苗接种的 T 依赖性抗体反应受损。
我们接下来提出,由于接种疫苗后先天免疫激活受损,GF 小鼠可能无法对 PCV13 产生最佳 GC 反应。与这一假设一致,在首次接种 PCV13 后 24 小时,我们观察到几种不同髓系细胞群的细胞上活化标志物 CD86 的表面表达显着增加,包括树突状细胞 (DC)、常规树突状细胞 (cDC)、浆细胞样树突状细胞 (pDC)、迁移性树突状细胞 (mDC) 和常驻树突状细胞 (rDC) 在 SPF 而非 GF 小鼠的 dLN 中(图 D.5e)。 接种疫苗后 24 小时,GF 或 SPF 小鼠未诱导 MHCII 或 CD80 的表达(扩展数据图 1.10a,b)。值得注意的是,鉴于我们观察到的双歧杆菌种类的 CLR 丰度增加与婴儿抗体滴度升高之间的关联,怀孕期间用短双歧杆菌定植的 GF 母系所生的小鼠(以确保从出生开始定植)在 PCV13 疫苗接种后 24 小时与保持 GF 的小鼠相比,CD86 表达显着更高(扩展数据图 13.10c)。
鉴于 GF 小鼠似乎对 PCV13 免疫的先天免疫反应受损,我们提出了进一步的假设,即来自微生物群的信号可能通过 MyD88 依赖性途径起作用。与此一致,Myd88 中血清 IgG 、 IgG1 、 IgG2c 和 IgM 对 PCV13 的反应严重受损−/−小鼠(图 .5f 和扩展数据图10d-f)。之前的一项研究发现,TLR5 介导的微生物群感应是抗体对非佐剂流感疫苗的反应所必需的9。然而,我们之前已经表明,对明矾佐剂 PCV13 疫苗的抗体反应在 Tlr5 中不受影响−/−小 鼠1。鉴于此,我们反而研究了 Tlr4 中对 PCV13 的反应−/−和 Tlr2−/−小鼠发现提示 Tlr4 中 PCV13 特异性抗体反应受损的趋势−/−但不是 Tlr2−/−小鼠(扩展数据图 .10g,h)。这些数据表明,对 PCV13 疫苗的最佳抗体反应可能需要通过 MyD88 依赖性途径感应微生物群;然而,需要进一步的工作来确定所涉及的上游模式识别受体,并指出不同受体之间的冗余是可能的。
双歧杆菌增强 PCV13 反应
我们的临床数据表明,免疫接种时婴儿双歧杆菌种类的丢失导致对 PCV13 和其他疫苗的抗体反应受损。为了评估对 GF 小鼠施用双歧杆菌物种联盟是否可以恢复 PCV13 特异性抗体反应,我们将短双歧杆菌、长双歧杆菌长亚种和婴儿双歧杆菌亚种的混合物施用到怀孕的母鼠中,以确保其后代从出生开始定植。这些幼仔 (GF + Bif) 和 GF 或 SPF 小鼠所生的幼仔在出生后第 21 天左右接种 PCV13 疫苗,并在 2 周后再次接种。与我们的假设一致,与 GF 小鼠相比,GF + Bif 幼仔在第二次接种 PCV13 后 2 周的 PCV13 特异性 IgG、IgG1 和 IgM 抗体反应显着更高(图 D.5G 和扩展数据图10i,j)。与 GF 小鼠相比,GF + Bif 小鼠脾脏中 GC B 细胞的比例或总数也显著更高(图 D.5h) 和 dLN (扩展数据图 .10k)。T 的比例或数量FH (中文)GF + Bif 小鼠的细胞也较高(扩展数据图 1.10l,m)。值得注意的是,我们观察到 GF + Bif 小鼠在仅接种一剂疫苗后对 PCV13 的抗体反应没有增加(扩展数据图 1.10n-p)。
接下来,我们想确定是否可以通过在更接近接种疫苗时(而不是通过它们的母亲)直接对 GF 小鼠进行益生菌干预来恢复 GF 小鼠对 PCV13 的反应。为了评估这一点,我们比较了 SPF 小鼠、GF 小鼠和在接种 PCV13 (GF + 益生菌) 前 1 周用商业益生菌 Infloran 菌株定植的 GF 小鼠对 PCV13 的反应。我们选择 Infloran 是因为它含有两歧双歧杆菌和嗜酸乳杆菌的混合物,还因为它常用于新生儿重症监护病房以预防坏死性小肠结肠炎30,31 。因此具有既定的临床安全性和明显的转化潜力。此外,我们观察到的双歧杆菌种类中,新 ABX 婴儿的丰度降低,而疫苗反应率高的婴儿丰度增加(扩展数据图 1.7b). GF 小鼠中 PCV13 特异性 IgG 和 IgG1 反应通过用 Infloran 益生菌菌株定植而显着增强(图 D.5i,j)。值得注意的是,单独使用任一菌株对 GF 小鼠的定植不足以增强对 PCV13 的抗体反应(扩展数据图 D.10q–s)。众所周知,双歧杆菌属使用各种交叉喂养协同策略,涉及肠道微生物群的其他成员,以获取它们无法代谢的碳水化合物;32这可能解释了为什么两种培养物都不会增强抗体反应。与此一致,同时用两歧双歧杆菌和嗜酸乳杆菌菌株定植的小鼠的细菌载量比单独用任一菌株定植的小鼠高两个对数倍(扩展数据图在 PCV13 疫苗接种前用一系列其他共生分离株定植 GF 小鼠并没有增强对 PCV13 疫苗接种的反应(扩展数据图 1.10u-w)。总之,我们的数据表明,在接种疫苗前恢复暴露于抗生素的婴儿中富含双歧杆菌的健康微生物群,可能会增强对疫苗接种的抗体反应并增强对传染病的保护。
讨论
我们之前已经表明,小鼠早期接触抗生素会导致对一系列不同婴儿疫苗的反应受损1;这促使我们进行我们在此处报告的前瞻性临床研究。与之前的临床前数据一致,我们发现暴露于抗生素的婴儿,特别是在新生儿期直接抗生素治疗,在 7 个月和 15 个月大时针对几种疫苗抗原的血清 IgG 滴度显著降低。我们的结果补充了先前几项重要研究(补充讨论)的发现,表明对某些类型的疫苗的免疫反应,特别是蛋白质多糖结合疫苗,如 PCV13,可能比其他疫苗更依赖于来自肠道微生物群的信号。需要进一步调查以确定为什么会这样;然而,这可能与多糖偶联疫苗与佐剂蛋白疫苗和其他平台(如 mRNA 疫苗)相比免疫原性较低有关10。
我们的临床和临床前数据表明,婴儿肠道微生物群中的双歧杆菌物种在介导对 PCV13 和其他疫苗的最佳先天性、GC 和血清抗体反应方面具有重要作用,并且对暴露于新生儿抗生素的婴儿施用益生菌可能是一种可行、廉价且安全的干预措施,可以提高对疫苗接种的反应。这需要在适当人群的随机对照试验中进行严格测试(补充讨论)。与我们的数据一致,之前的一些相关研究报告了双歧杆菌种类的相对丰度与对卡介苗 (BCG)、口服脊髓灰质炎和破伤风类毒素疫苗的反应之间存在关联33,34 。此外,GF 小鼠定植了长双歧杆菌 subp。最近发现婴儿对 BCG 疫苗的 T 细胞反应增加35.值得注意的是,在我们的研究中,产时抗生素暴露与对疫苗接种的抗体反应降低无关 (补充讨论)。一种可能的解释是,在第一剂疫苗接种时,暴露于产时抗生素的婴儿双歧杆菌种类的丰度没有显著降低,而直接接受抗生素治疗的婴儿的双歧杆菌丰度显著降低。
尽管我们取得了重要的发现,但我们的研究也有一些局限性。样本量相对适中,尤其是当抗生素暴露组根据抗生素暴露类型进一步细分时。现在有必要在更大的队列中进行进一步研究。令人鼓舞的是,我们在婴儿中的结果与我们在动物模型中的观察结果非常一致。我们的研究排除了剖宫产所生的婴儿和体重指数大于 30 的母亲所生的婴儿。未来的研究应调查这些因素和其他因素是否改变了婴儿肠道微生物群36还可以影响对疫苗接种的免疫反应。最近的一项研究报告称,剖宫产所生婴儿对唾液中肺炎球菌荚膜多糖的 IgG 滴度显著降低(该研究中未收集血清)37。此外,在接种疫苗后更多时间点和使用单细胞技术评估基因表达反应可以进一步完善我们对暴露于抗生素的婴儿转录反应改变与疫苗接种反应欠佳之间联系的理解(补充讨论)。最后,我们的研究主要集中在结合抗体滴度上,因为这些是大多数疫苗保护的既定相关性;然而,我们发现新生儿期接受抗生素治疗的婴儿血清对三种 PCV13 多糖之一 PPS6B 的调理吞噬活性显著降低。此外,与未接触抗生素的婴儿相比,接种了 4CMenB B脑膜炎球菌疫苗的婴儿所收集的血清的杀菌活性(针对脑膜炎奈瑟菌)略有降低。未来的研究还应更详细地评估抗生素暴露对功能性抗体反应的影响,以及 T 细胞对疫苗接种的反应。总之,我们发现早期抗生素暴露与疫苗免疫原性显着受损相关,对 PCV13 疫苗的免疫反应有特别影响。这些作用似乎是由双歧杆菌种类丰度的减少介导的,这反过来又导致基线免疫状态的改变。我们的研究结果强调需要将生命早期抗生素管理的基本原理扩大到抗菌素耐药性之外,以及精确疫苗接种方法在优化疫苗介导的传染病保护方面的潜力。
方法
研究设计
2017 年 4 月至 2021 年 3 月期间,澳大利亚阿德莱德妇女儿童医院招募了婴儿,作为抗生素和免疫反应 (AIR) 研究的一部分,这是一项前瞻性观察性临床研究 (ACTRN12617000856314)。产后病房的研究研究护士会联系潜在参与者,如果母亲和婴儿符合研究资格标准,则会邀请他们参加。以前还通过产前保健包中的小册子向在妇女儿童医院分娩的妇女提供了研究信息。在书面知情同意书后,向家庭提供粪便采集包,并审查医疗病例记录以确认资格标准和抗生素暴露状态。该研究的伦理批准已获得妇女和儿童健康网络人类研究伦理委员会的批准(批准号 HREC/17/WCHN/19),作者确认他们已遵守所有相关的伦理法规。
排除标准是妊娠少于 37 周;母亲体重指数大于 30(妊娠早期产前检查时);妊娠期母体脓毒症(定义为血培养或脑脊液中经实验室证实的细菌感染);剖宫产分娩的婴儿;婴儿确诊败血症(定义为血培养或脑脊液中经实验室证实的细菌感染);已知或疑似会阻止对疫苗产生免疫反应的免疫系统疾病,例如先天性或获得性免疫缺陷,或接受全身免疫抑制治疗;疑似或确诊 HIV、严重先天性异常或严重疾病的婴儿;母亲或婴儿参与可能干扰参与本研究的临床研究;以及任何会使个人处于更高风险或妨碍他们完全依从或完成研究的事情。对于免疫原性分析,仅包括在研究访问 1 时至少接种一种疫苗的参与者。
根据病历审查和与母亲的讨论,参与者被分配到抗生素暴露组进行免疫原性分析,以确定在研究访问 1 (大约 6 周龄) 接种疫苗前的任何抗生素暴露。抗生素暴露组先验定义如下:没有直接或母亲抗生素暴露的婴儿 (n = 80,No-ABX);(1) 在新生儿期 (出生后的前 28 天) 接受至少 48 小时抗生素治疗的婴儿,有或没有母亲接触抗生素 (n = 32, Neo-ABX);(2) 母亲在产时接受抗生素治疗(分娩前或分娩期间 28 天内)且在 6 周龄之前没有直接接触婴儿抗生素的婴儿 (n = 49,IP-ABX);(3) 不符合 No-ABX、Neo-ABX 或 IP-ABX 组纳入标准的婴儿。研究完成后,第 3 组的所有婴儿都是在出生后疫苗接种前母乳喂养期间可能接触母体抗生素的婴儿,因此我们将该组称为出生后暴露组 (PN-ABX,n = 30. 进行血清学检测、组学分析和其他数据分析的研究人员对抗生素暴露组分配不知情。参与者数据记录在安全的 REDCap (https://project-redcap.org/) 数据库中。
样本采集
父母在第 1 周(出生后第 2-10 天)和第 6 周(出生后第 38-56 天)从每个婴儿的尿布(尿布)中收集用于宏基因组学的粪便样本,并放入 Zymo DNA/RNA Shield 粪便收集管(Zymo Research)中,然后储存在 -80 °C。 在大约 6 周、7 周、7 个月和 15 个月时从婴儿身上获得血液 (3-5 ml)。6周时,将1-3 ml全血放入BD Vacutainer血清管中,将2 ml放入PAXgene血液RNA管(BD)中保存RNA,并储存在−80 °C。 第 7 周时,在 BD Vacutainer K3 EDTA 管中收集最多 1 ml 血液,收集 2 ml 用于流式细胞术分析,剩余部分(最多 2 ml)放入 PAXgene (BD) 管中。在 7 个月和 15 个月时,将 3-5 ml 血液收集到 BD Vacutainer 血清管中。
疫苗接种时间表
根据 2017 年南澳大利亚州 NIP 计划,婴儿在 6 周零 4 个月和 6 个月大时接种 PCV13(Prevenar 13,辉瑞)和 6 合 1 联合疫苗(Infanrix Hexa,GSK),并在 6 周和 4 个月大时接种口服轮状病毒疫苗(Rotarix,GSK)。大多数婴儿 (86%) 在出生时也接种了乙型肝炎疫苗(H-B-Vax II 儿科或 Engerix B 儿科)。本研究中的婴儿还在 7 周、4 个月和 6 个月大时接种了 B 型脑膜炎球菌疫苗 (4CMenB/Bexsero, GSK),并在 12 个月大时接种了加强剂。作为标准NIP计划的一部分,在12个月大时接种了ACWY(Nimenrix,辉瑞)和麻疹、腮腺炎、风疹(M-M-R II; Merck Sharp & Dohme; 或Priorix,GSK)疫苗(尽管在这项研究中并未评估这些疫苗的抗体反应.在这项研究中,PCV13 的加强剂量是在 15 个月时提供的,而不是目前的 NIP 预定时间点 12 个月大。除口服轮状病毒疫苗外,所有疫苗均采用肌肉注射给药。所有疫苗均按照澳大利亚免疫手册的建议进行接种。
肺炎球菌多糖特异性 IgG
如前所述测量针对 PCV13 血清型的抗体13、15、16 ,经过修改。简而言之,Bio-Plex COOH 微球 (6.25 × 106,500 μl,Bio-Rad)与优化剂量的 DMTMM 修饰的肺炎球菌多糖 (ATCC) 在 1× PBS pH 7.2 (Life Technologies) 中偶联过夜,根据 Schlottmann 等人。41最佳包被剂量为 1:1 剂量,500 μl 微球和 500 μl DMTMM 修饰的多糖,适用于血清型 1、3、5、7F 和 9V;以及 1:0.5 剂量的 500 μl 微球和 250 μl DMTMM 修饰的多糖,用于血清型 4、6A、6B、14、18C、19A、19F、23F 和 11A。
将人抗肺炎球菌胶囊国际参考标准 007sp (NIBSC) 的 10 步、3 倍连续稀释,两个内部质量控制和测试样品在含有 0.05% Tween-20、2% N-丁基苯磺酰胺 (Sigma-Aldrich) 和 2.5 μg ml 的吸附缓冲液中稀释−1CWPS Multi (SSI Diagnostica) 30 分钟以去除非特异性抗体,然后与多糖偶联的微球孵育。将等体积 (25 μl) 的稀释样品和每个区域含有 4,000 个微球的微珠混合物混合在用 50 μl 0.05% PBS 和 Tween-20 (PBS-T) 预润湿的 MultiScreen 滤板 (Merck) 上。将板在室温下避光在轨道振荡器上以 500 rpm 孵育 20 分钟。然后用 100 μl 0.05% PBS-T 洗涤两次,然后加入 100 μl (1:150) RPE 偶联的山羊抗人 IgG Fc 二抗 (Jackson ImmunoResearch Laboratories Inc.) 并再孵育 20 分钟。洗涤后,将珠子重悬于 125 μl 0.05% PBS-T 中,并在 Bio-Plex-200 机器 (Bio-Rad) 上读取。
白喉、破伤风和百日咳特异性 IgG
如前所述测量百日咳类毒素、百日咳素、丝状血凝素、破伤风类毒素和白喉类毒素特异性抗体浓度14,42 。
Hib-PRP 和 HB-sAg 特异性 IgG
如前所述测量白喉、破伤风和百日咳 (DTP) 的 Hib-PRP 和 HB-sAg 抗体14,42 ,仅更改使用的抗原包被微球、质控品和参比血清。简而言之,DMTMM 修饰41。如上所述,将 Hib-PRP 12/306 (NIBSC) 与 Bio-Plex COOH 微球 (Bio-Rad) 偶联,最佳剂量为 1:1,500 μl 微球与 500 μl DMTMM 修饰的多糖。如前所述,重组 HB-sAg 亚型 adr (Prospec Bio) 与 DTP 抗原偶联,最佳包被浓度为 10 μg ml−1.在测定该血清中的抗 HB-sAg 滴度后,使用抗 H. b 型流感嗜血杆菌国际标准 09/222 (NIBSC) 的 10 步、3 倍连续稀释作为参考血清。使用最终的 Bio-Plex 方案,根据第二个抗 HB-sAg 国际标准 07/164 (NIBSC) 量化 09/222 中的抗 HB-sAg 滴度;使用当前的金标准方法 Alinity i 抗 HBs 试剂盒 (PathWest) 进一步验证了它们,该方法显示出出色的一致性(变异系数小于 5%.
IgA 血清学
如前所述,通过经过验证的酶联免疫测定法测量轮状病毒 IgA 抗体17,18 。
疫苗反应高和低
高和低疫苗反应者被定义为 IgG 滴度分别在第 75 个百分位数和第 25 个百分位数的婴儿,用于评估的每种抗原。
多重调理吞噬方法
使用先前发表的方法对三种血清型(6B、9V 和 18C)进行多重调理吞噬作用测定43,44 。血清样品在 56 °C 下热灭活 30 分钟;然后,进行连续稀释,并在 96 孔 U 形底微量滴定板 (Interpath Services) 中一式两份测试每种稀释液的每孔 20 μl。使用连续的 3 倍稀释液。解冻目标肺炎球菌的冷冻等分试样,用调理素缓冲液(含镁和钙的 HBSS,以及 0.1% 明胶)洗涤,并稀释至约 5 × 104CFU ml−1 。每种血清型的然后将所有血清型合并在一个细菌悬液中,并向每个孔中加入 10 μl 细菌悬液。将板在室温下摇动孵育(迷你 Orbital Shaker;Bellco Biotechnology 以 700 rpm 的速度运行 30 分钟。然后,10 μl 婴儿兔补体和 40 μl HL60 细胞(约 1 × 107细胞 ML−1) 然后加入到每个孔中(HL60 细胞在使用前已用 HBSS 洗涤两次.将板在组织培养箱(37 °C ,5% CO2大气压),以 700 rpm 的速度振荡。45 分钟后,将板置于冰上以终止反应,并将 10 μl 最终反应混合物点样到补充有 0.5% 酵母提取物的 Todd-Hewitt 琼脂平板上。将含有一种选择性抗生素(目标细菌的选择性标记物)的覆盖琼脂添加到每个 Todd-Hewitt 琼脂板中的一个中,然后将其在 37 °C 和 5% CO2 下孵育过夜。使用 ProtoCol3 自动菌落计数器 (Synbiosis) 计数细菌菌落的数量。结果表示为调理素指数,定义为杀死 50% 细菌的血清的插值稀释液。测定中的检测下限为 4。为了分析目的,未杀死 50% 细菌的样品的调理素指数报告为 2。临界值 8 用于定义阳性反应。
人血清杀菌活性检测
如前所述,对 140 名匹配的研究参与者血清样本(来自研究的 6 周、7 个月和 15 个月的抽血)进行了人血清杀菌活性测定45。简而言之,将热灭活的研究参与者血清在检测缓冲液中连续稀释 2 倍,并接种大约 1 × 103N. meningitidis2菌株 NZ98/254 的 CFU。加入外源性人补体 (25% v/v, Pel-Freez Biologicals),并将测定微量滴定板在 37 °C 和 5% CO 下孵育持续 60 分钟;然后,将样品接种在使用 tilt 方法制备的 GC 琼脂基板上,并在 37 °C 和 5% CO2 下孵育过夜以启用 CFU 枚举。据报道,杀菌滴度是相对于无血清对照诱导至少 50% 杀伤的参与者血清的最低稀释度的倒数。对脑膜炎奈瑟菌保护的血清学相关性被认为是人血清杀菌活性滴度大于或等于 4(22)。使用单因素方差分析和双尾配对 Student’s t 检验进行统计分析。
用于流式细胞术的婴儿血液制备
对于流式细胞术分析,在采集后 3 小时内将 450 μl 婴儿血液从 BD Vacutainer K3 EDTA 管转移到无菌 10 ml 管中,并通过添加 4.5 ml 1× BD Pharm Lyse 在室温下裂解红细胞 15 分钟。然后以 200g 离心 5 分钟沉淀细胞,吸出上清液,将细胞沉淀重悬于 10 ml 流式细胞术缓冲液中并再次离心。随后将细胞重悬于 150 μl 流式细胞术缓冲液中,并平均分成三个试管进行染色。首先在 Brilliant Stain 缓冲液 (BD) 中使用人 TruStain FcX (BioLegend) 在冰上封闭 Fc 受体 10 分钟。设计了三个面板用于当天流式细胞术分析(有关每个面板中鉴定的细胞亚群的完整列表,请参见补充表 8。第 1 组是泛白细胞组,能够识别中性粒细胞、单核细胞、树突状细胞、嗜酸性粒细胞、嗜碱性粒细胞、T 细胞、B 细胞和自然杀伤细胞。用抗 CD3 FITC 混合物(HIT3a,1:20,BD生物科学),抗CD11c PE(B-ly6,1:20,BD生物科学),抗HLA-DR APC-H7(G46-6,1:40,BD生物科学),抗CD15 V500(HI98,1:80,BD生物科学),抗CD45 BUV395(HI30,1:80,BD生物科学),抗CD16 BV421(3G8,1:143,BD生物科学),抗CD14 AF647(MOP-9,1:143,BD生物科学),抗CD123 BV711(9F5,1:143,BD生物科学),抗CD56 PE-Cy7(5.1H11,BD生物科学) 1:40,BioLegend)、抗 CD19 BV605(HIB19,1:80,BioLegend)、抗 CD20 BV786(2H7,1:80,BioLegend)、抗 FcεRIα PerCP Cy5.5(AER-37,1:80,BioLegend)和抗 Siglec8 PE Dazzle(7C9,1:143,BioLegend.第 2 组能够表征大约 20 个 B 细胞和 T 细胞的功能亚群,包括初始、中枢记忆和效应记忆 CD4 和 CD8 T 细胞;调节性 T 细胞;以及幼稚、记忆和血浆 B 细胞。抗体混合物由抗 CD19 PE (HIB19, 1: 10,BD Biosciences),抗CCR7/CD197 AF647(150503,1:10,BDBiosciences),抗CD127 BV421(A019D5,1:40,BioLegend),抗CD38 BV510(HIT2,1:40,BD Biosciences),抗HLA-DR APC-H7(G46-6,1:40,BD Biosciences),抗CD3 BUV395(UCHT1,1:40,BD Biosciences),抗CD4 BV605(RPA-T4,1:80,BD Biosciences),抗CD8 Cy7(RPA-T8,1:80,BD Biosciences),抗IgD PerCP Cy5.5(IA6-2,BD Biosciences) 1:80,BD Biosciences)、抗 CD27 BV711(L128,1:143,BD Biosciences)、抗 CD25 PE Dazzle594(M-A51,1:80,BioLegend)、抗 CD20 BV786(2H7,1:80,BioLegend)和抗 CD45RA FITC(HI100,1:143,BioLegend.第 3 组旨在评估特定的 T 辅助性 (T++H) 子集,包括 TH1、TH2、TH9、TH17、TH22 和自然杀伤 T 细胞,使用抗 CD3 BUV395 (UCHT1, 1: 50,BD生物科学),抗CD4 BV605(RPA-T4,1:100,BD生物科学),抗CD8 PE Cy7(RPA-T8,1:100,BD生物科学),抗CXCR3 BV421(1C6/CXCR3,1:100,BD生物科学),抗CCR10 APC(1B5,1:100,BD生物科学),抗CCCR6 BV711(11A9,1:50,BD生物科学),抗CCR4 PECF594(1G1,1:50,BD生物科学),抗CD45RA FITC(HI100,1:100,BioLegend)和CD1d-Tet PBS57 PE(1:5,000,1:5,000,) NIH.有关抗体来源、目录编号和荧光基团的完整列表,请参见补充表 8。
加入每种抗体混合物后,将样品在冰上避光孵育 30 分钟,然后洗涤并重悬于 300 μl 流式细胞术缓冲液中。将第 1 组添加到 BD Trucount FACS 管 (BD) 中,而第 2 组和第 3 组与 10 μl 液体计数珠 (BD) 一起添加到圆底 5 ml FACS 管中。计数的生成方式如前所述25。通过添加 DNA 结合染料 DAPI 对死细胞进行染色,并从分析中排除。使用 FACSDiva 软件在 FACSymphony (BD) 流式细胞仪上运行样品,并使用 FlowJo v.10.6.1 (Tree Star) 分析结果。
从血液中提取 RNA
按照制造商的说明,使用 PAXgene 血液 RNA 试剂盒 (Qiagen) 进行 RNA 提取和基因组 DNA 的去除,最后洗脱到 80 μl 不含 RNase 的水中。进行了进一步的 RNA 沉淀反应。简而言之,将 RNA 重悬于 2.5 × 100% 乙醇和 10% 乙酸钠中,并在 4 °C 下以 12,000g 离心 30 分钟。 用 75% 乙醇洗涤样品。将沉淀风干并重悬于 40 μl 不含 RNase 的水中。使用生物分析仪 2100/TapeStation (Agilent) 和 Qubit (Thermo Fisher Scientific) 测定总 RNA 产量。文库制备前,将 0.2 ng 合成参比 RNA 标准品(Sequins,Garvan Institute)添加到 250 ng RNA 中。
RNA 文库制备
根据制造商的说明 (MO1442 v.2),使用 Tecan 的 Nugen Universal Plus mRNA-Seq 文库试剂盒,使用 Any Deplete 探针和定制的 γ 珠蛋白去除,将总 RNA 转化为链特异性 Illumina 兼容的测序文库。简而言之,用 polyA 筛选 250 ng 总 RNA,并在逆转录前将 mRNA 片段化。根据制造商的说明,在用混合的 γ 去除寡核苷酸合成链选择 II 互补 DNA (cDNA) 之前,进行任何去除和定制的 γ 珠蛋白去除。对所得 cDNA 进行末端修复,然后连接 Illumina 兼容的条形码测序接头。对 cDNA 文库进行链选择,并在使用 TapeStation (Agilent Technologies) 进行质量控制评估之前进行 PCR 扩增 12 个循环。使用 Qubit 荧光测定法 (Thermo Fisher Scientific) 评估文库浓度。测序池是通过在 Qubit 测量的基础上混合等摩尔量的兼容样本库来生成的。使用 Illumina NovaSeq 6000 S1 测序芯片对文库库进行测序,该流动槽具有 2 × 100 bp 的双端读长。
RNA 测序分析
使用 FastQC v.0.11.4 评估序列读取质量46并用 MultiQC v.1.8 进行总结47,然后使用 Trimmomatic v.0.38 进行质量控制48,窗口大小为 4,平均质量得分为 25。修剪后少于 50 个核苷酸的读数被丢弃。然后使用 HISAT2 v.2.1.0 将通过所有质量控制步骤的读数与人类基因组 (GRCh38) 比对49。基因计数矩阵是使用 FeatureCounts 版本 1.5.0-p2 生成的50 使用带有 Ensembl v.93 注释的联合模型。然后将数据导入 R v.4.2.0 进行进一步分析。使用 EdgeR v.3.38 中的 M 值的修剪均值方法对计数进行归一化40,然后使用 glmLRT 功能进行多维缩放分析和差异基因表达分析。对于比较第 6 周和第 7 周的差异表达分析,使用了配对设计,将每个参与者拟合到模型中以及每个时间点。由于每个参与者的样本是一起处理的,因此这在本质上控制了批处理效果。对于非配对比较,将处理批次和婴儿性别拟合到模型中以调整这些影响。使用 svaseq v.3.46.0 确定了未知的变异来源38 并针对多维缩放和基因集变异分析之前进行调整。在差异表达分析之前,对基因计数矩阵进行过滤,以去除 15 个样品中每百万计数小于 5 个的基因。Benjamini-Hochberg 方法用于校正多重比较。使用 fgsea R 软件包 v.1.22.0 进行基因集富集分析39 替换为预定义的 BTM24,其中输入排名为 edgeR 计算的折叠变化。基因集变异分析用于使用 R Bioconductor 包 GSVA v.1.44.1 计算每个 BTM(不包括标记为“TBA”的未注释模块)的每个样本活性分数51。使用 R v.4.2 中的 Hmisc v.4.7-0 包进行 Spearman 相关性分析。
从粪便样本中提取 DNA
将来自 Zymo DNA/RNA Shield 粪便收集管 (Zymo Research) 的 2 毫升粪便悬浮液转移到无菌微量离心管中,并在 4 °C 下以 16,200g 离心 20 分钟沉淀。 然后去除上清液,如前所述使用 PowerLyzer PowerSoil 试剂盒方案 (Qiagen) 对粪便沉淀进行 DNA 提取52。
定量实时 PCR 分析,以确定婴儿粪便样本中的细菌载量
如前所述,使用基于 SYBR 的测定法通过 16S 核糖体 RNA (rRNA) 基因的定量 PCR (qPCR) 测定样品中的总细菌载量53.每个 qPCR 反应包括 1× PowerUP SYBR Green 预混液(Thermo Fisher Scientific 的 Applied Biosystems)、0.2 μM 的每种正向和反向引物以及 1 μl DNA,总反应体积为 35 μl。然后将每个反应分装成三个 10 μl 的技术重复,用于 qPCR 分析。根据大肠杆菌基因组 DNA 连续稀释生成的标准曲线计算 16S rRNA 基因拷贝的数量,并根据每个样品的粪便重量(以 mg 为单位)进行归一化。
宏基因组文库制备
Shotgun 宏基因组学库的生成方式如前所述,经过修改54。简而言之,为 DNA 浓度至少为 0.2 ng μl 的样品生成文库−1使用 Nextera DNA XT 文库制备试剂盒,并使用 Nextera XT Index Kit v.2 (Illumina) 进行标定。在生物分析仪 (Agilent Technologies) 上使用 DNA 1000 芯片对 PCR 富集后 DNA 片段大小进行质量控制检查。在 NovaSeq 6000 平台 (Illumina) 上对所有浓度为 5 nM 及以上的文库进行双端测序 (2 × 151 bp)。
宏基因组数据分析
使用 FastQC v.0.11.4 评估读取质量(46)并用 MultiQC v.1.8 进行总结(47)。使用 cutadapt v.1.18 删除适配器,并使用 Trimmomatic v.0.38 执行质量过滤和修剪(48),窗口大小为 4,平均质量得分为 25,最小长度为 50 个核苷酸。使用 Kraken2 v.2.1.1 估计每个样本中人类 DNA 的百分比(55)。通过使用 metaSPAdes v.3.15.2 ( .56).然后将读取对齐回此组件目录,并将映射输出用于 MetaBAT2 v.2.15 的分箱(57)。然后,根据 bowtie2 v.2.5.0 的 SAM 文件输出计算每个箱的计数。每个 MAG bin 都使用 GTDB-Tk v.2.1.0 和参考数据版本 207(参考 207)进行分类。58)。然后将该 MAG bin 计数矩阵导入 R 进行进一步分析。在使用条形图可视化之前,将计数数据转换为相对丰度,并在 R 库 PhyloSeq v.1.28 中实现的其他地方通过 CLR 进行标准化。使用 R 库 MicrobiomeStat v.1.18 中实现的 LinDA 进行差异丰度分析,以原始计数数据作为输入。在使用 LinDA 中的 prev.filter 标志进行测试之前,对在至少 5% 的样品中检测到的分类群进行计数筛选59。使用基础 R 中的函数进行 Spearman 相关性分析,以 CLR 归一化数据作为输入。使用 PhyloSeq v.1.28 在 R 中进行 alpha 和 beta 多样性分析(60)。宏基因组样本通过狄利克雷多项式混合物建模 (R package DirichletMultinomial v.1.38.0) 聚集成 CST,使用最低的拉普拉斯近似计算最佳聚类数。质量过滤的读数也用作 HUMAnN v.3.0 的输入(61) 生成微生物通路数据,并求和以表示每个 MetaCyc 通路和基因本体术语(仅限生物过程)的计数。通路计数数据也经过 CLR 标准化。为了解释样品之间 16S rRNA 拷贝数的变化,这可能会使细菌载量的 qPCR 估计产生偏差,根据鸟枪法宏基因组数据的物种水平相对丰度曲线和 rrnDB 的拷贝数计算每个样品的平均拷贝数62。通过使用 prodigal v.2.6.3 预测 MAGs 编码的蛋白质序列,使用 cd-hit v.4.8.1 以 95% 的同一性聚类,并使用 transseq 转换为氨基酸序列来生成非冗余预测蛋白质目录,从而分析抗菌素耐药基因。非冗余目录与综合抗生素耐药数据库 (v.3.2.7) 对齐,使用耐药基因标识符 (v.5.2.1),默认参数(添加“–exclude_nudge”除外.通过使用 bowtie2 将读数与基因目录进行比对,并使用 SAMtools v.1.17 生成每个样本计数,从而生成每个基因计数。在 R 中生成每百万个映射读数值的每千碱基读数,按抗生素类别求和,并使用 Wilcoxon 秩和检验在组间进行比较,控制与 Benjamini-Hochberg 方法的多重比较。在带有中介 R 包 (v.4.5.0) 的 R 中执行因果中介分析28。
临床前小鼠实验
C57BL/6J小鼠(杰克逊实验室;RRID: IMSR_JAX:000664) 在南澳大利亚健康与医学研究所 (SAHMRI) 的特定和无机会性病原体 (SPF) 条件或生物条件下培育和维持。SPF 小鼠被饲养在笼子里,可以自由获得商业颗粒食物和水,并在标准化条件下饲养,日光、湿度和温度受调节。将 Gnotobiotic (GF) C57BL/6 小鼠(转化研究所)饲养在 SAHMRI 临床前、成像和研究实验室 (PIRL) 的正压 HEPA 过滤隔离器中,可使用高压灭菌的商业颗粒食品和随意消毒水,调节 12 小时昼/夜和调节湿度 (45-75%) 和温度 (18-24 °C.所有实验均按照 SAHMRI 动物伦理委员会批准的方案进行。每个疫苗实验都是作为独立实验进行的。使用相同数量的雄性和雌性小鼠。将幼鼠 (约 3 周龄) 或母鼠 (8-16 周龄) 和幼崽随机分配到治疗组。研究人员对小鼠治疗组不知情。小鼠实验的适当样本量是根据我们之前的小鼠疫苗实验数据确定的。
GF 小鼠dams及其幼崽保持GF(通过粪便样本培养和16S rRNA基因qPCR确定)或如前所述定植63通过口服强饲法与由短双歧杆菌(DSM 20213,莱布尼茨研究所)、长双歧杆菌亚种长(DSM 20219)和婴儿双歧杆菌亚种(DSM 20088)组成的联合体进行口腔灌胃,在后约 14 天 (E14) 以及出生后第 7 天和第 14 天。通过培养和 Sanger 测序证实定植成功。为了培养,将双歧杆菌分离物接种在富含 1 mg ml 的 MRS 琼脂(Thermo Fisher Scientific)上−1分离半胱氨酸和单个菌落,使用 MALDI Biotyper (Bruker) 确认,并使用 BD GasPak 袋系统 (BD) 在 37 °C 下培养 48 小时。为了评估市售益生菌的给药是否可以恢复对 PCV13 的抗体反应,在出生后第 21 天通过口服强饲法定植 GF 小鼠,× 2 到 107从商业益生菌 Infloran (Laboratorio Farmaceutico) 中分离的 CFU L. acidophilus 和双歧双歧杆菌。进一步的 GF 小鼠同样用 2 × 10 定植7CFU 与每个菌株单独。通过在厌氧条件下将 Infloran 连续稀释到 MRS 琼脂平板 (Thermo Fisher Scientific) 上制备嗜酸乳杆菌和两歧双歧杆菌培养物,MRS 琼脂平板 (Thermo Fisher Scientific) 富含嗜酸乳杆菌或增强梭菌琼脂 (Thermo Fisher Scientific) 用于两歧双歧杆菌。使用 MALDI Biotyper (Bruker) 鉴定单个菌落。进一步将 21 天龄的 GF 小鼠定植于鼠乳杆菌 (DSM 20452)、鸡肠球菌 (DSM 24841)、嗜粘蛋白阿克曼菌 (DSM 22959)、酸性细菌 (DSM 15896)、Blautia producta (DSM 2950)、植物乳杆菌 (ATCC 202195,全球生物资源中心)或阴沟肠杆菌1。
生产同窝野生型和敲除小鼠用于 Myd88 中的实验−/−、Tlr2−/−和 Tlr4−/−小鼠,成对的杂合子 Myd88+/−、Tlr2+/−和 Tlr4+/−母猪(8-12 周龄)与杂合种马繁殖。相同数量的野生型和敲除后代被共同饲养进行研究。
小鼠的疫苗接种
小鼠在出生后第 28 天腹膜内接种 3 μg PCV13 (Pfizer)、8 μg Infanrix Hexa 联合疫苗 (GSK) 或 17.5 μg Bexsero 脑膜炎球菌血清型 B 疫苗 (GSK),并在 2 周后用相同剂量加强。对照小鼠用 100 μl PBS 模拟接种。在每个实验中,每组 4 到 8 只性别匹配的小鼠接种疫苗或模拟接种疫苗。在每个实验中,在免疫后 2 周和 4 周收集血清,在选定的实验中,也在 6 周和 8 周收集血清。
小鼠粪便取样
在每次实验开始时和每个实验时间点从小鼠身上收集粪便样本,以确认小鼠的 GF 或定植状态。无菌收集粪便颗粒,立即快速冷冻并储存在 -80 °C 下。
从小鼠粪便样本中提取 DNA
将粪便样品单独称重,涡旋重悬于 1 ml 磷酸盐缓冲盐水 (PBS) (pH 7.2) 中,并以 13,000g 离心沉淀 5 分钟。使用 DNeasy PowerSoil 试剂盒 (Qiagen) 对粪便沉淀进行微生物 DNA 提取,并进行以下微小修改:将粪便沉淀重悬于 PowerSoil 珠板中的 750 μl PowerSoil 珠子溶液和 60 μl 溶液 C1 中,并在 65 °C 下孵育 10 分钟,然后按照先前描述的方案进行珠子打浆63。
16S rRNA 基因序列分析
如前所述,小鼠粪便 DNA 提取物用于生成 16S rRNA 基因 V4 高变区的扩增子63。使用 Illumina MiSeq 系统(2 × 300 bp 运行)对扩增子文库进行测序。对双端 16S rRNA 基因序列进行多重检测并导入 QIIME2(2023.2 版)进行处理64。序列经过纠错,每个样本的纠错读数计数(我们在本文中称为精确序列变体)是使用 DADA2 生成的(65)。使用 SILVA v.138 数据库,将分类法分配给具有 QIIME2 的 sklearn 插件的序列,置信度阈值为 80%66。将确切的序列变体计数转换为相对丰度,在 R v.4.2.0 和 ggplot2 v.3.3.6 中绘制。
定量实时 PCR 分析以确定细菌载量
在 Quant Studio 7 Flex 实时 PCR 系统 (Thermo Fisher Scientific) 上使用靶向 16S rRNA 基因保守区域的引物进行实时 PCR,如所述。67.每个反应包括 5 μl SYBR Green qPCR(Thermo Fisher Scientific)、0.2 μM 每种正向和反向引物、1 μl DNA 模板和无菌水,总反应体积为 22 μl。每次运行中包括无模板 DNA 对照,用 1 μl 无菌水代替 DNA。每个样品的实时荧光定量 PCR 反应一式两份,每个反应 10 μl。扩增程序为 50 °C 2 分钟,95 °C 10 分钟,然后是 95 °C 15 秒和 60 °C 1 分钟的 40 个循环。在程序结束时进行熔解曲线分析。根据大肠杆菌基因组 DNA 连续稀释的标准曲线定量每个样品中的总细菌载量,该稀释液在同一次运行中进行,可在 3 至 3 × 106-的范围内检测到等效的大肠杆菌细胞。然后根据每个样本使用的粪便重量计算细胞数。使用 Mann-Whitney 检验评估统计显著性。
小鼠抗体反应的评估
抗原特异性 IgG 总水平通过酶联免疫吸附测定 (ELISA) 测量从每个疫苗实验中收集的血清中的 IgG1 、 IgG2c 、 IgG3 和 IgM。简而言之,Nunc MaxiSorp ELISA 板 (Sigma) 包被 CRM197(0.5 微克 ml−1、Finabio)、PCV13 疫苗(0.05 μg ml−1辉瑞)、肺炎球菌多糖(4 μg ml−1PPS1、161-X、ATCC)、PPS3(4 μg ml−1169-X,ATCC),PPS6B(4 μg ml−1105-X,ATCC),PPS9V(4 μg ml−1305-X,ATCC)或白喉类毒素(1 μg ml−1,List Biological Laboratories),破伤风类毒素(1 μg ml−1,List Biological Laboratories)、百日咳类毒素(1 μg ml−1,List Biological Laboratories)或 Bexsero 疫苗(2 μg ml−1、GSK.用 0.5% Tween-20/PBS 洗涤板,并用 1× ELISA 缓冲液 (eBioscience) 封闭。将小鼠血清样品用 1× ELISA 缓冲液稀释,并在封闭板上孵育。使用辣根过氧化物酶 (HRP) 偶联抗体检测抗原特异性血清抗体:稀释度为 1:1,000 的抗小鼠 IgG (Novex) 或抗小鼠 IgG1 (Abcam) 或 1:500 稀释度的 IgG2c、IgG3 或 IgM (Abcam.使用四甲基联苯胺底物 (Thermo Fisher Scientific) 检测 HRP 活性,并用 2 N4H2 终止所以。使用 Synergy HTX 微孔板吸光度检测仪 (BioTek) 在 450 nm 处记录显影板,并在 595 nm 处通过减法进行校正。使用 Prism 10 (GraphPad) 分析数据。
组织解离和流式细胞术分析
通过 70 μm 尼龙过滤器 (Merck Millipore) 通过机械解离和过滤制备小鼠脾脏或淋巴结的单细胞悬液。在 PBS 中用 Fixable Viability Stain 780 (BD Biosciences) 和小鼠 Fc 阻断抗体克隆 2.4G2 (1:100,BD Biosciences) 对细胞染色 15 分钟。洗涤细胞,然后在FACS缓冲液(PBS,0.1%牛血清白蛋白,2 mM EDTA)中用荧光染料偶联抗体对CD3(142-C11,1:300,BD Biosciences)、CD4(RM4,1:300,BD Biosciences)、CD8(53-6.7,1:600,BD Biosciences)、CD19(1D3,1:300,BD Biosciences)、CD38(90,1:600,BioLegend)、CD44(IM7,1:600,BD Biosciences)、CD62L(MEL-14,1:600,BD Biosciences)、CD44(IM7,1:600,BD Biosciences)、CD62L(MEL-14,1:600,BD Biosciences)、 CD44(IM7,1:600,BD Biosciences)、CD62L(MEL-14,1:600,BD Biosciences)、 CD19(1D3,1:300,BD Biosciences)、CD38(90,1:600,BioLegend)、CD44(IM7,1:600,BD Biosciences)、CD62L(MEL-14,1:600,BD Biosciences)、CD44(IM7,1:600,BD Biosciences)、CD62L(MEL-14,1:600,BD Biosciences)、CD44 (IM7,1:600,BD Biosciences)、CD62L (MEL-14,1:600,BD Biosciences)、 CD44(IM7,1:600,BD Biosciences)、CD62L (MEL-14,1:600,BD Biosciences)、 CD19(1D3,1:300,BD Biosciences)、CD38(90,1:600,BioLegend)、CD44(IM7,1:600,BD Biosciences)、CD62L(MEL-14,1:600,BD Biosciences)、CD44 (IM7,1:600,BD Biosciences)、CD62L (MEL CD95(J02,1:300,BD生物科学)、CD138(281-2,1:600,BD生物科学)、B220(RA3-6B2,1:600,BD生物科学)、CXCR5(L138D7,1:200,BioLegend)、GL7(GL7,1:600,BD生物科学)、IgD(11-26 c.2a,1:300,BioLegend)、IgM(R6-60.2,1:300,BD生物科学)、PD-1(RMP1-30,1:300,BD生物科学)和链霉亲和素-PECF549(1:400,BioLegend)。
为了评估 CRM GC B 细胞,用 PBS 中的可固定活力染色剂 780 (1:1000, BD) 和小鼠 Fc 模块 (1:100, BD) 对细胞染色 15 分钟;然后,将它们洗涤并与生物素化的 CRM (1:100, Fina BioSolutions) 在 FACS 缓冲液中孵育。在 4 °C 下染色 20 分钟后直接加入表面抗体混合物。 在 BD FACS Symphony 上采集数据,并使用 FlowJo v.10 进行分析。为了评估 CD86、CD80 和 MCHII 表达,用 Zombie Aqua Fixable Viability Stain 780 (1:1000, BioLegend) 和小鼠 Fc 阻断抗体克隆 2.4G2 (1:100, BD Biosciences) 在 PBS 中染色脾脏或淋巴结的单细胞悬液 15 分钟。洗涤细胞,然后在FACS缓冲液(PBS,0.1%牛血清白蛋白,2 mM EDTA)中用荧光染料偶联抗体对CD19(ID3,1:200,BD)、CD3(145-2C11,1:150,BD生物科学)、CD8(53-6.7,1:200,BD)、NK1.1(PK136,1:200,BD)、Ly6G(1A8,1:600,BD)、B220(RA3-6B2,1:3000,BD)、CD11b(M1/70,1:500,BD)、CD11c(HL3,1:400,BD)进行染色, MHCII(M5/114.15.2,1:150,Miltenyi)、CD86(PO3.3,1:150,Miltenyi)和 CD80(16-10A1,1:150,Tonbo Biosciences+)。
免疫荧光染色和成像
纵隔淋巴结在1ml 4%多聚甲醛(Sigma)中固定4小时,然后在1ml 30%蔗糖溶液中于4°C孵育过夜,然后如前所述包埋在OCT(Tissue Tek)中68。将载玻片在封闭缓冲液 (正常山羊血清 4% v/v (Southern Cross Science)、正常驴血清 4% v/v (Stratech Scientific APAC) 和牛血清白蛋白 15% v/v (AusGeneX)) 中封闭 2 小时在室温下。用 Triton X-100 2% v/v (Sigma) 透化载玻片,并用 CD16/32(1:100,BD Biosciences)和 CD21/35 克隆 7E9 (1:200)、GL7 (1:200)、CD3 克隆 17A2 (1:200) 和 IgD 克隆 11-26c.2a (1:200) 染色(均来自 BioLegend.使用 Leica TCS SP8X 共聚焦显微镜采集图像,并使用斐济进行分析69在 ImageJ 中。
统计分析
AIR 研究的主要目的是确定抗生素暴露组和未暴露组在 7 个月大时对 PCV13 疫苗的抗体反应是否不同,特别是比较以下内容:
- 1.达到血清保护性抗体反应(大于或等于 0.35 μg ml)的参与者百分比−1) 在大约 7 个月大时针对 PCV13 疫苗中的肺炎球菌多糖血清型。
- 2.几何平均浓度 (μg ml)−1在大约 7 个月大时通过血清测定法测量的抗 PPS IgG。
作为次要结局,我们比较了 15 个月大时的 PCV13 疫苗反应和对 Infanrix Hexa 6 合 1 疫苗 (6-in-1, DTPa-HepB-IPV-Hib) 和 Rotarix 口服轮状病毒疫苗的抗体反应在两个时间点抗体暴露和未暴露的婴儿。使用多变量线性回归调整基线疫苗接种前滴度和性别来检验抗生素暴露组与评估的每种疫苗抗原的 IgG 几何平均浓度之间的任何关联。通过拟合混合效应多变量线性回归(包括参与者 ID 的随机效应)进行进一步的纵向分析,以评估时间点和抗生素暴露组对每种疫苗抗原的 IgG 几何平均浓度的相互作用。采用多变量 logistic 回归检验抗生素暴露组与达到血清保护反应的婴儿比例之间的任何关联。统计学显着性定义为 P < 0.05。进行了进一步的敏感性分析,以评估与调整益生菌消费、配方奶粉消费、基线 IgG/IgA 浓度、婴儿性别和分娩时妊娠的关联稳健性。AIR 研究还包括一系列探索性系统免疫学评估,这些评估是根据每种数据类型的最佳实践进行的,如上一节所述。测量取自不同的样本。整个统计测试都是双面的;使用的特定统计分析在图例中指定。
报告摘要
有关研究设计的更多信息,请参阅本文链接的 Nature Portfolio Reporting Summary。
数据可用性
支持本研究结果的数据已存放在 Gene Expression Omnibus 的 Accession Code GSE198276 和 Sequence Read Archive 的 BioProject Accession Code PRJNA807448 下。支持本研究结果的所有其他数据均可在本论文及其补充信息中找到。随本文提供。
代码可用性
本手稿中没有开发任何自定义代码。用于组学数据分析的 R 脚本可从 Lynn 实验室 BitBucket (https://bitbucket.org/lynnlab/air) 获得。
Hits: 56