Contents
- 1 摘要
- 2 主要
- 3 流感病毒感染唤醒DCC
- 4 IAV感染诱导DCC表型转变
- 5 IAV诱导的DCC觉醒需要IL-6
- 6 CD4 T 细胞维持 IAV 唤醒的 DCC+
- 7 SARS-CoV-2感染唤醒DCC
- 8 COVID-19 与癌症进展有关
- 9 COVID-19与癌症进展有关
- 10 讨论
- 11 方法
- 11.1 小鼠品系、流感感染和抗体治疗
- 11.2 SARS-CoV-2 MA10 传播
- 11.3 小鼠的 SARS-CoV-2 MA10 感染
- 11.4 来自肺部的 SARS-CoV-2 MA10 病毒滴度
- 11.5 免疫组化和免疫荧光染色
- 11.6 胶原蛋白沉积的评估
- 11.7 BALF加工
- 11.8 细胞因子检测
- 11.9 流式细胞术分析
- 11.10 肺CD8和CD4细胞的离体分析++
- 11.11 蛋白质印迹分析
- 11.12 固定单细胞RNA-seq
- 11.13 用于 scRNA-seq 分析的数据处理
- 11.14 线粒体特异性 scRNA-seq 分析
- 11.15 DCC 的 RNA-seq 分析
- 11.16 流感病毒RNA定量
- 11.17 HER2 乳腺球和 EO771 类器官培养+
- 11.18 测量白细胞耗尽外周血中的转基因 Her2 mRNA
- 11.19 定量和统计分析(小鼠模型)
- 11.20 人类观察数据
- 11.21 英国生物样本库的基于人群的分析
- 11.22 基于 Flatiron Health EHR 的分析
- 11.23 三阴
- 11.24 HER2+
- 11.25 的+
- 11.26 报告摘要
Respiratory viral infections awaken metastatic breast cancer cells in lungs
摘要
乳腺癌是全球第二大常见癌症,大多数死亡是由转移性疾病引起的,通常在临床潜伏期后发生。理解破坏休眠的播散性癌细胞(DCCs)静止状态的机制对于解决转移进展至关重要。由呼吸道病毒如流感病毒和SARS-CoV-2引起的感染会触发局部和全身炎症。在这里,我们在小鼠中展示了流感病毒和SARS-CoV-2感染导致肺部乳腺癌DCCs的休眠前表型丧失,感染后几天内导致DCC增殖,并在两周内大量扩增成转移性病变。这些表型转变和扩张依赖于白细胞介素-6(IL-6)。我们展示了DCCs会抑制肺T细胞激活,并且CD4+ T细胞在流感感染后通过抑制CD8+ T细胞激活和细胞毒性来维持肺转移负担。关键的是,这些实验结果与人类观察数据一致。对英国生物银行(所有癌症)和平坦铁健康(乳腺癌)数据库中的癌症幸存者分析显示,与未感染的癌症幸存者相比,SARS-CoV-2感染显著增加了与癌症相关死亡和肺转移的风险。这些发现强调了呼吸道病毒感染对转移性癌症复发的巨大影响,为传染病与癌症转移之间的联系提供了新的见解。
主要
乳腺癌是女性中最常见的癌症,也是美国第二大癌症相关死亡原因。在初次缓解后,DCCs可以休眠数年甚至数十年,然后发生转移性复发,最常见的部位是肺、骨和肝脏。细胞内在因素和肿瘤微环境共同决定了转移性细胞是保持休眠还是进展。重要的是,微环境的扰动,如由炎症增加引起的扰动,足以促进转移。
病毒性呼吸道感染很常见。季节性流感每年影响超过10亿人,截至2025年5月,SARS-CoV-2感染已导致近7.78亿例COVID-19确诊病例(参考文献)。病毒性呼吸道感染通常与肺部炎症相关联,伴随着肺内炎性细胞因子的增加,如白细胞介素-6(IL-6)和干扰素(IFNs),以及免疫细胞的扩张,包括中性粒细胞、巨噬细胞和T淋巴细胞。这些炎症机制,特别是涉及IL-6和STAT3信号传导、中性粒细胞和中性粒细胞外陷阱,以及CD4+ T细胞-巨噬细胞轴,已被确定为癌症转移过程的调节因子。
在COVID-19大流行的前两年,癌症死亡率上升的观察结果(1)并不完全归因于COVID-19死亡或延迟筛查和治疗,这引发了一个重要的假设:肺部病毒感染通过触发休眠的DCCs(休眠性导管原位癌)的发展,增加了癌症死亡。我们寻求通过双重方法来测试这一假设:检查病毒呼吸道感染(流感病毒和SARS-CoV-2)对乳腺癌休眠状态的影响,并将癌症幸存者中的SARS-CoV-2感染与转移进展和癌症死亡率相关联。
流感病毒感染唤醒DCC
为了研究流感病毒感染对已经潜伏在肺部的休眠乳腺癌细胞(DCCs)觉醒的影响,我们使用了已经建立的MMTV-ErbB2/Neu/Her2(以下简称MMTV-Her2)小鼠模型,该模型模拟了乳腺癌转移性休眠状态。在这种模型中,小鼠在上皮乳腺腺细胞中过表达大鼠Neu2(人类HER2的同源物)。HER2+早期病变细胞在乳腺腺中播散,并在小鼠出生后10-14周内将DCCs播种到肺部和其他器官,在那里它们作为休眠的单细胞存在长达一年,然后才进展为明显的转移性疾病。因此,这个模型再现了休眠的DCCs在肺部和骨髓中的持久性,这些个体可以保持缓解状态数年甚至数十年。
MMTV-Her2小鼠(FVB背景)被感染了一个亚致死剂量的流感A病毒(IAV)(图1a)。感染的小鼠在感染后11-12天体重减轻并恢复(扩展数据图3a),野生型和MMTV-Her2小鼠显示出类似的炎症反应,支气管肺泡灌洗液的细胞增多(扩展数据图5b)。野生型和MMTV-Her2小鼠之间的病毒清除动力学相似,其中IAV RNA拷贝数在6天达到峰值,从9到15天病毒载量减少了100-1000倍(扩展数据图7c)。
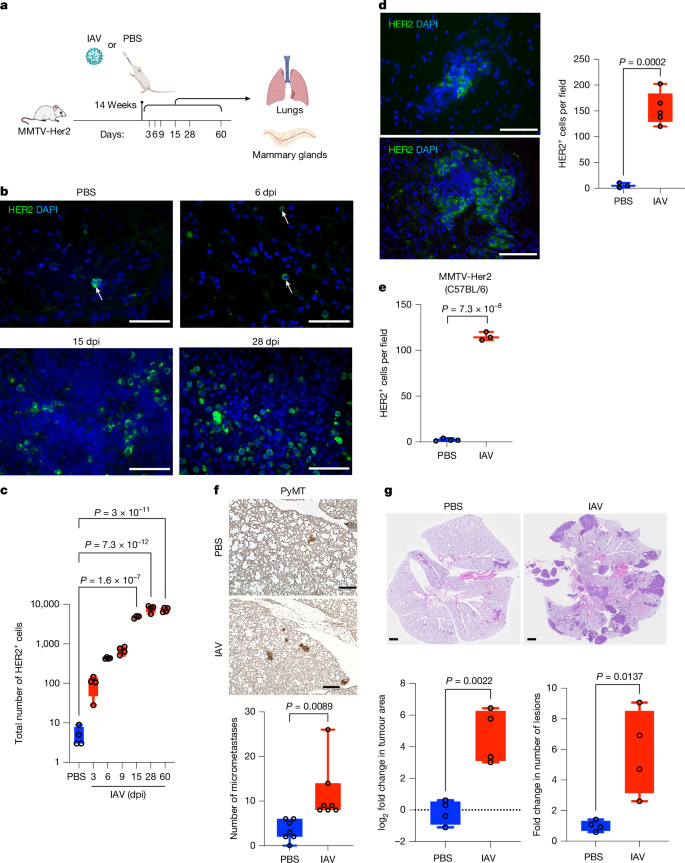
a,通过鼻内给药感染亚致死剂量的波多黎各A/PR/8/34 H1N1 IAV的FVB背景下的MMTV-Her2雌性小鼠。在感染后指示的时间点取肺和乳腺进行分析。b,c,免疫荧光 (b) 和肺部 HER2 细胞的定量 (c) 在 3、6、9、15、28 和 60 dpi。量化来自全肺三个部分的HER2细胞总数(每组n = 4,15 dpi时n = 3)。用 DAPI(蓝色)和 HER2(绿色)对肺切片进行染色,作为 DCC 的标记物 (b)。d,流感感染后 9 个月肺部 HER2 细胞的免疫荧光和定量(n = 3 PBS,n = 5 IAV)。 e,用IAV在15 dpi下定量C57BL6 / J MMTV-Her2小鼠肺中的HER2细胞(n = 4 PBS,n = 3 IAV)。 f、PyMT 微转移的免疫组化和定量,定义为面积小于 0.03 mm 的病灶+++++2 (n = 每组 7 个)。g,将EO771乳腺肿瘤细胞植入C57BL/6小鼠的乳腺脂肪垫中(每组n = 4个),并在31天(实验1)和20天(实验2)后用IAV或PBS对照感染。小鼠植入2×105(实验 1)或 1 × 106EO771(实验2)细胞,并显示了组合结果。感染后18 d(实验1)和17 d(实验2)取肺进行分析,并用H&E染色,对肿瘤面积和病灶数量进行定量。对于每个实验,PBS处理的小鼠肺的定量平均值设置为1,以便可以计算倍数变化。通过单因素方差分析(ANOVA)确定显着性。所有箱须图均以最大值(顶线)、中值(中线)和最小值(底线)表示,所有数据点均显示为点。比例尺:a 和 d,25 μm;f,200 微米;克,1 毫米。使用BioRender创建的插图(De Dominici, M., https://BioRender.com/i40c047; 2025)。所有重复都是生物的。
在3、6、9、15、28和60天接种(dpi)后,取MMTV-Her2小鼠的肺脏进行检查,观察HER2+3+4细胞的丰度(图11a, 12, 13),如前所述。与之前的工作一致,我们在IAV感染前观察到肺部有少量孤立的DCC或小簇(少于10个细胞)。值得注意的是,从3到15 dpi之间,转移负荷增加了100至1000倍;即使在感染后的第28天、第60天和9个月,肺部的HER2+17+18细胞数量仍然保持升高(图19b-d, 20)。在C57BL/6J背景的MMTV-Her2小鼠中,同样观察到IAV介导的HER2+21+22 DCCs在肺部扩张,发生在15 dpi时(图23e, 24)。值得注意的是,由此扩大的HER2+25+26细胞表现出一种弥漫的非上皮样结构,不同于在超过10个月的MMTV-Her2小鼠的肺部观察到的上皮样簇和转移(每个簇超过100个细胞)(扩展数据图33d, 34)。值得注意的是,我们没有观察到乳腺中Ki67+35+36HER2+37+38细胞数量的变化(扩展数据图39e, f, 40)。此外,对外周血中造血谱系耗尽的转基因大鼠Erbb2表达的定量PCR(qPCR)分析显示,感染后没有变化(扩展数据图43g, 44)。因此,肺部HER2+45+46细胞数量的增加似乎并非来源于乳腺癌细胞种子的增加。
我们测试了表达多瘤病毒中间T抗原癌基因的乳腺特异性MMTV-PyMT小鼠,这些小鼠显示出早期扩散但较短的肺DCC休眠期。MMTV-PyMT小鼠在IAV感染后肺部小肿瘤簇的数量增加(图5)。我们还测试了使用植入乳腺的EO771乳腺癌细胞(C57BL/6)感染IAV的效果,这些细胞会播散到肺部并经历一个休眠期。如上所述,与未感染的C57BL/6小鼠相比,正位植入EO771细胞并感染IAV的小鼠在17-18天肺转移负担增加,其中EO771细胞大多保持休眠状态(图11和扩展数据图13)。综合这些发现表明,IAV感染促进了多种乳腺癌DCC休眠模型中DCC的扩张。
IAV感染诱导DCC表型转变
当我们检查肺中DCCs的增殖时,我们发现从3天龄开始,表达Ki67(除G0期外所有细胞周期的标志物)的HER2+2细胞百分比显著增加,并在9天龄达到峰值(图32a,b4)。通过体内掺入胸腺嘧啶类似物EdU也得到了类似的结果(图52b6)。尽管在15天龄时,表达Ki67的HER2+7+8细胞的比例有所下降,但即使在60天龄时,考虑到肺中DCC负担的总体增加,表达Ki67的HER2+9+10细胞总数仍然远高于基线水平(图112b12)。这些结果表明,IAV感染触发了肺中DCC的觉醒,增加了转移性负担。
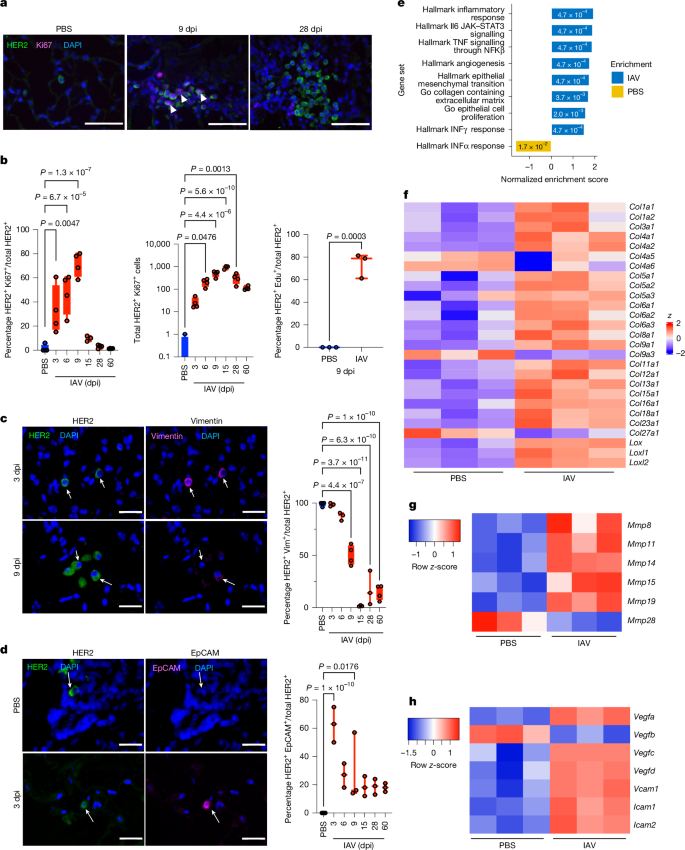
a,b,IAV感染后肺部Ki67 HER2细胞的免疫荧光(a)和定量(b)。幼稚和IAV感染小鼠的肺切片用HER2(绿色),Ki67(洋红色)和DAPI(蓝色)抗体染色(a)。Ki67 HER2 细胞的百分比(b,左),三个肺切片的 Ki67 HER2 细胞的绝对数量(中间,每组 n = 4,15 dpi 时 n = 3)和 EdU 掺入的检测(右,每组 n = 3)。c,d,流感感染后肺部波形蛋白(Vim)(c)和EpCAM HER2(d)细胞的免疫荧光和定量,其中幼稚和IAV感染小鼠的肺切片用HER2(绿色)和波形蛋白(洋红色)(每组n = 3,n = 4 PBS,9 dpi,60 dpi)或HER2(绿色)和EpCAM(洋红色)(每组n = 3)染色。图表显示波形蛋白 HER2 (c) 或 EpCAM HER2 (d) 细胞的百分比。在 a-d 中,显示了相对于 PBS 样本的统计显着性,由单因素方差分析确定。e,在9 dpi下比较未感染(PBS)和IAV感染的MMTV-Her2小鼠肺部的DCC的GSEA分析。参见补充图。2 用于排序的门控策略。f-h,显着差异表达的胶原蛋白 (Col) 亚型/赖氨酰氧化酶 (f)、金属蛋白酶 (Mmp) (g) 和血管内皮生长因子 (Vegf) 和细胞间粘附分子 (Icam)/血管细胞粘附分子 1 (Vcam1) 基因 (h) 的热图。所有箱须图均以最大值(顶线)、中值(中线)和最小值(底线)表示,所有数据点均以点表示。比例尺:a,25 μm;c 和 d,10 μm。所有重复都是生物的。++++++++++++++
HER2中的休眠DCC+而PyMT模型维持一个由ZFP281驱动的间充质样状态(波形蛋白)+直到ZFP281丢失触发上皮细胞转变(EpCAM/E-cadherin+在休眠退出期间16与之前的结果一致,未感染肺中大多数休眠的DCCs表达的是波形蛋白而不是EpCAM(图)。2c,dHER2的百分比+感染早期(3-6天)表达波形蛋白的细胞没有显著影响。然而,在9天时,HER2+表达波形蛋白的细胞减少到大约50%,在28天龄时进一步减少到不到20%(图)。2c相比之下,在IAV感染早期(3天接种后),HER2+细胞获得了EpCAM表达,与DCCs的激活相关联(见图)。二维大多数HER2+细胞在6天潜伏期后EpCAM阴性,尽管EpCAM+HER2+细胞仍保持升高状态(见图。二维因此,流感病毒感染驱动持续的间充质标记丢失和短暂的表型转变,随着时间的推移形成持久的混合或杂合群体,产生一个能够唤醒休眠细胞的杂合表型。为了更好地理解流感病毒感染对DCCs的影响,我们进行了HER2的流式细胞术分选+在9 dpi时,对未感染和IAV感染的鼠肺细胞进行批量RNA测序。正如预期的那样,IAV感染诱导了炎症、IFNα、IFNγ、TNF和IL-6-JAK-STAT3信号通路(图)。2e以及扩展数据图。2a-c值得注意的是,IAV感染还激活了DCCs中的胶原蛋白含有的细胞外基质和血管生成途径(图。2e许多胶原蛋白和胶原蛋白交联基因的表达增加(Lox, Loxl1和Loxl2(图。2F金属蛋白酶Mmp8, Mmp11, Mmp14, Mmp15和Mmp19(图。2G)和与血管生成相关的基因(Vegf-a, Vegf-c, Vegf-d, Vcam1, Icam1和Icam2(图。2小时胶原蛋白-1的丰度和转化为纤维状胶原蛋白与休眠的DCC觉醒有关18这可以通过血管生成开关来维持肿瘤生长。实际上,已经显示血管生成和金属蛋白酶在维持休眠癌细胞觉醒中发挥作用。19,20值得注意的是,我们观察到涉及间充质或上皮命运的基因表达发生了显著变化(扩展数据图)。二维尽管先前的研究已经表明,DCCs从休眠的间充质状态转变为更上皮的状态16我们观察到一种独特且据我们所知之前未被识别的混合增殖模式,在流感病毒感染后,间充质标记物(如Cdh2, Cdh11, Fn1, Eng和Vim)和上皮标志物(如Cdh1, Cldn2, Cldn5, Krt19, Klf4和Ovol2(全部P形容词≤ 0.05;补充数据1值得注意的是,表达Zfp281,这是休眠间充质状态的关键调节因子16实际上在DCCs中增加了9个dpi,进一步突出了DCCs在IAV感染后采用的混合状态,这似乎绕过了ZFP281的促休眠功能。我们还观察到Cd274(编码PDL1)和减少在B2m(这是由主要组织相容性复合体I类抗原呈递所必需的),这有助于避免免疫消除(补充数据)。1).
IAV诱导的DCC觉醒需要IL-6
炎症细胞因子如IL-6和IL-1已知能促进癌症的恶性和转移。此外,由活检或化疗引起的急性炎症过程中产生的IL-6有助于分散性乳腺肿瘤细胞肺转移的生长。在IAV感染期间,IL-6的产生量大量增加,部分原因是病毒在肺上皮细胞的复制。同样,我们在野生型和MMTV-Her2小鼠的支气管肺泡灌洗液(BALF)中也检测到了高水平的IL-6,而在IAV感染后IL-1β的水平非常低(扩展数据图#192e,f和#20)。此外,我们观察到IAV感染后在DCCs中IL-6信号通路的明显激活(图#212e和扩展数据图#232c和#24)。此外,体外IAV感染原代小鼠气管上皮细胞显著增加了IL-6的分泌(扩展数据图#252g和#26),表明上皮细胞是IAV感染后IL-6的主要来源。
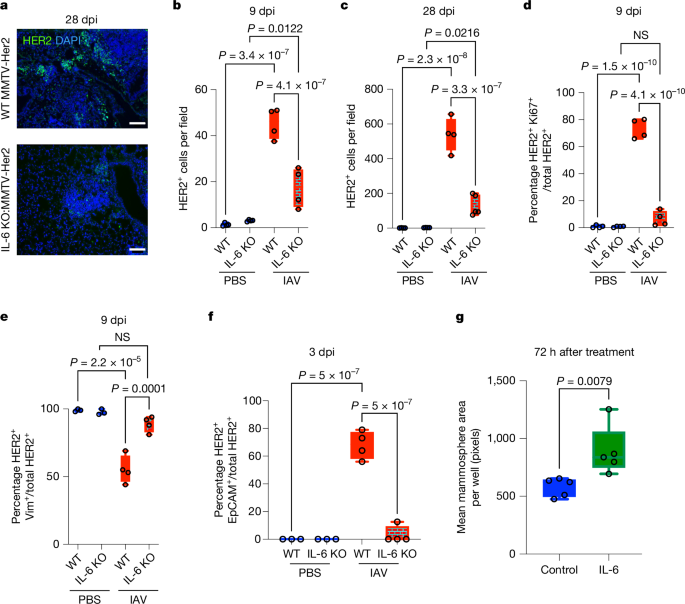
为了确定由流感病毒(IAV)感染触发的IL-6产生是否有助于休眠的DCCs觉醒,我们使用了与IL-6敲除(KO)小鼠交配的MMTV-Her2小鼠。MMTV-Her2和IL-6KO:MMTV-Her2小鼠被IAV感染,并在9天和28天(在这个剂量的IAV下,所有小鼠都恢复了健康,没有过度体重减轻)取肺进行分析。在感染前,IL-6KO:MMTV-Her2和MMTV-Her2小鼠之间休眠的HER2+10细胞数量没有差异(图13b,c 14),这些小鼠在较老年龄时以相似的时间发展出需要安乐死的原发性肿瘤(扩展数据图15a 16)。因此,IL-6对于原发性肿瘤生长或早期癌细胞向肺部的扩散不是必需的。值得注意的是,IAV感染的IL-6KO:MMTV-Her2小鼠的肺中HER2+17+18细胞的数量与感染的MMTV-Her2小鼠相比,在9天和28天时显著减少(图21a–c 22),Ki67+23+24HER2+25+26细胞的减少也相当大,这表明DCCs的休眠状态得以维持(图27d 28)。此外,在MMTV-PyMT乳腺癌转移小鼠模型中,IAV诱导的PyMT+29+30小病灶的增殖和肺部微转移的形成被IL-6缺乏所抑制(扩展数据图31b,c 32)。在EO771细胞模型中,IAV感染后增加的肺部转移负担也发现了类似的IL-6依赖性(扩展数据图33d,e 34)。对vimentin和EpCAM的染色表明,大多数IL-6KO:MMTV-Her2小鼠肺中的HER2+35+36细胞保留了vimentin表达,并保持了EpCAM阴性状态,这与免疫荧光显示的Ki67未能进入细胞周期一起,支持了感染诱导的DCCs从休眠到觉醒需要IL-6(图39e,f 40)。
a-c,用IAV(或PBS)在9和28 dpi下对MMTV-Her2或IL-6 KO:MMTV-Her2小鼠的肺切片进行HER2(绿色)和DAPI(蓝色)(a)染色,并在9 dpi(b)和28 dpi(c)下定量。比例尺:50 μm。d,MMTV-Her2 和 IL-6 敲除中 HER2 Ki67 细胞百分比的量化:MMTV-Her2 在 9 dpi(每组 n = 4)。NS,不显着。e,f,MMTV-Her2和IL-6敲除中波形蛋白HER2(e)和EpCAM HER2(f)细胞百分比的量化:MMTV-Her2小鼠在9 dpi(波形蛋白)和3 dpi(EpCAM)下(PBS的n = 3,n = 4 IAV)。显着性由单因素方差分析确定。g,用 10 ng ml 处理后 HER2 类器官每孔的平均乳腺球面积+++++++−1IL-6(每组 n = 5)(g);显着性通过 Mann-Whitney 检验计算。所有箱须图均以最大值(顶线)、中值(中线)和最小值(底线)表示,所有数据点均以点表示。所有重复都是生物的。
接下来,我们从3个月大的MMTV-Her2小鼠中提取了乳腺腺泡,在器官样培养条件下生长它们,并用载体或IL-6处理。用IL-6处理的乳腺球体显示出整体尺寸的显著增加(图13g2和扩展数据图33f4)。对于EO771细胞也观察到了类似的器官样培养尺寸增加(扩展数据图53g6)。尽管在体内无法完全复制肺泡中单个DCC的休眠状态(7-8169,102611),但已经使用从单个细胞到增殖团簇的乳腺球体启动分析来研究扰动如何影响单个细胞的生长启动或生长停滞(13-1414,15,161617,18)。尽管存在局限性,这种分析确认了IL-6直接影响了处于孤立状态的HER2+乳腺肿瘤细胞,这再现了体内观察到的IL-6反应。总体而言,这些结果表明,IAV感染触发的IL-6在介导休眠DCC的唤醒中起着关键作用。
CD4 T 细胞维持 IAV 唤醒的 DCC+
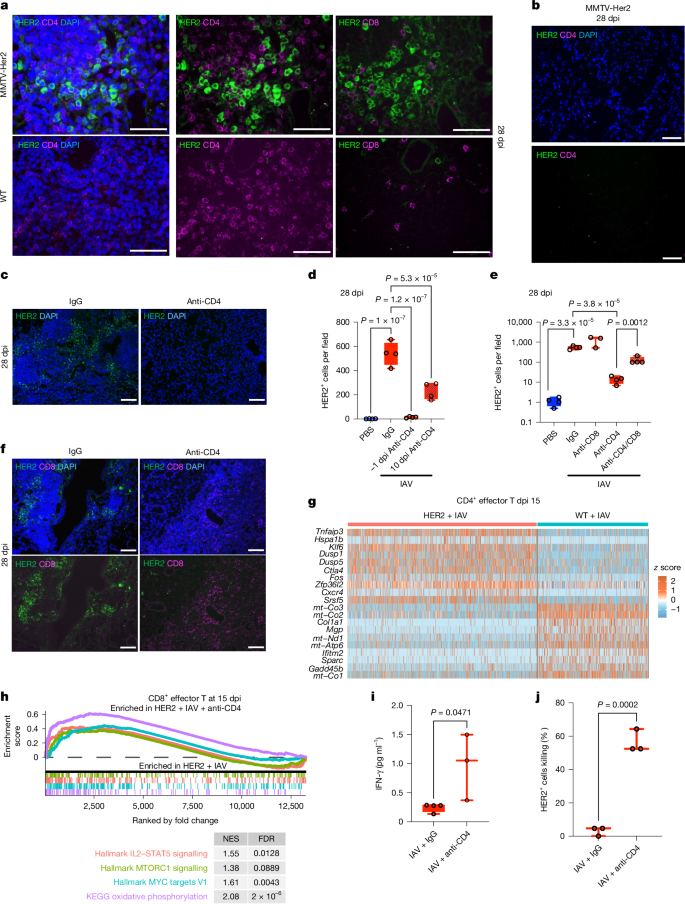
尽管IL-6对于DCC的觉醒和最初的显着扩张至关重要,但在15 dpi的MMTV-Her2小鼠的BALF中检测到最低水平的IL-6(扩展数据图。2e),表明存在其他因素,这些因素在感染后后期促进 DCC 扩张后的持久性。而中性粒细胞募集到肺部的次数为 IAV,而 CD4 T 细胞、CD8 T 细胞和 B 细胞在野生型和 MMTV-Her2 小鼠中从 9 dpi 左右在肺中积累(扩展数据图4a-d)。IAV 感染也被证明会触发肺部诱导型支气管相关淋巴组织 (iBALT) 的形成,iBALT 是主要包括 CD4 和 B 细胞的淋巴组织。iBALTS 可在感染后很长时间内在肺部检测到(高达 100 dpi)+++27.因此,我们还在野生型和MMTV-Her2小鼠的肺切片中检测到这些CD4细胞和B细胞富集的淋巴组织28 dpi(图。图4a和扩展数据图。4e–h,k)。正如预期的那样,这些 iBALT 中的 B 细胞对生发中心 B 细胞标志物 GL7 也呈阳性。与CD4细胞相比,野生型或MMTV-Her2小鼠的iBALT中存在的CD8细胞很少(图。图4a和扩展数据图。有趣的是,CD4 与 HER2 的共染色揭示了 CD4 细胞高密度簇附近选择性存在 DCC,而在缺乏 CD4 细胞的区域中几乎不存在 HER2 细胞(图 1999 年)。图4b和扩展数据图。此外,与IAV感染后DCC中许多胶原基因的上调一致(图。2f),我们观察到与野生型小鼠相比,在 IAV 感染后,MMTV-Her2 小鼠在 iBALT 中选择性地沉积胶原蛋白沉积显着增加(扩展数据图4l,m)。胶原蛋白已被证明可以限制 T 细胞浸润和活性++++++28.
a,在28 dpi下对IAV感染小鼠的相邻肺切片进行HER2(绿色)和CD4(洋红色,左侧和中间)或HER2(绿色)和CD8(洋红色,右侧)染色。b,与28 dpi的IAV感染MMTV-Her2小鼠一样,但对于缺乏CD4细胞的区域。c,d,从-1 dpi或10 dpi开始,在28 dpi下进行分析的MMTV-Her2小鼠的肺切片,对HER2(绿色)和DAPI(蓝色)进行染色(显示CD4从-1 dpi开始)(c)。量化HER2细胞的数量(每组n = 4)(d)。e,在28 dpi(每组n = 4,n = 3 CD8耗竭)时,来自CD4,CD8或CD4 / CD8耗竭(-1 dpi)的MMTV-Her2小鼠的HER2细胞的定量。f,在28 dpi下对MMTV-Her2和CD4耗竭的MMTV-Her2小鼠的肺切片进行HER2(绿色)、CD8(洋红色)和DAPI(蓝色)染色。g,来自scRNA-seq的前20个差异表达基因的热图,比较了来自MMTV-Her2 + IAV的CD4效应T细胞与野生型+ IAV小鼠在15 dpi下。h,GSEA分析显示CD4耗尽的MMTV-Her2 + IAV与对照MMTV-Her2 + IAV小鼠在15 dpi下效应CD8 T细胞的通路富集。i,富集的 CD8 细胞上清液中 IFNγ 的浓度,这些细胞富集自 MMTV-Her2 小鼠的肺,在 15 dpi 时有或没有 CD4 耗竭,并被抗 CD3/CD28 抗体激活(n = 4 IAV + IgG,n = 3 IAV + 抗 CD4)。 j,离体CD8细胞毒性测定,其中HER2细胞与相同的CD8细胞一起孵育(每组n = 3)。显着性通过单因素方差分析(d 和 e)或双尾学生 t 检验(i 和 j)确定。所有箱须图均显示为最大值(顶线)、中位数(中线)和最小值(底线),所有数据点均显示为点。比例尺:a,25 μm;b、c 和 f,50 μm。所有重复都是生物的。+++++++++
为了确定CD4+1+2细胞在IAV感染后是否维持了觉醒的DCCs,CD4+3+4细胞的耗竭是在感染前(-1 dpi)进行的,然后在肺切片中检查了HER2+5+6细胞(扩展数据图75a,b8)。CD4+9+10细胞的耗竭减少了28 dpi时觉醒DCCs的数量(图114c–e12)。然而,CD4+13+14细胞的耗竭在9 dpi时并未影响DCC数量或增殖(扩展数据图155c,d16),这与CD4细胞在感染后期积累一致(扩展数据图174b18)。此外,当CD4+19+20细胞的耗竭从10 dpi开始进行时,28 dpi时肺DCCs的数量也减少了(图214d22)。因此,CD4+23+24细胞有助于在IAV感染后维持觉醒的DCCs。综合这些数据表明,IL-6(而不是CD4+25+26细胞)有助于初始唤醒和扩张休眠的DCCs,但在感染后期,随着T细胞的招募,CD4+27+28细胞对于维持觉醒的DCCs是必需的。
先前的研究已经表明,在炎症过程中产生的中性粒细胞外陷阱如何唤醒肺部的DCCs。然而,与CD4+6细胞耗竭相反,在流感病毒感染时通过抗Ly6G抗体耗竭中性粒细胞并没有改变肺部HER2+8细胞的数量或Ki67阳性率(扩展数据图95b,e-g10)。同样,在感染前耗竭CD8+12细胞对DCCs的存在没有影响(图134e14),这与28天dpi肺部CD8+15+16细胞的稀少一致(图174a18)。因此,流感病毒感染后维持唤醒的肺部DCCs的选择性依赖于CD4+19+20细胞的存在。
有趣的是,尽管在MMTV-Her2小鼠的肺中只有少量的CD8+细胞存在,但当CD4+细胞被耗竭时,我们发现感染小鼠的肺中CD8+细胞的积累增加(图 4f)。这些结果表明,CD4+细胞可能抑制CD8+细胞向肺的招募,可能削弱了对被唤醒的DCCs的免疫监视。因此,我们测试了耗竭CD4+和CD8+细胞对IAV感染后维持肺DCCs的影响。尽管CD4+细胞的耗竭导致感染小鼠的肺中HER2+细胞数量显著减少,但CD8+细胞和CD4+细胞的双重耗竭部分恢复了肺中HER2+细胞的数量(图 4e)。因此,CD4+细胞在IAV感染后维持被唤醒的肺DCCs,部分是通过抑制CD8+免疫反应。
我们随后通过单细胞RNA测序(scRNA-seq)检查了野生型和MMTV-Her2小鼠在感染流感病毒后,肺部觉醒的DCCs是否存在能够重新编程招募的T细胞到一个更抑制性或抑制的状态。这些时间点是在肺部T细胞积累量高的时期(扩展数据图)。4b,c正如预期的那样,多种免疫细胞类型,如巨噬细胞、自然杀伤细胞、B细胞、效应和记忆CD4+细胞和效应及记忆CD8+在9和15天接种后,肺中均存在细胞(扩展数据图)。6a-c我们对大多数条件进行了两次重复实验,结果显示基因表达模式非常相似(扩展数据图)。6DIAV感染诱导了这些细胞类型中的I型和II型干扰素反应以及其他先天免疫途径,这是预期之中的(扩展数据图)。7a有趣的是,效应CD4中选择性基因子集的表达显著增加+与效应性CD4 T细胞相比,MMTV-Her2小鼠的细胞+野生型小鼠中的细胞。特别是,Tnfaip3, Zfp36l2, Dusp5, Dusp1, Cxcr4, Klf6, Pdcd4和Ctla4在效应CD4细胞中高度上调+与野生型小鼠相比,MMTV-Her2小鼠的细胞(图。4G补充数据2这些基因中的一些在蛋白质水平上通过流式细胞术得到了验证(Cxcr4)或通过Western印迹分析(Dusp5(扩展数据图)7b). Tnfaip3编码E3泛素连接酶A20的基因抑制CD8的抗肿瘤活性+细胞30而Zfp36l2,它调节RNA稳定性,抑制CD8+细胞激活和扩增31,32. Dusp5编码一种双磷酸酶,抑制T细胞增殖并促进其存活33. Klf6和Dusp1是中央记忆T细胞和驻留记忆T细胞的标志34,35. Ctla4诱导Pdcd4在细胞毒性T细胞中,Pdcd4缺乏可增强其抗肿瘤效应功能36这些结果表明CD4细胞效应细胞表型受损+与野生型小鼠相比,MMTV-Her2小鼠的记忆CD4+在IAV感染后第15天,MMTV-Her2小鼠与野生型小鼠的细胞基因表达显示出相似的变化,其中增加的Tnfaip3, Klf6, Dusp1, Dusp5和Dusp10(扩展数据图)7cCD8细胞中也观察到类似的变化。+在15天接种后,从MMTV-Her2小鼠和野生型小鼠分离的细胞(扩展数据图)。7d,e总体而言,这些数据表明CD4中更倾向于记忆表型,并且随着效应功能的减少而增加生存率。+CD8+感染MMTV-Her2小鼠的细胞。进一步分析证实了CD4+CD8+感染MMTV-Her2小鼠的细胞与野生型相比(扩展数据图)。7F与DCC介导的T细胞效应功能抑制一致。
此外,CD4+1+和CD4+2+细胞中对于T细胞激活重要的基因表达,包括3Gadd45b和5Slfn2(参考文献7、8、37、9、10、38、11、12、39、13、14),在感染HER2+17+和HER2+18小鼠的CD4+15+和CD4+16+效应细胞中相对于野生型小鼠有所降低(图19-4g和补充数据21-2-22)。有趣的是,多个线粒体基因(包括23mt-Atp6、25mt-Nd1、27mt-Co3和29mt-Nd3)在MMTV-Her2小鼠的CD4+31+和CD4+32+细胞中的表达大大降低,表明这些细胞的线粒体含量减少(图33-4g和34)。线粒体含量的减少可能是由于通过上调35Tnfaip3介导的自噬增加所致,因为37Tnfaip3缺乏已被证明可以通过促进自噬来增加CD4+39+和CD4+40细胞的线粒体含量(参考文献41、42、40、43、44)。在感染MMTV-Her2小鼠的T细胞类型中,包括CD8细胞在内,观察到从15天起(但在9天时,即完全DCC扩张之前)线粒体和核编码转录物的减少,这与T细胞效应功能的降低一致(扩展数据图45-8和补充说明47-1-48)。我们通过Mitotracker染色和流式细胞术验证了感染MMTV-Her2小鼠的CD4+49+和CD8+51+和CD8+52+细胞的线粒体含量相对于野生型小鼠有所减少(扩展数据图53-7g,h和54)。
通路分析进一步支持了MMTV-Her2小鼠CD4+细胞效应功能受损。对感染IAV后MMTV-Her2和野生型小鼠的scRNA-seq进行过度表达分析(ORA)显示,在多种免疫细胞类型中,MMTV-Her2小鼠的干扰素反应降低(扩展数据图 9a,b),如巨噬细胞(扩展数据图 9c,d)和T细胞(扩展数据图 10a)所示,这与感染MMTV-Her2小鼠肺部产生的I型和II型IFN水平较低一致(扩展数据图 10b;所有显著的基因集富集分析(GSEA)结果见补充数据 3)。此外,我们观察到感染MMTV-Her2小鼠中M2型与M1型巨噬细胞的比率增加,伴随着基因表达的显著变化(扩展数据图 9e)。我们还观察到,在感染MMTV-Her2小鼠的巨噬细胞和T细胞中,与感染野生型小鼠相比,氧化磷酸化途径在15天时间点(dpi)显著抑制(扩展数据图 9c,d 和 10a)。综合这些结果表明,DCCs的存在偏转了巨噬细胞的表型,并阻碍了CD4+和CD8+细胞对IAV感染的激活,有利于肿瘤细胞的持续存在。
关键的是,通过比较MTMV-Her2小鼠在IAV感染(15天接种后)和CD4细胞耗竭时CD8+1+2 T细胞的GSEA,发现与CD4+7+8细胞耗竭相比,参与CD8+3+4细胞激活的通路显著增加,如IL-2-STAT5、MTORC1以及1型和2型干扰素信号通路,这表明效应性和记忆性CD8+5+6细胞在CD4+7+8细胞耗竭时更具增殖性和激活性(图94h10和扩展数据图1110c12)。通过CD4+15+16细胞耗竭,在15天接种后,CD8+13+14细胞的线粒体和呼吸表型也得到了恢复(扩展数据图17818)。因此,CD4+19+20细胞耗竭对消除DCCs的影响似乎是通过增强CD8+21+22细胞对DCCs的响应来介导的。
为了进一步确定MMTV-Her2小鼠中的CD4+细胞是否抑制了抗肿瘤CD8+细胞的激活,我们分离了15天接种后感染IAV的MMTV-Her2小鼠或CD4+细胞耗尽的MMTV-Her2小鼠的肺CD8+细胞。在体外用抗CD3/抗CD28抗体激活后,从CD4耗尽感染的MMTV-Her2小鼠中分离出的肺CD8+细胞特异性检测到IFNγ的产生增加(图4i)。此外,我们还研究了这些CD8+细胞在体外杀死乳腺癌细胞的能力,使用从MMTV-Her2小鼠乳腺中分离出的原发性HER2+细胞培养。与IAV感染的Her2小鼠的肺CD8+细胞相比,从CD4耗尽感染的MMTV-Her2小鼠中分离出的肺CD8+细胞在体外对HER2+肿瘤细胞的杀伤活性更强(图4j和扩展数据图11a)。相比之下,IAV感染野生型小鼠的CD8+细胞对MMTV-Her2肿瘤细胞的杀伤活性最小。从CD4耗尽Her2小鼠中分离出的肺CD8+细胞也在杀死来自缺乏HER2的MMTV-PyMT小鼠生成的MET-1癌细胞系方面表现出色(扩展数据图11b)。综合这些数据表明,IAV感染的MMTV-Her小鼠中的CD8+细胞具有特异性抗乳腺肿瘤活性,以及肺CD4+细胞对抗肿瘤CD8+细胞的抑制作用。
SARS-CoV-2感染唤醒DCC
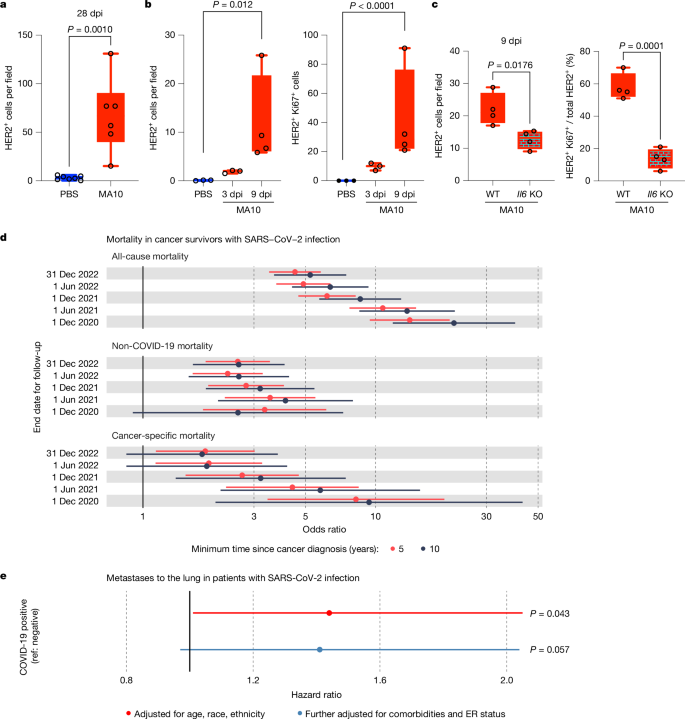
为了确定新冠病毒(SARS-CoV-2)感染肺部是否能促进休眠的间充质干细胞(DCCs)的重新激活,我们进行了研究(类似于图1.12中的IAV感染研究),使用了在小鼠中适应并识别小鼠血管紧张素转换酶2(ACE2)的SARS-CoV-2,称为MA10,通过遗传修饰刺突基因后,在老鼠中进行连续传代获得(3.415.6)。这种SARS-CoV-2毒株在小鼠中诱导出类似COVID-19的疾病,包括急性肺损伤,其特征是肺功能受损、弥漫性肺泡损伤和免疫细胞的浸润(11.1242.1314)。与IAV感染相似,MA10感染诱导肺部产生高水平的IL-6和IFNα(扩展数据图15.11c,d 16)。在BALF中也可以检测到较低水平的IFNβ、IFNγ和IL-1β。重要的是,将MA10-SARS-CoV-2感染到MMTV-Her2小鼠中,导致HER2+细胞数量在28天接种后(dpi)显著增加(图19.5a 20和扩展数据图21.12a 22)。对早期时间点(3和9 dpi)的分析显示,MA10感染后HER2+细胞和Ki67+HER2+细胞的数量呈逐步增加(图29.5b 30),伴随着EpCAM阳性性的短暂增加和vimentin阳性性的减少(扩展数据图31.12b 32),这与IAV感染后观察到的现象一致。值得注意的是,我们证明了HER2+ DCC增殖、扩增和表型转变的这些变化需要IL-6,因为在#35Il6#36-KO:MMTV-Her2小鼠中,MA10感染依赖的变化显著减少,且MA10病毒复制没有可检测到的变化(图37.5c 38和扩展数据图39.11f 40以及41.12c 42)。
a,用MA10 SARS-CoV-2(n = 6)或PBS对照(n = 7)在28 dpi下定量C57BL6 / J MMTV-Her2小鼠肺中三个肺切片的HER2细胞。b,c,FVB MMTV-Her2小鼠肺部HER2细胞和Ki67 HER2细胞在3dpi和9dpi时Ki67 HER2细胞的百分比(n = 3 PBS在3 dpi和n = 4在9 dpi)的肺部(b)和比较没有(WT)或有Il6敲除的MMTV-Her2小鼠(每组n = 4)(c)。显着性通过双尾学生 t 检验 (a,c) 确定。对于 b,我们对每个字段的 HER2 细胞应用负二项式模型,比较 9 dpi 和 PBS 对照(以适应潜在的过度分散);对于每个字段的 HER2Ki67 细胞,我们使用负二项式模型确定感染组中每个字段的细胞是否显着高于 0(所有 PBS 样品均为 0)。所有重复都是生物的。d,e,流行病学研究。d,英国生物银行的分析检查了 SARS-CoV-2 检测呈阳性或阴性与癌症幸存者全因、非 COVID-19 和癌症相关死亡风险之间的关联在 COVID-19 大流行开始前超过 5 年(红色)或 10 年(黑色)。这些分析比较了阳性测试和阴性测试参与者之间的死亡风险,使用2020年12月1日至2022年12月31日的死亡事件审查日期。e,来自 Flatiron Health 数据库的分析,评估了发生 COVID-19 疾病的乳腺癌患者与未发生的乳腺癌患者进展为转移性肺病的风险比,根据年龄、种族和民族(红色)进行了调整,并在还包括合并症、乳腺癌亚型(例如急诊室状态)和其他潜在混杂因素(蓝色)之后进行多变量分析。所有箱须图都显示为最大值(顶线)、中位数(中线)和最小值(底线),所有数据点都显示为点。+++++++
COVID-19 与癌症进展有关
COVID-19与癌症进展有关
新冠疫情大流行提供了一个独特的机会来研究肺部病毒感染对癌症进展的影响,因为与流感不同,在疫情初期就对病毒感染的病例和结果进行了系统的数据收集。首先,我们分析了英国生物银行的数据,以确定在癌症幸存者人群中,SARS-CoV-2阳性检测结果是否与全因、非COVID-19和癌症死亡率增加有关(扩展数据图#12d2)。为了减少疫苗接种和使用家用SARS-CoV-2检测可能带来的混杂因素,我们将分析限制在2020年12月之前进行PCR检测的受试者。由于观察到的病例数量不足,无法根据原发肿瘤类型和转移性疾病对结果进行分层。
在随访至2022年12月31日的完整研究人群中,包括4,837名在2015年1月1日之前被诊断为癌症的参与者(表明推断出的缓解),我们观察到413例死亡(测试阴性者中有298例,测试阳性者中有115例),得出的比值为4.50(95%置信区间:3.49–5.81)(图#15d2)。当我们排除了直接归因于COVID-19的120例死亡后,SARS-CoV-2阳性病例的死亡率仍然有所增加,比值为2.56(95% CI:1.86–3.51)。基于作为结果的128例与癌症相关的死亡,我们估计测试阳性者相比测试阴性者的癌症死亡率几乎增加了两倍(比值,1.85;95% CI:1.14–3.02)。
对至少在大流行前10年(即2010年1月1日之前)被诊断出患有癌症的参与者进行的分析显示,结果与主要分析一致,尽管由于病例数量减少而导致了一些功效损失。与SARS-CoV-2阴性参与者相比,SARS-CoV-2阳性参与者的全因死亡率风险增加(比值比,5.24;95%置信区间:3.66-7.48)、非COVID-19死亡率风险增加(比值比,2.58;95%置信区间:1.64-4.06)以及癌症死亡率风险增加(比值比,1.80;95%置信区间:0.85-3.80)。
当我们将从2022年1月31日到2020年12月1日的随访期缩短到从2020年1月31日到2020年12月31日时,比值比从1.85(1.1.4–3.02)增加到8.24(3.43–19.77)(图#15d和扩展数据表#324),并且随着后续6个月间隔的减少,随访时间内的比值比逐渐降低。这一趋势表明,感染后不久关联的强度最大,随着时间的推移而减弱。测试阴性组中的一些个体可能在随访期间感染了病毒。这些随时间演变的感染风险差异可能有助于观察到的关联变弱。即便如此,我们的发现表明,在感染SARS-CoV-2后的最初几个月内,癌症死亡风险增加最大。综合这些数据表明,对于感染SARS-CoV-2的癌症幸存者来说,癌症死亡的风险显著增加。
我们使用了Flatiron Health数据库中的36,845名女性乳腺癌患者,这些患者的完整信息被用来特别确定在COVID-19之后,最初诊断为乳腺癌的女性是否经历了进展到肺部转移性疾病的增加风险(扩展数据表#13和扩展数据图#312e)。关键的是,那些在初次乳腺癌诊断后经历COVID-19疾病的女性乳腺癌患者,显示出年龄、种族和民族调整后的危险比为1.44(95% CI:1.01,2.05;#5P#6 = 0.043),对于随后诊断为肺部转移性乳腺癌的风险(红色在图#75e和扩展数据表undefined10–undefined12中)。因为我们缺乏Flatiron Health数据集中的COVID阴性测试数据,COVID阴性组可能包括未诊断病例,这可能低估了危险比。进一步调整我们的模型以考虑合并症和乳腺癌亚型(雌激素受体(ER)状态),我们估计COVID对转移到肺部的转移性疾病有一个一致的影响,尽管略有减弱且不具统计学意义,危险比为1.41(95%CI:0.97,2.04)(蓝色在图#135e#14中)。这些结果表明,简约模型的初步发现是稳健的,而且在Flatiron Health数据集中额外协变量的潜在混杂效应可以忽略不计。总之,这些数据显示COVID增加了女性乳腺癌患者肺部转移的风险。
讨论
我们的结果表明,呼吸道病毒感染促进了先前播种的休眠癌细胞的觉醒和扩增。这个过程分两个不同的阶段展开。首先,DCC 从间充质表型到杂交状态的 IL-6 依赖性转变促进扩增。其次,这种扩增之后是恢复静止并建立抑制DCC消除的CD4细胞生态位,部分是通过抑制CD8细胞(扩展数据图。12f). 我们进一步展示了 HER2 肿瘤细胞的存在如何导致 CD4 细胞的抑制表型,以及 CD4 细胞的耗竭导致流感病毒感染扩充的 DCC 的消除,依赖于具有恢复效应活性的 CD8 细胞。重要的是,我们表明适应小鼠的 SARS-CoV-2 病毒同样会导致肺部 IL-6 依赖性 DCC 扩增。++++++
自 COVID-19 大流行爆发以来,SARS-CoV-2 对癌症进展的潜在影响一直是研究界的一个关键问题43,44,45.尽管物种差异在解释小鼠数据时需要谨慎,但英国生物样本库的分析表明,癌症幸存者在感染 SARS-CoV-2 后癌症死亡率增加。这种风险在感染后的几个月达到顶峰,与小鼠模型平行显示,DCC 在两周内扩展到转移性病灶的 100 倍以上。基于 Flatiron Health 数据库的分析进一步表明,COVID-19 后乳腺癌幸存者中转移性肺病的发病率显着增加。总的来说,这些发现强调了 COVID-19 对癌症幸存者构成的巨大转移风险,休眠的 DCC 重新激活可能会推动这一现象。
我们的研究强调了制定干预措施的重要性,以尽量减少数百万经历呼吸道病毒感染的癌症幸存者肺部 DCC 觉醒和转移性疾病的风险。除了一级预防策略外,美国食品和药物管理局批准的治疗重症 COVID-19 的治疗方法还包括针对 IL-6R 的拮抗抗体46和口服 JAK1/2 抑制剂47,提高了可以降低感染引起的转移性癌症进展风险的干预措施的前景。这些干预措施的有效性和安全性,以及避免阻碍感染解决的应用时机,需要首先在临床前和临床研究中进行测试。
总之,我们的研究揭示了呼吸道病毒感染如何增加癌症复发风险,并强调需要制定公共卫生和临床策略来减轻与 SARS-CoV2 和其他呼吸道病毒感染相关的转移进展风险增加。
方法
小鼠品系、流感感染和抗体治疗
使用小鼠乳腺肿瘤病毒 (MMTV) 长末端重复序列的乳腺癌转基因小鼠模型被广泛使用。简而言之,MMTV-PyMT和MMTV-erbB2/neu/Her2(MMTV-Her2)小鼠分别表达癌基因多瘤病毒中间T抗原(PyMT)和大鼠Erbb2(编码HER2),MMTV启动子的上游,在乳腺上皮中赋予表达,如其他地方所述10,13,48.MMTV-PyMT 转基因在 FVB 小鼠背景中是同源的(William Muller 的礼物)。鉴于MMTV-PyMT小鼠在生命的几个月内表现出大量的肺部肿瘤负荷,我们将分析限制在该模型中新唤醒的DCC(形成微转移,定义为面积小于0.03毫米的病变2).MMTV-Her2转基因在FVB(杰克逊实验室,002376)和C57BL / 6(来自Ramon Parsons的礼物,通过FVB背景的回交在C57BL / 6J中同源26)背景。MMTV-Her2小鼠(FVB)与IL-6敲除(KO)小鼠杂交9,25 .对于乳腺癌的原位模型,EO771 乳腺癌细胞49(戴安娜·西特利 (Diana Cittelly) 的礼物)用 2 个× 10 注射到第四个左右乳房脂肪垫中5或 1 × 106每个脂肪垫的细胞。
8周龄MMTV-PyMT和12至14周龄MMTV-Her2雌性小鼠通过鼻内给药50μl PBS感染500 EIU波多黎各A/PR/8/34 H1N1 IAV。对于病毒给药,使用5%诱导异氟醚和2%维持麻醉小鼠,在诱导室中使用SomnoFlo低流量电子蒸发器机进行。在通过缓慢而深的呼吸确保充分麻醉后,将病毒液滴放在小鼠的鼻孔上。小鼠通过鼻孔吸入液体。一旦液体被吸入,将鼠标放在加热垫上进行恢复。
对于免疫细胞耗竭实验,在IAV感染前1天和感染后每6天注射一次大鼠IgG作为对照(MP Biochemicals,MPBio 0855951),腹腔注射100μg抗CD4(Bio X细胞,克隆GK1.5,BP003-1)或100μg抗CD8(Bio X细胞,克隆2.43),或在流感病毒感染当天200μg抗Ly6G(Bio X细胞,克隆1A8,BP0075-1), 然后 24 小时,之后每隔一天一次,直到被安乐死。对于5-乙炔基-2′-脱氧尿苷(EdU)掺入,在安乐死前4小时向小鼠注射50mg/kg EdU(Sigma Aldrich,BCK488-IV-FC-S)。
对于MMTV-PyMT和MMTV-Her2小鼠,作为人道终点,当肿瘤在任何一个维度上达到20毫米,肿瘤溃烂或感染,或者如果有重大不适迹象时,小鼠被安乐死,由机构兽医确定。在第一周或直到触诊肿瘤之前,每隔一天监测一次小鼠,之后每天监测一次,直到小鼠需要安乐死。机构设施中的兽医技术人员每天监测小鼠。
所有小鼠被共同饲养在特定的无病原体动物设施中,保持在21°C(±1°C)和35%湿度,14小时:10小时的明暗循环(光照06:00–20:00)。所有小鼠都在 C57Bl/6J 背景下回交超过 10-12 代。研究仅使用雌性小鼠。小鼠的平均年龄为 12-24 周。经批准的一氧化碳测量2随后宫颈脱位用于安乐死。
科罗拉多大学机构动物护理和使用委员会 (IACUC) 审查并批准了所有动物实验(包括上述人道终点),这些实验是根据 NIH 实验动物护理和使用指南进行的。
SARS-CoV-2 MA10 传播
如前所述,小鼠适应的SARS-CoV-2 MA10(BEI Resources,NR-55329)在Vero E6细胞(ATCC CRL-1586)中繁殖42.简而言之,低传代 Vero E6 单层以 0.01 的感染倍数接种 SARS-CoV-2 MA10。当Vero E6单层表现出70-75%的细胞病变效应(2-3 dpi)时,收集上清液,通过离心澄清,补充额外的10%FBS,等分并储存在-80°C。通过Vero-E6细胞的斑块测定测定SARS-CoV-2滴度。将Vero-E6细胞维持在37°C中,在补充有10%胎牛血清(FBS),10mM HEPES(pH 7.3)和100U ml−1青霉素-链霉素。
小鼠的 SARS-CoV-2 MA10 感染
通过腹腔注射氯胺酮(80mg/kg)和甲苯噻嗪(7.5mg/kg)的混合物麻醉14-19周龄的MMTV-Her2雌性小鼠(C57BL / 6J和FVB背景)体积为100-200μl。完全麻醉的小鼠鼻内接种 104SARS-CoV-2 MA10的PFU在补充有1%牛犊血清的PBS中稀释,在每个鼻孔中施用25μl接种物,总体积为50μl。每天收集小鼠体重,持续15天,接种SARS-CoV-2 MA10的小鼠在2 dpi时开始表现出体重减轻,在3-4 dpi时损失最大,如前所述42.作为对照,MMTV-Her2小鼠模拟接种50μl PBS / 1%牛犊血清。
来自肺部的 SARS-CoV-2 MA10 病毒滴度
MA10病毒滴度如前所述测定50.将肺上叶均质化,在DMEM中用2%FBS、HEPES、青霉素-链霉素连续稀释,并在Vero E6细胞上在37°C下孵育1小时。 然后在 37 °C 下用 1% (w/v) 甲基纤维素在 MEM 中与 2% FBS 覆盖细胞 3 天。之后去除覆盖层,并在室温下用4%多聚甲醛固定板20分钟。将固定板在20%甲醇中用结晶紫(0.05%w / v)染色10分钟。通过手动计数形成的斑块来确定传染性病毒滴度。
免疫组化和免疫荧光染色
收集肺和乳腺并固定在 10% 中性缓冲福尔马林中过夜,第二天转移到 70% 乙醇中,然后包埋在石蜡中。将组织切片(5μm)并用于免疫组织化学(IHC)和免疫荧光。载玻片在 Histo-clear(Fisher Scientific,50-899-90147)中孵育 15 分钟,然后下降 10 分钟乙醇孵育:3 次孵育 100%,然后是 95% 和 70%,然后是 10 分钟的 H2O 孵化。在柠檬酸盐缓冲液(10 mM柠檬酸,pH 6.0)中的高压锅中进行热诱导抗原修复10分钟。对于IHC,样品在1%H2O2阻断内源性过氧化物酶活性 15 分钟。使用 0.1% 正常山羊血清在 0.4% Triton-X 100 中的 PBS 中进行透化 30 分钟。用含有MOM封闭试剂(Vector Laboratories,MKB2213-1)的封闭溶液(Abcam,AB64226)在室温下封闭切片1小时,与一抗(补充信息表1)在抗体稀释剂(Abcam,64211)下在4°C下孵育过夜,然后在PBS中的0.1%triton-X 100中洗涤3次,每次30分钟。对于IHC样品,根据制造商的说明,将切片在ImmPRESS HRP山羊抗兔或大鼠IgG聚合物检测试剂盒(Vector Laboratories,MP-7451 / MP7404)和ImmPACT DAB底物过氧化物酶HRP(Vector Laboratories,SK4105)中孵育。IHC 载玻片使用微型安装剂(StatLab,MMC0126)安装。对于免疫荧光,将切片与二抗在室温下在抗体稀释剂中孵育1小时(Abcam,64211)。然后将切片在 PBS 中的 0.1% Triton-X 100 中洗涤 3 次,每次 30 分钟,并使用带有 DAPI 的荧光屏蔽封片介质(Abcam,104139)进行封片。使用蔡司 Axiovert 200 米荧光显微镜收集免疫荧光图像。使用Keyence BZ-X800显微镜收集IHC图像。切片染色、图像捕获和图像分析是使用 ImageJ 手动完成的,并由一名对样本身份不知情的研究人员进行。随后的分组和绘图由另一名实验室成员完成,该成员在完成图像分析和定量后被揭盲。
胶原蛋白沉积的评估
使用 Masson 的 Trichrome 染色剂评估胶原蛋白沉积。如其他专题所述,使用FRIDA软件评估染色区域的强度51.
BALF加工
小鼠安乐死后,使用1ml PBS(ThermoFisher,14190-144)进行支气管肺泡灌洗。收集BALF并在4°C下以500g离心5分钟。 将上清液在液氮中快速冷冻并储存在-80°C直至分析。使用溶血缓冲液(150 mM NH4Cl,1 mM NaHCO3, 1.1 mM 钠2EDTA)3 min,加入流动缓冲液(PBS with 2% FBS 和 2 mM EDTA),并将细胞悬液在 4 °C 下以 500g 离心 5 分钟。 将细胞重悬于流动缓冲液中并手动计数。
细胞因子检测
根据制造商的说明,使用Meso Scale Discovery定制的高灵敏度多重检测法测量BALF中的细胞因子。
流式细胞术分析
从BALF中回收的细胞用抗体染色(补充信息表1)。或者,取全肺并使用其他地方描述的方法消化52.简而言之,肺消化混合物(1.5 毫克毫升−1胶原酶 A(Sigma Aldrich,COLLA-RO),0.4 毫克 ml−1脱氧核糖核酸酶I(Worthington,LS002139),10 mM HEPES pH 7.2,5%FBS)通过插管注射到肺部,将肺部在37°C的摇动培养箱中孵育30分钟,然后进行剧烈涡旋。将消化的肺通过50μm细胞过滤器,使用溶血缓冲液裂解红细胞3分钟,加入流动缓冲液,细胞悬液在4°C下以500g离心5分钟。 将单细胞重悬于流动缓冲液中,并用抗体染色(补充信息表1)进行流式细胞术。为了进行线粒体质量分析,将肺细胞悬液在37°C下用Mitotracker green(Invitrogen,M7514)染色30分钟。 在37°C孵育的最后5分钟内对CD4和CD8进行染色,并立即洗涤细胞进行流式细胞术分析。在LSR II流式细胞仪(BD Biosciences)或Aurora(Cytek)上收集数据,并使用FlowJo软件v.10进行分析。CD4 和 CD8 细胞群定义明确(扩展数据图7h).对于DCC的细胞分选,根据制造商的方案(Miltenyi,130-095-927),使用肺解离试剂盒小鼠从PBS或IAV(9 dpi)感染的MMTV-Her2小鼠中获得肺细胞匀浆。单细胞悬浮液处理红细胞裂解。将单细胞悬液与抗 CD16/CD32 Fc-Block(BD Biosciences,553141)预孵育(5 分钟),然后对 CD45 和 HER2 进行染色,并使用 Astrios EQ 流式细胞仪(Beckman Coulter)进行分选。DCC 在 CD45 上进行门控负HER2.分选的DCC用于批量RNA-seq(如下所述)。+
肺CD8和CD4细胞的离体分析++
根据制造商的方案,使用CD8α(Ly-2)微珠(Miltenyi,130-117-044)进行阳性选择,从消化的肺中分离CD8细胞。对于CD8细胞介导的细胞毒性实验,在杀伤测定前2天接种从MMTV-Her2小鼠的乳腺中分离的Her2细胞并在培养物中扩增,或从MMTV-PYMT小鼠的乳腺中分离的永生化PyMT细胞(MET-1)。IAV感染后15天从野生型小鼠、MMTV-Her2小鼠或用抗CD4抗体处理的MMTV-Her2小鼠中分离肺CD8细胞(从感染前一天开始)。将肺 CD8 细胞(从 3-4 只小鼠中混合)以 1:1 的效应子:靶标比例添加到癌细胞培养物中。然后,48小时后,洗涤共培养物(去除CD8细胞),计数胰蛋白酶消化和活癌细胞。使用抗CD3/抗CD28包被珠重新刺激分离的肺CD8细胞++++++53,20 h后,收集上清液,用于ELISA检测IFNγ,如前所述54,使用抗小鼠IFNγ捕获抗体(Biolegend,505702)和生物素化抗小鼠IFNγ抗体(Biolegend,505804)。
根据制造商的方案,使用CD4微珠(L3T4)(Miltenyi,130-117-043)进行阳性选择,从IAV感染的野生型和Her2小鼠肺细胞匀浆中分离CD4细胞。细胞沉淀用于蛋白质印迹分析的全细胞裂解物。+
蛋白质印迹分析
从从感染IAV的野生型和MMTV-Her2小鼠(FVB)的肺中分离出的CD4细胞制备全细胞提取物,方法在其他地方描述+55.对于蛋白质印迹分析,使用以下抗体:β-肌动蛋白单克隆抗体(AC-15)(Invitrogen,AM4302),抗DUSP5(Invitrogen,PA5-85961),抗兔HRP(Jackson ImmunoResearch Laboratories,111-035-144)和抗小鼠HRP(Jackson ImmunoResearch Laboratories,115-035-166)。
固定单细胞RNA-seq
按照流式细胞术分析一节所述生成单细胞。使用 Chromium Next GEM 单细胞固定 RNA 样品制备试剂盒 (10X Genomics) 将表现出大于 80% 活力的细胞固定在 4% 甲醛溶液中。将全转录组探针对(10X Genomics)添加到固定的单细胞悬液中,在42°C下孵育过夜期间与其互补的靶RNA杂交。 杂交后,通过洗涤去除未结合的探针。将固定和探针杂交的单细胞悬浮液加载到 Chromium X (10X Genomics) 微流控仪器上,以在油乳液中产生分配的纳升级液滴。目标是让每个液滴包含一个带条形码的凝胶珠、一个用于探针对连接和凝胶珠引物条形码扩展的单细胞和酶预混液 (10X Genomics)。将油乳液中的液滴置于热循环仪中,在25 °C下放置60 min,在60 °C下放置45 min,在80 °C下放置20 min。 单细胞条形码连接探针产品使用标准 10X Genomics 方案进行文库制备,为 Illumina 下一代测序做准备。在科罗拉多大学基因组学共享资源的 Illumina NovaSeq 6000 (Illumina) 上,将源自单细胞条形码连接探针产物的基因表达文库作为配对端 150 碱基对读数进行测序,目标深度为每个细胞 20,000 个读数对于所有样本。
用于 scRNA-seq 分析的数据处理
使用 Cell Ranger 软件(v.7.1.0,10X Genomics)处理 scRNA-seq fastq 文件56根据 Cell Ranger 的 Chromium 小鼠转录组探针集 (v.1.0.1) 为基因分配读取。使用 Seurat R 包分析计数57.在不到 10 个细胞中发现的基因被排除在外。如果细胞包含少于 201 个基因、超过 7,500 个唯一分子标识符 (UMI) 或超过 2.5% 的线粒体 UMI,则将其排除在外。R 包 scDblFinder58用于识别并随后从数据中删除双峰。除了去除被识别为双峰的细胞外,还以顺序方式使用初步聚类来去除超过 50% 的细胞被鉴定为双峰的簇。下游处理后,如果簇包含来自多种细胞类型的经典标记,则对簇进行过滤。然后对数据进行深度归一化,然后进行自然对数变换。使用前 2,000 个变化最大的基因来缩放数据,同时回归细胞周期 S/G2M 差异、总 UMI 和线粒体 UMI 的百分比。
使用前 2,000 个可变基因进行主成分分析。然后,捕获大部分变异的主成分 (n = 30) 被纳入进一步的数据处理步骤中。使用 K 最近邻算法识别聚类(分辨率为 1.5)。使用富集的经典标记和 ORA 对细胞类型进行注释59使用来自 MSigDB 的基因集60和 PanglaoDB61.广泛 T 淋巴细胞被鉴定并分别进行亚聚类以提高细胞类型分辨率。在为指示的比较确定的每种细胞类型中使用 Wilcoxon 秩和检验鉴定差异表达基因。GSEA 是使用 clusterProfiler R 包 (v.4.0.5) 完成的62采用Benjamini-Hochberg法计算调整后的P值。奥拉62使用 MSigDB 的 Hallmark、KEGG 和 GO Biological Processes 基因集集合对前 200 个差异表达基因进行60.使用修拉制作的情节57、ggplot263, ggpubr64和 pheatmap65R 包。
线粒体特异性 scRNA-seq 分析
我们分析了日志2(倍数变化)、调整后的 P 值和从 scRNA-seq 数据生成的原始 P 值,以比较以下实验组:HER2 + IAV 与 HER2 + PBS、HER2 + IAV 与野生型 + IAV 和 HER2 + IAV。为了关注线粒体功能,我们使用了我们的自定义线粒体通路基因列表,最初发表在参考文献中。66.具体来说,我们检查了线粒体 OXPHOS 基因与我们精选的与线粒体活性相关的先天免疫途径之间的重叠。使用pheatmap包(v.1.0.12)将结果可视化为热图。使用快速 GSEA 进行通路分析67使用之前在 ref.66.将所有样本与对照进行比较,并使用 −log 定义基因排名列表10(P 值)×对数2(折叠变化)。通过基因集的 1,000 个排列来评估统计显着性60.报告结果时错误发现率 (FDR) 阈值小于 0.25,并可视化为使用 pheatmap 包 (v.1.0.12) 生成的热图。
DCC 的 RNA-seq 分析
使用 RNeasy plus micro 试剂盒(Qiagen,74034)从分选的 DCC(如上所述的流动分选)中分离 RNA,并按照制造商的说明使用 SMART-Seq mRNA LP 试剂盒(Takara Bio,634762)制备文库。在 NovaSeq X (Illumina) 上对合并文库进行测序。fastq 文件使用 nf-core rnaseq 管道 (v.3.12.0) 进行处理68.使用Cutadapt修剪读取69并使用 STAR (v.2.7.9a) 与小鼠转录组(GRCm38,Ensembl 版本 102)比对70并使用 Salmon 进行量化 (v.1.10.1)71.使用limma进行差异表达分析72如上所述,使用 voom 方法后跟 GSEA。
流感病毒RNA定量
全肺组织均质化,并按照制造商的方案(分别为ThermoFisher和MilliporeSigma)使用TRIzol/氯仿提取分离RNA。用 iScript cDNA 合成试剂盒(Bio-Rad Laboratories)逆转录 RNA(1 μg),并通过 qPCR 确定 PR8 酸聚合酶基因的病毒载量,与先前描述的已知 PR8 酸聚合酶基因拷贝数的标准曲线进行比较73.
HER2 乳腺球和 EO771 类器官培养+
将 14-18 周龄的 FvB-MMTV-Her2/Neu 雌性小鼠用作早期(“癌前”)小鼠。使用异氟醚和颈脱位对小鼠实施安乐死。将整个乳腺切碎,并在 0.15% 胶原酶 1A(Sigma,C-9891)、2.5% 牛血清白蛋白和 200 U DNAse I(Stemcell Technologies,NC9007308)溶液中在 37 °C 下搅拌 30 分钟。在室温下使用红细胞裂解缓冲液(eBioscience,4333-57)2分钟去除血细胞。通过 40 μm 过滤器过滤细胞。然后 3 × 105将每孔细胞接种在 1 ml 哺乳球培养基 (DMEM/F12 (Gibco, 11320-082)、1× B27 补充剂 (Gibco, 17504-044)、10 ng ml 中的六孔超低粘附板中−1EGF(Peprotech,AF-100-15-A),50 U青霉素-链霉素(Thermo Fisher,15070-063))。接种后 24 小时再加入 1 ml 乳状细胞培养基。在接种后第 4 天,用 PBS 或 10 ng ml 处理细胞−1IL-6(R&D Systems,406-ML-005)连续 3 天。使用尼康 Eclipse Ti-S 显微镜,以 4× 倍率对乳腺球进行成像,在治疗结束时每孔拍摄两张图像。使用 QuPath 软件分析乳腺球的大小和数量。
将EO771细胞接种在聚HEMA包被的12孔低粘附培养皿中,密度为1.5 × 105每孔细胞在 1 ml 类器官培养基(DMEM/F12、5% FBS、1% 青霉素-链霉素 5,000 U ml−1, 20 纳克 毫升−1FGF2,10 纳克毫升−1EGF,5μM Y-27632,4μg ml−1肝素加 5% 基质胶)。用PBS或10 ng ml处理细胞−1IL-6(R&D Systems,406-ML-005)3 天。使用 EVOS M7000 显微镜,以 4× 的放大倍率对 EO771 类器官进行成像,每孔每隔一天拍摄 5 张图像。使用FIJI分析类器官的大小和数量(ImageJ)。
测量白细胞耗尽外周血中的转基因 Her2 mRNA
如上所述,将 12-14 周龄的 MMTV-Her2 小鼠感染 500 EIU 波多黎各 A/PR/8/34 H1N1 IAV 或 PBS,并使用 CO 安乐死2在 9 dpi 时。通过心内穿刺采集血液,置于冰上的肝素溶液中。红细胞裂解后,按照制造商的说明,使用 Miltenyi 直接谱系细胞耗竭试剂盒、小鼠(Miltenyi,130-110-470)进行谱系耗竭。谱系耗尽后,按照制造商的说明使用 RNeasy Plus Micro Kit(Qiagen,74034)提取 RNA。使用 iTaq Universal SYBR Green 一步法 RT-qPCR(Bio-Rad,172-5150)和 MMTV-Her2 大鼠转基因引物进行逆转录定量 PCR (RT-qPCR);前向,5′-CCCGAGTGTCAGCCTCAAA-3′;反向,5′-GCAGGCTGCACACTGATCA-3’。RT-qPCR在Bio-Rad热循环仪(CFX Opus 384)上运行。
定量和统计分析(小鼠模型)
使用 Prism 10.2.1 软件 (GraphPad) 进行统计分析。研究人员在病毒(IAV 或 SARS-CoV-2)接种或抗体治疗期间没有对分配不知情。定量和图像分析以盲法方式进行;n 表示每组小鼠的数量。每只小鼠至少使用三张载玻片进行图像分析。HER2细胞总计数(图。1c 和图 1.2b)、HER2 细胞和 HER2 Ki67 细胞使用 ImageJ 手动计数。对每只小鼠相距至少50μm的三个肺切片进行计数和求和。我们收集并分析了每个时间点的PBS组;由于在不同时间点没有观察到 DCC 扩增或表型的差异,因此合并了 PBS 样品的结果。对于其他图像量化,使用 ImageJ 网格函数将全肺图像划分为多个区域,每个图像随机选择 8-10 个区域并计数。对于两组的实验,使用双尾学生 t 检验;对于多组实验,除非另有说明,否则使用单因素方差分析检验。数据表示为平均值± s.d.,P 值 ≤ 0.05 被解释为反对原假设的证据(即无效应,无差异)。重复代表不同的小鼠或不同的培养物,而不是同一样品的重复测量。图表以盒形和胡须的形式呈现,带有代表单个值的点;这三条线表示数据集的最大值(顶线)、中位数(中线)和最小值(底线)。++++
人类观察数据
由于在大流行早期阶段强制报告感染和 COVID-19 疾病,我们选择 SARS-CoV-2 感染作为驱动病毒,允许使用真实世界的数据来检验呼吸道病毒感染促进转移性疾病的假设。分析了来自世界不同地区的两个互补数据集:英国生物样本库,这是一项基于人群的研究,包括 2006 年至 2010 年招募时 502,356 名年龄在 40-69 岁之间的成年志愿者(参考文献。 74,75)和 Flatiron Health 电子健康记录 (EHR) 数据库,其中包含来自约 280 家美国癌症诊所(约 800 个护理地点)的癌症患者和幸存者的纵向数据 76,77.
英国生物样本库的基于人群的分析
研究 1 是对英国生物样本库数据的分析,包括生活方式、人体测量、病史、SARS-CoV-2 检测和与国家登记册相关的死亡率数据。先前的癌症诊断是通过同意与国家癌症登记处的联系获得的,并通过与国家登记处的联系获得 SARS-CoV-2 检测状态。死亡率数据是从国家死亡登记处(NHS Digital、NHS Central Register 和 National Records of Scotland)获得的。我们考虑了全因死亡率(包括原发性和继发性原因)、非COVID-19死亡率(通过排除ICD代码为U07.1和U07.2的死亡(参考文献。78)或最新记录的阳性检测结果后一个月内的任何死亡)和癌症死亡率(考虑扩展数据表 1 中列出的 ICD 代码的死因)。
为了评估 SARS-CoV-2 检测阳性是否影响全因、非 COVID-19 或癌症死亡率,我们实施了严格的匹配策略。在大流行开始前至少五年被诊断为原发性癌症且 COVID-19 检测结果呈阳性的癌症幸存者与具有相似风险状况的检测结果为阴性的癌症幸存者进行了匹配。
在502,356名英国生物样本库参与者中,我们排除了两组:首先,那些缺少性别、年龄、体重指数、种族、吸烟状况、饮酒、教育、就业状况、家庭收入、自我报告的合并症、SARS-CoV-2检测日期(主要死因是COVID-19)和癌症诊断日期(如果主要死因是癌症)的信息(n = 65,245);其次,没有任何 SARS-CoV-2 PCR 检测记录的参与者 (n = 195,559)(扩展数据图。12d)。
这留下了 241,552 名参与者,其中 48,958 人在最近的随访中(2022 年 12 月 18 日)被诊断出患有癌症。从该组中,我们排除了五组:死亡日期不一致的参与者(n = 8);被诊断患有多种癌症的人 (n = 4,421);在大流行开始后(定义为 2020 年 1 月 1 日;n = 7,650);那些在英国疫苗接种推出后(2020 年 12 月 1 日;n = 13,274);以及在大流行发作前不到五年被诊断出癌症的参与者 (n = 9,969);这是为了确保参与者很可能处于完全缓解状态,因此任何残留的转移性癌细胞都可能处于休眠状态。
在这些排除之后,最终队列包括 13,636 名参与者,其中 531 名 SARS-CoV-2 检测呈阳性,13,105 名在疫苗接种推广前检测呈阴性(扩展数据图12d)。
我们使用了非参数匹配方法(无需替换)79为每个阳性测试参与者确定(最多)十个阴性测试参与者。匹配分两步进行。我们根据癌症类型和性别进行了精确匹配。然后,我们使用最近邻方法(一种基于倾向评分匹配的算法)匹配年龄、种族、吸烟状况、饮酒量、教育程度、就业状况、家庭收入和癌症诊断日期(癌症诊断的最大允许差异为五年)。由此产生的匹配人群包括 487 个检测呈阳性的人群(也就是说,我们找不到 44 个检测呈阳性的人群的良好匹配)与 4,350 个检测呈阴性的人群相匹配。
使用测试阳性率作为预测变量,我们运行了一系列全因、非 COVID-19 和癌症死亡率的无条件逻辑回归模型。针对所有匹配因子调整模型,以考虑潜在的残余混杂。我们还对英国COVID-19大流行开始前至少十年被诊断出的癌症患者重复了分析,以进一步增加患者缓解的可能性。这是通过排除 2010 年 1 月 1 日至 2019 年 12 月 31 日期间被诊断出患有癌症的阳性测试参与者并重新运行匹配程序来实现的,结果有 266 名检测呈阳性,2,228 名匹配个体检测呈阴性。
从2020年6月1日至2022年12月31日,每六个月间隔不同的审查日期进行敏感性分析。较长的随访期包括更多的事件,而较短的随访期最大限度地减少了因感染数据和疫苗接种缺失而产生的潜在偏差。
基于 Flatiron Health EHR 的分析
数据源
研究 2 使用了 Flatiron Health 的全国 EHR 衍生数据库,包括来自约 280 家美国癌症诊所(约 800 个护理地点)的去识别化数据。该数据库是纵向的,包括去识别化的患者级结构化和非结构化数据,通过技术支持的抽象进行整理 76,77.数据库中的大多数患者来自社区肿瘤学环境,尽管根据研究队列的不同,社区和学术比例可能有所不同。这些数据有义务防止重新识别和保护患者机密。在研究完成之前获得了机构审查委员会对该方案的批准,并包括知情同意豁免。
我们的研究包括初次癌症诊断时年满18岁的女性,她们有:
- 我。早期乳腺癌;该队列包括2011年1月1日或之后诊断为I-III期乳腺癌的概率样本,包括那些表现为非转移性疾病但随后发展为复发或进展性疾病的患者,在2011年1月1日或之后至少有两次就诊;
- 第二。转移性乳腺癌;该队列包括 2011 年 1 月 1 日或之后被诊断为 IV 期乳腺癌的患者,以及那些在 2011 年 1 月 1 日或之后出现早期乳腺癌但随后出现转移性疾病的患者,以及在 2011 年 1 月 1 日或之后发生在数据库中至少两次明显的临床就诊的患者;和
- 第三。初诊时年龄在 18 岁或以上的成年女性患者。
真实世界数据源
索引日期定义为乳腺癌的初步诊断日期。如果在索引日期之后和肺转移诊断之前做出任何 COVID-19 诊断(ICD 代码 B97.29、B97.21、J12.81、B34.2 和 U07.1),则 COVID-19 状态被定义为阳性或最后一次随访日期。数据截止日期为 2023 年 8 月 31 日。COVID-19 阳性状态的开始日期是最早的 COVID-19 诊断日期。从结构化数据中获得索引日期的性别、种族、民族和年龄的基线特征。
分析
使用描述性统计总结基线特征。进行了特定原因分析(死亡被审查)。采用单变量和多变量Cox比例风险模型评估COVID-19诊断对肺转移风险的影响,其中COVID-19诊断状态被视为时变协变量。多变量模型针对被认为相关的患者特征进行了调整,包括年龄、种族和民族。多变量分析包括 36,216 名 COVID-19 阴性患者和 532 名 COVID-19 阳性患者(所有 532 名 COVID-19 阳性患者在索引日均为 COVID-19 阴性)(扩展数据图 1912e). 所有患者的中位随访时间、相应的四分位距 (IQR) 和累积人年的总数分别为 4.36 年、6.21 年和 277,788 人年。患者COVID阴性期的中位随访时间、相应的IQR和累积人年的总数分别为4.35年、6.21年和277,115人年。患者COVID阳性期的中位随访时间、相应的IQR和累积人年的总数分别为0.98年、1.08年和673人年。报告了未经调整和调整的风险比以及相应的双侧 95% 置信区间。进行了双侧似然比检验。显著性水平为0.05。肺转移时间定义为从索引日期到肺转移日期的时间。没有肺转移日期的患者在最后确认的活动日期或死亡时被审查。最后确认的活动定义为生命体征记录、药物给药或报告的实验室测试或结果的最新日期。我们进行了额外的多因素分析(multivariate analysis, MVA)以控制其他潜在的混杂因素,包括合并症和乳腺癌亚型作为敏感性分析。使用之前报道的 ICD-9-CM 或 ICD-10 代码计算使用 Elixhauser 合并症指数的合并症评分80.如果诊断日期在初始诊断日期当天或之后 365 天内,则包括诊断代码。癌症亚组基于熨斗健康数据库中记录的最新测试结果,亚组定义如下:
三阴
ER 阴性、黄体酮受体阴性和 HER2 阴性检测结果的证据,其中 HER2 阴性定义为阴性且癌症类型未另行指定 (NOS)、下一代测序 (NGS) 阴性(ERBB2 未扩增)、荧光原位杂交 (FISH) 阴性/未扩增、IHC 阴性 (0-1+) 或 IHC 模棱两可 (2+);
HER2+
定义为以下一项或多项:NOS 阳性、IHC 阳性 (3+)、FISH 阳性/扩增、NGS 阳性(ERBB2 扩增);
的+
ER 阳性和/或黄体酮受体阳性测试结果。
采用分层因子分层因子分期、诊断年份、年龄组和癌症亚组的分层Cox比例风险模型评估COVID-19诊断对肺转移风险的影响,同时调整初始诊断时的重要协变量(年龄、种族、民族和合并症)。该多变量分析包括 23,876 名 COVID-19 阴性患者和 359 名 COVID-19 阳性患者。报告了调整后的风险比与相应的双侧 95% 置信区间。使用参考文献中概述的方法评估相称性假设。81,表明没有统计学上显着的证据表明违反了比例风险假设。
报告摘要
有关研究设计的更多信息,请参阅本文链接的《自然》作品集报告摘要。
Hits: 80