Contents
Use of Measles-Mumps-Rubella (MMR) Vaccine for the Management of Mumps Outbreaks in Canada
咨询委员会声明 (ACS)国家免疫咨询委员会 (NACI)
读者须知
参考文献中的错误已得到纠正。
序言
国家免疫咨询委员会 (NACI) 为加拿大公共卫生署 (PHAC) 提供与免疫接种相关的持续和及时的医疗、科学和公共卫生建议。
除了疾病负担和疫苗特性外,PHAC 还扩大了 NACI 的任务范围,包括在制定循证建议时系统考虑计划因素,以促进省级和地区级公共资助疫苗计划的及时决策。
NACI 要系统考虑的其他因素包括:经济、道德、公平、可行性和可接受性。在未来几年,NACI 将改进方法以包括这些因素。并非所有 NACI 声明都需要对所有程序因素进行深入分析。随着 NACI 努力全面实施扩大的任务,选定的声明将包括对公共卫生计划的不同程度的程序分析。
PHAC 承认本声明中提出的意见和建议基于当前可用的最佳科学知识,并正在分发本文件以供参考。接种疫苗的人也应了解相关产品专论的内容。此处列出的使用建议和其他信息可能与加拿大疫苗制造商的产品专论中列出的内容不同。制造商已寻求疫苗的批准,并仅在按照产品专论使用疫苗时提供其安全性和有效性的证据。NACI 成员和联络成员在 PHAC 的利益冲突政策范围内行事,包括每年宣布潜在利益冲突。
本 NACI 声明中包含的信息摘要
下面重点介绍了免疫接种提供者的关键信息。详情请参阅声明的其余部分。
1.什么
腮腺炎
自 2016 年以来,加拿大报告的流行性腮腺炎疫情和疫情相关流行性腮腺炎病例数量大幅增加。近年来,加拿大大多数与疫情相关的流行性腮腺炎病例发生在 15-39 岁的年轻人中。从地理上看,加拿大北部社区的疫情爆发率较高。此外,接种疫苗的个体中爆发疫情通常发生在接触病毒的风险增加的情况下,行为风险因素可能会促进传播。
睾丸炎和卵巢炎等并发症相对频繁;像耳聋这样的永久性后遗症很少见。虽然流行性腮腺炎感染的并发症并不总是得到很好的描述或报告,但它们在后疫苗时代和接种疫苗的人群中不太常见。
有关流行性腮腺炎的更多信息,请访问加拿大政府网站(疫苗可预防疾病)。
疫苗
流行性腮腺炎疫苗有麻疹-腮腺炎-风疹 (MMR) 或麻疹-腮腺炎-风疹-水痘 (MMRV) 疫苗。据估计,流行性腮腺炎疫苗的有效性为 1 剂 62% 至 91%,2 剂为 76% 至 95%。在疫情暴发环境中观察到疫苗的有效性略低,尤其是在密切接触环境中发生暴露时,因为保护作用似乎会随着时间的推移而减弱。疫苗有效性减弱可能是由于细胞免疫力、抗体浓度和亲和力下降。
对流行性腮腺炎疫苗的反应通常是轻微和短暂的,包括注射部位疼痛和发红、发烧和皮疹。
2.对象
本声明就流行性腮腺炎爆发环境中提供额外剂量的 MMR 疫苗的主题提供了证据摘要和建议,包括对之前接种过两剂有效疫苗的个体进行第三剂 MMR 疫苗 (MMR3) 的超说明书接种,供公共卫生计划考虑。
3. 如何
在疫情暴发环境中,NACI 建议可以考虑将实施暴发剂量的 MMR 疫苗作为更广泛的疫情管理策略的一部分。此外,NACI 建议在疫情暴发环境中接触流行性腮腺炎病例后的密切接触者可以考虑接种 MMR 疫苗(最多第三剂)。然而,由于与规划实施相关的潜在后勤挑战(例如与疫苗供应和获取成本、疫苗接种和病毒易感性确定以及缺乏免疫接种记录或暴露信息相关的挑战),及时评估疫情特征并确定已经或可能暴露于该疾病的人群非常重要。
4. 为什么
流行性腮腺炎在世界范围内发生,并且疫情仍在继续发生。流行性腮腺炎病的并发症相对常见,但永久性后遗症很少见。
I. 引言
I.1、本声明的目的
2018 年,在加拿大流行性腮腺炎活动高峰期之后,加拿大各省和地区表示有兴趣审查在疫情暴发环境中使用额外剂量含流行性腮腺炎疫苗的证据。美国免疫接种实践咨询委员会 (ACIP) 建议在流行性腮腺炎暴发期间使用第三剂含流行性腮腺炎的疫苗,以加强对流行性腮腺炎疾病和相关并发症的保护脚注1.本声明的主要目的是回顾在流行性腮腺炎爆发环境中提供额外剂量的 MMR 疫苗的有效性和安全性的证据,包括在之前接种过两剂有效剂量的个体中超说明书接种第三剂 MMR 疫苗 (MMR3)。进行了文献和环境证据综述,以制定在流行性腮腺炎爆发环境中使用额外剂量 MMR 疫苗的建议。在制定本指南时,NACI 审查了与以下方面相关的证据:
- 考虑到额外 MMR 疫苗剂量的数量和时间的规划建议,目标如下:
- 主要:通过限制病例数量来控制加拿大流行性腮腺炎疫情的规模;和
- 次要:预防流行性腮腺炎的并发症(例如,睾丸炎、卵巢炎、脑膜炎、脑炎、听力损失)。
- 考虑到疫情环境中额外剂量的数量和时间的个别建议,以保护规划建议未涵盖的个人。
本声明中提供的疫苗建议和其他信息旨在补充并在适用时更新2010 年发布的加拿大流行性腮腺炎疫情预防和控制指南,该指南提供了有关免疫接种后流行性腮腺炎疫情管理原则的更详细和全面的信息。
I.2 加拿大流行性腮腺炎免疫计划的背景和建议
最近更新的流行性腮腺炎国家减病目标是将每年病例维持在 100 例以下脚注2,基于 5 年滚动平均值。然而,鉴于在接种两剂 MMR 疫苗后观察到的流行性腮腺炎免疫力减弱脚注3,脚注4,脚注5,脚注6,脚注7,脚注8,人们承认,目前通过常规时间表可能难以实现这一目标。
MMR 疫苗免疫已被证明可有效预防流行性腮腺炎、病毒传播和疾病并发症脚注9.对于儿童的常规免疫接种,自 1996 年以来,NACI 建议在儿童一岁生日后接种 2 剂含流行性腮腺炎的疫苗。第一剂含流行性腮腺炎疫苗 [MMR 或麻疹、腮腺炎、风疹和水痘 (MMRV) 疫苗] 应在 12 至 15 个月大时提供,第二剂应在 18 月龄时或之后的任何时间提供,但不迟于入学。
目前的国家免疫目标是在 7 岁之前接种两剂含流行性腮腺炎疫苗,实现 95% 的疫苗接种覆盖率脚注2.
对成人的建议剂量从 0 到 2 剂不等,具体取决于个人的年龄和暴露风险。建议流行性腮腺炎暴露风险最大的人群(前往加拿大境外目的地的旅行者、1970 年后出生的高等教育学生以及所有医护人员和军事人员)接种两剂含麻疹疫苗(也包括流行性腮腺炎)脚注10.在疫情暴发情况下,NACI 建议为 1970 年或之后出生但尚未接种两剂 MMR 疫苗的成年人提供额外剂量的含流行性腮腺炎疫苗脚注11.通常认为 1970 年之前出生的成年人已获得对流行性腮腺炎的自然免疫力;然而,其中一些人可能易感脚注12.
虽然在高度接种疫苗的人群中爆发流行性腮腺炎的确切原因尚不清楚,但已经提出了几个因素可能是突破性感染的促成因素脚注3,脚注4,脚注7,脚注13,脚注14,脚注15,脚注16,脚注17,脚注18,脚注19:
- 接种疫苗后免疫力减弱脚注3,脚注5,脚注6,脚注7,脚注8,脚注20;研究表明,麻疹、腮腺炎和风疹的体液免疫力存在差异,即使它们在 MMR 疫苗中联合使用。与麻疹和风疹相比,流行性腮腺炎抗体水平一直显示较低脚注21;
- 由于流行病毒株和疫苗病毒株之间的抗原差异,疫苗有效性降低脚注3,脚注22,脚注23,脚注24;
- 在密切接触环境中高强度地接触病毒,再加上增加传播风险的行为脚注3,脚注22,脚注23,脚注24,脚注25,脚注26;
II. 方法
II.1 疾病负担
简而言之,准备 NACI 咨询委员会声明的主要阶段是:
- 知识综合;
- 综合益处和危害的证据主体,同时考虑证据的质量和观察到的效果大小;和
- 将证据转化为建议。
有关 NACI 制定声明的循证流程的详细信息,请参阅基于证据的免疫建议 – 国家免疫咨询委员会的方法。
NACI 审查了 NACI MMRV 工作组 (MMRV WG) 提出的文献综述的关键问题,包括疾病负担和目标人群等考虑因素;疫苗的安全性和有效性;疫苗接种时间表;以及整体免疫战略的其他方面。NACI 还审查了全国流行性腮腺炎监测数据,省级和地区卫生部门通过加拿大法定报告疾病监测系统 (CNDSS) 定期向加拿大公共卫生局 (PHAC) 报告脚注27.为了补充这些数据,对各省和地区进行了调查,以获取 2016 年 1 月至 2018 年 8 月期间发生的流行性腮腺炎疫情的信息。
文献综述和知识综合由 PHAC 工作人员进行,并由 NACI MMRV WG 监督。在对个别研究进行严格评估后,提出了疫苗使用的建议。证据和拟议的建议已于 2019 年 9 月 25 日和 2020 年 2 月 6 日提交给 NACI 进行审议。NACI 于 2020 年 11 月 18 日批准了这些建议,此前对评估在疫情暴发环境中使用含流行性腮腺炎疫苗的风险-获益的证据进行了全面审查。文中描述了相关考虑因素、具体决策的理由和知识差距。
II.2 NACI 文献综述(有效性和安全性)
本声明中涉及的政策问题是:
在疫情暴发的情况下,是否应该提供额外的含流行性腮腺炎疫苗剂量?如果是这样,谁应该接收它?
2019 年 1 月 2 日进行的文献检索和数据提取使用了以下人群、干预、对照和结局 (PICO 1):
- 人口:
- 因疫情暴发而面临流行性腮腺炎感染风险的所有年龄段的人接受 MMR 疫苗的暴发剂量
- 干预:
- 在流行性腮腺炎暴发期间提供 MMR 疫苗
- 对照:
- 因疫情暴发而面临流行性腮腺炎感染风险且有 MMR 疫苗接种记录但在疫情期间未接种 MMR 疫苗的所有年龄段的人
- 因疫情暴发而面临流行性腮腺炎感染风险且有记录的 MMR 疫苗接种状态但未接受疫情爆发剂量的人
- 成果:
- MMR3 的有效性和安全性
2019 年 7 月 16 日进行的补充文献检索和数据提取使用了以下 PICO 2:
- 人口:
- 在接触流行性腮腺炎后 7 天内接种一剂 MMR 疫苗的人,所有年龄段的人
- 干预:
- MMR 疫苗暴露后剂量
- 对照:
- 未接受暴露后剂量 MMR 的人,所有年龄段的人
- 成果:
- 暴露后剂量 MMR 的有效性
使用在加拿大卫生部图书馆专家的协助下开发的检索词和策略检索 MEDLINE 和 EMBASE 电子数据库。美国疾病控制和预防中心 (CDC) 支持 ACIP 进行的系统评价结果,评估了在疫情暴发环境中使用第三剂含流行性腮腺炎疫苗 (MMR3) 的情况,该评价还被用作 NACI 系统评价的基础。NACI 修改了 CDC 文献综述策略,以整合对 MMR 疫苗“爆发剂量”的额外研究,MMR 疫苗定义为在疫情爆发环境中提供的额外剂量(定义为追赶剂量,可能包括第三剂)。为了与 NACI MMRV 工作组 PICO 1 完全一致,两位评价员检索了 2000 年 1 月至 2019 年 1 月 2 日期间发表的研究,并按标题、摘要和全文筛选了可能的合格性。同一评价员还为 NACI MMRV 工作组 PICO 2 进行了额外的数据筛选提取,这是工作组的要求,以确定含流行性腮腺炎的疫苗在暴露后使用时的有效性。PICO 2 纳入了 1946 年至 2019 年 7 月 16 日期间发表的研究。由一名评价员对纳入文章的参考文献列表进行手工检索,以确定其他相关出版物。一位评价员使用试验性数据提取模板将纳入以供评价的研究数据提取到证据表中,该模板旨在捕获有关研究设计、人群和感兴趣结局的信息。第二位评价员独立验证了提取的数据,任何分歧或差异都通过讨论和共识解决。两位评价员使用 Harris 等人(2001 年)的设计特定标准独立评估纳入研究的证据水平(即研究设计)和方法学质量脚注28被 NACI 用于评估单个研究的内部效度(表 1、表 2)。
III. 流行病学
III.1 疾病特征和疾病负担
流行性腮腺炎病毒是流行性腮腺炎感染的病原体,是一种包膜 RNA 病毒,属于 Paramyxoviridae 科的Rubulavirus属脚注29.感染通过不到 2 米的短距离内大飞沫传播或通过直接接触受感染的呼吸道飞沫或唾液传播,症状在 12 至 25 天的潜伏期后出现(平均 16 至 18 天)。通常,流行性腮腺炎是一种相对轻微的疾病,腮腺炎是最常见的临床表现。然而,亚临床和无症状感染很常见脚注29,脚注30,脚注31,脚注32.在极少数情况行性腮腺炎感染可能具有永久性后遗症:脑膜脑炎可导致瘫痪、癫痫发作、颅神经麻痹、脑积水和耳聋,而睾丸炎和卵巢炎可导致不育脚注33,脚注34,脚注35.妊娠早期的感染与先天性异常无关脚注36,但可能会增加自然流产率。部分或完全免疫的个体可能会降低并发症的风险和严重程度,例如睾丸炎、卵巢炎、脑膜炎、脑炎、听力损失和胰腺炎脚注9,脚注10,脚注37,脚注38,脚注39,脚注40,脚注41,脚注42,脚注43.已知并发症在青春期后的青年和成人中比儿童更常见脚注44.
虽然在症状出现前 7 天至症状出现后 9 天已从流行性腮腺炎感染者的唾液中分离出流行性腮腺炎病毒,但流行性腮腺炎感染者在症状出现前 2 天至症状出现后 5 天内被认为最具传染性。无症状的感染者仍可将流行性腮腺炎传播给他人脚注45.
在接种疫苗前,流行性腮腺炎是一种地方病,主要影响 5 至 9 岁的儿童。继 1969 年加拿大批准流行性腮腺炎疫苗,随后在 1996/97 年引入常规两剂 MMR 疫苗接种 (MMR2) 计划后,全国报告的流行性腮腺炎病例数量减少了 99% 以上脚注45.然而,流行性腮腺炎在加拿大仍然是一种周期性疾病,每隔几年就会爆发一次,其他方面发病率很低脚注44.1970 年至 1990 年之间出生的个体群体代表了易受流行性腮腺炎感染的群体,因为这些个体不太可能接种两剂含流行性腮腺炎的疫苗或在野生病毒广泛传播时存活。
在后疫苗时代,流行性腮腺炎感染的并发症很少被报道。对加拿大卫生信息研究所 (CIHI) 2014-2018 日历年的加拿大住院数据(不包括魁北克)进行了分析。初步诊断为流行性腮腺炎 (ICD-10-CA 代码 B26,包括 B26.0、B26.1、B26.2、B26.3、B26.8 和 B26.9) 的住院人数较低,5 年内住院人数< 260 人。几乎一半 (42%) 的流行性腮腺炎相关住院患者是 1970 年之前出生的个体。在 5 年期间,因严重流行性腮腺炎并发症(脑膜炎和胰腺炎)住院的流行性腮腺炎住院人数极低,分别为 2 例和 1 例,该队列的所有 3 例住院病例均在 1990 年之后出生。仅确定了 7 例因流行性腮腺炎相关睾丸炎住院,其中 6/7 的住院病例来自 1990 年之后出生的队列。没有关于疫苗接种状态或以前对野生流行性腮腺炎病毒感染的免疫力的信息。尽管这些数据支持文献,即严重的流行性腮腺炎并发症很少见,但在解释这些数据时需要谨慎,因为这种提取未经验证;数据不是全国性的;并且仅提取了主要代码为 MUMPS 的住院病例。未评估合并症和结局。流行性腮腺炎的年龄特异性住院数据并不能反映监测数据和疫情数据,应进一步探讨这种差异,以更好地理解数据。
III.2 流行性腮腺炎疫苗接种覆盖率
国家疫苗接种覆盖率目标的目标是 95% 的儿童在 2 岁之前接种了一剂含麻疹、腮腺炎和风疹的疫苗,并在 7 岁之前接种了推荐的两剂含流行性腮腺炎疫苗的疫苗接种覆盖率达到 95%脚注2.
加拿大各省和地区的两剂含流行性腮腺炎疫苗的免疫覆盖率各不相同,目前没有全面的区域覆盖率数据。有关加拿大流行性腮腺炎和其他儿童疫苗的全国免疫覆盖率信息是通过儿童全国免疫覆盖率调查 (CNICS) 收集的。根据 2017 年 CNICS 的数据,90% 的加拿大儿童在 2 岁时接种了一剂 MMR 疫苗,86% 的儿童在 7 岁时接种了两剂。
在大多数情况下,在加拿大,1970 年之前出生的成年人被认为已经获得了对流行性腮腺炎的自然免疫力。需要注意的是,人群层面的流行性腮腺炎免疫力并不是同质的,部分原因是随着时间的推移,司法管辖区的疫苗接种策略存在差异:
- (1) 1970 年至 1983 年期间,各省和地区实施了常规的一剂流行性腮腺炎疫苗接种,第二剂计划在 1996 年至 2001 年期间实施。总体而言,1970 年至 1996 年之间出生的人可能只接种了一剂或没有接种过含有疫苗的流行性腮腺炎,而且这个年龄组可能更广泛,具体取决于省份或地区脚注11.例外情况是被确定为高危人群的成年人,他们可能终生接种了两剂含疫苗的流行性腮腺炎。
- (2) 如果 1970 年或之后出生的人被认为患流行性腮腺炎或麻疹的风险较高,那么接种疫苗一直是提高流行性腮腺炎免疫力的常见策略,因此这将包括旅行者、医护人员、军人和中学后教育环境中的学生。
此外,移民和其他加拿大新移民可能是一个易感/免疫不足的群体,因为鉴于 MMR 疫苗接种并不普遍,他们可能只接种了一剂或没有接种过一剂含流行性腮腺炎的疫苗脚注46.
III.3 2014 年至 2018 年加拿大流行性腮腺炎流行病学描述
自 1986 年以来,流行性腮腺炎一直是全国可报告的疾病脚注47,脚注48目前在加拿大流行,每两到五年发生一次周期性爆发脚注49.详细信息 关于病例定义和病例分类,请参阅加拿大传染病报告 (CCDR) 中有关流行性腮腺炎的部分。简而言之,当前国家对 确诊的流行性腮腺炎病例需要临床疾病和实验室确认感染,而近期没有接种过含流行性腮腺炎的疫苗;或与流行性腮腺炎相符的临床 与实验室确诊病例有流行病学关联的人的疾病。可能病例定义为在没有适当实验室检查或 与实验室确诊病例无流行病学关联。
全国流行性腮腺炎监测数据存在许多局限性,包括及时性,以及有关疫苗接种状态、疾病严重程度、长期病例信息的有限性 后遗症和并发症。加拿大的疫情数据不是通过全国监测定期收集的。此外,缺乏国家免疫登记处或免疫接种 所有省份和地区的登记都阻碍了确定个人或人群的疫苗接种状况的能力。
随着现行流行性腮腺炎疫苗接种计划的实施,流行性腮腺炎的发病率从接种疫苗前时代(即 1969 年之前)的每 100,000 人 251.2 例下降到 2014 年至 2018 年,每 100,000 人中有 1.9 例(图 1)脚注49.
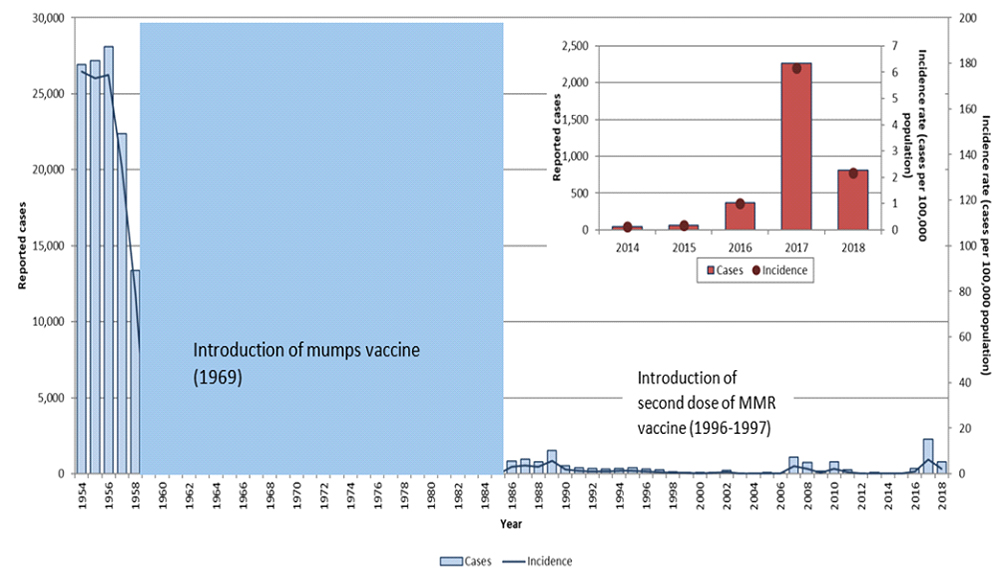
图 1:已报告的流行性腮腺炎病例的数量和发病率(每 100,000 人)脚注a在加拿大,按年份划分,1950 年至 2018 年,引入含流行性腮腺炎疫苗之前和之后。- 文本描述
图 1 显示了加拿大每年报告的流行性腮腺炎病例的数量和发病率(每 100,000 人),基于省和地区卫生部门通过加拿大法定报告疾病监测系统 (CNDSS) 向 PHAC 报告的流行性腮腺炎。主条形图将腮腺炎报告病例显示为蓝条(主要纵轴),每 100,000 人病例数(次要纵轴)相对于年份(横轴)的发病率(次要纵轴)从 1950 年到 2018 年,绘制为蓝线。从 1959 年到 1985 年延伸的蓝色矩形表示流行性腮腺炎从国家法定报告疾病清单中删除且无法获得国家监测数据的时期。
第二张图是位于右上角的红色条形图,将报告的流行性腮腺炎病例显示为浅红色条(主要纵轴),将每 100,000 名人口的发病率(次要纵轴)与 2014 年至 2018 年(横轴)的关系显示为深红色点。条形表示报告的病例数,点表示发病率。
| 年 | 报告病例 | 发病率 (每 100,000 人中的病例数) |
|---|---|---|
| 1954 | 26,908 | 176.0 |
| 1955 | 27,193 | 173.2 |
| 1956 | 28,112 | 195.2 |
| 1957 | 22,386 | 166.1 |
| 1958 | 13,360 | 96.3 |
| 1959 | – | – |
| 1960 | – | – |
| 1961 | – | – |
| 1962 | – | – |
| 1963 | – | – |
| 1964 | – | – |
| 1965 | – | – |
| 1966 | – | – |
| 1967 | – | – |
| 1968 | – | – |
| 1969脚注b | – | – |
| 1970 | – | – |
| 1971 | – | – |
| 1972 | – | – |
| 1973 | – | – |
| 1974 | – | – |
| 1975 | – | – |
| 1976 | – | – |
| 1977 | – | – |
| 1978 | – | – |
| 1979 | – | – |
| 1980 | – | – |
| 1981 | – | – |
| 1982 | – | – |
| 1983 | – | – |
| 1984 | – | – |
| 1985 | – | – |
| 1986 | 836 | 3.2 |
| 1987 | 949 | 3.6 |
| 1988 | 792 | 3.0 |
| 1989 | 1,550 | 5.7 |
| 1990 | 535 | 1.9 |
| 1991 | 390 | 1.4 |
| 1992 | 330 | 1.2 |
| 1993 | 325 | 1.1 |
| 1994 | 356 | 1.2 |
| 1995 | 397 | 1.4 |
| 1996脚注c | 290 | 1.0 |
| 1997脚注c | 254 | 0.8 |
| 1998 | 114 | 0.4 |
| 1999 | 92 | 0.3 |
| 2000 | 81 | 0.3 |
| 2001 | 102 | 0.3 |
| 2002 | 200 | 0.6 |
| 2003 | 28 | 0.1 |
| 2004 | 33 | 0.1 |
| 2005 | 79 | 0.2 |
| 2006 | 42 | 0.1 |
| 2007 | 1,110 | 3.4 |
| 2008 | 748 | 2.2 |
| 2009 | 187 | 0.6 |
| 2010 | 768 | 2.3 |
| 2011 | 273 | 0.8 |
| 2012 | 48 | 0.1 |
| 2013 | 94 | 0.3 |
| 2014 | 40 | 0.1 |
| 2015 | 59 | 0.2 |
| 2016 | 365 | 1.0 |
| 2017 | 2,263 | 6.2 |
| 2018 | 808 | 2.2 |
从 2014 年到 2018 年,全国共报告了 3,535 例流行性腮腺炎病例。然而,64% 的病例发生在 2017 年,可能是从 2016 年底开始并持续到 2017 年的各种疫情的结果。这导致五年中位数为每年 73 例(范围:40-2,263 例)。这一时期的总发病率为每 100,000 人 1.9 例,范围为每 100,000 人 0.1 至 6.2 例(图 1)。20 至 39 岁的成年人占所有流行性腮腺炎病例的 53%,其中 20 至 24 岁年龄组的发病率最高(每 100,000 人 3.8 例)。
2017 年,加拿大共报告了 2,263 例病例,相应的发病率为每 100,000 人 6.2 例。尽管在所有年龄组中都观察到病例,但青少年和年轻人群 (15 至 29 岁) 的发病率最高。53% 的病例为男性,90% 的病例发生在曼尼托巴省、安大略省和不列颠哥伦比亚省。
III.4 加拿大的疫情
1996 年至 2010 年间的暴发已在先前发布的流行性腮腺炎暴发指南中描述脚注11.自 2016 年以来,流行性腮腺炎疫情的数量和规模大幅增加。2017 年和 2018 年,对各省和地区进行了调查,以收集有关 2016 年 1 月至 2017 年 2 月和 2017 年 1 月至 2018 年 8 月期间发生的近期流行性腮腺炎疫情的增强省级和地区数据脚注50.该调查的目的是提供流行性腮腺炎活动的概述,包括加拿大各地的公共卫生行动。这项调查是为了在各省和地区之间以及内部进行信息共享而进行的。当时,各省和地区被要求仅报告与疫情相关的病例。没有使用爆发的标准定义。尚未收集有关流行性腮腺炎住院和并发症的信息,也无法获得。
2017 年和 2018 年流行性腮腺炎疫情综合调查结果
使用 2016 年 1 月至 2018 年 8 月各省和地区调查的综合数据,共报告了 881 例病例,不包括曼尼托巴省疫情(见下文),相当于 24 次疫情脚注50)。中位暴发规模为 12.5 例,从 2 到 166 例不等。总体而言,平均爆发持续时间为 16.5 周,从 1 周到 59 周不等。从 2016 年 2 月到 2018 年 7 月,至少在一个辖区报告了流行性腮腺炎疫情活动。大多数疫情发生在 2017 年第一季度,其中 9 起疫情始于 4 个省份,另外 2 起疫情发生在另外两个辖区。
在有年龄信息的病例中 (n=814),80.6% 的疫情相关病例年龄在 15-39 岁之间,其中 25% 的病例发生在 20 至 24 岁的年龄组中(n=217 例)(图 2)。
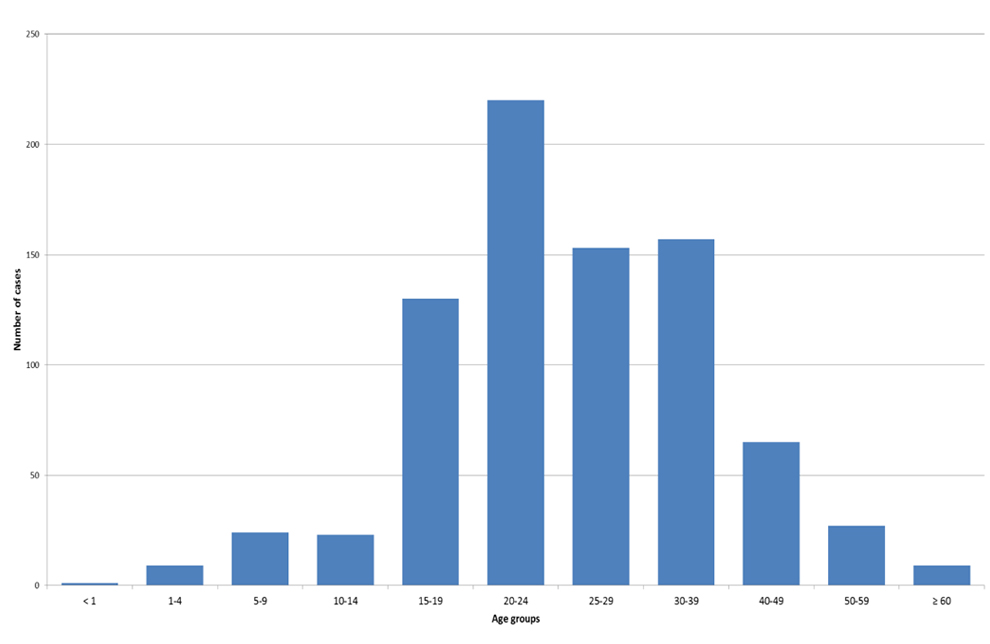 注意:不包括萨斯喀彻温省两次疫情 (n=63) 的病例,这些病例未提供具体年龄信息。
注意:不包括萨斯喀彻温省两次疫情 (n=63) 的病例,这些病例未提供具体年龄信息。资料来源:疫苗可预防疾病、监测和流行病学司 (SED)、免疫和呼吸道传染病中心 (CIRID)、加拿大公共卫生署
图 2:2016 年 1 月至 2018 年 8 月加拿大按年龄组划分的流行性腮腺炎疫情病例数 (n=814)
图 2 显示了 2016 年 1 月至 2018 年 8 月加拿大报告的流行性腮腺炎病例数(纵轴)与年龄组(横轴)的关系 (n=814)。未包括萨斯喀彻温省两次疫情 (n=63) 的病例,这些病例未提供具体年龄信息。
| 年龄组(岁) | 病例数 |
|---|---|
| < 1 | 1 |
| 1-4 | 9 |
| 5-9 | 24 |
| 10-14 | 23 |
| 15-19 | 129 |
| 20-24 | 217 |
| 25-29 | 153 |
| 30-39 | 157 |
| 40-49 | 65 |
| 50-59 | 27 |
| ≥ 60 | 9 |
资料来源:疫苗可预防疾病、监测和流行病学司 (SED)、免疫和呼吸道传染病中心 (CIRID)、加拿大公共卫生署
最常报告的暴露环境包括社区环境 (30.8%)、社交聚会 (26.9%)、高等教育机构 (19.2%) 和运动队 (19.2%)。报告的其他暴露环境 (26.9%) 包括工作场所位置、近距离工作或生活、家庭和高等教育环境。总体而言,9 起疫情 (37.5%) 与旅行有关。
在有性别信息的病例中 (n=816),大多数病例为男性 (59%),这与国家法定报告疾病监测系统中的性别分布一致。这可能是由于诊断偏倚,因为睾丸炎可能比卵巢炎更常被诊断出来。这也可能是由于女性的免疫接种差异,因为她们更频繁地接受风疹筛查,如果易感,则接种含流行性腮腺炎的疫苗。
在已知免疫接种状态的疫情相关病例 (n=628) 中,大约一半的病例接种了两剂含疫苗的流行性腮腺炎疫苗 (49%),30% 接种了 1 剂,20% 未接种疫苗。其余 (1%) 已接种 3 剂。
尽管增强的省级和地区监测数据为加拿大近期流行性腮腺炎疫情活动的规模和背景提供了有价值的见解,但在解释这些数据时应仔细考虑一些局限性和其他相关因素。首先,没有标准的全国性疫情病例定义,将病例归类为疫情相关由每个司法管辖区自行决定。此外,多年来,加拿大流行性腮腺炎的预期发病率发生了显著变化,这为建立共同的省级和地区疫情定义带来了挑战。此外,将病例与独特的流行性腮腺炎疫情联系起来的挑战很困难,尤其是当在社区中观察到的病例数高于预期时。在最初的 2017 年省级和地区数据请求时,正在进行的 2016 年流行性腮腺炎疫情没有具体的结束日期。因此,这些疫情可能会持续到 2017 年,导致报告重复病例数。此外,由于仅提供了汇总数据,因此无法对调查结果进行更详细和深入的分析,包括确定最后一次 MMR 剂量与疾病发作之间的间隔、病例的地理分布和流行性腮腺炎相关并发症的发生。
2016-2018 年曼尼托巴省流行性腮腺炎疫情
曼尼托巴省报告了从 2016 年 9 月开始的重大流行性腮腺炎疫情。省级公共卫生官员进行了一项生存分析,以评估 2016 年 9 月至 2018 年 9 月疫苗诱导的免疫力对流行性腮腺炎感染的保护作用 (51)。在研究期间,北方居民的疫苗诱导免疫力随着时间的推移而减弱,并评估了接种 1 剂和 2 剂疫苗对减弱的影响。截至全省疫情爆发结束时,共计 2,223 例,其中 51.7% 为男性。总累积发病率为每 1,000 人 1.6 例。中位年龄为 25 岁,发病率最高的是 18 至 29 岁年龄组(每 1,000 人中有 3.4 例)。尽管 70.4% (n=1,566) 的病例来自北部地区,这是曼尼托巴省最偏远的地区,拥有大量孤立的社区,但疫情起源于温尼伯地区卫生局。疫情从受影响的城市中心蔓延到全省的农村地区。在省级登记处有记录的确诊病例中,含疫苗的两剂覆盖率约为 70%。在接种了至少两剂记录在案的含流行性腮腺炎疫苗的病例中,个体接受最近一剂疫苗的中位时间已经过去了 11 年,这表明疫苗诱导的对流行性腮腺炎的免疫力减弱。对北部地区病例的分析表明,疫苗剂量(一剂或两剂)对免疫力的减弱没有显着影响。此外,尽管疫苗诱导的免疫力在接受最后一剂后几年内提供了对流行性腮腺炎感染的保护,但免疫力在几年后迅速减弱,并且与接受一剂与两剂 MMR/MMRV 无关。
2017-2018 年安大略省北部流行性腮腺炎疫情:
2017 年 12 月至 2018 年 6 月期间,安大略省北部和偏远地区的两个原住民社区爆发了流行性腮腺炎疫情脚注52.疫情共导致 70 例病例(52 例确诊,18 例可能),粗略发病率为每 1000 人 22.3 例。许多年龄组的发病率很高,包括婴儿和成人。在 1 至 < 7 岁的儿童中观察到最低的发病率 (8.5/1000)。病例的中位年龄为 24 岁 (范围为 10 个月至 62 岁)。7% 的病例 (5/70) 报告了并发症,包括睾丸炎、卵巢炎和神经系统症状。有 1 例住院,无死亡。在疫情暴发之初,所有社区成员中含流行性腮腺炎疫苗的免疫覆盖率为两剂 46%,一剂为 35%。
作为公共卫生应对措施的一个组成部分,建议 8 至 48 岁(出生于 1970-2010 年)、过去 28 天内未接种 MMR 疫苗(根据患者自我报告)且无医学禁忌症的个体接种含流行性腮腺炎疫苗的暴发剂量,此外还对免疫接种不足的社区成员进行机会性免疫接种。在疫情暴发开始时≥ 1 岁的所有社区成员中,33% 的人在疫情暴发期间至少接种了一剂含流行性腮腺炎的疫苗。在疫情爆发开始时,8-48 岁的人群中有 38% 接种了疫情剂量,这取决于疫情前疫苗的接种剂量(之前没有接种过一剂的人群为 54%,疫情前接种过一剂的人群为 48%,疫情前接种过两剂的人群为 31%,疫情前接种过两剂以上的人群为 25%)。
对疫情爆发剂量干预的评估侧重于在疫情暴发开始时符合接种含流行性腮腺炎疫苗的年龄(至少一岁)的社区成员,并将疫情爆发剂量定义为在疫情暴发期间接受任何剂量的含流行性腮腺炎疫苗。在调整了年龄组、性别和自上次疫情前疫苗接种以来的时间后,在疫情期间未接种含流行性腮腺炎疫苗的人中,调整后的流行性腮腺炎感染风险比为 2.7(95% 置信区间 1.0-10.1)。数据还表明,自上次疫情前剂量以来的时间与流行性腮腺炎感染风险之间存在剂量反应关系,尽管置信区间很宽且不显著。
III.5 加拿大疫情的分子流行病学
根据国家微生物实验室 (NML) 的流行性腮腺炎分子监测,自 2006 年以来加拿大各地的所有重大疫情都属于基因型 G,并且几乎所有疫情都与 MuVi/Sheffield。GBR/1.05 WHO 参考序列相同或高度相似。这种菌株可能不仅在加拿大流行,而且在北美和欧洲的其他地方也流行。流行性腮腺炎基因分型涉及对流行性腮腺炎基因组的一小部分进行测序,即长度仅为 316 个核苷酸的小疏水 (SH) 基因。由于 SH 基因分型无法区分过去十年中加拿大的疫情,因此对全基因组(约 15,430 个核苷酸)进行测序可能信息量更大脚注53,脚注54.
III.6 近期国际疫情总结
在过去十年中,在疫苗接种率高的国家/地区,流行性腮腺炎疫情的报告有所增加。然而,由于病例定义、常规免疫接种计划以及流行病学数据收集和报告的不同,司法管辖区之间的直接比较受到限制。下表总结了过去十年中报告的疫情样本。
| 国家 | 爆发的规模 | 受影响的人群 | 年龄组 | 爆发时长 | 时间框架 |
| 美国脚注25 | 每次疫情的病例数从 20 到 485 例不等 | 主要是密切接触环境中 的大学生和年轻人 据报道,近一半的疫情 (39%) 发生在高度接种疫苗的人群中(2 剂覆盖率 ≥85%)。 | 18-24 岁 | 共 23 次暴发,1.5 至 8.5 个月(中位数 = 3 个月) | 2010 年 7 月至 2015 年 12 月 |
| 欧洲(欧洲疾病预防和控制中心)脚注8 | 28 个欧盟/欧洲经济区成员国报告了 14,795 例病例 | 男性比女性更受影响(占所有病例的 57%) | 15-19 岁人群发病率最高(每 100,000 人中有 13.2 例) 其次是: 10-14 岁(每 100,000 人中有 12.4 例)。 | 2016 | |
| 以色列脚注55 | 5239 箱 | 大多数病例在其年龄 (78%) 完全接种疫苗(两剂计划,1 岁和 6 岁)。 | 5-14 岁儿童报告的病例比例最大(48% 的病例 | 12 个月 | 2009-2010 |
报告的疫情主要影响到彼此密切接触的青少年和年轻人脚注56,脚注57.与接种疫苗前时代(幼儿受影响最大)相比,青少年和年轻人的感染比例更高,这被解释为该年龄组儿童疫苗接种不足和/或免疫力减弱的可能结果。密切接触环境也被假设为导致学生流行性腮腺炎高发的一个因素,特别是在免疫覆盖率相对较低的个体聚集的环境中。
IV. 疫苗
IV.1 授权在加拿大使用的制剂(例如,描述、成分)
加拿大目前没有含单组分流行性腮腺炎的疫苗。在加拿大,所有获准用于预防流行性腮腺炎(MMR 和 MMRV)的疫苗均含有属于基因型 A 的 Jeryl Lynn 减毒流行性腮腺炎病毒株:
- M-M-RII 型®(麻疹、腮腺炎和风疹联合减毒活疫苗),Merck Canada Inc。 (MMR)
- PRIORIX®(麻疹、腮腺炎和风疹联合减毒活疫苗),葛兰素史克公司 (MMR)
- PRIORIX-TETRA®(麻疹、腮腺炎、风疹和水痘联合减毒活疫苗),葛兰素史克公司 (MMRV)
- 专业四轮驱动®(麻疹、腮腺炎、风疹和水痘联合减毒活疫苗),Merck Canada Inc。 (MMRV)
有关可在加拿大使用的流行性腮腺炎疫苗的更多信息,请参阅加拿大免疫指南,第 4 部分,流行性腮腺炎疫苗
所有这些产品都已获得授权,从儿童一岁生日后开始实施常规的两剂接种计划。如果在 12 个月大之前提供早期剂量的 MMR 疫苗(例如,用于旅行),则产品专论和 NACI 建议额外接种两剂脚注10.此外,默克公司的 M-M-RII 疫苗的产品专论指出,“如果还担心流行性腮腺炎或风疹的免疫状态,应考虑重新接种适当的含流行性腮腺炎或风疹的疫苗”®脚注58.任何产品专论均未明确提及在疫情暴发环境中接种第三剂的建议。对于疫情应对,应使用 MMR 疫苗,而不是 MMRV,因为在疫情暴发环境中,研究使用 MMR 或单价流行性腮腺炎疫苗。
IV.2 疫苗有效性
据估计,含有 MMR 疫苗的 Jeryl Lynn 毒株在预防儿童和青少年实验室确诊的流行性腮腺炎病例方面的有效性为 MMR1 为 62% 至 91%,MMR2 为 76% 至 95%脚注10.在疫情暴发环境中观察到疫苗有效性略低脚注19,尤其是在密切接触环境中进行曝光时脚注59因为保护似乎会随着时间的推移而减弱脚注60.
NACI 审查了提供 MMR 疫苗后的疫苗接种结果数据,包括 MMR3 的使用,这些数据在 16 份描述美国、英国、以色列、墨西哥和挪威流行性腮腺炎疫情管理干预措施的出版物中报告(见附录 A)。没有疫苗制造商报告了关于 MMR 疫苗对疫情管理或暴露后预防的有效性的任何其他未发表信息。
两项研究描述了向社区中的特定人群提供 MMR 疫苗的干预措施的结果。在美国一个宗教社区的社区疫情中,大约 65% 的 11-17 岁儿童在学校接受了 MMR3脚注61.社区中大约 98% 的儿童在提供疫苗的学校上学。在疫苗接种活动后的 21 天内,观察到接种疫苗的年龄组的流行性腮腺炎发作率降低超过 95%。在 5-10 岁儿童中,流行性腮腺炎发作率也观察到统计学上显着下降 (72.9%)。与干预前 3 周相比,干预后 3 周社区的发病率下降了 76% (从 0.86% 下降到 0.21%)。在免疫接种后 3 周以上,据报道的 MMR3 疫苗增量有效性估计为 88% (95% CI: -31.9%-98.9%)。在美国关岛领土的类似活动中,在发病率大于 3% 的学校(岛上 7/64 的学校)接种了 MMR0.5 剂脚注62.在免疫接种活动过程中,超过 1,000 名儿童接种了 MMR3(约占岛上 9-14 岁儿童的 5%)。在这个年龄组中,研究作者报告说,在干预后三周多时,接受 MMR3 (RR=0.4 [95%CI: 0.05-3.5]) 的学生之间接受 MMR3 (RR=0.4 [95%CI: 0.05-3.5]) 的发作率无显著差异。
在报告结局的已发表文献中,MMR 疫苗通常是作为更大型机构疫情管理策略的一部分提供的。在一所拥有 710 名学生和教职员工的英国学校中,大约五分之一的学生接种了爆发剂量的 MMR 疫苗(73% 的学生接种了 MMR3)脚注63.疫苗接种运动在发现第一例病例一个月后启动,疫情在免疫接种一个月后结束。在疫苗接种运动完成三周多后,仅确定了两例流行性腮腺炎病例,两人均未接种疫情疫苗。在英国的另一次学校疫情中,向根据唾液抗体检测发现易患流行性腮腺炎的儿童提供了 MMR 疫苗脚注64.在 33 名易感儿童中的 28 名接种完疫苗后,学校没有报告更多病例。
美国疾病预防控制中心的一份出版物还报告了一项干预措施,其中 15% (73/541) 没有 MMR2 疫苗接种记录或医生诊断的流行性腮腺炎的个体在夏令营爆发期间接受了免疫接种脚注65.在接种疫苗后两周多,营员中没有报告更多病例。在墨西哥的另一份出版物中,向没有流行性腮腺炎病史的 4 个医院科室的住院医师提供了 MMR 疫苗。在 50% 至 75% 的免疫接种活动之后脚注66的居民接种了疫苗,尽管社区中的流行性腮腺炎病例数量有所增加,但医院工作人员中没有报告更多病例。在另一篇描述医院环境中控制措施结果的出版物中,向 14 名没有流行性腮腺炎或 MMR 免疫接种史的个体提供了 MMR 疫苗,这些人在接触指示病例后不久就获得了 MMR 疫苗脚注67.这些人在接种疫苗后都没有患上流行性腮腺炎。
两篇出版物还报告了在美国开展的以大学为基础的免疫接种活动的结果。在伊利诺伊大学(University of Illinois)发生的长达一年的疫情期间,脚注68在 50,000 名符合条件的学生和教职员工(即 1957 年或之后出生的学生)中,约有 11,500 人获得了 MMR3.疫苗接种活动在初始病例报告后约 4.5 个月启动,一直持续到疫情结束。在疫情期间发现的 317 例病例中,50 例 (16%) 流行性腮腺炎患者接受了 MMR3,232 例 (73%) 接受了 MMR2,12 例 (4%) 接受了 MMR1,7 例 (2%) 未接种疫苗,16 例 (5%) 疫苗接种状态未知。在 MMR3 接受者中,有 34 人在接受 MMR3 两周或更长时间后出现流行性腮腺炎症状,5 人在疫情爆发前几年接受 MMR3 治疗。在爱荷华大学较短(9 个月)的疫情期间,为大约 23% 的学生提供了 MMR3 疫苗脚注69,脚注70(n≈5,000) 在首次病例报告后的三个月内。在干预后的 5 个月内,观察到的病例数与干预前 5 个月相比减少了 3 倍。研究作者还报告了 MMR3 剂量有效性 (与 MMR2] 的增量为 78% (95% CI: 61-88%)。当分析中仅包括活动启动后发生的病例时,这一估计值略低 (68%;95%CI: 42.2-82.5%)。在疫情期间发现的 259 例病例中,有 21 例在接受 MMR3 两周或更长时间后出现流行性腮腺炎症状。
两份出版物还报道了在狭窄军事环境中使用 MMR 疫苗的情况。作为以色列国防军疫情管理战略的一部分脚注55,脚注71,在发现病例后一周内向受影响单位的所有士兵提供了 MMR 疫苗。在 2005 年疫情期间,疫苗主要提供给以前接种少于 2 剂的个人,而在 2009/10 年疫情期间,所有士兵都接种了疫苗,与他们的疫苗接种状态无关。在 2005 年第一次疫情期间,免疫接种后没有发现病例,在两次疫情中都没有发现单个潜伏期以外的继发病例。在卢森堡军事中心报告了 10 例病例后,也报告了类似的结果脚注72.向受影响单位的所有人员和受训者提供了 MMR 疫苗,之后没有报告更多病例。
检索到的出版物中还描述了向病例接触者提供 MMR 疫苗的干预措施后的结果。在美国脚注17研究,在家庭指示病例腮腺炎发病后 5 天内向 28 例流行性腮腺炎病例的家庭成员提供 MMR3;没有家庭成员感染流行性腮腺炎。在另一项研究中,在接受 MMR1 或 MMR2 的 16 名个体中,一名没有免疫接种史的成年人在指示病例发病后的第一个潜伏期内被诊断出患有流行性腮腺炎脚注17.相比之下,在 77 名有 MMR2 病史且拒绝暴露后剂量的个体中,有 4 人被诊断出患有流行性腮腺炎。在挪威进行的另一项疫情管理干预措施中,为大约 1,300 名病例密切接触者提供了暴露后 MMR3 剂量脚注73.总共只有 3 人在免疫接种后患上流行性腮腺炎。一份出版物描述了一项干预措施,其中对美国海军基地的流行性腮腺炎病例的接触者接种了 MMR 疫苗脚注73.根据感染和实验室病史 (流行性腮腺炎 IgG 抗体滴度 < 20.0 U/mL) 被认为未接种疫苗和疾病的个体在暴露后 5 天内 (81 人中有 8 人) 进行免疫接种。干预后,在任何暴露个体中均未观察到继发性流行性腮腺炎病例。
文献检索还确定了两项较早的研究,这些研究报告了在美国疾病传播显著的环境中接种含有 Jeryl Lynn 菌株的单价流行性腮腺炎疫苗后的免疫后结局。在 1986 年进行的一项研究中,在学校疫情爆发期间,53/178 以前未接种疫苗的 9 至 12 岁学生获得了疫苗脚注74在干预后的 3 周内,接种流行性腮腺炎疫苗的学生 (15/53) 和未接种疫苗的儿童 (51/125) 都报告了病例。在接种疫苗后超过 21 天,接种疫苗的学生中没有报告病例,而未接种疫苗的儿童中有 8 例。第二项研究是一项随机对照研究,其中向 502 名一年级和二年级学生提供单价疫苗,而 54 名学生接受安慰剂。脚注75疫苗接种发生在 1960 年代后期对候选疫苗进行田间测试期间,这是野生型病毒大量传播的时期。在接种疫苗后的前两周,免疫接种学生中有 28 例流行性腮腺炎 (28/502),接受安慰剂的学生中有 4 例 (4/54)。两周后,研究作者报告了接种疫苗的学生中有 8 例流行性腮腺炎(3 例发生在接种疫苗后的第 15-30 天,5 例发生在接种疫苗后 30 多天),安慰剂组有 16 例。
在所有检索到的描述疫情控制措施的出版物中,MMR 疫苗接种被用作全面公共卫生应对措施的一部分,以试图控制疾病的传播。除免疫接种外,几乎所有出版物都报告了使用病例隔离、促进适当的预防性卫生习惯以及使用公共/媒体信息宣传活动作为补充性疫情管理措施。大多数疫情报告了流行性腮腺炎病毒的 G 基因型。
IV.3 疫苗安全性
虽然 7 篇出版物报告了安全性结局脚注61,脚注62,脚注63,脚注68,脚注76,脚注77,只有两项研究描述了 MMR3 给药后不良事件 (AEs) 的详细信息。没有研究报告用 MMR3 免疫后出现严重的 AE。制造商没有报告有任何关于 MMR3 疫苗给药安全性的额外、未发表的信息。
Abedi et。al 和 Ogbuanu 等人报告了 1,750 多名 11-17 岁学生接种疫苗后 MMR3 的安全结果脚注61,脚注77.7.2% (n=115) 的调查受访者在 MMR3 后 14 天内报告了至少 1 例局部或全身性 AE。最常报告的 AE 是注射部位疼痛、发红或肿胀 (3.6%);关节或肌肉疼痛 (1.8%);头晕或头重脚轻 (1.7%);以及发热 38 摄氏度或更高 (1.3%)。在 Nelson 等人的另一篇出版物中,作者报告了大约 1,000 名 9-14 岁儿童接种 MMR3 免疫后的不良事件结果。百分之六 (32/533) 的调查受访者报告了至少 1 个局部或全身性 AE脚注62.最常报告的 AE 是关节疼痛 (2.6%,14/533) 、头晕 (2.4%,13/533) 和注射部位反应 (2.4%)。
还回顾了来自加拿大免疫监测系统后不良事件 (CAEFISS) 和美国 CDC 疫苗不良事件报告系统 (VAERS) 的数据摘要。在 CAEFISS,从可获得 MMR(V) 疫苗剂量数的 15,000 多份报告中,仅在 60 份报告中确定了收到 MMR3 (0.4%)。其中,只有一例 AEFI 被报告为严重病例,涉及一名 5 岁儿童,该儿童在 2012 年接受了免疫接种。报告的 AEFI 是横贯性脊髓炎,从发病开始持续 57 天,免疫接种后 4 天开始。在医院进行的传染病调查得出 2 型副流感检测结果呈阳性,这可能与该事件有关。据报道,这名孩子已经完全康复。在 VAERS 中,在大约 60,000 份有 MMR 疫苗剂量的报告中,约有 1,500 份报告包括 MMR3.其中,65 例 (4.4%) AEFI 报告为严重。
V. 讨论
自 2016 年以来,加拿大报告的流行性腮腺炎疫情和疫情相关流行性腮腺炎病例数量大幅增加。疫苗有效性减弱可能是由于细胞免疫力、抗体浓度和亲和力下降。此外,接种疫苗的个体中的疫情通常发生在接触病毒的风险增加的情况下,行为风险因素可能会促进传播。
从流行病学上讲,流行性腮腺炎暴发可能难以定性,尤其是在社区环境中。关于加拿大最近流行性腮腺炎疫情的省级和地区调查数据显示,当疫苗接种状态数据可用时,大约一半的流行性腮腺炎病例至少接种了 2 剂含流行性腮腺炎的疫苗。近年来,加拿大大多数与疫情相关的流行性腮腺炎病例发生在 15-39 岁的年轻人中。这与加拿大接种疫苗前的时代形成鲜明对比,当时与疫情相关的流行性腮腺炎病例最常发生在儿童中。从地理上看,加拿大北部社区的疫情爆发率较高。虽然流行性腮腺炎感染的并发症并不总是得到很好的描述或报告,但它们在后疫苗时代和接种疫苗的人群中不太常见。
NACI 文献综述确定了 16 篇出版物,其中额外剂量的 MMR 疫苗在疫情爆发环境中被用作控制措施。这些研究描述了三种主要的免疫方法:1) 特定人群(通常是疾病发病率高的年龄组)的疫苗接种;2) 在确定的地理环境中为特定社区(即大学生和教职员工)接种疫苗,以及 3) 为密切接触者接种疫苗(在封闭环境中进行暴露后免疫接种)。这些研究描述了不同的免疫策略(例如,疫苗计划实施时间、人群、环境、额外的疫情控制措施),覆盖范围各不相同。研究质量从一般到低不等。总体而言,证据表明额外的 MMR 剂量似乎可能会减轻疾病负担,但是,由于研究设计的异质性,无法确定疫苗有效性的汇总估计值。
在人群层面,有一些证据表明,额外接种 MMR 剂量可能会影响传播,从而影响疫情的持续时间和规模,尤其是在疫情早期接种并且目标群体实现了高疫苗接种率时。
在个体层面,在疫情暴发环境中接受 MMR 疫苗后,很少在免疫接种后两周以上观察到症状性流行性腮腺炎病的发作,也很少在单个潜伏期之外观察到。向病例密切接触者提供 MMR3 疫苗的少量研究结果表明,在暴露后一周内接种一剂疫苗可能有效预防有症状的疾病和传播。然而,没有指定暴露后剂量的理想时间。几项研究还表明,在疫情爆发期间以及被认为患流行性腮腺炎及其并发症风险较高的个体中,接受额外剂量的 MMR 疫苗的可接受性可能会增加。
文献综述中确定的 7 篇出版物报告了安全性结果。这些研究未发现在疫情暴发环境中接种第三剂 MMR 疫苗后任何相关的严重 AE。这是基于在审查研究中施用 >14,000 MMR3 剂量后的数据。这些发现与先前观察到的后续剂量中 AE 的频率和强度较低一致。没有发现意外的安全信号。大多数全身和局部不良事件,尤其是在先前接种疫苗的个体中,强度轻微且持续时间短(持续 1-3 天)。
需要更有力、更全面和一致的证据来证明在与加拿大观察到的情况类似的情况下使用含流行性腮腺炎的疫苗暴发剂量的有效性。因此,NACI 将继续监测与在流行性腮腺炎爆发环境中提供 MMR 疫苗的有效性和安全性相关的证据,包括用于疫情控制的 MMR3 超说明书给药,并将根据需要更新本声明。
VI. 建议
在审查了有关加拿大流行性腮腺炎病和疫情的疾病负担以及在疫情环境中额外剂量的 MMR 疫苗的有效性和安全性的现有证据后,NACI 为公共卫生层面的决策提出了以下建议。这些建议与国家减少流行性腮腺炎疾病的目标和流行性腮腺炎的疫苗接种目标一致,以将每年病例数维持在 100 例以下脚注2,基于 5 年滚动平均值。
强烈建议适用于大多数人群/个体,除非存在替代方法的明确且令人信服的理由,否则应遵循该建议。在某些情况下,可能会考虑对某些人群/个体进行酌情推荐。其他方法可能是合理的。请参阅 表 3 以了解 NACI 建议强度和证据主体等级的更详细说明。
VI.1 对公共卫生计划层面决策的建议(即省/地区为公共资助的免疫计划做出决策)
在考虑这些建议并出于公共资助免疫规划实施的目的,各省和地区可能会考虑多种因素,例如成本效益评估、流行性腮腺炎的当地流行病学以及其他当地规划和运营因素(例如,当前的免疫规划、资源、疫情控制措施)。
建议 1:NACI 建议在疫情暴发环境中可以考虑接种 MMR 疫苗的暴发剂量。(酌情建议)
- NACI 得出结论,有公平的证据建议在疫情暴发期间使用 MMR 疫苗(包括有或没有 MMR3 的补种疫苗)(B 级证据)
证据摘要和理由
- 爆发剂量的 MMR 疫苗可能有效减少爆发的规模和持续时间。
- 对于在一岁生日后曾接种过 2 剂含流行性腮腺炎疫苗的人,建议接种第三剂,特别是如果最后一剂 MMR 疫苗是在 10 年前或更长时间前接种的。
- 对于免疫状态未知的人,可以提供爆发剂量。如果在 1 岁生日后之前接受过 3 剂,则没有证据支持提供额外的剂量。
- 在考虑疫情免疫接种控制措施时,除剂量数外的其他因素(例如距上次给药的时间)也可能是重要因素。
- 关于何时以及在何种情况下实施疫情/第三剂建议的决策很复杂,需要对流行性腮腺炎疫情应对提供额外的投入。请参阅管理选项表。
- 对疫情剂量的广泛、非歧视性建议可简化计划实施(例如,免疫接种状态可能不容易确定)并增加覆盖率。
- 在流行性腮腺炎暴发期间增加免疫接种与针对其他疫苗可预防疾病暴发采取的公共卫生管理方法一致。
- 根据目前可用的证据,无法确定爆发剂量的疫苗有效性,部分原因是研究设计的差异。
- 在流行性腮腺炎暴发的情况下,应提供 MMR 疫苗(而不是 MMRV,因为它尚未在暴发环境中进行研究)。尽管 MMR 疫苗的产品专论没有明确说明在疫情暴发环境中使用第三剂,但 MMR3 已被用作加拿大以外的许多司法管辖区的疫情控制策略,并得到了一些免疫咨询委员会的正式建议。此外,本综述未发现 MMR3 的疫苗安全性问题。因此,基于善意和非恶意的平衡,NACI 认为这是一种在疫情爆发环境中预防疾病的适当干预措施,尽管目前产品专论的措辞如此。
建议 2:NACI 建议,在疫情暴发的情况下,可以考虑在接触流行性腮腺炎病例后向密切接触者提供最多第三剂的 MMR 疫苗(酌情建议)
- NACI 得出结论,没有足够的证据支持或反对在接触流行性腮腺炎病例后向密切接触者推荐一剂含腮腺炎的疫苗(I 级证据)。
证据摘要和理由
- 建议暴露于流行性腮腺炎病例后的密切接触者接种 MMR 疫苗的证据质量较差。
- 如果在暴露后不久接种 MMR 疫苗,可以预防有症状的疾病。目前尚不清楚在已经暴露时需要提供暴露后剂量以防止感染的时间段。
- 在散发(非暴发)病例的情况下,向密切接触者提供 MMR 疫苗可被视为疾病控制干预措施,和/或作为在暴发环境中为高危人群提供暴发剂量的机会。
- 对密切接触者使用 MMR 疫苗与对其他疫苗可预防疾病接触者使用疫苗一致,无论是作为暴露后预防,还是将接触者随访作为更新免疫接种的机会。
VII. 管理选项
流行性腮腺炎通过分享饮料或接吻直接接触唾液传播,或通过咳嗽或打喷嚏通过大飞沫传播。流行性腮腺炎的潜伏期为 14 至 25 天。一旦个体被感染,流行性腮腺炎可在腮腺炎发作前 2 天至发作后 5 天传播脚注78.流行性腮腺炎病例也可能无症状,但仍然会传染给他人。
流行性腮腺炎疫情的规模、范围和持续时间可能各不相同,鉴于报告的延迟、寻求健康的行为以及流行性腮腺炎病毒的潜伏期相对较长,其进展和高峰很难预测。此外,流行性腮腺炎病毒在高度免疫人群中的传播可能未被发现,由于综合免疫登记的可用性存在差异,在加拿大的许多司法管辖区,确定病例和接触者的免疫状态可能具有挑战性。对流行性腮腺炎的公共卫生应对措施包括管理病例和接触者,以及在接触者随访不可行时确定社交网络以确定高危人群;以及维持/加强对更多病例和疾病结局(例如住院、并发症)的监测。一般来说,流行性腮腺炎的爆发由以下因素控制:
- 定义高危人群和传播环境;
- 通过隔离病例和接触者教育/提高认识来防止进一步传播;
- 免疫接种不足群体的疫苗接种;和
- 良好的风险沟通脚注11.
在疫情暴发的情况下,实施 MMR 免疫策略可被视为疫情管理的一部分。MMR 疫苗被认为是安全的,大多数全身或局部不良事件强度轻微且持续时间有限(持续 1-3 天),尤其是在以前接种疫苗的个体中。在疫情爆发环境中进行免疫接种可增强体液免疫和细胞免疫,从而有助于疫情控制。
实施 NACI 对 MMR 疫苗暴发剂量的建议有多种选择,包括根据自上次给药以来的时间、暴露的地点和强度以及年龄和并发症风险进行免疫接种。了解疫情的性质(人-地点-时间)以及易于获得目标群体内个人的免疫接种史,对于选择和实施疫情剂量策略非常重要,包括免疫策略是否作为免疫接种不足群体的重点实施(即提供第一剂或第二剂), 接种第三剂含流行性腮腺炎疫苗(即在两剂覆盖率高的疫情环境中),或者是否在难以获得个体免疫接种状态以确定特定剂量数 MMR 资格的情况下和/或当高危人群包括一剂和两剂疫苗接种者时,将其作为暴发剂量的交付进行作。
在流行性腮腺炎疫情暴发的早期(病例数迅速增加期间)实施与疫情相关的免疫接种策略很重要,因为早期免疫接种可能是控制疫情的最有效干预措施。虽然在疫情爆发后期(例如,在疫情高峰之后)进行免疫接种可能对个体有益,但其在人群层面的影响尚不确定。为了尽量减少地方层面的后勤挑战,特别是在孤立和难以到达的社区发生的疫情中,建议尽早与省/地区免疫规划联系人协调。
对于可以验证免疫接种史的个体,应考虑根据自上次给药以来的时间进行免疫接种。据观察,疫苗的有效性会随着时间的推移而减弱,这可能是由于细胞免疫力、抗体浓度和亲和力的下降。据观察,在疫情暴发环境中,流行性腮腺炎的风险从最后一次 MMR 疫苗接种后 2 年开始增加,在最后一次 MMR 疫苗接种后 10 多年内显著增加。因此,> 10 年前接种最后一剂 MMR 疫苗的个体感染流行性腮腺炎的风险最大,在疫情暴发情况下应优先接种疫苗,因为这是可行的。
在可以确定暴露风险或暴露史的群体中,靶向免疫接种可以简化计划实施。在加拿大和国际上,大多数疫情暴发是在密切接触环境中观察到的,在这些环境中,流行性腮腺炎病毒的暴露水平(持续时间和强度)增加。这些通常包括家庭、教育机构、体育设施和较小的社区。在特定环境中向个体提供暴发剂量的 MMR 疫苗可能有效降低该环境中的流行性腮腺炎发病率。
当确定免疫接种状态或暴露风险具有挑战性时,对已知历史上发病率和并发症风险最高的年龄组进行免疫接种可能是快速实施计划的另一种选择。特定年龄群体的免疫接种可有效降低特定年龄组的流行性腮腺炎发病率以及社区的整体疾病负担。根据从加拿大法定报告疾病监测系统 (CNDSS) 获得的监测数据,在 2014-2018 年期间,大多数病例发生在 20 至 <40 岁的年龄组中,其中 20-24 岁的成年人发病率最高(每 100,000 人中有 3.8 例)。
决定哪种免疫策略最适合特定疫情将取决于上述注意事项,下表以及 PHAC 流行性腮腺炎疫情控制指南的未来更新将进一步概述这些注意事项脚注11.
| 考虑 | 决策点 | |
| 1. 根据上次给药后的时间进行免疫 |
|
|
| 2. 根据环境和暴露水平进行免疫接种 |
|
|
| 3. 根据年龄和并发症风险进行免疫接种 |
|
|
VIII. 知识差距和研究重点
在仔细审查了现有证据后,NACI 确定了进一步研究的必要性,以解决当前数据缺失或有限的知识差距。NACI 认识到,已经有一些研究正在进行中,可能会解决其中的许多差距,但在审查时这些研究的结果尚未获得。已确定的知识差距包括:
- 检查在不同环境中遏制流行性腮腺炎疫情的不同公共卫生措施的成本,并评估实施额外流行性腮腺炎疫情剂量策略的各种方案的成本效益
- 模拟流行性腮腺炎爆发期间额外剂量的 MMR 疫苗对流行性腮腺炎负担的影响
- 获取有关流行性腮腺炎疫情流行病学和应对的更全面/完整的全国数据
- 使用暴发剂量的含流行性腮腺炎疫苗进行免疫接种在减轻疾病负担方面的绝对有效性
- 更全面地了解免疫力的持续时间和免疫力的减弱,以及免疫力如何受到额外暴发剂量的含流行性腮腺炎疫苗的影响
- 疾病保护的免疫学相关性以及额外暴发剂量的含流行性腮腺炎疫苗对免疫反应的影响
- 爆发剂量的最佳时机
- 与加拿大流行的流行性腮腺炎毒株相比,疫苗株提供的保护
IX. 监控问题
已确定以下与加拿大流行性腮腺炎疫情监测相关的问题:
- 流行性腮腺炎的国家监测数据有许多局限性,包括变量不完整(年龄、性别、发病日期)、及时性以及有关疫苗接种状态、疾病严重程度(包括并发症和长期后遗症)的信息有限。
- 加拿大的疫情数据不是通过全国监测常规收集的。
- 鉴于没有标准的全国性疫情病例定义,将病例归类为疫情相关由每个司法管辖区自行决定。
- 由于无症状感染和非特异性症状,确定病例的感染源通常具有挑战性,因此监测数据中特定环境采集信息的细节有限。
- 确定流行性腮腺炎基因组测序以协助疫情特征和传播模式。
表
| 水平 | 描述 |
|---|---|
| I | 来自随机对照试验的证据。 |
| II-1 | 来自无随机化的对照试验的证据。 |
| II-2 | 来自队列或病例对照分析研究的证据,最好来自多个使用疫苗功效临床结果测量的中心或研究小组。 |
| II-3 | 从有或没有干预的多个时间序列中获得的证据。不受控制的实验中的戏剧性结果(例如 1940 年代引入青霉素治疗的结果)也可以被视为此类证据。 |
| III | 受人尊敬的权威机构的意见,基于临床经验、描述性研究和病例报告,或专家委员会的报告。 |
| 质量评级 | 描述 |
|---|---|
| 好 | 符合所有设计特定标准的研究(包括荟萃分析或系统评价)脚注*井。 |
| 公平 | 一项研究(包括荟萃分析或系统评价)不符合(或不清楚是否满足)至少一项设计特定标准脚注*但没有已知的“致命缺陷”。 |
| 穷 | 至少有一项针对设计的研究(包括荟萃分析或系统评价)脚注*“致命缺陷”,或较轻缺陷的累积,以至于研究结果被认为无法为建议提供信息。 |
脚注
| |
表 3:NACI 建议:建议强度和证据等级
NACI 建议的强度
基于不与证据强度相隔离的因素(例如,公共卫生需求)
强
“应该/不应该提供”
- 已知/预期的优势大于已知/预期的劣势(“应该”),OR 已知/预期的缺点超过已知/预期的好处(“不应”)
- 含义:强烈建议适用于大多数人群/个体,除非存在明确且令人信服的替代方法理由,否则应遵循该建议
酌情
“可以考虑”
- 已知/预期的优势与已知/预期的劣势紧密平衡,或者存在优势和劣势证据的不确定性
- 含义:在某些情况下,可能会考虑对某些人群/个体进行酌情推荐。其他方法可能是合理的。
证据等级
基于对证据体的评估
- A:有充分的证据推荐
- B:公平的证据推荐
- C:证据相互矛盾,但其他因素可能会影响决策
- D:建议反对的公平证据
- E:推荐反对的良好证据
- I:证据不足(质量或数量),但其他因素可能会影响决策
缩写列表
致谢
本声明由以下人员编写:O Baclic 博士、M Salvadori 博士、A Sinilaite 女士、L Zhao 博士、V Dubey 博士,并经 NACI 批准。
NACI 衷心感谢以下人员的贡献:B Ho Mi Fane 女士、S Kelly 女士、D MacDonald 女士、M Roy 先生、M Saboui 女士、S Squires 女士、M Tunis 博士、Lynda Gamble(HC 健康图书馆)、C Tremblay 女士。
NACI 成员:C Quach 博士(主席)、S Deeks 博士(副主席)、N Dayneka 博士、P De Wals 博士、V Dubey 博士、R Harrison 博士、K Hildebrand 博士、J Papenburg 博士、C Rotstein 博士、B Sander 博士、S Smith 女士、S Wilson 博士
联络代表:LM Bucci 博士(加拿大公共卫生协会)、E Castillo 博士(加拿大妇产科医师协会)、A Cohn 博士(美国疾病控制和预防中心)、L Dupuis 女士(加拿大护士协会)、J Emili 博士(加拿大家庭医师学院)、D Fell 博士(加拿大免疫研究和评估协会)、M Lavoie 博士(卫生首席医疗官委员会)、 D Moore 博士(加拿大儿科学会)、M Naus 博士(加拿大免疫委员会)和 A Pham-Huy 博士(加拿大医学微生物学和传染病协会)。
当然代表:D Danoff 博士(HC 营销卫生产品局)、E Henry 女士(免疫和呼吸道传染病中心 [CIRID],PHAC)、M Lacroix 女士(公共卫生伦理咨询小组,PHAC)、J Pennock 女士(CIRID,PHAC)、R Pless 博士(加拿大卫生部生物和放射性药物局)、G Poliquin 博士(国家微生物学实验室,PHAC)、V Beswick-Escanlar 博士(国防和加拿大武装部队), 和 T Wong 博士(加拿大土著服务部原住民和因纽特人健康处)。
NACI MMRV 工作组成员:V Dubey 博士(主席)、J Brophy 博士、S Deeks 博士、G De Serres 博士、J Gallivan 先生、I Gemmill 博士、R Harrison 博士、T Hilderman 博士、M Marin 博士、M Asbury Marlow 博士、M Naus 博士、A Pham Huy 博士、A Severini 博士、N Sicard 博士、S Wilson 博士
附录 A:有效性调查结果摘要
| 研究详情 | 总结 | |||||
|---|---|---|---|---|---|---|
| 出版 | 疫苗(提供剂量),菌株 | 研究设计 | 爆发和研究描述 | 主要发现摘要 | 证据级别 | 质量 |
| Aasheim E、Inns T、Trindall A、Emmett L、Brown K、Williams C 等人。2013 年英国学校环境中的流行性腮腺炎爆发。Hum Vaccin 免疫剂。2014;10(8):2446-9. | MMR1、MMR2、MMR3; Jeryl Lynn 菌株 | 病例系列 |
| 按年龄组划分的发作率:
在学校接种疫苗的 103 名学生中,有 76 人接种了 MMR3. 在免疫接种活动完成后报告的 13 例病例中,只有 1 例发生在接受疫情剂量的学生中;接种疫苗后不到 2 周出现症状。 由于大多数新病例 (n=11/13) 发生在免疫接种活动后 3 周内(在典型的疾病潜伏期),因此研究作者无法就干预的有效性得出结论。 | II-3 | 公平 |
| Albertson JP, Clegg WJ, Reid HD, Arbise BS, Pryde J, Vaid A, Thompson-Brown R, Echols F。 大学腮腺炎疫情和第三剂麻疹-腮腺炎-风疹疫苗的建议-伊利诺伊州,2015-2016 年。MMWR Morb Mortal Wkly 代表 2016 年;65(29):731- 4. | MMR3;Jeryl Lynn 菌株 | 病例系列 |
| 夏季,大学校园的疫苗接种诊所共接种了 8,200 剂疫苗,秋季(2015 年)和春季(2016 年)学期共接种了 3,300 剂疫苗。夏季向住在校外的学生和教职员工提供了额外的剂量(数量未知)。 在疫情暴发期间接受 MMR3 治疗的 45 例病例中,60% (n=27) 在症状发作前 4 周>接受 MMR3 治疗。5 例在疫情暴发前几年接受了 MMR3. | II-3 | 公平 |
| 沃顿商学院 M、科奇 SL、哈奇森 RH、比斯托维什 JM、沙夫纳 W。后疫苗时代的流行性腮腺炎大规模爆发 。J Infect Dis。 1988 年 12 月;158(6):1253-60. | 单价流行性腮腺炎疫苗 | 队列 |
| 对 178 名易感学生(流行性腮腺炎病或流行性腮腺炎疫苗接种阴性史)进行了随访,直到疫情结束。53/178 名学生在疫情期间接种了流行性腮腺炎疫苗。15/53 免疫接种者和 51/125 未免疫接种学生在免疫诊所后 1 至 21 天内出现流行性腮腺炎。大多数 (13/15) 免疫接种学生的流行性腮腺炎病例发生在免疫诊所后 14 天内。在其余 112 名学生中,38 名免疫学生在接种疫苗后 >22 天没有发生后续流行性腮腺炎病例,而 8/74 名未免疫学生感染流行性腮腺炎。基于这些发现,作者得出结论,一剂单价流行性腮腺炎疫苗对控制疫情有影响。 | II-2 | 公平 |
| Ramsay ME, Brown DW, Eastcott HR, Begg NT。 流行性腮腺炎爆发中的唾液抗体检测和疫苗接种。CDR (Lond Engl Rev)。1991 年 8 月 16 日;1(9):R96-8 | MMR 疫苗,未指定 | 队列 |
| 在对易感儿童进行免疫接种后,没有报告新的流行性腮腺炎病例 | II-3 | 公平 |
| Sugg WC、Finger JA、Levine RH、Pagano JS。活病毒流行性腮腺炎疫苗的现场评价。儿科杂志。1968 年 4 月;72(4):461-6 | 单价流行性腮腺炎疫苗;Jeryl Lynn 菌株 | 随机对照试验 |
研究领域测试了目前包含在 MMR 疫苗中的 Jeryl Lynn 菌株的配方。 单价疫苗已接种给 2,965 名小学一年级和二年级的儿童;329 名儿童接受了安慰剂。 | 接种疫苗后 1-14 天的病例:
接种疫苗后 15-30 天的病例:
病例 >接种疫苗后 30 天:
| 我 | 公平 |
| Fischer PR、Brunetti C、Welch V、Christenson JC。医院流行性腮腺炎:疫情及其控制的报告。Am J 感染控制。1996 年 2 月;24(1):13-8. | MMR 疫苗,未指定 | 队列 |
| 所有免疫接种者均未患上流行性腮腺炎 | II-3 | 公平 |
| Pérez-Alba E, García-Ortiz A, Salazar-Montalvo RG, Hernández-Guedea MA, Camacho-Ortiz A。 流行性腮腺炎爆发,在大学教学医院的居民中并发症发生率很高。Am J 感染控制。2019 年 3 月;47(3):337-339. | MMR 疫苗,未指定 | 队列 |
| 尽管社区病例数量有所增加,但医院居民中没有出现更多病例。 | II-3 | 公平 |
| Mossong J, Bonert C, Weicherding P, Opp M, Reichert P, Even J, Schneider F。 2008 年卢森堡军队中爆发的流行性腮腺炎:流行病学和控制措施的评估。欧元监控。2009 年 2 月 19 日;14(7): 19121. | MMR 的爆发剂量 (Priorix) | 队列 |
| 虽然免疫接种后军事中心没有观察到临床病例,但在卢森堡“平民”人群中继续报告临床病例。 | II-3 | 公平 |
| 疾病控制和预防中心 (CDC)。2005 年纽约夏 令营爆发的流行性腮腺炎。MMWR Morb Mortal Wkly Rep。 2006 年 2 月 24 日;55(7):175-7 | MMR1/2 | 队列 |
| 干预后没有进一步的临床病例报告。 | II-3 | 公平 |
| Cardemil CV、Dahl RM、James L、Wannemuehler K、Gary HE、Shah M、Marin M、Riley J、Feikin DR、Patel M、Quinlisk P。 2017 年。第三剂 MMR 疫苗对流行性腮腺炎疫情控制的有效性。N Engl J Med。 2017 年;377(10):947-56. Shah M、Quinlisk P、Weigel A、Riley J、James L、Patterson J、Hickman C、Rota PA、Stewart R、Clemmons N、Kalas N、Cardemil C 等人,2018 年。2015 年 7 月至 2016 年 5 月爱荷华州麻疹-腮腺炎-风疹疫苗接种运动前后在高度接种疫苗的大学附属环境中爆发流行性腮腺炎。Clinl Infect Dis。 2018 年;66(1):81-8. | MMR1、MMR2、MMR3;Jeryl Lynn 菌株 | 队列 |
| 共有 4,783 人接种了 MMR3(94% 在疫苗接种活动期间提供) 根据 MMR 剂量数的发作率:
根据 MMR2 剂量时间的发作率:
根据自 MMR2 以来的时间(参考:0-2 年)的流行性腮腺炎风险 (HR): 3-12 岁:3.1 (95% CI: 0.6-16.2) 如果 13-15 岁:9.1 (95%CI: 2.2-36.9) 16-24 岁:14.3 (95%CI: 3.5-57.6) 增量 VE(MMR3 vs。 MMR2):范围从接种疫苗后 7 天的 60.0%(95% CI,38.4 -74.0%)到接种疫苗后 28 天的 78.1%(95% CI:60.9-87.8%)。 在疫情暴发期间接受 MMR3 治疗的 34 例病例中,35% (n=12) 在症状发作前 >4 周接受。 | II-2 | 公平 |
| Fiebelkorn AP、Lawler J、Curns AT、Brandeburg C、Wallace GS。华莱士 2013 年。使用第三剂麻疹-腮腺炎-风疹疫苗进行流行性腮腺炎暴露后预防,美国纽约州奥兰治县。新兴感染病,19(9): 1411-7. | MMR1、MMR2、MMR3;Jeryl Lynn 菌株 | 队列 |
| 28 名家庭成员接受了 MMR3,16 名接受了 MMR1 或 MMR2.77 名拒绝 MMR3 免疫接种的 MMR2 家庭成员用作对照。 根据 MMR3 状态的发作率(指数病例中腮腺炎发作后 12-25 天)*:
*组间差异无统计学意义 (p = 0.57)。 对照组自上次 MMR 给药以来的中位年数为 11 年 (范围 0-39)。 指数病例患者发病至最后一次 MMR 疫苗剂量之间的中位间隔为 3 年。 | II-2 | 公平 |
| Levine H、Rishpon S、Huerta-Hartal M、Davidovitch N。 2011 年。在密闭环境中预防流行性腮腺炎暴发:作为一种遏制策略的全面环围疫苗接种。嗡嗡声 Vaccin,7(12): 1389-93. | MMR2、MMR3;Jeryl Lynn 菌株 | 流行病学报告 |
| 在 2005 年疫情的两波疫情期间,超过 1,000 名士兵在指数病例报告后的一周内接受了免疫接种。在第一波中,所有个体都接种了额外的 MMR 剂量。在第二波中,接受 MMR2 的个体被排除在外。在这两起事件中,均未发现更多主动监测病例。 在 2009/10 年疫情期间,总共有近 2,000 名士兵接种了额外剂量的疫苗,与 MMR 疫苗状态无关(>40 个不同的事件)。流行性腮腺炎感染仅发生在疫苗接种活动开始后的单个潜伏期内。 | II-3 | 穷 |
| Nelson GE, Aguon A, Valencia E, Oliva R, Guerrero ML, Reyes R, Lizama A, Diras D, Mathew A, Camacho EJ, Monforte MN, Chen TH, Mahamud A, Kutty PK, Hickman C, Bellini WJ, Seward JF, Gallagher K, Fiebelkorn AP。 在高度接种疫苗的岛屿人口中流行性腮腺炎疫情的流行病学和使用第三剂麻疹-腮腺炎-风疹疫苗进行疫情控制 – 关岛 2009 年至 2010 年。儿科感染疾病杂志 2013;32(4):374-80. | MMR3;Jeryl Lynn 菌株 | 队列 |
| 在 3,364 名 9-14 岁的合格学生中,33% (n=1,068) 获得了 MMR3. 根据 MMR3 状态*,符合条件的学校的攻击率:
*组间差异 (RR=0.4 [95%CI: 0.05-3.5]) 无统计学意义 (p=0.67)。 在干预后被诊断患有流行性腮腺炎的 6 名学生中,只有一名接受了 MMR3. 增量 VE(MMR3 vs。 MMR2):接种疫苗后 21 天或以上为 61%(95% CI,-250 -95%) | II-2 | 穷 |
| Ogbuanu IU、Kutty PK、Hudson JM、Blog D、Abedi GR、Goodell S、Lawler J、McLean HQ、Pollock L、Rausch-Phung E、Schulte C、Valure B、Armstrong GL、Gallagher K。 2012 年。第三剂麻疹-腮腺炎-风疹疫苗对流行性腮腺炎爆发的影响。儿科,130(6):e1567-74. | MMR1、MMR2、MMR3;Jeryl Lynn 菌株 | 队列 |
| 在 2,688 名 11-17 岁的学生中,有 1,723 人获得了 MMR3;少数学生 (n=87) 接受了 MMR1 或 MMR2 的追赶剂量。 11-17 岁学生的发病率:
增量 VE(MMR3 vs。 MMR2):88%(95% CI:-31.9%,98.9%);由于疫苗接种率高和病例数量少>干预后 21 天,CI间隔较宽(413 名未接种疫苗的学生中有 2 名,1 名接种疫苗的学生中有 1,723 名) 干预后社区流行性腮腺炎发病率的下降在 11-17 岁 (96%;95% CI: 87-99) 和 5-10 岁 (72.9%;95%CI: 52-84) 年龄组中也具有统计学意义。 | II-2 | 公平 |
| Salmón-Mulanovich G, Utz G, Lescano AG, Bentzel DE, Blazes DL。2009. 对流行性腮腺炎病例的快速反应:对预防医学研究机构传播的影响。Salud Publica Mex, 51(1): 34-8. | MMR1;Jeryl Lynn 菌株 | 病例系列 |
| 在 81 名暴露员工中,根据感染史和 <20.0 U/ml 的抗体滴度,发现 8 人未接种疫苗和疾病。 所有符合条件的个体在暴露后一周内接种了 MMR 疫苗。干预后未观察到继发性流行性腮腺炎病例。 | II-3 | 公平 |
| Veneti L, Borgen K, Borge KS, Danis K, Greve-Isdahl M, Konsmo K, Njølstad G, Nordbø SA, Øystese KS, Rykkvin R, Sagvik E, Riise ØR。2018.2015 年至 2016 年挪威接种疫苗的学生中流行性腮腺炎病毒基因型 G 的大规模爆发。欧元监控。2018;23(38):1700642 | MMR1、MMR2、MMR3;基因型 A (Jeryl Lynn 和 RIT 4385) | 病例系列 |
| MMR3 已向大约 1,300 名病例密切接触者(包括家庭成员)提供。 在接受 MMR3 的个体中,仅报告了 3 例病例,均在接种疫苗后 2 周内。 | II-3 | 穷 |
附录 B:安全性检查结果摘要(不良事件 [AE] 和严重不良事件 [SAE])
| 研究详情 | 总结 | |||||
|---|---|---|---|---|---|---|
| 出版 | 疫苗(提供剂量),菌株 | 研究设计 | 爆发和研究描述 | 主要发现摘要 | 证据级别 | 质量 |
| Aasheim E、Inns T、Trindall A、Emmett L、Brown K、Williams C 等人。2013 年英国学校环境中的流行性腮腺炎爆发。Hum Vaccin 免疫剂。2014;10(8):2446-9 | MMR1、MMR2、MMR3;Jeryl Lynn 菌株 | 病例系列 | N=76 名 10-19 岁的学生,他们的父母批准了额外的 MMR 剂量 | 接种疫苗后未报告 AE。 | II-3 | 公平 |
| Abedi GR、Mutuc JD、Lawler J、Leroy ZC、Hudson JM、博客 DS、Schulte CR、Rausch-Phung E、Ogbuanu IU、Gallagher K、Kutty PK 2012.在流行性腮腺炎爆发中接种第三剂麻疹、腮腺炎和风疹疫苗后的不良事件。疫苗,30(49):7052-8. Ogbuanu IU、Kutty PK、Hudson JM、Blog D、Abedi GR、Goodell S、Lawler J、McLean HQ、Pollock L、Rausch-Phung E、Schulte C、Valure B、Armstrong GL、Gallagher K。 2012 年。第三剂麻疹-腮腺炎-风疹疫苗对流行性腮腺炎爆发的影响。儿科,130(6):e1567-74. | MMR3;Jeryl Lynn 菌株 | 病例系列 | N= 1,597 名 11-17 岁的学生 | 在获得 MMR3 的 1,755 名 11-17 岁学生中,91% (1,597) 返回进行后续调查。 调查受访者(学生和家长报告)中的 AE:
| II-3 | 公平 |
| Albertson JP, Clegg WJ, Reid HD, Arbise BS, Pryde J, Vaid A, Thompson-Brown R, Echols F。 大学腮腺炎疫情和第三剂麻疹-腮腺炎-风疹疫苗的建议-伊利诺伊州,2015-2016 年。MMWR Morb Mortal Wkly 代表 2016 年;65(29):731-4. | MMR1、MMR2、MMR3;Jeryl Lynn 菌株 | 病例系列 | N=>1957 年或之后出生的 11,500 名大学生和教职员工 | 接种疫苗后未报告 SAE。 | II-3 | 公平 |
| 莱文 H、里什彭 S、韦尔塔-哈塔尔 M、大卫多维奇 N。 2011. 在密闭环境中预防流行性腮腺炎爆发:全面环围疫苗接种作为一种遏制策略。嗡嗡声 Vaccin,7(12): | MMR2、MMR3;Jeryl Lynn 菌株 | 流行病学报告 | N=>2,000 名士兵 | 免疫接种后未报告不良事件。 | II-3 | 穷 |
| Nelson GE、Aguon A、Valencia E、Oliva R、Guerrero ML、Reyes R、Lizama A、Diras D、Mathew A、Camacho EJ、Monforte MN、Chen TH、Mahamud A、Kutty PK、Hickman C、Bellini WJ、Seward JF、Gallagher K、Fiebelkorn AP。 2013 年。在高度接种疫苗的岛屿人口中流行性腮腺炎疫情的流行病学以及使用第三剂麻疹-腮腺炎-风疹疫苗进行疫情控制 – 关岛 2009 年至 2010 年。儿科感染疾病杂志 2013;32(4):374-80. | MMR3;Jeryl Lynn 菌株 | 病例系列 | N=533 名 9-14 岁的儿童 | 通过回顾性调查收集 AE 数据。6% (n=32) 的学生在接种疫苗后 2 周内报告了 AE,其中关节痛 (2.6%)、局部疼痛/发红/肿胀和头晕 (2.4%) 最常见。 未报告SAEs。 | II-3 | 穷 |
| Veneti L, Borgen K, Borge KS, Danis K, Greve-Isdahl M, Konsmo K, Njølstad G, Nordbø SA, Øystese KS, Rykkvin R, Sagvik E, Riise ØR。2018. 2015 年至 2016 年挪威接种疫苗的学生中流行性腮腺炎病毒基因型 G 的大规模爆发。欧元监控。2018;23(38):1700642 | MMR1、MMR2、MMR3;基因型 A (Jeryl Lynn 和 RIT 4385) | 病例系列 | N≈1,300 名成人 | 未报告SAEs。 | II-3 | 公平 |
引用
- 脚注 1
- Marin M, Marlow M, Moore KL, Patel M。 免疫实践咨询委员会关于在疫情期间对流行性腮腺炎风险增加人群使用第三剂含流行性腮腺炎病毒疫苗的建议。MMWR Morb Mortal Wkly 代表 2018 年;67(1):33-8.
- 脚注 2
- 加拿大公共卫生署 (PHAC)。到 2025 年疫苗接种覆盖率目标和疫苗可预防疾病减少目标 [互联网]。渥太华(安大略省):加拿大政府;2019 [更新于 2019-05-08]。可从:https://www。canada。ca/en/public-health/services/immunization-vaccine-priorities/national-immunization-strategy/vaccination-coverage-goals-vaccine-preventable-diseases-reduction-targets-2025.html。
- 脚注 3
- Ramanathan R, Voigt E, Kennedy R, Poland G。 知识差距持续存在,阻碍了消除流行性腮腺炎的进展。疫苗。2018;36(26):3721-6
- 脚注 4
- Lewnard JA,研究生 YH。疫苗减少和流行性腮腺炎在美国重新出现。Sci Transl Med。 2018;10(433):1-11.
- 脚注 5
- Cortese M、Jordan H、Curns A、Quinlan P、Ens K、Denning P 等人。流行性腮腺炎爆发期间大学生的流行性腮腺炎疫苗表现。Clin Infect Dis。 2008;46(8):1172-80.
- 脚注 6
- Cohen C、White JM、Savage EJ、Glynn JR、Choi Y、Andrews N 等人。疫苗有效性估计,2004-2005 年流行性腮腺炎爆发,英格兰。Emerg Infect Dis。 2007 年;13(1):12-7.
- 脚注 7
- Seagle EE、Bednarczyk RA、Hill T、Fiebelkorn AP、Hickman CJ、Icenogle JP 等人。麻疹、腮腺炎和风疹抗体在第二剂 MMR 疫苗后的持续存在和下降速度模式。疫苗。2018 年 2 月 1 日;36(6):818-26.
- 脚注 8
- 欧洲疾病预防和控制中心 (ECDC)。2016 年年度流行病学报告 – 流行性腮腺炎。监测报告。斯德哥尔摩 (SE): ECDC;2018.
- 脚注 9
- Gouma S, Hahné SJM, Gijselaar DB, Koopmans MPG, van Binnendijk RS。流行性腮腺炎病的严重程度与 MMR 疫苗接种状态和病毒脱落有关。疫苗。2016 年 4 月 7 日;34(16):1868-73.
- 脚注 10
- 流行性腮腺炎疫苗:加拿大免疫指南 [互联网]。渥太华(安大略省):加拿大政府;2018 [更新于 2019-07-26]。可从:https://www。canada。ca/en/public- health/services/publications/healthy-living/canadian-immunization-guide-part-4-active- vaccines/page-14-mumps-vaccine。html。
- 脚注 11
- 加拿大公共卫生署。加拿大流行性腮腺炎疫情预防和控制指南。Can Commun Dis Rep。2010;36(增刊 1):1-46.
- 脚注 12
- Yoshida N、Fujino M、Miyata A、Nagai T、Kamada M、Sakiyama H 等人。流行性腮腺炎病毒再感染不是由逆转录环介导的等温扩增证实的罕见事件。J Med 病毒。2008 年 3 月;80(3):517-23.
- 脚注 13
- Kennedy RB, Ovsyannikova IG, Thomas A, Larrabee BR, Rubin S, Poland GA。 MMR 疫苗接种后对麻疹和腮腺炎的免疫反应的差异持久性。疫苗。2019 年 3 月 22 日;37(13):1775-84.
- 脚注 14
- Kontio M, Jokinen S, Paunio M, Peltola H, Davidkin I。 抗体水平和亲和力减弱:对 MMR 疫苗诱导保护的影响。J Infect Dis。 2012 年;206(10):1542-8.
- 脚注 15
- Davidkin I, Jokinen S, Broman M, Leinikki P, Peltola H。 麻疹、腮腺炎和风疹抗体在 MMR 疫苗接种队列中的持久性:20 年随访。J Infect Dis。 2008;197(7):950-6.
- 脚注 16
- LeBaron CW、Forghani B、Beck C、Brown C、Bi D、Cossen C 等人。接种 2 剂麻疹-腮腺炎-风疹疫苗后流行性腮腺炎抗体持续存在。J Infect Dis。 2009 年;199(4):552-60.
- 脚注 17
- Fiebelkorn AP、Coleman LA、Belongia EA、Freeman SK、York D、Bi D、Zhang C、Ngo L、Rubin S。 年轻人在第三剂麻疹-腮腺炎-风疹疫苗后的抗体反应。Open Forum Infect Dis。 2014 年;1(3):ofu094.
- 脚注 18
- Principi N, Esposito S。 流行性腮腺炎爆发:需要解决的问题。J 感染。2018 年 6 月;76(6):503-6.
- 脚注 19
- Dayan GH, Rubin S, Plotkin S。 接种疫苗人群中的流行性腮腺炎疫情:现有的流行性腮腺炎疫苗是否足以有效预防疫情爆发?Clin Infect Dis。 2008;47(11):1458-67.
- 脚注 20
- Lewnard JA,研究生 YH。疫苗减少和流行性腮腺炎在美国重新出现。Sci Transl Med。 2018;10(433):eaa05945.
- 脚注 21
- Rasheed MAU、Hickman CJ、McGrew M、Sowers SB、Mercader S、Hopkins A、Grimes V、Yu T、Wrammert J、Mulligan MJ、Bellini WJ、Rota PA、Orenstein WA、Ahmed R、Edupuganti S。 儿童期接种 MMR 疫苗的年轻人对流行性腮腺炎的体液免疫力降低。美国国家科学院院刊 2019 年 9 月 17 日;116(38):19071-6
- 脚注 22
- 霍曼 EJ,布雷梅尔 RD。接种疫苗的患者的流行性腮腺炎病例是否归因于疫苗 T 细胞和 B 细胞表位的错配?:免疫信息学分析。Hum Vaccin 免疫剂。2014;10(2):290-300.
- 脚注 23
- Nöjd J, Tecle T, Samuelsson A, Örvell C。 腮腺炎病毒中和抗体不能防止异源腮腺炎病毒基因型的再次感染。疫苗。2001 年 2 月 08 日;19(13-14):1727-31.
- 脚注 24
- Gouma S、Ten Hulscher HI、Schurink-van ‘t Klooster TM、de Melker HE、Boland GJ、Kaaijk P 等人。MMR 疫苗诱导的抗体对流行性腮腺炎特异叉中和可预测对流行性腮腺炎病毒感染的保护作用。疫苗。2016 年 7 月 29 日;34(35):4166-71.
- 脚注 25
- Clemmons NS, Redd SB, Gustanaduy PA, Marin M, Patel M, Fiebelkorn AP。 2010 年 7 月至 2015 年 12 月美国大型流行性腮腺炎疫情的特征。Clin Infect Dis。 2019;68(10):1684-90.
- 脚注 26
- 国家免疫和呼吸疾病中心 (NCIRD)。流行性腮腺炎病例和疫情 [互联网]。亚特兰大 (GA):疾病控制和预防中心 (CDC);2019 [更新于 2019 年 7 月 22 日;引用于 2019 年 7 月 31 日]。可从:https://www。cdc。gov/mumps/outbreaks。html。
- 脚注 27
- 加拿大公共卫生署 (PHAC)。流行性腮腺炎 – 监控 [互联网]。渥太华(安大略省):加拿大政府;2014 [更新于 2014 年 11 月 24 日;引用于 2019 年 7 月 19 日]。可从:https://www。canada。ca/en/public-health/services/immunization/vaccine-preventable-diseases/mumps/surveillance。html。
- 脚注 28
- Harris RP、Helfand M、Woolf SH、Lohr KN、Mulrow CD、Teutsch SM、Atkins D 等人。美国预防服务工作组的当前方法:流程回顾。Am J Prev Med。 2001 年;20(3 增刊):21-35
- 脚注 29
- Hviid A, Rubin S, Mühlemann K。 腮腺炎。柳叶 刀。2008 年 3 月 15 日;371(9616):932- 44.
- 脚注 30
- 传染病控制手册。第 18 版。华盛顿(特区):美国公共卫生协会;2004. 第 376-9 页
- 脚注 31
- 阿特金森 W、汉博斯基 J、麦金泰尔 L、et。al。疫苗可预防疾病的流行病学和预防。第 10 版。华盛顿(特区):疾病控制和预防中心;2007. 第 149-58 页。
- 脚注 32
- Dittrich S、Hahné S、van Lier A、Kohl R、Boot H、Koopmans M 等人。接种疫苗儿童流行性腮腺炎病毒感染的血清学证据评估。疫苗。2011 年 11 月 15 日;29(49):9271-5.
- 脚注 33
- Conly J,约翰斯通 B。流行性腮腺炎卷土重来吗?Can J Infect Dis Med Microbiol。。2007;18(1):7-9.
- 脚注 34
- 鲁宾 SA。副粘病毒: 流行性腮腺炎。在:Kaslow R、Stanberry L、Le Duc, J,编辑。人类病毒感染。波士顿(马萨诸塞州):施普林格·林克;2014. 第 553-7 页。
- 脚注 35
- 鲁宾 S、埃克豪斯 M、伦尼克 LJ、班福德 CG、杜普雷克斯 WP。流行性腮腺炎病毒的分子生物学、发病机制和病理学。J Pathol。2015;235(2):242-52.
- 脚注 36
- Lozo S, Ahmed A, Chapnick E, O’Keefe M, Minkoff H。 妊娠期流行性腮腺炎推测病例:临床和感染控制并发症。感染妇产科疾病。2012;2012:345068.
- 脚注 37
- Gouma S, Durand ML, van Binnendiijk RS。流行性腮腺炎和其他类型的病毒性腮腺炎。在:Durand M,Deschler D,编辑。耳朵、鼻子、喉咙和鼻窦感染。。加拿大:Springer, Cham;2018. 第 279-89 页。
- 脚注 38
- Donahue M、Schneider A、Ukegbu U、Shah M、Riley J、Weigel A 等人。现场笔记:接种 2 剂麻疹-腮腺炎-风疹疫苗的学生在大学爆发期间的流行性腮腺炎并发症–爱荷华州,2015 年 7 月至 2016 年 5 月。发病率和死亡率周报 (MMWR)。2017;66(14):390-1.
- 脚注 39
- 传染病研究协会。流行性腮腺炎并发症的回顾性调查。JR Coll Gen 实践。1974;24(145):552-6.
- 脚注 40
- Zamir CS, Schroeder H, Shoob H, Abramson N, Zentner G。 大规模流行性腮腺炎爆发的特征:流行性腮腺炎爆发病例的临床严重程度、并发症和与疫苗接种状态的关联。Hum Vaccin 免疫剂。2015;11(6):1413-7.
- 脚注 41
- Yung C, Andrews N, Bukasa A, Brown KE, Ramsay M。 流行性腮腺炎疫苗接种的并发症和影响,英格兰和威尔士,2002-2006 年。Emerg Infect Dis。 2011;17(4):661-7.
- 脚注 42
- Sane J、Gouma S、Koopmans M、de Melker H、Swaan C、van Binnendijk R 等人。疫苗接种者流行性腮腺炎,荷兰,2009-2012 年。Emerg Infect Dis。 2014 年;20(4):643-8.
- 脚注 43
- López-Perea N, Masa-Calles J, Torres de Mier, María de Viarce, Fernández-García A, Echevarría JE, De Ory F, et al。在高度接种疫苗的人群中,流行性腮腺炎发病率、住院和严重并发症的年龄组内发生变化。西班牙,1998-2014 年。疫苗。2017 年 8 月 3 日;35(34):4339-45.
- 脚注 44
- 关于流行性腮腺炎的事实 [互联网]。欧洲疾病预防和控制中心 (ECDC);2020 [引用 2020 年 1 月 14 日]。可从:https://www。ecdc。europa。eu/en/mumps/facts。
- 脚注 45
- 加拿大公共卫生署 (PHAC)。指南:加拿大的流行性腮腺炎 [互联网]。渥太华(安大略省):加拿大政府;2009 [更新于 2009 年 6 月 17 日;引用于 2019 年 7 月 19 日]。可从: https://www。canada。ca/en/public-health/services/reports-publications/canada-communicable-disease-report-ccdr/monthly-issue/2010-36/guidelines-prevention-control-mumps-outbreaks-canada。html
- 脚注 46
- 免疫覆盖率 [互联网]。日内瓦(瑞士):世界卫生组织 (WHO);2019 [更新于 2020 年 12 月 6 日;引用于 2020 年 1 月 31 日]。可从:https://www。who。int/news-room/fact-sheets/detail/immunization-coverage。
- 脚注 47
- 加拿大公共卫生署 (PHAC)。病例定义:国家法定报告疾病 [Internet]。渥太华(安大略省):加拿大政府;2018 [更新于 2018 年 11 月 25 日;引用于 2019 年 7 月 19 日]。可从:http://diseases。canada。ca/notifiable/diseases-list。
- 脚注 48
- 加拿大公共卫生署 (PHAC)。流行性腮腺炎:适用于卫生专业人员 [互联网]。渥太华(安大略省):加拿大政府;2014 年 [更新于 2014 年 12 月 23 日;引用于 2019 年 8 月 13 日]。可从:https://www。canada。ca/en/public-health/services/immunization/vaccine-preventable-diseases/mumps/health-professionals。html。
- 脚注 49
- 国家免疫咨询委员会 (NACI)。
关于流行性腮腺炎疫苗的声明。渥太华(安大略省):加拿大公共卫生署 (PHAC);2007 [更新于 2007 年 8 月 1 日;引用于 2019 年 8 月 13 日]。可从:https://www。canada。ca/en/public-health/services/reports-publications/canada-communicable-disease-report-ccdr/monthly-issue/2007-33/statement-on-mumps-vaccine。html。
- 脚注 50
- Saboui M, Squires S。 2016 年至 2018 年加拿大各地的流行性腮腺炎疫情。Can Commun Dis Rep。 2020;46(11-12):427–31.
- 脚注 51
- Wei Y, Wilkinson K, Rusk R, Kadkhoda K, Loeppky C。 2016 年 9 月至 2018 年 12 月加拿大曼尼托巴省的大型社区流行性腮腺炎疫情。Can Commun Dis Rep。 2020;46(4):70-76
- 脚注 52
- Rudnick W, Wilson S, Majerovich JA, Haavaldsrud M, Gatali M, Matsumoto CL, Deeks S。 加拿大安大略省北部两个原住民社区爆发剂量的含流行性腮腺炎疫苗的有效性。研究广场。2020 年 11 月 6 日。https://doi。org/10.21203/rs。3.rs-103431/v1.
- 脚注 53
- Stapleton PJ、Eshaghi A、Seo CY、Wilson S、Harris T、Deeks SL 等人。评估全基因组测序在加拿大安大略省大规模流行性腮腺炎疫情调查中的应用。Sci Rep。 2019 年 8 月 30 日;9(1):12615.
- 脚注 54
- Gardy JL、Naus M、Amlani A、Chung W、Kim H、Tan M 等人。在 2010 年冬奥会后感染爆发期间,对麻疹病毒基因型 H1 和 D8 进行全基因组测序,揭示了病毒传播途径。J of Infect Dis。 2015;212(10):1574-8.
- 脚注 55
- Anis E, Grotto I, Moerman L, Warshavsky B, Slater PE, Lev B。 以色列高度接种疫苗社会的流行性腮腺炎爆发:两剂就够了吗?流行病菌感染。2012(140):439-46
- 脚注 56
- Cordeiro E, Ferreira M, Rodrigues F, Palminha P, Vinagre E, Pimentel JP。2012 年至 2013 年,葡萄牙中部地区高度接种疫苗的青少年和儿童中爆发流行性腮腺炎。2015 年医学杂志;28(4):435-41.
- 脚注 57
- Braeye T、Linina I、De Roy R、Hutse V、Wauters M、Cox P 等人。2012-2013 年比利时佛兰德斯流行性腮腺炎增加:临时强制通知和大学生队列研究的结果。疫苗。2014 年 7 月 31 日;32(35):4393-8.
- 脚注 58
- 默克加拿大公司产品专论:M-M-R ® II(麻疹、腮腺炎和风疹病毒疫苗,活疫苗,减毒疫苗,默克标准疫苗)。2021. 可从:https://www。merck。ca/static/pdf/MMR_II-PM_E。pdf。
- 脚注 59
- Langwig KE、Gomes MGM、Clark MD、Kwitny M、Yamada、Steffany、Wargo、Andrew R。、Lipsitch Marc。有限的可用证据支持理论预测,即在较高暴露剂量下疫苗效力会降低。Sci Rep。 2019;9(1):3203.
- 脚注 60
- Beleni A, Borgmann S。 疫苗接种时代的流行性腮腺炎:全球流行病学和德国的情况。国际环境研究公共卫生杂志。2018;15(8):1618.
- 脚注 61
- Ogbuanu IU、Kutty PK、Hudson JM、Blog D、Abedi GR、Goodell S 等人。第三剂麻疹-腮腺炎-风疹疫苗对流行性腮腺炎爆发的影响。小儿科。2012;130(6):1567-74.
- 脚注 62
- Nelson G、Aguon A、Valencia E、Oliver R、Guerrero M、Reyes R 等人。高度接种疫苗的岛屿人口中流行性腮腺炎疫情的流行病学以及使用第三剂麻疹-腮腺炎-风疹-疫苗控制疫情–关岛 2009-2010 年。儿科感染疾病杂志 2013;32(4):374-80.
- 脚注 63
- Aasheim E、Inns T、Trindall A、Emmett L、Brown K、Williams C 等人。2013 年英国学校环境中的流行性腮腺炎爆发。Hum Vaccin 免疫剂。2014;10(8):2446-9.
- 脚注 64
- Ramsay M, Brown D, Eastcott H, Begg N。 流行性腮腺炎爆发中的唾液抗体检测和疫苗接种。CDR (Lond Engl Rev)。1991;1(9):R96-8.
- 脚注 65
- 疾病控制和预防中心 (CDC)。2005 年,纽约夏令营爆发的流行性腮腺炎。MMWR Morb Mortal Wkly 代表 2006 年;55(7):175-7.
- 脚注 66
- Pérez-Alba E, García-Ortiz A, Salazar-Montalvo RG, Hernández-Guedea MA, Camacho-Ortiz A。 流行性腮腺炎爆发,在大学教学医院的居民中并发症发生率很高。Am J 感染控制。2019;47(3):337-9.
- 脚注 67
- Fischer PR、Brunetti C、Welch V、Christenson JC。医院流行性腮腺炎:疫情及其控制的报告。Am J 感染控制。1996;24(1):13-8.
- 脚注 68
- Albertson JP, Clegg WJ, Reid HD, Arbise BS, Pryde J, Vaid A, Thompson-Brown R, Echols F。 大学腮腺炎疫情和第三剂麻疹-腮腺炎-风疹疫苗的建议-伊利诺伊州,2015-2016 年。MMWR Morb Mortal Wkly 代表。2016;65(29):731- 4.
- 脚注 69
- Shah M、Quinlisk P、Weigel A、Riley J、James L、Patterson J 等人。2015 年 7 月至 2016 年 5 月爱荷华州麻疹-腮腺炎-风疹疫苗接种运动前后在高度接种疫苗的大学附属环境中爆发流行性腮腺炎。Clinl Infect Dis。 2018 年;66(1):81-8.
- 脚注 70
- Cardemil C、Dahl R、James L、Wannemuehler K、Gary H、Shah M 等人。第三剂 MMR 疫苗对流行性腮腺炎疫情控制的有效性。N Engl J Med。 2017 年;377(10):947-56.
- 脚注 71
- Levine H, Rishpon S, Huerta-Hartal M, Davidovitch N。 在密闭环境中预防流行性腮腺炎爆发:作为遏制策略的全面环围疫苗接种。嗡。2011;7(12):1389-93.
- 脚注 72
- Mossong J, Bonert C, Weicherding P, Opp M, Reichert P, Even J, Schneider F。 2008 年卢森堡军队中爆发的流行性腮腺炎:流行病学和控制措施的评估。欧元监控。2009;14(7):19121.
- 脚注 73
- Veneti L, Borgen K, Borge KS, Danis K, Greve-Isdahl M, Konsmo K, Njølstad G, Nordbø SA, Øystese KS, Rykkvin R, Sagvik E, Riise ØR。2015 年至 2016 年,挪威接种疫苗的学生中爆发了 G 型流行性腮腺炎病毒基因型的大规模爆发。欧元监控。2018;23(38):1700642.
- 脚注 74
- 沃顿 M、科奇 S、哈奇森 R、比斯托维什 J、沙芬纳 W。后疫苗时代的流行性腮腺炎大规模爆发。J Infect Dis。 1988 年;158(6):1253-60.
- 脚注 75
- Sugg W, Finger J, Levine R, Pagano J。 活病毒流行性腮腺炎疫苗的现场评估。儿科杂志。1968;72(4):461-6.
- 脚注 76
- Veneti L、Borgen K、Borge KS、Danis K、Greve-Isdahl M、Konsmo K 等人。2015 年至 2016 年,挪威接种疫苗的学生中爆发了 G 型流行性腮腺炎病毒基因型的大规模疫情。欧元监控。2018;23(38):1700642.
- 脚注 77
- Abedi GR、Mutuc JD、Lawler J、Leroy ZC、Hudson JM、博客 DS、Schulte CR、Rausch-Phung E、Ogbuanu IU、Gallagher K、Kutty PK。流行性腮腺炎爆发中第三剂麻疹、腮腺炎和风疹疫苗后的不良事件。疫苗。2012;30(49):7052-8.
- 脚注 78
- 更新了对流行性腮腺炎患者隔离的建议。MMWR Morb Mortal Wkly 代表 2008 年;57(40):1103-5.
- 脚注 79
- Vygen S、Fischer A、Meurice L、Mounchetrou Njoya I、Gregoris M、Ndiaye B 等人。接种疫苗的年轻人对流行性腮腺炎的免疫力减弱,法国 2013 年。欧元监控。2016;21(10):30156.
- 脚注 80
- Barskey AE、Schulte C、Rosen JB、Handschur EF、Rausch-Phung E、Doll MK 等人。流行性腮腺炎在美国的东正教犹太社区爆发。N Engl J Med。 2012 年;367(18):1704-13.
- 脚注 81
- Marin M、Kitzmann TL、James L、Quinlisk P、Aldous WK、Zhang J 等人。大学流行性腮腺炎爆发期间第三剂麻疹-腮腺炎-风疹疫苗的公共卫生响应和疫情控制成本 – 爱荷华州,2015-2016 年。Open Forum Infect Dis。 2018 年;5(10):ofy199.
页面详细信息
修改日期:
Hits: 72

