Contents
- 0.1 摘要
- 0.2 执行摘要
- 0.3 序言
- 0.4 未来高致病性和高传播性冠状病毒的出现代表了一种真实而现实的威胁,这凸显了对协调研发计划开发广泛保护性冠状病毒疫苗的迫切需要。
- 0.5 未来的疫苗开发必须确保全球公平是研发的核心原则,并且计划能够预测和解决可能破坏这一目标的问题。
- 0.6 介绍
- 0.7 随着人口的增加,从人畜共患宿主到人类的“溢出”事件的可能性也在增加;因此,我们可以预期未来会出现更多的新型病毒,包括冠状病毒。
- 0.8 主题1:适用于疫苗开发的病毒学
- 1
- 2
- 3
- 4
- 5
- 5.1 主题3:疫苗学
- 5.1.1 问题:需要一套经过主要利益相关者广泛审查和同意的广泛保护性冠状病毒疫苗的首选产品特性(PPC),以便为疫苗研发提供信息。
- 5.1.2 问题:具有广泛保护性的冠状病毒候选疫苗需要在保持疫苗安全性的同时提供针对一系列现有和新型冠状病毒的保护。
- 5.1.3 问题:候选疫苗需要获得持久保护。
- 5.1.4 问题:需要进一步优化冠状病毒疫苗,以改善不同人群内部和跨人群获得未来疫苗的机会。
- 5.1.5 问题:对于具有广泛保护性的冠状病毒疫苗来说,临床试验设计或其他证明有效性、非劣效性或优越性的替代方法很复杂。
- 5.1.6 问题:对于设计为具有广泛保护作用的冠状病毒疫苗来说,证明有效性、非劣效性或优越性的监管途径尤为复杂。
- 6
- 7
- 8
- 9
- 10 主题1:适用于疫苗研发的病毒学
- 11 主题2:免疫学和免疫保护相关性
- 12 主题3:疫苗学
- 13 主题4:用于冠状病毒疫苗研究的动物和人类感染模型
- 14 主题5:政策与融资
冠状病毒疫苗研发路线图
菜单
附录 C:按主题领域和战略目标划分的 CVR 高优先级里程碑摘要
摘要
COVID-19对全球健康和经济稳定造成的历史性、持续性影响凸显了将广泛保护性冠状病毒疫苗的研发作为全球优先事项的迫切需要。SARS-CoV-2 于 2019 年出现,导致 COVID-19 大流行,是过去二十年来从动物宿主中出现的第三种冠状病毒,导致人类流行病。严重急性呼吸系统综合症冠状病毒(SARS-CoV)于2003年出现,随后于2012年出现中东呼吸综合征冠状病毒(MERS-CoV)。
冠状病毒可能具有高度致命性。中东呼吸综合征冠状病毒的病死率为35%,这意味着大约三分之一的感染会导致死亡。对于SARS-CoV,大约十分之一的感染会导致死亡(10%病死率)。幸运的是,这两种冠状病毒不能有效地在人与人之间传播。尽管 SARS-CoV-2 的病死率要低得多,但该病毒具有高度传播性,并在全球范围内迅速传播,导致更多的死亡。截至 2022 年底,SARS-CoV-2 感染已造成超过 6.5 亿例 COVID-19 确诊病例和超过 660 万人死亡。
除了当前 COVID-19 大流行的全球祸害之外,更令人担忧的是未来新型冠状病毒的威胁,这种冠状病毒可能具有高度传播性和高度致命性。数以千计的不同冠状病毒在全世界的动物中传播,特别是在蝙蝠中,但也在其他哺乳动物和鸟类中传播。过去 20 年的趋势正在加剧,冠状病毒从动物宿主蔓延到人类的风险越来越大,这是由于人口迅速扩展到动物栖息地和日益相互联系的世界所推动的。
目前可用的SARS-CoV-2疫苗的耐久性和免疫保护有限,这进一步凸显了迫切需要一种新的、积极主动的方法来开发冠状病毒疫苗,以提供更好、更持久的保护,以预防正在传播的和未来的SARS-CoV-2变体以及其他尚未出现的冠状病毒。 目前可用的COVID-19疫苗已被证明在预防重症和死亡方面是安全有效的,并构成了全球公共卫生大流行应对的支柱。然而,这些疫苗并不能提供足够的保护,防止感染、传播和逃避免疫反应的新变种的无情出现。
执行摘要
广泛保护性冠状病毒疫苗的研发(R&D)路线图
COVID-19对全球健康和经济稳定造成的历史性、持续性影响凸显了将广泛保护性冠状病毒疫苗的研发作为全球优先事项的迫切需要。SARS-CoV-2 于 2019 年出现,导致 COVID-19 大流行,是过去二十年来从动物宿主中出现的第三种冠状病毒,导致人类流行病。严重急性呼吸系统综合症冠状病毒(SARS-CoV)于2003年出现,随后于2012年出现中东呼吸综合征冠状病毒(MERS-CoV)。
冠状病毒可能具有高度致命性。中东呼吸综合征冠状病毒的病死率为35%,这意味着大约三分之一的感染会导致死亡。对于SARS-CoV,大约十分之一的感染会导致死亡(10%病死率)。幸运的是,这两种冠状病毒不能有效地在人与人之间传播。尽管 SARS-CoV-2 的病死率要低得多,但该病毒具有高度传播性,并在全球范围内迅速传播,导致更多的死亡。截至 2022 年底,SARS-CoV-2 感染已造成超过 6.5 亿例 COVID-19 确诊病例和超过 660 万人死亡。
除了当前 COVID-19 大流行的全球祸害之外,更令人担忧的是未来新型冠状病毒的威胁,这种冠状病毒可能具有高度传播性和高度致命性。数以千计的不同冠状病毒在全世界的动物中传播,特别是在蝙蝠中,但也在其他哺乳动物和鸟类中传播。过去 20 年的趋势正在加剧,冠状病毒从动物宿主蔓延到人类的风险越来越大,这是由于人口迅速扩展到动物栖息地和日益相互联系的世界所推动的。
目前可用的SARS-CoV-2疫苗的耐久性和免疫保护有限,这进一步凸显了迫切需要一种新的、积极主动的方法来开发冠状病毒疫苗,以提供更好、更持久的保护,以预防正在传播的和未来的SARS-CoV-2变体以及其他尚未出现的冠状病毒。
目前可用的COVID-19疫苗已被证明在预防重症和死亡方面是安全有效的,并构成了全球公共卫生大流行应对的支柱。然而,这些疫苗并不能提供足够的保护,防止感染、传播和逃避免疫反应的新变种的无情出现。
建立对冠状病毒威胁的积极响应
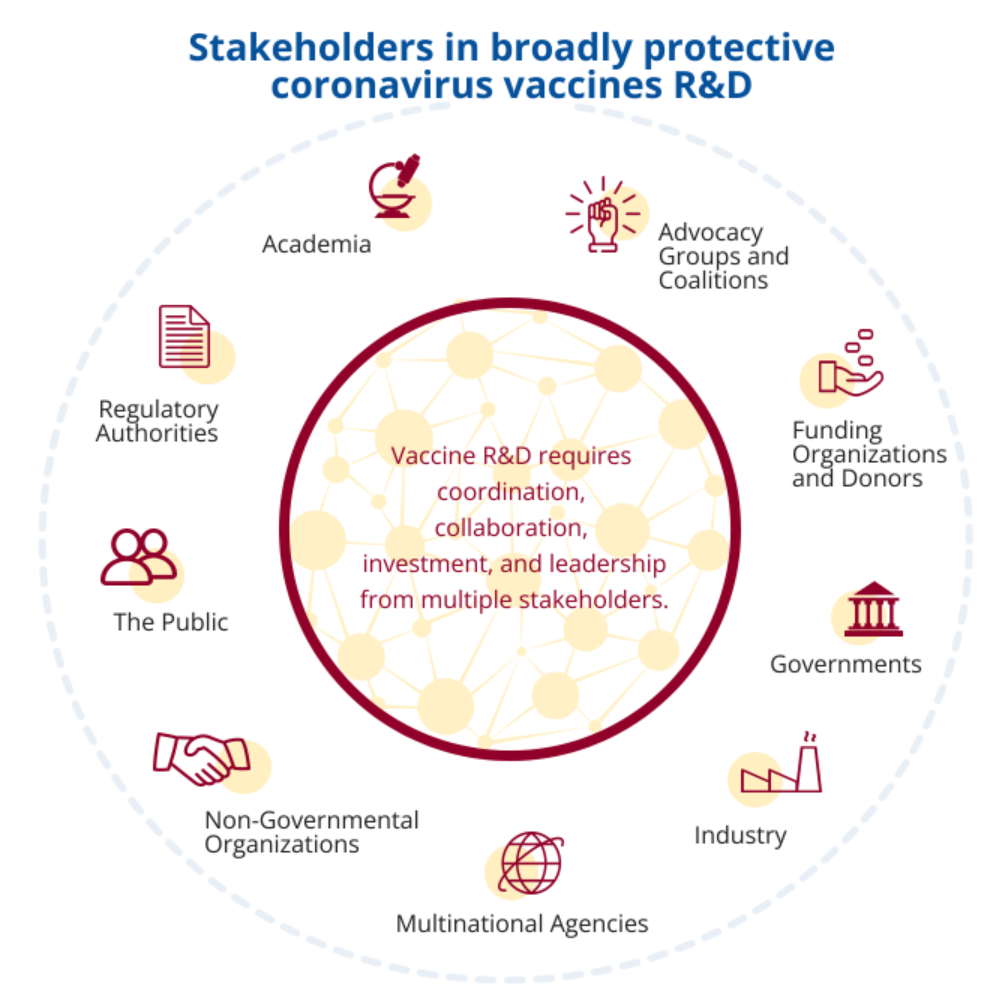
在短短20年内发生了三次新的冠状病毒流行,再加上我们对全球携带冠状病毒的动物宿主的广度以及目前可用疫苗的局限性的日益了解,正在发出一个明确的信号。冠状病毒对全球健康和稳定构成了现实的威胁,需要通过大规模、全面和协调的研发计划来应对,以开发具有广泛保护性和全球可及性的冠状病毒疫苗。
因此,开发具有广泛保护性的冠状病毒疫苗的最终目标是多方面的:创造更有效、更持久的COVID-19疫苗,减轻尚未出现的未来冠状病毒的潜在威胁,理想情况下,预防感染和传播。
针对广泛保护性冠状病毒疫苗的结构化和协调计划
开发具有广泛保护性的新冠病毒疫苗是一项庞大、复杂且成本高昂的工作。推进全球研发疫苗计划将需要研究人员、政府、行业、多边和非政府组织、监管机构、公共卫生官员和政策制定者之间的持续投资、沟通和协调。COVID-19 大流行导致全球数百万人丧生、数万亿美元的经济损失和社会动荡。拥有避免这种破坏重演的工具的回报是可观的。在创纪录的时间内开发COVID-19疫苗的科学进步和伙伴关系表明,通过明确、结构化和协调的冠状病毒疫苗研发计划,有可能取得快速进展。未来的进展还必须确保全球公平是疫苗研发的核心原则,并且计划能够预测和解决可能破坏这一目标的问题。
在过去的一年里,明尼苏达大学传染病研究与政策中心(CIDRAP)在洛克菲勒基金会和比尔及梅琳达·盖茨基金会的支持下,通过来自世界各地的50名专家的共同努力,为广泛保护的冠状病毒疫苗制定了全面的冠状病毒疫苗研发路线图(CVR)。CVR 为基本研究、领导力和投资提供了框架和时间表,同时对具体的科学、监管和后勤挑战进行了详细评估。许多努力已经在进行中,这将有助于推进广泛保护性冠状病毒疫苗的研发。该路线图提供了结构和有时限的里程碑,以确保这项工作协调一致,并专注于建立实现这些雄心勃勃的目标所必需的协调、领导力和投资。
CVR的最终目标是加速开发持久、具有广泛保护作用的冠状病毒疫苗,这些疫苗可以:
- 减少由当前和未来的人类冠状病毒引起的严重疾病和死亡(并可能预防感染),包括已知会感染人类的冠状病毒和未来有可能从动物传播给人类的病毒。
- 减轻未来全球冠状病毒流行的影响。
- 适用于全球所有地区,包括偏远地区和低收入和中等收入国家。
CVR分为五个主题领域。每个领域都包括对关键障碍和知识差距的总结,以及一组衡量成功的技术里程碑。主题是:
- 适用于疫苗研发的病毒学
- 免疫学和免疫保护相关性
- 疫苗学
- 用于冠状病毒疫苗研究的动物和人类感染模型
- 政策与融资
适用于疫苗研发的病毒学
开发具有广泛保护性的新冠病毒疫苗需要通过推进全球监测、研究和信息共享来更好地了解新冠病毒的全球分布。需要协调和持续的努力,使用标准化的工具和方法,从全世界所有野生和圈养动物宿主中收集、描述和分享病毒信息。从这些工作中获得的知识将指导选择各种冠状病毒的明智策略,这些冠状病毒定义了未来冠状病毒疫苗所需的保护范围。
免疫学和免疫保护相关性
开发具有广泛保护作用的冠状病毒疫苗需要人类免疫学科学的进步。关键研究领域包括确定扩大免疫保护的广度和持久性的因素,以及表征全身和粘膜免疫所涉及的机制,以防止冠状病毒感染、疾病和传播。进一步确定保护相关性(作为保护标志物的免疫反应)将加快使用不同抗原、平台和给药方式的冠状病毒疫苗的开发.化验、标本采集和研究方法的标准化、改进的信息共享以及虚拟生物储存库的创建将促进合作并加速科学发现。
疫苗学
就广泛保护性冠状病毒疫苗的首选产品特性达成共识将为疫苗研发的优先事项和战略提供信息。 需要考虑的关键疫苗特性包括覆盖范围的广度、保护的持久性以及在全球范围内使用的可行性,包括在资源匮乏的环境中。新技术的进步(如新平台和佐剂以及创新的给药方法)将加速广泛保护性疫苗的开发和分发。此外,确定进行随机对照试验的最佳策略,将新候选疫苗与现有疫苗进行比较,特别是在已有暴露和免疫力的人群中,将改善研发工作。 一些战略和平台具有开发广泛保护性疫苗的潜力;长期承诺和投资对于推进新的候选疫苗从发现到监管批准的整个管道至关重要。
用于冠状病毒研究的动物和人类感染模型
一系列合适的动物模型的可用性是开发广泛保护性冠状病毒疫苗的主要障碍,这些模型必须经过标准化、验证和充分表征。它们还必须能够反映与冠状病毒感染相关的一系列人类免疫反应和临床疾病,包括严重的急性、慢性和致命后果。 最大化动物模型的价值还需要更加关注为研究人员提供经过验证的可靠试剂;更新的病毒株和储备液;以及协调的检测方法。 已经开发了一种用于研究 SARS-CoV-2 的受控人类感染模型 (CHIM),该模型可能在评估广泛保护性冠状病毒候选疫苗方面发挥重要作用。优化 CHIM 的其他努力将扩大其效用,包括确定最佳实践和扩大使用标准化的道德和安全准则。
政策与融资
Broadly 保护性冠状病毒候选疫苗面临高昂的开发成本、制造复杂性,以及一旦获得批准,需求和投资回报将不确定。成功开发和广泛提供具有广泛保护性的新冠病毒疫苗将需要重振和维持对疫苗研发、监测以及全球制造和分销的高度政治承诺和投资。在开发和生产这些疫苗所需的背景下,详细分析了广泛保护性冠状病毒疫苗的广泛潜在社会和经济效益,将成为强有力的基础文件,为政策制定和必要的全球投资提供信息。
序言
明尼苏达大学传染病研究与政策中心(CIDRAP)在比尔和梅琳达·盖茨基金会和洛克菲勒基金会的资助下,为广泛保护性冠状病毒疫苗(称为冠状病毒疫苗路线图[CVR])制定了这一研究与开发(R&D)路线图,作为促进研发的战略规划工具。 协调资金,促进利益相关者的参与。CVR的最终目标是针对冠状病毒科病毒科的物种和毒株产生广泛的保护性疫苗。
该路线图的主要受众包括学术基础和转化科学家、临床研究人员、资助者、公共卫生政策制定者、政府官员、行业科学家、商业领袖、监管机构和宣传专家。
理由
在过去的二十年中,从动物宿主中出现了三种新型且致病性很强的冠状病毒,以引起人类流行病或大流行。严重急性呼吸系统综合症冠状病毒 (SARS-CoV) 于 2003 年出现,随后是 2012 年的中东呼吸综合征冠状病毒 (MERS-CoV) 和 2019 年的严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2)。冠状病毒对人类具有高度致命性,MERS-CoV 的病死率 (CFR) 为 35%,SARS-CoV 的病死率为 10%。幸运的是,MERS-CoV和SARS-CoV都没有被证明可以在人与人之间有效传播。SARS-CoV-2 的病死率要低得多,但由于其高传播性,到 2022 年底,全球已报告超过 6.5 亿例 COVID-19 病例和超过 660 万例死亡(世卫组织 2022a)。
未来高致病性和高传播性冠状病毒的出现代表了一种真实而现实的威胁,这凸显了对协调研发计划开发广泛保护性冠状病毒疫苗的迫切需要。
此外,现有的SARS-CoV-2疫苗和自然感染赋予的有限的耐久性和免疫保护(包括对感染的有限保护),以及新病毒变种的不断出现,进一步凸显了迫切需要一种新的、积极主动的方法来开发具有更大耐久性并针对不断出现的变异株的疫苗。
推进广泛保护性冠状病毒疫苗的全球研发议程是一项庞大而复杂的工作,需要研究人员之间的持续投资、沟通和协调;来自政府、行业、多边和非政府组织的代表;监管 机构;以及公共卫生政策制定者。该路线图提供了一个框架和时间表,以协调实现这些雄心勃勃的目标所需的协调、领导和投资。
广泛保护性冠状病毒疫苗研发工作的一个关键总体目标是开发可用于全球的疫苗。将最初的SARS-CoV-2疫苗推向市场的速度是一项了不起的成就;然而,多种因素导致在偏远和资源匮乏地区获得疫苗方面存在严重不平等。冷链和技术要求限制了产品使用,在供应有限的情况下保护国家利益,以及技术和公共卫生能力、融资、技术转让和制造能力方面的全球不平等,加剧了这种差异。
未来的疫苗开发必须确保全球公平是研发的核心原则,并且计划能够预测和解决可能破坏这一目标的问题。
展望未来,社区、国家、区域和国际层面的早期和持续参与对于实现未来冠状病毒疫苗的公平分配和接种至关重要。
路线图范围和结构
最近在其他领域制定研发路线图的努力,例如世界卫生组织(WHO)重点疾病的医疗对策开发(世卫组织研发蓝图2022,Modjarrad 2016)和流感疫苗研发路线图(CIDRAP 2021)为CVR的结构提供了信息,CVR分为五个主题领域:

每个主题领域都包含与该部分密切相关的关键问题、障碍和知识差距的概述。在这些问题的基础上,确定了五个专题领域的高级别战略目标,然后制定了实现这些目标所需的相关行动(里程碑)。里程碑包括完成目标日期(为每个里程碑列出的年底),并在可行的范围内反映 SMART(具体、可衡量、可实现、现实/相关和时间敏感)标准。高优先级里程碑是那些对开发新的、具有广泛保护作用的冠状病毒疫苗最关键的里程碑。在某些情况下,里程碑是有抱负的,因为它们反映了一个重要的研究领域,并包括一些乐观的时间表,以帮助推动该领域向前发展。每个主题领域还包括其他研究重点的列表。这些清单并不全面,可能会根据未来的科学发现重新确定优先级,而是为了说明未来研究的其他兴趣领域。本标题下列出的项目通常属于以下类别之一:(1)该项目的优先级不够高,无法纳入目标和里程碑,(2)研究或活动的性质不适合完成初始目标日期(认识到即使在达到初始目标之后,CVR中许多里程碑的研究仍将随着时间的推移而继续进一步完善), 或(3)研究或活动相对非特异性,不符合里程碑标准。
该路线图全面审视了无数复杂的科学和政策问题,这些问题对于生产适用于所有国家的广泛保护性冠状病毒疫苗非常重要,并将预防已知会导致人类严重疾病的现有冠状病毒(包括新的SARS-CoV-2变种)以及未来可能从人畜共患病宿主蔓延到人类的任何其他出现前的冠状病毒。然而,我们也认识到,该路线图中确定的一些问题旨在长期推动这一研究领域向前发展,对于下一代疫苗的早期成功开发不一定是必不可少的。因此,在短期内,探索资源密集度较低、有针对性的疫苗学解决方案可能会为早期开发更具广泛保护性的新冠病毒疫苗提供更务实的方法。
CVR特别关注与研发议程相关的问题;许多问题虽然对疫苗的分发和接种至关重要,但超出了本路线图的范围。例子包括与当前SARS-CoV-2疫苗相关的政策和做法(如给药方案和加强针频率);疫苗犹豫问题;一般公共卫生防控措施;以及实施国家或地方疫苗分发计划。
路线图制定流程
CVR开发过程涉及科学学科,公共和私营部门以及国际社会的广泛利益相关者,以围绕研发优先事项达成共识,并确定解决这些问题的策略。该过程包括识别和审查相关科学文献,与来自不同领域的一系列主题专家 (SME) 讨论科学挑战和知识差距,对路线图文件草案进行深入审查,并为书面反馈提供广泛宣传的公众意见征询期。
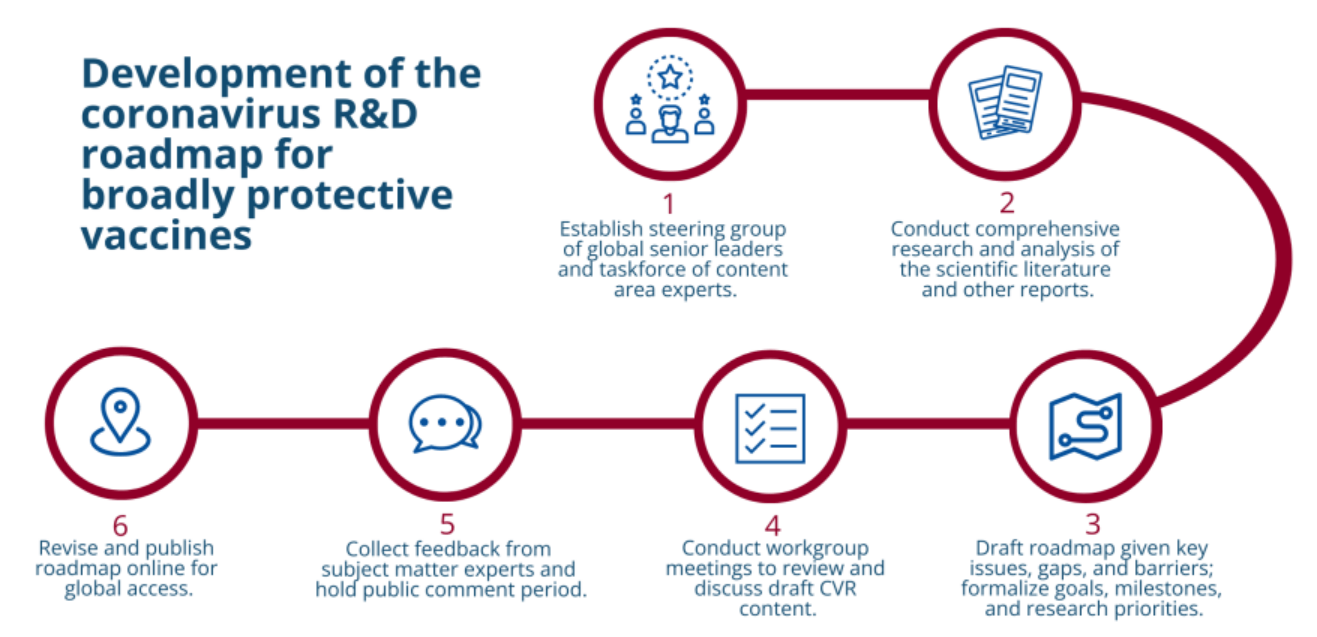
为了指导CVR的开发过程,CIDRAP聘请了比尔和梅琳达·盖茨基金会(Bill & Melinda Gates Foundation)的高级领导人组成的小型指导小组;洛克菲勒基金会;惠康信托基金;美国国立卫生研究院(NIH)的国家过敏和传染病研究所(NIAID);流行病防范创新联盟(CEPI);一些学术机构(包括爱荷华大学[美国]、北卡罗来纳大学[美国]、西奈山伊坎医学院[美国]和威特沃特斯兰德大学[南非]);以及Biologics Consulting,一家总部位于美国的咨询公司,在监管问题方面拥有专业知识。除指导小组外,CIDRAP还成立了一个由39家外部中小企业组成的全球CVR工作组,这些企业在疫苗开发方面提供了广泛的知识和经验。该工作组负责通过详细的在线讨论和文件审查,就CVR提供专家意见和评论。CVR 于 2022 年 10 月 24 日至 11 月 18 日在 CIDRAP 网站上发布以征询公众意见。每条意见都经过 CIDRAP 路线图开发团队认为适当的裁决并纳入最终路线图。
路线图愿景
加快开发持久、具有广泛保护作用的冠状病毒疫苗,这些疫苗:(1)适用于全球所有地区,包括偏远地区和低收入和中等收入国家(LMICs),(2)可以减少冠状病毒(包括已知感染人类的冠状病毒和出现前的病毒)引起的严重疾病和死亡(并可能预防感染),以及(3)将减轻未来冠状病毒流行或全球大流行的影响。
路线图实施
通过确定生产具有广泛保护性冠状病毒疫苗的研发重点,CVR旨在提供一个框架,为资助者、研究人员、政策制定者和行业领导者的决策提供信息。展望未来,需要为CVR制定正式的实施战略。关键利益攸关方必须成立一个协调监督小组或指导委员会,以加速和推进CVR里程碑。此外,还需要一个系统来监测和评估随着时间的推移实现CVR目标和里程碑的进展,并在必要时进行调整(称为监测、评估和调整[ME&A]计划)。
CVR术语的定义
路线图:一种战略计划,确定在特定时间范围内的关键活动,以实现总体目标,即推进安全有效的广泛保护性冠状病毒疫苗的开发。
障碍:可能影响冠状病毒疫苗开发各个阶段成功可能性的固有障碍或技术挑战;识别这些障碍有助于了解旨在实现研发(R&D)成果的活动的性质和范围。
差距:对新疫苗开发至关重要的关键未解决的问题或知识限制,可以通过有针对性的研发活动来解决。
战略目标:路线图的行动旨在在规定的时间范围内解决的长期高层次研究优先事项。
里程碑:为实现路线图的战略目标而采取的必要行动;里程碑包括完成的目标日期,并在可行的范围内反映了 SMART(具体、可衡量、可实现、现实/相关和时间敏感)标准。
高优先级里程碑:根据CVR指导小组和工作组的意见,被认为对推进冠状病毒疫苗研发至关重要的里程碑。
其他研究重点:与实现战略目标相关的其他主题和问题,但优先级不够高而无法被视为里程碑,或者不够具体或有时限,无法通过 SMART 标准确定。
介绍
冠状病毒的分类
冠状病毒是包膜的正义单链核糖核酸 (RNA) 病毒,包括四个属:α冠状病毒、β冠状病毒、γ 冠状病毒和 delta 冠状病毒。所有四个属都含有感染动物物种(主要是哺乳动物或鸟类)的病毒。通常已知只有甲型冠状病毒和乙角膜病毒会感染人类;然而,最近描述了猪 delta 冠状病毒向人类的人畜共患传播(Lednicky 2021)。
- 在甲冠状病毒属中,有两种病毒会引起人类疾病——人类冠状病毒 229E 和人类冠状病毒 NL63。两者都会引起轻度上呼吸道感染,与“普通感冒”的临床表现一致。此外,犬甲冠状病毒已被确定为多人患病的原因(Zehr 2022)。
- 在β冠状病毒属中,已经确定了五种导致人类疾病的病毒。这些病毒包括 SARS-CoV 和 SARS-CoV-2、MERS-CoV 以及两种引起轻度上呼吸道感染的病毒:人类冠状病毒 HKU1 和人类冠状病毒 OC43。
- 迄今为止,尚不清楚γ 冠状病毒会感染人类。
- 大多数 delta 冠状病毒也不会感染人类,但最近在几名患有急性未分化发热病的海地儿童的血浆样本中发现了人类猪 delta 冠状病毒毒株,这表明 delta 冠状病毒可能发生人畜共患传播给人类(Lednicky 2021)。
目前,β冠状病毒是公共卫生最关注的问题,因为该属包括导致人类严重疾病和死亡的三种病毒(SARS-CoV、SARS-CoV-2和MERS-CoV)。β冠状病毒包括五个亚属:embecoviruses(2a组)、沙贝病毒(2b组)、merbecovirus(2c组)以及hibecovirus和nobecovirus(2d组)(Zhu 2020)。人冠状病毒HKU1和人冠状病毒OC43属于栓子病毒亚属,SARS-CoV和SARS-CoV-2属于沙贝科病毒亚属,MERS-CoV属于分子病毒亚属。其他亚属(hibecovirus和nobecovirus)包含迄今为止仅在人类以外的动物中发现的病毒,并且很少有人努力表征这些2d组病毒。这一类病毒引起人类疾病的可能性仍然未知,不应被忽视。
人类中高致病性β冠状病毒的历史发生
SARS-CoV
2002 年 11 月,爆发了非典型肺炎疫情,2003 年初该地区又发现了其他疫情(Pieris 2003)。2003年2月和3月,新加坡和多伦多也发生了类似的疫情。当年3月,SARS-CoV被确定为这些疫情的病原体。在接下来的几个月里,该病毒传播到五大洲的 26 个国家,已发现的病例刚刚超过 8,000 例,死亡 774 人(Peiris 2003),在已确定的病例中,病死率约为 10%。
大多数病例与医疗机构的暴发有关,尽管有些病例与“超级传播者”事件有关。2004 年,发生了第二次 SARS-CoV 的独立溢出,但仅发现了 4 例病例(Wang 2005)。幸运的是,病毒通常在症状出现后才传播,这使得病毒可以通过传统的公共卫生和感染控制措施来遏制病毒。自 2004 年以来,没有发现其他 SARS-CoV 疫情,此后在动物宿主中没有发现该病毒,尽管在蝙蝠中发现了遗传密切相关的病毒(Ng 2017)。在临床前模型中开发和测试了几种针对 SARS-CoV 的疫苗,并启动了一些 1 期临床试验,但没有 SARS-CoV 疫苗超过这一点(Li 2020)。
中东呼吸综合征冠状病毒
中东呼吸综合征冠状病毒于2012年在沙特阿拉伯一名死于非典型肺炎的患者中首次被发现(Zaki 2012)。从那时起,病例继续以低发病率发生,主要发生在中东,特别是在沙特阿拉伯。在中东、北非、欧洲、北美和亚洲的27个国家发现了病例。截至 2022 年 11 月,全球已发现 2,600 多例病例,报告病例的病死率约为 35%(ECDC 2022)。发生人际传播(有症状和无症状);然而,传播既不有效也不可持续,因此病例尚未广泛传播。与 SARS-CoV 类似,疫苗已经在临床前模型中开发和评估,并且正在进行多项 1/2 期试验 (Li 2020)。
SARS-CoV-2
SARS-CoV-2 是当前大流行的病原体,于 2019 年底首次出现,并迅速传播到全球;世卫组织于 2020 年 3 月 11 日正式宣布 COVID-19 大流行 (Cucinotta 2020)。截至 2022 年底,全球已报告了超过 6.5 亿例病例,记录在案的死亡病例超过 660 万例,这些数字可能低估了疾病的真正负担。在报告病例中,全球总体病死率约为 1%(WHO 2022a),并且可能因国家和时间而异(约翰霍普金斯大学和医学院,2022 年)。然而,由于这种病毒的高传播性以及不断出现不同的关注变异株(VOC),这种病毒对公共卫生的影响要大得多,这些变异株具有更高的传播性,并且能够至少部分逃避(或多或少程度)抗体诱导的免疫保护免受先前感染或疫苗接种的影响。SARS-CoV-2 疫苗在大流行开始时被快速开发,疫苗于 2020 年 12 月首次获得紧急使用授权(美国 FDA 2021)。
冠状病毒的持续威胁
人类中许多新出现的病原体起源于野生动物宿主。有几个因素增加了人类与野生动物之间的互动,包括土地利用变化、自然生态系统的破坏、城市化进程加快、旅行、气候变化以及野生动物贸易和消费(Cunningham 2017,Irving 2021)。
随着人口的增加,从人畜共患宿主到人类的“溢出”事件的可能性也在增加;因此,我们可以预期未来会出现更多的新型病毒,包括冠状病毒。
蝙蝠是几种新出现的病毒病原体的主要宿主,包括埃博拉病毒、尼帕病毒、马尔堡病毒和亨德拉病毒。SARS-CoV 和 MERS-CoV 都可能起源于蝙蝠,后来适应了果子狸 (SARS-CoV) 和单峰骆驼 (MERS-CoV)(El Sayed 2021)。SARS-CoV-2的来源尚未明确确定;然而,蝙蝠和其他动物宿主扮演中间角色,仍然是最有可能的可能性(Worobey 2022)。在各种蝙蝠物种中已经发现了500多种冠状病毒(Chen 2014),一些研究人员估计在蝙蝠中可以发现超过3,000种冠状病毒(Anthony 2017)。马蹄蝠被认为是俄罗斯和中国SARS相关冠状病毒的主要宿主(胡 2017,阿尔霍夫斯基 2022)。此外,蝙蝠被认为是全球冠状病毒多样性的主要进化库和生态驱动因素(Anthony 2017)。鉴于冠状病毒可以迅速进化,并且许多是受体通才病毒,我们可以预期,致病性冠状病毒将在未来从蝙蝠宿主或某些中间宿主中出现(El Sayed 2021)。
沙贝病毒经常发生重组,这可能具有进化优势。例如,研究人员假设 SARS-CoV 的出现是由动物宿主内的重组事件引起的,该事件允许病毒与上皮细胞上的人血管紧张素转换酶 2 (hACE2) 受体位点结合,这是病毒进入的主要靶点(Wells 2021)。除蝙蝠外,沙贝病毒科病毒感染多种宿主物种的能力为合并感染、突变和重组创造了机会,这可能导致具有大流行潜力的新型沙贝病毒科病毒的出现(Wells 2021,任 2008)。然而,由于在基因上与 SARS-CoV 和 SARS-CoV-2 非常相似的 SARS 样毒株在自然界中传播,因此持续的威胁已经存在,并不一定取决于未来的随机重组事件。
最近的研究表明,SARS-CoV-2 可以在自然环境中感染多种动物物种,包括狗、家猫、大型野猫(老虎、狮子等)、大猩猩、雪貂、水貂和白尾鹿(Goraichuk 2021、Meisner 2022、Pickering 2022、Sharun 2021、Tan 2022、Telenti 2022 ).基于宿主物种中血管紧张素转换酶-2(ACE2)受体的存在,其他动物也可能有感染的风险。鉴于该病毒具有跳跃物种的潜力,SARS-CoV-2有可能与其他冠状病毒进行重组,从而产生一种具有新大流行潜力的新型病毒。此外,人类可以将病毒传播给其他物种,例如家养宠物、水貂和鹿(反向人畜共患传播或人畜共患病)。
冠状病毒在人类中具有高度致病性,MERS-CoV 的 CFR 约为 35%,SARS-CoV 的 CFR 约为 10%。幸运的是,MERS-CoV和SARS-CoV在人与人之间的传播效率低于SARS-CoV-2;然而,我们不能排除未来从蝙蝠或中间宿主中出现高致病性和高传播性冠状病毒的可能性。鉴于冠状病毒构成的持续威胁,需要广泛的保护性疫苗来防止出现更多的SARS-CoV-2变异株和未来具有大流行潜力的新型冠状病毒。
开发和使用广泛保护性冠状病毒疫苗的策略
预防感染与预防严重疾病
广泛保护性冠状病毒疫苗研发的一个重要考虑因素是定义“保护”的含义。理想情况下,未来的冠状病毒疫苗将防止感染,这样做不仅可以预防疾病,还可以阻止传播。这种方法将降低人群中传播病毒的水平。现有的 SARS-CoV-2 疫苗通常不能预防感染(部分取决于疫苗、自上次接种以来的时间以及变体暴露情况),而是主要预防严重疾病和死亡(Wahl 2022)。这使得 SARS-CoV-2 病毒能够继续传播,进而导致病毒诱变和重组,并有可能出现新的 VOC。然而,制造阻断传播的疫苗具有挑战性,可能需要上呼吸道和下呼吸道产生强烈的粘膜免疫反应。随着下一代冠状病毒疫苗的首选产品特性的确定,阻断传播可能被认为是理想的或最佳的,而预防重症和死亡仍将是更现实的目标。
保护的广度 研究人员在开发具有广泛保护性的冠状病毒疫苗时可以考虑多种选择,包括:
- “防变异”SARS-CoV-2疫苗:这些疫苗将预防所有SARS-CoV-2变异株,包括已经出现的和未来可能出现的变异株。
- 可预防多种 沙贝病毒es沙贝病毒的疫苗:这些疫苗将包括针对 SARS-CoV 和 SARS-CoV-2 变体的保护,并可能针对其他新型沙贝病毒。
- 预防多种β冠状病毒的疫苗:这些疫苗将预防β冠状病毒,包括SARS-CoV、SARS-CoV-2、MERS-CoV、引起轻度疾病的疫苗,以及人畜共患病宿主中可能溢出到人类体内的“前期”β冠状病毒。
- 可预防多种冠状病毒的疫苗(也称为“通用”冠状病毒疫苗):此类疫苗将预防所有冠状病毒属的代表性病毒,包括较温和的“普通感冒”物种和具有大流行潜力的新型新冠病毒。
尽管β冠状病毒是目前最受关注的问题,但绝不应将α冠状病毒或其他冠状病毒引起严重人类疾病的可能性降到最低。因此,疫苗开发的循序渐进的方法可能是最实用的策略。这种方法将从最高优先级的病毒开始,然后随着新的科学信息和技术解决方案的出现,随着时间的推移逐渐扩大覆盖范围。例如,针对 SARS-CoV-2 变体的疫苗将是最高优先级,其次是针对所有沙贝病毒的疫苗,然后是针对 merbecoviruses,然后是所有 β 冠状病毒,最后是针对所有四个属的多种冠状病毒的疫苗。
在设计适用于上述一个或多个类别的广泛保护性冠状病毒疫苗时,可以采用不同的方法。对于下一代 SARS-CoV-2 疫苗,主要策略是确定产生针对 SARS-CoV-2 变体保守区域的广泛中和抗体的免疫原。此类疫苗可以潜在地利用 SARS-CoV-2 病毒主要与人类上皮细胞上的 hACE2 受体结合这一事实。宿主细胞结合是通过病毒刺突 (S) 糖蛋白上的受体结合域 (RBD) 介导的,该糖蛋白似乎相对免疫显性,并且针对该区域的中和抗体似乎抑制宿主中的受体附着——尽管 RBD 中存在较大的突变空间,可以逃避抗体但仍保留 ACE2 结合活性。
由于并非所有沙贝病毒都使用 hACE2 作为宿主受体,因此寻找具有广泛保护作用的沙贝病毒疫苗变得复杂(Wells 2021)。然而,S 蛋白上可能存在其他免疫原性表位(例如,在 RBD、N 末端结构域 [NTD] 或 S1 亚基或 S2 亚基的亚结构域内),这些表位在 沙贝病毒es 之间共享;因此,有必要进一步努力鉴定这些表位(Yuan 2020)。例如,最近的几项研究发现,带有佐剂的 SARS-CoV-2 RBD 和刺突纳米颗粒引发了针对 SARS-CoV、几种 SARS-CoV-2 变体和几种蝙蝠冠状病毒的交叉中和抗体反应(Joyce 2022,Saunders 2021)。 最近另一项针对仓鼠和小鼠的研究发现,使用基于 S2 的纳米颗粒疫苗进行免疫接种可引发针对 SARS-CoV-2 变体、SARS-CoV 和四种地方性人类冠状病毒的广泛交叉反应抗体(Halfmann 2022)。此外,Fc 受体 (FcR) 介导的交叉保护性免疫反应在通用泛沙贝病毒疫苗设计中可能至关重要(Adams 2022,Mackin 2022)。 开发广泛保护性沙贝病毒科病毒疫苗的另一种方法是生产含有来自沙贝病毒科病毒亚属内不同分支的多种代表性免疫原的疫苗,例如通过开发嵌合刺突疫苗或镶嵌/多重纳米颗粒疫苗(Cohen AA 2021、Cohen J 2022、Martinez 2021、Walls 2021、Wuertz 2021 )。该策略也正在研究用于生产具有广泛保护性的流感疫苗(Arevalo 2022,Pecetta 2022a)。 使用不同免疫原的初免加强策略可能为制造具有广泛保护性的沙贝病毒疫苗提供第三种选择(Tan 2021)。最后,使用T细胞表位和非结构蛋白作为免疫原可能是另一种选择。
类似的方法可用于开发具有广泛保护性的β冠状病毒疫苗。例如,最近的一项研究确定了一种单克隆抗体,该抗体与来自八种 β 冠状病毒的 S 糖蛋白发生交叉反应,包括所有已知对人类具有致病性的五种 β 冠状病毒(Sauer 2021)。诸如此类的研究表明,有可能在不同冠状病毒属中鉴定出具有广泛保护性和免疫原性的表位。或者,结合来自不同病毒组的免疫原的多价方法可能有助于开发跨属广泛保护的疫苗。

使用具有广泛保护性的新冠病毒疫苗
使用具有广泛保护性的冠状病毒疫苗可以考虑几种策略。
- 最广泛的方法是将具有广泛保护性的冠状病毒疫苗作为常规儿童或成人疫苗接种计划(预防性使用)的一部分。如果能够开发出更持久的疫苗(即持久性为一年或更长时间),则该策略将是一种选择,并且如果导致显着发病率和死亡率的新 SARS-CoV-2 变体随着时间的推移继续在全球人群中传播,则该策略可能很重要。这种方法还允许通过自然传播当代 SARS-CoV-2 毒株和其他冠状病毒来连续加强。
- 另一种方法是使用这些疫苗来加强大流行防范,方法是提供疫苗,如果这些病毒从动物宿主中出现,则可以预防具有大流行潜力的新型冠状病毒(反应性使用)。这种疫苗可以储存足够数量,以便在疫情暴发时尽早使用,以迅速阻断传播并防止升级为大流行,并根据需要迅速扩大生产规模。这种方法限制了生产新疫苗所需的滞后时间。
- 第三种选择是前两种选择的混合,其中可以建议某些接触新型或现有冠状病毒的高风险群体或重症高风险个体使用常规预防性疫苗,而如果出现并传播新型病毒,则可以保留对普通人群的反应性使用。例如,可以考虑在中东呼吸综合征冠状病毒流行地区为卫生保健人员和动物工作者常规接种具有广泛保护性的疫苗,以预防该病毒。
随着这些疫苗的开发,在研发过程中应考虑某些关键属性。例子包括:(1)价格合理,适用于世界所有地区,包括中低收入国家;(2)能够预防重症,预防所有沙贝病毒和美甲病毒,并引起快速而强大的免疫反应;(3)对已有免疫力的人具有免疫原性;(4)公众可接受的安全概况;(5) 适用于所有年龄组、免疫功能低下人群、孕妇和其他特殊人群(Morens 2022);(6)耐久性(至少1年);(7)一剂(或仅几剂)有效。阻断传播的能力是另一个理想的属性,但需要更多的科学发现来生产阻断传播的疫苗(Morens 2022)。
主题1:适用于疫苗开发的病毒学
本节总结了与开发广泛保护性冠状病毒疫苗相关的病毒学问题。需要使用标准化的工具和方法更好地了解冠状病毒在全世界人类和动物宿主中的全球分布,以指导明智的研发战略。收集、表征和共享病毒信息的协调和持续努力将加快疫苗开发的进展。
问题:冠状病毒分布于全球,冠状病毒宇宙尚未得到很好的描述。
障碍
- 冠状病毒具有在广泛但尚未完全定义的宿主范围内和之间轻松传播的能力(Millet 2021、Morens 2022、Singh 2021)。由于它们在各种地理环境和不同的宿主物种中广泛存在,通过采样和测序更好地表征该病毒家族的努力本质上是复杂的(Ghai 2021、Morens 2022、Terrier 2021)。
- 蝙蝠(可能在较小程度上是啮齿动物)被认为是冠状病毒的主要人畜共患宿主,其他物种可能作为中间宿主(Frutos 2021,Sánchez 2022)。蝙蝠分布在七大洲中的六大洲,是第二大生物多样性的哺乳动物目,已鉴定出 1,400 多种。此外,在蝙蝠中发现了500多种冠状病毒(Chen 2014),研究人员认为实际数量可能超过3,000种(Anthony 2017)。这种非凡的多样性和广泛的地理范围给全球表征蝙蝠库内冠状病毒的努力带来了重大挑战(Lattine 2020,Ruiz-Aravena 2022)。
- 除了蝙蝠和啮齿动物之外,其他各种哺乳动物和鸟类可能携带着未被发现的新型冠状病毒,这使了解冠状病毒宇宙的努力进一步复杂化。
- SARS-CoV-2 已从人类传播给许多动物物种,例如水貂、白尾鹿、驯养宠物(即猫和狗)和大型猫科动物(Goraichuk 2021、Meisner 2022、Pickering 2022、Tan 2022、Telenti 2022),这为理解冠状病毒生态系统增加了另一层复杂性。
- 在所有拥有单峰骆驼的地区都发现了聚甲病毒传播的证据,但对人类的溢出主要发生在阿拉伯半岛国家,尽管非洲也可能发生溢出(周,2021 年)。对不同溢出潜力的一种可能的解释是不同地区存在遗传和表型多样化的MERS冠状病毒(周 2021,周 2023),但需要更多的工作来了解MERS冠状病毒的多样性及其人畜共患潜力。
- 进一步界定冠状病毒领域的努力对全球健康和安全至关重要;然而,涉及潜在大流行性病原体的研究引发了对生物安全和生物安保的质疑和担忧。必须考虑并适当减轻这些风险,以确保安全的研究环境(美国 DHHS,2017 年)。
差距
- 虽然最近已经努力扩大对野生和圈养动物的冠状病毒采样,但需要进一步的工作来提高对该病毒家族的地理分布、病毒多样性、宿主范围和流行率的理解,并将这些信息与人类监测数据联系起来,并最终与疫苗研发联系起来(Baric 2022, Keusch 2022、MacLean 2021、Morens 2022、Terrier 2021)。
- 虽然蝙蝠可能是主要的宿主,但其他动物宿主可能在蝙蝠和人类之间发挥重要的中间作用(Ghai 2021,Terrier 2021);因此,需要提高对中间动物宿主的理解,以更好地定义溢出事件对人类的风险(Morens 2022、Ruiz-Aravena 2022、Terrier 2021)。
- 需要进一步鉴定和表征各种冠状病毒,以指导协调、知情的病毒株选择过程,以研究旨在开发具有广泛保护性的冠状病毒疫苗(Baric 2022)。
- 为了实现这一目标,一个关键的考虑因素是确定菌株的系统发育和抗原多样性程度,以确保疫苗研发的覆盖范围足够广。因此,有必要从不同属获取病毒,以获得具有潜在溢出到人群中的冠状病毒的代表性样本。
- β冠状病毒被认为具有很高的溢出风险;因此,特别需要开展研究活动来更好地表征这些病毒。2d 组 β 冠状病毒(组状病毒和诺贝科病毒)通常不可用于研究,并且 2c 组 β 冠状病毒(美甲病毒)的病毒库存有限。必须纠正这种情况,以开发有效的广泛保护性β冠状病毒疫苗。
- 可用于研究的广泛冠状病毒可以促进存在于不同冠状病毒物种中的保守 B 细胞和 T 细胞表位的发现和表征,这可能是广泛保护性疫苗研发的关键问题(Baric 2022、Morens 2022、Starr 2021)。(参见免疫学和保护的免疫相关性。
- 血清学研究对于提高对不同物种和地理环境中冠状病毒暴露的频率和规模的理解非常重要。对野生和圈养动物的血清调查可以发现潜在的宿主,这将为随后的风险评估提供信息。对人群进行血清调查,特别是那些与已知和潜在动物宿主密切接触的人,将增强对暴露频率和相关风险因素的理解(Morens 2022、Ruiz-Aravena 2022、Sánchez 2022)。
- 在实验室中培养和研究蝙蝠源性冠状病毒的一个局限性是总体上缺乏可获得的试剂(例如可以促进病毒分离的细胞培养试剂)和容易对一系列蝙蝠源性冠状病毒敏感的多种细胞系(Letko 2020a,Ruiz-Aravena 2022)。
- 另一个限制是缺乏可供学术研究人员使用的生物安全等级 (BSL)-3 设施。
- 需要协调资金计划和资源来开展必要的研究活动,以加强该领域的科学发现。鉴于不同地区冠状病毒的多样性,此类计划应包括对中低收入国家研究能力建设的投资。
问题:冠状病毒经常发生突变和重组,这使得理解和跟踪宿主范围和病毒传播变得复杂。
障碍
- 冠状病毒的广泛地理分布、广泛的宿主、蝙蝠种群的特定生态和行为以及较大的基因组规模为冠状病毒发生突变和重组提供了充足的机会(Morens 2022、Terrier 2021、Zhu 2020、Forni 2017、Kistler 2021、Millet 2021).这种耐受变化的总体倾向也适用于刺突蛋白(特别是 S1 亚基),最终使在不牺牲病毒适应性的情况下在抗原位点内或附近发生明显修饰的可能性成为可能(Cotten 2021,Telenti 2022)。
- 不同冠状病毒在同一地理区域的宿主物种之间共同传播,以及蝙蝠等不同宿主物种共享栖息地,增加了合并感染和随后重组事件的可能性(Latinne 2020、Ruiz-Aravena 2022、Wells 2021)。有证据表明,某些蝙蝠种群——它们可以生活在大群落中,并与其他物种共享人口稠密的栖息地——经常经历涉及一种或多种冠状病毒的合并感染(Ruiz-Aravena 2022)。合并感染可以促进病毒对新宿主和生态环境的快速适应(Forni 2017、Telenti 2022、Woo 2009)。
- 对至少几种人类冠状病毒(包括 OC43、229E 和 SARS-CoV-2)的选择性压力是动态的,能够改变抗原位点(Cameroni 2022、Eguia 2021、Kistler 2021)。
- 由于缺乏可用的工具、执行此类工作所需的高水平技术专长、耗时的性质以及相关成本,目前对冠状病毒进行表型表征的能力受到限制(Letko 2020a、Letko 2020b)。 反过来,总体上缺乏功能表征限制了基因组测序数据的解释,并延迟了对与人畜共患潜力和毒力等性状相关的病毒因子的理解(Letko 2020a,Telenti 2022)。
- 信息、样本和试剂的全球监测和共享受到世界各地不同立法程序的阻碍。《名古屋议定书》的引入在不同地区有不同的解释,已将其扩展到生态采样(CBD 2011,Ribeiro 2018)。
差距
- 需要一组强大的小型和大型人类疾病动物模型,包括概括严重人类急性和慢性疾病的模型。
- 需要开展长期合作,对全球多个不同地区的各种动物物种的冠状病毒进行基因组测序,以便为冠状病毒监测和风险评估提供信息,以确定具有大流行潜力的冠状病毒。生成开放、可访问、标准化(包括元数据)和彻底的病毒测序数据将允许进行高通量分析,最终有助于弥合冠状病毒病毒组中存在的系统发育差距,并说明不同人群和地理环境中存在的多样性(Baric 2022、Chen 2022、Morens 2022)。
- 投资于资源和全球倡议,以加快冠状病毒的功能表征,对于破译基因型和表型之间的关系以及识别可以改变并可能增强传播性、免疫逃避和毒力等特征的遗传标记非常重要(Forni 2017、Letko 2020a、Obermeyer 2022、Terrier 2021、Oude Munnink 2021)。
问题:令人感兴趣、关注和后果严重的 SARS-CoV-2 变体可能会继续出现,需要加大力度实时跟踪病毒系统发育进化。
障碍
- 随着时间的推移,SARS-CoV-2 的持续传播和适应性表现为多个 VOC 和后代亚变体的出现。迄今为止出现的 VOC 都是独立完成的,每个 VOC 都利用其独特的突变群赋予的特征来胜过先前流行的变体(Obermeyer 2022,Telenti 2022)。
- SARS-CoV-2 刺突蛋白具有抗原位点发生显着变化的高倾向性,多种 VOC 和后代亚变体对现有疫苗和治疗方法的有效性有显着影响,尤其是在预防或治疗不太严重的疾病方面(Hachmann 2022,Mannar 2022)。
- 通过疫苗接种或既往感染实现的人群免疫力的提高,可能会对抗原进化施加选择性压力(Harvey 2021、Markov 2022、Yewdell 2021a)。
- 持续感染,特别是在免疫功能低下的宿主中,可能通过宿主内重组或病毒进化导致新变种的出现(Simons 2022)。
- 各国和全球各地区在系统基础设施、专业知识、人力和财力资源以及总体测序和监测能力方面存在差异,限制了为改善SARS-CoV-2全球基因组监测而采取协调一致的努力(Chen 2022,Houtman 2022)。即使基础设施、资金和专业知识可用,此类企业使用的技术差异也会减慢数据周转时间,并且相关成本可能会限制容量。
- 涉及 SARS-CoV-2 和其他新出现的冠状病毒的研究必须在 BSL-3 实验室进行,这带来了挑战。此外,各国的生物安全水平各不相同,表明需要协调生物安全条例。
- SARS-CoV-2 的基因组监测数据可通过全球流感数据共享倡议 (GISAID)、国际核苷酸序列数据库协作 (INSDC) 和其他平台获得,但这些数据不一定准确、标准化或彻底。INSDC还包含其他冠状病毒的数据,并具有元数据标准,但信息通常不完整。
- 由于担心公众形象、边境关闭的可能性和经济影响,各国可能不愿意与全球科学界迅速分享冠状病毒基因组或流行数据(Mendelson 2021,Ribeiro 2018)。
- SARS-CoV-2 在人类和动物种群中广泛而持续地传播引发了与其他冠状病毒重组的理论可能性(Telenti 2022),这可能会传播具有意想不到的特征的病毒。此外,SARS-CoV-2 在一系列野生动物和家养动物中持续传播存在长期宿主的风险,可能导致不同或重组菌株并溢出到人类中(Peacock 2021、Pickering 2022、Rabalski 2022、Sila 2022)。
- 中东呼吸综合征冠状病毒在阿拉伯半岛和非洲这两个不同地理区域的骆驼中持续传播,也为进一步进化和多样化提供了机会,并具有潜在的人畜共患溢出效应和适应风险。
- 由于缺乏标准化的变异命名法,再加上序列在多个数据库和平台上提供,系统之间没有一致性,也没有发布原始信息,混淆了SARS-CoV-2可用测序数据的解释和代表性(Chen 2022,柳叶刀2021)。
差距
- 虽然在 COVID-19 大流行期间,在扩大全球进行 SARS-CoV-2 基因组测序的能力方面取得了进展(特别是在中低收入国家和其他资源匮乏地区),但需要实时做更多工作来生成有意义的基因组监测,更全面和具有代表性地了解 SARS-CoV-2 的分布和进化,并了解抗原变化的影响。这些举措产生的数据对于评估现有SARS-CoV-2疫苗的有效性和确保未来的候选疫苗能够预防抗原漂移的变异株非常重要。
- 在已经存在这种能力的地区(包括自 COVID-19 出现以来的扩展),应维护系统,并且需要更好地了解限制测序和数据共享的具体障碍和瓶颈(Babady 2022,Keusch 2022)。 此外,需要制定战略来建立与现有计划相结合的实验室能力,以改进系统,同时保护有限的资源。最近的信息表明,全球对 SARS-CoV-2 的监测正在下降,这将使世界没有准备好面对新的 SARS-CoV-2 变体或为下一次大流行做准备(经济学人 2023 年)。
- 尽可能将原始的、标准化的基因组测序数据和元数据上传到公共数据库作为规范,将提高准确解释测序数据、批判性评估数据集的能力,并为质量保证提供机会。
- 应随着时间的推移评估《名古屋议定书》(CBD 2011)对病毒共享和新型冠状病毒疫苗发展的影响,包括国家获取和惠益分享立法的影响(Babady 2022,Mueni Katee 2021,世卫组织2017)。
- 努力扩大计算和机器学习工具的使用来分析基因组序列数据集,可以提高预测SARS-CoV-2病毒进化的能力,这可能有助于针对广泛保护性冠状病毒疫苗的疫苗研发(Telenti 2022)。
- 应广泛鼓励基因组数据和关联表型数据的开放共享(Harrison 2021)。
问题:冠状病毒可以与不同的细胞受体结合,宿主细胞受体的广度和特异性尚未完全阐明。
障碍
- 冠状病毒刺突蛋白能够与动物和人类中的多种细胞受体结合,这有助于促进其广泛的宿主范围(Forni 2017、Kistler 2021、Millet 2021、Tan 2022、Zmasek 2022)。 例如,SARS-CoV 和 SARS-CoV-2 利用 ACE2 受体,MERS-CoV 使用二肽基肽酶 4 (DPP4) 受体。对于许多冠状病毒,宿主细胞受体尚未表征。
- 受体结合似乎是一种可进化的特征,分析表明 SARS-CoV-2 可能通过重组(Tan 2022、Wells 2021、Xiong 2022)或可能通过从常见祖先菌株进化而获得使用 hACE2 的能力。值得注意的是,有证据表明,非ACE2使用冠状病毒与使用ACE2的冠状病毒在同一地理区域传播,这带来了改变受体使用和改变宿主范围的风险。最近,已经确定了使用 hACE2 受体而不是 DPP4 的 MERS-CoV 相关病毒,这强调了受体使用的“滥交性”,并强调了这些病毒持续存在的潜在人畜共患威胁(Xiong 2022)。此外,许多沙贝病毒RBD 可以获得结合以从单个氨基酸变化中选择 ACE2 受体的能力 (Starr 2022)。SARS-CoV-2 的持续进化证明了这种延展性,其扩大的宿主细胞受体趋向性周期性与新出现的 VOC 相关(Shuai 2021)。
- 除了细胞-受体结合外,一系列未定义的附加宿主细胞因子(如蛋白酶)通常在病毒进入中发挥重要作用(MacLean 2021,Millet 2021)。
差距
- 需要进一步的研究来:
- 确定不同冠状病毒结合的主要宿主细胞受体(Ghai 2021)。特别是,定义使用 ACE2 的冠状病毒的范围可以提高评估人畜共患风险的能力(Wells 2021)。例如,在蝙蝠和穿山甲中发现的冠状病毒具有与 SARS-CoV-2 非常相似的 RBD,它们很容易与 hACE2 结合(Holmes 2021、Seifert 2022、Telenti 2022、Temmam 2022)。 进一步了解宿主受体结合的全范围对于开发广泛保护性疫苗非常重要。
- 确定宿主细胞受体和其他因素(如蛋白酶)的存在与否,这些因素对病毒进入很重要,并绘制它们在不同物种和不同组织类型中的分布图,以确定组织趋向性(塞万提斯 2022、胡 2021、小米 2021、鲁伊斯-阿拉维纳 2022)。
主题1的战略目标和一致的里程碑:适用于疫苗研发的病毒学
| 战略目标1.1:加强和维持识别、表征和分享全球研究人员感兴趣、关注和影响重大的SARS-CoV-2变异株的能力。 |
| 里程碑 1.1.a:到 2023 年,启动必要的风险评估和决策流程,以确定某些 SARS-CoV-2 谱系或克隆是否可以安全地从 BSL-3 重新分类为 BSL-2,以及在什么条件下。 |
| 里程碑1.1.b:到2023年,制定一项战略,确保在COVID-19大流行期间形成的对人类样本的SARS-CoV-2病毒进行基因组测序的全球能力能够随着时间的推移而保持,特别是在资源匮乏的环境中。 |
| 里程碑1.1.c:到2023年、2023年,标准化SARS-CoV-2基因组测序数据和元数据(包括命名法),旨在提高准确性解释和使用。 |
| 里程碑 1.1.d(高优先级):到 2024 年,制定一个财务上可持续的合作国际计划,以实时快速识别、表征和共享有关 SARS-CoV-2 病毒的信息,包括抗原信息,并有可能建立在现有系统的基础上,例如世卫组织的全球流感监测和应对系统 (GISRS)(WHO 2022b、Harvey 2021、Subbarao 2021)。 |
| 战略目标1.2:改进对冠状病毒的表征,以确定必要的毒株多样性,以确保疫苗研发的覆盖范围足够广。 |
| 里程碑1.2.a:到2024年,为涉及致病性未知冠状病毒的实地和实验室研究建立国际最佳实践和标准操作程序,以确保将生物安全和生物安保风险降至最低。 |
| 里程碑1.2.b:到2024年,启动旨在:(1)确定其他蝙蝠衍生冠状病毒(特别是2d组β冠状病毒)和(2)生成研究此类病毒所需的关键试剂。 |
| 里程碑1.2.c(高优先级):到2024年,制定一种共识方法,对冠状病毒进行优先排序和选择,这些冠状病毒将构成一个最佳多样化的小组,用于疫苗研发,以评估保护的广度(Baric 2022)。选择标准最初应侧重于以下 α 冠状病毒和 β 冠状病毒:(1) 使用 hACE2 受体,(2) 在原代人类细胞中生长,(3) 具有遗传多样性,(4) 具有抗原特性,以及 (5) 具有可供研究的菌株。 |
| 里程碑 1.2.d:到 2024 年,制定一个协调一致的国际框架,以加强对地理不同地区的野生和圈养动物种群(尤其是蝙蝠)的采样,以提高对全球冠状病毒分布、病毒多样性、宿主范围和流行率的了解(Baric 2022、Morens 2022、Terrier 2021)。 |
| 里程碑 1.2.e:到 2024 年,确保提供评估重点冠状病毒所需的试剂,例如用于抗原表征的参考单克隆抗体,包括沙贝病毒(2b 组)和美甲病毒(2c 组)(Letko 2020a,Ruiz-Aravena 2022)。 |
| 里程碑 1.2.f(高优先级):到 2024 年,至少生成一个初始病毒库存组合,其中包含不同的冠状病毒和容易对多种冠状病毒敏感的多种细胞系,并使从事冠状病毒疫苗研发的研究人员可以使用该组合(Letko 2020a,Ruiz-Aravena 2022)。 |
| 里程碑1.2.g:到2025年,开发在高危人群中进行血清监测研究所需的血清学平台(基于可能对人类健康构成风险的多种冠状病毒),以确定表明可能从动物蔓延到人类的信号。 |
| 里程碑 1.2.h:到 2025 年,建立一个全球血清调查方法框架(包括要研究的人群),以同步研究设计。 |
| 战略目标1.3:增进对动物源性冠状病毒随时间推移的系统发育进化的理解。 |
| 里程碑 1.3.a:到 2024 年,启动并实施一项协作、协调和可持续的工作,对在全球多个地区采样的相关动物物种的冠状病毒进行基因组测序,并确保生成的病毒测序数据可以通过标准化元数据公开访问(Baric 2022、Chen 2022、Morens 2022)。 |
| 战略目标1.4:提高对冠状病毒宿主细胞受体广度的理解。 |
| 里程碑 1.4.a:到 2026 年,确定不同冠状病毒样本结合的宿主细胞受体,最初重点关注重点病毒,例如 β 冠状病毒,以确定不同受体的物种分布(Ghai 2021)。 |
| 里程碑1.4.b:到2027年,一旦确定了不同冠状病毒的宿主细胞受体,就确定哪些存在于人类中(胡 2021,小米2021,Ruiz-Aravena 2022)。对于人类中的那些,评估人类和常用动物模型中各种组织类型的分布,以确定组织趋向性。 |
其他研究重点
- 继续实时和随着时间的推移获得更多的SARS-CoV-2分离株,并确保合适的研究人员能够平等地获得这些分离株,这可以扩大表型表征。
- 对地方性季节性人类冠状病毒进行额外分析,以进一步了解冠状病毒进化的途径和机制。
- 对各种冠状病毒的基因组序列数据进行持续的高通量分析,以弥合冠状病毒宇宙中存在的系统发育差距,并提高对这些病毒抗原多样性的理解。
- 当发现其他病毒时,定期更新必要试剂的供应。
- 扩大基因组序列数据集的计算和机器学习工具的使用范围,以提高预测 SARS-CoV-2 病毒进化的能力。
- 确保SARS-CoV-2序列的原始基因组测序数据尽可能容易和广泛地获取。
- 扩展冠状病毒的功能表征,以提高对冠状病毒基因型和表型之间关系的理解(Forni 2017、Letko 2020a、Obermeyer 2022、Terrier 2021)。
- 继续建设开展病毒学监测的全球基础设施和能力,特别是在中低收入国家。
- 继续评估《名古屋议定书》对病毒共享和新型冠状病毒疫苗推进的影响(如果有的话)。
主题2:免疫学和免疫保护相关性
本节总结了人类免疫学科学开发广泛保护性冠状病毒疫苗所需的进展。主要研究领域包括确定扩大免疫保护的广度和持久性的因素;表征预防冠状病毒感染、疾病和传播的全身免疫和粘膜免疫机制;并确定保护的免疫相关性。化验、标本采集和研究方法的标准化、改进的信息共享以及虚拟生物储存库的创建将促进合作并加速科学发现。
问题:需要更好地了解与 SARS-CoV-2 感染相关的粘膜和全身免疫机制以及广泛保护性冠状病毒疫苗的开发。
障碍
- 对 SARS-CoV-2 和其他冠状病毒的先天性和适应性免疫反应涉及复杂、相互关联的生理机制和生物标志物,而这些机制和生物标志物尚不充分了解。关于对冠状病毒感染的保护性和交叉保护性免疫以及疫苗接种引起的免疫的性质,仍然存在基本问题(Aguilar-Bretones 2023、Diamond 2022、Siggins 2021)。
- 各种宿主和环境因素,如年龄、性别、合并症和地理位置,都会影响对病毒抗原的保护性免疫反应,这可能会使广泛保护性冠状病毒疫苗的研究复杂化(Tomalka 2022)。
- 粘膜免疫对于防止冠状病毒感染和传播可能很重要,因为冠状病毒是呼吸道病原体,没有专性病毒血症传播(即,通过淋巴和血液从初始感染部位传播,这是发病机制或传播的必要步骤)(Yewdell 2021b,Morens 2023).这带来了许多重要的挑战,因为粘膜免疫保护的作用没有得到很好的阐明,刺激和测量粘膜免疫的策略也没有(岩崎 2016,Lavelle 2022,毛 2022,Morens 2023)。
- 获得适当和足够的临床样本来研究与冠状病毒感染相关的粘膜和全身免疫可能具有挑战性(Logue 2022)。
差距
- 需要对先天性和适应性免疫有更深入的了解,这对于开发控制 COVID-19 等呼吸道感染的疫苗至关重要(Sette 2021),特别是在预防严重疾病以及减少有症状的疾病和传播方面。具体而言,需要信息来澄清以下内容:
- 先天免疫如何影响对 SARS-CoV-2 感染的适应性(B 细胞和 T 细胞)免疫反应,例如确定建立长寿命浆细胞、记忆 B 细胞和记忆 T 细胞的信号通路(Tomalka 2022、Sette 2021)。
- 通过刺激先天“训练有素”的免疫力来提高对冠状病毒的保护范围的潜力(Mettelman 2022、Verbeke 2022、Ziogas 2022)。
- 对 SARS-CoV-2 病毒感染和疫苗接种(以及其他冠状病毒)适应性免疫的三个主要成分(B 细胞、CD4 T 细胞和 CD8 T 细胞)的作用,重点是它们的特定功能和动力学(Moss 2022、Sette 2021、Sette 2022、Wherry 2022)。这包括特别关注关键亚群的作用,例如 T 滤泡辅助细胞、调节性 T 细胞、记忆 T 细胞和记忆 B 细胞(Kent 2022、Moss 2022、Tarke 2022、Yu D 2022、Zheng 2021)。
- 佐剂在介导先天性和适应性免疫反应之间相互作用中的作用和机制(Carmen 2021,Lee 2022)(例如,通过 CD4 T 细胞激活驱动反应的广度)(Joyce 2022)。
- 粘膜免疫与全身免疫在预防冠状病毒感染和限制病毒传播潜力方面的相对作用(Mettelman 2022、Mostaghimi 2022、波兰 2021)。
- B 细胞在病毒清除、限制有症状或严重疾病、产生强大的免疫记忆以及产生对不同病毒变体的保护性免疫反应中的作用 (Qi 2022)。
- 抗体介导的保护性免疫,包括中和抗体反应保护水平的阈值、非中和抗体的潜在作用以及 B 细胞和 T 细胞成分之间的协调机制(Khoury 2022)。
- T 细胞的作用是:病毒清除、在没有血清转化的情况下预防感染、限制感染后的疾病程度、产生强大的免疫记忆以及对不同的病毒变体做出反应(Grifoni 2022,Wherry 2022)。
- 抗体、B 细胞和 T 细胞在降低传播风险中的作用(van Kampen 2021)。
- 确定对原发性 SARS-CoV-2 感染的最佳协调细胞免疫反应的特征,并确定减少严重疾病和防止传播所需的最佳疫苗诱导的细胞免疫反应,这反过来可以防止新的病毒变体的出现(Moss 2022)。
- 对不同疫苗结构的免疫反应,包括在混合免疫的背景下,以及给药策略,包括不同的途径,如鼻内、口服、吸入、透皮和肌肉注射。特别令人感兴趣的是组织驻留记忆(TRM)上呼吸道和下呼吸道 B 细胞群和 T 细胞群中的细胞(Mettelman 2022,Nelson 2021)。
- 鉴于 VAED 在某些罕见情况下与其他病毒一起存在的历史证据,潜在的疫苗相关疾病增强 (VAED) 的免疫机制,例如嗜酸性粒细胞免疫病理学,在 SARS-CoV-2 感染或疫苗接种的背景下(Bigay 2022、Bolles 2011、DiPiazza 2021、Gartlan 2022、Munoz 2021).这对于引发抗体反应的疫苗可能尤为重要,这些抗体反应超出了迄今为止对SARS-CoV-2疫苗的测试。
- 免疫失调可能导致感染后严重 COVID-19 疾病的过程以及对下一代疫苗开发的影响,特别是在确定 CD8 T 细胞反应或先天免疫反应在刺激促炎反应或增强免疫病理学方面可能发挥的作用(Ahmed-Hassan 2020,Zheng 2022)。
- 免疫学检测,包括高通量中和检测、T 细胞检测和记忆 B 细胞检测——至少是合格的,理想情况下是经过验证的——需要研究广泛保护性冠状病毒疫苗产生的免疫反应(Baric 2022、Goldblatt 2022a、Vardhana 2022)。(见疫苗学。
- 需要先天免疫的生物标志物来评估和预测对冠状病毒感染的适应性免疫反应的机制(Espinoza 2022)。
- 需要粘膜免疫的全身替代物来加速粘膜冠状病毒疫苗的开发(Matuchansky 2021)。
- 用于快速评估新出现变异株关键性状的标准化检测方法,供全球实验室使用。
问题:刺激对不同冠状病毒具有交叉反应的广泛保护性免疫反应的机制尚不明确。
障碍
- SARS-CoV-2 发展迅速,导致出现新的病毒变种,这些变种能够逃避抗体诱导的免疫保护,免受疫苗接种或先前感染的影响。
差距
- 需要在以下领域进行免疫学研究,以产生具有广泛保护作用的冠状病毒疫苗:
- 详细了解人类对 SARS-CoV-2 和其他冠状病毒的抗体反应,以及病毒反应之间的相互作用(Aguilar-Bretones 2023,Pecetta 2022b)。
- 鉴定产生中和体液免疫并在不同病毒中保守的表位(S 蛋白的 RBD 除外)(Cohen J 2021、Crowe 2022、Martinez 2021、Saunders 2021、Walls 2021)。
- 鉴定 T 细胞表位,这些表位可能通过刺激 CD4 和 CD8 T 细胞反应来提供针对不同冠状病毒的更广泛的交叉保护。
- 评估先前或当前流行的冠状病毒(例如 SARS-CoV 和普通感冒冠状病毒)的既往感染是否能提供针对异源人类冠状病毒感染的交叉保护(Dangi 2021,Moss 2022)。
- 促进对结合但非中和抗体与 SARS-CoV-2 疫苗产生的中和抗体的作用的理解(波兰,2021 年)。
- 提高对受体依赖性抗体效应器在开发针对多种冠状病毒株的交叉保护中的功能的理解(Adams 2022,Mackin 2022)。
- 确定诱导广泛保护性记忆 B 细胞的机制 (Wahl 2022)。
- 确定 B 细胞对保守抗原反应的动力学和程度,足以为不同的疫苗平台提供广泛的冠状病毒感染保护,无论是独立还是与 T 细胞反应结合使用(Sette 2022)。
- 调查与下一代冠状病毒疫苗相关的免疫不良事件的可能性,例如确定广泛反应性抗体水平的增加是否会通过增加自身反应性抗体来加剧自身免疫性疾病(Labombarde 2022)。
问题:对冠状病毒的长期免疫反应的机制需要进一步阐明。
障碍
- 由于最初的 SARS-CoV-2 感染主要发生在粘膜表面的上皮细胞中,因此全身免疫的参与有限,并且在感染或注射疫苗接种后保护性抗体反应是短暂的(Morens 2022)。对于其他导致人类感染的冠状病毒来说,这也可能是正确的(Belyakov 2009,Karczmarzyk 2022)。此外,由于粘膜病毒复制时间短,人类免疫反应可能无法完全控制自然感染,这给开发有效和持久的疫苗带来了挑战(Morens 2023)。
- 疫苗引发的免疫记忆反应,主要涉及长寿命浆细胞和记忆 B 细胞,可能还涉及记忆 T 细胞,对于诱导长期保护至关重要,但该过程的机制和决定因素尚不完全清楚(Gaebler 2021、Inoue 2022、Laidlaw 2022、Siggins 2021、Wahl 2022)。
差距
- 需要进一步的研究来:
- 了解初次疫苗接种、加强和免疫记忆过程如何相互作用,以在既往感染、既往疫苗接种或两者都未接种的情况下产生广泛的保护性免疫。阐明免疫记忆的不同组成部分对不同类型的保护性免疫的相对重要性,例如针对感染、传播、有症状的疾病或严重疾病。
- 确定影响 SARS-CoV-2 感染或疫苗接种后抗体和记忆 B 细胞和 T 细胞反应持续时间的因素(Bhattacharya 2022、Moss 2022、Siggins 2021、Tarke 2022),特别是在防止异源菌株方面。
- 确定疫苗接种的保护性免疫力(无论是针对感染还是针对严重疾病的发展)可以维持的时间长度。
- 确定骨髓和粘膜相关淋巴组织中抗原特异性浆细胞寿命的决定因素(Siggins 2021)。
- 确定在感染和/或接种疫苗后促进生发中心持续存在的机制,这是建立免疫记忆所必需的(Laidlaw 2022)。
- 定义 上呼吸道和下呼吸道中的TRM细胞和驻留记忆 B 细胞促进持久的免疫保护(Nelson 2021,Sette 2022)。
- 确定粘膜刺激抗体和细胞反应的动力学和作用。
问题:先前存在的对SARS-CoV-2的部分免疫力(无论是感染获得性免疫还是疫苗介导的免疫力)对未来疫苗接种的影响尚不清楚。
障碍
- 世界上大多数人口要么感染了SARS-CoV-2,要么已经接种了该病毒的疫苗,这使得旨在了解对新疫苗的保护性免疫反应的研究变得复杂。
- 过去接触过其他冠状病毒可能存在区域差异,这使研究工作进一步复杂化。
差距
- 需要进一步的研究来:
- 确定不同人群对冠状病毒的基线免疫水平,并评估先前存在的异型免疫(例如,先前感染 SARS-CoV、MERS-CoV、普通感冒季节性冠状病毒和 SARS-CoV-2 变体)对未来冠状病毒暴露引起的感染和疾病易感性的影响(Bean 2021、Tan 2021、Yu ED 2022)。
- 通过群体特征和对先前接触冠状病毒疫苗或感染的免疫反应确定印记机制(Mettelman 2022,Pecetta 2022b)。
- 使用不同的疫苗平台技术确定重复加强剂量对 SARS-CoV-2 体液和细胞反应的定性和定量变化的影响。
- 提高对 S 蛋白抗原印记的理解,这对于开发旨在刺激对未来 SARS-CoV-2 变体和广泛其他冠状病毒的免疫反应的疫苗非常重要。
- 更好地了解通过来自疫苗接种或感染的预先存在的抗体来掩盖抗原表位的聚糖,糖蛋白化学在免疫印记中的作用,以及它对设计广泛保护性冠状病毒疫苗的影响(Zarnitsyna 2015)。
- 阐明先前存在的免疫力与随后对疫苗接种的反应之间的相互作用,包括免疫动力学、保护广度、持久性和免疫记忆的作用(Sette 2022)。
- 确定如何重新编程启动的免疫系统,或者先前存在的免疫力是否会主导回忆反应(Pecetta 2022b)。这包括需要比较全球不同人群中疫苗诱导的 SARS-CoV-2 免疫反应与背景免疫健康状况的关系(例如,与伴随感染、营养和其他因素相关的更高炎症)。
- 阐明上呼吸道和下呼吸道免疫耐久性的机制。
问题:在评估广泛保护性冠状病毒疫苗时,需要额外的保护相关性。
- 保护相关 (CoP) 是一种可测量的生物标志物,用于可靠地预测疫苗对临床结果的效力水平,例如疫苗诱导的对感染、严重疾病或 SARS-CoV-2 感染 (PASC) 急性后遗症的保护(Sherman 2022)。使用CoP可以促进对有前途的广泛保护性候选疫苗进行临床试验的下遴选和审查,并可以简化后期评估的各个方面,通过为特定使用环境的疫苗提供临时或传统批准的主要终点,有可能绕过大规模的现场试验(Karim 2021,Openshaw 2022,Plotkin 2010)。
障碍
- 中和抗体滴度已被确定为 SARS-CoV-2 疫苗效力的 CoP(Gilbert 2022a)。然而,广泛保护性冠状病毒疫苗结果的 CoP 尚未明确定义,可能包括适应性和先天免疫反应的额外措施(Britto 2022、Gilbert 2022b、Khoury 2021、Morens 2022)。缺乏具有广泛保护性冠状病毒疫苗功效的 CoP 可能会阻碍新疫苗通过评估、监管批准和许可后审查取得进展。
- 针对冠状病毒感染的 CoP 可能与针对严重疾病的 CoP 不同,粘膜免疫的 CoP 可能与全身免疫的 CoP 不同 (Goldblatt 2022a)。拥有能够区分这些不同情况的 CoP 可能很重要。
- 广泛保护性疫苗的 CoP 需要考虑通过先前的疫苗接种和/或感染广泛暴露于 SARS-CoV-2 抗原。
- CoP 可能因暴露时的病毒载量、免疫记忆的作用、个体特征(如整体免疫状态)以及用于检测 CoP 的方法而异(Misra 2022)。这为定义预测冠状病毒疫苗功效的必要生物标志物带来了障碍。
- T细胞检测对于识别广泛保护性冠状病毒疫苗的CoP可能很重要;然而,它们在技术上比血清学测定更困难、更昂贵,并且测量 T 细胞的技术目前在临床试验中是不切实际的(Goldblatt 2022a)。此外,通常不会从临床试验期间收集的血清样本中分析T细胞,因此更难得出有关细胞免疫的结论。
- 适应性(体液和细胞)和先天免疫反应的免疫机制介导不同组织和生理区室中对冠状病毒感染和疾病的保护,这些机制非常复杂,这使得 CoP 的发展复杂化(Britto 2022,Sui 2021)。
- CoP 可能因宿主特征而异,例如年龄、性别、预先存在的免疫力、潜在的宿主遗传学和暴露史(Sherman 2022,Rodda 2022)。
- 不同的疫苗平台可能具有不同的保护性免疫机制,导致不同的CoP,这可能会使比较不同方法之间疫苗效力的努力复杂化(Sui 2021)。
- 由于抗体检测缺乏标准化、市售检测的敏感性和特异性差异以及所研究参与者的特征,研究感染后抗体的持久性变得复杂(Goldblatt 2022a)。
差距
- 为了确定具有广泛保护性和持久性冠状病毒疫苗的 CoP,需要研究以确定以下内容:
- 不同感染阶段各个区室中每种相关类型免疫反应的动力学,这对 CoP 测量的采样时间有影响。不同的生物标志物具有不同的耐久性特征(例如,与对有症状的 COVID-19 的短期保护相关的抗刺突中和抗体滴度)(Huang 2020)。
- 感染、疫苗接种或两者兼而有之后,在适当的动物模型中对不同关键免疫反应的保护阈值(即高于 CoP 阈值的生物标志物意味着高水平的疫苗保护)(“混合免疫”)(Misra 2022、Suryawanshi 2022、Vardhana 2022)。这些对于评估候选疫苗、生产一致性和随时间推移的更新非常重要(Goldblatt 2022b,Krammer 2021)。不同的临床终点也需要保护阈值(Sherman 2022)。
- 虽然保护性阈值提供了最有用的 CoP,但在某些临床使用环境中可靠预测疫苗功效的目标可能满足使用使用免疫生物标志物的整个分布或使用阈值临界值以外的其他特征(如几何平均值)的 CoP。这需要一种统计算法来预测疫苗效力,该算法基于测量疫苗接受者样本(也可能来自另一组比较疫苗接受者进行比较)的免疫生物标志物,其中该算法可能会也可能不会使用CoP的阈值临界值。
- 可能需要多种生物标志物来提高不同预期结果的测量可靠性(Jang 2020、Misra 2022、Plotkin 2020)。与持久和广泛保护性免疫反应相关的关键成分包括中和抗体、记忆 B 细胞、Fc 效应抗体以及 CD4 和 CD8 T 细胞(Goldblatt 2022a、Kaplonek 2022、McGrath 2022)。
- 需要更多关于SARS-CoV-2混合免疫模式(基于先前感染、疫苗接种、疫苗剂量间隔、疫苗平台等)的生物标志物的信息(Rodda 2022)。
- 基于不同的抗原(潜在的菌株特异性和广泛保护性抗原)、不同的疫苗平台和不同的给药方式,以及开发适当的动物模型和建立监管途径以供其审查,不同的冠状病毒疫苗结构将需要可靠的 CoP(Krammer 2022)。
- 尽管针对 S 蛋白的中和抗体似乎是 SARS-CoV-2 疫苗的合理 CoP,但需要确定与具有不同 SARS-CoV-2 病毒暴露史的人群的保护相关的滴度(Simon 2022)。
- 需要努力开发机制 CoP,这需要更深入地了解先天性和适应性(体液和细胞)免疫反应(Britto 2022)。
- 需要扩大使用先进的系统生物学工具,如蛋白质组学和系统血清学,以及机器学习,以支持机理 CoP 的发展(Britto 2022)。
- 对其他冠状病毒疫苗的COP进行研究将需要必要的试剂和病毒储备。
- 定义和协调临床或疗效终点对于确定和比较不同疫苗的 CoP 是必要的(Sherman 2022)。
- 需要标准化的、经过验证的 T 细胞反应高通量检测来推进 CoP 开发并促进其在临床试验中的使用(Goldblatt 2022a、Huang 2020、McGrath 2022、Misra 2022、Pecetta 2022b、Vardhana 2022)。
- 需要创新,通过简化样本采集和储存,以及标准化数据采集和实验室方法来扩大T细胞检测的规模。
- 一个包含当前疫苗潜在 CoP 的中央数据库可能有助于评估多个变量作为 CoP,并测试一项试验中确定的 CoP 是否在其他试验中有效(Karim 2021)。根据 CoP 的使用或免疫桥接应用,CoP 可能会有所不同,验证 CoP 的方法可能会有所不同;因此,中央数据库需要包括足够的元数据,以支持数据分析实现目标的能力。
- 一旦确定了一个或多个 CoP,就需要对该 CoP 进行标准化检测,以确保不同疫苗平台、给药方式和使用条件之间的可比性(Sherman 2022,Krammer 2022)。
主题 2 的战略目标和一致的里程碑:免疫学和免疫保护相关性
| 战略目标2.1:确保研究界能够获得临床样本和免疫测定,以提高对与SARS-CoV-2感染相关的粘膜和全身免疫机制的理解。 |
| 里程碑 2.1.a(高优先级):到 2023 年,开发一个集中式或虚拟生物储存库以及相关的治理结构,以使用 COVID-19 大流行前的临床样本,包括粘膜(例如,洗鼻和唾液)和血清学样本,这些样本目前可从一系列研究实验室获得,可能通过利用现有的生物样本库。 |
| 里程碑 2.1.b:到 2023 年,制定检测开发计划,旨在生成检测方法,以回答生物样本库样本可以解决的与 SARS-CoV-2 相关的关键免疫机制问题。 |
| 里程碑 2.1.c(高优先级):到 2024 年,建立并资助一个集中式或虚拟生物储存库,涉及来自世界多个地区的新受试者队列,包括那些有 SARS-CoV-2 感染史的受试者,以获得高影响力(例如,粘膜、支气管肺泡灌洗、血清学、骨髓)以及适当收集和定时的临床样本。 |
| 里程碑 2.1.d(高优先级):到 2024 年,按照里程碑 2.1.b 中确定的计划,为 SARS-CoV-2 研究开发新的免疫学检测方法,并确保此类检测方法适当协调、标准化和可重复。 |
| 里程碑 2.1.e:到 2027 年,开发针对更广泛的冠状病毒的免疫学检测方法,这些检测方法具有协调性、标准化和可重复性。 |
| 战略目标2.2:确定与SARS-CoV-2感染相关的粘膜和全身免疫机制,并开发具有广泛保护性的冠状病毒疫苗。 |
| 里程碑 2.2.a:到 2025 年,确定 SARS-CoV-2 感染粘膜屏障的初始体液保护机制。 |
| 里程碑 2.2.b:到 2026 年,确定 SARS-CoV-2 感染粘膜屏障的初始细胞保护机制。 |
| 里程碑 2.2.c:到 2026 年,确定粘膜(上呼吸道和下呼吸道)与全身体液免疫在预防冠状病毒感染和限制病毒传播可能性方面的相对作用(Mettelman 2022,波兰 2021)。 |
| 里程碑 2.2.d(高优先级):到 2027 年,确定粘膜生物标志物,包括粘膜免疫的全身替代物 (Matuchansky 2021),这些标志物可预测针对 SARS-CoV-2 感染的粘膜免疫保护。 |
| 里程碑 2.2.e:到 2027 年,开发粘膜免疫“图谱”——粘膜免疫的综合表征——以收集和组织有关先天性和适应性冠状病毒粘膜免疫的信息,以绘制不同年龄组和地区的不同解剖室(即上呼吸道与下呼吸道)的反应。 |
| 战略目标2.3:阐明刺激对不同冠状病毒具有交叉反应的广泛保护性粘膜和全身免疫反应的机制。 |
| 里程碑 2.3.a(高优先级):到 2024 年,确定除 S 蛋白的 RBD 区域以外的表位,这些表位可产生保护性体液免疫并在各种病毒类型中保持保守(Cohen J 2021、Crowe 2022、Martinez 2021、Saunders 2021、Walls 2021)。 |
| 里程碑 2.3.b:到 2025 年,确定针对 SARS-CoV-2 刺突蛋白保守 S2 区域的广泛保护性抗体,这可能对开发广泛保护性冠状病毒疫苗至关重要(周,2022 年)。 |
| 里程碑 2.3.c:到 2025 年,确定诱导广泛保护性抗体的潜在机制,例如通过产生和召回识别 SARS-CoV-2 病毒中保守表位的长寿命记忆 B 细胞 (Qi 2022)。 |
| 里程碑 2.3.d:到 2026 年,确定非刺突蛋白的 T 细胞表位,这些表位可能通过刺激 CD4 和 CD8 T 细胞反应来提供针对不同冠状病毒的广泛交叉保护。 |
| 战略目标2.4:了解SARS-CoV-2和其他冠状病毒免疫保护的持久性机制。 |
| 里程碑 2.4.a(高优先级):到 2024 年,确定影响 SARS-CoV-2 感染或疫苗接种后抗体和记忆 B 细胞和 T 细胞反应持续时间的初始因素,例如生发中心的持久性(Bhattacharya 2022、Moss 2022、Siggins 2021、Tarke 2022)。 |
| 里程碑 2.4.b:到 2029 年,确定骨髓和粘膜相关淋巴组织中抗原特异性浆细胞寿命的决定因素(Siggins 2021)。 |
| 战略目标2.5:提高对先前存在的免疫力(包括感染获得性和疫苗介导的免疫力)对未来流行冠状病毒免疫反应的影响的理解。 |
| 里程碑 2.5.a:到 2025 年,阐明先前存在的冠状病毒免疫力与随后的疫苗接种反应之间的相互作用,例如通过评估免疫动力学、保护广度、表位掩蔽的作用和免疫记忆的作用(Sette 2022)。 |
| 里程碑2.5.b:到2026年,确保实施纵向队列研究,以确定不同地理位置人群对冠状病毒的基线免疫水平,并评估先前存在的异型免疫(如先前感染SARS-CoV、MERS-CoV、普通感冒冠状病毒和SARS-CoV-2变体)对未来冠状病毒暴露的感染和疾病易感性的影响(Bean 2021, Tan 2021,Yu ED 2022)。 |
| 战略目标2.6:确定SARS-CoV-2疫苗和广泛保护性冠状病毒疫苗产生的免疫保护的机制相关性。 |
| 里程碑 2.6.a:到 2023 年,创建一个主要来自观察性研究的中央数据库,其中包括当前 SARS-CoV-2 疫苗的潜在 CoP,以允许不同的研究人员评估多个或替代 CoP(Karim 2021),并在可用时添加新信息。 |
| 里程碑 2.6.b:到 2025 年,定义和协调用于确定和比较不同 SARS-CoV-2 疫苗的 CoP 的临床或疗效终点(例如,轻度与重度疾病)(Sherman 2022)。(见疫苗学。 |
| 里程碑 2.6.c(高优先级):到 2026 年,确定经过统计验证的 CoP,以根据与特定临床终点相关且适用于具有不同特征的病毒变体的关键免疫反应来预测 SARS-CoV-2 疫苗的功效。 |
| 里程碑 2.6.d(高优先级):到 2027 年,确定一项或多项针对 SARS-CoV-2 感染的粘膜疫苗的 CoP。 |
| 里程碑 2.6.e:到 2027 年,确定 T 细胞反应的检测或替代标志物是否可以作为当前或新的广泛保护性冠状病毒疫苗的 CoP。 |
| 里程碑2.6.f:到2027年,在动物模型中进行研究,以确定用于评估广泛保护性冠状病毒疫苗的CoP。 |
| 里程碑 2.6.g:到 2028 年,确定是否需要多种生物标志物来提高 CoP 的性能,以预测 SARS-CoV-2 疫苗或广泛保护性冠状病毒疫苗的疫苗效力(Jang 2020、Misra 2022、Plotkin 2020),例如中和抗体、记忆 B 细胞、Fc 效应抗体以及 CD4 和 CD8 T 细胞(Goldblatt 2022a、Kaplonek 2022、 麦格拉思 2022 年)。 |
| 里程碑2.6.h:到2028年,确保一项或多项用于评估广泛保护性冠状病毒疫苗的缔约方会议得到验证。 |
| 里程碑 2.6.i:到 2028 年,标准化和开发协调 CoP 检测的机制,以促进不同疫苗平台和给药模式之间的可比性(Sherman 2022,Krammer 2022)。 |
其他研究重点
- 继续研究先天免疫如何影响对 SARS-CoV-2 感染的适应性(B 细胞和 T 细胞)免疫反应(Sette 2021,Tomalka 2022),特别是在不同年龄组和全球地区或人群中,包括免疫功能低下的人。
- 详细了解人类对 SARS-CoV-2 和其他冠状病毒的抗体反应 (Pecetta 2022b)。
- 确定 SARS-CoV-2 变体(以及潜在的其他冠状病毒)如何逃避免疫反应,包括抗体和 T 细胞反应。
- 确定通过刺激先天“训练有素”的免疫力来提高对冠状病毒的保护范围的潜力(Mettelman 2022,Ziogas 2022)。
- 确定佐剂在介导先天性和适应性免疫反应之间相互作用中的作用和机制(Carmen 2021,Lee 2022),例如那些通过 CD4 T 细胞激活驱动广泛反应的佐剂(Joyce 2022)。
- 阐明记忆 T 细胞在降低疾病严重程度中的作用(Kent 2022、Moss 2022、Zheng 2022)。
- 继续明确上呼吸道和下呼吸道中的TRM细胞和驻留记忆 B 细胞促进持久的免疫保护(Nelson 2021,Sette 2022)。
- 通过群体特征和对先前接触冠状病毒疫苗或感染的免疫反应确定印记机制(Mettelman 2022,Pecetta 2022b)。
- 确定预先存在的免疫如何影响召回反应,以及如何诱导启动的免疫系统对不同的冠状病毒产生广泛的保护性免疫反应(Pecetta 2022b)。
- 继续评估不同免疫区室和适应性免疫成分对 SARS-CoV-2 病毒感染和疫苗接种或其他冠状病毒的作用,重点关注适应性免疫反应的三个关键组成部分的特定功能和动力学(Moss 2022、Sette 2021、Sette 2022):
- B细胞,中和抗体的来源
- CD4 T 细胞,产生辅助性 T 细胞、Th1 细胞和滤泡性 T 细胞
- CD8 T细胞,可杀死受感染的细胞
- 阐明冠状病毒疫苗产生的结合但非中和抗体在免疫保护中的作用(波兰,2021 年)。
- 确定 B 细胞对保守抗原反应的动力学和程度,足以为不同的疫苗平台提供广泛的冠状病毒感染保护,无论是独立使用还是与 T 细胞反应结合使用。
- 继续扩大使用先进的系统生物学工具,如蛋白质组学和系统血清学,以及机器学习,以支持与广泛保护性冠状病毒疫苗密切相关的免疫学研究。
- 在未来 SARS-Co-V-2 变体的背景下,继续评估疫苗接种后免疫介导的增强疾病的可能性(Bigay 2022)。
- 确定广泛反应性抗体水平的增加是否通过增加自身反应性抗体来加剧自身免疫性疾病 (Labombarde 2022)。
- 确定 SARS-CoV-2 疫苗诱导的心肌心包炎的免疫病理机制。
- 确定激活免疫系统多个分支(包括 T 细胞、非中和抗体、保守表位的中和抗体、先天免疫反应和粘膜免疫)在引发广泛保护性免疫中的作用(Hauser 2022)。
- 继续采用创新技术,通过简化样本采集和处理,以及标准化数据采集和实验室方法,扩大 T 细胞检测规模。
- 考虑对免疫标志物进行实验操作的研究,以便更直接地评估机制 CoP,包括疫苗攻击研究、单克隆抗体攻击研究和用于预防的单克隆抗体的现场试验。
- 确定免疫失调可能导致感染后严重COVID-19疾病的过程,以及对开发下一代冠状病毒疫苗的影响。
- 继续评估 SARS-CoV-2 感染和免疫后人类 B 细胞库和抗体反应的演变,以确定有助于扩大免疫反应的潜在参数(Pecetta 2022b)。
主题3:疫苗学
本节讨论疫苗学主题中的优先领域,以推进广泛保护性冠状病毒疫苗的研发,例如开发首选产品特性。新技术、研究方法、平台、佐剂和创新给药方法的进步将加速广泛保护性疫苗的开发和分发。长期承诺和投资对于推进新的候选疫苗从发现到监管批准的整个管道至关重要。
问题:需要一套经过主要利益相关者广泛审查和同意的广泛保护性冠状病毒疫苗的首选产品特性(PPC),以便为疫苗研发提供信息。
障碍
- 由于下一个冠状病毒威胁在出现的时间和来源、传播性、发病率、死亡率和临床表现方面尚不清楚,因此无法对具有广泛保护性的冠状病毒疫苗进行典型的风险收益计算。
- 由于针对不同病毒、针对不同高危人群或年龄或具有不同适应症(例如,阻断传播与降低发病率和死亡率)的疫苗可能需要不同的产品特性,因此首选产品特性 (PPC) 的开发变得复杂。
差距
- PPC和目标产品概况(TPP)都概述了正在开发的疫苗的优惠属性。PPC 涉及早期研究,旨在通过为新产品的开发或现有产品的改进提供广泛的指导来促进创新。PPC 并非针对任何特定产品,而是提供与疫苗适应症、目标人群和疫苗用例 (WHO IVB) 相关的属性的一般指导。TPP通常更具体,并提供参数,可以为资助者和开发商的研发目标提供信息;它们通常被用作旨在获得监管批准或世卫组织资格预审(世卫组织IVB)的实体的规划工具。在制定具有广泛保护性冠状病毒疫苗的TPP方面做出了重要努力。还需要一套PPC,以便就此类疫苗的关键特性向研究界和工业界提供全面指导。开发 PPC 时要考虑的问题包括:
- 关于短期目标与长期目标的指导将有助于最有效地将所需疫苗推向市场(例如,SARS-CoV-2变异型疫苗与预防多种冠状病毒的疫苗)。
- 就疫苗功效终点达成共识,例如阻断感染、阻断传播和/或降低发病率和死亡率(可能包括长期COVID/PASC),将有助于优先考虑将下一代广泛保护性疫苗推向市场的努力。
- 明确如何衡量耐久性以及根据哪些结果、影响耐久性的因素、疫苗是否可以更持久以及持续时间,并确定对疫苗耐久性的现实期望。
- 就新冠病毒疫苗的广泛使用达成共识(例如,主动作为常规疫苗接种计划的一部分,而不是被动地作为大流行或流行病应对策略的一部分)。这将为最终产品的设想提供信息,可能影响监管途径,并将决定不同方法的市场。
- 还需要强调开发适合全球使用的疫苗的重要性,包括在偏远和资源匮乏的环境中使用。
- 许多用于广泛保护性冠状病毒疫苗的创新免疫原设计具有极其复杂的制造工艺,在决定哪些候选疫苗应通过开发管道时应考虑到这一点,因为这将影响在中低收入国家或其他资源匮乏环境中生产此类疫苗的能力。
- 需要预先讨论如何在不牺牲疫苗安全性或有效性的情况下简化分发、给药时间表(例如间隔、剂量数量、模式)和稳定性(例如冷链和储存要求),以促进疫苗获取的公平性(Rees 2022a)。
- 由于开发具有广泛保护作用的冠状病毒疫苗将很困难,特别是考虑到上述许多问题,因此必须确定一个最低限度可接受的TPP或一套以广泛保护为出发点的PPC。
问题:具有广泛保护性的冠状病毒候选疫苗需要在保持疫苗安全性的同时提供针对一系列现有和新型冠状病毒的保护。
障碍
- 许多新的疫苗技术和方法正在研究中,以引发对冠状病毒的广泛保护,但需要额外的持续资源和投资来激励和推动新的候选疫苗通过开发管道,特别是进入可以充分评估安全性和有效性的临床试验(尽管即使进行相对较大的临床试验,对罕见不良事件的上市后监测也是必不可少的)。
- 由于冠状病毒的系统发育多样性、冠状病毒内的抗原广度以及对不同冠状病毒亚组中保守的 B 细胞和 T 细胞表位的了解有限,选择抗原以优化广泛的免疫原性和交叉反应性具有挑战性(Baric 2022,Pack 2022)。(参见适用于疫苗研发的病毒学。
- 针对尚未出现的病原体的疫苗的开发,或旨在应对未来爆炸性疫情的疫苗,存在多种科学、方法和监管挑战。
差距
- 研究人员正在研究各种抗原呈递策略以引发广泛的保护,例如专注于高度保守的病毒区域和使用多重嵌合体或纳米颗粒疫苗技术(Chiu 2021、Martinez 2021、Saunders 2021、Walls 2021、Joyce 2022)。 目前,尚不清楚这些方法中哪一种对广泛保护性冠状病毒疫苗最有效。
- 对 S 蛋白以外的免疫原性抗原的进一步研究可能会确定可以更广泛保护的新型疫苗靶标,例如核衣壳、膜或包膜蛋白(Poland 2020,Soraci 2022)。
- 目前尚不清楚哪些疫苗平台将带来最广泛和最持久的保护。许多平台正在研究中,例如减毒活病毒疫苗、全灭活病毒疫苗、病毒载体疫苗、重组蛋白亚单位疫苗、病毒样颗粒和纳米颗粒疫苗以及核酸(脱氧核糖核酸 [DNA] 或 RNA)疫苗(Begum 2021、Li 2020、Sung 2021、WHO 2023)。
- 需要进一步努力跟踪和分析广泛保护性冠状病毒候选疫苗的疫苗前景,并确定工业界、学术界和政府实验室的疫苗开发人员可以采取的途径,并确定潜在的陷阱,以刺激和维持富有成效的疫苗研发。
- 许多正在评估的疫苗平台都相对较新,没有长期的安全记录。例如,上市后监测将心肌炎确定为与信使 RNA (mRNA) 疫苗相关的不良事件 (Bots 2022),并且在使用腺病毒载体疫苗后已确定血栓事件 (Mani 2022)。随着广泛保护性冠状病毒疫苗的更多新方法正在研究,需要不断努力促进对疫苗安全性的充分评估,无论是在批准前管道还是全球上市后不良事件监测中(Rizk 2021)。
- 需要进一步研究抗原印记和异源初免-加强疫苗接种策略,以产生针对多种冠状病毒株的广泛保护(Shepherd 2022,Tan 2021)。 例如,不同的疫苗接种方法,例如使用多个加强剂的免疫计划、不同的计划以及在初免-加强异源策略中使用不同的疫苗平台,可能比单独修改抗原或佐剂产生更有效的反应(Shepherd 2022)。这应该在不同的地理区域进行评估。
- 通过扩展全基因组测序和基因组数据库、生物信息学方法、基于结构的理性免疫原设计、抗原图谱和机器学习辅助的计算分析,可以增强对疫苗开发所必需的 SARS-CoV-2 突变和进化的理解(Soraci 2022,Pack 2022)。(参见适用于疫苗研发的病毒学。
- 免疫印记和先前存在的对SARS-CoV-2的部分免疫(感染获得性和疫苗介导)对未来疫苗接种的影响尚不清楚。(参见免疫学和保护的免疫相关性。
- 需要免疫学测定来评估广泛保护性的冠状病毒疫苗,并确定诸如预先存在的免疫力对疫苗性能的影响、疫苗在幼稚或脆弱人群中的表现以及疫苗保护的广度和持久性等因素[Baric 2022, Goldblatt 2022a, Vardhana 2022]).此类检测对于识别 CoP 也很重要,CoP 在疫苗评估中发挥着重要作用。(参见免疫学和保护的免疫相关性。
问题:候选疫苗需要获得持久保护。
障碍
- 鉴于缺乏针对感染,尤其是针对严重疾病的免疫 CoP,并且缺乏持久免疫的早期免疫特征,因此在人类或动物模型中不容易评估保护的持久性。识别CoP需要产生具有不同耐久性的免疫反应的模型(参见动物和人类感染模型。
- 确定如何在临床前开发中最好地评估疫苗的耐久性仍然是一项重大的科学挑战。
- 对感染和疾病的持续保护依赖于中和反应和非中和反应,例如 T 细胞、记忆 B 细胞和 Fc 依赖性体液反应(Krause 2022,Hsieh 2021)。 确定这些不同的全身和粘膜反应在促进耐久性方面的作用,特别是在不同的冠状病毒中,需要进一步研究。(参见免疫学和保护的免疫相关性。此外,所有这些反应的免疫标志物都不容易获得。
- 临床试验可能需要 1 到 2 年或多个季节的随访才能确定疫苗的耐久性,这增加了研究工作的成本和复杂性,并引发了可行性问题(Hodgson 2021)。
- 使用额外剂量的现有疫苗或略微修改的疫苗反复加强可能会限制研究引起更广泛保护性反应的新型疫苗的能力(Pack 2022)。
- 在详细了解疫苗的耐久性之前,疫苗通常已获得许可并用于快速应对疫情。
差距
- 持久保护性疫苗的预期保护期限和类型(例如,住院、死亡、再感染和/或传播)尚未明确定义(Pack 2022)。
- 需要更多关于不同疫苗平台提供的耐久性的信息。
- 需要更多关于不同类型适应性疫苗对预防疾病和住院的影响的信息。
- 可能需要也可能不需要佐剂和精心设计的涉及定期加强的免疫计划来刺激对已启动人群的有效和长期保护(Altmann 2022,Pack 2022)。
问题:需要进一步优化冠状病毒疫苗,以改善不同人群内部和跨人群获得未来疫苗的机会。
障碍
- 刺激粘膜免疫对于促进保护的广度和持久性可能很重要(Bhattacharya 2022),也可能是防止病毒进入粘膜细胞所必需的,这将防止感染并减少冠状病毒无症状传播的可能性(Soraci 2022)。目前的可注射冠状病毒疫苗似乎不能显着刺激足够的粘膜免疫(Azzi 2022,Collier 2022)。
- 一些正在研究的技术,如减毒活病毒疫苗,可能不适合孕妇、老年人或其他免疫系统受损的人(Ansariniya 2021,Soraci 2022)。
- 未来冠状病毒疫苗的给药途径可包括现有或新的疫苗接种方法(肌肉注射、透皮、口服、吸入或鼻腔);替代给药途径的经验有限。
差距
- 需要在以下领域做出更多努力,以优化未来的冠状病毒疫苗:
- 研究刺激粘膜免疫的疫苗(包括免疫球蛋白 A [IgA] 抗体、局部粘膜免疫球蛋白 G [IgG] 产生和细胞毒性 T 淋巴细胞活化),并可能通过鼻内或口服给药。黏膜疫苗的一个重要问题是需要建立黏膜免疫的CoP。(参见免疫学和保护的免疫相关性。
- 提高疫苗热稳定性,以解决冷链问题,这些问题可能会限制在偏远或资源匮乏环境中使用某些疫苗平台(Soraci 2022)。
- 提高免疫功能低下、虚弱或老年人疫苗免疫原性的策略(Sung 2021)。
- 研究以确定不同佐剂在提高下一代冠状病毒疫苗免疫原性方面的作用,包括为不同疫苗平台设计、开发和选择最有效的佐剂(Pack 2022)。
- 提高对孕产妇疫苗接种相关问题的理解。
问题:对于具有广泛保护性的冠状病毒疫苗来说,临床试验设计或其他证明有效性、非劣效性或优越性的替代方法很复杂。
障碍
- 目标病毒(或多种病毒)必须在人类中传播,才能进行疫苗功效的金标准随机对照试验 (RCT)(Hodgson 2021)。对于尚未在人群中传播的病毒或变异株,可能无法进行评估疫苗在其全部保护范围内的有效性的随机对照试验,尽管可以进行随机对照试验以确定广泛保护性疫苗是否优于或不劣于已批准的针对流行SARS-CoV-2毒株的疫苗。
- 需要在未接种、既往接种和既往感染的人群中评估广泛的保护和交叉反应性免疫,这增加了未来研究的复杂性(Pecetta 2022b)。
- 对于 SARS-CoV-2 变体,临床试验期间评估的疫苗功效很难推断,因为结果将取决于试验时该地区正在传播的毒株(Pecetta 2022b)。
- 在不同的地理位置可能会观察到疫苗效力的差异,这不仅是因为流行的毒株或感染或疫苗接种的流行率不同,还因为人口统计、贫困、营养不良、获得高水平医疗的机会以及包括艾滋病毒在内的合并症的流行等健康因素(Hodgson 2021)。
差距
- 由于缺乏标准化或协调的临床试验终点、感兴趣的结果和用于评估人类免疫反应的测定方法,因此难以解释和比较临床试验数据(Pecetta 2022b)。
- 需要一个框架,如平台试验,来评估粘膜疫苗的临床终点,如感染、疾病和传播。
- 研究和监管界将需要确定如何根据先前存在的感染或疫苗接种免疫力来最好地评估广泛保护性冠状病毒疫苗的功效(Rees 2022a)。此外,目前尚不清楚监管机构需要什么来证明保护的广度。
- 研究人员可能需要使用一种或多种 CoP 或表征良好的免疫标志物作为在没有循环病毒的情况下评估疫苗效力的替代终点(Krause 2022);然而,需要更多的努力来定义它们。(参见免疫学和保护的免疫相关性。
- 由于对广泛保护性冠状病毒疫苗进行临床试验存在挑战,因此可能需要评估疫苗功效的替代方法。例如,一些人提出了一个替代框架,涉及将新疫苗与批准的疫苗进行比较。有关使用此框架的问题示例包括(Krause 2022):
- 对照疫苗的选择将取决于现有疫苗的可用性和坚实的知识基础;因此,研究人员需要确保获得有关对照疫苗的充分信息。
- 该框架要求能够对新疫苗和对照疫苗引起的免疫反应进行直接或间接比较;因此,有必要彻底了解每种疫苗的免疫反应。
- 如果中和免疫反应用于免疫桥接,它们需要预测其他整体保护反应。需要数据来验证这一概念。
- 关于涉及不同平台的疫苗是否可以相互比较,需要更多的研究。
- 除临床试验外,其他评估疗效的方法包括进一步免疫桥接人群的动物研究或人类感染研究。需要进一步努力澄清如何使用这些替代策略来评估疫苗效力,特别是确定保护范围。(参见动物和人类感染模型。
问题:对于设计为具有广泛保护作用的冠状病毒疫苗来说,证明有效性、非劣效性或优越性的监管途径尤为复杂。
障碍
- 在了解病毒的特征、疫苗的特性以及疫苗使用的潜在适应症之前,除了制定批准任何具有广泛保护作用的冠状病毒疫苗的监管策略之外,还需要做更多的事情。
- 在紧迫感明显增加的情况下,加速批准途径或紧急使用授权可能是授权的选择,这是COVID-19大流行早期发生的情况。然而,这些途径的使用取决于高水平的公共卫生风险(Beasley 2016,WHO 2020b)。 此外,除非出现新的SARS-CoV-2变种,从而产生新的紧迫感,否则未来冠状病毒疫苗的紧急使用授权和快速许可程序的机会可能会更加有限(Branswell 2022)。
- 良好临床规范 (GCP)、药品生产质量管理规范 (GMP) 和良好实验室规范 (GLP) 构成了合规性的基础。疫苗在生产国由国家监管机构 (NRA) 批准,但并非所有 NRA 都严格遵守其 GMP,并非所有国家/地区的 NRA 都有能力确保 GMP,这可能导致冠状病毒疫苗的监管合规性失效(Brüssow 2021)。
- NRA之间不能轻易地进行多边讨论,而仅限于签订保密协议的NRA之间的双边讨论(Farley 2022,Cavaleri 2022)。
- 具有广泛保护性的冠状病毒疫苗可能不仅需要对在人群中传播的冠状病毒具有保护作用,还需要对未传播的病毒具有保护作用,这给监管部门的批准和确定产品标签中可以包含哪些信息带来了额外的挑战。
差距
- 在美国,疫苗的监管批准有三种潜在的途径:依赖于随机对照试验的疗效数据的传统途径,基于替代标志物确定田间试验疗效的加速批准途径,以及通过美国食品和药物管理局(US FDA)的动物规则获得批准,该规则涉及动物研究产生的功效数据,如果其他途径不可行,则免疫桥接到人类,并且要求可以满足动物规则(美国 FDA 2011,美国 FDA 2022)。 其他国家的监管机构也有类似的途径,尽管他们通常缺乏动物规则选项;然而,动物数据仍然可以在收益风险评估中发挥关键作用。此外,来自人类感染研究的数据可用于评估疫苗并快速确定疫苗是否可能产生临床益处,在某些情况下可用于评估疗效(美国食品和药物管理局,2011 年)。此外,此类研究还可以确定给定疫苗的替代标志物或免疫 CoP,可用于更大规模的现场试验,以进一步评估疗效,正在考虑用于其他病原体(Deming 2020,Giersing 2019)。如果无法进行临床疗效试验,例如SARS-CoV-2变体不再在人群中传播,动物和人类感染研究可能对疫苗批准有价值。然而,目前尚不清楚除了传统批准之外,哪些信息或途径可以被监管部门接受,以批准具有广泛保护性的新冠病毒疫苗。
- 疫苗开发人员需要获得指导,了解监管机构可能会接受哪些信息来定义防变异型 SARS-CoV-2 疫苗或广泛保护性冠状病毒疫苗的功效。
主题 3:疫苗学的战略目标和一致的里程碑
| 战略目标3.1:通过建立一套广泛商定和审查的PPC,确定广泛保护性冠状病毒疫苗的目标,并确定此类疫苗的用例。 |
| 里程碑3.1.a(高优先级):到2023年,在现有TPP的基础上,制定一套广泛同意和国际审查的PPC(例如,通过涉及世界卫生组织等国际多边组织的进程),以确定关键产品特性, 包括最佳和关键的最低标准。这些疫苗可以采用分层方法,最初侧重于防变异的SARS-CoV-2疫苗,然后转向其他更广泛的保护层。 |
| 里程碑3.1.b:到2024年,开发广泛保护性冠状病毒疫苗的初始用例,确定此类疫苗的使用方式、地点和情况,例如确定目标人群,解决冷链和疫苗稳定性问题,并探索在资源有限环境中的公平获取。在初始开发之后,用例和 PPC 可能需要随着时间的推移通过迭代过程进行修改。 |
| 战略目标3.2.利用新技术或新方法创造有效、持久和安全的疫苗,为不同的冠状病毒提供广泛的保护。 |
| 里程碑3.2.a:到2023年,定义一套原则,供资助者和开发者用来选择候选疫苗以进行进一步评估。这套原则应考虑到制造的复杂性、疫苗分发和使用的主要挑战以及使用不同疫苗的最终目标等问题。所有这些问题都影响着疫苗在全球不同地区(包括中低收入国家)的生产和使用能力。 |
| 里程碑 3.2.b(高优先级):到 2023 年,发布 SARS-CoV-2 粘膜疫苗研讨会的结果,以确定疫苗开发粘膜方法的差距。 |
| 里程碑3.2.c:到2024年,推进一项战略或机制,促进研究人员和开发人员之间的合作,旨在结合技术来扩大冠状病毒疫苗的覆盖范围,例如在动物模型或早期临床试验中评估疫苗或不同抗原的组合,或评估不同已批准或候选疫苗的初免-加强组合。 |
| 里程碑 3.2.d(高优先级):到 2024 年,开发并向研究人员提供冠状病毒(如可用)、假病毒(如果可以制造)和抗原的初始存储库。存储库可以分层开发,最初侧重于风险最高的病毒,然后随着时间的推移添加其他病毒。 |
| 里程碑3.2.e:到2024年,在临床前和临床开发中建立广泛保护性冠状病毒候选疫苗的综合格局,并建立更新和分析格局的机制,包括确定成功研发工作背后的关键因素以及持续的挑战和障碍。 |
| 里程碑3.2.f:到2024年,对现有佐剂进行分析,并创建一个可用佐剂库,以确保疫苗研发研究人员可以获得和使用它们。 |
| 里程碑 3.2.g:到 2024 年,评估与现有 SARS-CoV-2 疫苗相关的罕见不良事件的病理生理学,并使用最有希望的广泛保护方法确定类似不良事件的潜在风险。 |
| 里程碑 3.2.h:到 2025 年,主要通过临床前研究确定是否有任何佐剂可以在不影响安全性的情况下显着提高 SARS-CoV-2 变体和其他冠状病毒的疫苗效力、广度或耐久性。 |
| 里程碑3.2.i(高优先级):到2027年,通过临床研究进一步阐明替代给药途径,包括鼻内、透皮、吸入和口服疫苗,是否可以增强粘膜免疫力并预防疾病和传播。 |
| 战略目标 3.3.建立进行临床试验的原则,以便对疫苗进行比较。 |
| 里程碑 3.3.a:到 2024 年,制定一套统一的临床终点(例如感染、重症、死亡和潜在的长期 COVID/PASC)和免疫学终点,可用于广泛保护性冠状病毒疫苗的疫苗功效研究,以证明对 SARS-CoV-2 变体和“普通感冒”冠状病毒的保护作用。 |
| 里程碑3.3.b:到2025年,制定一个涉及跨领域专家和监管机构的流程,以快速识别和商定标准化的临床和/或免疫学终点,这些终点可用于在新型冠状病毒出现后快速捕捉疫苗效力。 |
| 里程碑3.3.c:到2025年,根据先前里程碑的结果、科学知识状况和当时流行的病毒,制定和传播一项国际概念方案,其中包括临床试验原则,以便对广泛保护性候选疫苗和对照疫苗进行比较。 |
| 战略目标3.4.为未来冠状病毒疫苗的监管评估奠定基础。 |
| 里程碑3.4.a:到2023年,在科学界、监管机构和疫苗开发商之间发起年度会议,分享最新的免疫学、病毒学、疫苗学和监管科学进展和挑战,以协助为新型冠状病毒疫苗的监管评估奠定基础。 |
| 里程碑3.4.b(高优先级):到2023年,制定一套原则,为新型冠状病毒疫苗的监管评估提供信息,概述需要哪些信息来证明对抗变异SARS-CoV-2疫苗的需求和附加值,并提供对疫苗效力的信心,特别是与批准的疫苗相比。这套原则不如监管指南具体,因为许多细节仍未解决,但这些原则可以成为澄清此类疫苗监管评估的宝贵起点。 |
| 里程碑 3.4.c(高优先级):到 2025 年,在里程碑 3.4.b 的基础上,制定一套对未来更广泛的保护性冠状病毒疫苗进行监管评估的原则,这些原则:(1) 遵循分层或逐步的方法(例如,首先预测对 SARS-CoV-2 以外的沙贝病毒的疗效,然后是美甲病毒,然后根据需要预测其他需要关注的冠状病毒);(2)考虑不同疫苗可能采用的各种保护机制,这可能为特定疫苗结构的潜在保护广度提供信息;(3)从监管角度阐明了“广泛保护性冠状病毒疫苗”的含义,以及如何在相关产品信息中传达保护的广度;(4)确定预测新疫苗对未在人群中传播的冠状病毒提供的保护(即预测潜在临床益处)的方法;(5)定义动物研究、人类感染研究和免疫桥接等工具在预测新疫苗保护广度方面的潜在作用和局限性;(6)阐明了新型冠状病毒疫苗的潜在监管途径。 |
| 战略目标3.5.促进开发具有满足全球需求特性的候选疫苗。 |
| 里程碑3.5.a:到2023年,开始推进中低收入国家参与临床开发项目,以便广泛保护性冠状病毒疫苗的临床试验包括中低收入国家环境。 |
| 里程碑3.5.b:到2026年,支持开发具有广泛保护性的新冠病毒疫苗,这些疫苗可以使用不太复杂的生产系统制造,以确保在更多地区生产此类疫苗的潜力,从而实现更公平的分配。 |
| 里程碑3.5.c(高优先级):到2027年,支持开发适合广泛获取和全球分发的冠状病毒疫苗技术,例如冷链独立技术;是可扩展的;并且可以经济实惠地生产。 |
其他研究重点
- 继续扩大全基因组测序和基因组数据库、生物信息学方法、结构疫苗学和计算分析的使用,以改进疫苗设计(Soraci 2021,Pack 2022)。
- 持续评估免疫压力下保守表位之间抗原漂移的可能性,例如当表位用作广泛保护性疫苗的抗原靶标时。
- 随着新型广泛保护性冠状病毒疫苗的开发,继续评估VAED的潜力(Gartlan,2022)。
- 继续在世界各地的NRA之间建立能力和合作,包括对临床试验和许可申请进行联合审查,就保护性冠状病毒疫苗许可的全球标准达成一致,以及制定流程,以便在全球疫苗推广的地理不同地区及时和简化许可。
- 鼓励创新,以改进冠状病毒疫苗并使其多样化。
- 继续评估不同疫苗平台提供的耐久性。
- 促进免疫学家、实验室科学家、统计学家、临床医生和计算生物学家之间的协调,努力开展广泛保护性冠状病毒疫苗的临床试验。
- 制定战略,了解如何在全球范围内部署新技术,并实现更公平的获取。
- 继续建立机制,改善有关冠状病毒疫苗安全性的公众沟通,例如跟踪公众的安全问题并制定共识沟通策略来解决这些问题。
- 将更多研究重点放在疫苗在特殊人群(如儿童、孕妇、免疫功能低下者和老年人)中的有效性、副作用和持久性上。
主题4:用于冠状病毒疫苗研究的动物和人类感染模型
本节讨论了与合适的动物模型的可用性相关的主要障碍,这些模型对于开发具有广泛保护性的冠状病毒疫苗很重要,以及这些动物模型需要标准化、验证和充分表征,并反映人类免疫反应和临床疾病谱。该部分还讨论了受控人类感染模型在推进冠状病毒疫苗研发方面的潜在作用。 优化CHIM的其他努力将扩大其效用,包括确定最佳实践和扩大使用标准化的道德和安全指南。
动物模型
问题:需要多种动物模型来评估预防多种冠状病毒的疫苗。
障碍
- SARS-CoV 和 SARS-CoV-2 与 hACE2 受体结合;然而,并非所有人类冠状病毒都与该部位结合。MERS-CoV 与 DPP4 结合,一些导致人类疾病较轻的病毒的受体位点仍然未知(Gralinski 2015)。因此,可能需要几种不同的动物模型来研究预防不同属或亚属的多种冠状病毒的疫苗。
- 适合 SARS-CoV 和 SARS-CoV-2 的动物模型包括叙利亚仓鼠、小鼠(例如,转基因小鼠、敲入小鼠、用腺病毒或表达 hACE2 的腺相关病毒转导的小鼠或感染小鼠适应病毒株的小鼠)和非人灵长类动物 (NHP)(Muñoz-Fontela 2020、Qin 2022、Singh 2020、Casel 2021、Shou 2021、McCray 2007、Sun 2020、Wong 2022)。虽然这些不同的动物模型可以提供有用的信息,但它们都有重要的局限性(Qin 2022),包括以下内容:
- 小动物模型有几个优点,因为它们很容易获得,可以以更少的努力和成本进行处理,并且可以大量使用以获得更强的统计能力。主要限制是人类与啮齿动物或其他小型哺乳动物之间的内在生物学差异。
- 对于非人灵长类药物,有几个问题限制了它们的使用,包括:(1)非人灵长类药物的冠状病毒疾病通常是轻微的,不能概括人类病理学;(2)非人灵长类成本更高(Gralinski 2015),这限制了研究中包含的数量并降低了统计功效;(3) 大多数非人灵长类是近亲繁殖的动物,遗传背景差异很大,这有时难以解释研究结果(Trichel 2021);(4)伦理考虑限制了它们的使用(Carvalho 2019);(5) COVID-19 显着增加了对它们的需求,造成了供应问题(Contreras 2021)。
- 目前,不同冠状病毒的病毒库存有限。例如,2d β冠状病毒不可用于动物模型研究,除MERS-CoV以外的2c β冠状病毒病毒库存非常有限。(参见适用于疫苗研发的病毒学。
- 具有不同目标的研究需要不同的动物模型(Wang 2021)。例如,当试图确定SARS-CoV-2在接种疫苗后是否仍然存在于上呼吸道或研究传播时,叙利亚仓鼠是一个潜在的选择,尽管这些动物的临床疾病有限。对于 SARS-CoV-2 诱导的肺部疾病,以及对粘膜 COVID-19 疫苗的初步探索,hACE2 转基因小鼠或使用小鼠适应病毒是潜在的选择。
- 如果不能满足其他途径的要求,美国食品和药物管理局的动物规则可能是一个适当的监管途径,通过使用动物研究来促进广泛保护性冠状病毒疫苗的批准;然而,通过动物规则获得批准需要证明在多个动物物种或单个特征明确的动物模型中的有效性(Brockhurst 2021,美国 FDA 2022)。
- 涉及非人灵长类的研究的实验和报告缺乏标准化(Witt 2021)。
差距
- 研究需求包括以下内容:
- 标准化、经过验证且表征良好的动物模型(包括非人灵长类动物和一组用于人类 β 冠状病毒病的稳健小鼠模型),用于评估和比较具有广泛保护性的冠状病毒疫苗。要考虑的参数示例包括攻击病毒株、剂量、途径、体积和攻击时间。此外,还需要确定每种动物物种的适当临床或病毒学终点。
- 更好地表征不同动物的冠状病毒传播动态,以确定哪些动物最适合研究不同的SARS-CoV-2变体或其他冠状病毒。
- SARS-CoV-2 VOC 的动物模型,用于评估现有疫苗是否能预防临床疾病 (Fan 2022)。
- 进一步阐明非 ACE2 结合冠状病毒的受体位点 (Dai 2020)。(参见适用于疫苗研发的病毒学。
- 其他信息,例如来自致命的人类MERS-CoV感染的尸检数据,以确定哪种动物模型最能代表人类的MERS-CoV(Singh,2020)。
- 用于研究蝙蝠源性冠状病毒的动物模型,例如 2d 组 β 冠状病毒。
- 动物模型可以提供针对代表广泛抗原空间的广泛病毒的疗效数据。例如,动物模型可以通过证明疫苗可以防止跨亚属、多个亚属或不同属的系统发育和抗原相关性最小的病毒感染来“包围”广泛的免疫力。
问题:需要动物模型来概括人类冠状病毒感染的临床特征范围,包括严重和致命的急性和慢性疾病,并可以解决宿主因素对疫苗效力的影响。
障碍
- 大多数动物模型对冠状病毒感染的反应表现出有限的致死性(Fan 2022,Kim 2022)。 这在一定程度上取决于病毒株。
- 需要适用于抗原初治人群(即婴儿和非常年幼的儿童)和抗原经验人群(即暴露于SARS-CoV-2或接种疫苗的成人和儿童以及暴露于冠状病毒导致轻度疾病的人群)的动物模型,这使得它们的开发和应用变得复杂。
差距
- 与动物模型相关的研究需求包括:
- 鉴定概括人类 SARS Co-V-2 感染的严重和致命形式的动物模型(Muñoz-Fontela,2022 年)。
- 鉴定动物模型,这些动物模型可以评估尚未跳过人畜共患屏障的病毒的疾病。
- 了解病毒结合的宿主细胞受体通路的潜在差异。
- 进一步改进动物模型以模拟不同的人类状况,例如感染途径、潜在发病率、性别、高龄、怀孕和免疫功能低下状态,这些状况会影响对广泛保护性冠状病毒疫苗的免疫反应(Braxton 2021)。
- 建立适合有抗原经验的人群(即既往感染过冠状病毒或接种过疫苗的人群)的 SARS-CoV-2 动物模型。
- 在不同的动物模型中进行实验,并使用不同的新兴 SARS-CoV-2 变体来确保研究结论的有效性(Muñoz-Fontela,2022 年)。
- 用于评估人类 T 细胞反应的动物模型(尤其是小鼠模型)(例如,T 辅助细胞 [Th1 和 Th2])(Fan 2022,Jarnagin 2021)。
- 用于评估“长期 COVID”的动物模型(Frere 2022),尽管存在许多挑战,因为长期 COVID 尚未明确定义,并且急性 SARS-CoV-2 感染后会出现多种病理途径和慢性疾病。这对于评估广泛保护性冠状病毒疫苗是否可以降低长期COVID/PASC的风险可能很重要。
问题:在动物模型中准确评估广泛保护性冠状病毒疫苗还存在其他挑战。
障碍
- 研究广泛保护性冠状病毒疫苗将需要提供具有代表性的病毒储备库用于动物模型研究,这可能具有挑战性,尤其是在冠状病毒的不同属和亚属中(Cohen J 2021)。
- SARS-CoV、SARS-CoV-2 和 MERS-CoV 动物实验必须至少在动物 BSL (ABSL)-3 实验室进行,这使得工作繁琐且昂贵。此外,用于 NHP 研究的 ABSL-3 实验室空间有限(Hild 2021)。
- 新的SARS-CoV-2变体可能会改变宿主范围或影响某些动物模型(如叙利亚仓鼠)的病理生理学和反应。这反过来可能会使该动物的研究变得困难或缺乏有效性(Muñoz-Fontela,2022 年)。
- 持久保护将是广泛保护性冠状病毒疫苗的重要考虑因素;然而,在动物模型中很难研究保护持续时间。
- 随着 COVID-19 大流行的继续以及越来越多的人口被感染或接种疫苗,绝大多数人可能对 SARS-CoV-2 具有预先存在的免疫力,这可能很难在动物模型中模仿。
- 随着 SARS-CoV-2 毒株的进化并变得更加适应人类,它们感染动物或在动物模型中引起疾病的能力可能会降低(McMahan 2022)。
差距
- 在具有多种候选疫苗的动物模型中进行头对头研究可以增强对疫苗诱导免疫的理解。
- 需要不断努力确保经过验证的、可靠的试剂;更新的病毒株和库存;研究界可以使用统一的检测方法,以提高对各种动物模型中针对冠状病毒感染的先天性和适应性免疫反应的理解。
- 需要努力调整动物模型,以反映人群中先前存在的对 SARS-CoV-2 的免疫力(DeGrace 2022,Fan 2022)。
- 需要 SARS-CoV-2 动物模型,其中病毒可以长时间复制,以便评估针对疫苗的耐药变体的出现(Muñoz-Fontela,2022 年)。
- 需要努力确保为涉及非人灵长类的研究提供充足、持续的动物和资源(包括实验室空间),特别是特定的无病原体非人灵长类(Contreras 2021)。此外,需要努力保护动物资源并制定良好管理此类资源的战略(Fan 2022)。
受控人类感染模型 (CHIM)
问题:CHIM在冠状病毒疫苗研究中的作用需要进一步澄清和定义。
障碍
- 感染后可能出现严重疾病或长期后遗症(例如,长期 COVID 或 PASC),尽管不常见,但可能会限制 CHIM 研究调查 SARS-CoV、SARS-CoV-2 和 MERS-CoV 的效用(Williams 2022)。
- 英国是第一个,也是唯一一个进行 SARS-CoV-2 CHIM 研究的国家(Killingley 2022);因此,最近使用CHIM进行冠状病毒研究的经验有限。目前正在努力将CHIM的使用范围扩大到其他国家。
- 与流感病毒和其他病原体类似,CHIM 研究仅限于没有合并症的健康成年人,因此不能反映其他人群的潜在结果(Sherman 2019)。
- CHIM 研究目前仅限于小样本量(Killingley 2022),这限制了它们在评估疫苗功效方面的效用。
- 获得挑战病毒和创建挑战菌株所需的时间表可能是进行 CHIM 研究的障碍。由惠康信托基金会和比尔及梅琳达·盖茨基金会资助的GMP Delta和Omicron SARS-CoV-2挑战病毒将提供给具有CHIM研究能力及其严格安全要求的研究人员。由惠康信托基金会指定的独立国际访问管理小组将对这些计划进行监督。
差距
- 其他研究需求包括:
- 阐明 CHIM 研究在评估广泛保护性冠状病毒疫苗方面的作用,包括它们在支持疫苗许可方面的作用(Deming 2020、Giersing 2019、Sekhar 2020)。
- CHIM研究在评估广泛保护性冠状病毒疫苗方面的参数标准化。
- 制定在冠状病毒疫苗研究中使用 CHIM 的最佳实践,包括反映不断变化的疾病和治疗格局的风险缓解策略。
- 确定先前感染或接种 SARS-CoV-2 疫苗对更广泛的保护性冠状病毒疫苗的 CHIM 研究的潜在影响以及解决此问题的策略。找到对 SARS-CoV-2 感染或疫苗接种不幼稚的志愿者可能很困难或非常耗费资源。
- 进行CHIM研究的监管协调。
- 需要有能力进行更大规模的研究,以便疗效试验能够及时提供结果。这种能力差距包括 BSL-3 检疫设施、专业知识以及有效的单克隆抗体疗法、抗病毒药物或其他抢救疗法的可用性。
- 在人类中引起轻度疾病的冠状病毒(人 β 冠状病毒 HKU1 和 OC43 以及人 α 冠状病毒 229E 和 NL63)可能适合用于 CHIM。需要进一步澄清此类研究如何促进冠状病毒疫苗研发(Morens 2022)。
- Delta 和 Omicron 计划已获得资助,并正在进行中,以在免疫前志愿者中建立模型,因此将生成有关先前免疫对变体感染影响的数据。例如,正在接种疫苗和未接种疫苗的人中使用野生型 SARS-CoV-2 进行剂量研究(牛津大学,2023 年)。
- 对幼稚参与者的研究实际上不再可能,因为几乎所有成年人都对疫苗接种和/或感染具有免疫力。
- 需要加强国际合作,以便产品能够针对世界各地不同机构可能提供的不同毒株或病毒进行测试。方案和流程的一致性将允许对不同产品和病毒株的结果进行有意义的比较。
主题 4 的战略目标和一致的里程碑:冠状病毒疫苗研究的动物和人类感染模型
| 战略目标4.1:确保开发适当的动物模型,并可用于进行广泛保护性冠状病毒疫苗的研发 |
| 里程碑4.1.a(高优先级):到2024年,制定一项战略,确保经过验证的可靠试剂;病毒株和病毒库;统一的血清学检测可用于在动物模型中研究更广泛的冠状病毒,最初侧重于其他 沙贝病毒(2b 组 β 冠状病毒)和更多种类的 MERS 相关 merbecovirus(2c 组 β 冠状病毒)。 |
| 里程碑4.1.b(高优先级):到2024年,召开一次关于研究广泛保护性冠状病毒疫苗的动物模型国际研讨会。研讨会的主题示例包括:(1)审查SARS-CoV、SARS-CoV-2、MERS-CoV和其他冠状病毒的现有动物模型;(2)确定哪些动物模型最适合研发具有广泛保护性的新冠病毒疫苗;(3)确定优化小动物模型(如小鼠、仓鼠、雪貂)使用的策略;(4)确定如何最好地优化和减少非人灵长类药物在研发工作中的使用,特别是考虑到其供应有限;(5)确定如何模拟动物模型中预先存在的免疫力;(6)确定如何使用动物模型来评估宿主基因组学或微生物组对疫苗性能的影响,例如通过使用“脏小鼠”;(7)确定动物模型在测量疫苗粘膜免疫、广度和耐久性方面的作用;(8)确定动物模型在定义免疫CoP中的作用;(9) 确定动物模型在研究长期 COVID/PASC 中的作用;(10)确定当前动物模型景观中的差距;(11)制定战略和计划,以满足未来的动物模型研究需求。 |
| 里程碑4.1.c:到2025年,确定最适合研究与冠状病毒疫苗研发相关的MERS-CoV的动物模型。 |
| 里程碑4.1.d(高优先级):到2025年,确保标准化、经过验证和表征良好的动物模型可用于评估和比较具有广泛保护性的冠状病毒疫苗。要考虑的参数示例包括挑战病毒株;激发的剂量、途径、体积和时间;以及动物对人类适应变异的反应。还应考虑免疫史和既往祖先冠状病毒暴露史。每个动物物种以及用于建立模型的每个病毒亚属或相关变异都需要适当的临床疾病严重程度替代标志物,例如体重减轻或肺部病毒滴度。 |
| 里程碑4.1.e:到2025年,对各种动物模型进行并排比较,以确定不同动物的传播动态,以及哪些动物最适合研究不同的SARS-CoV-2变体或其他冠状病毒。 |
| 里程碑4.1.f:到2026年,对不同动物模型中的多种候选疫苗进行比较研究,包括小型哺乳动物和非人灵长类。 |
| 里程碑4.1.g:到2026年,对人类和非人灵长类候选疫苗进行平行研究,尽可能紧密地对齐,例如使用相似的剂量和时间表,以获得从动物到人类的免疫桥接信息。 |
| 里程碑 4.1.h:到 2027 年,确保获得标准化、经过验证且表征良好的动物模型,以概括与人类 COVID-19 相关的严重急性疾病的范围,例如严重肺病、凝血病和神经系统疾病(Muñoz-Fontela 2022)。 |
| 战略目标4.2:确立CHIM在广泛保护性冠状病毒疫苗研发中的作用,并优化疫苗研究模式。 |
| 里程碑 4.2.a:到 2023 年,举办一次研讨会,阐明 CHIM 研究在评估广泛保护性冠状病毒疫苗方面的作用(Sekhar 2020)。关键问题的例子包括:(1)就如何将CHIM模型用于冠状病毒疫苗研究达成共识,(2)确定研究先前感染或疫苗接种免疫力对疫苗性能的作用的策略,(3)确定CHIM研究如何用于评估粘膜免疫和粘膜炎症标志物,(4)确定CHIM在建立CoP中的作用, (5)确定通过CHIM研究评估疫苗耐久性的策略,以及(6)阐明涉及导致人类轻度疾病的冠状病毒的CHIM研究如何为额外的冠状病毒疫苗研发提供信息(Deming 2020,Morens 2022)。 |
| 里程碑 4.2.b:到 2024 年,确定先前感染或接种 SARS-CoV-2 疫苗对涉及 SARS-CoV-2 疫苗的 CHIM 研究的潜在影响。 |
| 里程碑4.2.c(高优先级):到2024年,制定一套在冠状病毒疫苗研究中使用CHIM的最佳实践,以包括反映疾病和治疗不断变化的风险缓解策略。 |
| 里程碑4.2.d(高优先级):到2025年,与全球监管机构协调,确定使用CHIM研究和免疫桥接获得候选疫苗许可的参数。 |
| 里程碑 4.2.e(高优先级):到 2025 年,假设候选疫苗可用,则在评估广泛保护性冠状病毒疫苗时标准化 CHIM 模型的参数,例如确定适当的菌株选择(当时可能需要根据上下文进行定义)、标准化免疫学检测组合和检测协调、识别粘膜炎症标志物以及尽可能协调方案。 |
| 里程碑4.2.f:到2026年,建立国际能力和合作网络,开展广泛保护性冠状病毒疫苗的CHIM研究。 |
| 里程碑 4.2.g:到 2026 年(假设候选疫苗可用),确定先前感染或接种 SARS-CoV-2 疫苗对涉及广泛保护性冠状病毒疫苗的 CHIM 研究的潜在影响。 |
其他研究重点
- 进一步阐明非ACE2结合冠状病毒的受体位点,为冠状病毒疫苗研究的动物模型开发提供信息(Dai 2020)。(有关相关里程碑,请参阅适用于疫苗研发的病毒学。
- 进行研究以确定适合蝙蝠源性冠状病毒的动物模型,例如 2d 组 β 冠状病毒。
- 随着时间的推移,进一步完善动物模型,以模拟不同的人类状况,例如感染途径、潜在发病率、性别、高龄和免疫功能低下状态,这些都会影响对广泛保护性冠状病毒疫苗的免疫反应(Braxton 2021)。还应考虑建立动物模型来研究VAED的可能性。
- 持续确定使用动物模型研究评估 SARS-CoV-2 病毒变体出现的最佳策略,这些变体可以逃避疫苗接种或感染的免疫保护(Muñoz-Fontela,2022 年)。
- 继续探索如何使用来自动物模型或人类感染模型的数据来支持疫苗许可,以及定义此类数据作用的参数是什么。(有关相关里程碑,请参阅疫苗学。
- 持续确保为涉及非人灵长类的研究提供充足和持续的动物和资源,包括实验室空间(包括实验室空间),用于涉及非人灵长类的研究,特别是特定的无病原体非人灵长类(Contreras,2021 年)。
- 在 CHIM 中使用单细胞转录组学来剖析细胞特异性反应。
- 评估动物模型在研究长期COVID / PASC与疫苗研发的关系中的作用。
主题5:政策与融资
本节将讨论与将具有广泛保护性的冠状病毒候选疫苗推向市场相关的多种政策和融资问题。新疫苗的成功开发和广泛供应将需要重振和维持对疫苗研发的高度政治承诺和投资,以及加强全球生产和分销,以确保公平获取。详细分析,了解具有广泛保护性的新冠病毒疫苗的广泛潜在社会和经济效益,将为政策制定和必要的全球投资提供信息。
问题:多重市场力量阻碍了高收入、中等收入和低收入国家向国际社会提供广泛保护性冠状病毒疫苗。
障碍
- 目前的新冠病毒疫苗研发领域充斥着一系列专利、合同和协议;社会和经济不平等;制造能力的地理分布不均; 以及不稳定的资金。
- 新疫苗的研发非常昂贵。最近,政府和基金会提供了数十亿美元将SARS-CoV-2疫苗推向市场;然而,在总是有下一个变种、病毒或大流行威胁的环境中,维持持续资助的政治意愿和公众兴趣具有挑战性(柳叶刀委员会 2021 年),公众对此类大规模投资的支持正在减少(Branswell 2022)。此外,一旦危机过去,政府资金将更难获得,因为政府面临的压力是解决紧急危机,而不是长期战略。
- 疫苗可以是一个赢家通吃(或大多数)市场,与率先进入市场相比具有显着优势。在大流行或流行情况下尤其如此,在这种情况下,政府在其他候选疫苗有机会完成其临床开发之前就完全购买了第一种证明其有效性的疫苗。然而,早期SARS-CoV-2疫苗的免疫力迅速减弱,疫苗对变异株的效力下降,可能会削弱当前冠状病毒疫苗的一些率先上市优势。
- 除非发现疫苗存在问题,否则几乎没有动力投资于更好的或下一代疫苗(Agarwal 2022)。对于SARS-CoV-2疫苗,当前形势的财务风险和收益往往有利于对现有技术进行微小的改变,而不是对新技术的投资。例如,目前的一种商业模式是利用现有平台,在新变种出现时创建特定于它们的助推器。这种模式可能会改变创造特定菌株疫苗的现状,而不是扩大疫苗研发以生产具有广泛保护性的疫苗。
- 除非成本被政府或其他资助机构吸收,否则在专注于疫苗而不是其他可能具有更高单位利润、持续使用和稳定需求的药品时,公司将面临很高的机会成本(Cernuschi 2022)。
- 冠状病毒疫苗面临着一个由少数大型购买者主导的庞大全球市场。一个巨大的市场既可以看作是私人投资新疫苗的机会,也是阻碍。例如,高收入国家 (HIC) 的大市场可以带来更高的收入,但更大的市场也可以降低单位疫苗成本,因为政府或其他大型全球买家(如全球疫苗免疫联盟)谈判广泛的合同,这可能会塑造市场并导致定价灵活性降低(Haugen 2021, Agarwal 2022, 蒙拉德 2021 年)。
- 确保全球疫苗获取的公平性需要解决目前疫苗研发、制造和高收入国家购买力的地理集中问题,这可能导致疫苗市场的严重不平等。全球疫苗免疫联盟等组织通过新成立的COVID-19疫苗全球获取机制,在确保世界最贫困国家获得COVID-19疫苗方面发挥了关键作用。目前尚不清楚全球疫苗免疫联盟和COVAX机制在未来为中低收入国家采购具有广泛保护性的新冠病毒疫苗方面将发挥什么作用。
- 一些中等收入国家可能没有资格获得全球疫苗免疫联盟等组织的援助,可能无法获得低收入和高收入国家能够获得的疫苗(Cernuschi 2022)。
- 最大限度地提高疫苗接种的潜在效益取决于全球需求和疫苗接种率。这在很大程度上取决于这些疫苗是否会常规预防性使用(从而产生大量需求),或者是否会为应对疫情而储备(导致需求相对不确定)。疫苗开发商还记得疫苗市场需求不足的时候,这使得开发成本的收回变得不太确定(Kumraj 2022)。
差距
- 在基础和应用研究、实验室系统、研究基础设施和全球能力建设方面正在进行的大量努力正在努力将具有广泛保护性的冠状病毒疫苗推向全球市场。然而,这些努力并没有得到协调、广泛分享或旨在提高效率和避免重复。
- 与COVID-19大流行开始时投资新产品的紧迫性不同,在现阶段,可能需要一套有针对性的激励措施来鼓励可能优于第一代疫苗的新型疫苗技术。然而,在新技术被证明优于第一代疫苗之前,不能放弃或忽视具有良好记录的疫苗。
- 除了政府资金和非货币驱动因素的“推动”激励措施外,高收入国家和中低收入国家还需要“拉动”激励措施,例如预示着市场可预测和充足的提前市场承诺,以推动产品获得批准、制造和供应。需要制定战略来支持这些激励措施。
问题:知识产权是疫苗创新的一个关键方面,但也是有代价的。
障碍
- 新的候选疫苗可能基于一系列专利技术,其中许多已经存在。许多不同的专利适用于疫苗,从开发到组件,再到制造,再到交付(产权组织,2022年)。
- 尽管政府为学术和企业研发提供了大量资金,但这些公共基金的知识产权最终落入了私营部门、非政府领域。由此产生的知识产权是疫苗开发商业投资的重要激励因素,但当不清楚是否会通过使用公共资金建立相应的公众获取知识产权时,公共部门可能不愿意增加公共投资(Rees 2022b)。
- 只有部分关于下一代冠状病毒疫苗的专利。
- 从2020年到2021年9月30日,共申请了417项与COVID-19疫苗开发相关的专利(产权组织,2022年)。然而,专利出版物可能需要 18 个月才能公布(Alshrari 2022、Kitsara 2022、WIPO 2022)。专利公布时间因国家而异,从中国的7.7个月到美国的18.8个月和日本的18.9个月(产权组织,2022年)。由于进入公有领域的滞后性,这 417 项只是围绕 COVID-19 疫苗以及与疫苗研究、开发、测试和生产相关的技术的专利活动的早期迹象。
- 谈判许可协议和了解知识产权环境可能非常昂贵,并且需要专业知识,这可能导致疫苗开发商在寻求新方法时犹豫不决。
差距
- 世界贸易组织(WTO)协定的未来应用,包括与贸易有关的知识产权(TRIPS)灵活性在突发公共卫生事件中的应用是不确定的,需要澄清。
- 研发的公共资金奖励并不总是包括改善小型开发商、中低收入国家开发商以及更广泛的公共卫生需求时期的知识产权获取的条款。同样,除了少数例外(例如CEPI),公共投资并不迫使开发商承诺确保在中低收入国家成功开发产品后获得服务。
- 在 COVID-19 大流行期间进行的自愿许可和共享的长期结果尚不清楚。目前尚不清楚,当大流行“结束”时,目前尚未执行的知识产权将会发生什么。
- 需要努力澄清专利池的作用,例如世卫组织的 COVID-19 技术获取池 (C-TAP),以及利用不受专利保护的现有技术的疫苗(Hotez 2020,WHO 2020a)。
问题:及时获得具有广泛保护作用的冠状病毒疫苗将需要更大的生产能力。
障碍
- 如果出现一种新的冠状病毒引起另一场大流行,在全球范围内快速获得针对毒株的疫苗或具有广泛保护性的新冠病毒疫苗对于减轻大流行的影响至关重要。高收入国家和一些人口大国的制造和监管能力在全球范围内集中,这保证了它们的巨大市场。此外,在疫苗短缺的突发公共卫生事件期间,目前的疫苗行业可能会因为政府对疫苗出口的限制或有利于高收入国家的分层定价结构而成为保护主义者。就 COVID-19 而言,这两个因素都可能导致疫苗获取的不平等(Cernuschi 2022)。
- 成功的技术转让是复杂的,需要具有专业知识和能力、长期人力和财力投资以及政治意愿的可信赖合作伙伴(Kumraj,2022 年)。
- 各国监测GCP、GMP和GLP的监管能力水平参差不齐,中低收入国家的监管机构很少获得世卫组织疫苗成熟度3级,如果要考虑将当地生产的疫苗推向全球市场,这是必需的(Kumraj 2022)。
- 仅靠知识产权豁免可能不如基于制造能力和专业知识的良好和完整的技术转让成功(Prasad 2022)。
- 专利持有人正在寻找值得信赖的技术转让合作伙伴,以确保拥有生产高质量、安全疫苗的专业知识和经验,这些疫苗可以通过监管批准(Kahla 2022、Nohynek 2022、Rizvi 2022)。
- 制造能力不仅仅是建设设施和专业知识的问题,还包括保持这种能力并随着时间的推移保持财务可持续性的能力,尤其是在非大流行时期。
差距
- 在COVID-19大流行的下一阶段或随着大流行的减弱,自愿技术转让、不执行专利的承诺、世贸组织的行动、TRIPS的灵活性和许可协议将如何发挥作用尚不得而知。
- 在临床试验完成或疫苗监管部门批准之前,为有风险的生产提供资金,或扩大剂量生产,可能是在发生突发公共卫生事件时加快新疫苗供应的一种方式(Sampat 2021)。然而,目前人们对这些机制的兴趣不大,如何利用这些机制来推广具有广泛保护性的冠状病毒疫苗尚不清楚;因此,有必要进一步探讨解决这些问题的机制。
- 世卫组织及其合作伙伴在大韩民国建立了信使核糖核酸技术转让中心、全球生物制造培训中心,以及供监管机构解决全球生产能力问题的全球基准工具(世卫组织2021年、世卫组织2022年c、世卫组织2022年d)。 然而,仍需要努力实施这些计划,产生可持续的商业模式,扩大拥有最先进能力的公司的参与,并将努力扩展到 mRNA 技术以外的其他疫苗平台(全球疫苗免疫联盟,2022 年)。
主题 5:政策和融资的战略目标和一致的里程碑
| 战略目标5.1.确定并传达持续财政支持的价值和对开发广泛保护性冠状病毒疫苗的需求。 |
| 里程碑5.1.a(高优先级):到2024年,通过疫苗全值评估(FVVA)或一系列详细的成本效益分析,为从SARS-CoV-2变异证明疫苗到更广泛的保护性冠状病毒疫苗,制定和传播广泛保护性冠状病毒疫苗的详细经济案例。这些评估需要包括多个层面(例如全球、国家和区域)的多种观点(例如,健康支付者、经济和社会),并考虑到不同的背景(例如,人口统计、医疗保健能力、相互竞争的卫生优先事项)和潜在的部署途径,例如常规、预防性使用或反应性疫情控制(Giersing 2021)。 |
| 里程碑5.1.b:到2024年,制定有针对性的沟通和宣传战略以及必要的沟通工具,以FVVA或成本效益分析为基础,提供有关经济成本、未来冠状病毒威胁的风险以及持续投资冠状病毒疫苗研发的必要性的信息。 |
| 里程碑5.1.c(高优先级):到2024年,召开一次疫苗投资者、购买者(包括政府和大型全球机构)、生产商和政府代表会议,旨在探讨为广泛保护性冠状病毒疫苗提供可靠市场和财务模式的战略。与会者将评估当前的推动(例如,赠款、补贴)和拉动激励措施(例如,预先市场承诺)以及从推动到拉动的适当门槛,并建立符合各种特征疫苗的可预期 PPC 的定价模型,例如所需剂量、稳定性、保护期限、 和保护级别。 |
| 里程碑5.1.d:到2025年,探索制定协调方法的战略,以产生可持续的长期资金,涉及公共和私人合作伙伴,旨在支持广泛保护性冠状病毒疫苗的研发。 |
| 战略目标 5.2.重新评估知识产权的现状,以改善涉及新技术的信息共享。 |
| 里程碑5.2.a:到2023年,就学术或公共资助研究产生的知识产权许可如何解决不平等问题达成共识,并从研究的最初阶段采用全球公平获取条款。 |
| 里程碑5.2.b:到2024年,启动一个资源中心,支持可能不具备有效获取专利技术的资源或背景知识的科学家的许可谈判和知识产权能力建设。 |
| 战略目标 5.3.建立可持续和更平衡的生产能力地理分布,并利用专业知识生产供当地使用的高质量疫苗。 |
| 里程碑5.3.a:到2024年,就疫苗生产可接受的地理分布以及从变异株特异性SARS-CoV-2疫苗过渡到广泛保护性冠状病毒疫苗的潜在途径达成共识。 |
| 里程碑5.3.b:到2027年,提供必要资源,确保100%具有疫苗生产能力的国家能够至少部分实施世卫组织全球基准工具(世卫组织2021年)确定的世卫组织检查指标。 |
| 里程碑5.3.c:到2028年,通过支持生产各种疫苗平台技术的全球举措:(1)设计和建造符合疫苗GMP标准的生产基地,(2)转让各种疫苗平台和其他相关技术的专业知识,以及(3)开始在至少几个新地点生产疫苗,并计划随着时间的推移和大流行之间的年份保持产能(全球疫苗免疫联盟,2022年, 药品专利池 2022)。 |
其他研究重点
- 协调努力,以应对广泛保护性冠状病毒疫苗研发融资面临的各种挑战。
- 加强科学家、疫苗开发商、制造商、资助者和政府机构之间的全球共享和沟通。
- 回顾COVID-19大流行初期TRIPS协议和自愿不执行知识产权的经验。
- 继续收集有关冠状病毒疫苗的作用和影响(包括疫苗有效性)的数据,以建立疫苗需求,这反过来将影响政策制定。
引用
Adams LE、Leist SR、Dinnon KH 等人,Fc 介导的 αbirus 载体疫苗接种后的泛沙贝病毒保护。(预印本)bioRxiv 2022 年 11 月 22 日;11.28.518175 [全文]
阿加瓦尔 R, Gaule P.是什么推动了创新?COVID-19 R&D. J Health Econ 2022 年 3 月的教训;82:102591 [全文]]
Aguilar-Bretones M、Fouchier RA、Koopmans MP 等人。抗原进化和原抗原罪对SARS-CoV-2免疫的影响。临床投资杂志 2023 年 1 月 3 日;133(1):e162192 [全文]
Ahmed-Hassan H、Sisson B、Shukla RK 等人。对高致病性冠状病毒和其他重大呼吸道病毒感染的先天免疫反应。Front Immunol 2020 年 8 月 18 日;11:1979 [全文]]
Alkhovsky S、Lenshin S、Romashin A 等人,俄罗斯马蹄蝠 (Rhinolophus spp) 中的 SARS 样冠状病毒,2020 年。病毒 2022 1月 9;14(1):113 [全文]
Alshrari AS、Hudu SA、Imran M 等人。Covid-19疫苗的创新和开发:专利审查。J 感染公共卫生 2022 年 1 月;15(1):123-31 [全文]
阿尔特曼 DM,博伊顿 RJ。COVID-19疫苗接种:前方的道路。科学 2022 3月 10;375(6585):1127-32 [全文]
Ansariniya H、Seifati SM、Zaker E 等人。SARS、MERS 和 COVID-19 感染之间的免疫反应比较,对疫苗设计和开发的看法。Biomed Res Int 2021 Jan 22:8870425 [全文]
Anthony SJ、Johnson CK、Greig DJ 等。冠状病毒多样性的全球模式。病毒卷 2017 1 月;3(1):vex012 [全文]
Arevalo CP、Bolton MJ、Le Sage V 等人。一种针对所有已知流感病毒亚型的多价核苷修饰 mRNA 疫苗。科学 2022 11 月 25;378(6622):899-904 [摘要]
Azzi L、Dalla Gasperina D、Veronesi G 等人。BNT162b2 COVID-19 疫苗接种者的粘膜免疫反应。eBioMedicine 2022年1月;75:103788 [全文]]
Babady NE、Burckhardt RM、Krammer F 等人。为 COVID-19 及以后建立有弹性的科学网络。mBio 2022 年 9 月至 10 月;13(5):e02223-22 [全文]
Baric R. 泛冠状病毒疫苗开发的主要挑战。在世卫组织关于COVID-19疫苗研究——推进泛沙贝病毒疫苗开发的磋商会上的发言。2022 年 3 月 25 日 [演讲于 13:54:00]
Bean DJ,Sagar M. 家庭对冠状病毒疾病和疫苗的影响。(解说)J Clin Invest 2021 年 12 月 15 日;131(24):e155615 [全文]
比斯利 DWC、Brasel TL、Comer JE。根据 FDA 动物规则首次批准疫苗。NPJ 疫苗 2016;1:16013 [全文]
Begum J、Mir NA、Dev K 等人。基于SARS和MERS疫苗开发进展的COVID-19疫苗开发的挑战和前景。Transbound Emerg Dis 2021 年 5 月;68(3):1111-24 [全文]
Belyakov IM,阿勒斯 JD。免疫途径在产生针对粘膜病原体的保护性免疫中起什么作用?J Immunol 2009 年 12 月 1 日;183(11):6883-92 [全文]
Bhattacharya,D,指导 COVID-19 和其他可接种疫苗疾病的持久体液免疫。免疫力 2022 6 月 14 日;55(6):945-64 [全文]
Bigay J、Le Grand R、Martinon F 等人。人类和动物模型中与疫苗相关的增强疾病:疫苗开发的经验教训和挑战。Front Microbiol 2022 年 8 月 10 日;13:932408 [全文]]
Bolles M、Deming D、Long K 等人。双重灭活的严重急性呼吸系统综合症冠状病毒疫苗对小鼠的保护不完全,并在攻击时诱导嗜酸性粒细胞促炎性肺反应增加。J Virol 2011 年 12 月;85(23):12201-15 [全文]
Bots SH、Riera-Arnau J、Belitser SV 等。与 SARS-CoV-2 疫苗相关的心肌炎和心包炎:使用来自四个欧洲国家的电子医疗保健数据进行基于人群的描述性队列和嵌套的自我控制风险区间研究。Front Pharmacol 2022 年 11 月 24 日;13:1038043 [全文]]
布兰斯韦尔 H.随着需求开始减弱,COVID-19疫苗市场正变得越来越拥挤。统计 2022年3月21日 [全文]
Braxton AM、Creisher PS、Ruiz-Bedoya CA 等。仓鼠作为严重急性呼吸系统综合症冠状病毒-2的模型。Comp Med 2021 年 10 月;71(5):398-410 [全文]
布里托 C,阿尔特 G.疫苗设计的下一个前沿领域:将保护的免疫相关性融入合理的疫苗设计中。Curr Opin Immunol 2022 年 8 月 13 日;78:102234 [全文]]
布罗克赫斯特 JK,维拉诺 JS。动物研究在大流行应对中的作用。Comp Med 2021 年 10 月;71(5):359-68 [全文]
Brüssow H. COVID-19:疫苗接种问题。Environ Microbiol 2021 年 6 月;23(6):2878-90 [全文]
Cameroni E、Bowen JE、Rosen LE 等。广泛的中和抗体克服了 SARS-CoV-2 Omicron 抗原转移。自然 2022 2 月 24;602(7898):664-70 [全文]
Carmen JM, Shrivastava S, Lu Z, et al. SARS-CoV-2 铁蛋白纳米颗粒疫苗诱导强大的先天免疫活性,驱动多功能刺突特异性 T 细胞反应。NPJ 疫苗 2021 年 12 月 13 日;6:151 [全文]]
Carvalho C、Gaspar A、Knight A 等人。关于非人灵长类动物实验室研究的伦理和科学陷阱,以及可能的解决方案。动物(巴塞尔)2019年1月;9(1):12 [全文]
卡塞尔·马布、罗伦 RG、崔 YK。冠状病毒感染的实验动物模型:优势和局限性。免疫网 2021 年 4 月 26 日;21(2):e12 [全文]
卡瓦列里 M.关键的临床前挑战是什么,如何在下一次大流行之前为未来的候选药物解决这些挑战?世卫组织小组讨论:从近期疫情中采取科学策略,帮助我们为病原体X做好准备,第2天,第5场会议。2022 年 8 月 30 日 [演讲时间 2:38:00]
CBD(生物多样性公约)。《关于获取遗传资源和公正和公平分享其利用所产生惠益的名古屋议定书》。联合国环境规划署《生物多样性公约》秘书处。2011 [附全文链接的网页]
Cernuschi T、Malvolti S、Hall S 等人。寻求更有效的疫苗市场——机遇、挑战以及 SARS-CoV-2 大流行带来的变化。疫苗。2022年10月21日 [全文]
塞万提斯 M、赫斯 T、莫比奥利 GG 等人。ACE-2 受体加速,但不是 SARS-CoV-2 膜融合的生化要求。(预印本) bioRxiv 2022 Oct 24:513347 [全文]
Chen L, Liu B, Yang J, et al. DBatVir:蝙蝠相关病毒数据库。数据库(牛津)2014年3月18日;2014:bau021 [全文]
Chen Z, Azman AS, Chen X, et al.SARS-CoV-2基因组监测和数据共享的全球格局。Nat Genet 2022 年 4 月;54(4):499-507 [全文]
Chiu NC, Chi H, Tu YK, et al.混合还是不混合?异源初免-加强 covid-19 疫苗接种的快速系统评价。专家修订疫苗 2021 年 10 月;20(10):1211-20 [全文]
CIDRAP的。流感疫苗研发路线图。2021年9月 [全文]
Cohen AA、Gnanapragasam PNP、Lee YE 等人。马赛克纳米颗粒在小鼠中引发对人畜共患冠状病毒的交叉反应性免疫反应。科学 2021 2 月 12;371(6530):735-41 [全文]
Cohen AA、van Doremalen N、Greaney AJ 等人。马赛克RBD纳米颗粒可防止动物模型中的多种沙贝病毒挑战。(预印本) bioRxiv 2022 Mar 28 [全文]
科恩 J.梦想中的疫苗:为什么只停留在SARS-CoV-2上?正在开发的疫苗旨在同时预防多种冠状病毒。科学 2021 4月 16;372(6539):227-31 [全文]
Collier AY、Brown CM、McMahan KA 等人。突破性感染 SARS-CoV-2 delta 变体后完全接种疫苗的个体免疫反应的表征。Sci Transl Med 2022 4月 20;14(641):eabn6150 [全文]
Contreras MA、Arnegard、ME、Chang MC 等。用于 SARS-CoV-2 研究的非人灵长类动物模型:管理对无特定病原体 (SPF) 动物的需求。(评论)Lab Anim 2021 年 8 月;50:200-1 [全文]
科顿 M、罗伯逊 DL、潘 MVT。SARS-CoV-2 相对于其他沙贝病毒的独特蛋白质特征。病毒 Evol 2021;7(2):veab067 [全文]
Crowe JE Jr. 用于病毒感染的人类抗体。Annu Rev Immunol 2022 年 4 月 26 日;40:349-86 [摘要]
Cucinotta D, Vanelli M. 世卫组织宣布COVID-19为大流行。生物医学学报 2020;91(1):157-60 [全文]
坎宁安 AA、达扎克 P、伍德 JLN。“同一个健康”、新出现的传染病和野生动植物:二十年的进展?Philos Trans R Soc Lond B Biol Sci 2017;372(1725):20160167 [全文]
戴玲, 郑涛, 徐坤, 等.针对 COVID-19、MERS 和 SARS 的 β 冠状病毒疫苗的通用设计。细胞 2020 8 月 6 日;182(3):722-33 [全文]
Dangi T、Palacio N、Sanchez S 等人。冠状病毒疫苗接种和冠状病毒感染后的交叉保护性免疫。J Clin Invest 2021 年 12 月 15 日;131(24):e151969 [全文]
DeGrace MM、Ghedin E、Frieman MB 等。定义 SARS-CoV-2 变体对免疫保护的风险。(透视)自然 2022;605:640-52 [全文]
Deming ME、Michael NL、Robb M 等人。加速 SARS-CoV-2 疫苗的开发——人类感染受控模型的作用。(透视)N Engl J Med 2020 年 9 月 3 日;383(10):e63 [全文]
钻石 MS,Kanneganti TD。先天免疫:抵御SARS-CoV-2的第一道防线。Nat Immunol 2022 年 2 月;23(2):165-176 [全文]
DiPiazza AT、Leist SR、Abiona OM 等人 COVID-19 疫苗 mRNA-1273 在 SARS-CoV-2 攻击后在小鼠中引发与疫苗增强疾病无关的保护性免疫特征。免疫力 2021 年 8 月 10 日;54(8):1869-82.e6 [全文]
ECDC(欧洲疾病预防和控制中心)。中东呼吸综合征冠状病毒全球概览:最新情况。2022 年 12 月 5 日。访问时间:2023 年 1 月 9 日 [网页]
经济学家。在世界各地,新冠病毒的监测正在步履蹒跚。经济学家 2023 年 1 月 7 日 [引言]
Eguia RT、Crawford KHD、Stevens-Ayers T 等人。人类冠状病毒通过抗原进化以逃避抗体免疫。PLOS Pathog 2021 年 4 月 8 日;17(4):e1009453 [全文]
El-Sayed A, Kamel M. 人类和动物中的冠状病毒:蝙蝠在病毒进化中的作用。环境科学污染研究国际 2021;28(16):19589-600 [全文]
埃斯皮诺萨 C, 阿拉尔孔 M.对 SARS-CoV-2 的免疫反应:机制、衰老、后遗症和疫苗。Mini Rev Med Chem 2022 年;22(16):2166-85 [全文]
Fan C, Wu Y, Rui X, 等.COVID-19 动物模型:进展、差距和前景。信号转导目标 2022 年 7 月 7 日;7(1):220 [全文]
法利 J.可以提前制定主要监管原则吗?世卫组织小组讨论:从近期疫情中采取科学策略,帮助我们为病原体X做好准备,第2天,第4节。2002 年 8 月 30 日 [演讲时间 2:35:00]
Forni D、Cagliani R、Clerici M 等人。人类冠状病毒基因组的分子进化。趋势微生物 2017 年 1 月;25(1):35-48 [全文]
Frere JJ、Serafini RA、Pryce KD 等人。 仓鼠和人类感染 SARS-CoV-2 会导致康复后持久且独特的全身扰动。Sci Transl Med 2022 9月 28;14(664):eabq3059 [全文]
Frutos R、Serra-Cobo J、Pinault L 等人。蝙蝠相关β冠状病毒的出现:危害和风险。Front Microbiol 2021 年 3 月 15 日;12:591535 [全文]]
Gaebler C, Wang Z, Lorenzi JCC, et al.SARS-CoV-2 抗体免疫的演变。自然 2021 3月;591(7851):639-44 [全文]
Gartlan C、Tipton T、Salguero FJ 等人。疫苗相关的增强疾病和致病性人类冠状病毒。Front Immunol 2022 年 4 月 4 日;13:882972 [全文]]
全球疫苗免疫联盟(Gavi),即疫苗联盟。在非洲扩大可持续疫苗生产:优先支持。2022年11月 [全文]
Ghai RR、Carpenter A、Liew AY 等。新出现的甲型冠状病毒和乙型冠状病毒的动物宿主和宿主。Emerg Infect Dis 2021 年;27(4):1015-22 [全文]
Giersing B、Shah N、Kristensen D 等人。疫苗产品创新战略:为低收入和中等收入国家采用产品开发创造有利环境。疫苗 2021 年 12 月 3 日;39(49):7208-19 [全文]
Giersing BK、Porter CK、Kotloff K、Neels P 等人。受控人类感染模型如何加速志贺氏菌疫苗的临床开发和政策途径?疫苗 2019 年 8 月 7 日;37(34):4778-83 [全文]
Gilbert PB、Donis RO、Koup RA 等。实现了 Covid-19 的里程碑——与疫苗保护相关。N Engl J Med 2022 年 12 月 15 日;387(24):2203-6 [全文] (Gilbert 2022a)
Gilbert PB、Montefiori DC、McDermott AB 等。mRNA-1273 COVID-19 疫苗功效临床试验的免疫相关分析。科学 2022 1 月 7 日;375(6576):43-50 [全文] (Gilbert 2022b)
GISAID(共享所有流感数据全球倡议)。2022 年 10 月 10 日访问 [网页]
Goldblatt D、Alter G、Crotty S 等人。预防 SARS-CoV-2 感染和 COVID-19 疾病的相关性。Immunol Rev 2022 年 9 月;310(1):6-26 [全文] (Goldblatt 2022a)
Goldblatt D、Fiore-Gartland A、Johnson M 等人。实现基于人群的COVID-19疫苗保护阈值。疫苗 2022 年 1 月 21 日;40(2):306-15 [全文] (Goldblatt 2022b)
Goraichuk IV、Arefiev V、Stegniy BT 等。SARS-CoV-2 的人畜共患和反向人畜共患传播性。病毒研究 2021;302:198473 [全文]]
格拉林斯基 LE,巴里克 RS。新出现的冠状病毒感染的分子病理学。J Pathol 2015 年;235(2):185-95 [全文]
格里福尼 A, 塞特 A.从阿尔法到奥密克戎:T细胞的反应。Curr Res Immunol 2022 年;3:146-50 [全文]
Hachmann NP、Miller J、Collier AY 等人。SARS-CoV-2 Omicron 亚变体 BA.2.12.1、BA.4 和 BA.5 的中和逃逸。(通信)N Engl J Med 2022 年 7 月 7 日;387(1):86-8 [全文]
Halfmann PJ, Frey SJ, Loeffler K, et al. 基于多价 S2 的疫苗可针对 SARS-CoV-2 变异株和穿山甲冠状病毒提供广泛的保护。eBioMedicine 2022年12月;86:104341 [全文]]
Harrison PW、Lopez R、Rahman N 等人。COVID-19 数据门户:通过快速开放获取数据共享加速 SARS-CoV-2 和 COVID-19 研究。核酸研究 2021 年 7 月 2 日;49(W1):W619-23 [全文]
Harvey WT、Carabelli AM、Jackson B 等人 SARS-CoV-2 变体、刺突突变和免疫逃逸。Nat Rev Microbiol 2021 年;19(7):409-24 [全文]
豪根 HM.TRIPS(与贸易有关的知识产权协定)是否阻止COVID-19疫苗成为全球公共产品?J World Intellect Prop 2021 年 7 月;24(3-4):195-220 [全文]
Hauser BM、Sangesland M、St Denis KJ 等人。合理设计的免疫原可在 SARS-CoV-2 刺突印记后实现免疫聚焦。细胞代表 2022 年 3 月 22 日;38(12):110561 [全文]
Hild SA、Chang MC、Murphy SJ 等。用于 SARS-CoV-2 研究的非人灵长类动物模型:大流行防范的基础设施需求。(评论)Lab Anim 2021 年 6 月;50(6):140-1 [全文]
Hodgson SH、Mansatta K、Mallett G 等人。什么是有效的COVID-19疫苗?评估SARS-CoV-2疫苗临床疗效的挑战综述。《柳叶刀感染》杂志 2021 年 2 月;21(2):e26-e35 [全文]
Holmes EC、Goldstein SA、Rasmussen AL 等人。SARS-CoV-2 的起源:批判性评论。细胞 2021 Sep 16;184(19):4848-56 [全文]
Hotez PJ,Bottazzi ME。为全球健康开发低成本且可及的 COVID-19 疫苗。PLOS Negl Trop Dis 2020 年 7 月 29 日;14(7):e0008548 [全文]
Houtman J、Shultz L、Rivera JM 等人。变体、亚系和重组体:不断变化的 SARS-CoV-2 基因组。洛克菲勒基金会。2022年3月25日 [全文]
Hsieh CL、Werner AP、Leist SR 等。稳定的冠状病毒刺突茎可引发广泛的保护性抗体。细胞代表 2021 年 11 月 2 日;37(5):109929 [全文]
Huang AT、Garcia-Carreras B、Hitchings MDT 等。抗体介导的冠状病毒免疫的系统评价:动力学、保护相关性以及与严重程度的关联。Nat Commun 2020 年 9 月 17 日;11:4704 [全文]
胡 B, 郭 H, 周 P, 等.SARS-CoV-2 和 COVID-19 的特征。Nat Rev Microbiol 2021 年 3 月;19(3):141-54 [已发表的更正:Nat Rev Microbiol 2022 May;20(5):315] [全文]]
胡 B, 曾LP, 杨XL, 等.蝙蝠SARS相关冠状病毒基因库的发现为SARS冠状病毒的起源提供了新的见解。PLOS Pathog 2017 年 11 月 30 日;13(11):e1006698 [全文]
Inoue T, Shinnakasu R, Kurosaki T. 高质量记忆 B 细胞的产生。Front Immunol 2022 年 1 月 12 日;12:825813 [全文]]
INSDC(国际核苷酸序列数据库协作)。访问时间:2023 年 1 月 12 日 [网站]
Irving AT、Ahn M、Goh G 等人。从蝙蝠的宿主防御中吸取教训,蝙蝠是一种独特的病毒库。自然 2021 年 1 月;589(7842):363-70 [全文]
Iwasaki A. 利用粘膜免疫进行抗病毒疫苗。Annu Rev Immunol 2016 年 5 月 20 日;34:575-608 [摘要]
呼吁通过利用多种保护相关性来改变通用流感疫苗的设计范式。专家Opin Drug Discov 2020年12月;15(12):1441-55 [摘要]
Jarnagin K、Alvarez O、Shresta S 等人。用于 SARS-Cov2/Covid19 研究的动物模型。(解说)Biochem Pharmacol 2021年6月;188:114543 [全文]]
约翰霍普金斯大学与医学院。冠状病毒资源中心。受影响最严重国家的死亡率。访问时间:2022 年 12 月 28 日 [网站]
Joyce MG、King HAD、Elakhal-Naouar I 等人。SARS-CoV-2 铁蛋白纳米颗粒疫苗在非人灵长类动物中引发保护性免疫反应。Sci Transl Med 2022 2 月 16 日;14(632):eabi5735 [全文]
Kahla K. 访问和问责制。在世卫组织:COVID-19研究和创新论坛上的演讲:为世界大流行应对提供动力——现在和未来。第 2 天,第 1 部分。2022 年 2 月 24 日至 25 日 [演讲时间 2:20:00]
Kaplonek P、Cizmeci D、Fischinger S 等人 mRNA-1273 和 BNT162b2 COVID-19 疫苗引发的抗体在 Fc 介导的效应器功能方面存在差异。Sci Transl Med 2022 Mar 29:eabm2311 [全文]
Karczmarzyk K, Kesik-Brodacka M. 攻击门口的入侵者:粘膜抗 SARS-CoV-2 疫苗的前景。病原体 2022 1 月 19;11(2):117 [全文]
卡里姆SSA。疫苗和SARS-CoV-2变异株:迫切需要相互关联的保护。(通信)柳叶刀 2021 年 4 月 3 日;397(10281):1263-4 [全文]
Kent SJ、Khoury DS、Reynaldi A 等人。解开 T 细胞反应在 COVID-19 中的相对重要性:主演还是配角?Nat Rev Immunol 2022 年 6 月;22(6):387-97 [全文]
Keusch GT、Amuasi JH、Anderson DE 等人。大流行起源和“同一个健康”的防范和预防方法:基于SARS-CoV-2和其他RNA病毒的解决方案。美国国家科学院院刊 2022 年 10 月 18 日;119(42):e2202871119 [全文]
Khoury DS、Cromer D、Reynaldi A 等人。中和抗体水平高度预测对有症状的 SARS-CoV-2 感染的免疫保护。Nat Med 2021 年 7 月;27(7):1205-11 [全文]
Khoury DS、Schlub TE、Cromer D 等人。SARS-CoV-2 感染中保护、保护阈值和免疫桥接的相关性。(预印本) medRxiv 2022 Jun 6 [全文]
Killingley B、Mann AJ、Kalinova M 等人。年轻人 SARS-CoV-2 人类挑战期间的安全性、耐受性和病毒动力学。国家医学 2022;28(5):1031-41 [全文]
金毅, Casel MAB, 崔 YK.SARS-CoV-2变异株在动物模型中的传播性和致病性。微生物学杂志 2022 年 3 月;60(3):255-67 [全文]
Kistler KE, Bedford T. 季节性冠状病毒 OC43 和 229e 受体结合域适应性进化的证据。 eLife 2021;10:e64509 [全文]
基萨拉一世。COVID疫苗和治疗方法的专利迷宫。在世卫组织的演讲:COVID-19研究和创新:为世界大流行应对提供动力——现在和未来。第 2 天,第 1 部分。2022 年 2 月 24 日至 25 日 [演讲时间为 1:50:00]
Krammer F. 预防 SARS-CoV-2 感染的相关性。柳叶刀 2021 年 4 月 17 日;397(10283):1421-3 [全文]
Krammer F. 免疫反应,可预防严重疾病和变异,短期和长期保护。在世卫组织研发蓝图磋商会上的演讲:制定评估新型COVID-19疫苗的框架。2022年2月23日 [全文]
Krause PR、Arora N、Dowling W 等人。提供更多COVID-19疫苗以满足全球需求:考虑因素及其评估框架。疫苗 2022 9 月 22;40(40):5749-51 [全文]
Kumraj G、Pathak S、Shah S 等人。发展中国家疫苗生产能力建设:前进方向。嗡18(1):2020529 [全文]
Labombarde JG、Pillai MR、Wehenkel M 等人。广泛反应性流感抗体的诱导增加了自身免疫的易感性。细胞代表 2022 年 3 月 8 日;38(10):110482 [全文]
莱德劳 BJ,Ellebedy AH。生发中心 B 细胞对 SARS-CoV-2 的反应。Nat Rev Immunol 2022 年 1 月;22(1):7-18 [全文]
柳叶 刀。大流行中的基因组测序。(社论)柳叶刀 2021 年 2 月 6 日;397(10273):445 [全文]
柳叶刀 COVID-19 疫苗和治疗委员会工作组成员。曲速行动:对全球疫苗安全的影响。柳叶刀全球健康 2021 年 7 月;9(7):e1017-21 [全文]
Latinne A, 胡 B, Olival KJ, et al.中国蝙蝠冠状病毒的起源和跨物种传播.Nat Commun 2020 年 8 月 25 日;11:4235 [全文]
拉维尔 EC,沃德 RW。粘膜疫苗——巩固边界。Nat Rev Immunol 2022 年 4 月;22(4):236-50 [全文]
Lednicky JA、Tagliamonte MS、White SK 等。海地儿童中猪 delta 冠状病毒的独立感染。自然 2021;600(7887):133-7 [全文]
Lee A, Wimmers F, Pulendran B. 表观遗传佐剂:用佐剂对先天免疫系统进行持久重编程。Curr Opin Immunol 2022 年 8 月;77:102189 [全文]]
Letko M, Marzi A, Munster V. SARS-CoV-2 和其他谱系 B β 冠状病毒的细胞进入和受体使用的功能评估。Nat Microbiol 2020 年 4 月;5(4):562-9 [全文] (Letko 2020b)
Letko M、Seifert SN、Olival KJ 等人。蝙蝠传播病毒的多样性、溢出和出现。Nat Rev 微生物学 2020;18(8):461-71 [全文] (Letko 2020a)
Li YD, Chi WY, Su JH, 等.冠状病毒疫苗开发:从SARS和MERS到COVID-19。生物医学杂志 2020;27(1):104 [全文]
Logue JK, Chu HY.为应对大流行建立人类免疫分析队列研究的挑战和经验教训。Immunol Rev 2022 年 8 月;309(1):8-11 [全文]
Mackin SR、Desai P、Whitener BM 等。Fcγ受体依赖性抗体效应器功能是疫苗保护免受SARS-CoV-2抗原变异感染所必需的。(预印本) bioRxiv 2022 年 11 月 27 日 [全文]
MacLean OA、Lytras S、Weaver S 等人。蝙蝠 SARS-CoV-2 进化过程中的自然选择创造了一种通才病毒和强大的人类病原体。PLOS Biol 2021 年 3 月;19(3):e3001115 [全文]
Mani A, Ojha V. COVID-19 疫苗接种后的血栓栓塞:对 286 名患者此类事件的系统评价。Ann Vasc Surg 2022 Aug;84:12-20.e1 [全文]
Mannar D, Saville JW, Sun Z, et al. 关注的 SARS-CoV-2 变体:刺突蛋白突变分析和用于广泛中和的表位。Nat Commun 2022 年 8 月 18 日;13:4696 [全文]
毛 T, 以色列人B, 佩尼亚-埃尔南德斯, 等.无佐剂鼻内刺突疫苗可引起针对 沙贝病毒es 的保护性粘膜免疫。科学 2022 11 月 25;378(6622):eabo2523 [全文]
马尔科夫 PV, Katzourakis A, Stilianakis NI.抗原进化将导致严重程度不可预测的新 SARS-CoV-2 变体。Nat Rev 微生物学 2022;20(5):251-2 [全文]
Martinez DR、Schäfer A、Leist SR 等。嵌合刺突 mRNA 疫苗可预防小鼠的沙贝病毒攻击。科学 2021 8月 27;373(6558):991-8 [全文]
Matuchansky C. 对 SARS-CoV-2 的粘膜免疫:破译自然和疫苗诱导的防御的临床相关关键。临床微生物感染 2021 年 12 月;27(12):1724-6 [全文]
McCray PB Jr、Pewe L、Wohlford-Lenane C 等人。感染严重急性呼吸系统综合症冠状病毒的K18-hACE2小鼠的致死感染。J Virol 2007 年;81(2):813-21 [全文]
麦格拉思 JJC、李 L、威尔逊 PC。记忆B细胞多样性:优化疫苗设计的见解。趋势免疫 2022 年 5 月;43(5):343-54 [全文]
McMahan K、Giffin V、Tostanoski LH 等人。降低 SARS-CoV-2 omicron 变体在仓鼠中的致病性。(简短沟通)Med (NY) 2022 年 4 月 8 日;3(4):262-8.e4 [全文]
药品专利池。MRNA技术转让中心计划。2022 [网站]
Meisner J、Baszler TV、Kuehl KE 等。SARS-CoV-2 从人类到宠物的家庭传播,美国华盛顿州和爱达荷州。Emerg Infect Dis 2022 年 10 月 26 日;28(12):2425-34 [全文]
Mendelson M、Venter F、Moshabela M 等人。英国对南非实施旅行禁令的政治舞台。(评论)柳叶刀 2021 年 12 月 18 日;398(10318):2211-3 [全文]
Mettelman RC, Allen EK, Thomas PG. 呼吸道感染和疫苗接种的粘膜免疫反应。免疫 2022 年 5 月 10 日;55(5):749-80 [全文]
小米 JK, Jaimes JA, Whittaker GR. 冠状病毒宿主细胞进入受体的分子多样性。FEMS 微生物修订版 2021 年 5 月;45(3):fuaa057 [全文]
米斯拉 A,泰尔 ES。对 SARS-CoV-2 的免疫力:我们知道什么,我们应该对其进行检测吗?临床微生物学杂志 2022 年 6 月;60(6):e00482-21 [全文]
Modjarrad K、Moorthy VS、Ben Embarek P 等人。中东呼吸综合征冠状病毒研究和产品开发路线图:世界卫生组织磋商报告。Nat Med 2016 年 7 月 7 日;22(7):701-5 [全文]
蒙拉德 JT、桑德布林克 JB、Cherian NG。促进针对新出现的大流行的多功能疫苗开发。NPJ 疫苗 2021 年 2 月 11 日;6:26 [全文]]
莫伦斯 DM、陶本伯格 JK、福奇 AS。重新思考针对冠状病毒、流感病毒和其他呼吸道病毒的下一代疫苗。细胞宿主微生物 2023 年 1 月 11 日;31(1):146-57 [全文]
莫伦斯 DM、陶本伯格 JK、福奇 AS。通用冠状病毒疫苗——迫切需求。(透视)N Engl J Med 2022 年 1 月 27 日;386(4):297-9 [全文]
苔藓 P.针对 SARS-CoV-2 的 T 细胞免疫反应。Nat Immunol 2022 年 2 月;23(2):186-93 [全文]
Mostaghimi D、Valdez CN、Larson HT 等。预防SARS-CoV-2疫苗的宿主间传播。柳叶刀感染 Dis 2022 年 2 月;22(2):e52-8 [全文]
Mudgal R, Nehul S, Tomar S. 粘膜疫苗的前景:关闭 SARS-CoV-2 的大门。嗡嗡声 Vaccin Immunother 2020;16(12):2921-31 [全文]
Mueni Katee S, Keambou Tiambo C. 讨论在 COVID-19 大流行后实施《名古屋议定书》获取和惠益分享的弊端。(意见)前线公共卫生 2021 年 12 月 10 日;9:639581 [全文]]
Munoz FM、Cramer JP、Dekker CL 等人,布莱顿合作疫苗相关增强疾病工作组。疫苗相关强化疾病:病例定义和数据收集、分析和免疫安全性数据呈现指南。疫苗 2021 年 5 月 21 日;39(22):3053-66 [全文]
Muñoz-Fontela C、Dowling WE、Funnell SGP 等。COVID-19动物模型。自然 2020年10月;586(7830):509-15 [全文]
Muñoz-Fontela C、Widerspick L、Albrecht RA 等人。SARS-CoV-2感染模型的进展和差距。PLOS Pathog 2022 年 1 月;18(1):e1010161 [全文]
纳尔逊 SA,圣 AJ。通过鼻内疫苗接种增强肺粘膜免疫力。(透视)Front Immunol 2021 年 12 月 14 日;12:808527 [全文]]
吴彦娴, Tan YJ.了解蝙蝠SARS样冠状病毒为未来冠状病毒爆发做准备——对冠状病毒疫苗开发的影响。嗡嗡声 Vaccin Immunother 2017 年 1 月 2 日;13(1):186-9 [全文]
Nohynek H. 获取和问责制。在世卫组织的演讲:COVID-19研究和创新:为世界大流行应对提供动力——现在和未来。第 2 天,第 1 部分。2022 年 2 月 24 日至 25 日 [演讲时间为 2:38:00]
Obermeyer F、Jankowiak M、Barkas N 等人。对 640 万个 SARS-CoV-2 基因组的分析确定了与健康相关的突变。科学 2022 年 5 月 24 日;376(6599):1327-32 [全文]
Openshaw PJM。使用相关性来加速疫苗学。(透视)科学 2022 1 月 6;375(6576):22-3 [全文]
Oude Munnink BB, Worp N, Nieuwenhuijse DF, et al.SARS-CoV-2监测的下一阶段:实时分子流行病学。Nat Med 2021 年 9 月;27(9):1518-24 [全文]
包装 SM,彼得斯 PJ。SARS-CoV-2特异性候选疫苗;结构疫苗学的贡献。疫苗 2022;10(2):236 [全文]
Peacock TP、Penrice-Randal R、Hiscox JA 等人 SARS-CoV-2 一年后:持续病毒适应的证据。J Gen Virol 2021 年;102(4):001584 [全文]
Pecetta S、Kratochvil S、Kato Y 等人。严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 疫苗的免疫学和技术。药理学修订版 2022 年 1 月;74(1):313-39 [全文] (Pecetta 2022b)
Pecetta S,Rappuoli R. mRNA,一种新的流感疫苗游戏的开始。美国国家科学院院刊 2022 年 12 月 13 日;119(50):e2217533119 [全文] (Pecetta 2022a)
Peiris JS、Yuen KY、Osterhaus AD 等。严重急性呼吸系统综合症。N Engl J Med 2003 年 12 月 18 日;349(25):2431-41 [全文]
Pickering B、Lung O、Maguire F 等人。高度分化的白尾鹿SARS-CoV-2,具有潜在的鹿与人传播。Nat Microbiol 2022 年 12 月;7:2011-24 [全文]
普洛特金SA。疫苗接种诱导的保护相关性。临床疫苗免疫 2010 年 7 月;17(7):1055-65 [全文]
普洛特金SA。疫苗诱导保护的免疫学相关性更新。疫苗 2020 年 2 月 24 日;38(9):2250-7 [摘要]
、野兔和疫苗:SARS-CoV-2疫苗开发的警示说明。(社论)疫苗 2020 6月 2;38(27):4219-20 [全文]
波兰 GA、Ovsyannikova IG、肯尼迪 RB。对广泛保护性 COVID-19 疫苗的需求:超越仅 S 的方法。疫苗 2021 7 月 13;39(31):4239-41 [全文]
Prasad SD. 访问和问责制。在世卫组织的演讲:COVID-19研究和创新:为世界大流行应对提供动力——现在和未来。第 2 天,第 1 部分。2022 年 2 月 24 日至 25 日 [演讲时间为 2:15:00]
Qi H, Liu B, Wang X, 等.针对 SARS-CoV-2 感染的体液反应和抗体。Nat Immunol 2022 年 6 月 27 日;23:1008-20 [全文]
秦淑, 李蕊, 郑志, 等.呼吸道冠状病毒感染的选定动物模型及其在药物研究中的应用综述.J Med Virol 2022 年 7 月;94(7):3032-42 [全文]
Rabalski L、Kosinski M、Mazur-Panasiuk N 等人。SARS-CoV-2 的人畜共患溢出:适应水貂的病毒在人类中。(研究笔记)临床微生物感染 2022 年 3 月;28(3):451.e1-451.e4 [全文]
任 W, 曲旭, 李 W, 等.严重急性呼吸系统综合症 (SARS) 冠状病毒和蝙蝠来源的 SARS 样冠状病毒之间受体使用的差异。J Virol 2008 年;82(4):1899-1907 [全文]
里斯 H.我们如何前瞻性地评估旨在预防尚未传播的病毒的疫苗?在世卫组织关于COVID-19疫苗研究——推进泛沙贝病毒疫苗开发的磋商会上的发言。2022 年 3 月 25 日 [3:17:00 演讲] (Rees 2022a)
里斯 H.未来的方向是什么?在世卫组织关于COVID疫苗研究的磋商会上的发言——我们为什么需要泛沙贝病毒疫苗?2022 年 1 月 28 日 [5:11:00 演示] (Rees 2022b)
Ribeiro CDS、van Roode MY、Haringhuizen GB 等。微生物的所有权如何影响传染病控制和创新:对关键利益相关者所经历的数据共享障碍的根本原因分析。PLOS One 2018 年 5 月 2 日;13(5):e0195885 [全文]
里兹克 JG、巴尔 CE、里兹克 Y、勒温 JC。疫苗安全和VAERS的下一个前沿:COVID-19的经验教训和十项行动建议。疫苗 2021 10 月 1 日;39(41):6017-8 [全文]
Rizvi Z. 访问和问责制。在世卫组织的演讲:COVID-19研究和创新:为世界大流行应对提供动力——现在和未来。第 2 天,第 1 部分。2022 年 2 月 24 日至 25 日 [演讲时间为 2:31:00]
Rodda LB、Morawski PA、Pruner KB 等。印迹 SARS-CoV-2 特异性记忆淋巴细胞定义了混合免疫。细胞 2022 Apr 28;185(9):1588-601.e14 [全文]
Ruiz-Aravena M、McKee C、Gamble A 等人。蝙蝠冠状病毒的生态学、进化和溢出。Nat Rev 微生物学 2022;20(5):299-314 [全文]
Sampat BN,Shadlen KC。COVID-19 创新系统。Health Aff (Millwood) 2021 年 3 月;40(3):400-9 [摘要]
Sánchez CA、Li H、Phelps KL 等。评估东南亚蝙蝠SARS相关冠状病毒溢出风险的策略。自然通讯 2022 年 8 月 9 日;13(1):4380 [全文]
Sauer MM、Tortorici MA、Park YJ 等。广泛中和冠状病毒的结构基础。Nat Struct Mol Biol 2021 年 6 月;28(6):478-86 [全文]
Saunders KO、Lee E、Parks R 等人。用于大流行性和出现前冠状病毒的中和抗体疫苗。自然 2021 6 月;594(7864):553-9 [全文]
Seifert SN、Bai S、Fawcett S 等人。俄罗斯蝙蝠中的ACE2依赖性沙贝病毒对SARS-CoV-2疫苗具有抗药性。PLOS Pathog 2022 年 9 月;18(9):e1010828 [全文]
Sekhar A, Kang G. 疫苗开发中的人体挑战试验。Semin Immunol 2020 年;50:101429 [全文]]
Sette A, Crotty S. 对 SARS-CoV-2 和 COVID-19 的适应性免疫。细胞 2021 2 月 18;184(4):861-80 [全文]
Sette A, Crotty S. SARS-CoV-2 感染和 COVID-19 疫苗的免疫记忆。Immunol Rev 2022 年 9 月;310(1):27-46 [全文]
Sharun K, Dhama K, Pawde AM, et al. 动物中的SARS-CoV-2:未知宿主的可能性和公共卫生影响。兽医Q2021;41(1):181-201 [全文]
Shepherd BO, Chang D, Vasan S, et al. HIV 和 SARS-CoV-2:追踪疫苗研发之路。Curr HIV/AIDS Rep 2022 年 2 月;19(1):86-93 [全文]
谢尔曼 AC、Desjardins M、巴登 LR。疫苗诱导的严重急性呼吸系统综合症冠状病毒 2 抗体反应和加速发展的途径(确定保护的相关性)。临床医学实验室 2022 年 3 月;42(1):111-28 [全文]
Sherman AC、Mehta A、Dickert NW 等。流感的未来:人类挑战模型和系统生物学的回顾,以促进流感疫苗学的发展。Front Cell Infect Microbiol 2019 年 4 月 17 日;9:107 [全文]]
Shou S, Liu M, Yang Y, 等.COVID-19动物模型:仓鼠、小鼠、雪貂、水貂、树鼩和非人灵长类动物。Front Microbiol 2021 年 8 月 31 日;12:626553 [全文]]
Shuai H, Chan JF-W, Yuen TT-T, 等.新出现的 SARS-CoV-2 变体将物种向性扩展到鼠类。eBioMedicine 2021年11月;73:103643 [全文]]
西金斯 MK、斯韦茨 RS、Openshaw PJM。对 SARS-CoV-2 和其他呼吸道病毒的免疫力持久性。趋势微生物 2021 年 7 月;29(7):648-62 [全文]
Sila T、Sunghan J、Laochareonsuk W 等。2021 年 7 月至 9 月,泰国疑似猫传人 SARS-CoV-2。Emerg Infect Dis 2022 年 7 月;28(7):1485-8 [全文]
Simon V、Kota V、Bloomquist RF 等人 PARIS 和 SPARTA:寻找 SARS-CoV-2 的致命弱点。mSphere 2022 5 月至 6 月;7(3):e00179-22 [全文]
Simons LM、Ozer EA、Gambut S 等人。免疫抑制患者中 SARS-CoV-2 刺突突变的新出现。Transpl Infect Dis 2022 年 12 月;24(6):e13914 [全文]
Singh A、Singh RS、Sarma P 等人。冠状病毒动物模型的全面综述:SARS-CoV-2、SARS-CoV 和 MERS-CoV。Virol Sin 2020 年 6 月;35(3):290-304 [全文]
Singh J、Pandit P、McArthur AG 等。SARS-CoV-2 和新出现的变体的进化轨迹。维罗尔杂志 2021;18:166 [全文]]
Soraci L、Lattanzio F、Soraci G 等人 COVID-19 疫苗:当前和未来的前景。疫苗(巴塞尔) 2022 年 4 月 13 日;10(4):608 [全文]
Starr TN、Czudnochowski N、Liu Z 等人 SARS-CoV-2 RBD 抗体可最大限度地提高逃逸的广度和抵抗力。自然 2021 年 9 月 2 日;597(7874):97-102 [全文]
Starr TN, Zepeda SK, Walls AC, et al. ACE2 结合是 沙贝病毒es 的祖先和可进化的特征。自然 2022 3月;603(7903):913-8 [全文]
Subbarao K.SARS-CoV-2疫苗的成功和未来的挑战。细胞宿主微生物 2021 年 7 月 14 日;29(7):1111-23 [全文]
隋 Y, 贝克勒 Y, Berzofsky JA.SARS-CoV-2 免疫与感染和疫苗免疫保护的潜在相关性。病原体 2021 年 2 月;10(2):138 [全文]
孙军, 庄志, 郑军, 等.生成用于 COVID-19 发病机制、疫苗接种和治疗的广泛有用的模型。细胞 2020 8 月 6 日;182(3):734-43.e5.[全文]
Sung HD、Kim N、Lee Y 等。用于 SARS-CoV-2 的基于蛋白质的纳米颗粒疫苗。国际分子科学杂志 2021;22(24):13445 [全文]
Suryawanshi R, Ott M. SARS-CoV-2 混合免疫:银弹还是一线希望?Nat Rev Immunol 2022 年 10 月;22(10):591-2 [全文]
Tan CCS、Lam SD、Richard D 等。SARS-CoV-2 从人类传播到动物以及潜在的宿主适应。Nat Commun 2022 年 5 月 27 日;13:2988 [全文]]
Tan CW、Chia WN、Young BE 等。BNT162b2 免疫 SARS-CoV-1 幸存者中的泛沙贝病毒科病毒中和抗体。(简要报告)N Engl J Med 2021 年 10 月 7 日;385(15):1401-6 [全文]
Tarke A, Coelho CH, Zhang Z, et al. SARS-CoV-2 疫苗接种诱导免疫 T 细胞记忆,能够交叉识别从 Alpha 到 Omicron 的变异。细胞 2022 3 月 3 日;185(5):847-59.e11 [全文]
Telenti A、Hodcroft EB、Robertson DL。SARS-CoV-2 变体的进化和生物学。2022 年 5 月 27 日冷泉 Harb Perspect Med;12(5):a041390 [全文]
Temmam S、Vongphayloth K、Baquero E 等人。蝙蝠冠状病毒与 SARS-CoV-2 相关,对人体细胞具有传染性。自然 2022 4 月 14 日;604(7905):330-6 [全文]
Terrier O、Si-Tahar M、Ducatez M 等。流感病毒和冠状病毒:已知、未知和共同的研究挑战。PLOS Pathog 2021 年 12 月;17(12):e1010106 [全文]
Tomalka JA、Suthar MS、Deeks SG 等。抗击SARS-CoV-2大流行需要采取全球方法来了解疫苗反应的异质性。Nat Immunol 2022 年 3 月;23(3):360-70 [全文]
特里切尔AM。SARS-CoV-2 非人灵长类动物模型概述。Comp Med 2021 年 10 月;71(5):411-32 [全文]
牛津大学。COV-CHIM01:SARS-CoV-2 (COVID-19) 剂量发现感染研究。ClinicalTrials.gov 标识符:NCT04864548。首次发布于 2021 年 4 月 29 日;2023 年 1 月 6 日更新 [审判记录]
美国 DDHS(卫生与公众服务部)。指导涉及增强潜在大流行病原体的拟议研究的资助决策的框架。2017:1-6 [全文]
美国FDA(食品和药物管理局)。动物规则信息。访问时间:2022 年 12 月 21 日 [网页]
美国食品和药物管理局。FDA 批准了第一种 COVID 19 疫苗。2021年8月23日 [新闻稿]
美国食品和药物管理局。行业指南:开发预防全球传染病的疫苗的一般原则。2011年12月 [全文]
van Kampen JJA、van de Vijver DAMC、Fraaij PLA 等。2019 年冠状病毒病 (COVID-19) 住院患者传染性病毒脱落的持续时间和关键决定因素。Nat Commun 2021 年 1 月 11 日;12:267 [全文]]
Vardhana S, Baldo L, Morice WG 2nd, et al. 了解 T 细胞对 COVID-19 的反应对于制定公共卫生策略至关重要。(观点)Sci Immunol 2022 年 3 月 24 日;7(71):eabo1303 [全文]
Verbeke R、Hogan MJ、Loré K 等人。mRNA疫苗的先天免疫机制。免疫力 2022 11 月 8 日;55(11):1993-2005 [全文]
Wahl I, Wardemann H. 灭菌免疫:了解 COVID-19。免疫力 2022 12 月 13 日;55(12):2231-5 [全文]
Walls AC、Miranda MC、Schäfer A 等人。通过受体结合域纳米颗粒疫苗引发广泛保护性沙贝病毒科病毒免疫。细胞 2021 10 月 14 日;184(21):5432-47.e16 [全文]
Wang M, Yan M, Xu H, et al. 棕榈果子狸餐厅的SARS-CoV感染。Emerg Infect Dis 2005年;11(12):1860-5 [全文]
Wang S, Li L, Yan F, et al. COVID-19 动物模型和疫苗:现状和未来前景.疫苗(巴塞尔)2021年10月;9(10):1082 [全文]
Wells HL、Letko M、Lasso G 等人。ACE2 在冠状病毒亚属沙贝病毒中的使用进化历史。病毒卷 2021 年 1 月;7(1):veab007 [全文]
Wherry EJ,巴鲁奇 DH。T 细胞对 COVID-19 疫苗的免疫力。(透视)科学 2022 8月 19;377(6608):821-2 [全文]
WHO(世界卫生组织)。冠状病毒 (COVID 19) 仪表板。2022 年 12 月 20 日 [网页] (WHO 2022a)
谁。COVID-19 疫苗追踪器和景观。2023 (每半周更新一次) [网页]
谁。C-TAP:概念文件。2020年10月27日 [全文] (WHO 2020a)
谁。全球流感监测和应对系统(GISRS)。2022 年 10 月 3 日访问 [网页] (WHO 2022b)
谁。《名古屋议定书》的执行和病原体共享:对公共卫生的影响。2017年2月1日 [全文]
谁。为了实现促进当地药品生产的目标,世卫组织在大韩民国建立了全球生物制造培训中心。2022年2月23日 [新闻稿] (世卫组织 2022c)
谁。关于紧急使用清单程序指南的问答。2020年7月15日 [全文] (WHO 2020b)
谁。研发蓝图。2022 年 11 月 21 日访问 [网页]
谁。mRNA技术转移中心。2022 年 7 月 5 日访问 [网页] (WHO 2022d)
谁。世卫组织用于评估国家医疗产品监管体系的全球基准工具(GBT)——修订版六。2021年5月10日【全文】]
世卫组织IVB(免疫、疫苗和生物制剂)产品和交付研究单位。首选产品特性和目标产品配置文件。访问时间:2023 年 1 月 12 日 [网页]
WIPO(世界知识产权组织)。COVID-19相关疫苗和疗法:对大流行期间相关专利活动的初步见解。2022 [全文]
Williams E、Craig K、Chiu C 等人。COVID-19人类挑战研究的伦理审查:HRA/WHO联合研讨会。疫苗 2022 年 6 月 9 日;40(26):3484-9 [全文]
威特 AN、格林 RD、温特伯恩 AN。恒河猴 (Macaca mulatta)、食蟹猴 (Macaca fascicularis)、非洲绿猴 (Chlorocebus aethiops) 和雪貂 (Mustela putorius furo) 作为 COVID-19 大型动物模型的荟萃分析。Comp Med 2021 年 10 月;71(5):433-41 [全文]
Wong LR, Zheng J, Wilhelmsen K, et al.类花生酸信号阻断可保护中年小鼠免受严重 COVID-19 的侵害。自然 2022 年 5 月 5 日;605(7908):146-51 [全文]
Woo PC, Lau SK, Huang Y, et al.冠状病毒多样性、系统发育和种间跳跃。Exp Biol Med (Maywood) 2009年10月;234(10):1117-27 [全文]
Worobey M、Levy JI、Serrano LM 等。武汉的华南海鲜批发市场是 COVID-19 大流行的早期震中。科学 2022 8月 26;377(6609):951-9 [全文]
Wuertz KM, Barkei EK, Chen WH, et al.SARS-CoV-2 刺突铁蛋白纳米颗粒疫苗可保护仓鼠免受 Alpha 和 Beta 病毒变体攻击。NPJ 疫苗 2021 年 10 月 28 日;6:129 [全文]]
熊琦, 曹玲, 马 C, 等.蝙蝠中MERS-CoV的近亲使用ACE2作为其功能受体。自然 2022 12 月 22;612(7941):748-57 [全文]
Yewdell JW。抗原漂移:了解 COVID-19。免疫力 2021 12 月 14;54(12):2681-7 [全文] (Yewdell 2021a)
Yewdell JW。个人不能依赖COVID-19群体免疫:对病毒性疾病的持久免疫仅限于具有专性病毒血症传播的病毒。PLOS Pathog 2021 年 4 月 26 日;17(4):e1009509 [全文] (Yewdell 2021b)
Yu D, Walker LSK, Liu Z, et al. 靶向 TFH系列人类疾病和疫苗接种中的细胞:基本原理和实践。Nat Immunol 2022 年 8 月;23(8):1157-68 [全文]
Yu ED, Narowski TM, Wang E, et al.在大流行前的三年内纵向评估了对普通感冒冠状病毒COVID19免疫记忆。细胞宿主微生物 2022 年 9 月 14 日;30(9):1269-78.e4 [全文]
Yuan M, Wu NC, Zhu X, 等.SARS-CoV-2 和 SARS-CoV 受体结合域中高度保守的隐匿表位。科学 2020;368(6491):630-3 [全文]
Zaki AM、van Boheemen S、Bestebroer TM 等人。从沙特阿拉伯一名肺炎患者身上分离出一种新型冠状病毒。(简要报告)N Engl J Med 2012 年 11 月 8 日;367(19):1814-20 [全文]
Zarnitsyna VI、Ellebedy AH、Davis C 等人。抗体掩盖抗原表位塑造了对流感的体液免疫反应。Philos Trans R Soc Lond B Biol Sci 2015 年 9 月 5 日;370(1676):20140248 [全文]
郑 MZM, Wakim LM.呼吸道中的组织驻留记忆 T 细胞。粘膜免疫 2022 年 5 月;15(3):379-88 [全文]
Zehr JD、Pond SLK、Martin DP 等。犬冠状病毒最近的人畜共患溢出和趋向性转移与刺突蛋白 NTD 亚域的松弛选择和假定的功能丧失有关。病毒 2022 Apr 21;14(5):853 [全文]
周, 宋G, 何伟, 等.广泛中和的抗 S2 抗体可预防导致严重疾病的所有三种人类 β 冠状病毒。(预印本) bioRxiv 2022 Mar 7 [全文]
周 Z, Ali A, Walelign E, et al.2017-2020年埃塞俄比亚单峰骆驼中东呼吸综合征冠状病毒的遗传多样性和分子流行病学。新兴微生物感染 2023 年 1 月 9:2164218 [全文]
周, 慧凯柏, 苏瑞, 等.对来自非洲的中东呼吸综合征冠状病毒进行表型和遗传表征,以了解其人畜共患病潜力。美国国家科学院院刊 2021 年 6 月 22 日;118(25):e2103984118 [全文]
朱楠, 张东, 王伟, 等.2019年来自中国肺炎患者的新型冠状病毒。N Engl J Med 2020 年 2 月 20 日;382(8):727-33 [全文]
Ziogas A, Netea MG. 训练有素的免疫相关疫苗:先天免疫记忆和针对感染的异源保护。趋势 Mol Med 2022 6月;28(6):497-512 [摘要]
Zmasek CM、Lefkowitz EJ、Niewiadomska A 等人。冠状病毒科的基因组进化。病毒学 2022 年 5 月;570:123-33 [全文]
附录 A:缩略语
ABSL Animal biosafety level
ACE2 Angiotensin converting enzyme-2
BSL Biosafety level
C-TAP COVID-19 Technology Access Pool
CEPI Coalition for Epidemic Preparedness Innovations
CFR Case-fatality ratio
CHIM Controlled human infection model
CIDRAP Center for Infectious Disease Research and Policy (University of Minnesota)
CoP Correlate of protection
COVAX COVID-19 Vaccines Global Access
COVID-19 Coronavirus Disease 2019
CVR Coronavirus Vaccines R&D Roadmap
DNA Deoxyribonucleic acid
DPP4 Dipeptidyl peptidase 4
FcR Fc receptor
FVVA Full value of vaccine assessment
GCP Good clinical practice
GISAID Global Initiative on Sharing All Influenza Data
GISRS Global Influenza Surveillance and Response System
GLP Good laboratory practice
GMP Good manufacturing practice
hACE2 Human angiotensin converting enzyme-2
HICs High-income countries
IgA Immunoglobulin A
IgG Immunoglobulin G
LMICs Low- and middle-income countries
ME&A Monitoring, evaluation, and adjustment
MERS-CoV Middle East respiratory syndrome coronavirus
mRNA Messenger ribonucleic acid
MICs Middle-income countries
NHP Nonhuman primate
NIAID National Institute of Allergy and Infectious Diseases
NIH National Institutes of Health
NRA National regulatory authority
NTD N-terminal domain
PASC Post-acute sequelae of SARS-CoV-2 infection
PPCs Preferred product characteristics
R&D Research and development
RBD Receptor binding domain
RCT Randomized controlled trial
RNA Ribonucleic acid
S Spike (spike protein)
SARS-CoV Severe acute respiratory syndrome coronavirus
SARS-CoV-2 Severe acute respiratory syndrome coronavirus 2
SMART Specific, measureable, achievable, realistic/relevant, and time-sensitive
SME Subject-matter expert
Th T helper (T helper cells)
TPP Target product profile
TRIPS Trade Related Aspects of Intellectual Property Rights
TRM Tissue resident memory
US FDA United States Food and Drug Administration
VAED Vaccine-associated enhancement of disease
VOCs Variants of concern
WHO World Health Organization
WTO World Trade Organization
附录 B:贡献者
有关指导小组成员、工作组成员、CIDRAP撰稿人和CIDRAP编辑/设计人员的名单,他们为广泛保护性冠状病毒疫苗研发路线图的制定做出了贡献,请参阅PDF中的附录B或CVR网站关于页面。
附录 C:按主题领域和战略目标划分的 CVR 高优先级里程碑
主题1:适用于疫苗研发的病毒学 |
| 战略目标1.1:加强和维持识别、表征和分享全球研究人员感兴趣、关注和影响重大的SARS-CoV-2变异株的能力。 |
| 里程碑1.1.d:到2024年,制定一个财务上可持续的合作性国际计划,以实时快速识别、表征和共享有关SARS-CoV-2病毒的信息,包括抗原信息,并有可能建立在现有系统的基础上,如世卫组织的全球流感监测和应对系统(GISRS)(世卫组织2022b,Harvey 2021,Subbarao 2021)。 |
| 战略目标1.2:改进对冠状病毒的表征,以确定必要的毒株多样性,以确保疫苗研发的覆盖范围足够广。 |
| 里程碑1.2.c:到2024年,制定一种共识方法,对冠状病毒进行优先排序和选择,这些冠状病毒将构成一个最佳多样化的小组,用于疫苗研发,以评估保护的广度(Baric 2022)。选择标准最初应侧重于以下 α 冠状病毒和 β 冠状病毒:(1) 使用 hACE2 受体,(2) 在原代人类细胞中生长,(3) 具有遗传多样性,(4) 具有抗原特性,以及 (5) 具有可供研究的菌株。 |
| 里程碑1.2.f:到2024年,至少生成一个初始病毒库存组合,其中包含不同的冠状病毒和容易对多种冠状病毒敏感的多种细胞系,并使从事冠状病毒疫苗研发的研究人员可以使用该组合(Letko 2020a,Ruiz-Aravena 2022)。 |
主题2:免疫学和免疫保护相关性 |
| 战略目标2.1:确保研究界能够获得临床样本和免疫测定,以提高对与SARS-CoV-2感染相关的粘膜和全身免疫机制的理解。 |
| 里程碑 2.1.a:到 2023 年,开发一个集中式或虚拟生物储存库以及相关的治理结构,以使用 COVID-19 大流行前的临床样本,包括目前可从一系列研究实验室获得的粘膜(例如洗鼻液和唾液)和血清学样本,可能通过利用现有的生物库。 里程碑 2.1.c:到 2024 年,建立并资助一个集中式或虚拟生物储存库,涉及来自世界多个地区的新受试者队列,包括有 SARS-CoV-2 感染史的受试者,以获得高影响力(例如,粘膜、支气管肺泡灌洗、血清学、骨髓)以及适当收集和定时的临床样本。 里程碑 2.1.d:到 2024 年,按照里程碑 2.1.b 中确定的计划,为 SARS-CoV-2 研究开发新的免疫学检测方法,并确保此类检测方法具有适当的协调性、标准化和可重复性。 |
| 战略目标2.2:确定与SARS-CoV-2感染相关的粘膜和全身免疫机制,并开发具有广泛保护性的冠状病毒疫苗。 |
| 里程碑 2.2.d:到 2027 年,确定粘膜生物标志物,包括粘膜免疫的全身替代物 (Matuchansky 2021),这些标志物可预测针对 SARS-CoV-2 感染的粘膜免疫保护。 |
| 战略目标2.3:阐明刺激对不同冠状病毒具有交叉反应的广泛保护性粘膜和全身免疫反应的机制。 |
| 里程碑 2.3.a:到 2024 年,确定除 S 蛋白的 RBD 区域以外的表位,这些表位产生保护性体液免疫并在各种病毒类型中保持保守(Cohen J 2021、Crowe 2022、Martinez 2021、Saunders 2021、Walls 2021)。 |
| 战略目标2.4:了解SARS-CoV-2和其他冠状病毒免疫保护的持久性机制。 |
| 里程碑 2.4.a:到 2024 年,确定影响 SARS-CoV-2 感染或疫苗接种后抗体和记忆 B 细胞和 T 细胞反应持续时间的初始因素,例如生发中心的持久性(Bhattacharya 2022、Moss 2022、Siggins 2021、Tarke 2022)。 |
| 战略目标2.6:确定SARS-CoV-2疫苗和广泛保护性冠状病毒疫苗产生的免疫保护的机制相关性。 |
| 里程碑 2.6.c:到 2026 年,确定经过统计验证的 CoP,以根据与特定临床终点相关且适用于具有不同特征的病毒变异的关键免疫反应来预测 SARS-CoV-2 疫苗的功效。 里程碑 2.6.d:到 2027 年,确定一项或多项针对 SARS-CoV-2 感染的粘膜疫苗的 CoP。 |
主题3:疫苗学 |
| Strategic Goal 3.1: Define goals for broadly protective coronavirus vaccines by establishing a widely agreed upon and vetted set of PPCs and determine use cases for such vaccines. |
| 里程碑3.1.a:到2023年,在现有TPP的基础上,制定一套广泛商定和国际审查(例如,通过涉及世卫组织等国际多边组织的进程)的PPC,以确定关键产品特性, 包括最佳和关键的最低标准。这些疫苗可以采用分层方法,最初侧重于防变异的SARS-CoV-2疫苗,然后转向其他更广泛的保护层。 |
| 战略目标3.2.利用新技术或新方法创造有效、持久和安全的疫苗,为不同的冠状病毒提供广泛的保护。 |
| 里程碑3.2.b:到2023年,发布SARS-CoV-2粘膜疫苗研讨会的结果,以确定疫苗开发粘膜方法的差距。 里程碑3.2.d:到2024年,开发并向研究人员提供冠状病毒(如有)、假病毒(如果可以制造)和抗原的初始存储库。存储库可以分层开发,最初侧重于风险最高的病毒,然后随着时间的推移添加其他病毒。 里程碑3.2.i:到2027年,通过临床研究进一步阐明替代给药途径,包括鼻内、透皮、吸入和口服疫苗,是否可以增强粘膜免疫力并预防疾病和传播。 |
| 战略目标3.4.为未来冠状病毒疫苗的监管评估奠定基础。 |
| 里程碑3.4.b:到2023年,制定一套原则,为新型冠状病毒疫苗的监管评估提供信息,概述需要哪些信息来证明对抗变异SARS-CoV-2疫苗的需求和附加值,并提供对疫苗效力的信心,特别是与批准的疫苗相比。这套原则不如监管指南具体,因为许多细节仍未解决,但这些原则可以成为澄清此类疫苗监管评估的宝贵起点。 里程碑3.4.c:到2025年,在里程碑3.4.b的基础上,制定一套对未来更广泛的保护性冠状病毒疫苗进行监管评估的原则,这些原则:(1)遵循分层或逐步的方法(例如,首先预测对SARS-CoV-2以外的沙贝病毒的疗效,然后是美沙病毒,然后根据需要预测其他值得关注的冠状病毒的疗效);(2)考虑不同疫苗可能采用的各种保护机制,这可能为特定疫苗结构的潜在保护广度提供信息;(3)从监管角度阐明了“广泛保护性冠状病毒疫苗”的含义,以及如何在相关产品信息中传达保护的广度;(4)确定预测新疫苗对未在人群中传播的冠状病毒提供的保护(即预测潜在临床益处)的方法;(5)定义动物研究、人类感染研究和免疫桥接等工具在预测新疫苗保护广度方面的潜在作用和局限性;(6)阐明了新型冠状病毒疫苗的潜在监管途径。 |
| 战略目标3.5.促进开发具有满足全球需求特性的候选疫苗。 |
| 里程碑3.5.c:到2027年,支持开发适合广泛获取和全球分发的冠状病毒疫苗技术,例如冷链独立技术;是可扩展的;并且可以经济实惠地生产。 |
主题4:用于冠状病毒疫苗研究的动物和人类感染模型 |
| 战略目标4.1:确保开发适当的动物模型,并可用于进行广泛保护性冠状病毒疫苗的研发。 |
| 里程碑 4.1.a:到 2024 年,制定一项战略,以确保经过验证的可靠试剂;病毒株和病毒库;统一的血清学检测可用于在动物模型中研究更广泛的冠状病毒,最初侧重于其他 沙贝病毒(2b 组 β 冠状病毒)和更多种类的 MERS 相关 merbecovirus(2c 组 β 冠状病毒)。 里程碑4.1.b:到2024年,召开一次关于研究广泛保护性冠状病毒疫苗的动物模型国际研讨会。研讨会的主题示例包括:(1)审查SARS-CoV、SARS-CoV-2、MERS-CoV和其他冠状病毒的现有动物模型;(2)确定哪些动物模型最适合研发具有广泛保护性的新冠病毒疫苗;(3)确定优化小动物模型(如小鼠、仓鼠、雪貂)使用的策略;(4)确定如何最好地优化和减少非人灵长类药物在研发工作中的使用,特别是考虑到其供应有限;(5)确定如何模拟动物模型中预先存在的免疫力;(6)确定如何使用动物模型来评估宿主基因组学或微生物组对疫苗性能的影响,例如通过使用“脏小鼠”;(7)确定动物模型在测量疫苗粘膜免疫、广度和耐久性方面的作用;(8)确定动物模型在定义免疫CoP中的作用;(9) 确定动物模型在研究长期 COVID/PASC 中的作用;(10)确定当前动物模型景观中的差距;(11)制定战略和计划,以满足未来的动物模型研究需求。 里程碑4.1.d:到2025年,确保提供标准化、经过验证和表征良好的动物模型,以评估和比较具有广泛保护性的冠状病毒疫苗。要考虑的参数示例包括挑战病毒株;激发的剂量、途径、体积和时间;以及动物对人类适应变异的反应。还应考虑免疫史和既往祖先冠状病毒暴露史。每个动物物种以及用于建立模型的每个病毒亚属或相关变异都需要适当的临床疾病严重程度替代标志物,例如体重减轻或肺部病毒滴度。 |
| 战略目标4.2:确立CHIM在广泛保护性冠状病毒疫苗研发中的作用,并优化疫苗研究模式。 |
| 里程碑4.2.c:到2024年,制定一套在冠状病毒疫苗研究中使用CHIM的最佳实践,以包括反映疾病和疗法不断变化的风险缓解策略。 里程碑4.2.d:到2025年,与全球监管机构协调,确定使用CHIM研究和免疫桥接获得候选疫苗许可的参数。 里程碑 4.2.e:到 2025 年,假设候选疫苗可用,则在评估广泛保护性冠状病毒疫苗时,将 CHIM 模型的参数标准化,例如确定适当的菌株选择(当时可能需要根据上下文进行定义)、标准化免疫学检测组合和检测协调、识别粘膜炎症标志物以及尽可能协调方案。 |
主题5:政策与融资 |
| 战略目标5.1.确定并传达持续财政支持的价值和对开发广泛保护性冠状病毒疫苗的需求。 |
| 里程碑5.1.a:到2024年,通过疫苗全值评估(FVVA)或一系列详细的成本效益分析,为从SARS-CoV-2变异型疫苗到更广泛的保护性冠状病毒疫苗,制定和传播广泛保护性冠状病毒疫苗的详细经济案例。这些评估需要包括多个层面(例如全球、国家和区域)的多种观点(例如,健康支付者、经济和社会),并考虑到不同的背景(例如,人口统计、医疗保健能力、相互竞争的卫生优先事项)和潜在的部署途径,例如常规、预防性使用或反应性疫情控制(Giersing 2021)。 里程碑5.1.c:到2024年,召开一次疫苗投资者、购买者(包括政府和大型全球机构)、生产商和政府代表会议,旨在探讨为广泛保护性冠状病毒疫苗提供可靠市场和金融模式的战略。与会者将评估当前的推动(例如,赠款、补贴)和拉动激励措施(例如,预先市场承诺)以及从推动到拉动的适当门槛,并建立符合各种特征疫苗的可预期 PPC 的定价模型,例如所需剂量、稳定性、保护期限、 和保护级别。 |
https://cvr.cidrap.umn.edu/roadmap
Hits: 63




Thank you for your sharing. I am worried that I lack creative ideas. It is your article that makes me full of hope. Thank you. But, I have a question, can you help me?