Contents
IDSA 2025 Guidelines on the Use of Vaccines for the Prevention of Seasonal COVID-19, Influenza, and RSV Infections in Immunocompromised Patients
2025年美国传染病学会关于在免疫功能低下患者中使用疫苗预防季节性COVID-19、流感和呼吸道合胞病毒感染的指南
发布时间2025年10月17日
最后更新2025年11月18日
最后更新:
2025年11月18日
在线发表:
有关新冠病毒、流感和呼吸道合胞病毒疫苗使用的更多指导,请参考以下链接:
孕妇:美国妇产科医师学会
此内容已更正/更新。查看更新历史
作者:
阿诺玛·内洛尔*、保罗·戈普费特*、陈萨布丽娜·谭*、克里斯蒂娜·巴耶马、凯瑟琳·贝尔登、迪恩·布隆伯格、摩根·J·卡茨、丹尼尔·考尔、坦维·夏尔马、施韦塔·安詹、埃拉·J·阿里扎-埃雷迪亚、弗朗西斯科·马加纳、蒂莫西·明尼尔、詹妮弗·洛夫莱斯、迪普利恩·考尔**、伊丽莎白·约克**、英格夫·法尔克-伊特**、林赛·巴登**
关键词:
免疫功能低下 疫苗接种 成人与儿童 家庭接触者, 联合接种(新冠病毒、 流感 RSV)
背景
为支持2025-2026年呼吸道感染季基于证据的临床决策和共同决策,美国传染病学会(IDSA)制定了关于免疫功能低下的成人和儿童患者使用美国许可的新冠病毒、流感和呼吸道合胞病毒(RSV)疫苗的快速指南。
免疫功能低下患者指的是因基础疾病(如艾滋病、恶性肿瘤)或必须服用的药物(如实体器官移植后用药)导致免疫系统受损的个体。本指南不纳入患有慢性器官功能障碍的患者(如需要透析的终末期肾病、肝硬化或终末期心脏病患者)。
这些建议适用于患有血液系统恶性肿瘤、原发性免疫缺陷、接受免疫抑制剂或生物制剂治疗的自身免疫性疾病、患有严重免疫抑制的HIV(CD4<15%或<200/mm³)的患者,以及实体器官移植(SOT)受者、造血细胞移植(HCT)受者、嵌合抗原受体T细胞疗法(CAR-T)接受者或实体瘤化疗患者。
方法
IDSA专家小组包括在传染病、血液学/肿瘤学、实体器官移植、免疫学、病毒学/疫苗学、免疫抑制药物和单克隆抗体、儿科学以及艾滋病领域具有专业知识的临床医生。该小组针对每种疫苗的使用提出了一个临床问题(“免疫功能低下患者是否应使用[病毒]疫苗而非不使用疫苗?”),并确定了疫苗有效性和不良事件的患者重要结局(例如,分别为住院、死亡率、进展为重症;以及严重不良事件,或免疫功能低下或自身免疫性疾病的恶化)。
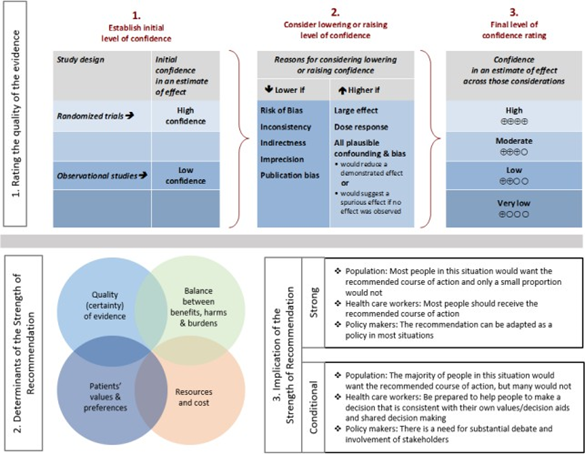
为制定建议的依据,专家小组回顾了自美国疾病控制与预防中心(CDC)针对每种疫苗的上一次建议所依据的证据发布后的18至24个月内发表的最佳可用证据(新冠病毒的搜索起始日期为2024年6月;呼吸道合胞病毒的搜索起始日期为2024年8月;流感的搜索起始日期为2023年8月,搜索截止日期均为2025年7月31日)。利用疫苗完整性项目开展的系统性文献综述结果,以及针对其他患者重要结局的补充搜索,美国传染病学会(IDSA)专家小组采用GRADE(推荐意见的评估、制定与评价分级)方法来评估证据的确定性,并确定每项建议的强度(图1)。
汇总的疫苗有效率及相应的相对效应指标(RR、HR、OR)已汇总于GRADE证据概况中。为更好地说明人群效应,通过使用队列研究的基线风险估计以及来自已发表的累积发病率的额外估计值[1](经免疫功能低下状态调整)来计算绝对风险差异。采用ROBINS-I工具评估纳入研究的偏倚风险。使用既定的GRADE标准对每个结局及各项研究的总体证据确定性进行评级。
图1. 使用GRADE方法对证据质量和推荐强度进行评级的方法和意义(美国GRADE网络允许无限制使用该图)
建议
新冠肺炎建议
在免疫力低下的成人和儿童中*,美国感染病学会(IDSA)指南小组建议接种适合其年龄的2025-2026年新冠疫苗(强烈推荐,证据确定性中等)。
*有关风险人群和接种时间,请参见表1。
备注
- 应尽快接种美国食品药品监督管理局批准的2025-2026年新冠疫苗。
- 第二剂新冠疫苗接种可能会延长保护期。
- 从未接种过疫苗和未完全接种疫苗的患者,请参考已发表的指南[2]。
- 免疫功能低下患者的家庭成员和密切接触者应及时接种最新的新冠疫苗。
- 患者同时接种新冠、流感和呼吸道合胞病毒疫苗是合适的。
流感建议
在免疫力低下的成人和儿童中*,美国传染病学会(IDSA)指南小组建议接种适合其年龄的2025-2026年流感疫苗(强烈推荐,证据确定性中等)。
*有关风险人群和接种时间,请参见表3。
备注
- 为提供最佳保护,必须每年重复接种疫苗。
- 高剂量或含佐剂的流感疫苗能提供更强的免疫反应,这在免疫功能低下的患者中可能尤为重要。
- 免疫功能低下患者的家庭成员和密切接触者应及时接种流感疫苗。
- 减毒活流感疫苗禁用于免疫功能低下的宿主,且应避免用于严重免疫抑制个体(如近期造血干细胞移植受者或移植物抗宿主病患者、严重联合免疫缺陷患者)的密切接触者。
- 患者同时接种新冠病毒、流感和呼吸道合胞病毒疫苗是合适的。
呼吸道合胞病毒(RSV)推荐意见
在美国传染病学会(IDSA)指南小组看来,对于免疫力低下的成人和青少年*,建议接种适合其年龄的呼吸道合胞病毒(RSV)疫苗(强烈推荐,证据确定性中等)。
*有关风险人群和接种时间,请参见表5。
备注
- 美国食品药品监督管理局(FDA)批准的成人呼吸道合胞病毒(RSV)疫苗包括RSVPreF3、RSVPreF和mRNA-1345。
- 对于18岁以下的免疫功能低下患者,应在共同决策的指导下进行接种。
- 实体器官移植候选人,特别是肺移植候选人,理想情况下应在移植前接种疫苗。
- 免疫功能低下患者的家庭成员和密切接触者,若符合接种条件,应及时接种呼吸道合胞病毒疫苗。
- 患者同时接种新冠病毒、流感和呼吸道合胞病毒疫苗是合适的。
新型冠状病毒肺炎
最后更新:
2025年10月17日
已进行的文献综述:
2025年10月17日
作者:
阿诺玛·内洛尔*、克里斯蒂娜·巴杰马、凯瑟琳·贝尔登、迪恩·布隆伯格、伊丽莎白·约克**、英格夫·法尔克-伊特**
关键词:
免疫功能低下 COVID-19疫苗接种, 成人与儿童
建议
对于免疫力低下的成人和儿童*,美国传染病学会(IDSA)指南小组建议接种适合其年龄的2025-2026年新冠疫苗(强烈推荐,证据确定性中等)。
*有关风险人群和时间安排,请参见表1。
备注
- 应尽快接种美国食品药品监督管理局批准的2025-2026年新冠疫苗。
- 第二剂新冠疫苗接种可能会延长保护期。
- 从未接种过疫苗和未完全接种疫苗的患者,请参考已发表的指南[2]。
- 免疫功能低下患者的家庭成员和密切接触者应及时接种最新的新冠疫苗。
- 患者同时接种新冠、流感和呼吸道合胞病毒疫苗是合适的。
表1. 免疫功能低下人群的COVID-19疫苗接种指南[2-8]
根据社区病毒传播水平,在早期窗口期采用共同决策模式
结果
检索发现了两项队列研究[9,10]和五项测试阴性病例对照研究[11-15],这些研究报告了疫苗有效性结果。检索还发现了一项自对照病例系列研究[16],该研究报告了严重不良事件,以及三项观察性研究[17-19],这些研究报告了免疫功能低下或自身免疫性疾病的恶化情况。
表2. GRADE证据概况:免疫功能低下患者(成人和儿童)应接种COVID-19疫苗还是不接种?
说明
CI:置信区间;HR:风险比;OR:比值比
h. 由于事件数量较少
疫苗有效性
在免疫功能低下人群中接种COVID-19疫苗与COVID-19相关住院率的降低有关。研究中疫苗有效性的估计值在33%到56%之间,其中包括一项队列研究[9](疫苗有效性为46%,95%置信区间39-52%)和四项检测阴性病例对照研究[11-13,15](疫苗有效性为37%,95%置信区间29-44;中等确定性证据)。接种疫苗还与重症减少相关[14](疫苗有效性为40%,95%置信区间26-51;中等确定性证据)、COVID-19相关死亡率降低相关[10](疫苗有效性为61%,95%置信区间36-77;低确定性证据),以及COVID-19相关急诊/紧急护理就诊减少[11](疫苗有效性为34%,95%置信区间22-45)和COVID-19相关门诊就诊减少[11](疫苗有效性为40%,95%置信区间19-55;中等确定性证据)。在大多数研究中,随访时间或末次接种疫苗后的时间相对较短,中位数不到两个月。鉴于疫苗保护作用会随着时间的推移而减弱,这些估计值可能代表的是较高水平的值。
不良事件
在2020-2022年进行的一项自身对照病例系列研究中[16],观察到接种第三剂mRNA疫苗后少数不良事件的风险有所增加;然而,由于评估的疾病数量较多(52种)、存在多重检验以及事件发生率较低,无法排除虚假关联(邦费罗尼校正后的p值在1%的水平上不显著(校正p=0.22))。一些受关注的不良结局,如血栓性事件(例如心肌梗死和中风)在接种疫苗人群中更为少见。尽管在接种队列中观察到了心肌炎病例,但接种组的风险低于未接种组,这可能是因为新冠感染期间心肌炎的风险会增加。不过,由于在接种第一剂和第二剂疫苗后,这种结局较为罕见(<1:48,000),因此这一估计并不精确。总之,目前可用的新冠疫苗几乎未引发严重不良事件(低确定性证据)。
总体而言,免疫功能低下或自身免疫性疾病的恶化并不会因接种疫苗而增加;然而,有一项研究报告称,多发性硬化症患者的影像学病灶有所增加[19](极低确定性证据</b0),尽管其临床意义仍不明确。
推荐理由
专家小组一致认为,由于有证据表明新冠疫苗在免疫功能低下患者中通过预防住院体现出有效性,因此总体证据的确定性为中等。有益效果的中等规模,加上几乎没有或不存在严重的不良反应,这为强烈推荐接种2025-2026年新冠疫苗提供了依据。
实施注意事项
免疫功能低下的患者患重症COVID-19的风险仍然较高,且可能对疫苗的反应减弱,这就需要量身定制的疫苗接种策略和持续的风险缓解措施。在这一人群中实施COVID-19疫苗建议应考虑以下核心因素:
一般原则:
- 所有6个月及以上的免疫功能低下者都应至少接种一剂当前季节的新冠疫苗,是否需要额外接种则根据既往接种史和临床判断而定。
- 共享临床决策至关重要,它能在时间安排和剂量方面提供灵活性,以适应免疫抑制治疗计划、出行安排以及个人风险因素。
- 家庭成员和密切接触者应及时接种最新的新冠疫苗,以降低传播风险。
特定亚组的注意事项:
- 实体器官移植(SOT):疫苗接种的最佳时间为移植前≥2周或移植后≥3个月,应避开脉冲式免疫抑制期和急性排斥反应期。在社区传播率高或患者存在风险因素时,可考虑提前接种。
- 造血细胞移植(HCT)/CAR-T:建议在造血细胞移植(HCT)/CAR-T后≥3个月,或B细胞耗竭治疗后≥3-6个月接种疫苗,在社区传播率高时可考虑提前接种。
- 血液系统恶性肿瘤:使疫苗接种与治疗周期相匹配,理想情况下在新的免疫抑制治疗前≥2周进行;在发热性中性粒细胞减少症或重症期间推迟接种。在社区传播率高时考虑接种。
- 实体瘤化疗:最好在治疗前≥2周接种疫苗,但必要时在治疗期间或治疗后接种也可接受;重症期间应推迟接种。在社区传播率高时可考虑接种。
- 原发性免疫缺陷:临床稳定时接种疫苗,接种时间应与静脉注射免疫球蛋白/皮下注射免疫球蛋白的接种计划或就诊时间一致;急性发病期应推迟接种。在社区传播率高时,应考虑接种。
- 自身免疫性疾病的免疫抑制:在使用生物制剂前至少2周或治疗后至少3个月接种疫苗;B细胞耗竭后至少3-6个月接种;在严重发作或感染期间推迟接种。在社区传播率高时考虑接种。
- HIV:无论CD4细胞计数或病毒载量如何,均应接种疫苗,理想情况是在病情稳定且与预防性常规护理一致时进行;急性病期间应推迟接种。
- 在社区高传播期间应考虑接种。
其他实施问题:
- 疫苗效力低于免疫功能正常人群,这表明需要根据社区传播水平持续进行风险评估。
- 快速获取针对新冠病毒的抗病毒药物以及非药物干预措施仍然是重要的辅助手段,尤其是对于那些疫苗应答不佳或有禁忌症的人群。
- 患者可自行证明其免疫功能低下状态以获得疫苗接种资格。
- 对于免疫功能低下人群来说,及时更新新冠疫苗接种情况至关重要,这需要个性化的接种计划,并与临床护理密切配合。持续沟通、公平获取疫苗以及整合预防策略,对于获得最佳保护至关重要。
研究重点
证据凸显了在不同免疫功能低下亚群中,免疫原性、临床有效性和最佳疫苗策略方面存在的持续差距,以及对量身定制的方法和可靠结果数据的需求。
免疫功能低下患者的COVID-19疫苗接种研究重点应解决不同人群在免疫原性、临床有效性和实施策略方面的关键空白。免疫功能低下人群(包括实体器官移植受者、血液系统恶性肿瘤患者、自身免疫性疾病患者和艾滋病病毒感染者)对COVID-19疫苗的免疫反应存在差异,且往往较弱,其中器官移植受者和接受B细胞耗竭疗法的患者血清转化不良和突破性感染的风险最高。
关键优先事项包括:
- 确定不同免疫功能低下亚群的保护相关性和免疫原性阈值,包括细胞免疫和体液免疫的作用,以及特定免疫抑制方案的影响。
- 关于疫苗持久性和免疫力减弱的纵向研究,尤其是在新型SARS-CoV-2变异株出现以及免疫抑制疗法不断发展的背景下。
- 疫苗平台和接种策略的比较效果研究,包括信使核糖核酸(mRNA)疫苗与蛋白亚单位疫苗的比较,以及额外(加强)剂量对血清转化和临床结果的影响。
- 对修改后的疫苗接种方案以及与免疫抑制治疗相关的接种时机的评估,包括移植、化疗或生物治疗前后的最佳接种间隔。
- 真实世界有效性数据,包括突破性感染率、住院率和死亡率,以及按年龄、合并症和免疫抑制方案进行的亚组分析。
- 针对罕见疫苗不良事件(如心肌炎)的增强安全性数据,以及针对该患者群体的特定担忧(即器官移植排斥或自身免疫性疾病发作的风险),并按合并症和免疫抑制方案进行亚组分析。
- 增强疫苗反应的策略,包括暂时调整免疫抑制方案、使用含佐剂或更高剂量的疫苗,以及整合非药物干预措施和早期治疗手段。
- 疫苗获取和接种的公平性,以及对疫苗接种障碍、覆盖率差异和改善高危人群推广工作的干预措施的研究。
要实现这些优先目标,需要开展多中心、前瞻性研究,采用统一的结局指标,进行可靠的亚组分析,并整合免疫学和临床终点。随着新冠病毒转为地方性流行,加强疫苗接种方案和量身定制的预防策略对于保护免疫功能低下患者仍然至关重要。
参考文献
- 泰勒 CA、帕特尔 K、范 H 等人。2023年10月至2024年4月美国12个州COVID-NET中18岁及以上成人的COVID-19相关住院情况。《发病率和死亡率周报》2024;73(39):869-75。
- Panagiotakopoulos L、Moulia DL、Godfrey M等人。6月龄及以上人群COVID-19疫苗的使用:美国免疫实践咨询委员会的建议——美国,2024-2025年。《发病率和死亡率周报》2024;73(37):819-24。
- Viganò M、Beretta M、Lepore M 等人。实体器官移植成年候选者和受者的疫苗接种建议。《疫苗(巴塞尔)》2023;11(10)。
- 美国移植外科医师学会(ASoT)、国际心肺移植学会(ISHLT)。《关于器官移植候选者和受者接种COVID-19疫苗的联合声明》,2022年。
- ASH-ASTCT针对造血干细胞移植和CAR-T细胞受者的COVID-19疫苗接种:常见问题 可访问:https://www.hematology.org/covid-19/ash-astct-covid-19-vaccination-for-hct-and-car-t-cell-recipients。 访问日期:2025年10月15日。
- 席尔瓦-平托 A、阿布雷乌 I、马丁斯 A、巴斯托斯 J、阿劳若 J、平托 R。造血干细胞移植后的疫苗接种:文献综述及建议的疫苗接种方案。《疫苗(巴塞尔)》2024;12(12)。
- Dioverti V、Boghdadly ZE、Shahid Z等人。《造血细胞移植和细胞治疗受者中冠状病毒病19管理修订指南》(2022年8月)。《移植细胞治疗》2022;28(12):810-21。
- 巴斯AR、查克拉瓦蒂E、阿克尔EA等。2022年美国风湿病学会风湿病和肌肉骨骼疾病患者疫苗接种指南。《关节炎护理与研究》(霍博肯)2023;75(3):449-64。
- 威尔逊 A、拉海 N、贝克 E 等人。评估 mRNA-1273.815 在美国 18 岁及以上成年人中预防 COVID-19 住院的有效性。《感染性疾病治疗》2025;14(1):199-216。
- 佩恩AB、诺沃萨德S、宋HM等人。2023-2024年新冠疫苗对美国18岁及以上终末期肾病成人新冠相关住院的有效性——美国,2023年9月-2024年4月。《疫苗》2025;55:127010。
- Caffrey AR、Appaneal HJ、Lopes VV等人。BNT162b2 XBB疫苗在美国退伍军人事务医疗系统中的有效性。《自然·通讯》2024;15(1):9490。
- 林克-盖勒斯 R、罗利 EAK、德席尔瓦 MB 等人。2023-2024 年更新的(单价 XBB.1.5 型)新冠疫苗在 18 岁及以上免疫功能低下成人中预防新冠相关住院的中期有效性——VISION 网络,2023 年 9 月 – 2024 年 2 月。《发病率和死亡率周报》2024;73(12):271 – 6。
- Link-Gelles R、Chickery S、Webber A等人。2024-2025年18岁及以上成人COVID-19疫苗有效性的中期估计——VISION和IVY网络,2024年9月-2025年1月。《发病率和死亡率周报》2025;74(6):73-82。
- 林克-盖勒斯 R、罗利 EAK、欧文 SA 等人。2023-2024 年成人新冠肺炎疫苗有效性估计。《美国医学会网络开放》2025;8(6):e2517402。
- Nguyen JL、Mitratza M、Volkman HR等人。BNT162b2 XBB.1.5适配疫苗在欧洲预防与JN.1变异株相关的COVID-19住院的有效性:一项使用id.DRIVE平台的检测阴性病例对照研究。《EClinicalMedicine》2025;79:102995。
- 陈DT、科普兰E、赫斯特JA等。因免疫抑制药物治疗或移植手术而处于临床风险的人群中COVID-19疫苗的接种率、有效性和安全性:英格兰一项基于人群的队列研究。《BMC医学》2024;22(1):237。
- Rossier LN、Décosterd NP、Matter CB等人。瑞士单中心回顾性研究显示,炎症性肠病患者接种SARS-CoV-2疫苗与疾病发作无关。《内科医学年鉴》2024;56(1):2295979。
- 李明、廖亮、黄伟等人。接受免疫检查点抑制剂治疗的晚期癌症患者接种COVID-19疫苗可改善预后,且不会增加胰腺相关不良事件。《人类疫苗与免疫治疗》2024;20(1):2358575。
- Ganelin-Cohen E、Buxbaum C、Bosak N等人。COVID-19疫苗接种对多发性硬化症活动的影响(通过MRI反映)。《大脑与行为》2024;14(7):e3587。
流感
最后更新:
2025年11月18日
作者:
保罗·戈普赫特*、摩根·卡茨、丹尼尔·考尔、坦维·夏尔马、迪普林·考尔**、英格夫·法尔克-伊特**
关键词:
免疫功能低下 流感疫苗接种, 成人与儿童
建议
在免疫力低下的成人和儿童中*,美国传染病学会(IDSA)指南小组建议接种适合其年龄的2025-2026年流感疫苗(强烈推荐,证据确定性中等)。
*有关风险人群和接种时间,请参见表3。
备注
- 为提供最佳保护,必须每年重复接种疫苗。
- 高剂量或含佐剂的流感疫苗能提供更强的免疫反应,这在免疫功能低下的患者中可能尤为重要。
- 免疫功能低下患者的家庭成员和密切接触者应及时接种流感疫苗。
- 减毒活流感疫苗禁用于免疫功能低下的宿主,且应避免用于严重免疫抑制个体(如近期造血干细胞移植受者或移植物抗宿主病患者、严重联合免疫缺陷患者)的密切接触者。
- 患者同时接种新冠病毒、流感和呼吸道合胞病毒疫苗是合适的。
表3. 免疫功能低下人群的流感疫苗接种指南[1-10]
在急性移植排斥反应治疗的最剧烈时期或严重/急性疾病期间应推迟接种
**由于流感疫苗建议每年接种,因此接种时机尤为重要。如果在建议的间隔之前接种,免疫反应可能会减弱,但在秋冬季节,流感疫苗接种的最佳时机与免疫抑制状态相关,这将取决于当地流感病毒的流行情况。**
结果
检索发现了一项评估免疫功能低下人群流感疫苗接种情况的阴性试验病例对照研究[11],该研究报告了疫苗预防住院的有效性,以及三项报告免疫功能低下或自身免疫性疾病加重情况的研究[25-27]。
由于免疫功能低下人群中疫苗有效性结果的直接证据有限,因此纳入了来自老年人群中进行的VIP分析[28]的间接证据。这包括10项关于流感相关住院的检测阴性病例对照研究[11-20]、1项关于全因死亡率的队列研究[21]以及1项关于ICU入院的研究[20]。未发现免疫功能低下人群中不良事件的直接证据;因此,纳入了来自老年人VIP分析[28]的间接证据(两项研究[22-23]评估吉兰-巴雷综合征,两项研究[22,24]评估严重不良事件)。
表4. GRADE证据概况:免疫功能低下患者(成人和儿童)应使用流感疫苗接种还是不接种?
说明
疫苗有效性
在免疫功能低下的成年人中,流感疫苗接种与流感相关住院风险降低32%相关(95%置信区间7-50%)[11]。在老年人群中观察到了类似的结果,疫苗效力估计为42%(95%置信区间36-47%)[11-20]。一项研究报告称,老年人群接种流感疫苗后,全因死亡风险降低53%(95%置信区间41-63%)[21],另一项研究则指出,在类似人群中,该疫苗对预防ICU入院的效力为41%(95%置信区间31-50%)[20]。
不良事件
两项自控病例系列研究未发现老年人患吉兰-巴雷综合征的风险增加(发病率比0.96,95%置信区间:0.73至1.27)[22-23]。一项针对联邦医疗保险受益人的研究也发现,总体而言,接种各种流感疫苗不会增加缺血性或出血性中风的风险,但观察到在接种流感疫苗后22-42天,缺血性中风或短暂性脑缺血发作(TIA)的复合风险有所增加(即联邦医疗保险优势计划人群,发病率比1.10,95%置信区间1.02至1.17)[22]。然而,这意味着在10,000名接种疫苗的联邦医疗保险优势计划参保人中,大约会增加1个终点事件。此外,一项加拿大队列研究发现,30天内接种流感疫苗与降低中风风险相关(调整后风险比0.66,95%置信区间0.65至0.68)[24]。有关免疫功能低下或自身免疫性疾病加重的研究显示,其安全性良好。一项研究发现,肾移植受者接种疫苗后,肾功能(估算肾小球滤过率、血清肌酐或蛋白尿)未发生变化,也未出现白细胞减少、中性粒细胞减少或血小板减少的病例[25]。此外,两项研究发现,接种疫苗后不会增加多发性硬化症发作的风险(比值比0.90,95%置信区间0.88-1.09)[27],也不会增加炎症性肠病发作的风险(调整后发病率比0.68,95%置信区间0.46-1.02)[26]。
推荐依据
专家组一致认为,证据的总体确定性为中等,这是因为关于流感疫苗在免疫功能低下患者中有效性的证据主要来自其对住院的预防作用。中等程度的有益效果,加上几乎没有或不存在严重的不良反应,这为强烈推荐接种2025-2026年流感疫苗提供了依据。
实施注意事项
免疫功能低下的患者感染严重流感病毒的风险仍然较高,且可能对疫苗的反应较弱,因此需要量身定制的疫苗接种策略(例如,高剂量或佐剂流感疫苗可产生更好的血清学反应)以及持续的风险缓解措施,包括获得治疗和预防性抗病毒药物的机会。在这一人群中实施流感疫苗建议应考虑以下核心因素:
一般原则:
- 所有6个月及以上的免疫功能低下人群都应接种季节性流感疫苗。
- 共享临床决策至关重要,它能在时间安排和剂量方面提供灵活性,以适应免疫抑制治疗计划、出行安排以及个人风险因素。
- 家庭成员和密切接触者也应接种季节性灭活流感疫苗,以降低传播风险。
特定亚组的注意事项:
- 实体器官移植(SOT):疫苗接种的最佳时间为移植前≥2周或移植后≥1个月,应避开脉冲式免疫抑制和活动性排斥反应期间。若可能,可考虑在秋季流感季节高峰前提前接种。造血细胞移植(HCT)/CAR-T:建议在造血细胞移植/CAR-T后≥3个月,或B细胞耗竭疗法后≥3-6个月接种疫苗;在社区传播率高的时期,可考虑提前接种。
- 血液系统恶性肿瘤:将疫苗接种与治疗周期相匹配,理想情况下在开始新的免疫抑制治疗前≥2周进行;在发热性中性粒细胞减少症或重症期间应推迟接种。可能的话,考虑在秋季流感季节高峰期前提前接种。
- 实体瘤化疗:最好在治疗前≥2周接种疫苗,但若有需要,在治疗期间或治疗后接种也可接受;患重症期间应推迟接种。可能的话,考虑在秋季流感季节高峰期前提前接种。
- 原发性免疫缺陷:临床病情稳定时进行疫苗接种,接种时间应与静脉注射免疫球蛋白/皮下注射免疫球蛋白的 schedule 或门诊就诊时间相匹配;急性发病期应推迟接种。在可能的情况下,考虑在秋季流感高峰期来临前提前接种。
- 自身免疫性疾病的免疫抑制:在使用生物制剂前至少2周或治疗后至少3个月接种疫苗;B细胞耗竭后至少3-6个月接种;在严重发作或感染期间推迟接种。可能的话,考虑在秋季流感高峰期前尽早接种。
- HIV:无论CD4细胞计数或病毒载量如何,都应接种疫苗,理想情况是在病情稳定且与预防性常规护理相配合时进行;急性病期间应推迟接种。可能的话,考虑在秋季流感高峰期前提前接种。
其他实施问题:
- 快速获取针对流感病毒的抗病毒药物以及非药物干预措施仍然是重要的辅助手段,尤其是对于那些预计疫苗反应不佳或有疫苗接种禁忌症的人群。
每年接种流感疫苗对免疫功能低下人群至关重要,需制定个性化接种计划,并与临床护理密切配合。持续沟通、公平获取疫苗和流感治疗手段,以及整合预防策略,是实现最佳保护效果的关键。
研究重点
免疫功能低下患者流感疫苗接种的研究重点应解决不同人群在免疫原性、临床有效性和实施策略方面的关键差距。
免疫功能低下的人群——包括实体器官移植受者、血液系统恶性肿瘤患者、自身免疫性疾病患者以及艾滋病患者——对流感疫苗的免疫反应存在差异,且往往较弱,其中器官移植受者和接受B细胞耗竭疗法的人群,血清转换不良和突破性感染的风险最高。
关键优先事项包括:
- 为不同免疫功能低下亚群确定保护相关性和免疫原性阈值,包括细胞免疫和体液免疫的作用,以及特定免疫抑制方案的影响。
- 关于疫苗持久性和免疫力减弱的纵向研究,尤其是在流感病毒株变化和免疫抑制疗法不断发展的背景下。
- 流感疫苗平台和给药策略的有效性研究,以及额外(加强)剂量对血清转化和临床结果的影响。
- 对改良疫苗接种方案以及与免疫抑制治疗相关的接种时机的评估,包括移植、化疗或生物治疗前后的最佳接种间隔。
- 真实世界的有效性数据,包括突破性感染率、住院率和死亡率,以及按年龄、合并症和免疫抑制方案进行的亚组分析。
- 针对疑似罕见疫苗不良事件(如吉兰-巴雷综合征)的增强安全数据,以及针对该患者群体的特定担忧(即器官移植排斥风险或自身免疫性疾病发作风险),并按合并症和免疫抑制方案进行亚组分析。
- 增强疫苗反应的策略,例如暂时调整免疫抑制、使用高剂量或含佐剂的疫苗,以及整合非药物干预措施和早期治疗方法。
- 疫苗获取和接种的公平性,以及对疫苗接种障碍、覆盖率差异和改善高危人群推广干预措施的研究。
要实现这些优先目标,需要开展多中心、前瞻性研究,采用统一的结局指标,进行可靠的分层亚组分析,并整合免疫学和临床终点。加强疫苗接种方案和量身定制的预防策略,对于保护免疫功能低下患者免受未来地方性和大流行性流感感染仍然至关重要。
参考文献
- Viganò M、Beretta M、Lepore M等人。实体器官移植成年候选者和受者的疫苗接种建议。《疫苗(巴塞尔)》2023;11(10)
- 席尔瓦-平托 A、阿布鲁 I、马丁斯 A、巴斯托斯 J、阿劳若 J、平托 R。造血干细胞移植后的疫苗接种:文献综述及建议的疫苗接种方案。《疫苗(巴塞尔)》2024;12(12)
- Bass AR、Chakravarty E、Akl EA等。2022年美国风湿病学会风湿和肌肉骨骼疾病患者疫苗接种指南。《关节炎护理与研究》(霍博肯)2023;75(3):449–464
- 弗隆E,科特查RS。从接受癌症治疗的免疫功能低下儿童流感疫苗接种中吸取的经验教训。《柳叶刀·儿童与青少年健康》。2023年3月;7(3):199-213。doi:10.1016/S2352-4642(22)00315-7。在线发表于2023年1月24日。PMID:36706776
- 艾森MG。特殊人群使用的疫苗:免疫功能低下宿主。《传染病杂志》。2025;231(3):552-555。doi:10.1093/infdis/jiae508
- 佩雷斯-罗梅罗P、布恩斯-拉莫斯A、托雷-西斯内罗斯J等。实体器官移植后前6个月接种流感疫苗有效且安全。《临床微生物学与感染》。2015;21(11):1040.e11-1040.e1.04E18。doi:10.1016/j.cmi.2015.07.014
- Vijenthira A、Gong I、Betschel SD、Cheung M、Hicks LK。抗CD20治疗后的疫苗反应:对905名患者的系统综述和荟萃分析。《血液进展》。2021;5(12):2624-2643。doi:10.1182/bloodadvances.2021004629
- Bosaeed M, Kumar D. 免疫功能低下人群的季节性流感疫苗。《人类疫苗与免疫治疗》。2018;14(6):1311-1322。doi:10.1080/21645515.2018.1445446
- Grohskopf LA、Ferdinands JM、Blanton LH、Broder KR、Loehr J. 利用疫苗预防和控制季节性流感:美国免疫实践咨询委员会的建议——美国,2024-25年流感季。《发病率和死亡率周报建议报告》。2024;73(5):1-25。发布于2024年8月29日。doi:10.15585/mmwr.rr7305a1
- 卡尔德拉F、默瑟M、萨姆森SI、皮特JM、海尼MS。免疫功能低下人群的流感疫苗接种:提高免疫原性的策略。《疫苗》。2021;39增刊1:A15-A23。doi:10.1016/j.vaccine.2020.11.037
- Lewis NM、Harker EJ、Cleary S等人。2023年9月1日至2024年5月31日美国疫苗对甲型H1N1、甲型H3N2和乙型流感相关住院的有效性。《传染病杂志》。2025年4月8日在线发表。doi:10.1093/infdis/jiaf185。
- Gharpure R、Regan AK、Nogareda F等人。2023年南半球流感疫苗对严重流感相关疾病的有效性:来自8个国家采用测试阴性设计的汇总估计。《柳叶刀·全球健康》。2025年,doi:10.1016/S2214-109X(24)00473-X,13(2):e203-e211。
- Martínez-Baz I、Navascués A、Trobajo-Sanmartín C等人。2023/24季节西班牙北部流感疫苗在预防确诊流感病例和住院方面的有效性:一项基于人群的测试阴性病例对照研究。《国际传染病杂志》。2025年,doi:10.1016/j.ijid.2024.107364,151:107364。
- 罗斯 AM、卢卡乔尼 H、马什 K 等人。2024/25 年流感疫苗有效性中期报告:八项欧洲研究,2024 年 9 月至 2025 年 1 月。《欧洲监测》。2025 年,doi:10.2807/1560-7917.ES.2025.30.7.2500102,30(7):2500102。
- Emborg HD、Valentiner-Branth P、Trebbien R、Bolt Botnen A、Grove Krause T、Søborg B. 增强型流感疫苗对65岁及以上人群有效性的影响,丹麦,2024/25流感季至2025年3月4日。《欧洲监测》,2025年,doi:10.2807/1560-7917.ES.2025.30.12.2500174,30(12):2500174。
- Maurel M、Howard J、Kissling E等人。2023/24年度甲型流感疫苗中期有效性:VEBIS欧洲初级保健和医院多中心研究,2023年9月至2024年1月。《欧洲监测》。2024年,doi:10.2807/1560-7917.ES.2024.29.8.2400089,29(8):2400089。
- Frutos AM、Cleary S、Reeves EL等人。2024-2025年季节性流感疫苗效力的中期估计——美国四个疫苗效力网络,2024年10月-2025年2月。《发病率和死亡率周报》。2025年,doi:10.15585/mmwr.mm7406a2,74(6):83-90。已发表,2025年2月27日。
- Frutos AM、Price AM、Harker E等人。2023-24赛季季节性流感疫苗效力的中期估计——美国。《发病率和死亡率周报》。2024年,doi:10.15585/mmwr.mm7308a3,73(8):168-174。已发表,2024年2月29日。
- Silva-Afonso RF、Platas-Abenza G、Guerrero-Soler M等人。西班牙某卫生部门2023/2024季预防重症急性呼吸道感染的免疫策略效果。《临床感染性疾病与微生物学》(英文版)。2025年,doi:10.1016/j.eimce.2025.03.017,43(7):435-443。
- Tenforde MW、Reeves EL、Weber ZA等。2023-2024季美国儿童、青少年和成人流感疫苗对住院及急诊科或紧急护理就诊的有效性。《临床传染病》。2025,doi:10.1093/cid/ciae597,81(3):667-678。
- Acuti Martellucci C、Rosso A、Zauli E等人。四种四价灭活流感疫苗单独接种或与肺炎球菌和/或SARS-CoV-2疫苗联合接种的有效性:一项全人群队列研究。《疫苗(巴塞尔)》。2025年,doi:10.3390/vaccines13030309,13(3):309.,已发表,2025年3月13日。
- Lloyd PC、Acharya G、Zhao H等人。2023-2024季美国65岁及以上 Medicare受益人流感疫苗接种后健康结局的安全性监测。《疫苗》。2025年,doi:10.1016/j.vaccine.2025.127069,53:127069。
- 施XC、格鲁伯JF、翁达里M等。2022-2023年季节性流感疫苗在美国65岁及以上成年人中引发的潜在不良事件评估。《疫苗》。2024年,doi:10.1016/j.vaccine.2024.04.051,42(15):3486-3492。
- 田中K、德姆丘克AM、马洛S、希尔MD、霍洛丁斯基JK。加拿大阿尔伯塔省流感疫苗接种后3、7、14、21和30天内的中风风险:一项基于人群的研究。《欧洲神经病学杂志》。2024年,doi:10.1111/ene.16172,31(4):e16172。
- Zawiasa-Bryszewska A、Nowicka M、Górska M等人。肾移植后晚期肾移植受者流感疫苗接种的安全性和有效性。《疫苗(巴塞尔)》。2025年,doi:10.3390/vaccines13020189,13(2):189.,已发表,2025年2月14日。
- 中房郎G、格兰奇MJ、卡德T、马伦CD、阮文谭JS、阿比舍克A。灭活流感疫苗在炎症性肠病中的接种率、安全性和有效性:一项英国全国性研究。《英国医学杂志·开放 Gastroenterol》。2024年,doi:10.1136/bmjgast-2024-001370,11(1):e001370.,发表于2024年6月18日。
- 格里马尔迪L、帕佩克斯C、哈蒙Y等。疫苗与多发性硬化症急性发作住院风险。《美国医学会杂志·神经病学》。2023,doi:10.1001/jamaneurol.2023.2968,80(10):1098-1104。
- 斯科特·J、艾伯斯·MS、马尔瓦·HK、麦肯·NC、迈耶罗维茨·EA、里克特曼·A、弗莱明·DF、霍姆斯·EJ、莫特·LE、雷德彭宁·SG、史密斯·EA、斯托达特·CJ、桑达拉姆·ME、乌尔里希·AK、阿尔巴·C、安德森·CJ、阿佩伊·MK、博雷·E、拉丁斯-林·J、梅尔·AJ、里奇·K、瓦茨·C、巴斯塔·NE、雅罗利莫娃·J、瓦伦斯基·RP、达格代尔·CM。2025-2026年新冠病毒、呼吸道合胞病毒和流感疫苗的最新证据。《新英格兰医学杂志》。2025年10月29日。
呼吸道合胞病毒(RSV)
最后更新:
2025年11月4日
作者:
陈·萨布丽娜·谭*、什韦塔·安扬、埃拉·阿里扎·埃雷迪亚、弗朗西斯科·马加纳、米尼埃尔、迪普林·考尔**、英格夫·法尔克-伊特尔**。
关键词:
免疫功能低下 RSV疫苗接种, 成人与儿童
建议
在免疫力低下的成人和青少年中*,美国传染病学会(IDSA)指南小组建议接种适合其年龄的呼吸道合胞病毒(RSV)疫苗(强烈推荐,证据确定性中等)。
*有关风险人群和接种时间,请参见表5。
备注
- 美国食品药品监督管理局(FDA)批准的成人呼吸道合胞病毒(RSV)疫苗包括RSVPreF3、RSVPreF和mRNA-1345。
- 对于18岁以下的免疫功能低下患者,应在共同决策的指导下进行接种。
- 实体器官移植候选人,特别是肺移植候选人,理想情况下应在移植前接种疫苗。
- 免疫功能低下患者的家庭成员和密切接触者,若符合接种条件,应及时接种呼吸道合胞病毒疫苗。
- 患者同时接种新冠病毒、流感和呼吸道合胞病毒疫苗是合适的。
表5. 免疫功能低下人群的呼吸道合胞病毒(RSV)疫苗接种指南[1-5]
*在急性移植排斥反应治疗期间或患有严重/急性疾病时推迟使用
根据社区病毒传播水平,在早期窗口期采用共同决策模式
结果
检索发现了2项测试阴性病例对照研究[6,7],这些研究报告了免疫功能低下成人中与呼吸道合胞病毒(RSV)相关的住院情况。未发现有研究报告该人群中其他疫苗有效性或不良事件结局。因此,纳入了来自VIP中针对老年人进行的分析所得的间接证据[11]。其中包括1项关于危重症的病例对照研究[6]、1项关于严重不良事件的随机对照试验(RCT)[8]以及1项关于格林-巴利综合征的自身对照病例系列研究[7]。此外,还纳入了2项在检索期之前发表的、报告RSV疫苗严重不良事件的随机对照试验[9,10],旨在全面评估比较性严重不良事件(SAEs)。
表6. GRADE证据概要:免疫功能低下患者(成人和儿童)是否应接种RSV疫苗与不接种疫苗?
疫苗有效性
在免疫功能低下人群中,研究发现RSV疫苗对RSV相关住院的有效率为70%(两项研究的汇总估计,95%置信区间:66%-73%)[6,7]。一项研究报告称,在老年人中,该疫苗对重症复合结局(定义为入住ICU、住院死亡或两者皆有)的有效率为81%(95%置信区间:52%-92%)[6]。
不良事件
一项自身对照病例系列研究发现,吉兰-巴雷综合征的风险有所增加,发病率比为2.1(95%置信区间:1.5-2.9),这相当于每100万剂疫苗会额外增加11.2例病例[7]。三项随机对照试验报告称,老年人发生严重不良事件的相对风险为1.02(95%置信区间:0.96-1.09),这表明接种疫苗组和未接种疫苗组的风险相当[8-10]。
推荐依据
专家小组认为,由于有关RSV疫苗在免疫功能低下患者中有效性的证据主要来自其对住院的预防作用,因此总体证据的确定性为中等。显著的有益效果加之极少或没有严重的不良反应,证明强烈建议为免疫功能低下人群接种RSV疫苗是合理的。
实施注意事项
免疫功能低下的患者患严重呼吸道合胞病毒(RSV)的风险仍然较高,且可能出现疫苗应答减弱的情况,因此需要定制化的疫苗接种策略和持续的风险缓解措施。在这一人群中实施呼吸道合胞病毒疫苗建议时,应考虑以下核心要点:
一般原则:
- 所有18岁及以上的免疫功能低下者都应接种RSV疫苗。
- 对于18岁以下的免疫功能低下患者,应在共同决策的指导下进行接种。
- 大多数证据来自蛋白质亚单位疫苗。
- 目前,仅推荐单剂接种。
- 共享临床决策至关重要,它能在时间安排和剂量方面提供灵活性,以适应免疫抑制治疗计划、出行安排以及个人风险因素。
- 符合条件的家庭成员和密切接触者应及时接种呼吸道合胞病毒疫苗,以降低传播风险。
特定亚组的注意事项:
- 实体器官移植(SOT):疫苗接种的最佳时间为移植前≥2周。实体器官移植后呼吸道合胞病毒(RSV)疫苗接种的理想时间尚不明确。在呼吸道合胞病毒流行季,可考虑在诱导治疗/移植后最早1个月接种呼吸道合胞病毒疫苗;若处于非流行季,为确保最佳免疫原性,可将接种时间推迟至6个月。如果疫苗接种时间早于最佳时机,可考虑补种。
- 造血细胞移植(HCT)/CAR-T:建议在造血细胞移植/ CAR-T后≥3个月,或B细胞耗竭治疗后≥6个月接种疫苗,在社区传播率高时可考虑提前接种。如果疫苗接种时间早于最佳时机,考虑补种。
- 血液系统恶性肿瘤:使疫苗接种与治疗周期相匹配,理想情况是在新的免疫抑制治疗前≥2周进行;在发热性中性粒细胞减少或重症期间应推迟接种。在社区传播率高时,可考虑接种疫苗。如果疫苗接种时间早于最佳时机,可考虑补种。
- 实体瘤化疗:最好在治疗前≥2周接种疫苗,但若有需要,在治疗期间或治疗后接种也可接受;重症期间应推迟接种。在社区传播率高时,可考虑接种疫苗。如果疫苗接种时间早于最佳时机,可考虑补种。
- 原发性免疫缺陷:临床稳定时接种疫苗,需与静脉注射免疫球蛋白/皮下注射免疫球蛋白的接种计划或就诊时间相匹配;急性发病期推迟接种。社区传播率高时,可考虑接种疫苗。
- 自身免疫性疾病的免疫抑制:在使用生物制剂前至少2周或治疗后至少3个月接种疫苗;B细胞耗竭后至少6个月接种;在严重发作或感染期间推迟接种。在社区传播率高时考虑接种。如果疫苗接种时间早于最佳时机,考虑补种。
- HIV:无论CD4细胞计数或病毒载量如何,均应接种疫苗,理想情况是在病情稳定且符合预防性常规护理时进行;急性病期间应推迟接种。在社区传播率高时,可考虑接种。如果在免疫重建前接种了疫苗,可考虑再次接种。
其他实施问题:
- 疫苗效力低于免疫功能正常人群,这表明需要根据社区传播水平持续进行风险评估。
- 快速获得免疫球蛋白疗法以及非药物干预措施仍然是重要的辅助手段,特别是对于那些疫苗反应不佳或有禁忌症的人群。美国食品药品监督管理局(FDA)批准的呼吸道合胞病毒(RSV)抗病毒药物疗效有限。
- 患者可自行证明其免疫功能低下状态以获得疫苗接种资格。
对于免疫功能低下人群来说,及时接种呼吸道合胞病毒(RSV)疫苗至关重要,这需要制定个性化的接种计划,并与临床护理密切配合。持续沟通、公平获取疫苗以及整合预防策略,对于获得最佳保护效果而言必不可少。
研究重点
免疫功能低下患者呼吸道合胞病毒(RSV)疫苗接种的研究重点应解决不同人群在免疫原性、临床有效性、不良反应及实施策略方面的关键空白。免疫功能低下人群包括实体器官移植受者、造血细胞移植(造血细胞移植/CAR-T)受者、血液系统恶性肿瘤患者、自身免疫性疾病患者和艾滋病病毒(HIV)感染者,他们对疫苗的免疫反应存在差异且往往减弱,其中器官移植受者和接受B细胞耗竭疗法的患者血清转换不良和突破性感染的风险最高。
未来是否需要追加RSV疫苗加强剂仍需进一步研究。
关键优先事项包括:
- 为不同免疫功能低下亚群确定保护相关性和免疫原性阈值,包括细胞免疫和体液免疫的作用,以及特定免疫抑制方案的影响。
- 关于疫苗持久性和免疫力减弱的纵向研究、加强剂的潜在需求以及不断发展的免疫抑制疗法。
- 对疫苗平台和接种策略的比较有效性研究,包括mRNA疫苗与蛋白亚单位疫苗,以及额外(加强)剂量对血清转化和临床结果的影响。
- 对改良疫苗接种方案以及与免疫抑制治疗相关的接种时机的评估,包括移植、化疗或生物治疗前后的最佳接种间隔。
- 真实世界的有效性数据,包括突破性感染率、住院率和死亡率,以及按年龄、合并症和免疫抑制方案进行的亚组分析。
- 针对罕见疫苗不良事件(如吉兰-巴雷综合征)的增强安全性数据,以及针对该患者群体的特定担忧(即器官移植排斥风险或免疫功能低下或自身免疫性疾病的恶化风险),并按合并症和免疫抑制方案进行亚组分析。
- 增强疫苗反应的策略,包括暂时调整免疫抑制、使用含佐剂疫苗,以及整合非药物干预措施和早期治疗方法。
- 18岁以下人群中RSV疫苗的使用。
- 疫苗获取和接种的公平性,以及对疫苗接种障碍、覆盖率差异和改善高危人群服务推广的干预措施的研究。
要实现这些优先事项,需要开展多中心、前瞻性研究,采用统一的结局指标,进行可靠的亚组分析,并整合免疫学和临床终点。强化疫苗方案和量身定制的预防策略对于保护免疫功能低下的患者仍然至关重要。
参考文献
- Viganò M、Beretta M、Lepore M 等人。实体器官移植成年候选者和受者的疫苗接种建议。《疫苗(巴塞尔)》2023;11(10)。
- 席尔瓦-平托 A、阿布鲁 I、马丁斯 A、巴斯托斯 J、阿劳霍 J、平托 R。造血干细胞移植后的疫苗接种:文献综述及拟议疫苗接种方案。《疫苗(巴塞尔)》2024;12(12)。
- 巴斯AR、查克拉瓦蒂E、阿克勒EA等。2022年美国风湿病学会风湿病和肌肉骨骼疾病患者疫苗接种指南。《关节炎护理与研究》(霍博肯)2023;75(3):449-64。
- Almeida NC、Parameswaran L、DeHaan EN等人。双价呼吸道合胞病毒融合前F亚单位疫苗在免疫功能低下或肾功能受损成人中的免疫原性和安全性。《疫苗(巴塞尔)》。2025;13(3):328。2025年3月19日发表。doi:10.3390/vaccines13030328
- Kamboj M、Bohlke K、Baptiste DM等。癌症成人患者的疫苗接种:ASCO指南。《临床肿瘤学杂志》。2024;42(14):1699-1721。doi:10.1200/JCO.24.00032
- 佩恩AB、瓦茨JA、米切尔PK等人。2023年10月至2024年3月美国60岁及以上成年人中呼吸道合胞病毒(RSV)疫苗预防RSV相关住院和急诊科就诊的有效性:一项测试阴性设计分析。《柳叶刀》。2024年,doi:10.1016/S0140-6736(24)01738-0,404(10462):1547-1559。
- Fry SE、Terebuh P、Kaelber DC、Xu R、Davis PB。60岁及以上美国成年人呼吸道合胞病毒疫苗的有效性和安全性。《美国医学会杂志网络开放》。2025年,doi:10.1001/jamanetworkopen.2025.8322,8(5):e258322.,出版时间:2025年5月1日。
- 沃尔什EE、埃拉斯D、伍德赛德J等人。二价RSV融合前F蛋白(RSVpreF)疫苗在老年人中两个RSV流行季的有效性、免疫原性和安全性。《临床传染病》。2025年2月10日在线发表。doi:10.1093/cid/ciaf061。
- Papi A、Ison MG、Langley JM等。老年人呼吸道合胞病毒融合前F蛋白疫苗。《新英格兰医学杂志》。2023年,doi:10.1056/NEJMoa2209604,388(7):595-608。
- Wilson E、Goswami J、Baqui AH等。基于mRNA的RSV PreF疫苗在老年人中的有效性和安全性。《新英格兰医学杂志》。2023年,doi:10.1056/NEJMoa2307079,389(24):2233-2244。
- 斯科特·J、艾伯斯·MS、马尔瓦·HK、麦肯·NC、迈耶罗维茨·EA、里克特曼·A、弗莱明·DF、霍姆斯·EJ、莫特·LE、雷德彭宁·SG、史密斯·EA、斯托达特·CJ、桑达拉姆·ME、乌尔里希·AK、阿尔巴·C、安德森·CJ、阿佩伊·MK、博雷·E、拉丁斯-林·J、梅尔·AJ、里奇·K、瓦茨·C、巴斯塔·NE、雅罗利莫娃·J、瓦伦斯基·RP、达格代尔·CM。2025-2026年新冠病毒、呼吸道合胞病毒和流感疫苗的最新证据。《新英格兰医学杂志》。2025年10月29日。
注释
致谢
我们感谢Lindsey Fraser-Green提供的医学图书馆员支持(文献检索的创建和执行),以及Genet Demisashi、Loretta Dzanya、Jonathan Heald和Dana Wollins在项目协调方面所做的工作。
林赛·巴登担任主席,负责监督跨分组整合工作。阿诺玛·内洛尔(负责新冠病毒)、保罗·戈普费特(负责流感)和陈萨布丽娜·谭(负责呼吸道合胞病毒)担任各分组负责人。新冠病毒分组成员包括克里斯蒂娜·巴杰马、凯瑟琳·贝尔登和迪恩·布隆伯格;流感分组成员包括摩根·J·卡茨、丹尼尔·考尔和坦维·夏尔马;呼吸道合胞病毒分组成员包括施韦塔·安詹、埃拉·J·阿里扎-埃雷迪亚、弗朗西斯科·马加纳和蒂莫西·明尼尔。
在新冠肺炎方面,英格夫·法尔克-伊特和伊丽莎白·约克担任主要方法学家;迪普琳·考尔和詹妮弗·洛夫莱斯提供了方法学支持。在流感和呼吸道合胞病毒方面,英格夫·法尔克-伊特和迪普琳·考尔担任主要方法学家;詹妮弗·洛夫莱斯和伊丽莎白·约克提供了方法学支持。所有作者都参与了该指南的起草和修订,并认可最终版本及建议。
披露冲突
可能的利益冲突。 对作为潜在利益冲突的关系的评估通过审查程序确定。对已披露关系是否存在可能的利益冲突(COIs)的评估基于财务关系的相对权重(即金额)和该关系的相关性(即独立观察者可能合理地将某种关联解读为与所考虑的主题或建议相关的程度)。
以下 panelists 披露了与拥有与 COVID-19、流感和 RSV 主题无关产品的公司之间的关系:A.N 获得美国国立卫生研究院(NIH)的研究资金;C.S.T 获得 NIH 和 Eurofin-Viracor 的研究资金;D.K 获得诺贝尔制药公司和美国国家过敏和传染病研究所(NIAID)的研究资金;担任 CME Outfitters 的非促销性(CME)演讲者;E.J.A.H 获得美国临床肿瘤学会(ASCO)的研究资金,并获得 SoftDev 公司的研究资金;K.B 获得退伍军人事务部合作研究计划的研究资金; L.B 获得 NIH 和 NIAID 的研究资金,担任《新英格兰医学杂志》编辑,并担任生物医学高级研究与发展局(BARDA)/NIH 和美国食品药品监督管理局(FDA)的顾问;M.J.K 担任 Skinclique 的顾问,获得医疗保健研究与质量局(AHRQ)和疾病控制与预防中心(CDC)的研究资金,并为律师事务所提供有关传染病相关问题的专家证词;P.G 获得 NIAID 的研究资金;T.M 获得 NIAID 的研究资金。
以下 panelists 与拥有与 COVID-19 和 RSV 主题相关产品的公司存在关联:P.G 曾获得辉瑞公司的研究资金(在加入该小组之前已结束);D.K 目前获得辉瑞公司的研究资金。
出版物免责声明
©IDSA<2025>。保留所有权利。未经事先书面许可,或未经法律明确允许、未经许可,或未根据与相关复制权组织达成的条款,本出版物的任何部分均不得以任何形式或任何方式复制、存储在检索系统中、传输、用于文本和数据挖掘或用于训练人工智能。如需商业再利用,请联系reprints@oup.com获取重印本及重印本的翻译权。所有其他许可可通过《临床传染病》中本文的许可链接,通过牛津大学出版社RightsLink服务获得。如需更多信息,请联系journals.permissions@oup.com。
更新历史
2025年11月18日
截至2025年11月18日,对《流感建议》的备注4已做如下更新:
之前:减毒活流感疫苗禁用于免疫功能低下的宿主及其家庭接触者。
之后:减毒活流感疫苗禁用于免疫功能低下的宿主,且应避免用于严重免疫抑制个体(如近期造血干细胞移植受者或移植物抗宿主病患者、严重联合免疫缺陷患者)的密切接触者。
2025年11月4日
截至2025年11月4日,美国传染病学会(IDSA)已发布关于流感和呼吸道合胞病毒(RSV)疫苗使用的新建议。现行指南可在IDSA网站上查询,稍后将发表在《临床传染病》(CID)上。
2025年10月17日
截至2025年10月17日,这些快速指南仅包含关于新冠病毒疫苗接种的建议。关于流感和呼吸道合胞病毒(RSV)疫苗接种使用的额外指导将在未来几周内补充。当前指南可在IDSA网站上查阅,并将在稍后发表于《临床传染病》(CID)。
Hits: 85
- 心脏病成人的疫苗接种指南
- 用于检测治疗性蛋白制品的免疫原性的检测法开发和验证行业指南
- 肺部疾病成人的疫苗接种指南
- 快速响应:截至 2024 年 12 月在非大流行背景下人类接种禽流感疫苗的初步指南
- 糖尿病成人的疫苗接种指南
- 慢性肝病或慢性肝脏感染成人的疫苗接种指南
- 人类免疫缺陷病毒(HIV)感染者成人疫苗接种指南
- 65 岁及以上成人流感疫苗接种补充指南
- 2013 年美国感染病学会(IDSA)免疫功能低下人群疫苗接种临床实践指南
- 针对公共卫生紧急情况的猴痘检测政策
- 卫生保健机构手部卫生指南
- 环境感染控制指南 保健设施
- 2025 年 4 月 30 日的 NACI 声明摘要:关于 2025-2026 年季节性流感疫苗的声明
- 更新了老年人呼吸道合胞病毒 (RSV) 疫苗指南,包括扩大 RSVPreF3 在 50-59 岁人群中的使用以及使用新的 mRNA-1345 疫苗
- 孕期梅毒感染筛查:美国预防服务工作组重申建议声明
- 2025 年 5 月 14 日的 NACI 声明摘要:关于免疫功能低下成人带状疱疹疫苗接种的最新建议
- 2022 美国动物卫生协会犬类疫苗接种指南(2024年更新)
- 2020 年 AAHA/AAFP 猫科动物疫苗接种指南
- 2025 年 5 月 15 日的 NACI 声明摘要:关于使用 Imvamune 预防 mpox 的更新指南的快速响应
- 2025 年 2 月 13 日 NACI 声明摘要:关于麻疹暴露后预防的更新建议
- 从 2025 年 7 月 1 日起完成常规免疫接种计划(英国)
- 2025 年 1 月 10 日的 NACI 声明摘要:2025 年至 2026 年夏季 COVID-19 疫苗使用指南
- 麻疹暴露后预防更新建议的增编
- 使用 Imvamune 预防猴痘的更新指南
- 免疫功能低下成人带状疱疹疫苗接种的最新建议
- 推荐使用帕利珠单抗减少婴儿呼吸道合胞病毒感染的并发症
- 登革热防控方案(2025年版)
- 关于防止节肢动物叮咬的个人防护措施的声明 – 更新
- CATMAT 关于在 65 岁或以上人群中使用基孔肯雅热减毒活疫苗 (IXCHIQ) 的指南
- 关于在授权旅行者使用 QDENGA(登革热疫苗)的司法管辖区使用的建议
- 基于暴露的干预措施,用于管理整个生命周期中高度针头恐惧的个体:临床实践指南,呼吁进一步研究
- mRNA COVID-19 疫苗接种后患有心肌炎和心包炎的青少年的临床指南
- 归国国际旅客发热初步评估指南
- NACI 快速响应:在持续的猴痘疫情背景下更新了关于 Imvamune 的临时指南
- 关于管理耐多药沙门氏菌感染的临时指南
- 家长免疫接种指南
- 英国旅行者接种基孔肯雅热疫苗:JCVI 建议
- 针对 80 岁及以上成年人的呼吸道合胞病毒 (RSV) 免疫计划:JCVI 建议,2025 年 7 月 16 日
- JCVI 关于 2026年秋季和 2027 年春季 COVID-19 疫苗接种的声明
- CATMAT 关于播散性类圆线虫病的声明
- 成人免疫接种指南
- 针对呼吸道合胞病毒感染住院高风险婴幼儿的帕利珠单抗预防更新指南
- 针对呼吸道合胞病毒感染住院高风险婴幼儿的帕利珠单抗预防
- JCVI 关于 2026 年至 2027 年流感疫苗的声明
- 有关打算探亲访友的国际旅客的声明摘要
- 青少年疫苗接种指南
- 免疫接种状态不确定或不完全的个人疫苗接种:2025 年 7 月 1 日起
- 从 2025 年 7 月 1 日起进行常规儿童免疫接种(2024 年 7 月 1 日出生的婴儿)
- 加拿大关于在疫苗短缺期间使用分次剂量黄热病疫苗的临时建议
- 寨卡病毒预防和治疗建议
- 带状疱疹免疫接种计划:医护人员资讯
- 带状疱疹疫苗接种指南
- 儿童和青少年接种COVID-19疫苗
- 印度旅行疫苗接种:2025 年循证健康指南
- 旅行者疟疾预防和治疗指南
- 登革热:给明智旅行者与移居者的详尽旅行指南
- 旅行者伤寒:预防和保护完整指南
- 美国儿科学会 2025 年 8 月 19 日发布的推荐18 岁及以下儿童与青少年免疫接种程序
- 隐藏的敌人:旅行者立克次体感染完整指南
- 心脏病发作症状:旅行者的基本医疗指南
- 真菌性皮肤感染:类型、治疗和预防完整指南
- 热带医学和旅行咨询委员会 (CATMAT) 关于国际旅行者和伤寒的声明
- 2025 年简明临床指南:ACC 关于成人免疫接种作为心血管护理一部分的专家共识声明:美国心脏病学会解决方案集监督委员会的报告
- 产科-妇科护理中的 COVID-19 疫苗接种注意事项
- 妊娠期流感:预防和治疗
- 母体呼吸道合胞病毒疫苗接种
- 疫苗预防和控制季节性流感:免疫实践咨询委员会的建议——美国,2025-26 年流感季节
- 用Clesrovimab预防婴儿严重呼吸道合胞病毒相关下呼吸道感染:免疫实践咨询委员会的建议 — 美国,2025年
- 健康怀孕指南
- 关于预防婴幼儿呼吸道合胞病毒感染的建议:政策声明
- 过敏反应定义、概述和临床支持工具:2024 年共识报告 – GA2LEN项目
- 人狂犬病免疫球蛋白(human rabies immunoglobulin, HRIG)使用临时建议
- 如何与我们的心脏病患者讨论成人疫苗接种
- 2025 年秋季疫苗指南
- 疫苗佐剂非临床研究技术指导原则
- 完整的常规免疫接种计划 英国 2025年9月1日期
- 2025 年至 2026 年国家流感免疫接种计划信函
- 恰加斯病:基本旅行指南
- 创新型疫苗临床试验申请申报资料要求
- 远离结核病的旅行者指南
- 更顺畅的免疫接种体验指南
- 您的免疫预约指南:充满信心地完成整个过程
- 联合疫苗临床前和临床研究技术指导原则
- 疫苗接种预约指南:预期事项与准备方法
- 旅行时如何保护儿童免受水痘侵害:专家指南
- 家长互联网免疫接种信息指南
- 您的无缝免疫接种与健康服务指南
- 2025年病毒爆发与旅行警告:专家友好指南
- 结合疫苗质量控制和临床研究技术指导原则
- 预防用含铝佐剂疫苗技术指导原则
- 生物制品稳定性研究技术指导原则(试行)
- 常见传染病的暴露后预防
- 无缝接种预约指南
- 开发用于预防全球传染病的疫苗的一般原则
- 关于预防性疾病的联合疫苗评估:生产、测试和临床研究
- 关于组合疫苗及免疫学兽用药品(IVMPs)联合使用的指导原则
- 世界卫生组织关于疫苗非临床评价的指南
- 确保基于DT的组合疫苗的质量、安全和有效性的建议
- 沙特 疫苗生产和质量控制指南
- 疫苗接种预约指南:流程与准备事项
- 儿童与青少年疫苗接种时间指南
- 聚焦预防 | 美国心脏病学会简化心血管疾病免疫接种建议
- 精通疫苗接种诊所:提高效率与优化患者护理的内部指南
- 临床医生呼吸道疫苗共同临床决策指南
- 你的疫苗接种顺利体验指南
- 美国传染病学会关于A组链球菌性咽炎的临床实践指南更新
- 更顺畅疫苗接种体验终极指南
- 婴幼儿和青少年COVID-19疫苗接种建议:政策声明
- IDSA 2025年关于在免疫功能低下患者中使用疫苗预防季节性新冠病毒、流感和呼吸道合胞病毒感染的指南
- 无脾成人的疫苗接种指南
- 花生过敏预防的积极趋势:预防指南的实际影响
- 2025–2026年儿童流感预防与控制建议:技术报告
- 您的疫苗诊所指南:像专业人士一样导航系统
- 带状疱疹疫苗临床试验技术指导原则
- PIDS/IDSA 2023年儿童急性细菌性关节炎诊断和管理指南
- 预防节肢动物叮咬的个人防护措施声明
- 异维甲酸与疫苗诊所:保持防护的内部指南
- IDSA 2024年抗微生物药物耐药革兰氏阴性菌感染治疗指南
- 重组糖蛋白激素类产品药学研究与评价技术指导原则
- 流感病毒疫苗临床试验技术指导原则(征求意见稿)
- 重组表达单克隆抗体类生物制品制造及检定规程撰写指南(征求意见稿)
- 归国国际旅行者发热初始评估指南
- 中国流感疫苗预防接种技术指南(2025—2026)
- 成人癌症相关免疫抑制患者抗菌药物预防临床实践指南:ASCO/IDSA更新版
- 免疫功能低下旅行者
- 全国镰状细胞中心联盟关于镰状细胞病健康维护的共识建议共识声明
- 多联疫苗临床试验技术指导原则
- 曲霉病诊断和管理临床实践指南:IDSA 2016年更新版
- 养老院感染预防与控制多学会指南
- 关于跨国收养的声明
- 美国传染病学会 (IDSA) 发布的《念珠菌病管理临床实践指南:2016 年更新版》
- 流感疫苗完全指南
- IWGDF/IDSA糖尿病相关足部感染诊疗指南
- 热带病与旅行咨询委员会:老年旅行者声明
- 疫苗临床试验不良事件分级标准指导原则(修订版)
- ATS/CDC/IDSA临床实践指南:成人和儿童结核病的诊断
- 用于人乳头瘤病毒检测的自行收集阴道标本及筛查终止指南:美国癌症协会宫颈癌筛查指南更新
- 热带医学与旅行咨询委员会关于儿童旅行者的声明
- 成人导管相关性尿路感染的诊断、预防和治疗:美国传染病学会2009年国际临床实践指南
- HIVMA/IDSA 2014年更新版:HIV感染患者慢性肾病管理临床实践指南
- 对免疫状况不明或未完成的人员进行疫苗接种:自2026年1月1日起
- SHEA/IDSA 发布的《成人艰难梭菌感染管理临床实践指南:2021 年更新》
- 加拿大传染病报告:孕期旅行声明

博士您好,狗舔了一下的食物,三分钟后我吃了,当时有咽喉发炎疼痛,有没有风险,谢谢博士,给您磕一个^0^。