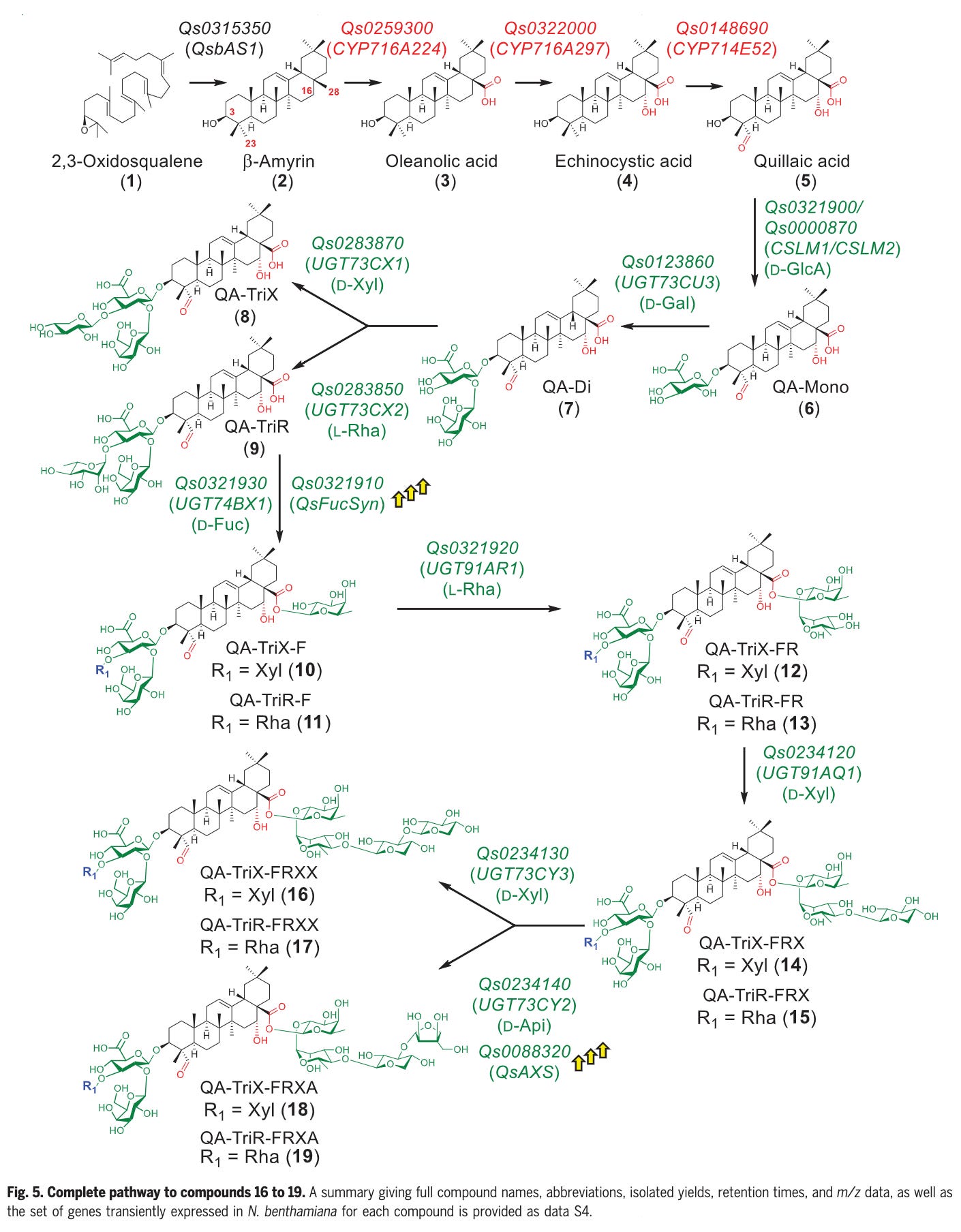
Contents
Novavax has a good COVID-19 vaccine. How good is it? A very deep dive
让我们将神话与数据分开。
Novavax 是一种基于蛋白质的 COVID-19 疫苗(又名 Nuvaxovid,或祖先变体疫苗的 Nvx-CoV2373)的制造商,该疫苗作为辉瑞和莫德纳 mRNA 疫苗的替代品而存在。这是一种固体疫苗。不幸的是,在互联网的某些部分,人们声称存在某种深刻的阴谋来压制公众的 Novavax,这种疫苗在各个方面都明显优于 mRNA 疫苗,任何选择不接种它的人都犯了一个严重的错误。
为了全面了解数据,从而对所有感兴趣的各方公平,这是一篇较长的文章,所以我完全理解为什么人们可能不想浏览所有内容。 以下是您应该了解的内容:
- 现有证据一致表明,Novavax 疫苗的副作用比 mRNA 疫苗更温和——如果你对 mRNA 疫苗感到非常困难,这是一个非常好的理由1.事实上,在我对这种疫苗数据的检查中,这是我能找到的唯一令人信服的理由,让我用它来代替 mRNA。
- Novavax 产生的抗体反应至少与辉瑞疫苗相当。这种抗体反应可能比辉瑞疫苗的抗体反应更持久,但我们需要更多数据来自信地证明这一点。
- 在 CD8(又名杀伤性)T 细胞反应方面,Novavax 显然输给了 mRNA 疫苗(甚至更输于腺病毒疫苗)。这些细胞是感染的早期反应者,负责杀死病毒感染的细胞,被认为特别适用于预防严重疾病(但对感染/传播的作用较小)。造成这种情况的一个主要原因是这些 T 细胞识别 SARS-CoV-2 的部分,这些部分不会随着变体而发生显着变化,但在细胞已经感染之前它们无法发挥作用。然而,尽管 CD8 T 细胞反应不佳,但 Novavax 在临床试验和有限的真实世界数据中显示出对重症的可靠保护作用,但由于接种疫苗的人数相对较少,因此很难自信地说它在保护方面的比较如何。
- 就免疫反应的相对质量而言,关于 Novavax 作为 mRNA 助推器的数据喜忧参半,并且这些研究的样本量很小。
- Novavax 的技术意味着它无法像 mRNA 那样快速更新以覆盖最新的变体。从广义上讲,不完全匹配循环变体是可以的,因为免疫反应会产生广度,但这确实意味着相对于 mRNA 存在劣势。
- 除了最初的许可前研究外,关于 Novavax 在现实世界中与 mRNA 相比表现的数据非常有限,我们所做的少数研究给出了喜忧参半的结果。
- 许可前试验表明,从广义上讲,Novavax 的 COVID-19 疫苗是安全的;然而,由于 Novavax 在生产方面存在挑战,全球提供的疫苗剂量有限,我们对特定罕见不良事件(即心肌炎)的风险缺乏确定性。具体到心肌炎/心包炎,诺瓦瓦克斯疫苗在普通人群中的风险在数值上略高于 mRNA 疫苗,但目前尚不清楚如果我们有相当多的诺瓦瓦克斯接受者,这是否会成立。已知发生这种不良事件风险较高的特定人群(即年轻男性)的风险尚不清楚。
目录,以便您可以跳到您关心的部分
执照前试验和一点历史
序言提供了 Novavax 作为一家公司的背景以及他们在大流行之前所处的位置。
临床前开发
描述 Novavax COVID-19 疫苗的早期临床前数据
阶段 1/2
描述 Novavax 的 COVID-19 疫苗的早期人体研究
第 2/3 阶段
描述 Novavax 的 COVID-19 疫苗的功效研究
儿科数据
描述 Novavax 的 COVID-19 疫苗在儿童中的使用
真实世界的有效性数据
描述 Novavax 的 COVID-19 疫苗在临床试验之外的表现
反应原性和安全性
总结了对 Novavax COVID-19 疫苗的副作用概况和潜在严重风险的了解
Novavax 与其他 COVID-19 疫苗:基础系列、加强针和混合疫苗
将 Novavax 的 COVID-19 疫苗与其他选项置于背景中,由于可用数据,因此重点关注 mRNA
Nuvaxovid 的设计
Novavax COVID-19 疫苗成分的详细说明
Nuvaxovid 作用的免疫学基础
详细说明 Novavax 的 COVID-19 疫苗如何诱导免疫反应(主要面向具有强大免疫学背景的人)
制造困境
描述 Novavax 的生产问题限制了其疫苗的商业实现
营销恶作剧和 The Fandom
直接解决关于 Novavax 的 COVID-19 疫苗的流行说法,以及我个人对 Novavax 关于其疫苗工作原理的一些说法的问题
2024-2025 流行季 COVID-19 疫苗
基于 JN.1 的 Novavax 疫苗的相关免疫原性数据快速概览。
数据结论和知识差距
总结 Novavax COVID-19 疫苗的已知和未知数
执照前试验和一点历史
在 COVID-19 大流行之前,Novavax 在财务上陷入困境。到那时为止,它还无法将任何疫苗推向市场(迄今为止,其唯一获得许可的疫苗是针对 COVID-19 和疟疾的疫苗),而且它紧随 RSV 候选疫苗失败之后。尽管如此,它之前已经设计了一种针对 MERS-CoV(导致中东呼吸综合征的冠状病毒)的蛋白质纳米颗粒疫苗,该疫苗在小鼠中显示出保护作用,并从曲速行动中获得了 16 亿美元的资助2.基本上:Novavax 作为一家制药公司缺乏经验,这将被证明是一个问题——但我们会回到这个问题。无论如何,让我们看看实际的疫苗:
临床前开发
2020 年 8 月,Novavax 发布了一份预印本,研究了他们在猴子(特别是食蟹猴)中的候选疫苗 Nvx-CoV2373,该疫苗随后于 2020 年 11 月发布。这项研究着眼于猴子对不同剂量的疫苗的反应,它们如何根据它们的疫苗接种状态处理 SARS-CoV-2 的攻击,并将这些反应与人类恢复期血清进行了基准测试。特别令人印象深刻的是,尽管猕猴在鼻内和气管内受到高剂量病毒的攻击,但在所有接种疫苗的猴子中都无法检测到病毒亚基因组 RNA(sgRNA;主动复制的标志物)。然而,接受最低剂量疫苗的猴子在第 2 天的肺部确实有可检测到的 sgRNA。
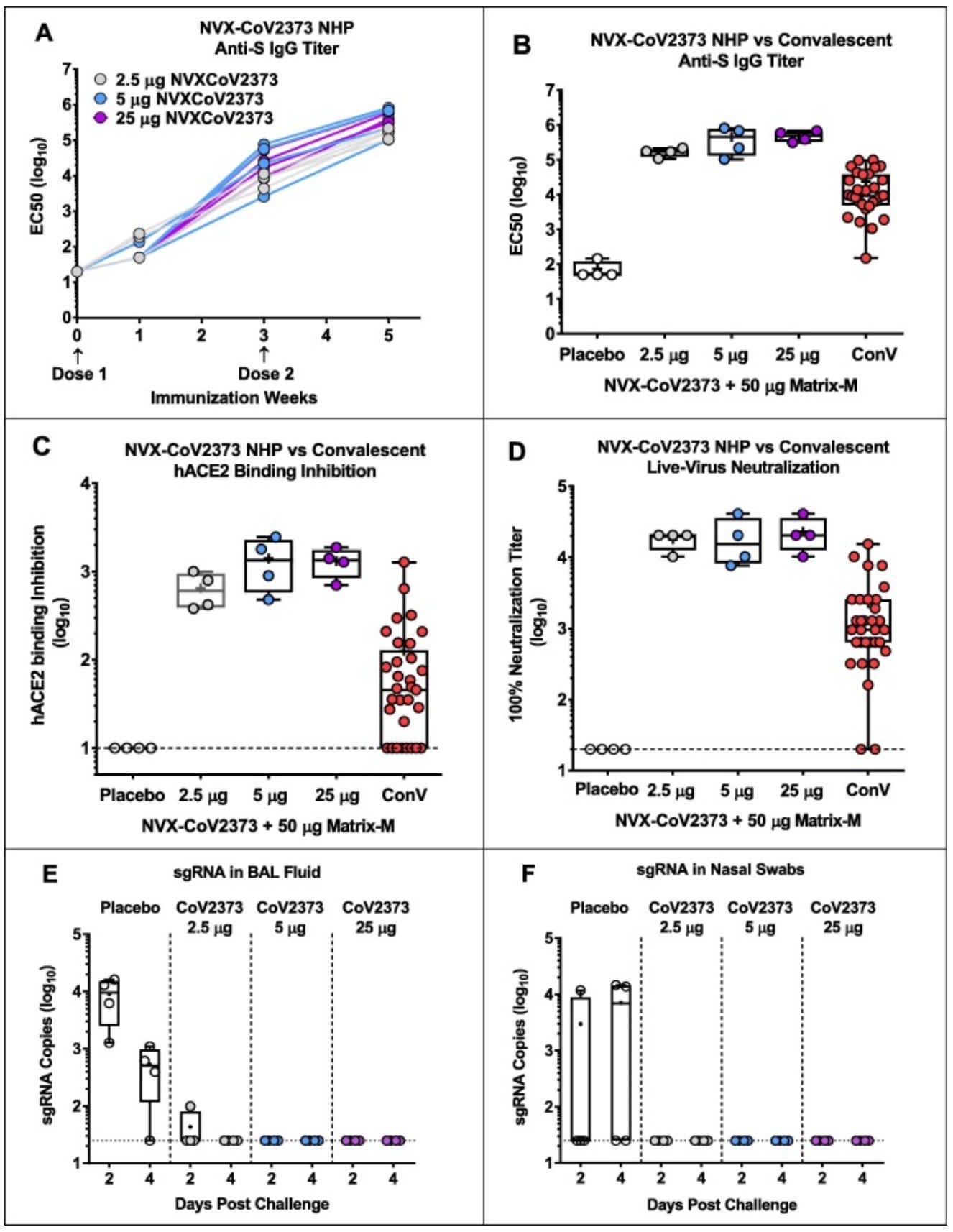
作为参考,这与使用 Moderna 疫苗在猕猴身上取得的成绩相当(然而,Moderna 的猴子受到攻击的病毒剂量更高)。病毒在上呼吸道得到如此好的抑制这一事实表明,该疫苗可以抑制 SARS-CoV-2 的传播。不幸的是,正如谚语所说:老鼠撒谎,猴子夸大其词,病毒进化。
阶段 1/2
2020 年 9 月,Novavax 公布了其疫苗的 1-2 期试验数据。临床试验的这一阶段旨在帮助确定产品的安全性,包括适当的剂量。在疫苗的情况下,这也用于收集有关疫苗诱导免疫反应(免疫原性)的能力的数据。对 2 剂抗原(重组刺突蛋白)进行了 2 剂系列测试。通过与从 COVID-19 中康复的人进行比较来测量抗体反应。令人印象深刻的是,2 剂疫苗诱导的抗体水平明显高于 COVID-19 幸存者的抗体水平(只要刺突蛋白与 Matrix-M 佐剂结合):
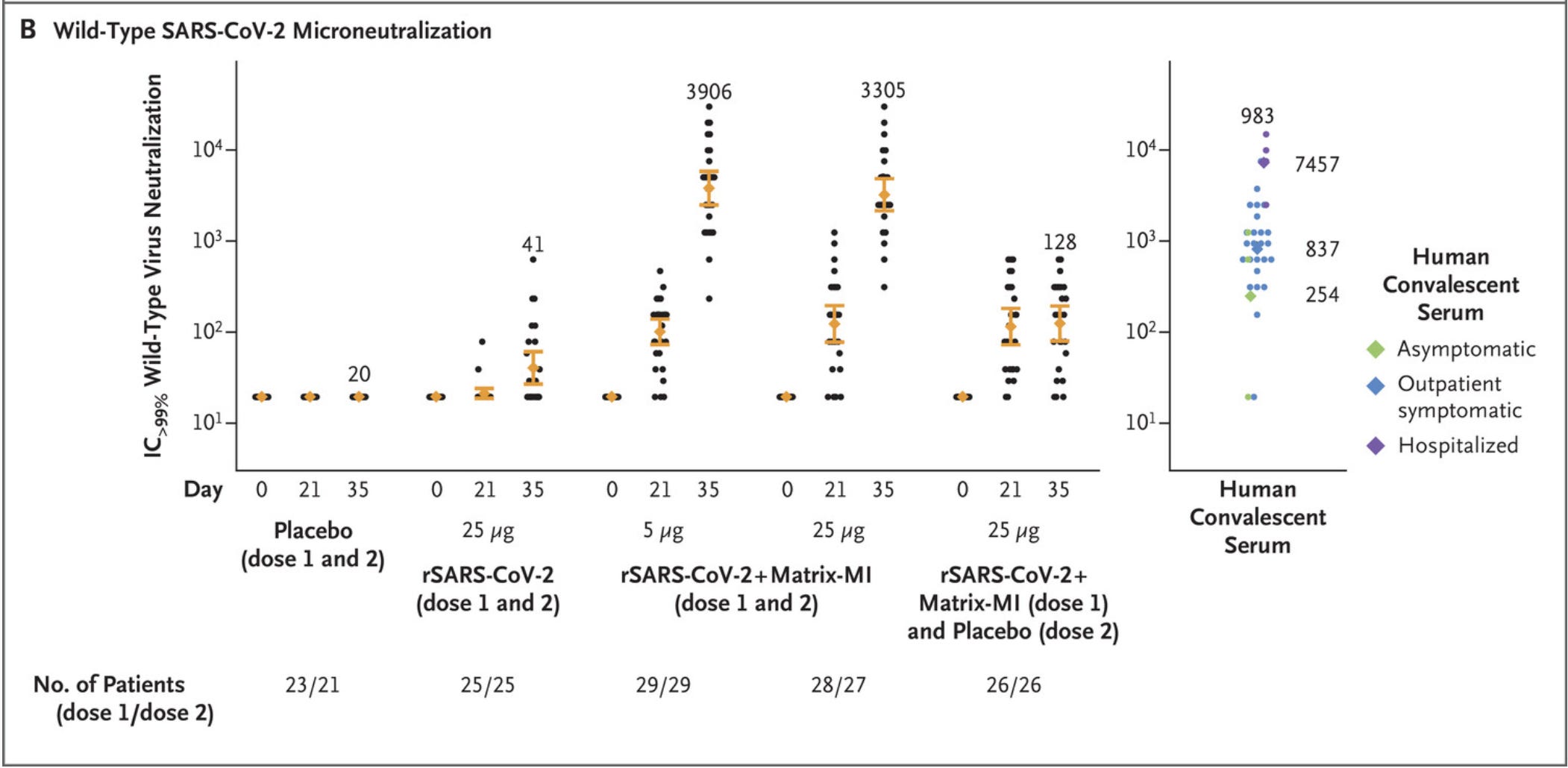
不过,这里应该注意的一件事是,这里看到的中和抗体滴度有明显的传播。此外,此处报告的值是 IC>99%,而 IC50 (或本例中的倒数 ID50)是更标准的指标。这使得关于这些反应与其他疫苗相比如何的解释变得复杂(但我们确实有其他研究可以帮助我们——稍后会详细介绍)3.
第 2/3 阶段
Novavax 发表了 Nuvaxovid 的两项 3 期试验。 第一项研究于 2021 年 6 月发布,在英国进行,招募了大约 15,000 名参与者,并以 1:1 的比例随机分配他们。主要结果如下:

一些警告:A 和 C 是距离*第二剂*的时间。第一剂后的疗效不为零,预计在接种疫苗后 2-3 周左右出现,第二剂在第一剂后 21 天接种,因此 A 和 C *可能*不会在其累积发生率函数中表现出不朽的时间偏差。从广义上讲,这种疫苗是有效的,这一点几乎没有疑问。该试验中测得的疗效为:对有症状的 COVID-19 为 89.7%(95% CI,80.2 至 94.6),对 B.1.1.7(α)变体为 86.3%(95% CI,71.3 至 93.5),对非 B.1.1.7 毒株为 96.4%(95% CI,73.8 至 99.4),在首次给药后 14 天开始,所有参与者为 83.4%(95% CI,73.6 至 89.5),以及 88.9%(95% CI,95% CI,73.6 至 89.5) 12.8 至 98.6) 在 65 岁及以上人群中的总体有效性。
在安全性方面,疫苗总体耐受性良好,但一名接受者在接种第二剂疫苗后出现心肌炎,DSMB 判断可能是病毒性心肌炎。疫苗组中的一名患者在有机会接种第二剂疫苗之前就死于 COVID。
在更新中,Novavax 报告说,在这项研究人群中,超过 7.5 个月的研究人群(即按照研究方案接种所有剂量疫苗且未退出的人)对 COVID-19 的疗效为 82.7%(95% CI 73.3 至 88.8)和意向治疗人群(研究中的所有参与者,无论他们是否遵循方案)的 68.7%(95% CI 58.1 至 76.6):
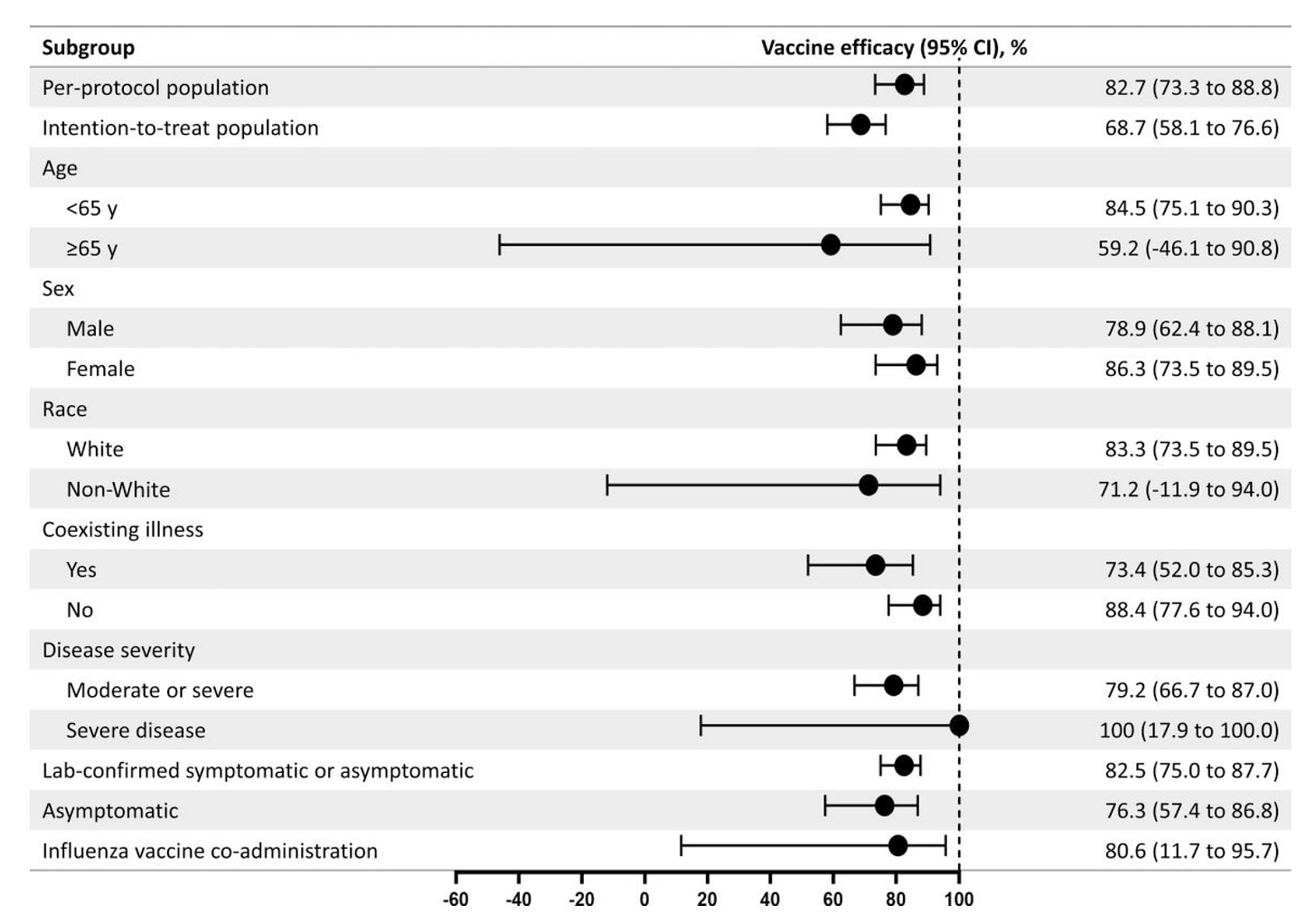
作为参考,在第二剂后 4 个月内,辉瑞的疗效为 83.7%(95% CI 74.7 至 89.9),而 Moderna 的疗效为 82.0%(95% CI 79.5 至 84.2),盲法阶段结束时,中位随访期为 5.3 个月。我发现很难从这些数据中对 Novavax 对 mRNA 的相对持久性做出强有力的声明。
PREVENT-19 还检查了 Novavax 疫苗在 Delta 变体出现之前的保护持久性。

根据论文的讨论:
虽然由于研究设计、终点、毒株和随访持续时间的差异,很难评估疫苗保护效力的持久性的比较,但从定性上讲,NVX-CoV2373 与其他疫苗一致,对 Delta 前毒株的疫苗效力在 3 个月内保持不变,对 Delta 的效力在 5 个月内减弱。NVX-COV2373 在后期时间点是否具有与 mRNA 疫苗相似的持久性特征尚不清楚。
…
虽然与其他疫苗相比,我们的随访时间更短,样本量更小,但这项分析表明,对于此处研究的随访期间,NVX-COV2373 具有类似于前 Delta 和 Delta COVID-19 的基于 mRNA 和载体的疫苗的持久性特征。使用不同疫苗平台进行异源加强可能会提高持久性 [2],评估异源加强的研究将提供有用的数据来为疫苗推荐提供信息。
换句话说,与当时的其他疫苗相比,Novavax 的疫苗对 Delta 变体的持久性没有明显优越。
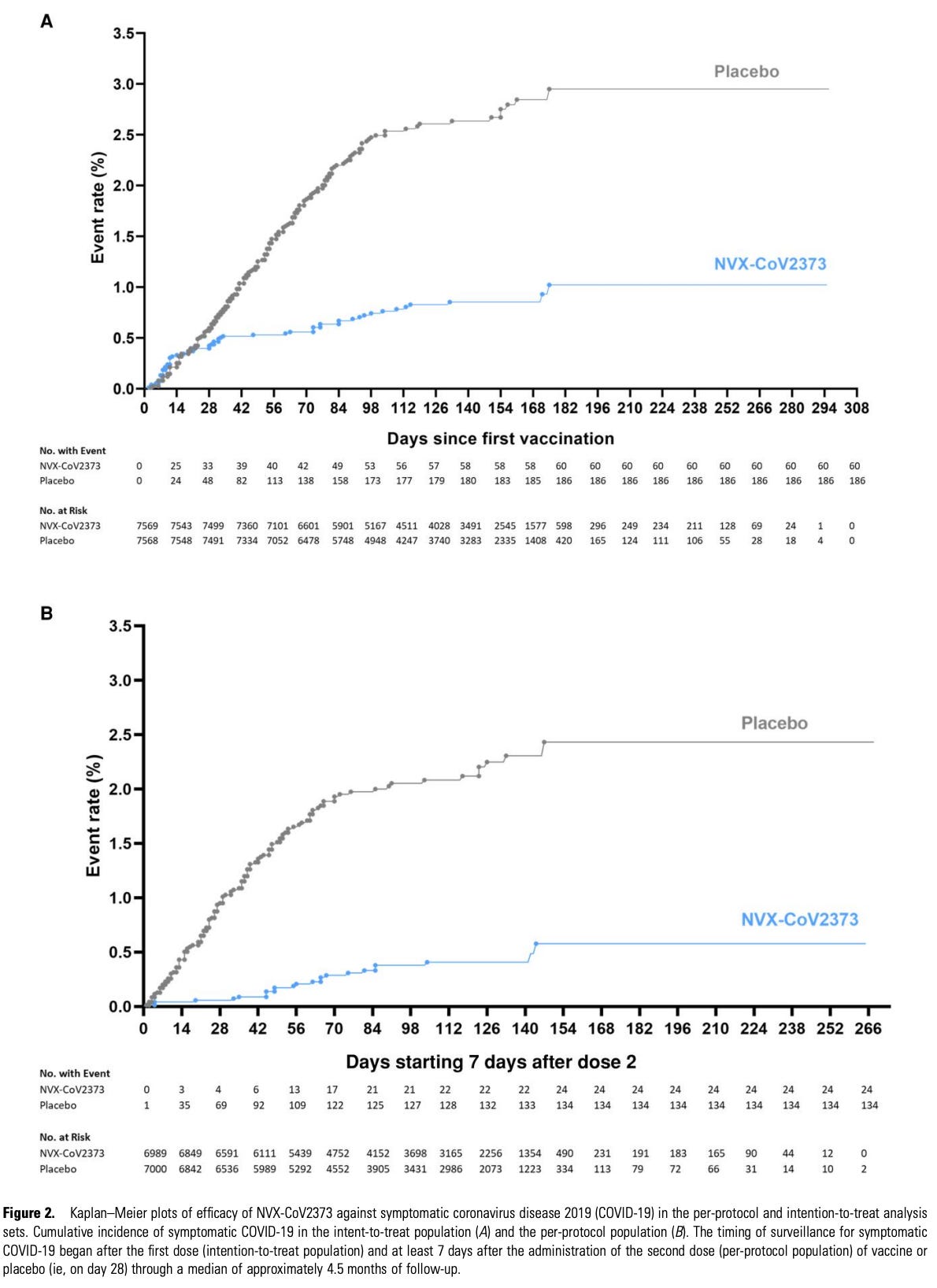
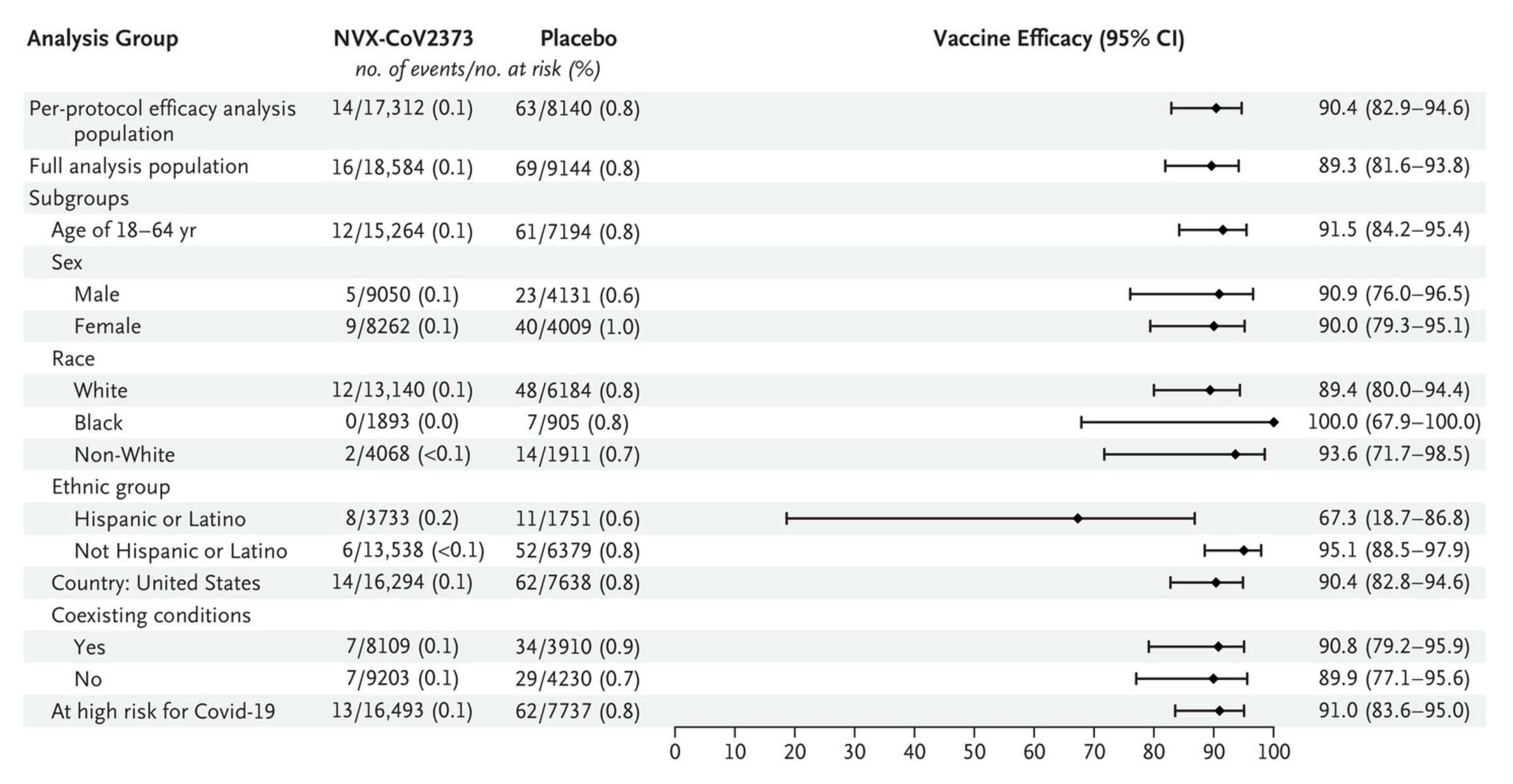
在 2021 年 12 月在美国和墨西哥发表的另一项 3 期试验中,招募了 ~31,000 人,其中 ~30,000 人接受了随机分组(2:1,疫苗:安慰剂)。以下是累积发生率函数:
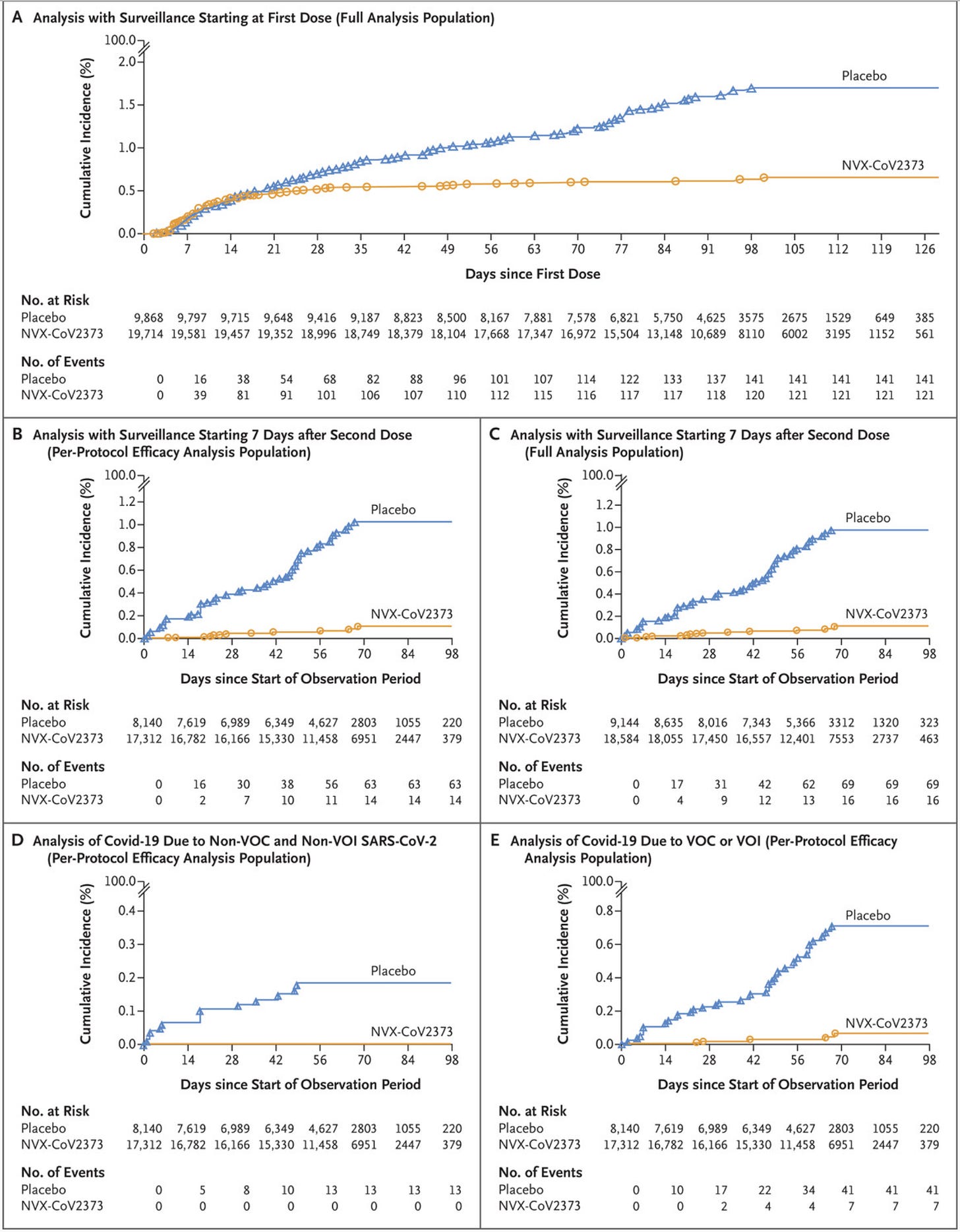
我个人更愿意从第一次给药开始报告所有结果的疗效(这有助于确认各组不存在某种偏倚),但这并不是取消资格。下表列出了所有不同的疗效结果:
在安全性方面,没有明显的跳出,但疫苗组发生了 1 例心肌炎,安慰剂组也发生了 1 例;因为这项研究是 2:1 随机分配的,所以在这项研究中,疫苗组的发病率实际上在数值上更高,但这是否有意义是任何人的猜测。该研究还在 3-4 个月时建立了盲法交叉,因为在安慰剂组证明有效后拒绝接种疫苗是不道德的。值得注意的是,这里的所有数据都是在 Delta 和 Omicron 变体出现之前的数据。
Nuvaxovid 可能在处理某些变体时遇到了重大问题,但很难确定。 例如,beta 变体 (B.1.351) 在南非扎根,尤其令人担忧,因为它严重逃避了两剂疫苗或感染引起的抗体反应(比 Omicron 之前的任何其他变体都多)。在这里,Nuvaxovid 的功效急剧下降,降至 50% 左右。
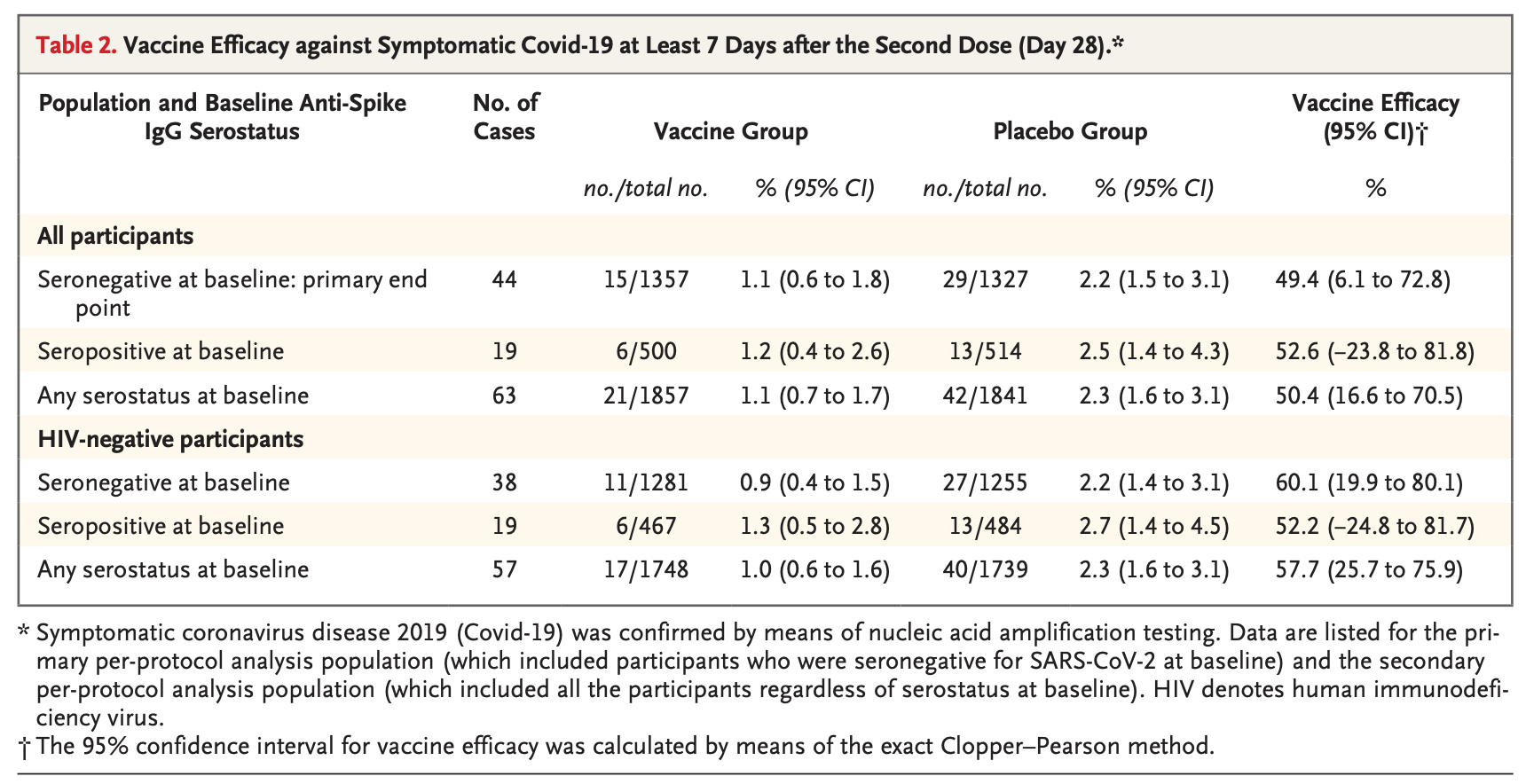
值得注意的是,这一人群背负着 HIV 感染的沉重负担,这自然会降低疫苗的保护作用。然而,当将分析限制在那些没有感染 HIV 的人时,效果并不是特别显着,疗效为 60.1%(95% CI,19.9 至 80.1)。诚然,这至少部分可能与有限的随访时间有关,因为其他疫苗最初也显示出对 B.1.351 变体的有效性不佳,尤其是在第二剂之前,而这项研究仅对人们进行了 60 天的随访。尽管如此,我不知道 Novavax 曾经解释过为什么这种疫苗的功效似乎受到了如此大的打击,而其他疫苗似乎表现得要好得多。
作为参考,辉瑞报告称,在其南非工厂,发生了 9 例 COVID-19 病例,全部由 beta 变体引起,并且都在安慰剂组中(疗效为 100%,95% CI,53.5 至 100)。Moderna 确实在其 RCT 数据中报告了特定于 B.1.351 变体的数据;但是,我们确实有针对这种变体的 mRNA 疫苗的真实世界有效性数据。 来自卡塔尔的数据发现,辉瑞疫苗对 B.1.351 变体的症状性 COVID-19 的有效性为 72.1%(95% CI,66.4 至 76.8); 在以色列,完全接种疫苗的 VE 对确诊或可能的 Beta 感染为 72% (95% CI -5 – 97%;p=0·04),对有症状的确诊或可能的 Beta 感染为 100% (95% CI 19 – 100%;p=0·01),未观察到部分疫苗接种的有效性。对于 Moderna,来自卡塔尔的数据发现,在接种第一剂后 14 天或更长时间但在接种第二剂之前,该疫苗的接种率为 61.3%(95% CI:56.5-65.5%),在接种第二剂后 14 天或更长时间内,该疫苗对 beta 变体感染的接种率为 96.4%(95% CI:91.9-98.7%)。 法国也报告了类似的结果。
儿科数据
Novavax 在 12 岁以下就被批准使用,这得到了美国青少年 3 期试验数据的支持。青少年以 2:1 (疫苗:安慰剂) 的比例随机分配 2 剂 Nuvaxovid。因为这是大流行的后期时间点,感染范围更广,并且已经出现了变种,因此该研究主要试图证明疫苗在青少年中诱导的反应与在成人中诱导的反应相似,而疫苗已经被证明具有保护作用。尽管如此,还收集了安全性和有效性数据:
从广义上讲,该疫苗耐受性良好,疫苗组和安慰剂组在不良事件方面没有令人担忧的差异。对特定不良事件的更详细观察并未揭示任何令人担忧的模式,但这应该在这项研究招募了 ~2300 名青少年的背景下看待,因此对于这种规模的研究来说,罕见的不良事件是无法检测到的。
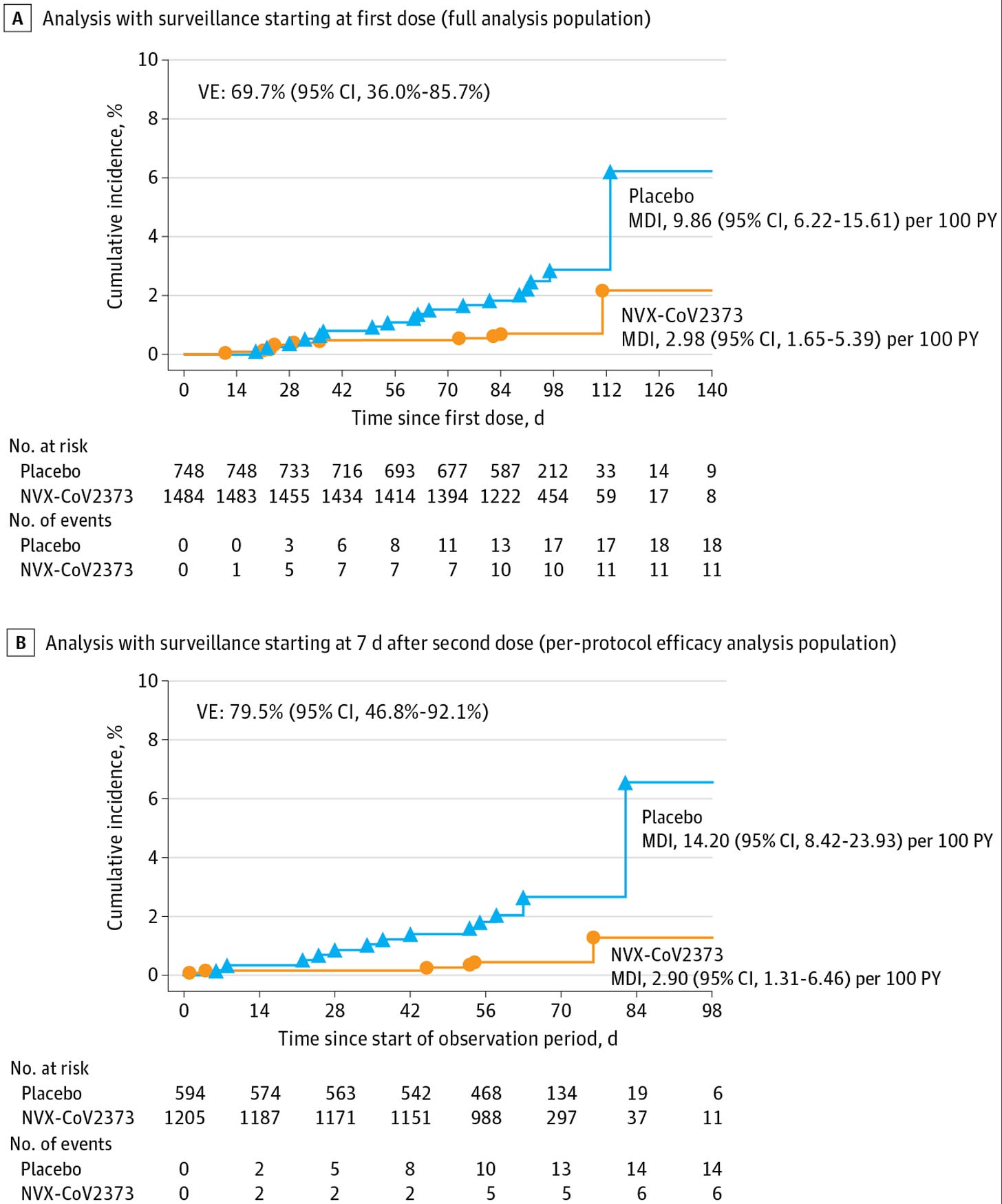
研究期间的主要变异是 alpha 和 delta:

大多数免疫原性数据都在补充剂中;总的来说,反应非常好,尽管来自 Ancestral 的 alpha 变体的中和滴度下降幅度惊人地大。我还觉得奇怪的是,伽马变体的中和滴度比 α 高。还值得注意的是,大量疫苗接种者缺乏可检测到的针对 Omicron 变体 (BA.1、BA.2、BA.5) 的中和抗体,尽管这些抗体在分析研究期间不存在。

基本上,疫苗在这里起到了它想要的作用。
另一项 2/3 期试验使用印度血清研究所 (SII) 生产的名为 Covovax 的疫苗(与 SII 刚刚生产的 Nuvaxovid 疫苗相同)在印度青少年中进行。2 岁至 17 岁的参与者以 3:1 的比例随机分配到 SII-NVX-CoV2373 或安慰剂组,并监测 179 天。~460 名青少年 (12-17) 和 ~460 名儿童 (2-11) 完成了这项研究。从广义上讲,该研究表明,该疫苗可靠地诱导疫苗接种者的抗体反应明显大于成人,儿童的反应也大于青少年。
实际有效性
关于 Novavax 的真实世界有效性数据非常有限,因为接种这种疫苗的人相对较少。我们确实有一项 来自澳大利亚的研究,试图比较 BNT162b2(辉瑞)、mRNA-1273(莫德纳)、ChAdOx1 nCov-19(牛津/亚利桑那州)和 NVX-CoV2373(诺瓦瓦克斯)对 Omicron 变体的真实世界有效性:
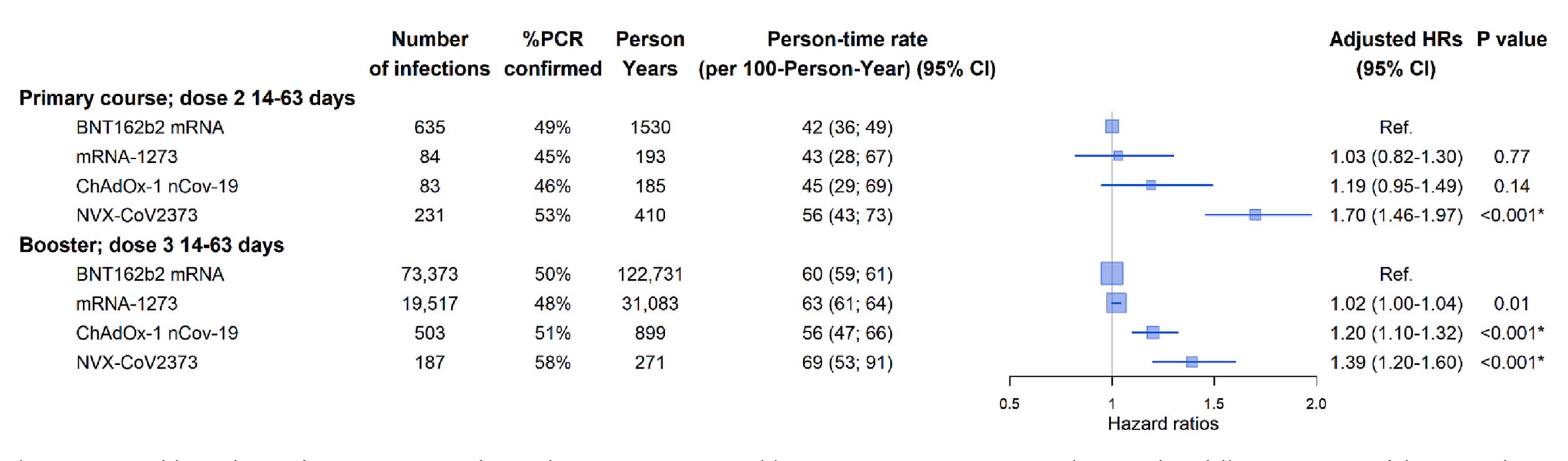
在这项研究中,辉瑞和莫德纳的感染率都是最低的,而诺瓦瓦克斯实际上在初级系列和加强剂方面的发病率甚至比牛津/亚利桑那州都高,这令人费解。值得注意的是,这是专门检查感染,并没有考虑这些个体中的哪些人(如果有的话)患上了疾病。此外,在此处看到的加强针队列中,与 mRNA 疫苗相比,接种 Novavax 疫苗的人很少。这使得比较变得困难,尽管主要系列队列的数据足够相似,因此比较可能是合理的。尽管如此,我们已经看到,至少需要 3 剂疫苗才能真正获得针对 Omicron 变体的可靠抗体反应,因此这些数字并不那么重要。尽管如此,这项研究未能证实 Novavax 在 COVID-19 疫苗中被神化的地位。
除了这项工作之外,我们还有两个预印本,研究了 Novavax 在韩国的有效性。 这项研究检查了 3 剂 Novavax 与 3 剂辉瑞的比较,发现感染 Novavax 的风险略高,而严重感染的风险在数值上较低,但未达到统计学意义(不幸的是,这是我能从预印本中获得的最高分辨率数字):
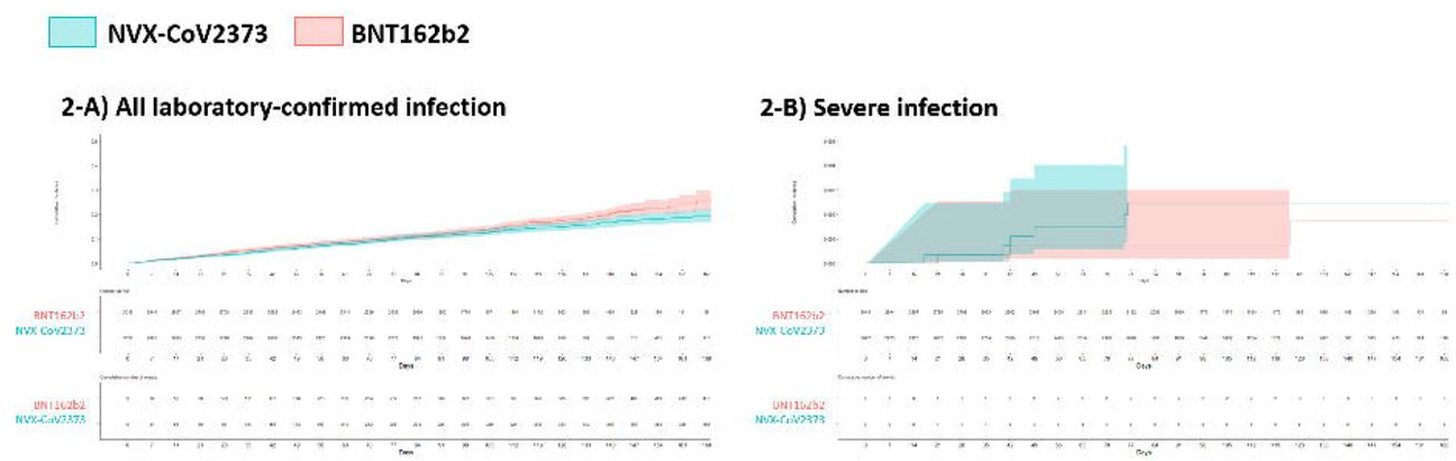
在这些数据中,还有一个表格按年龄组比较了风险。辉瑞在该数据集中的优势似乎主要在 18-39 岁的年龄组中,而对于所有其他年龄段的人口统计数据,没有统计学上的显着差异。
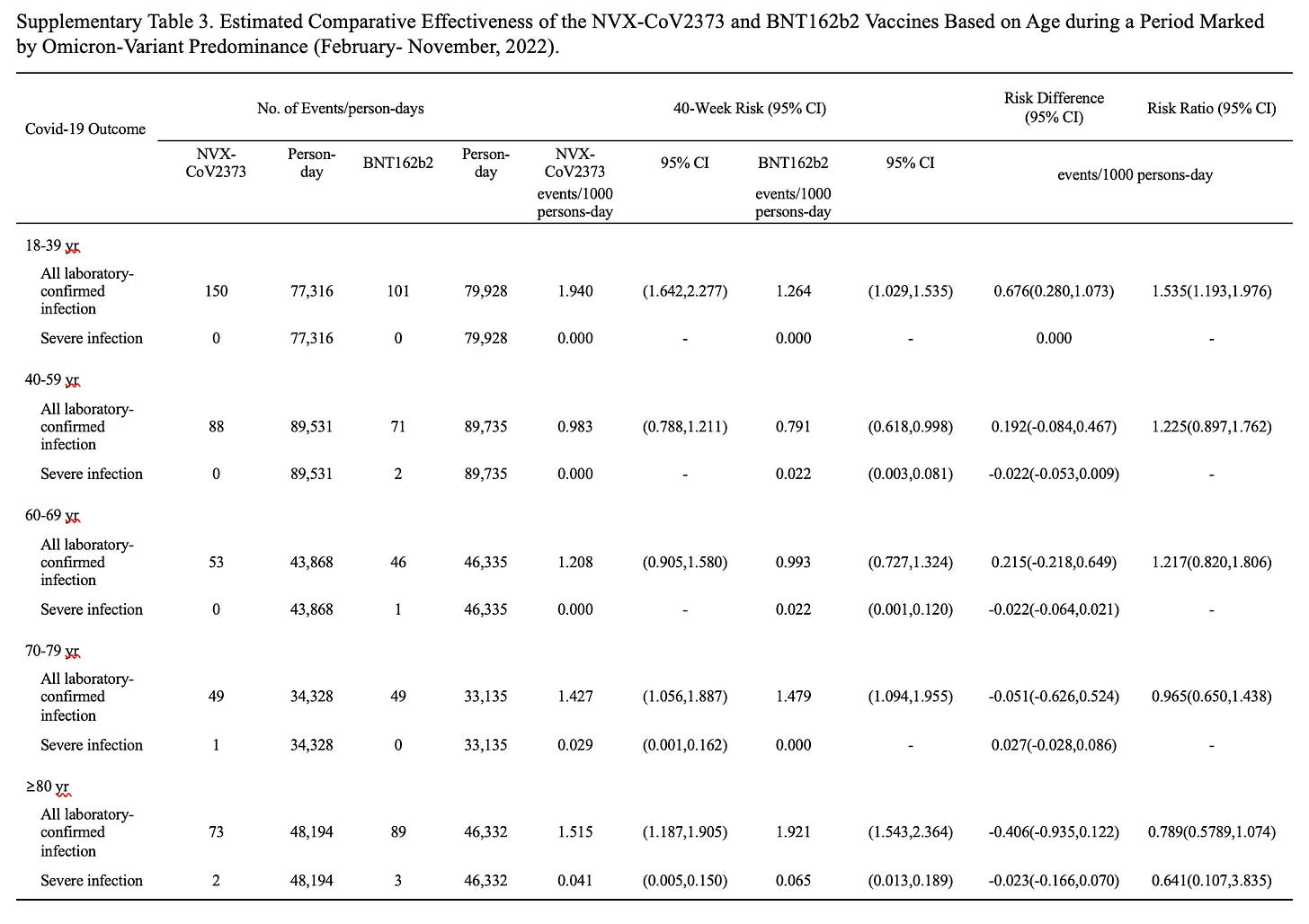
然而,这项研究在它能够调整的混杂因素方面非常有限,因为这些不包括社会经济地位和合并症等内容。
我们拥有的第二个预印本也使用了来自韩国的数据,但也许值得注意的是,Novavax 也有这个预印本的作者。这丝毫没有否定其调查结果的资格,但值得牢记。结果如下:
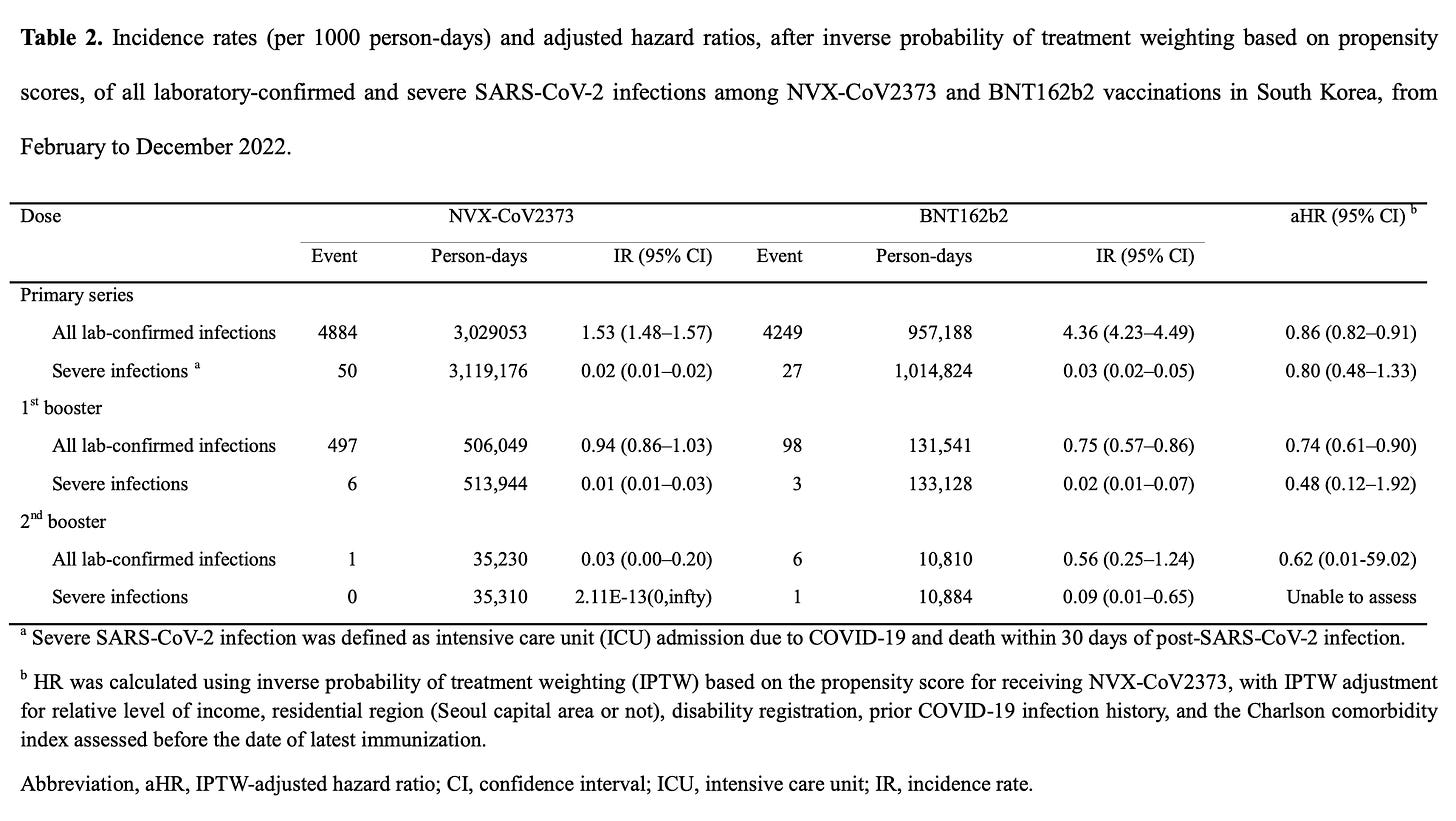
基本上,诺瓦瓦克斯在同源基础系列和第一剂加强针方面比辉瑞对感染有轻微益处;第二次加强针的比较缺乏统计能力,但从最后一剂接种后 30 天内来看,Novavax 疫苗的风险似乎较低。就严重感染而言,Novavax 的发病率在数值上较低,但在任何情况下都没有达到统计学意义。不过,这里有一个重要的细节。对于每个对照组(基础系列、第一剂加强剂、第二剂加强剂),Novavax 的接受者既往感染的可能性明显更高,仅接受原发性接种的接受者差异最大(77.5% 对 63.2%)。这可能部分通过与以下事实相平衡:诺瓦瓦克斯的接受者中有更大比例可能是残疾的,并且有更多的合并症,但尽管如此,这使得关于疫苗相对于彼此效果如何的解释变得复杂。
我们还有一项有效性研究,使用 2022 年 2 月至 2022 年 9 月的意大利人群,当时 Omicron 亚变体 BA.2 和 BA.5 占主导地位。这项有效性研究的设计与大多数研究略有不同,使用第一次给药后 3-10 天作为其参考间隔。这里的想法是,这是在预期疫苗产生任何有效性之前,这是合理的。结果总结如下:
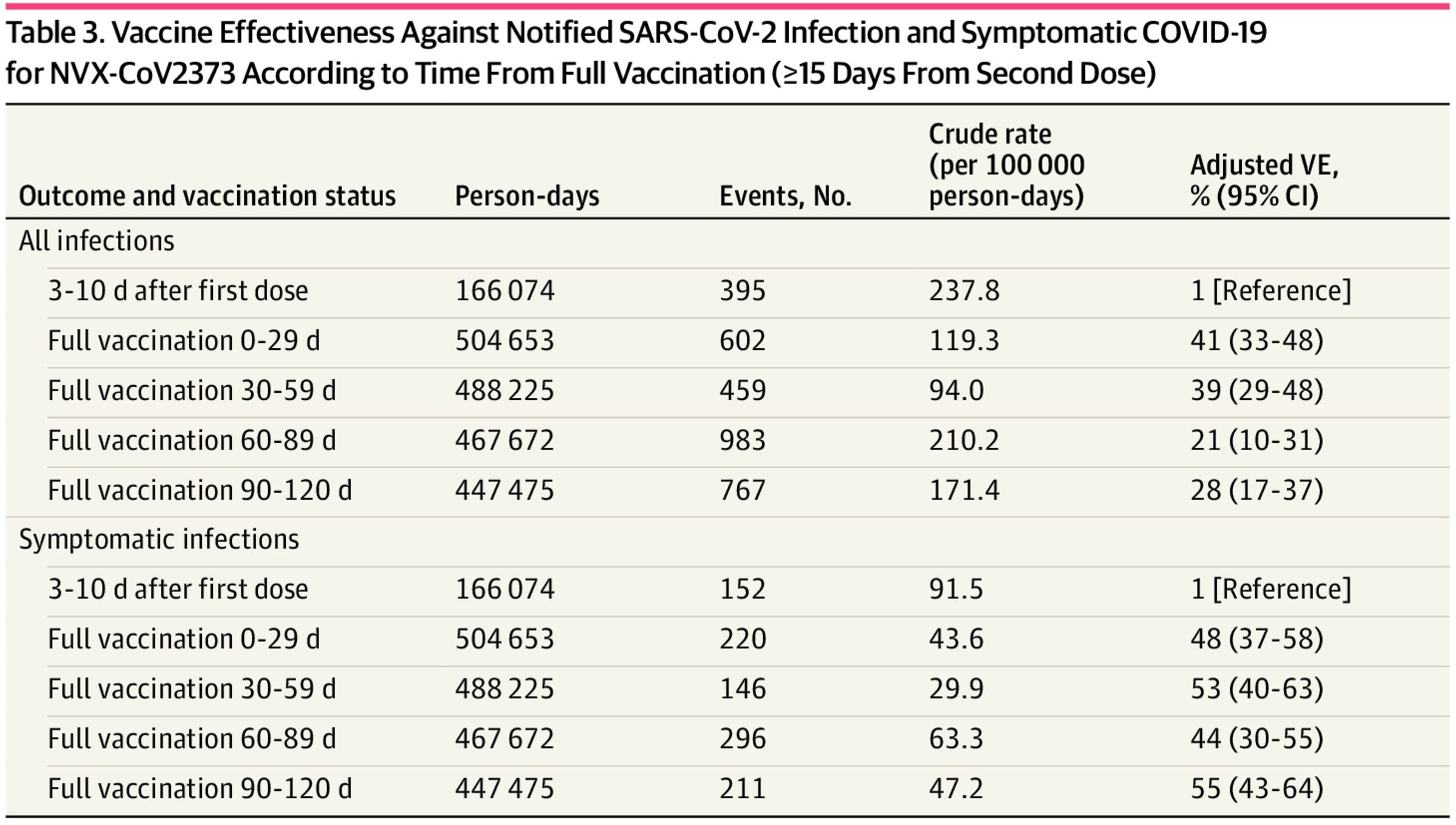
该研究还排除了那些有记录的 SARS-CoV-2 感染者,这有帮助。从广义上讲,一旦在 4 个月内完成完整的疫苗系列,该方案的有效性似乎是稳定的。然而,由于这项研究的设计在疫苗有效性的测量方式上有所不同,并且不同研究中报告症状的方式可能存在差异,因此很难与其他疫苗进行比较。此外,由于快速抗原检测的出现,测量未就医的感染(例如无症状感染)从根本上说是非常困难的,如果研究人群中检测的使用不均匀,这可能会影响任一方向的估计。也许最重要的是,这是基于两剂 Nuvaxovid 系列,因此它在大多数人至少接种了 3 剂的世界中的含义尚不完全清楚。
另一项真实世界的研究也已经发布,一些人声称该研究证实了 Novavax 的耐用性特别好的说法。关键人物是这个:
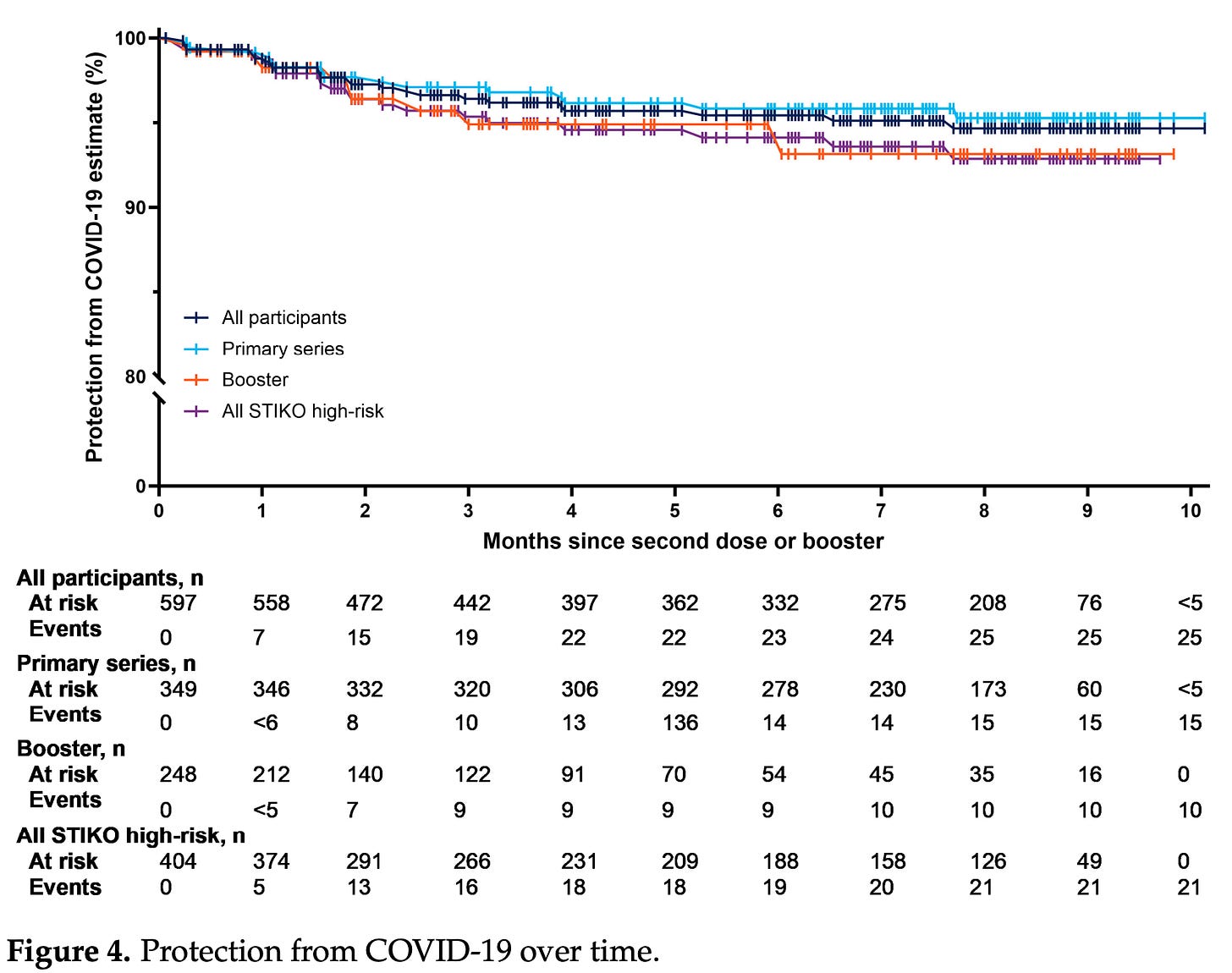
这里的问题是,这不是你衡量疫苗有效性的方式。这实际上是一个检查您的队列中有多少人没有感染 COVID-19 的图。与未接种疫苗的人或接种不同疫苗的人没有可比性。此外,该研究人群的很大一部分包括患有 STIKO 认为是高风险疾病的个体(54% 仅患有慢性神经系统疾病),这可能会影响感染 COVID-19 的行为,使他们更加谨慎(因此需要平行对照组)。同样重要的是要注意,如果感染发生在 2022 年之前,这项研究无法解释感染史。
反应原性和安全性
首先,许可前试验报告了反应原性和安全性数据:

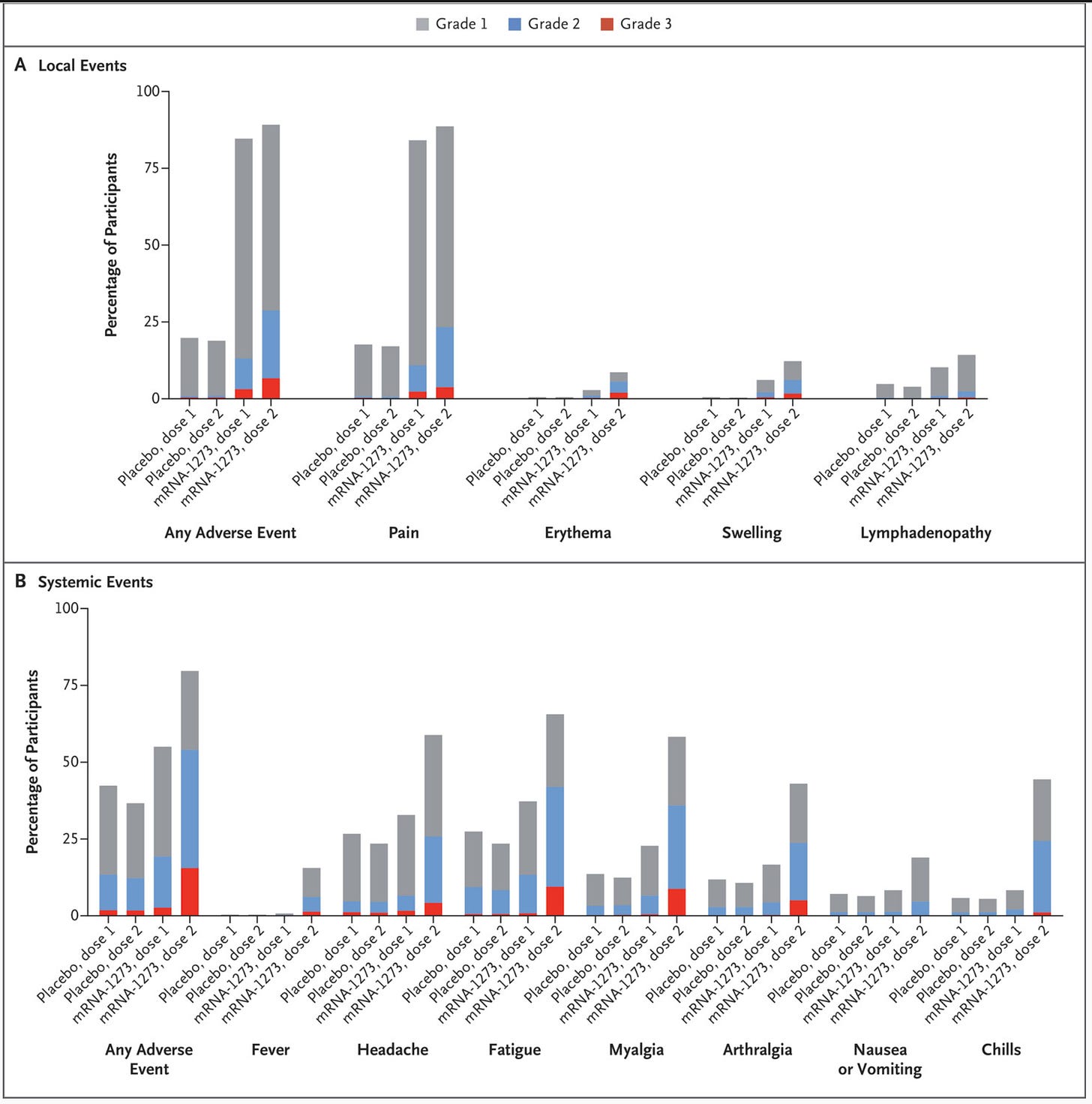
从广义上讲,2 剂疫苗似乎耐受性非常好。值得注意的是,全身症状的频率通常较低且接近安慰剂,这与在疫苗免疫学中观察到的情况一致(后面部分)。值得注意的是,第二剂似乎比第一剂更难一些,类似于 mRNA 疫苗。为了进行比较,以下是来自 Moderna 的删节反应原性数据:
辉瑞公司 (Pfizer):
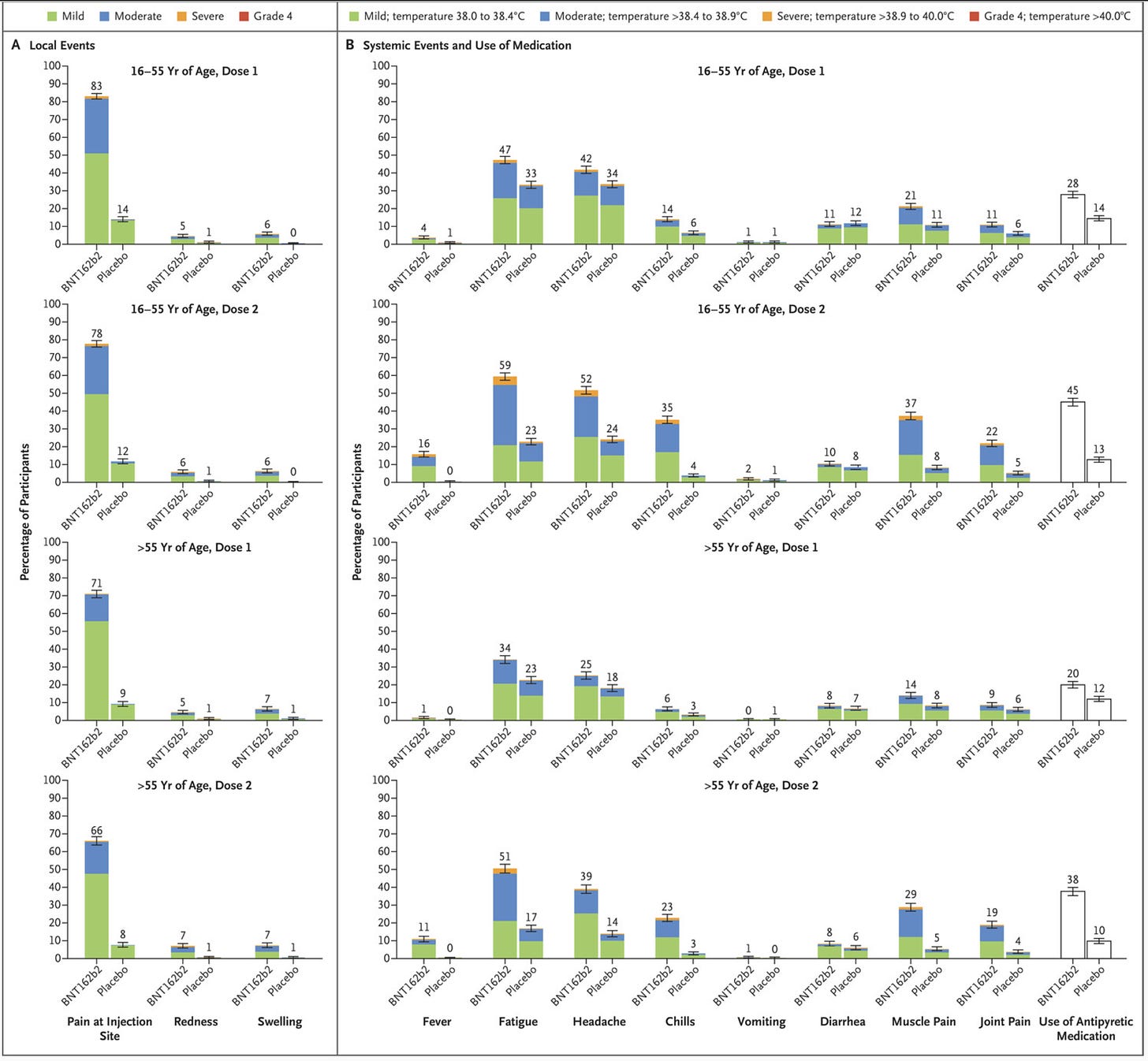
一般来说,对于绝大多数人来说,mRNA 疫苗的反应原性并不像有些人可能引导您想象的那么糟糕——反应原性非常频繁,但总体上趋于轻度或中度(即,不会显着干扰日常生活)。尽管如此,大数的一小部分仍然是一个非常大的数字。这意味着有些人会出现破坏性的全身症状,如疲劳、头痛、肌肉酸痛、关节痛等,其程度是破坏性的。一般来说,这些症状是短暂的(1-2 天左右),但尽管如此,这可能意味着计划疫苗接种很麻烦。这些症状是疫苗接种引发的主动免疫反应的结果,通常本身无害,尽管它们可能会让人感到不愉快。在极小比例的情况下,已知 mRNA 疫苗会对患有某些慢性病的人造成重大破坏,例如肌痛性脑脊髓炎,又名慢性疲劳综合征。
尽管如此,由于很多人已经获得了 mRNA,因此对大多数人来说,相关的问题不是“Novavax 的初级系列是什么样子的”,而是“Novavax 作为 mRNA 的助推器是什么样子的?在这方面,Novavax 确实赢得了金星:

一项文献综述检查了主要系列为 mRNA 疫苗的人在接受 mRNA 加强剂或 Novavax 后的反应原性,发现 Novavax 接受者比接受 mRNA 加强剂的人出现全身症状的频率明显较低,但最初完成 Moderna 疫苗系列接种的人出现恶心和呕吐的情况除外。那个人有点奇怪,我不能冒险解释。这可能是由于使用的样本量相对较小。
Novavax 的 COVID-19 疫苗的安全数据有点有限;的确,它在许可前试验中显然达到了可接受的安全指标,这支持疫苗对大多数人应该是安全的,但仍有一些罕见的不良事件值得关注。在诺瓦瓦克斯疫苗获得许可之前,心肌炎是一个特别令人担忧的问题,因为此时它已被揭示为 mRNA 疫苗接种后的严重不良事件。此外,Novavax 在其许可前试验中测得的心肌炎风险实际上高于任何一种 mRNA 疫苗(详见表 20)。一般来说,这种风险在普通人群中很难检查,因为(至少在 mRNA 疫苗的情况下)它强烈偏向于年轻男性,这意味着普通人群中增加的风险可以忽略不计,但对他们的影响不成比例。澳大利亚的 TGA 此前曾报告称,每 100,000 名 Novavax 接受者中有 3-4 例心肌炎,而每 100,000 剂 mRNA 疫苗有 1-2 例,但他们也指出,Novavax 的剂量数量有限意味着这一估计的确定性降低。CDC 还公布:
在澳大利亚、加拿大、欧盟、新西兰和韩国接种了 744,235 剂 Novavax COVID-19 疫苗期间,在 20 名男性和 15 名女性疫苗接种者中确定了 35 份报告(代表 36 例不良事件),中位年龄为 34 岁(范围 = 23-62 岁):29 份心包炎报告,包括 5 例在 mRNA COVID-19 疫苗接种后有心包炎病史的人;4 例心肌炎病例;2 例心肌包炎病例;和1 例心脏炎,未另行说明。澳大利亚的一项上市后分析确定了 3 例心肌炎和 12 例心包炎病例,在此期间接种了 160,000 剂 Novavax COVID-19 疫苗 (5)。
CDC 还发布了一份基于对 69,227 岁及以上人群接种的 12 剂疫苗的安全报告;一般来说,这里没有明显的令人担忧或不寻常的模式,但剂量如此之少,以至于对于考虑罕见的不良事件来说毫无信息量。截至 2024 年 8 月 10 日,美国已接种 83,047 剂疫苗 根据 Our World in Data.
Novavax 发表了一项风险-收益分析,研究了疫苗有效性与其疫苗报告的风险的几种情景,发现风险和收益的平衡仍然有利;然而,他们确实指出,缺乏 16-29 岁男性的详细数据,他们代表了确定临床试验中心肌炎发生率的两个病例。话虽如此,我确实同意,假设与 Novavax 疫苗相关的心肌炎病程与 mRNA 疫苗的病程相似,那么风险和收益的平衡是有利的。
除此之外,EMA 还发布了关于过敏反应可能性的警告,尽管发生率尚不清楚并且可能非常罕见,并且还报告了感觉异常(皮肤针刺感)。
Novavax 与其他 COVID-19 疫苗:基础系列、加强针和混合疫苗
附录 09/15/2024:
最近这篇论文出来比较了Novavax、Moderna、Johnson & Johnson/Janssen和Oxford/AZ疫苗在感染情况下的病毒载量。当然,每个人都想知道哪种疫苗效果最好,但在我们走到那一步之前,有几个重要的点需要考虑(但如果你赶时间,我可以告诉你,我们可以合理地得出结论,当谈到 SARS-CoV-2 的早期变体时,Novavax 和 Moderna 的突破性感染可能比未接种疫苗的人更有效地传播病毒——除此之外, 我们不能说太多,包括哪种疫苗效果更好)。
首先,这不是病毒载量本身,而是 PCR 拷贝数。理解这一点很重要,因为虽然这些数量是相关的,但它们不是一回事。特别是,当考虑冠状病毒等病毒时,亚基因组 RNA (sgRNA) 是在复制过程中产生的,基因组 3′ 端的基因比 5′ 端的基因以更大的拷贝数存在:

这意味着 RT-PCR 靶向基因的选择会影响测量的拷贝数。因此,进行的比较是平行的非常重要。然而,我们在这方面遇到了两个问题。首先是:目前尚不清楚基因靶标在 3 期试验中是否协调一致,这使得直接比较令人担忧。第二个原因是不同地点收集拭子的方式存在显着差异。
该论文通过限制与最接近 COVID-19 发病的鼻咽拭子相对应的病毒载量的比较来解决这个问题。不幸。。。所有 4 项研究都使用了 COVID-19 发病的不同定义:
COVID-19 发病定义为首次 PCR 检测呈阳性的日期 (阿斯利康)、症状出现 (杨森)、2 个中较早的日期 (Novavax) 或 2 个较晚的日期 (Moderna)。
除此之外,Moderna 的样本必须仅限于通过 RT-PCR 和抗核衣壳血清学测定在 57 天内呈阴性且诊断时 PCR 呈阳性的参与者。基本上:我认为一个理性的人无法尝试争辩这里的比较是真正平行的。尽管如此,这项研究并非没有价值。这是关键数字:

结果也以表格形式进行了总结:
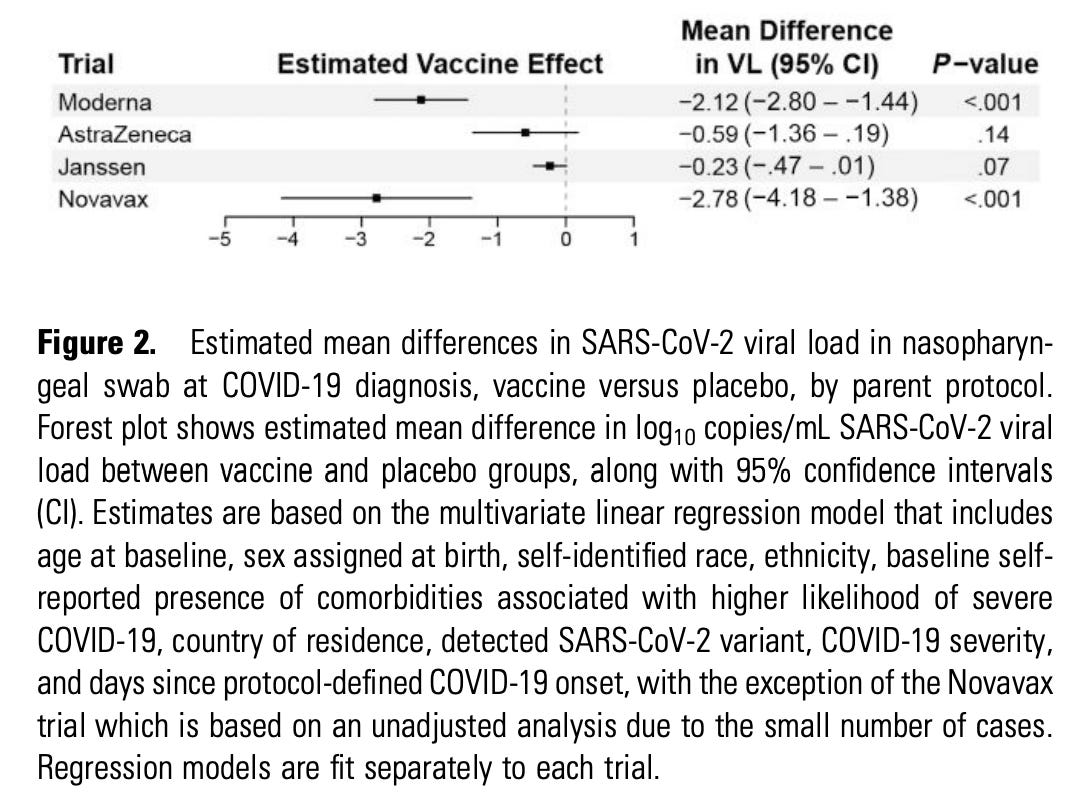
首先,我认为解决许多人可能没有关注但仍然很重要的一点很重要。与安慰剂相比,两种腺病毒疫苗的“病毒载量”差异不明显(置信区间包含 0)。这并不意味着疫苗不会减少传播。请记住 – 这些是突破性感染。疫苗首先降低了感染发生的可能性。
我已经看到广泛的声明,这证明了 Novavax 在降低病毒载量和传播方面优于 Moderna。这种说法的问题是多方面的。首先,存在基本统计数据的问题:Novavax 的估计远不如 Moderna 的精确,因为它们为分析提供的样本要少得多。这表现在较宽的置信区间中。事实上,置信区间非常宽,以至于它包含了 Moderna 的所有置信区间和点估计值。这里的意思是,病毒载量减少的差异可以仅凭偶然来解释,并不一定反映由生物效应驱动的真实差异。 还值得注意的是,在病毒载量分布方面, Novavax 的安慰剂组的病毒载量也往往低于 Moderna 的病毒载量(注意量表)。这可能反映样本相对较少,但也可能表明比较不平行(同样,请注意,拭子相对于症状发作的时间是不同的)。此外,如果人们想比较病毒载量读数的有效性,我们不能忽视另一个有效性读数:Moderna 与 Novavax 的 PCR 结果呈阳性的相对风险。为此,我们需要去补充:

对于 Moderna,安慰剂组观察到 594 例,疫苗组观察到 36 例 (1:1 随机化)。对于 Novavax,安慰剂组有 60 例,疫苗组有 11 例(随机化比例为 1:2)。这相当于 Moderna 的疫苗效力为 94%,Novavax 的疫苗效力为 72%。此外,该报还写道:
除了接种疫苗外,没有其他具有统计学意义的 VL 预测因子(补充图 3-6)。仅对于 mRNA-1273 (Spearman 相关性 = 0.30),自上次疫苗接种以来的时间与 VL 弱相关(补充图 7),尽管当调整该变量时估计的关联基本没有变化(补充图 8)。
如果我们查看补充,我们会看到以下情节:

事实上,自接种疫苗以来,Moderna 的病毒载量呈明显的上升趋势,值得注意的是,Moderna 的数据仅限于至少第 57 天且核衣壳阴性的数据。对于 Novavax 来说,情况不太明显,可能是因为只有 11 个数据点可供借鉴,但我确实认为也看到了积极的趋势。该论文指出,对病毒载量的影响遵循抗体滴度的基本趋势——抗体滴度越高,病毒载量下降幅度越大。如果我们在第 57 天之前查看,Moderna 的数据可能会看起来更好一些,因为我们可能更接近抗体峰值。无论如何,鉴于所有这些限制,我认为无法得出关于哪种牛痘素表现“最好”的有力结论。特别是,鉴于这是基于大流行时期的古老历史变体,我不知道结果如何转化为现代背景,作者也指出了这一点。让我们转向更有用的研究来进行比较,好吗?
2022 年发表了了解不同 COVID-19 疫苗的不同优点和局限性的最有价值的研究之一。这项研究特别有价值,因为它收集了四种不同疫苗(辉瑞、莫德纳、强生/杨森和诺瓦瓦克斯)和SARS-CoV-2感染在多个匹配时间点的免疫反应数据,并使用相同的检测方法评估免疫反应,从而确保比较是平行的。尽管如此,关于 Novavax 的数据仍然更难获得,并且在所采集的时间点方面更加有限,并且总体上纳入的 Novavax 患者较少:

请注意,Novavax 仅采集了 2 个时间点,T4 比其他疫苗的等效时间点晚一点,但 T5 是匹配的。基本结果总结在图形摘要中,但我确实建议您回头查看论文以查看详细信息:
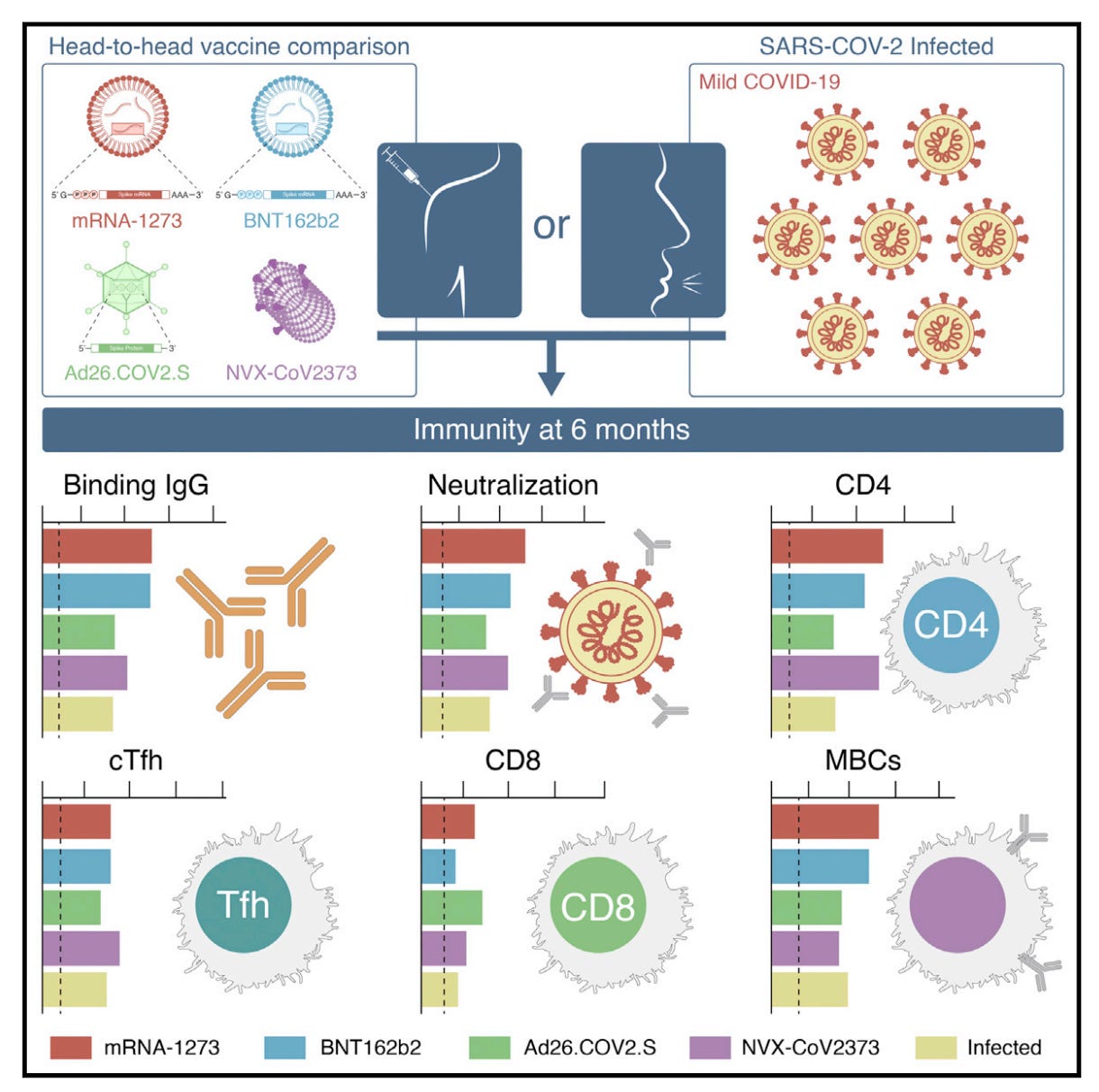
在血液中的抗体反应 (IgG) 方面,Moderna 和 Pfizer 是赢家,Novavax 紧随其后,感染落后。这些抗体中和病毒的能力对 Moderna 来说也是最大的,但辉瑞和诺瓦瓦克斯相似。mRNA 疫苗在记忆 B 细胞水平上也取得了胜利,这对于产生覆盖新变体的新抗体非常重要。就 T 细胞而言,Novavax 在辅助性 T 细胞反应方面与 mRNA 相似,包括 cTFH 细胞,该细胞群被认为对支持抗体产生至关重要。CD8 T 细胞可以杀死病毒感染的细胞,并且是新变异的早期反应者,在 Novavax 中很少见,但与 mRNA 疫苗和 Janssen 疫苗的诱导频率相当;然而,Janssen 的独特之处在于 CD8 T 细胞水平在整个研究期间持续上升。总之,Novavax 表明:
- 对辉瑞的抗体反应相当,在第二剂后 ~6 个月略低于 Moderna;我们不能在这里说太多抗体反应的相对持久性,因为我们只有 2 个 Novavax 时间点
- CD4 T 细胞对两种 mRNA 疫苗的反应相当
- CD8 反应明显低于 mRNA 疫苗或 Janssen 疫苗(图形摘要在这一点上不清楚 – 查看原始论文)
简而言之,这是一种固体疫苗,但在提供保护方面并不明显优于 mRNA 疫苗,无需观察第一剂后 6 个月内的免疫反应。这里的一个关键限制是,上呼吸道的免疫反应没有测量疫苗或感染,这错过了很大一部分。该小组最近提供了上呼吸道免疫微环境的详细特征。
Novavax 疫苗作为加强剂或混合初级系列的数据有点到处都是。人们普遍 认为,除了先前对其他疫苗的免疫力之外,一剂 Novavax 确实可以增强免疫反应,所以我不会介绍所有这些研究,因为结果是意料之中的,并不令人惊讶。我认为考虑它相对于替代方案如何作为助推器更有用。
COV-BOOST 研究了疫苗在接种其他疫苗的人中作为加强剂的效果如何。在这个数据集中,那些接受辉瑞疫苗的人如果接种 Oxford/AZ 疫苗的加强针,比接种 Novavax 疫苗的人具有更好的抗体反应。那些首先接受 Oxford/AZ 系列治疗的人对 Novavax 的反应优于第三剂 Oxford/AZ。在接种辉瑞疫苗的人中,接种 Moderna 疫苗的人接种了 Moderna 疫苗,接种者的反应最大。

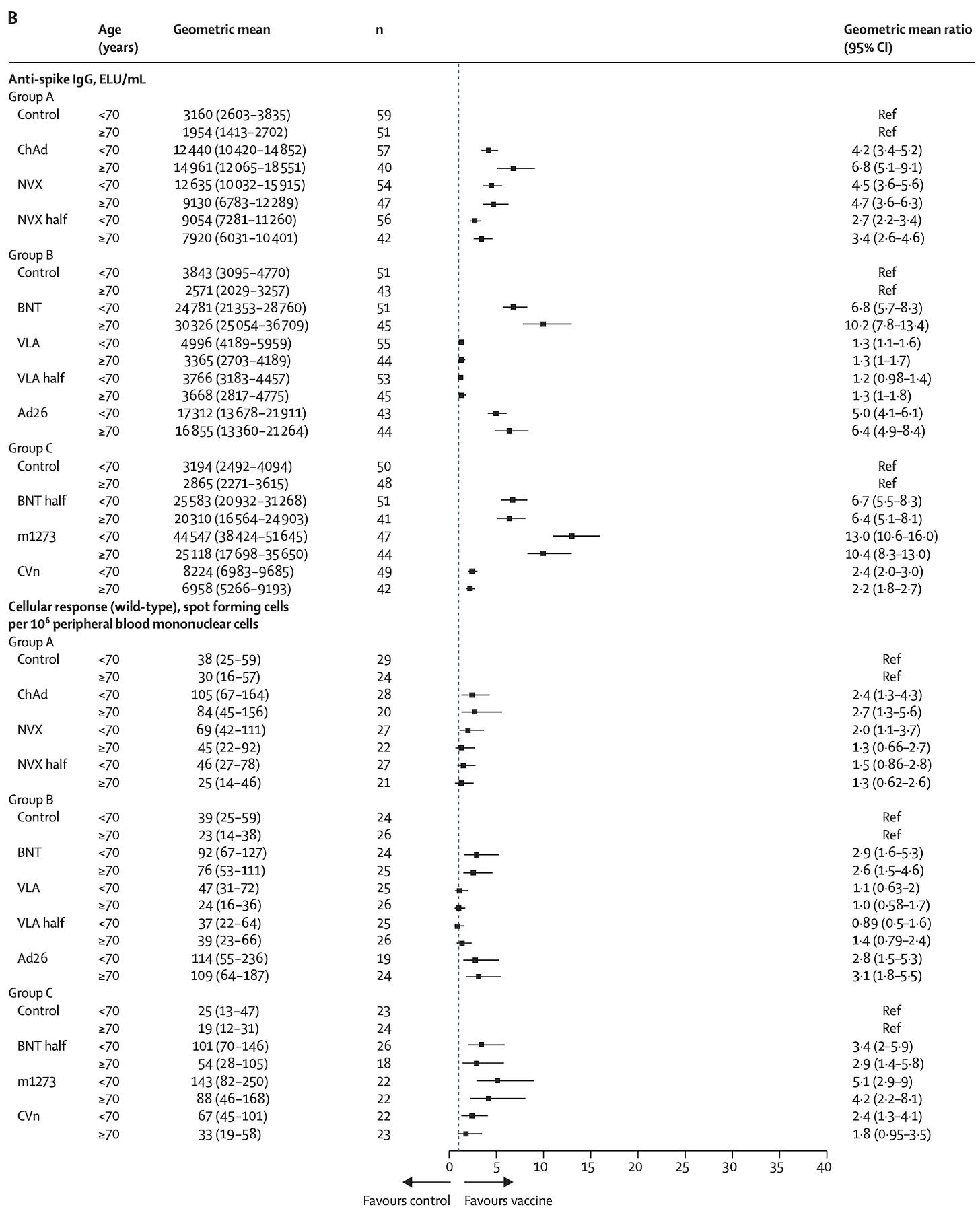
如果 Oxford/AZ 加强 Pfizer 的 T 细胞反应也优于 Novavax。
Com-COV 研究了混合疫苗系列的效果并发表了几项研究。 Com-CoV2 在英国随机分配参与者接受与第一剂相同的疫苗或不同的疫苗,然后比较免疫反应。以下是关键数据:
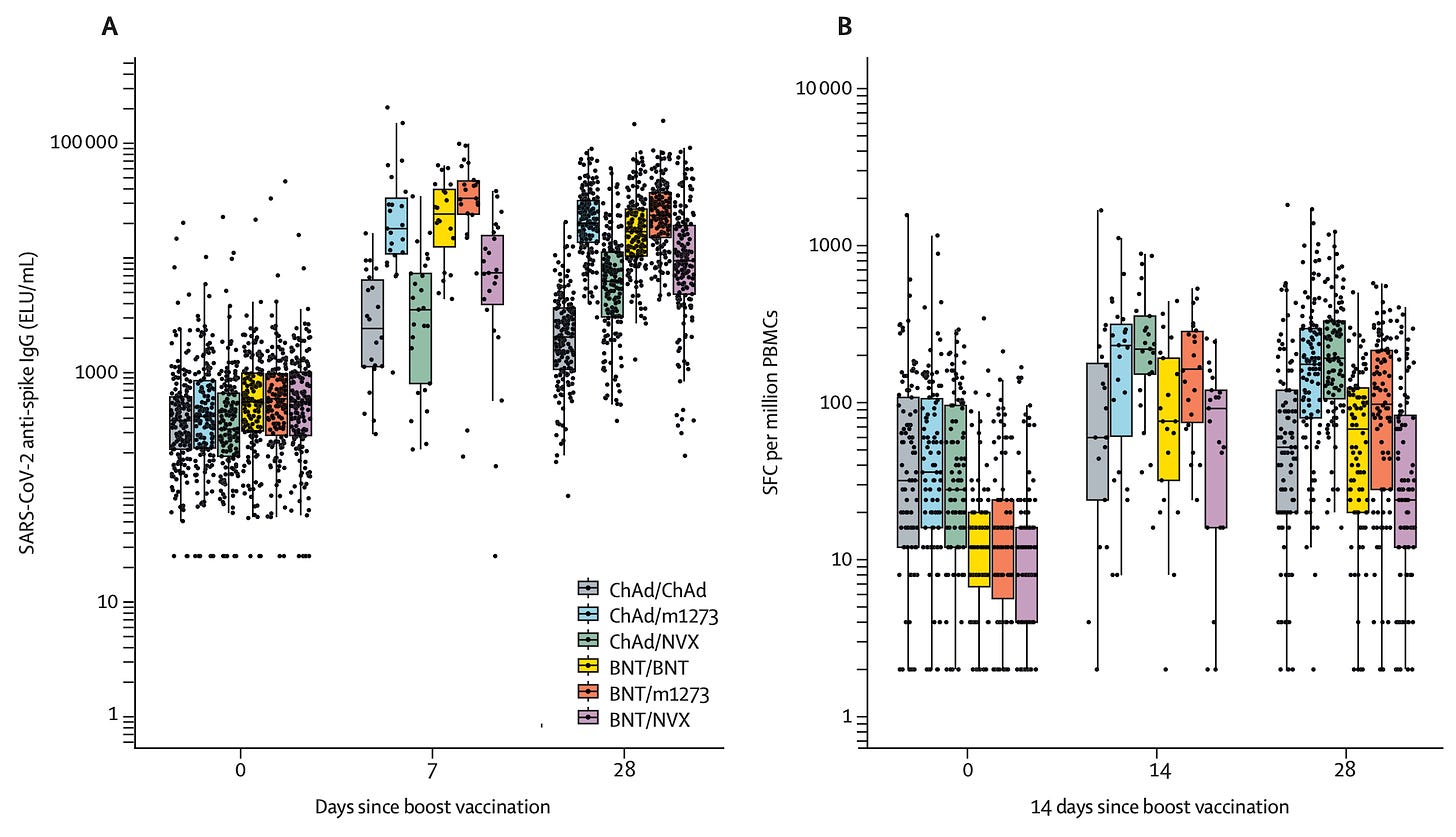
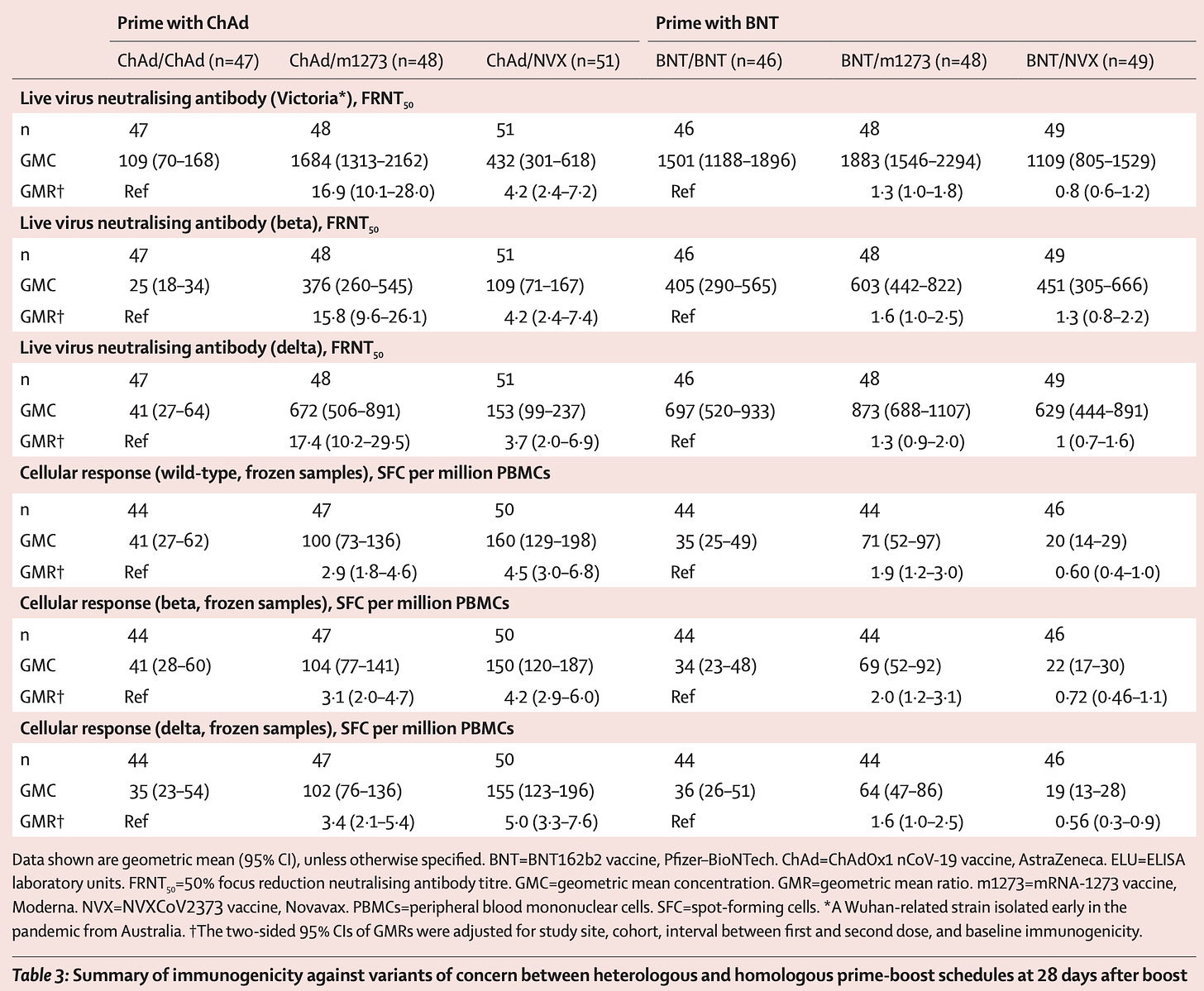
对于那些一开始就接种辉瑞疫苗的人来说,诺瓦瓦克斯在抗体反应方面没有明显优于辉瑞或莫德纳,并且在 T 细胞反应方面看起来更差一些。
在 Com-COV2 的更新中,比较了免疫反应的持久性。同样,在这里,那些接种了辉瑞疫苗的人似乎最好再接种一剂辉瑞疫苗,而那些接种牛津/亚利桑那州疫苗的第一剂疫苗的人似乎接种了诺瓦瓦克斯疫苗会更好。
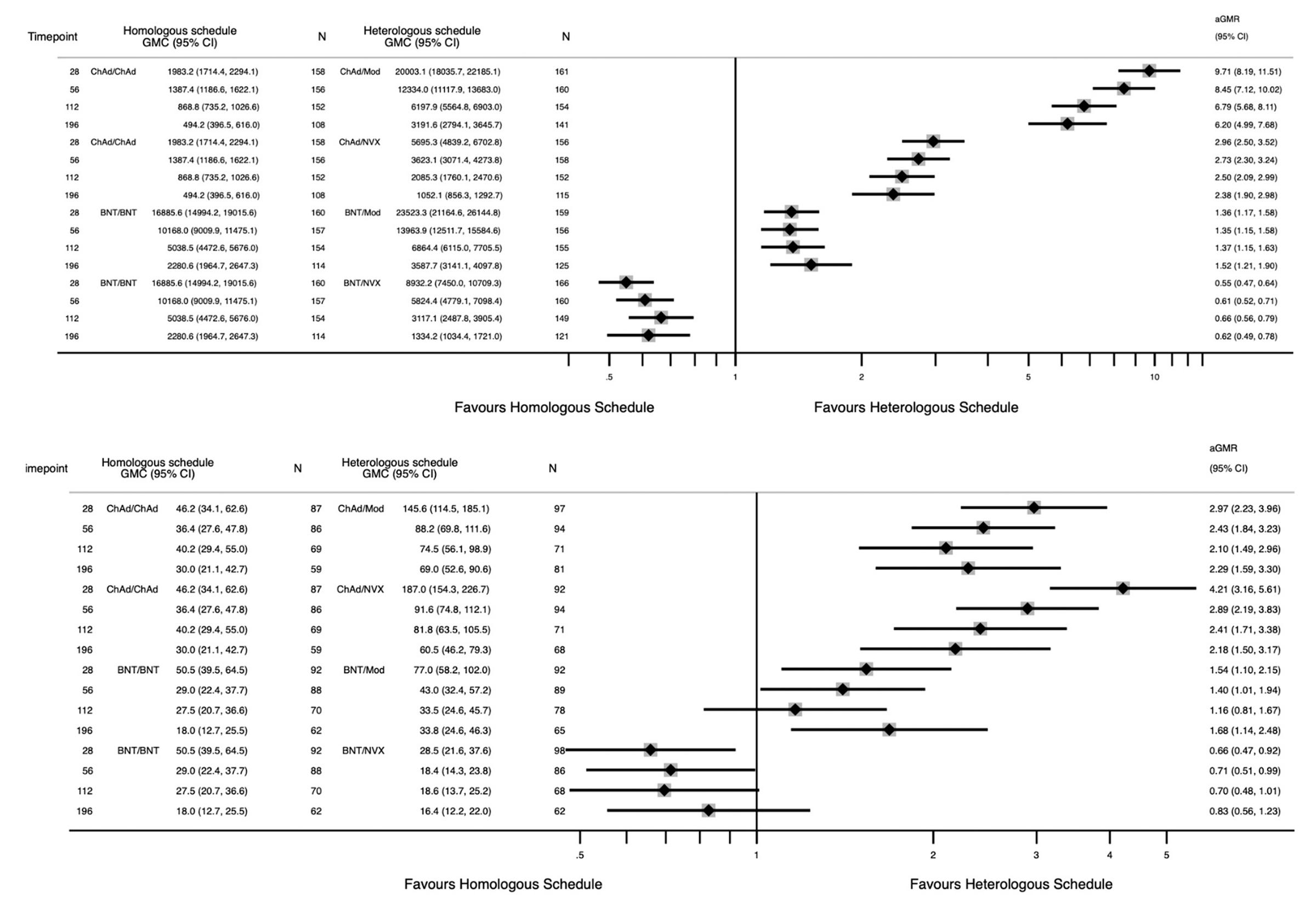
然而,如果我们观察抗体反应随时间的倍数变化,就会发现与 Pfizer/Pfizer 系列相比,Pfizer/Novavax 系列在中和抗体反应方面具有一些优势。同时,Oxford/AZ 在用作同源序列时衰减最慢。
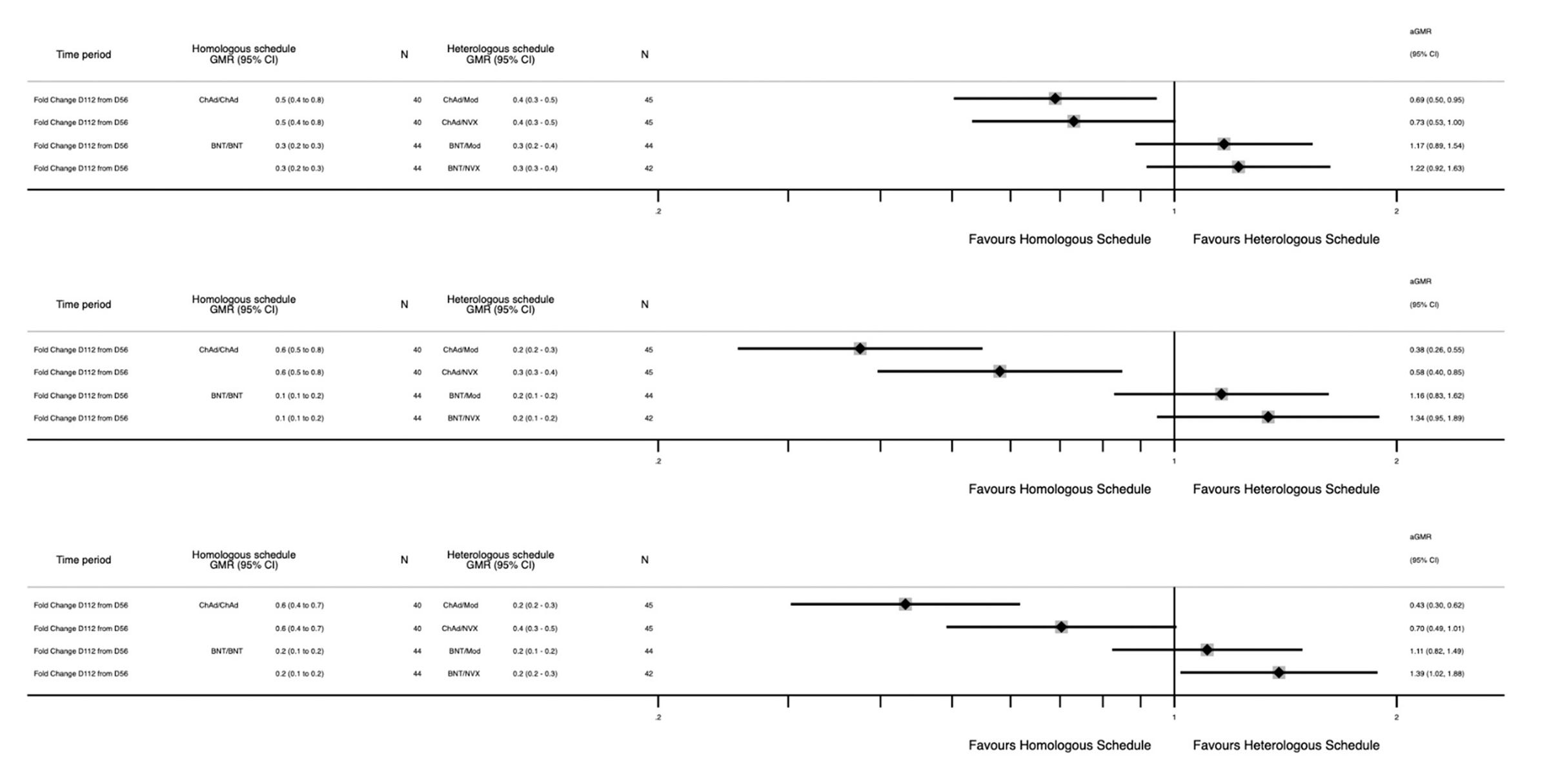
Com-COV3 着眼于使用 2 种不同剂量的辉瑞或诺瓦瓦克斯加强接种辉瑞疫苗初级系列的青少年。在抗体反应方面,Novavax 在青少年中比 Pfizer 有一点优势:

该研究还跟踪了每组患 COVID-19 的频率(A = 所有参与者,B = 以前没有感染过 COVID 的参与者,C = 以前感染过 COVID 的参与者):

总的来说,诺瓦瓦克斯确实比任何一剂辉瑞都有优势,尽管对于较高剂量来说略有优势。然而,以前感染过 COVID-19 的人和没有感染过的人的趋势不同。在以前感染过 COVID-19 的人中,mRNA 在任一剂量下的表现都更好。在那些没有的人中,Novavax 更胜一筹。应该注意的是,这些群体的规模相当小,包括血清阳性组 (C),因此应谨慎对待关于疫苗效果如何的强烈结论;就所有青少年自我报告的感染而言,Novavax 与高剂量辉瑞的调整比值比为第二剂后 132 天的 0.34 (95% CI 0.09-1.20),第二剂后 236 天的 0.65 (95% CI 0.27-1.54) 根据补充图 7。
来自南非的数据研究了 Novavax 疫苗的第三剂支持,它能够诱导针对 Omicron 的中和抗体反应,与辉瑞的第三剂相当:
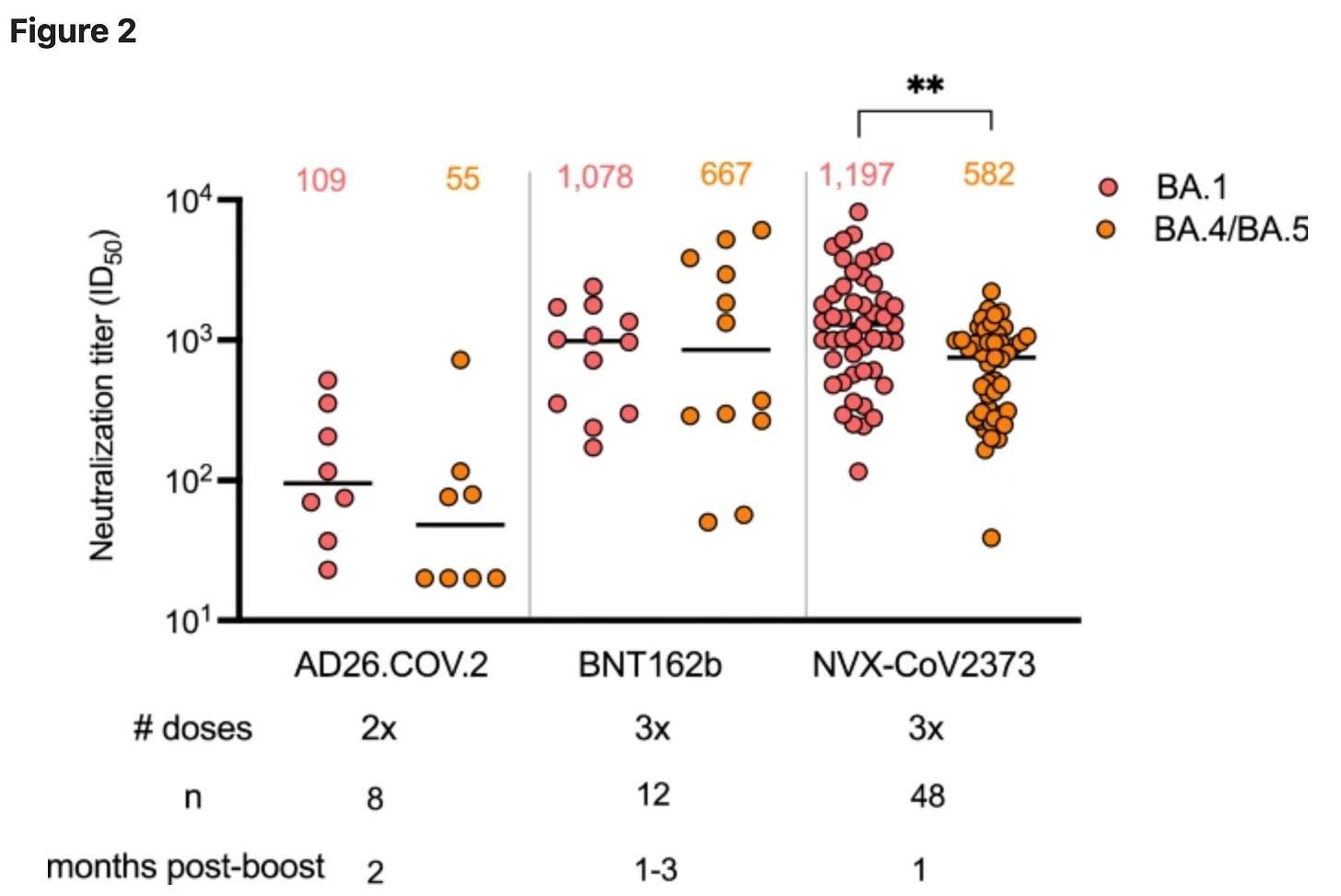
然而,应该注意的是,辉瑞疫苗抗体滴度有更多的时间减弱,并且在这项研究中,辉瑞疫苗接种者的平均年龄明显高于诺瓦瓦克斯疫苗接种者。
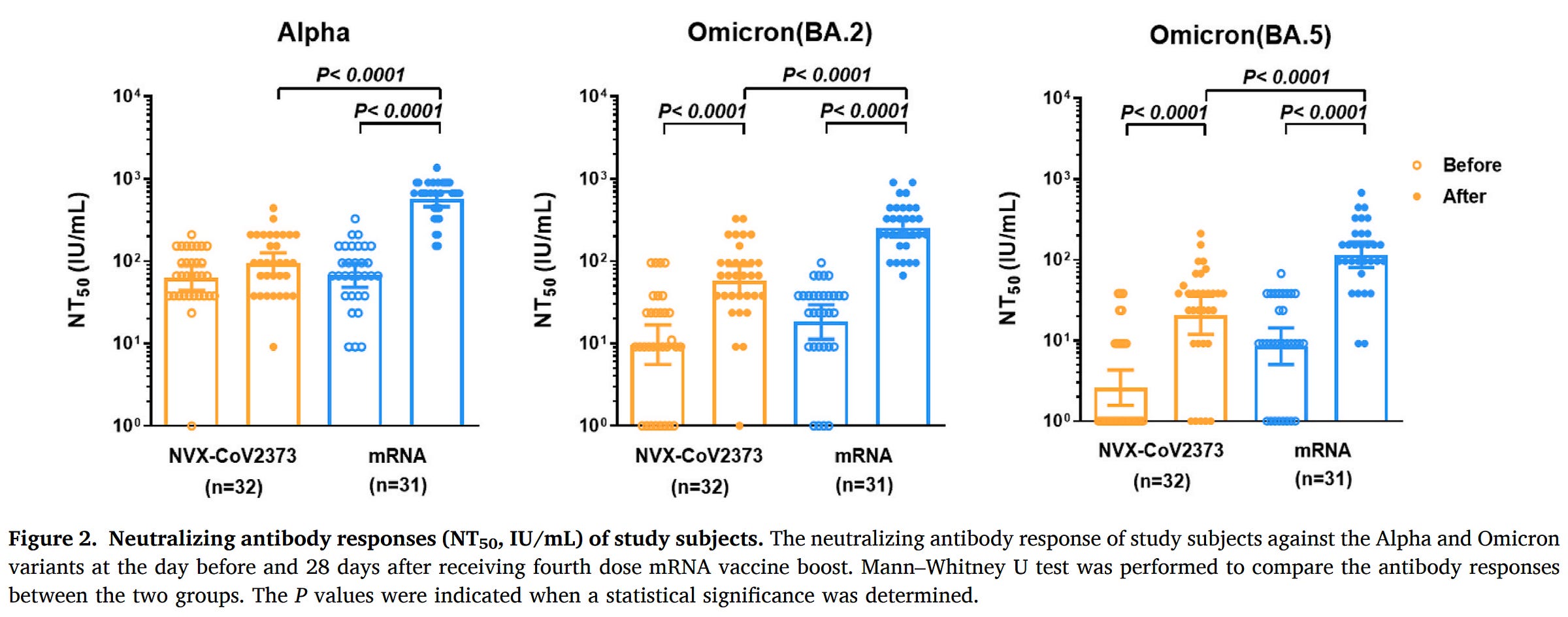
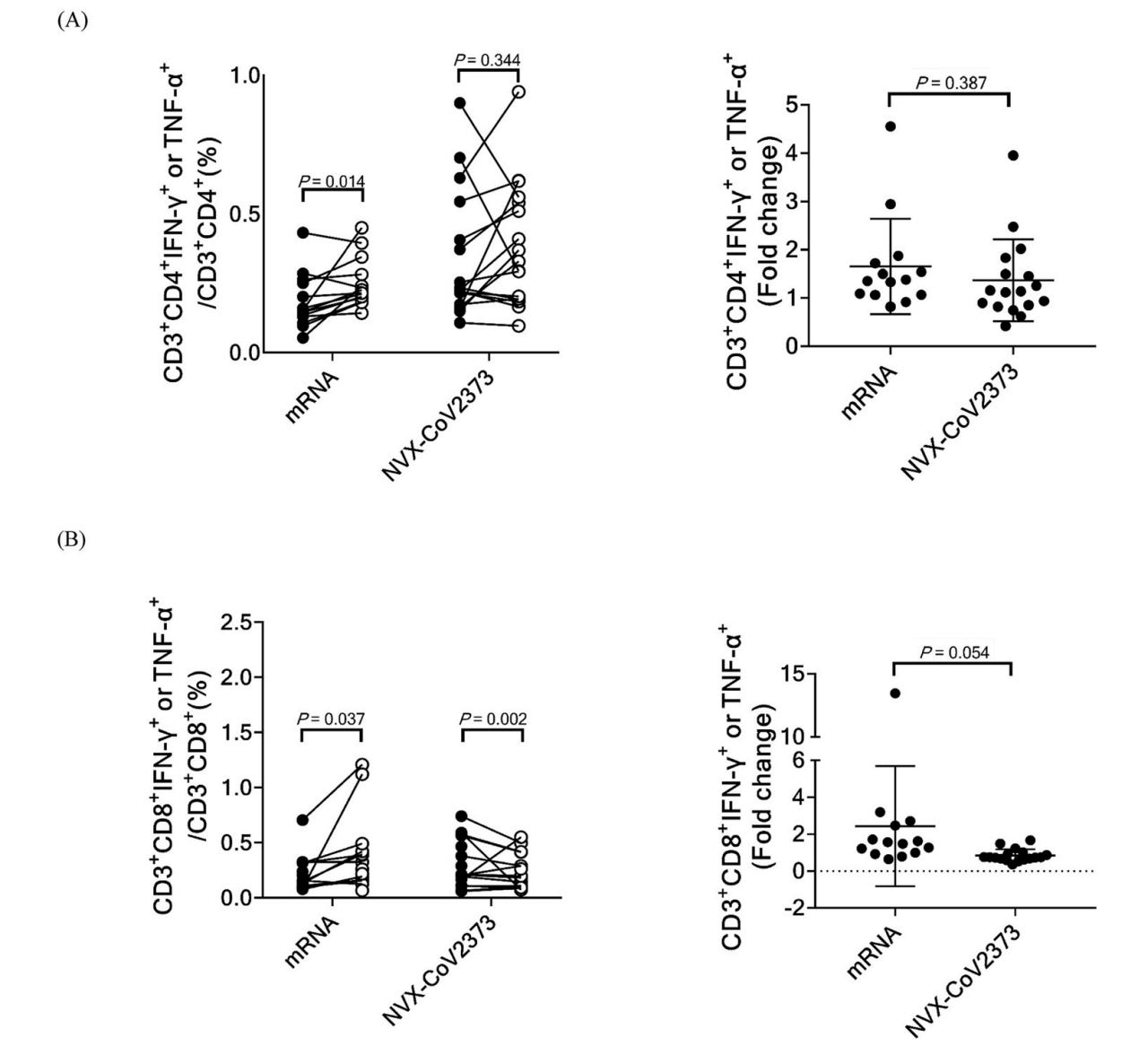
在另一项研究中,在 12 周前接受 mRNA 疫苗加强剂(第三剂)并确认既往没有 COVID-19 病史的医护人员被邀请接受 Novavax 或 mRNA 作为加强剂。101 人接受了 Novavax,59 人接受了 mRNA。在这里,不仅 Novavax 对每种变体的抗体反应都明显更差:
以及更差的 T 细胞反应:
但该研究实际上追踪了他们中有多少人继续感染 COVID-19:
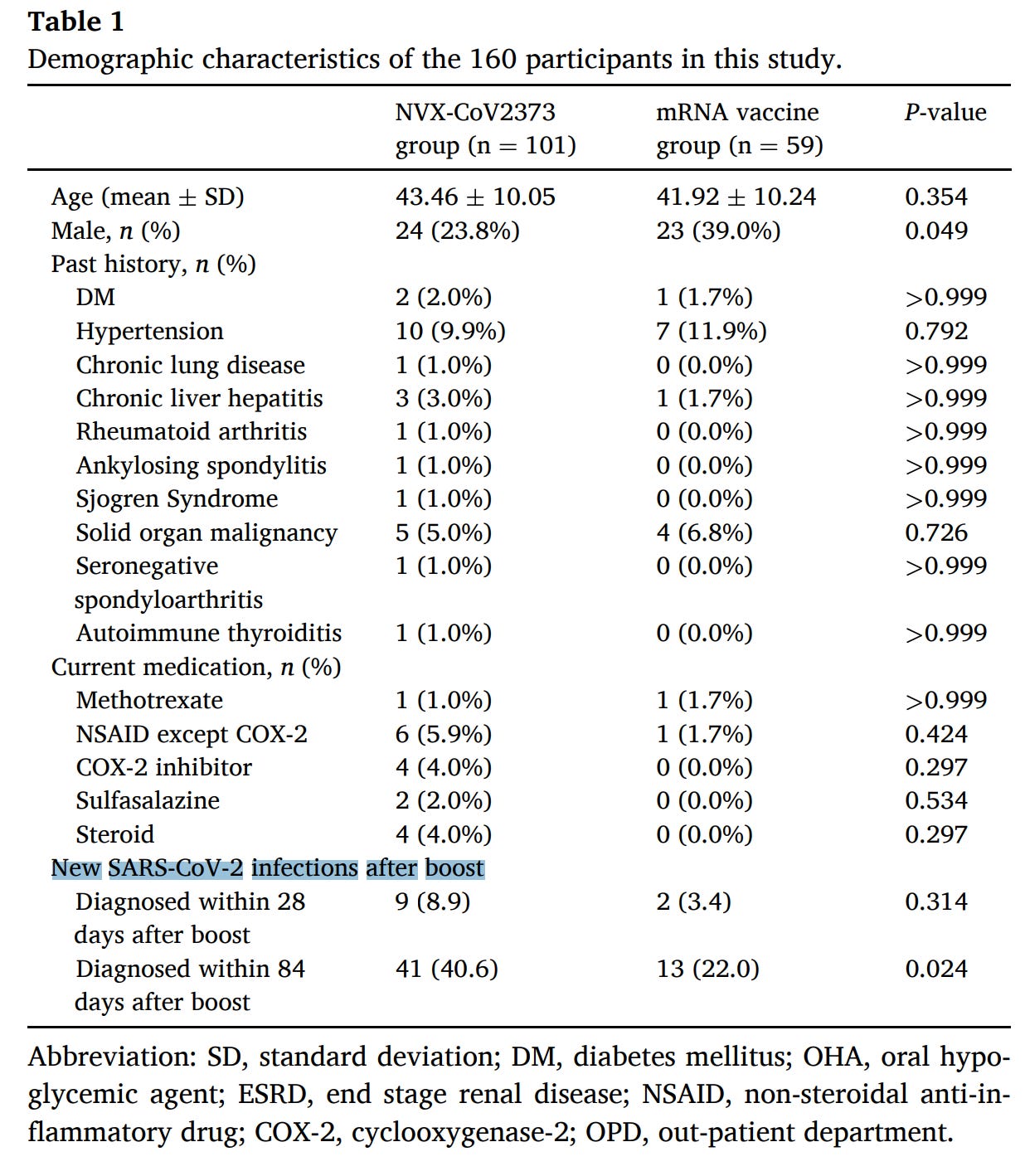
而接种 Novavax 的患者在加强后第 84 天的表现显著更高(40.6% 对 22.0%)。这里的一个关键限制是参与者不是随机的——他们能够选择他们想要接种的疫苗。诺瓦瓦克斯可能受到那些在 mRNA 疫苗反应原性方面遇到困难的人的青睐。讨论部分还指出,可能更多的 Novavax 接受者是护士,他们的暴露风险特别高,这可能会扭曲结果。尽管如此,免疫反应数据表明,Novavax 作为 mRNA 的助推器不如 mRNA,这与发病率数据一致。否则,疫苗耐受性良好。
总而言之,作为 mRNA 疫苗的加强剂,就免疫反应或保护而言,Novavax 在大多数群体中似乎并不比 mRNA 更好,但我们在这里必须利用的数据是有限的。不过,就反应原性而言,它的耐受性更好。
Nuvaxovid 的设计
Novavax COVID-19 疫苗成分的全面描述可以在其专利中找到;以下是我的总结和评论。
Nuvaxovid是由重组刺突蛋白纳米颗粒制成的,这些纳米颗粒已经经历了双脯氨酸替换的预融合稳定(就像mRNA和Johnson & Johnson/Janssen的疫苗一样,多碱基切割位点的缺失(又名furin切割位点或FCS;两种mRNA疫苗都没有这样做,但像Johnson & Johnson/Janssen的疫苗一样,被称为3Q-2P-FL刺突蛋白,并使用 Sf9 细胞中的杆状病毒载体 。Sf9 细胞是来自草地贪夜蛾 (Spodoptera frugiperda) 的昆虫细胞。

有人认为,多碱基位点的缺失是 Nuvaxovid 免疫原性的一个重要因素。 简而言之,当 SARS-CoV-2 的刺突蛋白产生时,它会进行预处理,其中宿主蛋白酶在 FCS 处切割刺突蛋白,将其分离成 S1 和 S2:
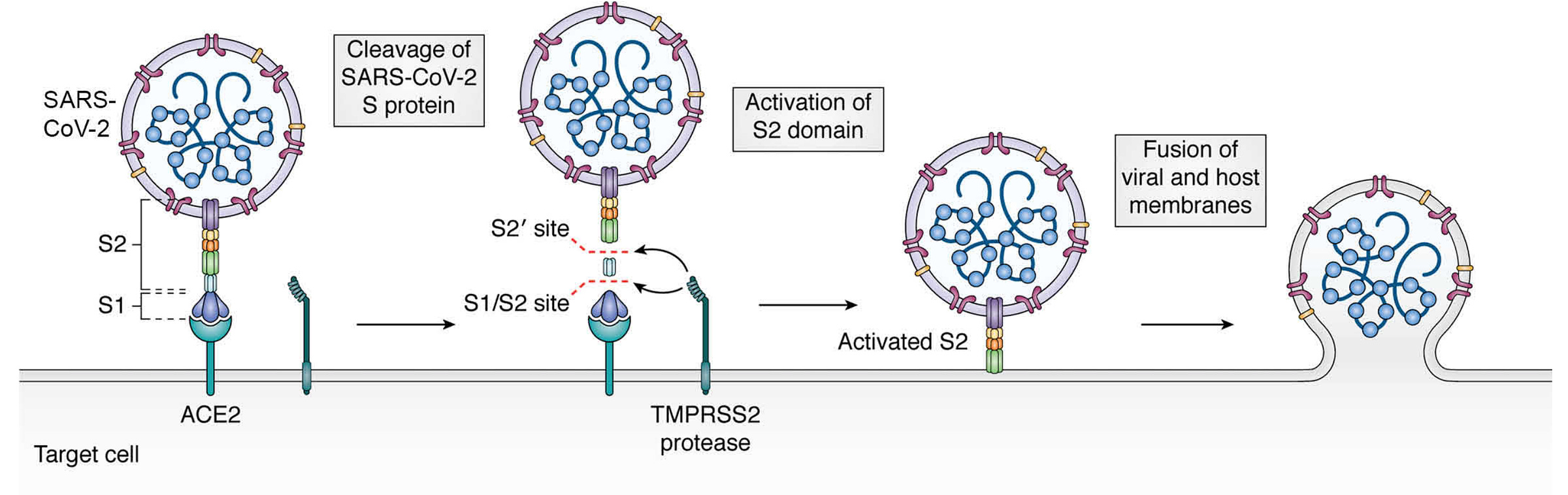
S1 包含病毒与其受体结合并进入细胞所需的受体结合结构域,因此虽然裂解听起来是个坏主意,但 S1 通过非共价相互作用保留在原位,并且在 ACE2 结合之前通常不会解离。尽管如此,S1 有时可以自发地从刺突蛋白上解离,带走了抗体的一系列重要靶标4。重要的是,这些不会完全丢失,因为 S1 仍然会被分泌并且可以成为免疫系统的目标,但这意味着 S1 的高阶显示会丢失,而 S1 可以帮助免疫反应。动物模型表明,由同时具有切割位点缺失和双脯氨酸稳定的蛋白质诱导的保护对只有其中一种的蛋白质提供了卓越的保护,但这如何适用于我们自己体内制造的蛋白质(如 mRNA 疫苗或病毒载体疫苗的情况尚不清楚);特别应该注意的是,双脯氨酸取代的主要后果也显着增强刺突蛋白的表达,这意味着即使当蛋白质剂量相同时去除切割位点有好处,这并不意味着当蛋白质由我们自己的细胞制造时,优势就很明显。我无法找到数据来检查编码 mRNA 疫苗的全长刺突蛋白的免疫原性如何根据多碱基位点的存在/不存在而变化,这很奇怪。
一旦这些刺突蛋白从 Sf9 细胞中纯化出来,它们就会使用聚山梨酯-80 胶束围绕纳米颗粒核心排列,然后用 QS-21 佐剂佐剂,QS-21 是皂树皂角(QS;皂树皮树)的提取物,用作 Novavax 专有的 Matrix-M 佐剂的一部分(每剂 Nuvaxovid 42.5 μg 组分 A,7.5 μg 组分 C)。Matrix-M 的另一部分包括磷脂和胆固醇,以降低 QS-21 皂苷的毒性,如果不以这种方式共同配制,通常会导致注射部位溶血和立即疼痛。
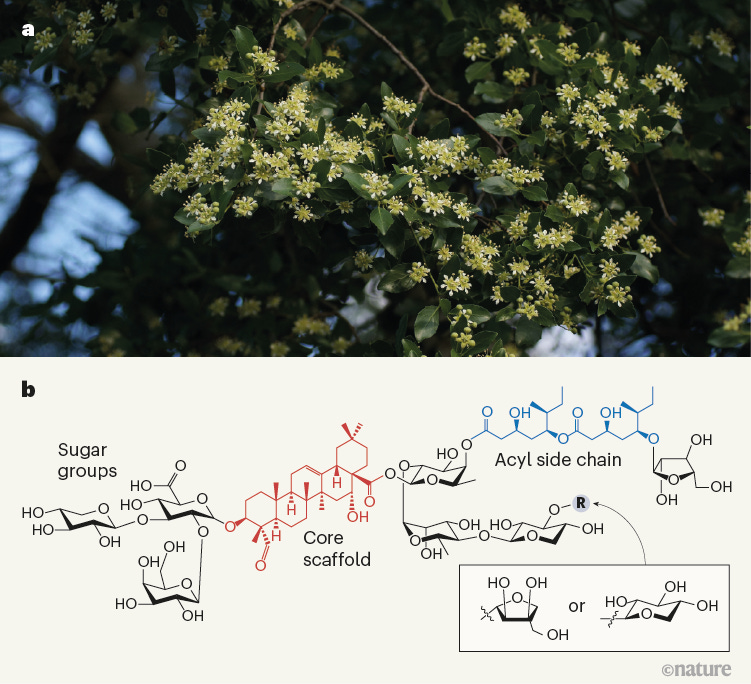
Matrix-M 是一类称为免疫刺激复合物 (ISCOM) 的佐剂的一部分,最初旨在使病毒糖蛋白更具免疫原性。最初,目标是蛋白质本身嵌入到 ISCOM 中,但蛋白质必须是疏水性才能实现的,这在大多数情况下需要修饰,这需要大量的工作。随后的工作表明,蛋白质和 ISCOM 不需要相互作用即可发挥 ISCOM 的佐剂作用,这意味着它们可以以天然形式存在。Matrix-M 似乎不直接与刺突蛋白纳米颗粒相互作用。有关 Matrix-M 如何促进免疫反应的更多详细信息,请参见 Nuvaxovid 的免疫学部分。
最终产品如下所示:
从上面显示的图像中,这种结构确实让我感到困扰的一件事是,虽然它被宣传为纳米粒子,但真正重复显示刺突蛋白三聚体在所示的疫苗样品中似乎并不常见,许多刺突显示为与胶束无关的游离三聚体。此外,即使可以看到玫瑰花结(黄色圆圈),它们的尖刺数量似乎也有很大差异(根据本文,每个胶束最多出现 14 个)。这不是一个安全问题,但是,刺突蛋白在病毒上可能发生的方向(即受体结合域朝外)紧密聚集在一起被认为对于产生纳米颗粒免疫原发生的免疫反应中的优势很重要。我觉得有点奇怪的是,Novavax 在纯化刺突蛋白后没有选择以化学方式将它们连接在一起,这样就不会发生这种情况,例如通过分选到一些支架或融合到已经自发组装成纳米颗粒(如 lumazine 合酶或铁蛋白)的蛋白质,因为这在理论上会导致更均匀和一致的纳米颗粒结构。根据 EMA 的评估报告,我也对这里的纯化过程感到有些疑惑,该产品经过 HPSEC-MALS(高效尺寸排阻色谱多角度光散射),应该能够分离以纳米颗粒形式存在的刺突蛋白,除非玫瑰花结不稳定并且胶束在分离后无法可靠地保持刺突蛋白(这让我回到了我的观点……你为什么要这样做?EMA 报告还指出,在此过程之后观察到大量的大颗粒。我还注意到,疫苗接受者的抗体滴度分布似乎比其他疫苗更广泛,这让我想知道其成分中的剂量是否一致,特别是考虑到 Novavax 的制造问题。
使用 Sf9 细胞产生刺突蛋白也被认为对 Nuvaxovid 的设计很重要。当细胞制造蛋白质时,它们的质量控制机制的一部分涉及糖(聚糖)附着到它们的特定位点,这称为糖基化。
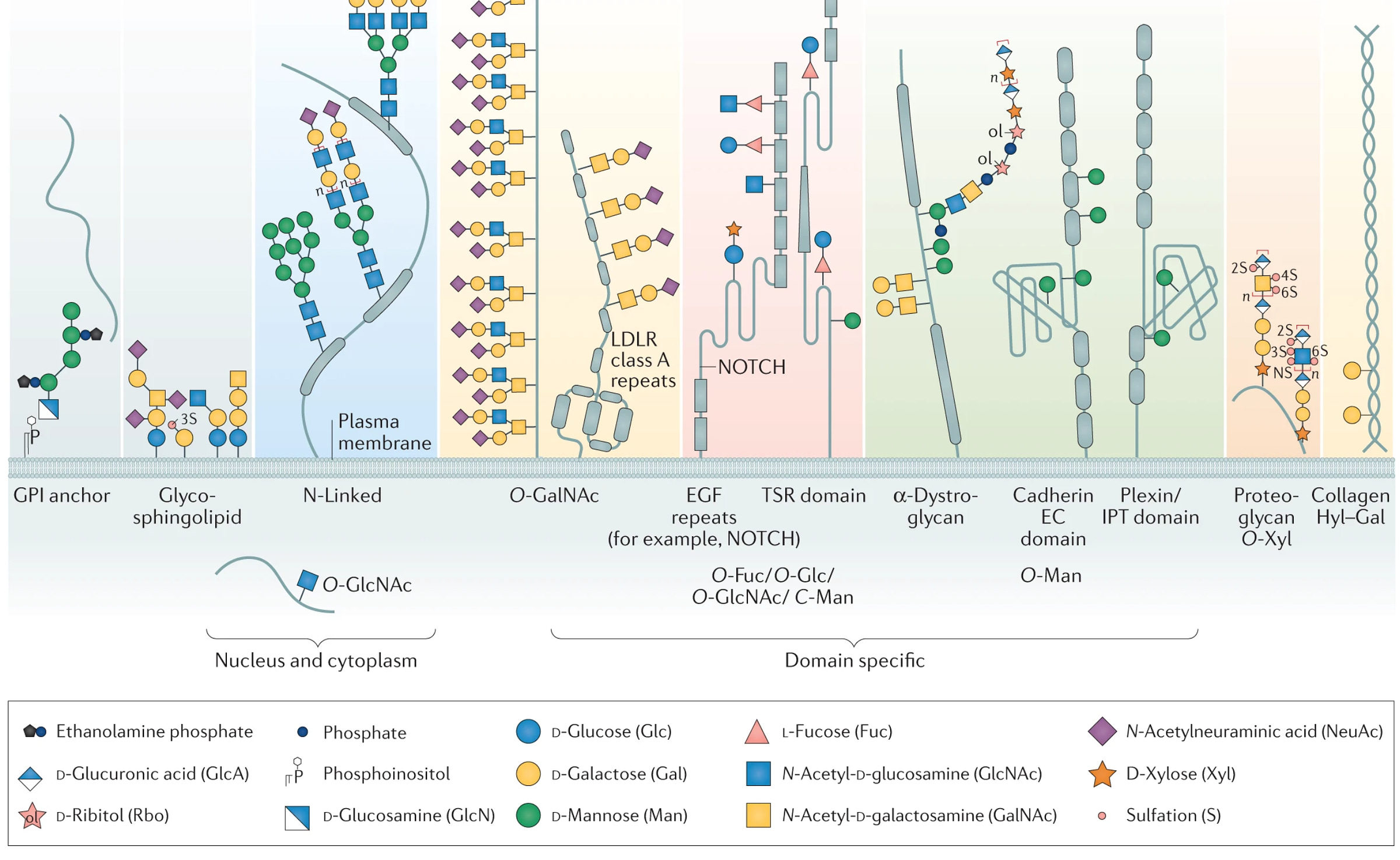
对于某些蛋白质,这种糖基化也具有关键的功能重要性。蛋白质如何糖基化是细胞的功能,因为这决定了糖基转移酶(附着或去除这些糖的酶)的表达。在免疫系统的情况下,这些聚糖可能会对免疫反应造成问题,因为免疫系统不会产生源自我们自身细胞的针对聚糖的抗体5.病毒可以利用这一点来屏蔽其蛋白质上的关键位点免受抗体的攻击(这称为聚糖屏蔽6):
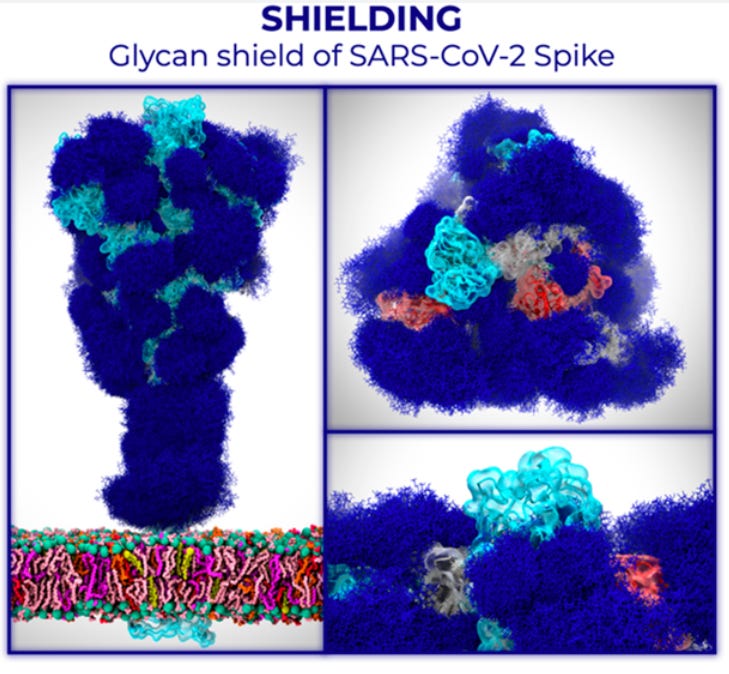
然而,昆虫细胞很有趣,因为它们产生的聚糖比人类产生的聚糖更短、更简单:
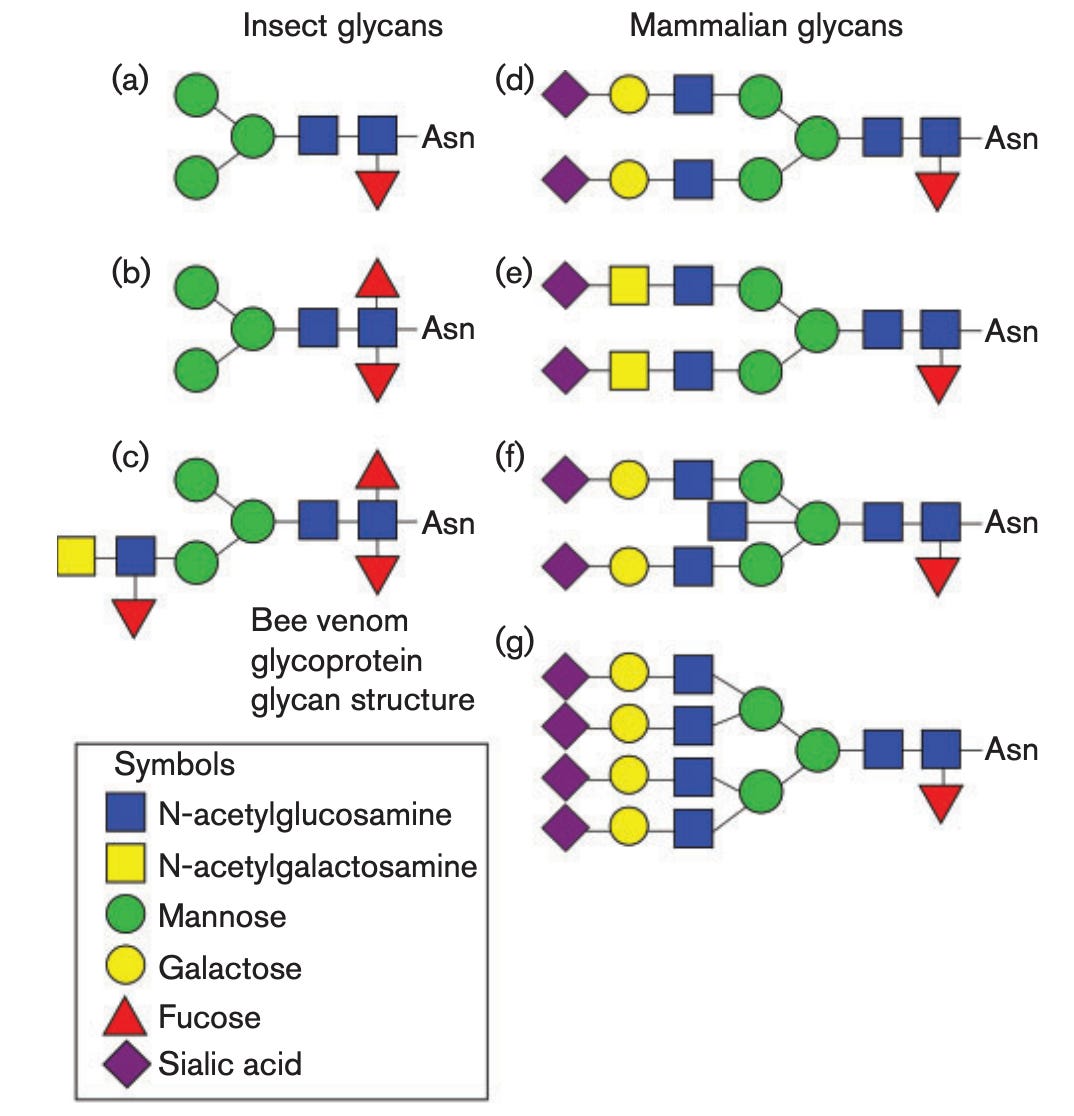
这意味着昆虫来源的聚糖使聚糖屏蔽层小得多,从而暴露出更多的蛋白质表位。一些文献表明,当糖基位点(蛋白质中与聚糖相连的部分)从刺突蛋白中去除或聚糖被酶修剪时,这会导致更广泛的抗体反应,即对变体发生的变化更具弹性的反应。因此可以想象,使用昆虫细胞制造这种刺突蛋白对免疫反应的质量有好处,尽管没有头对头的免疫原性比较,我知道查看 Sf9 产生的这种刺突蛋白与哺乳动物细胞系的效果表达7.
此外,值得称赞的是,Nuvaxovid 的储存要求比 mRNA 疫苗的储存要求简单得多(标准冷藏就足够了)。
Nuvaxovid 作用的免疫学基础
Nuvaxovid 免疫原性的独特特征主要取决于 Matrix-M 的佐剂性8,其作用是刺突蛋白修饰,如上一节所述。Matrix-M 的作用机制很复杂,但混合物的关键成分似乎是 QS-21 皂苷,尽管其他皂苷(QS-7、QS-17 和 QS-18)也可能有贡献9。尽管如此,这些并不被认为像 QS-21 那样具有有效的免疫刺激作用。QS-21 是多种佐剂的组成部分,包括 AS01、AS02、AS05 和 AS15,因此 Matrix-M 的大部分机理数据是研究 AS01 机制工作的间接结果10。尽管如此,人们认为起作用的机制应该是相似的,并且已经对 AS01 的佐剂成分(即单磷酸酯脂质 A (MPLA),一种 TLR4 激动剂与 QS-21)进行了解剖。现在有可能已经实现了 QS-21 的完全生物合成(这里和这里)11,对基于 QS-21 的佐剂进行更详细的机械分析可能是可能的,因为即使是极少量的 QS-21 的成本也是天文数字(每克 400,000 美元),部分原因是森林砍伐导致肥皂树皮树(其原生植物来源)的稀缺,再加上树产生 QS-21 的非常严格的条件。
QS-21 是一种两亲性三萜糖苷,含有 ~2:1 比例的顶糖 (QS-21A) 或木糖 (QS-21X) 部分。它在碱性条件下不稳定,但可以与磷脂和胆固醇一起掺入脂质体(基质佐剂的情况下为 40 nm),以降低其毒性/反应原性并保持其免疫增强特性;当独立于这些药物使用时,其毒性被认为禁止在人类中使用。QS-21 的免疫刺激后果是明确的,但实现它们的机制知之甚少12。这些总结 在 Novavax 的下图中:
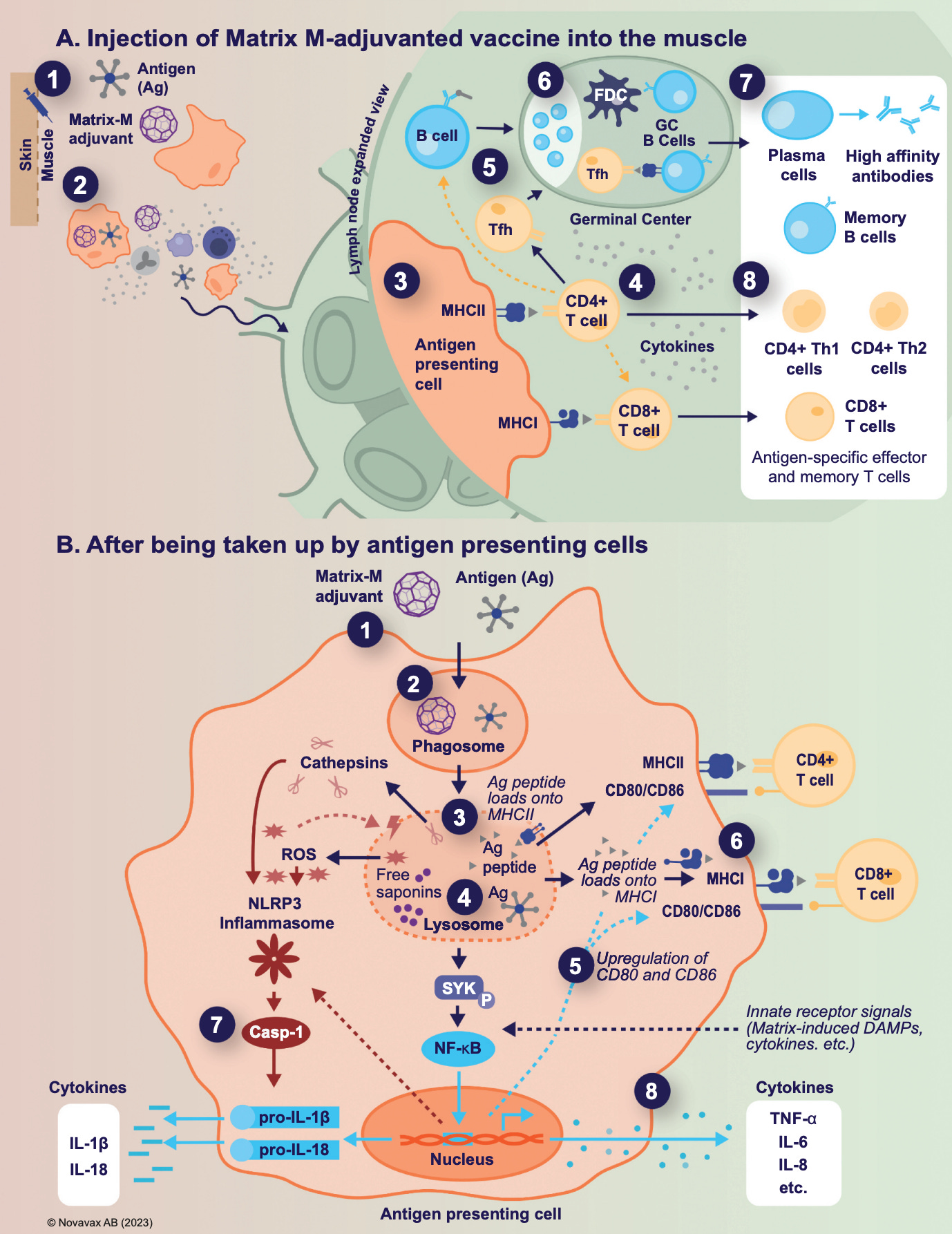
施用 Matrix-M 后,抗原呈递细胞吸收佐剂(以及抗原)并被激活。这导致它们迁移到淋巴结并产生关键细胞因子和趋化因子(干扰素-γ [IFN-γ]、白细胞介素 [IL]-1β、IL-6、肿瘤坏死因子 [TNF]-α、CXCL1、CCL2、CXCL9 和 CXCL10)。这种佐剂的主要作用之一是淋巴结细胞结构的显着(但短暂)增加,其倍数变化对于中性粒细胞最大,但也募集 B 细胞和 T 细胞,这可能导致淋巴结肿大13。QS-21 已被证明可诱导基于 Th1 的反应,并促进 TFH 细胞的诱导。除此之外,据信 QS-21 可以在抗原呈递细胞的内体中诱导孔隙,从而允许发生交叉呈递,从而诱导 CD8 T 细胞反应。尽管如此,虽然确实发生了一些诱导,但这对 Nuvaxovid 来说是适度的14.
QS-21 被认为会引起炎性小体激活,这种机制与其他几种佐剂相同,尽管有人认为这种机制对其体内佐剂并不重要。尽管如此,炎性小体激活诱导 IL-1β 的蛋白水解激活,IL-1β 通过吸收 QS-21 的细胞中的孔释放。在脂质体中配制后,QS-21 破坏溶酶体的结构,导致蛋白酶释放到胞质溶胶中,从而触发脾酪氨酸激酶 (Syk) 的激活,从而诱导 NF-κB 激活,从而触发细胞因子(如 IL-6、IL-8 和 TNF-α)的产生。由于其碳水化合物部分,QS-21 被怀疑与凝集素结合作为其佐剂作用的机制,这有助于允许抗原呈递细胞摄取15。除此之外,有人提出 QS-21 的醛可以与 T 细胞上存在的赖氨酸的 ε-氨基形成亚胺,并且在对 CD2 受体执行此作时,可以为 T 细胞提供共刺激。醛基被认为对免疫反应的 Th1 极化至关重要,因为它不会发生在缺乏醛的 QS-21 衍生物中。用 AS01 处理的人单核细胞显示 CD86 和 CD11c 的表达显著增加;AS01 展示了 HLA-DR 表达的额外增强。QS-21 还被证明与 引流淋巴结中的 CD169+ 驻留巨噬细胞共定位,其中它似乎会导致淋巴结巨噬细胞的丢失,这些巨噬细胞通常以类似于淋巴传播感染的方式捕获淋巴传播颗粒。对包膜下窦巨噬细胞的影响大于髓质巨噬细胞16.如果这些巨噬细胞在用氯膦酸盐脂质体免疫之前耗尽,则 QS-21 的佐剂作用似乎丧失,表明这些细胞是佐剂的关键介质。HMGB1 与 IL-1β 和 IL-18 一起通过炎性小体孔释放,似乎对通过 TLR4 结合诱导 T 细胞多功能很重要;然而,这引发了对 AS01 中包含 MPLA 的额外好处的疑问,根据其他数据,其辅助作用似乎并不多余。
已在非人灵长类动物中对 Nuvaxovid 进行了详细的免疫原性分析,但应谨慎使用,因为研究结果可能无法完美地转化为人类。从广义上讲,数据支持 Matrix-M 在从注射部位引流淋巴结时促进高度局部的免疫反应,接种疫苗后第 1 天和第 14 天 T 淋巴细胞的下降与淋巴结归巢受体 CCR7 的表达相吻合;血清中 NK 细胞和 B 细胞也下降,但 CCR7 的表达没有显著变化,这表明 CCL19 或 CCL21 以外的细胞因子可能促进了淋巴结归巢。在免疫接种后的 14 天内,SDF-1α(基质细胞衍生因子 1α 或 CXCL12)、IL-8 (CXCL8)、CCL11 和 CCL4 的血浆细胞因子最显着增加,支持免疫反应的高度局部性质。免疫后 2 周内血清中 CD40L 也进行性增加。此外,随着随后的疫苗接种,针对刺突蛋白的抗体反应连续多样化,最初集中在 RBD 表位上,但随后转移到 RBD 表位之外。这很可能是表位掩蔽和抗体反馈的结果。值得注意的是,猕猴的免疫显性层次结构与接受 mRNA 的人类略有不同,因为第一剂疫苗接种主要在猕猴中引发靶向 RBD 的抗体,而在接受 mRNA 疫苗的人类中,S2 表位是主要靶标。作者合理地认为,这可能反映了人类先前 β 冠状病毒感染的免疫史,并指出有必要对 Novavax 疫苗接种者人类队列进行随访。关于抗体亲和力,接种第二剂疫苗而不是第三剂疫苗时增加幅度最大。浆细胞在恒河猴的骨髓中进行性积累,随着疫苗的连续给药而增加,高峰出现在疫苗接种和之后的收缩附近;然而,尽管骨髓确实含有长寿命的浆细胞,但骨髓中的大多数浆细胞寿命并不长,这意味着,虽然这对体液免疫的持久性的评论令人鼓舞,但它并不是决定性的。IgG 也确实与血清 IgG 滴度成比例地出现在肺部,但 BAL 液中的 IgA 含量太低,无法检测到。抗体本身表现出诱导抗体依赖性细胞吞噬作用 (ADCP)、抗体依赖性中性粒细胞吞噬作用 (ADNP)、抗体依赖性补体沉积 (ADCD) 的强大能力。然而,当考虑到接种祖先和 P.1 刺突疫苗的恒河猴的 Omicron 刺突蛋白时,ADNP 显着下降,尽管其他效应器功能得以保留;其依据尚不清楚。有趣的是,很大一部分血清抗体反应似乎包括 IgM。就 T 细胞反应而言,免疫后对刺突反应的记忆 Th1 细胞存在于肺部和血液中;cTFH 细胞也存在于血液中,但在肺部无法明显检测到。记忆 Th1 细胞比例随疫苗接种时间的延长而下降,但通过加强疫苗接种后恢复。猕猴中的 CD8 T 细胞反应很小,这在人类中也可见。尽管这种详细的免疫原性分析对于了解 Nvx-CoV2373 免疫的功能后果非常有价值,但缺乏与其他 COVID-19 疫苗的平行比较限制了可解释性。
除了这项关于非人灵长类动物的工作外,还发表了一项研究,将 Novavax 疫苗作为 mRNA-1273 的异源加强剂进行了研究。与人类一样,在第二次 mRNA 给药后后期,观察到向 IgG4 的显着类别转换;奇怪的是,对于那些接受 Novavax 疫苗的猕猴,尤其是那些接受 Nvx-CoV2515(一种 BA.5 变体疫苗)的猕猴来说,IgG4 刺突抗体的比例最大。此外,该加强剂后分泌物中的 IgG 抗体略低于接受同源 mRNA-1273 的分泌物,但差异未达到统计学意义。在变体特异性中和方面,所有加强剂在猕猴中产生的滴度基本相似,尽管除了 mRNA-1273 的 BA.2.75.2 之外,所有变体都具有明显的数量优势(在这种情况下,Nvx-CoV2515 具有优势)。滴度也以类似的速度下降,与加强疫苗无关。接种疫苗 3 个月后,猕猴接受 6 × 105 个 SARS-CoV-2 BA.5 变体 PFU 的攻击,气管内途径给药 2 mL,鼻内途径给药 1 mL。所有疫苗接种方案都有效抑制了 BAL 液中病毒 RNA 的出现,尽管 mRNA-1273 同源加强组中的单个猕猴在第 2 天和第 4 天确实出现了亚基因组 RNA 的短暂出现,其水平高于接受 Nvx-CoV2373 或 Nvx-CoV2515 的猕猴。事实证明,鼻腔亚基因组病毒 RNA 更难抑制,在猕猴之间具有显著的异质性,但在接受 mRNA-1273 同源加强剂的猕猴中,病毒载量在数值上更高。从数量上讲,Novavax 增强的灵长类动物在 RNA 计数方面略有优势,但奇怪的是,这对 Nvx-CoV2373 来说是最大的。血清 BA.5 中和抗体滴度是鼻腔病毒亚基因组 RNA 的最强负预测因子。尽管如此,鉴于每组只有 6 只猕猴,关于异源疫苗接种方案对人类的相对保护的有力结论似乎没有根据,特别是考虑到前面描述的关于这个问题的人类特异性数据的存在。
制造困境
在讨论 Novavax 时,一个问题有时会被掩盖,这是一个非常重要的问题,那就是该公司遇到的重大制造问题。 这是 Novavax 延迟进入市场的主要原因。由于 RSV 疫苗在 2016 年失败,Novavax 不得不裁员 30% 的员工,并于 2019 年出售了工厂,使他们没有内部制造设施。在“曲速行动”的 16 亿美元和流行病防范创新联盟 (CEPI) 的 3.84 亿美元支持下,他们与合同制造组织 (CMO) 和发展中国家疫苗制造商网络 (DCVMN) 的成员合作。在美国,Emergent BioSolutions 带头生产疫苗,这将被证明是一个问题,因为该公司在生产牛津/阿斯利康和强生/杨森疫苗的腺病毒载体疫苗时遇到了重大问题。最终,当 Novavax 被指定用于生产其他疫苗时,该工厂在美国的生产被取代。最终,Novavax 的供应链变得极其复杂。正如 King 所写:
欧洲供应链的原料药预计将来自捷克共和国的 Bohumil 工厂(他们购买了该工厂)和西班牙的 Biofabri。预计美国供应将来自北卡罗来纳州和德克萨斯州的 CMO FujiFilm。预计亚洲供应将来自韩国的 SK Biosciences,印度的供应来自印度血清研究所,日本的供应来自武田 [24]。将原料药工艺的技术转移到如此多的不同工厂中是非常具有挑战性的,并且没有像预期的那样进行 [37]、[38]。出现了产量和原料药纯度不一致的重大问题,不同设施之间的纯度不同。这些制造问题可能导致监管授权的延迟 [38]、[39]、[40]。WHO 和 EMA EUL 于 2021 年 12 月 20 日根据印度血清研究所使用的制造过程的 CMC 数据获得。
FDA 批准的疫苗版本由印度血清研究所在印度生产,这在 FDA 历史上是第一次。在 FDA 使用韩国 SK Biosciences 生产的疫苗后不久,EMA 很快批准了它。
我观察到有些人试图表现得好像 Novavax 的制造问题只是小问题,因为他们有这么好的产品。这是一个极其天真的观点。从根本上说,如果你的疫苗只存在于理论上,如果你实际上无法制造你声称制造的疫苗,那么你的疫苗实际上就不存在。例如,诺瓦瓦克斯的德克萨斯州工厂未能生产出符合纯度标准(70%,而预期至少为 90%)的疫苗。疫苗产品的纯度至关重要,因为在细胞中制造(某些 mRNA 疫苗除外),可能会接触到来自那些对人类健康影响未确定的细胞的任意数量的外源因子。原则上,这些对于像 Novavax 这样的亚单位疫苗来说不是什么问题,但该公司 CMO 的生产能力遇到了多个障碍。基于最近的迭代延迟的上市时间,可扩展性仍然没有完全解决。最近,诺瓦瓦克斯 (Novavax) 报告称,它将与赛诺菲签订生产合同,这有望改善这种情况,因为赛诺菲在疫苗方面拥有广泛的商业成功和经验。尽管如此,他们最新的疫苗(一种基于 SARS-CoV-2 JN.1 刺突蛋白的疫苗)的批准已被推迟。Novavax 确实报告说,他们预计在 9 月 1 日的 VRBPAC 会议上做好准备,只要它是 JN.1 疫苗,事实上,在 2024 年 8 月 29 日,FDA 批准了这种疫苗。
营销恶作剧和 The Fandom
很难将 Novavax 的说法与“The Fandom”的说法区分开来,“The Fandom”即 Novavax 的坚定信徒,他们利用了这种疫苗的可用数据,并将有关它的真相延伸到远远超过临界点17.尽管如此,我认为 Novavax 有时以具有欺骗性的方式展示他们的疫苗,我认为有一个具体的例子在道德上应受到谴责。当然,他们可能真的不知道为什么他们的评论是不正确的或具有误导性的,但我不知道这是否更好,因为他们是疫苗制造商,应该拥有广泛的主题专业知识。
首先,纯粹是同人小说的东西:
- 基本上没有充分的证据表明 Novavax 的抗体反应比 mRNA 好得多。我希望我已经详细说明了上面的原因,但为了明确演示,以下是 Novavax 制作的 2023 年 6 月 VRBPAC 会议关于 2023-2024 流行季菌株选择的幻灯片:
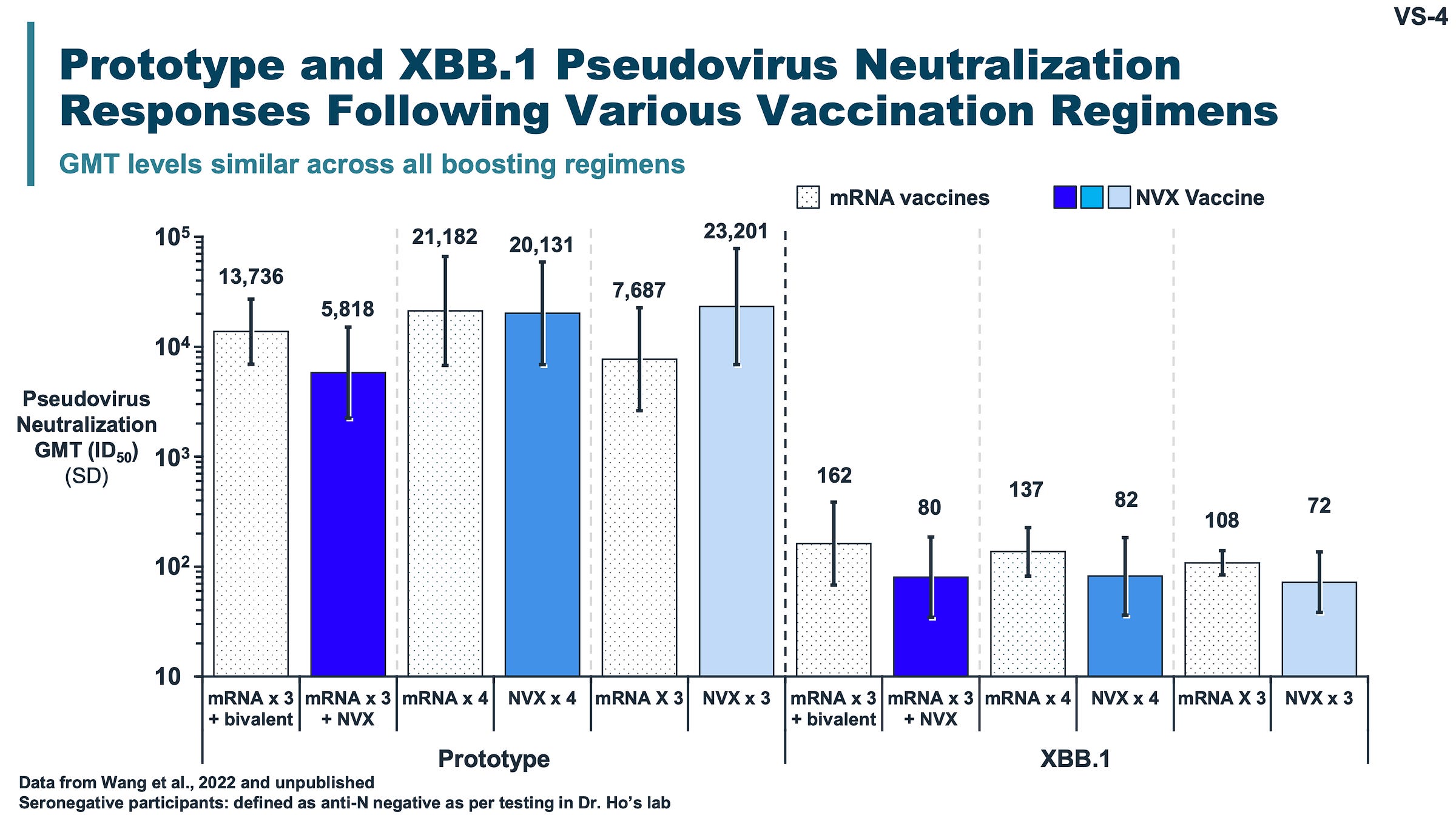
如果您发现 Novavax 的中和效果明显优于 mRNA,我建议您检查一下眼睛。当然,也许 3 个 Novavax 中祖先刺突蛋白的滴度高于 3 个 mRNA,但鉴于这个版本的刺突蛋白基本上完全不在流通,我要说无关紧要。在所有其他比较中,差异都非常小。
- 诺瓦瓦克斯疫苗的保护持久性显然并不比 mRNA 好多少。 Novavax 自己表示,它们的耐用性与 mRNA 相当(阅读:并没有明显更好)。
Novavax 的疫苗在实际世界的使用有限(同样,因为它们存在严重的制造问题),这使得评估其性能的尝试变得复杂。在疫苗学中,我们得到了保护相关性的极大帮助。保护相关性 (CoP) 是免疫反应的某些方面,可以测量,它可以预测(至少在人群水平上)疫苗所预防的疾病某些结果的保护作用。一般来说,这将是一种抗体反应,这在很大程度上是因为该领域在评估抗体反应方面拥有丰富的经验,但这并不一定意味着抗体本身负责保护。
这已经用于疫苗的功效试验,并且已经建立了与各种保护水平相对应的抗体水平(正式地,在 Plotkinian 命名法中,这被称为绝对相关,但在现场使用是草率的,人们倾向于使用“保护的相关性”,当他们的意思是“绝对相关”时)——但这里有一个问题。这些数据都是基于病毒在试验期间存在的形式,这意味着:前 Omicron、前 Delta 等。自从这些变体出现以来,SARS-CoV-2 感染身体的哪个部位以及感染的速度发生了变化(例如,Omicron 对上呼吸道的亲和力比旧变体大得多,这可能会降低疾病的严重程度,虽然没有有些人希望的那么多,但也使它变得更加困难控制传播)。这意味着您不能只测量抗体对您感兴趣的变体的反应,将值与保护分析的相关性进行插值,然后估计有效性,因为感染的基本特性在变体之间发生了变化。然而,以下是 Novavax 经常向监管机构展示其免疫原性数据的方式:

以下是最近出版物中的一个例子:
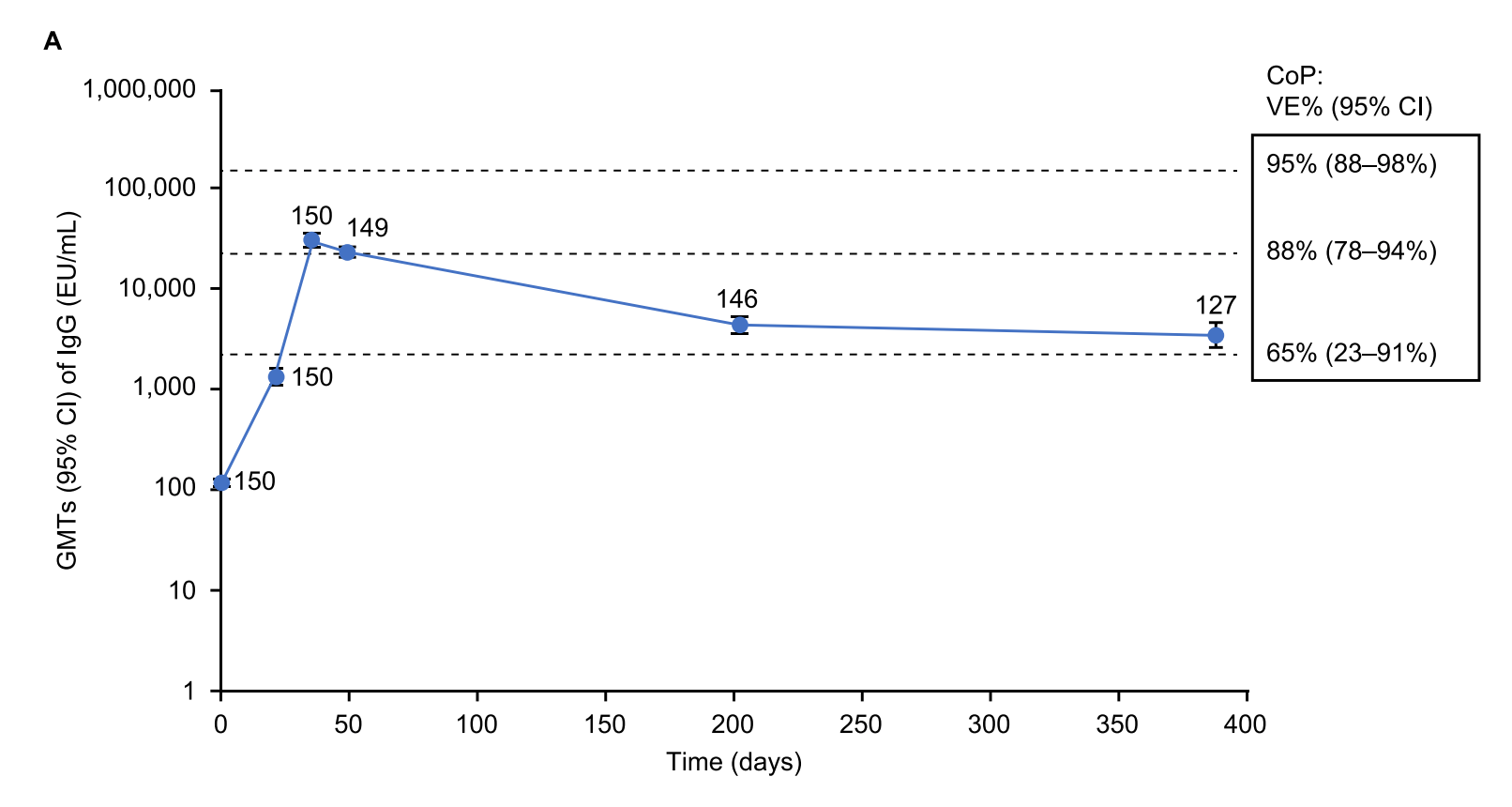
当以这种方式呈现时,Novavax 似乎试图暗示,通过他们的祖先疫苗加强剂,它诱导的免疫反应与他们在针对最近变体的初始试验中实现的保护水平大致相同,这不是一个合理的假设(这绝对是 The Fandom 逃跑和传教的解释)。我确实认为可以合理地说,在同源初级系列之后加强剂量的 Nuvaxovid 甚至显着增强了针对 BA.5 的抗体反应,预计这将大大增强保护,但以特定的疗效值(尤其是如此高的疗效值)呈现这些指标具有误导性。
同样,Novavax 在《新英格兰医学杂志》上发表了一封简短的信,展示了抗原制图数据,显示了连续接种疫苗对 SARS-CoV-2 变体抗原距离的影响:
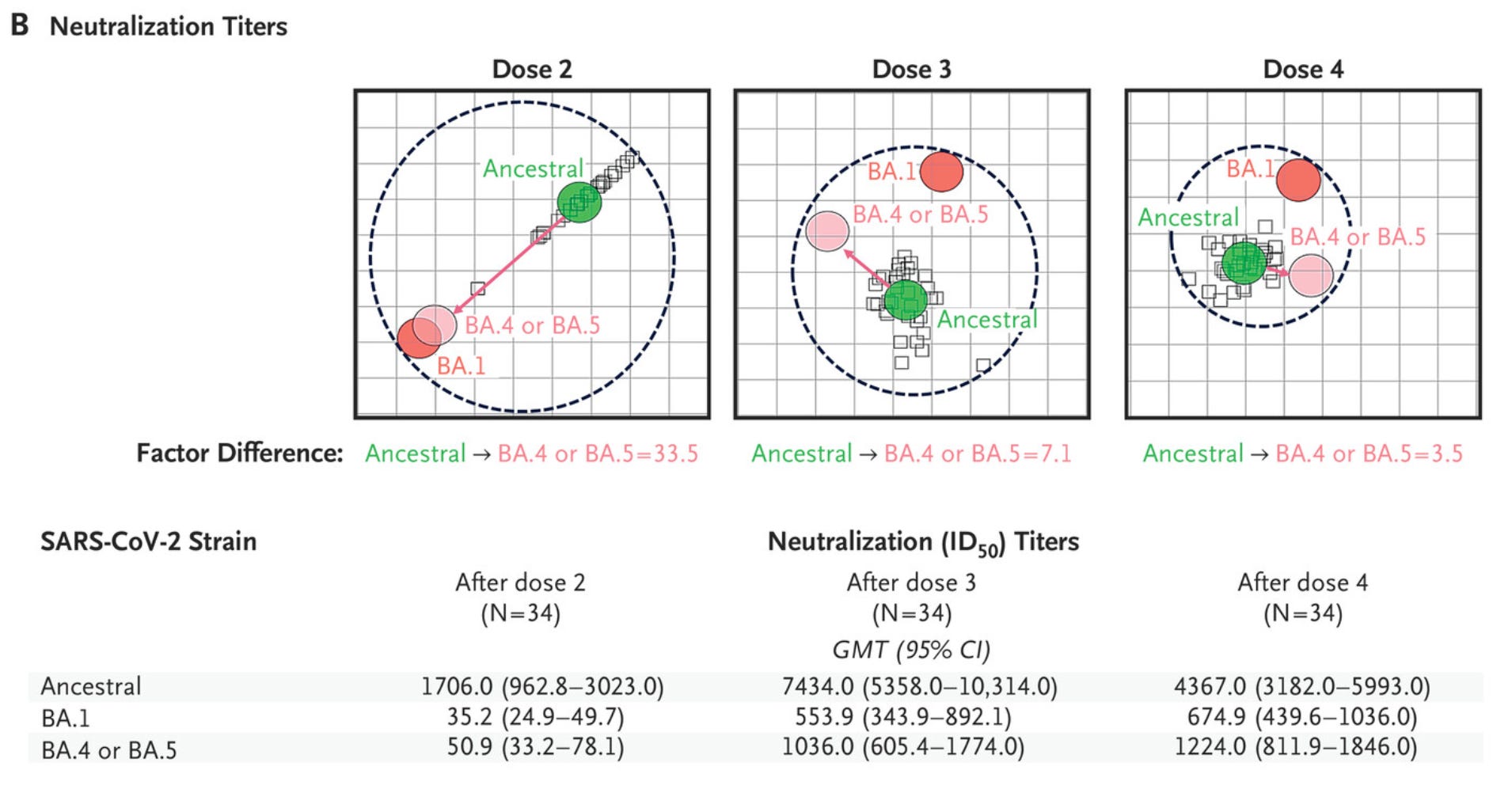
这里的基本思想是,变体在抗原图谱上越接近,它们之间的抗体滴度变化就越小。基本上,随着变异株之间的抗原距离越来越接近祖先变异株(其刺突蛋白在疫苗中使用,并进行了前面所述的细微调整),对这些变异株的抗体反应在幅度上与祖先变异株的抗体反应变得更加相似,这意味着疫苗对这些变异株提供的保护也增加了。Novavax 还在此处提供了精确的抗体滴度,这对他们来说是非常透明的。但他们讨论这些发现的方式值得一提:
这些数据表明,使用 NVX-CoV2373 疫苗加强可增强对 SARS-CoV-2 变体的交叉反应性免疫力,缩小对变体和祖先毒株的免疫识别之间的差距,并诱导针对 SARS-CoV-2 变体的潜在更普遍的反应。我们认为这种现象可能是由重组蛋白疫苗上发现的保守表位驱动的,其中 S 蛋白全长三聚体的表达呈现在变体中保守的表位,以便被免疫系统识别。 4
你看到了吗?他们只是描述了免疫印记。他们说他们的疫苗效果如此之好,是因为印记使其能够将免疫反应集中在刺突蛋白的保守部分——这正是 mRNA 疫苗因这样做而受到批评的。现在,诚然,诺瓦瓦克斯不对 mRNA 疫苗出现印记现象的热负责,尽管新出现的证据强烈表明免疫系统的这一特性远大于消极的积极性,所以我不认为他们有错。然而,有些人接受了这个数字,并逃避了 Novavax 在广度上明显优于 mRNA 的解释,而这并没有得到很好的支持。此外,采样的时间也会影响抗原制图结果 – 当您远离峰值抗体滴度时,抗原距离有增加的趋势,这里没有提供纵向抗原制图数据。这些限制未得到承认。
在最近的一封信中,Novavax 描述了 Novavax 疫苗接种者的 IgG 亚类组成。这涉及到以下发现:随着连续剂量的 mRNA 疫苗,对由 IgG4 组成的刺突蛋白的免疫反应的比例越来越大。我在这里写了大量关于这一发现的已知和未知的文章。在这部作品中,他们写道:
SARS-CoV-2 特异性 Fc 介导的反应(即 ADCP、ADCD 和 ADCC)的临床重要性与 IgG4 的结合不佳,正在迅速得到重视。4、 6、 7、 8、 10 Fcγ 依赖性效应子功能可以为病毒控制提供额外的机制,这些机制可能与中和互补,这些机制对于促进疫苗介导的对不断发展的 SARS-CoV-2 变体的交叉保护可能很重要。10 在这里,我们报道了 NVX-CoV2373 rS 蛋白疫苗似乎不会诱导 IgG4 的显着增加,即使在多次暴露后也是如此,也不会像 mRNA 疫苗那样损害 Fcγ 依赖性效应子反应。相反,NVX-CoV2373 推动了 IgG3 的成比例增加,IgG3 可能是最有效的 SARS-CoV-2 中和抗体亚类,3 并增强了替代 ADCP、ADCD 和 ADCC 活性。
这里有很多东西要解读,主要与遗漏有关。首先,该数据仅与那些在所有剂量中都接种了 Novavax COVID-19 疫苗的人相关。如果您已经接受了第一剂 mRNA,就像很大一部分公众一样,这里写的所有内容与您无关,因为类别切换到 IgG4 意味着您无法转移回 IgG1 或 IgG3 – 在制造 IgG4 的过程中,您会丢失编码这些恒定区域的 DNA 来自 B 细胞。此时获得 IgG1/3 主要反应的唯一方法是诱导新的、幼稚的 B 细胞对抗刺突蛋白。然而,这很难做到,因为免疫系统已经解决了如何通过制造 IgG4 抗体来处理刺突蛋白的问题——你需要一种对 IgG4 抗体具有非常高逃逸度的刺突蛋白,这很难做到,因为这些 IgG4 抗体具有很大的结合广度。这不是一件坏事——这意味着你有覆盖大量变体的抗体,甚至是那些尚不存在的变体。正确 – Novavax 的数据明确表明,他们的疫苗引发的抗体在他们的检测中比 mRNA 疫苗具有更强的 Fc 效应功能,并且他们特别强调了 IgG3 作为中和和这些效应器功能贡献者的重要性。外行读者可能会认为效应器功能越多越好,这是可以原谅的,但实际上并非如此。正如我在关于 IgG4 的文章中解释的那样,存在强烈通过 CD16A (FcγRIIIA) 激活的中和性差的 IgG 抗体能够预测 80% 的 COVID-19 住院风险,并且 IgG3 与 CD16A 的结合在所有亚类中具有最强的结合。IgG3 是独一无二的,因为它具有非常大的铰链区,并且是一种非常有效的补体激活剂。补体还被认为在严重 COVID-19 引起的免疫病理学中处于核心地位。确实,由于其铰链的柔韧性,IgG3 能够更好地参与二价结合,从而具有更大的中和效力(这种效果对 IgM 甚至更强,因为它最终有 10 个结合位点,因为它通常以五聚体的形式存在)。然而,IgG3(和 IgM)的半衰期比 IgG 的其他亚类短得多(除非您是具有 R435H 突变的 IgG3 同种异型的人群中的罕见部分),因为它们不能在酸性 pH 值下有效结合 FcRn(如在回收内体中遇到的那样)。IgG3 和 IgM 往往在免疫反应的早期产生,因为人们认为其强大的效应功能可以通过帮助使环境对感染充满敌意(以牺牲宿主的健康为代价)来争取时间,而亲和力成熟、类别转换的 IgG1/2/4 和 IgA1/2 正在产生以控制感染。制造这些其他亚类中的任何一个都需要丢失定义 IgG3 抗体特性的 G3 恒定区 DNA。据推测,大多数人群缺乏这种同种异体型 IgG3 的原因是,非常有效的效应功能加上较长的半衰期,很容易导致炎症,而炎症对宿主的有害影响将更难控制。除此之外,诺瓦瓦克斯轻率地选择忽略 mRNA 疫苗,无论它们是否诱导 IgG4,每次加强针都始终显示出增强的保护作用和对重症的有力预防,这似乎是持久的。
然而,如果我们暂时把以上所有内容放在一边,他们在这里做的事情可以说要糟糕得多。这封信中的引文 8 是掠夺性出版商 MDPI 上对 IgG4 的评论(本质上完全是反疫苗的宣传), 作者包括 William (aka Villiam) Makis。 Makis 是来自加拿大的前加拿大核医学放射科医生,由于 2017 年因不专业行为而受到纪律处分,他的行医执照现已失效,并被宣布为无理取闹的诉讼人。然而,你可能会错误地认为他是一名肿瘤学家(需要明确的是:他不仅不是肿瘤学家,因为他没有行医执照,而且他从未作为肿瘤学家执业,也不具备执业资格),因为他不断在社交媒体上假装自己是肿瘤学家。 此外,他是 Turbo Cancer 的大力支持者,并突然去世的恶作剧。好吧,但这有什么大不了的呢?诺瓦瓦克斯是否应该了解地球上每一个反疫苗宣传者,并齐心协力避免利用他们的工作成果?我认为是的。老实说,他们中没有那么多,作为疫苗的制造商,我不认为他们不知道谁应该为损害疫苗的销售和采用负责是合理的,但即使我在这一点上给他们一个通行证,报纸上也充满了危险信号,我不敢相信 Novavax 的员工不会发现这些。这些作者均不隶属于免疫学、过敏学、风湿病学或传染病部门,尽管 IgG4 是免疫学中一个非常小众的领域。该论文立即在摘要中将总 IgG4 与刺突特异性 IgG4 混为一谈。根据 ONS 的一份精心挑选的报告,引言立即声称第三剂疫苗比第二剂造成的伤害更大。自从这篇开创性的论文于 2022 年 12 月在《科学免疫学》上发表以来,Pubmed 已经索引了数百篇关于 IgG4 的评论,其中包括一篇发表在顶级评论期刊《自然评论免疫学》上的评论,该评论由 IgG4 领域发表最多的学者之一撰写。然而,他们没有引用其中任何一个,而是有意识地选择利用他们所持有的精神作为合法的科学专业知识机构来提升工作,这些工作显然是煽动一种疫苗接种是有害的叙事,即作者直接从 旨在打击所谓的疫苗接种毒性的补充剂销售中获利。除此之外,考虑到所有其他在完全相同的地方进行的引用都提出了完全相同的观点,这个引用是否有必要?我们引用谁以及如何引用它们很重要,Novavax 决定在所有可用的文献中将这项工作提升为合法性,以试图使他们的疫苗看起来更好,这是绝对应受谴责的。
我不打算接种他们的疫苗,因为鉴于我们拥有的数据以及我的 mRNA 疫苗剂量都不难处理的事实,我还没有看到对自己有任何好处,但我特别抵制为一个如此粗心或对其行为后果如此漠不关心的组织做出贡献。
2024-2025 流行季 COVID-19 疫苗
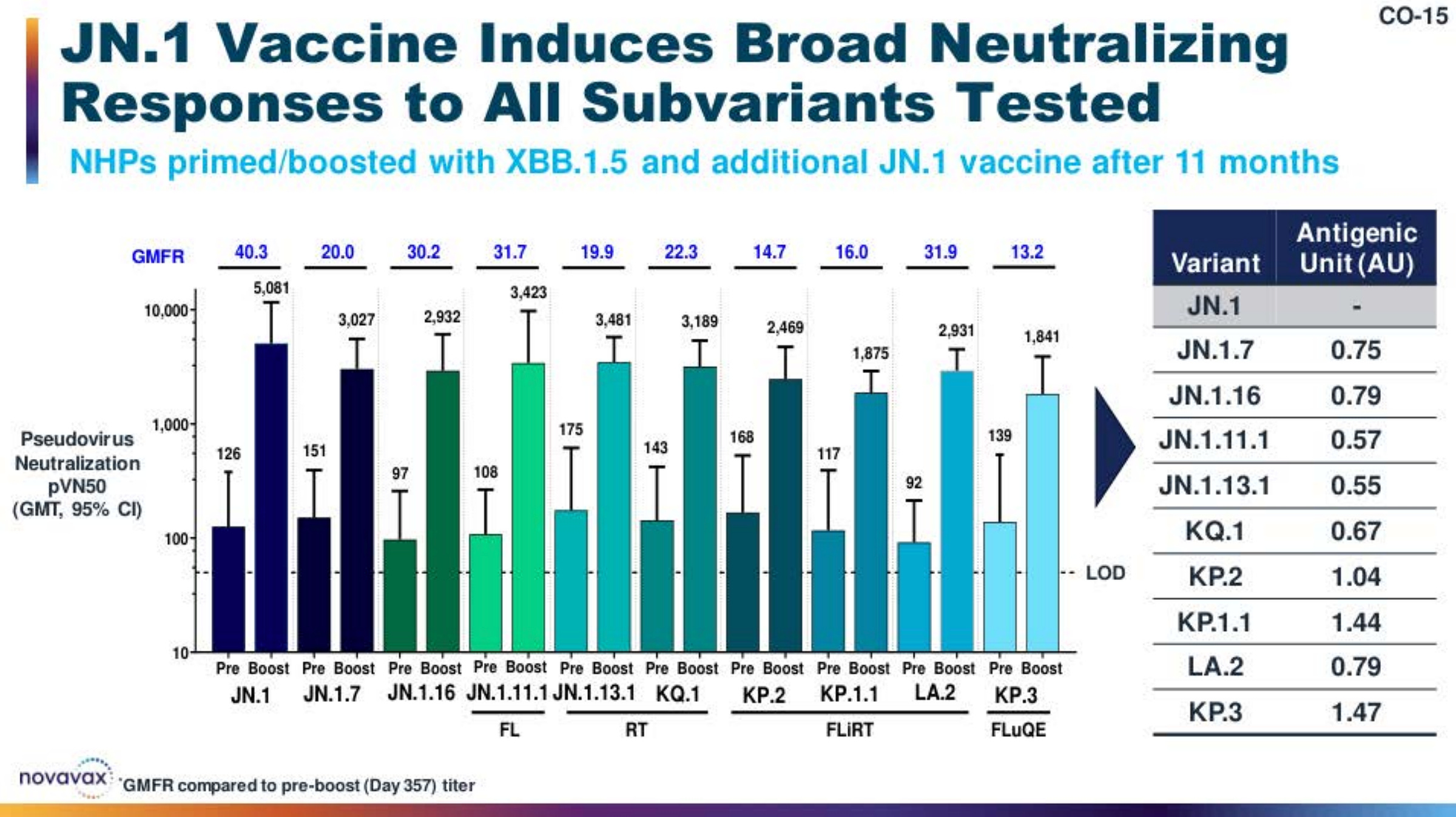
Novavax 在 2024 年 6 月 5 日的 VRBPAC 会议上展示了动物体内 JN.1 加强针的数据 。Novavax 受到他们使用的技术的更多限制 – 蛋白质疫苗的更新时间比 mRNA 长。因此,尽管 JN.1 本身现在已经被一些来源称为 FLiRT 变体的后代变体所取代,但 Novavax 无法及时制造针对这些变体之一的疫苗,以便在 2024-2025 年季节分发,但能够为 JN.1 疫苗做到这一点。基本上,Novavax 表明,当前的变体在抗原上彼此相似,并且与 JN.1 接近,后者支持使用 JN.1 靶向疫苗 (true)。特别是,一些最重要的数据来自非人类灵长类动物,这些灵长类动物接种了 2 剂 XBB.1.5 口味的疫苗,然后在 11 个月后接种了 JN.1 疫苗。这里滴度的具体值很难解释,因为它们没有基准(例如,一组接受 XBB.1.5 mRNA 疫苗,然后接受 JN.1 mRNA 的非人灵长类动物)。简而言之,这些灵长类动物的 JN.1 加强剂确实显着提高了针对当前变体(包括 FLiRT 和 FLuQE 变体)的假病毒中和抗体滴度,滴度都在同一范围内。
在接种 2 剂 XBB.1.5 系列疫苗 2 个月后接受 JN.1 加强剂的小鼠也完成了此作,结果相似:

还测量了 CD4 T 细胞反应,正如预期的那样,它们在不同的变体中是相似的:
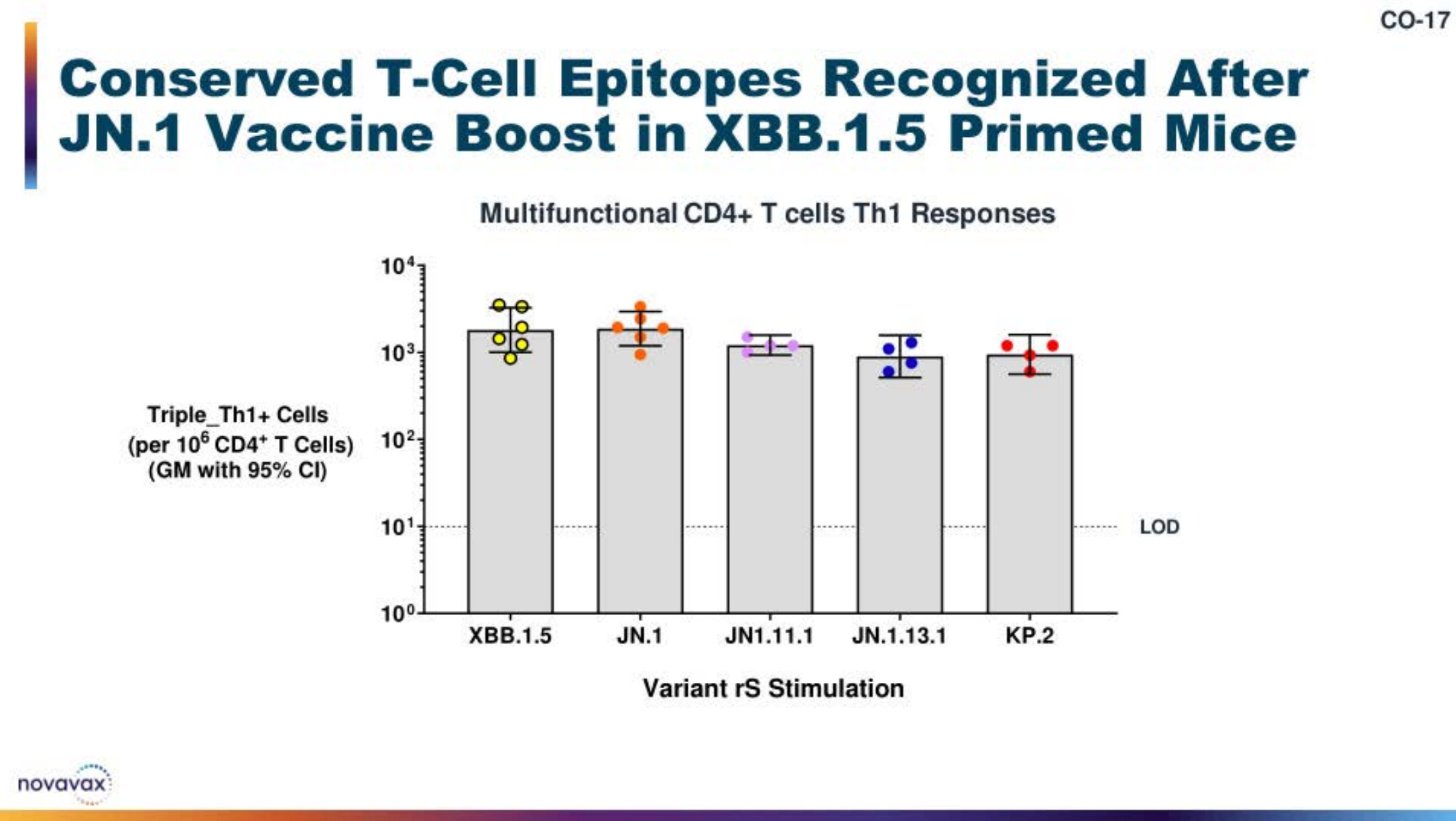
简而言之,Novavax 提供的免疫原性数据支持 JN.1 疫苗是当前季节的良好更新。
有些人试图就这是否是比 KP.2 更好的选择提起诉讼。JN.1 刺突的支持者认为,JN.1 代表了当前变体的遗传根,因此它是一个更好的选择,因为 SARS-CoV-2 将遵循的抗原漂移路径不容易预测。一些人还认为,Moderna 的 JN.1 疫苗在动物中的效果优于他们的 KP.2 疫苗对 KP.3。这一点是正确的,但值得注意的是,辉瑞的情况恰恰相反,KP.2 对 FLuQE 变体的滴度特别好。这些结果的不一致可能是因为动物具有不同的免疫历史——Moderna 接种了 2 剂 XBB.1.5 疫苗,然后接种了 JN.1 或 KP.2 疫苗。辉瑞接受了 2 剂祖先 BA.4/5 二价疫苗,然后是 XBB.1.5、JN.1 或 KP.2。随着我们自身的免疫历史变得越来越复杂,用动物对它们进行建模变得更具挑战性,但在大多数情况下,人们的第一次暴露是具有祖先刺突或刺突蛋白非常相似的变体,我们明白我们暴露的第一个刺突会影响用于对抗未来刺突抗体的选择,这些刺突与第一个具有结构特征(又名印记).正因为如此,我倾向于相信辉瑞的疫苗接种方案对大多数公众来说更相关,因为对 KP.2 与 JN.1 的免疫反应的期望飙升。此外,我个人的观点是,虽然 Novavax 认为 JN.1 和 KP.2 之间的抗原差异很小是正确的,但我更喜欢远离抗原根,因为这一直被证明会导致更广泛的抗体反应(再一次,我对我们没有包含 SARS-CoV-1 刺突的疫苗感到失望)。尽管如此,Novavax 的疫苗确实显示出对相关变体中 JN.1 峰值的中和效果相对较好,因此我认为这种考虑(KP.2 与 JN.1)并不特别突出。
数据结论和知识差距
Novavax 的 Nuvaxovid 是一种针对 COVID-19 的良好疫苗,也是一种有效的疫苗接种选择,特别是对于那些与 mRNA 疫苗的反应原性作斗争的人。没有任何强有力的证据表明 Nuvaxovid 对 COVID-19 的保护比 mRNA 疫苗更好。在抗体和 CD4 T 细胞反应方面,免疫反应似乎与 mRNA 相当,但疫苗显然失去了 CD8 T 细胞反应。这其中的确切意义尚不完全清楚。Novavax 似乎继续受到未能适当扩大生产规模的阻碍,但这些问题可能很快就会得到解决。就仍未解决或未完全回答的问题而言,我想说我们在以下方面缺乏明确性:
- Novavax 的持久性与其他 COVID-19 疫苗相比如何?
- 与其他 COVID-19 疫苗相比,Novavax 的保护质量如何?
- 与其他疫苗的安全性相比如何,特别是在考虑罕见的不良事件时?
我觉得有义务提到,我的疫苗剂量(都是辉瑞的)都没有比手臂酸痛更糟糕,所以我不认为这是作为个人服用 Novavax 的理由。然而,我的经验并不是每个人都有的,如果选择 Novavax 还是什么都没有,Novavax 显然是最好的选择。
我认为需要强调的一点非常重要:不同群体用于测量免疫反应的抗体检测存在很多差异。这些不是直接可比的,我的意思是:你不能说一个检测的较大数字意味着另一个显示较小数字的检测的响应更大,特别是如果报告的指标不同。需要标准化检测才能进行这些比较,理想情况下,每次都应该由同一个人以相同的方式进行。相同的样品可能会产生非常不同的滴度,具体取决于所使用的分析类型。
有一种观点认为,释放到循环中的游离 S1 蛋白是接种疫苗后不良事件的一个因素;简而言之,我发现这些说法没有说服力。他们基于这样一种信念,即脂质纳米颗粒从注射部位广泛分布,这没有得到证实。给大鼠注射远超过人类等效剂量的疫苗的临床前模型表明,它绝大多数保留在注射部位,尽管其中一部分最终确实进入了循环,使其能够广泛分布。可以想象,在循环中脱落的 S1 最终会广泛分布在体内,受到某些解剖屏障(如血脑屏障)的限制,但 S1 在循环中的出现是短暂的,并且起作用的浓度大约低 100,000 倍(刺突-ACE2 相互作用的 Kd 为 120 nM,剂量在 mRNA-1273 疫苗接种后在循环中发现的刺突蛋白为 1.5 pM),高于预期通过 ACE2 诱导任何种类有意义信号传导的浓度。
同样,有工作检测到在发生疫苗相关心肌炎的患者中存在未与抗体结合的全长刺突蛋白;然而,这并不能深入了解因果关系的方向(即,心肌炎是因为血液中这种刺突蛋白的存在增加,还是导致心肌炎的免疫反应导致血液中刺突蛋白的存在增加?
然而,我应该提到,来自其他物种的聚糖具有极强的免疫原性。例如,卡他菌(旧世界猴子、猿类和人类)缺乏糖蛋白 α-半乳糖基转移酶 1 (GGTA1) 的功能版本,该酶负责制造半乳糖 α-1,3-半乳糖(又名 α-gal 或 Galili 抗原)。这意味着我们所有的蛋白质都缺乏 α-gal。然而,这种酶具有功能性并广泛存在于大多数哺乳动物中。事实证明,如果你被孤星蜱或蓖麻子蜱叮咬,你最终会产生针对 α-gal 的 IgE 抗体(目前尚不清楚为什么 IgE 抗体会发展,因为免疫学的第一原理表明 α-gal 应该只能产生 IgM 抗体,尽管这假设 α-gal 本身存在,而不是附着在蛋白质上)。如果发生这种情况,结果可能是您可能会对所有红肉过敏,这被称为 α-gal 综合征 (AGS)。针对 α-gal 的抗体也会导致对其他物种器官的排斥反应,这导致了对缺乏 α-gal 的动物进行基因工程(也可以用作 AGS 人类的食物来源)。
令人惊讶的是,针对 α-gal 的抗体实际上可能具有重要的生存优势:如果蜱虫有血粉(尽管一些证据表明它甚至可能不需要将 α-gal 引入您的体内)然后继续叮咬您,蜱虫可能会充当载体,传播您从未遇到过的任何数量的新型病毒并让您生病。然而,由于这些病毒(可能)是在非卡他氏哺乳动物中制造的,因此针对 α-gal 的抗体可以迅速与它们结合并在它们有机会引起疾病之前清除它们。
这也表明,作为针对蜱传病毒的通用策略的一部分,可以诱导针对 α-gal 的抗体 (只要它们不是 IgE 同种型)。此外,其他一些微生物也使用 α-gal 作为其蛋白质的一部分,这意味着这些抗体可以具有额外的价值。
聚糖屏蔽降低导致更广泛的抗体反应的确切原因尚不清楚。确实,通过减少蛋白质的糖基化,更多的糖基化暴露出来,这意味着抗体现在可以更容易地接触到它。然而,目前尚不清楚为什么这会导致更好的抗体反应,因为当蛋白质出现在实际病毒中时,虽然任何给定位点的糖基化效率可能会发生变化,但聚糖屏蔽通常存在。
在一项使用编码带有糖位点缺失的刺突蛋白的 mRNA 疫苗的研究中,发现这导致诱导未折叠的蛋白质反应,这可能促成了促进诱导稳健抗体的佐剂效应。问题在于,这无法解释为什么当直接提供聚糖修剪的蛋白质时会出现更广泛的反应,但这也被观察到。
随着蛋白质的自然移动,聚糖屏蔽层下方的蛋白质区域可能会在短时间内接近,当已经存在针对这些区域的高亲和力抗体时,可以利用这一点。然而,如果抗体尚不存在,则暴露时间太短,无法发生结合,因此这些表位不是靶向的。如果这是真的,那么这些表位也可能没有受到强大的选择压力而发生突变(但如果与它们紧密结合的抗体出现而没有充分抑制传播,这种情况可能会改变)。
另一种可能性与聚糖的直接免疫调节作用有关。例如,siglecs 是一个蛋白质家族,可识别含有唾液酸的聚糖,并发挥免疫抑制作用。如果病毒蛋白最终被唾液酸化,这可能会阻碍对它们的免疫反应的诱导。事实上,SARS-CoV-2 刺突蛋白被证明会进化出 Siglec-9 的结合位点,并将其突变掉会大大增强抗体反应。
AS01 有两种剂型:
AS01B:gE/AS01B;葛兰素史克疫苗;1 mg 二油酰磷脂酰胆碱、250 μg 胆固醇、50 μg MPL 和 50 μg QS-21
AS01E:gE/AS01E;葛兰素史克疫苗;500 μg 二油酰磷脂酰胆碱、125 μg 胆固醇、25 μg MPL 和 25 μg QS-21
肥皂树皮树作为 QS-21 的来源是有限的,部分原因是从树中提取会破坏树皮,树木必须有 30-50 年的历史才能产生 QS-21。在所描述的方法下,YL-46 的产量低于皂树皮树的产量,但生产速度快约 1000 倍。随着菌株选择、酶的定向进化等方面的不断进步,这可能会进一步得到显著改善。
疫苗佐剂通常就是这种情况,甚至使用近一个世纪的铝盐也是如此。机制对于了解如何制造更好、更有效的疫苗很有价值,但安全记录不言自明。
根据 QS-21 能够诱导交叉呈递的拟议机制,我假设抗原与 QS-21 佐剂的物理连接可以实现更有效的交叉呈递,因此它们必然存在于同一内体中。
描述可能性的主要工作表明了对免疫学的过时理解,将 Th1 称为促炎性,而 Th2 是抗炎性的;然而,本文描述的定义结构-活性关系的实验似乎在方法上是有效的。
这很有趣,因为与单独的纳米疫苗相比,掺入抑制包膜下窦巨噬细胞作用的试剂的纳米疫苗在中和抗体滴度方面提高了 30 倍,在抗原特异性抗体方面提高了 60 倍,这表明抗原淋巴转运到卵泡中的障碍代表了产生强大免疫原性的重大障碍。
需要明确的是,我并不是指通常只喜欢 Nuvaxovid 或更喜欢它而不是其他疫苗类型的人,因为它相对于 mRNA 具有更有利的反应原性特征。我指的是那些认为和行为好像 Novavax 的疫苗在某种程度上具有魔力并且其保护作用远远优于任何其他可用于 COVID-19 的疫苗的人。
订阅 Deplatform Disease
Hits: 54