Contents
Recommendations for Prevention and Control of Influenza in Children, 2025–2026: Policy Statement
本声明更新了美国儿科学会(AAP)关于在2025-2026年流感季节使用流感疫苗和抗病毒药物预防和治疗儿童流感的建议。支持这些建议的证据综述见随附的技术报告(https://doi.org/10.1542/peds.2025-073622)。
美国儿科学会(AAP)建议,所有无医学禁忌症的儿童从6个月大开始,每年接种流感疫苗。流感疫苗接种是一项重要策略,有助于保护儿童和更广泛的社区,同时在其他病毒共同流行时,减轻呼吸道疾病的总体负担。只要是适合儿童年龄和健康状况的 licensed 流感疫苗,都可在流感季节尽早接种,无需偏好某一种产品或制剂。
对于因疑似或确诊流感而住院、患有严重或进展性疾病,或存在可能增加流感并发症风险的基础疾病的儿童,建议进行流感抗病毒治疗。在这种情况下,无论患病时长如何,都应尽快开始抗病毒治疗。在某些情况下,对于门诊中其他疑似或确诊流感的儿童,抗病毒治疗也是一种选择。
抗病毒化学预防是某些人群的一种选择,特别是那些已暴露、无症状但有流感并发症高风险且尚未接种疫苗的儿童,或那些预计无法产生有效免疫反应的人群。
引言
儿童接种流感疫苗可直接减轻自身的疾病负担,也能减轻家庭成员、密切接触者以及所有年龄段社区成员的疾病负担。7,8通过减轻呼吸道疾病的负担,流感疫苗有助于维持医疗保健能力,尤其是在其他病毒同时流行的情况下。美国儿科学会(AAP)建议≥6月龄的儿童常规接种流感疫苗以预防流感。尽管有这一建议,2024-2025年流感季的流感疫苗接种率再次下降。截至2025年4月26日,仅有49.2%的6月龄至17岁儿童接种了疫苗,比2020年底低14.5个百分点(https://www.cdc.gov/fluvaxview/interactive/general-population-coverage.html)。接种率在年龄、种族和民族、贫困状况、居住地区以及母亲免疫状况方面存在差异。9迫切需要持续努力提高流感疫苗接种率,包括采取策略减少疫苗获取和接种方面的差异,以及应对疫苗犹豫问题。
本政策声明总结了2025-2026年流感季节的最新情况和建议。随附的技术报告提供了更多细节。10
2025-2026年流感季的更新内容
儿科高危人群
5岁以下儿童,尤其是2岁以下儿童,以及患有某些基础疾病的儿童,因流感住院和出现并发症的风险更高(表2)。10尽管建议从6个月大开始,所有人都要接种流感疫苗,但应重点确保高危儿童、有医疗脆弱性的儿童、病情复杂的儿童,以及他们的父母/监护人、其他家庭接触者和照料者每年接种流感疫苗(表3)。此外,还需要加大努力,消除所有因流感而面临更高不良结局风险人群接种疫苗的障碍。流感所致严重结局存在种族和民族差异,一些群体的严重结局发生率更高。12在一项涵盖10个流感季的横断面研究中,黑人、西班牙裔以及美洲印第安人/阿拉斯加原住民的流感相关住院率和重症监护病房入院率更高,其中4岁及以下儿童的差异最为显著。12与白人儿童相比,黑人、西班牙裔以及亚裔/太平洋岛民儿童的流感相关住院死亡率高出3至4倍。12医疗系统可及性方面的不平等以及其他健康的社会决定因素,导致这些群体出现严重结局和死亡率上升。
表2. 流感并发症高危人群
| 类别。 | 描述。 |
|---|---|
| 人口统计学特征 | 5岁以下儿童,尤其是2岁以下儿童a |
| 早产儿或早期足月儿 | |
| 慢性护理机构或疗养院的居民 | |
| 基础疾病或治疗(含常见示例)c | |
| 慢性肺部疾病 | 哮喘21 |
| 支气管肺发育不良21 | |
| 呼吸功能受损(例如,需要机械通气、气管切开术) | |
| 心血管疾病 | 血流动力学显著异常的疾病(不含单纯高血压) |
| 肾脏疾病 | 透析 |
| 肝病 | 肝硬化22,23 |
| 血液系统疾病 | 镰状细胞病 |
| 其他血红蛋白病 | |
| 代谢紊乱 | 糖尿病 |
| 神经系统和神经发育疾病 | 脑瘫 |
| 癫痫 | |
| 中风 | |
| 智力发育障碍 | |
| 中度至重度发育迟缓 | |
| 神经肌肉疾病,包括肌营养不良症 | |
| 脊髓损伤 | |
| 极度肥胖 | 成人BMI≥40;儿童BMI≥第95百分位d |
| 免疫抑制 | 接受免疫抑制药物治疗 |
| 接受造血细胞移植或实体器官移植 | |
| 先天性或获得性免疫缺陷,包括艾滋病病毒 | |
| 阿斯普利尼亚 | |
| 接受阿司匹林或含水杨酸盐的疗法治疗e | |
| 妊娠期及产后至多2周 | |
表3. 提高儿童流感疫苗接种率的策略
| 临床医生/护理团队。 |
|---|
|
| 诊所/医疗系统 |
|
| 社区/公共卫生 |
|
季节性流感疫苗
2025-2026赛季获准用于儿童的季节性流感疫苗详见表4。与2024-2025赛季一样,美国2025-2026赛季的所有季节性流感疫苗均为三价疫苗,包含的血凝素来自世界卫生组织(WHO)和美国食品药品监督管理局(FDA)为北半球推荐的同一流感毒株(表1)。13、14 2025-2026赛季的甲型流感(H3N2)疫苗成分已更新。甲型流感(H1N1)和乙型流感维多利亚系则保持不变。
表4.美国2025-2026年流感季儿童和青少年推荐季节性流感疫苗
| 疫苗 | 商品名称(制造商) | 年龄组。 | 每剂次每种抗原的呈现形式和血凝素抗原含量(灭活流感疫苗和三价重组流感疫苗)或病毒数量(三价减毒活流感疫苗)。 | 推荐剂量。 | 硫柳汞汞含量a(微克汞/0.5毫升剂量)。 |
|---|---|---|---|---|---|
| 三价标准剂量——基于鸡蛋的疫苗 | |||||
| IIV3 | 通量(Seqirus)b | ≥36个月 | 0.5毫升预填充注射器(15微克/0.5毫升) | 0.5 毫升 | 0 |
| IIV3 | Fluarix(葛兰素史克) | ≥6个月 | 0.5毫升预充式注射器(15微克/0.5毫升) | 0.5毫升 | 0 |
| IIV3 | 葛兰素史克(GlaxoSmithKline) | ≥6个月 | 0.5毫升预装注射器(15微克/0.5毫升) | 0.5 毫升 | 0 |
| IIV3 | Fluzone(赛诺菲巴斯德) | ≥36个月 | 5毫升多剂量小瓶c(15微克/0.5毫升) | ||
| 三价标准剂量——基于细胞培养的疫苗 | |||||
| ccIIV3 | Flucelvax( Seqirus公司) | ≥6个月 | 0.5毫升预装注射器(15微克/0.5毫升) | ||
| 重组疫苗 | |||||
| RIV3 | Flublok(赛诺菲巴斯德) | ≥9岁 | 0.5毫升预充式注射器(45微克/0.5毫升) | ||
| 减毒活疫苗-基于鸡蛋的疫苗 | |||||
| LAIV3 | FluMist(阿斯利康) | 2–49 岁 | 0.2毫升预装鼻内喷雾器(病毒剂量:106,.5–7.5 FFU/0.2毫升) | ||
缩写:IIV3,三价佐剂灭活(非活)流感疫苗;ccIIV3,三价细胞培养灭活(非活)流感疫苗;FFU,荧光灶单位;LAIV3,三价减毒活流感疫苗;RIV3,三价重组流感疫苗。
关于供应、定价、支付、账单、编码和责任问题的实施指南可在aap.org/influenza上找到。
流感疫苗建议
一般建议
美国儿科学会(AAP)建议在2025-2026年流感季为所有6个月及以上的人群接种流感疫苗。
美国儿科学会(AAP)建议使用任何适合年龄和健康状况的已获许可流感疫苗产品,不倾向于选择某一种产品,包括灭活(非活)流感疫苗(IIV)、重组流感疫苗(RIV)和减毒活流感疫苗(LAIV)。重组流感疫苗(RIV)目前已成为9岁及以上人群的一种选择。11不应为了获得特定产品(包括不含硫柳汞的产品)而推迟流感疫苗接种。含硫柳汞疫苗的安全性在技术报告的“灭活流感疫苗(IIV)和重组流感疫苗(RIV)的安全性”部分进行了讨论(https://doi.org/10.1542/peds.2025-073622)。
减毒活流感疫苗(LAIV)不应用于免疫功能低下者以及患有某些慢性疾病的人群(表5)。
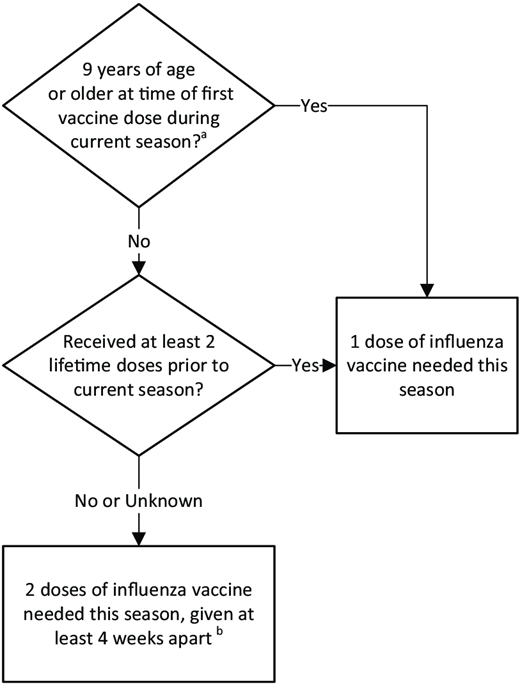
2025-2026年流感季推荐给儿童的流感疫苗接种剂次保持不变,这取决于儿童首次接种时的年龄以及流感疫苗接种史(图1)。在建议的最短间隔前4天内接种的剂次是可接受的。
如果建议儿童在特定季节接种2剂疫苗,这2剂疫苗无需是同一品牌或剂型。如果年龄和健康状况适宜,儿童可以接种灭活流感疫苗(IIV)、重组流感疫苗(RIV)和减毒活流感疫苗(LAIV)的组合。
流感疫苗一旦可用,就应给儿童接种,特别是那些建议接种2剂的儿童。为在流感季节前获得最佳保护,建议的剂次最好在10月底前接种完毕。
对于接受化疗的恶性肿瘤患儿,在临床可行的情况下,应在细胞毒性化疗前≥2周接种灭活流感疫苗(IIV)或重组流感疫苗(RIV)。
对于将要开始抗B细胞治疗(如利妥昔单抗、阿仑单抗)的儿童,应最好在开始这些治疗前至少2至4周接种灭活流感疫苗(IIV)或重组流感疫苗(RIV)。对于已接受抗B细胞治疗的儿童,灭活流感疫苗应在最后一剂治疗后推迟6个月接种,理想情况下是在有B细胞恢复的证据后再接种。
对于处于缓解期且不需要额外化疗或造血干细胞移植的患者,应在CD19靶向嵌合抗原受体(CAR)-T细胞输注后≥6个月考虑使用非活疫苗。
对于造血细胞移植(HCT)受者,可在移植后4至6个月开始接种灭活流感疫苗(IIV)或重组流感疫苗(RIV)。
尽管高剂量灭活流感疫苗(IIV)未被批准用于儿童,但临床医生可考虑为3至17岁的儿童造血干细胞移植受者接种2剂高剂量三价灭活(非活)流感疫苗(IIV3),两剂间隔28至42天。15,16
对于实体器官移植(SOT)受者,可在接受实体器官移植3个月后接种灭活流感疫苗(IIV)或重组流感疫苗(RIV),不过在流感季节,也可考虑在实体器官移植1个月及以上后接种。
免疫功能低下者的家庭接触者应每年接种流感疫苗。
表5.流感疫苗的禁忌证与慎用情况
| 疫苗 | 禁忌证 | 慎用症 | 临床医生酌情处理 | 非禁忌证或非预防措施 |
|---|---|---|---|---|
| 基于鸡蛋的灭活(非活)流感疫苗(IIV)a |
|
|
| |
| 基于细胞培养的灭活(非活)流感疫苗(ccIIV)a |
|
|
| |
| 减毒活流感疫苗(LAIV)a |
|
|
| |
| 重组血凝素疫苗(RIV3)a |
|
|
|
孕妇和哺乳期女性的额外建议
14. 与孕妇接触的儿科医生应建议接种流感疫苗,并强调接种疫苗对她们及其婴儿的益处。
15. 孕妇可在孕期任何时候接种灭活流感疫苗(IIV)或重组流感疫苗(RIV),以保护自身及婴儿。孕期未接种流感疫苗者,应在出院前接种。对于住院期间拒绝接种疫苗的人,应鼓励其与产科医生、家庭医生、助产士或其他信赖的临床医生讨论流感疫苗接种事宜。
16. 哺乳期父母接种流感疫苗可为父母和婴儿都提供保护,这是推荐且安全的做法。
旅行者的额外建议
17. 前往热带地区、乘坐游轮旅行,或在4月至9月期间前往南半球的人员,如果在前一年秋季或冬季未接种过疫苗且有疫苗可用,应考虑在出发前≥2周接种季节性流感疫苗(参见技术报告中的“流感疫苗接种时机和保护持续时间”部分[https://doi.org/10.1542/peds.2025-073622])。10
卫生保健人员的补充建议
18. 美国儿科学会(AAP)支持将医护人员接种流感疫苗作为雇佣条件,这是减少与医疗相关的流感病毒感染的关键策略。
流感疫苗的实施
19. 应努力推动所有儿童接种流感疫苗,特别是5岁以下儿童、高危人群(表2)及其密切接触者,除非存在禁忌证(表5),并采用循证策略(表3)。为在存在健康差距的社区推广流感疫苗接种,让社区成员参与制定具有文化相关性的策略至关重要。
20. 关于与家庭沟通疫苗相关事宜及提高疫苗信心的策略,可访问https://www.aap.org/vaccinecommunication。
21. 通过学校、药房、医院和其他非传统场所增加疫苗接种的可及性并减少障碍,可能会提高疫苗接种率。然而,对于幼儿来说,在家庭医疗场所接种疫苗是更理想的选择,因为这有助于提供其他必要服务,包括健康护理、预防性筛查、前瞻性指导以及其他重要的儿童疫苗接种。对于那些因资源限制而难以在家庭医疗场所接种疫苗的患者及其家庭而言,居家接种鼻内用流感减毒活疫苗(LAIV)是2至49岁部分符合条件人群的一种替代方案。关于居家接种LAIV的实际考量,详见技术报告(https://doi.org/10.1542/peds.2025-073622)。10
22. 当流感疫苗接种在非传统场所进行时,应向患者和家庭医疗服务机构提供适当的记录,并将其提交给州或地区的免疫接种信息系统(IISs)。
23. 为儿童和青少年提供服务的医疗机构可考虑为其家庭成员和密切接触者接种流感疫苗。17
流感疫苗宣传
24. 所有参与免疫接种工作的人员都应努力消除私人参保患者与通过“儿童疫苗计划”(VFC)获得接种资格者之间在流感疫苗供应方面的差异。
25. 应向符合条件的儿童及其家庭以他们偏好的语言提供有关流感疫苗和流感疫苗接种门诊的信息,特别是那些可能在预防保健方面存在障碍的儿童及其家庭。
26. 公共和私人支付方应针对儿科人群的流感疫苗供应和接种提供充足的费用支付,更新流感疫苗的支付标准,以便为儿童提供服务的医生和其他临床医生在7月和8月接种疫苗时能获得报酬,并消除仍然存在的、阻碍流感疫苗接种的“患者自负”费用壁垒。
流感疫苗的禁忌症和注意事项
流感疫苗使用的禁忌症和注意事项详见表5,技术报告中提供了更多详细信息。10要点包括:
在选择要接种的流感疫苗类型时,必须考虑特定产品的禁忌症。18
尽管对任何流感疫苗有严重过敏反应(如过敏性休克)史通常是未来接种流感疫苗的禁忌症,但接种流感疫苗后发生严重过敏反应的儿童应接受过敏专科医生的评估,以帮助确定引发反应的疫苗成分,并判断未来是否适合接种疫苗。对明胶过敏的儿童(极为罕见)应接种灭活流感疫苗(如年龄适宜,也可接种重组流感疫苗),而非减毒活流感疫苗。已有报告称明胶过敏与α-半乳糖过敏存在重叠。19
对鸡蛋过敏的儿童可以接种任何流感疫苗,除了所有疫苗都建议采取的预防措施外,无需额外的预防措施。
患有急性中度或重度疾病的儿童,在急性疾病好转后应尽快接种流感疫苗;应采取策略确保他们康复后及时接种(例如,安排复诊、发送提醒信息;如果住院,则在出院前接种);患有轻度疾病(包括低热)的儿童仍应接种疫苗。
流感检测
流感检测建议取决于具体场景及其对临床管理的预期影响
当流感检测结果有望影响临床管理时(例如,为启动抗病毒治疗或避免抗生素治疗、进行其他诊断性检测、采取感染预防和控制措施,或与其他具有相似症状的呼吸道病毒区分开来的决策提供信息),应对有流感体征和症状的儿童进行流感检测。应在公共卫生部门的指导下对禽流感或其他新型毒株进行检测。20临床医生应考虑询问患者是否接触过生病或死亡的动物,特别是野鸟、家禽或奶牛,以确定是否需要进行禽流感检测。
当流感在社区内传播时,出现流感体征和症状的住院患者应接受具有高敏感性和特异性的核酸扩增检测(例如逆转录聚合酶链反应[RT-PCR])。
2岁及以上的儿童可进行家庭检测(https://www.fda.gov/medical-devices/in-vitro-diagnostics/influenza-diagnostic-tests),但关于这些检测在儿科患者中使用的数据有限。利用家庭检测结果来指导治疗决策时,应考虑检测的敏感性和特异性、社区中流感的流行情况、相应体征和症状的存在及持续时间,以及个体风险因素和合并症。
流感治疗
抗病毒药物(表6)是控制流感的重要辅助手段,但不能替代流感疫苗。抗病毒药物在儿童流感预防和治疗中的作用取决于疾病的严重程度和风险因素(表7)。技术报告[https://doi.org/10.1542/peds.2025-073622](参见“儿童流感治疗的理由”部分)总结了抗病毒药物的选择以及抗病毒治疗的潜在益处和危害。10 尽管在儿童出现症状后48小时内进行治疗能取得最佳效果,但在某些情况下,超过48小时仍应考虑进行抗病毒治疗。
照顾儿童的医生和其他临床医生应及时识别疑似感染流感的患者,在有指征时及时启动抗病毒治疗,以降低发病率和死亡率。对于门诊中流感并发症高风险人群之外的儿童,其治疗应基于临床医生与儿童父母/监护人之间的共同决策。
当社区内存在流感传播时,提供抗病毒治疗无需流感检测呈阳性。抗病毒治疗的启动应基于与流感感染相符的体征和症状、患者的风险因素以及流行病学因素(例如,社区内流感传播、已知的暴露史等)。
美国儿科学会(AAP)认为奥司他韦是甲型和乙型流感患者的首选抗病毒药物,原因在于该药物在儿童中的累积使用经验、相对成本以及给药便利性。临床医生应参考美国疾病控制与预防中心(CDC)(https://www.cdc.gov/flu/hcp/antivirals/summary-clinicians.html#cdc_generic_section_9-influenza-antiviral-resistance-considerations;其关于奥司他韦的使用建议与FDA批准的标签内容存在差异),以获取有关抗病毒药物敏感性的最新信息。
表6.2025-2026年流感季美国儿童流感抗病毒药物治疗和化学预防的推荐剂量与给药方案
| 药物 | 治疗 | 化学预防 | 常见不良事件a | ||
|---|---|---|---|---|---|
| 剂量 | 疗程 | 剂量 | 末次暴露后持续时间 | ||
| 奥司他韦b、c | |||||
| 成人 | 75毫克,每日两次,口服或经饲管给药 | 5天 | 75毫克,每日一次 | 7天 | |
| 12个月及以上儿童 | |||||
| ≤15千克 | 30毫克,每日两次,口服或通过饲管给药 | 5天 | 30毫克,每日一次 | 7天 | 头痛 |
| >15千克–23千克 | 45毫克,每日两次,口服或通过饲管给药 | 5 天 | 45毫克,每日一次 | 7天 | |
| >23千克–40千克 | 60毫克,每日两次,口服或通过饲管给药 | 5 d | 60毫克,每日一次 | 7 天 | |
| >40 千克 | 75毫克,每日两次,口服或通过饲管给药 | 5 天 | 75毫克,每日一次 | 7 天 | |
| 婴儿9-11在d | 3.5毫克/千克每次,每日两次,口服或通过饲管给药 | 5天 | 3.5毫克/千克每次,每日一次 | 7天 | 皮肤反应 腹泻(1岁以下儿童) |
| 足月儿 0–8 月龄 注:d为格式标签,此处不影响语义翻译,保留原格式标签。 | 3毫克/千克/剂量,每日两次,口服或通过饲管给药 | 5 d | 3–8个月:每次3毫克/千克,每日一次 | 7 天 | |
| 早产儿e | |||||
| <38周胎龄 | 1毫克/千克/剂量,每日两次,口服或通过饲管给药 | 5 d | 参见脚注 | ||
| 38-40周出生后胎龄 | 1.5毫克/千克/次,每日两次,口服或通过饲管给药 | 5 d | |||
| >40周胎龄 | 每次3毫克/千克,每日两次,口服或通过饲管给药 | 5 d | |||
| 扎那米韦c,f | |||||
| 成人 | 10毫克(两次5毫克吸入),每日两次 | 5 d | 10毫克(两次5毫克吸入),每日一次 | 7 天c | 头晕 |
| 儿童 | ≥7岁:10毫克(两次5毫克吸入),每日两次 | 5 d | ≥5岁:10毫克(两次5毫克吸入),每日一次 | 7 db | |
| 帕拉米韦g | |||||
| 成人 | 一次600毫克剂量,通过静脉输注给药,时间为15-30分钟 | 不适用 | 不推荐 | 皮肤反应 | |
| 儿童6 mos-12和 | 一次12毫克/千克剂量(最大600毫克),通过静脉输注,时间为15-30分钟 | 不适用 | 不推荐 | ||
| 13–17岁 | 一次600毫克剂量,通过静脉输注,时长15-30分钟 | 不适用 | 不推荐 | ||
| 巴洛沙韦h | |||||
| 5岁及以上个体 | |||||
| <20千克 | 一次2毫克/千克剂量,口服或通过饲管给药 | 不适用 | 2毫克/千克,单剂量,口服 | 不适用 | 临床试验中报告的不良事件,包括恶心、呕吐和腹泻,与安慰剂相似 |
| 20千克–<80千克 | 一次40毫克剂量,口服或通过饲管给药 | 不适用 | 一剂40毫克 | 不适用 | |
| ≥80 千克 | 一剂80毫克,口服或通过饲管给药 | 不适用 | 一次80毫克剂量,口服 | 不适用 | |
肾功能不全患者应根据肌酐清除率调整剂量。奥司他韦的肾脏给药剂量在儿科患者的药品说明书中未载明。不过,对于体重超过40千克、符合成人剂量标准的儿童,药品说明书中的用法可能适用。对于肌酐清除率为10–30毫升/分钟的患者,治疗方案为:75毫克,每日一次,连续5天。对于肌酐清除率为10–30毫升/分钟的患者,化学预防方案为:接触后30毫克,每日一次,连续10天;或75毫克,隔日一次,接触后连续10天(共5剂)。
e适用于可能有雷氏综合征高风险的19岁以下儿童和青少年。 Grohskopf LA、Ferdinands JM、Blanton LH、Broder KR、Loehr J。《使用疫苗预防和控制季节性流感:美国免疫实践咨询委员会的建议——2024-25年流感季》。MMWR 建议报告。2024;73(RR-5):1-25。 表3.提高儿童流感疫苗接种率的策略
早产儿的奥司他韦剂量。早产儿基于体重的剂量建议低于足月儿。28–30 由于肾功能不成熟,早产儿的奥司他韦清除率可能较低,足月儿推荐的剂量可能会导致该年龄段婴儿体内药物浓度过高。美国国家过敏和传染病研究所抗病毒合作研究小组的有限数据为根据早产儿的月经后年龄(PMA)(胎龄+实足年龄)确定剂量提供了依据。对于极早产儿(<28周),请咨询儿科传染病医师。由于早产儿使用暴露后预防(PEP)的数据有限,一般不建议对早产儿使用PEP,除非临床医生判断为控制疫情爆发而必须使用。在这种情况下,最佳剂量尚未确定。
来源:IDSA26和https://www.cdc.gov/flu/hcp/antivirals/summary-clinicians.html?CDC_AAref_Val=https://www.cdc.gov/flu/professionals/antivirals/summary-clinicians.htm。
表7.抗病毒治疗和化学预防建议总结
| 适用人群 | 谁会接受抗病毒药物治疗 | 出现症状或暴露后的时间 | 用药方案 |
|---|---|---|---|
| 住院儿童 | 有症状且已知或疑似感染的儿童a | 开始治疗没有时间限制,但理想情况下应在症状出现后尽快开始治疗。 | 推荐治疗方案 |
| 重症儿童 | 有症状且已知或疑似感染的儿童a | 开始无时间限制 | 推荐治疗 |
| 患有复杂疾病的儿童 | 有症状且已知或疑似感染的儿童a | 开始无时间限制 | 推荐治疗 |
| 患有进行性疾病的儿童 | 有症状且已知或疑似感染的儿童a | 开始无时间限制 | 推荐治疗 |
| 并发症风险较高的儿童(5岁以下或有基础疾病[表2]) | 有症状且已知或疑似感染的儿童a | 开始无时间限制 | 推荐治疗 |
| 有高风险家庭接触者的儿童 | 有症状且已知或疑似感染的儿童a | 开始无时间限制 | 考虑治疗 |
| 有6个月以下家庭接触者的儿童 | 有症状且已知或疑似感染的儿童a | 开始无时间限制 | 考虑治疗 |
| 其他有流感样症状的儿童 | 有症状且已知或疑似感染的儿童a | 症状出现后的48小时内 | 考虑治疗 |
| 未接种疫苗或未完全接种疫苗且有高并发症风险的儿童 | 已知或疑似接触的无症状儿童 | 暴露后48小时内 | 考虑化学预防 |
| 接种过疫苗但可能未产生免疫反应、且出现并发症风险较高的儿童 | 已知或疑似接触的无症状儿童 | 暴露后48小时内 | 考虑化学预防 |
| 当疫苗株与流行株不匹配或对流行株无效时,接种疫苗的儿童出现并发症的风险较高 | 已知或疑似接触的无症状儿童 | 暴露后48小时内 | 考虑化学预防 |
| 有家庭成员或密切接触者属于流感并发症高风险人群且无法通过其他方式有效预防流感的未接种疫苗儿童 | 已知或疑似接触的无症状儿童 | 暴露后48小时内 | 考虑化学预防 |
| 未接种疫苗的家庭成员,以及存在高并发症风险的未接种疫苗儿童或24个月以下未接种疫苗儿童的密切接触者 | 已知或疑似暴露的无症状密切接触者 | 暴露后48小时内 | 考虑化学预防 |
| 当疫苗株与流行株不匹配或对流行株无效时,易出现并发症的高危儿童的家庭成员及密切接触者 | 已知或疑似暴露的无症状密切接触者 | 暴露后48小时内 | 考虑化学预防 |
特定人群的治疗和化学预防建议
4. 应尽早为以下人群提供抗病毒治疗,无论其流感疫苗接种状态和症状持续时间如何1:
任何因疑似或确诊流感而住院的儿童。
任何患有严重、复杂或进行性流感疾病的儿童,无论其医疗环境如何(即住院或门诊)。
任何疑似或确诊流感且病情轻重不一的儿童,若年龄小于5岁,或属于流感并发症的其他高危人群,无论其所处的医疗环境如何(即住院或门诊)(表2)。
任何疑似或确诊流感且无流感并发症高风险的儿童,若能在发病后48小时内开始治疗。
任何疑似或确诊流感的儿童,其兄弟姐妹或家庭接触者年龄小于6个月,或属于流感并发症高风险人群(表2)。
5. 门诊环境中,以下人群可选择接受治疗:
流感化学预防建议
化学预防不能替代疫苗接种,在一些高危人群中,接种灭活流感疫苗(IIV)或重组流感疫苗(RIV)与抗病毒化学预防均可作为一种选择。
美国儿科学会(AAP)认为奥司他韦是甲型和/或乙型流感暴露后化学预防的首选药物。
暴露后化学预防仅应在暴露后48小时内能够启动抗病毒药物时使用。
暴露后化学预防不应在机构暴发之外用于常规或广泛的预防。对于处于封闭机构环境中、有流感并发症高风险的儿童(如长期护理机构)中的未接种疫苗的工作人员和未接种疫苗的儿童,建议采用暴露后化学预防来控制流感暴发。
在以下情况下,已知或疑似接触流感的儿童可考虑进行暴露后化学预防:
任何有流感并发症高风险的儿童,若:
○ 他们无法接种流感疫苗。
○ 本季尚未接种流感疫苗。
○ 他们在过去2周内接种过流感疫苗,或者可能因免疫抑制而未产生足够的反应(即免疫力不佳)。
○ 社区中流行的流感病毒株与季节性流感疫苗中的病毒株匹配度不高。
任何未接种疫苗的儿童,若其家庭成员或密切接触者属于流感并发症高风险人群,且无法通过其他方式有效预防流感。
在以下情况下,对于已知或疑似感染流感的家庭成员,或流感并发症高风险儿童的密切接触者,可考虑进行暴露后化学预防:
未接种疫苗的家庭成员和密切接触者,他们可能会持续、密切地接触有流感并发症高风险的未接种疫苗儿童,或24个月以下的未接种疫苗儿童。
美国疾病控制与预防中心表示,社区中流行的流感病毒株与季节性流感疫苗中的病毒株匹配度不高。
传染病委员会,2024-2025年
肖恩·T·奥利里,医学博士、公共卫生硕士、美国儿科学会会员,主席
詹姆斯·D·坎贝尔,医学博士、理学硕士、美国儿科学会会员,副主席
Monica I. Ardura,DO,MSCS,FAAP
克里斯蒂娜·A·布莱恩特,医学博士,美国儿科学会会员,《红皮书在线》团队负责人
玛丽·T·卡塞尔塔,医学博士,美国儿科学会会员
Claudia Espinosa,医学博士,理学硕士,FAAP
小罗伯特·W·弗兰克,医学博士,美国儿科学会会员
C.玛丽·希利医学博士
钱迪·C·约翰,医学博士、理学硕士、美国儿科学会会员
亚伦·M·米尔斯通,医学博士、卫生科学硕士、美国儿科学会会员
安吉拉·L·迈尔斯,医学博士、公共卫生硕士、美国儿科学会会员
Pia Pannaraj,医学博士,公共卫生硕士,FAAP
亚当·J·拉特纳医学博士、公共卫生硕士、美国儿科学会会员,《红皮书》副主编
何塞·R·罗梅罗,医学博士,美国儿科学会会员
马修·赞恩,医学博士,FAAP
贡献者
克里斯蒂娜·布莱恩特,医学博士,FAAP
安妮卡·M·霍夫施泰特,医学博士、哲学博士、公共卫生硕士、美国儿科学会会员
政策执行合作伙伴关系
胡安·D·查帕罗,医学博士、理学硕士、美国儿科学会会员
杰里米·J·米歇尔,医学博士、卫生科学硕士、美国儿科学会会员
当然
大卫·W·金伯林医学博士、美国儿科学会会员,《红皮书》主编
丽图·班纳吉,医学博士、哲学博士、美国儿科学会会员,《红皮书》副主编
伊丽莎白·D·巴尼特医学博士、美国儿科学会会员,《红皮书》副主编
露丝·林菲尔德医学博士、美国儿科学会会员,《红皮书》副主编
-线条
阿米娜·艾哈迈德,医学博士,美国儿科学会会员,美国胸科学会
米歇尔·巴顿医学博士,加拿大儿科协会
莉萨·M·卡弗,医学博士,美国儿科学会会员,美国儿科学会执业与门诊医学委员会
德尼·J·穆尔医学博士,美国家庭医师学会
詹妮弗·L·汤普森医学博士,美国妇产科医师学会
Juan P. Torres,医学博士,拉丁美洲儿科传染病学会
小查尔斯·R·伍兹,医学博士、理学硕士、美国儿科学会会员,儿科传染病学会
工作人员
吉莉安·吉布斯,公共卫生硕士
利益冲突披露:布莱恩特博士没有披露与本声明内容相关的冲突。布莱恩特博士披露了与吉利德、辉瑞、赛诺菲和恩anta公司已完成或正在进行的研究关系,这些关系经审查后被确定与流感无关。布莱恩特博士从WebMed获得酬金,从美国肾脏病学会获得津贴,并从牛津大学出版社获得版税。披露了相关冲突的传染病委员会成员未参与本声明的制定。
资金来源:无外部资金。
本文件受版权保护,为美国儿科学会及其董事会所有。所有作者均已向美国儿科学会提交了利益冲突声明。任何冲突均已通过董事会批准的程序得到解决。美国儿科学会在本出版物内容的撰写过程中,既未寻求也未接受任何商业参与。
美国儿科学会的政策声明得益于联络人以及内部(美国儿科学会)和外部评审人员的专业知识与资源。不过,美国儿科学会的政策声明可能并不反映联络人及其所代表的组织或政府机构的观点。
本声明中的指导意见并非表明唯一的治疗方案,也不构成医疗护理标准。考虑到个体情况的差异,采取不同的治疗方式可能是合适的。
美国儿科学会的所有政策声明自发布之日起5年后自动失效,除非在此之前或之时得到重申、修订或废止。
截至2025年7月5日,指向cdc.gov和fda.gov网站的嵌入式链接均处于活跃状态,并已由美国儿科学会(AAP)的主题专家审核。
配套论文: 本文的配套论文可在以下网址查阅:www.pediatrics.org/cgi/doi/10.1542/peds.2025-073622。
致谢
传染病委员会衷心感谢克里斯蒂娜·A·布莱恩特医学博士、美国儿科学会会员,以及安妮卡·M·霍夫施泰特医学博士、哲学博士、公共卫生硕士、美国儿科学会会员,感谢他们在起草这份政策声明和技术报告时发挥的领导作用;同时也感谢胡安·D·查帕罗医学博士、理学硕士、美国儿科学会会员,以及杰里米·J·米歇尔医学博士、卫生科学硕士、美国儿科学会会员,感谢他们代表美国儿科学会政策实施合作伙伴关系,为初稿提供意见并做出的重要贡献。
AAP
美国儿科学会
FDA
美国食品药品监督管理局
ccIIV
基于细胞培养的灭活(非活)流感疫苗
ccIIV3
三价细胞培养灭活(非活)流感疫苗
IIV
灭活(非活)流感疫苗
IIV3
三价灭活(非活)流感疫苗
LAIV
减毒活流感疫苗
LAIV3
三价减毒活流感疫苗
RIV
重组流感疫苗
RIV3
三价重组流感疫苗
世界卫生组织
世界卫生组织
参考文献
2024;73(RR-5): 1-25.doi:10.15585/mmwr.rr7305a1
Hits: 162
- 关于流感
- 感冒与流感
- 流感和新冠肺炎的异同
- 流感病毒的类型
- 流感季节
- 流感的症状和体征
- 季节性流感和葡萄球菌感染
- 流感是如何传播的
- 流感并发症风险增加的人群
- 流感与儿童
- 流感和 65 岁及以上的人
- 流感和哮喘患者
- 流感和有心脏病或中风史的人
- 流感和糖尿病患者
- 流感和慢性肾病患者
- 流感和残疾人
- 流感和艾滋病毒携带者
- 流感和患有神经系统疾病的儿童
- 流感和癌症
- 预防流感的健康习惯
- 对季节性流感和流感疫苗的误解
- 谁需要流感疫苗
- 关于季节性流感疫苗的主要事实
- 同时接种流感疫苗和其他推荐疫苗
- 流感疫苗和鸡蛋过敏人群
- 预防季节性流感
- 季节性流感疫苗基础知识
- 流感诊断
- 流感的治疗
- 用抗病毒药物治疗流感
- 儿童流感的治疗
- 流感抗病毒药物耐药性
- 流感抗病毒药物巴洛沙韦马波西酯
- 如果儿童不能吞咽胶囊,打开奥司他韦胶囊并将其与液体混合
- 流感:如果你生病了怎么办
- 照顾生病的人
- 婴幼儿的照料者
- 预防流感:给旅行者的信息
- 健康公平与流感
- 流感季节的信息
- 2024–2025流感季节
- 农场工人的季节性流感疫苗接种
- 流感疫苗安全性
- 流感疫苗安全与怀孕
- 格林-巴利综合征与流感疫苗
- 儿童期疫苗接种(包括流感疫苗接种)后的热性惊厥
- 流感疫苗中的硫柳汞
- 不同类型的流感疫苗
- 减毒活流感疫苗 [LAIV](鼻喷流感疫苗)
- 基于细胞的流感疫苗
- 重组流感疫苗
- Fluzone 高剂量季节性流感疫苗
- 通过喷雾注射器接种流感疫苗
- 三价流感疫苗
- 佐剂流感疫苗
- 如何制造流感 (Flu) 疫苗
- 为季节性流感疫苗选择病毒
- 流感疫苗的进步
- 流感儿科死亡人数创下新的严峻里程碑
- CDC研究显示早期流感抗病毒治疗降低死亡风险
- 美国将在2024-2025年过渡到三价流感疫苗
- 这一季的流感疫苗减少了所有年龄段的流感就医和住院人数
- 研究表明,流感病毒感染会增加心脏病发作的风险
- 2023-2024年流感疫苗覆盖率更新(续)
- CDC研究指出新型流感疫苗的潜在益处
- 患有慢性疾病的人继续占本季度流感住院人数的大多数
- 研究显示,流感和新冠肺炎的医院结果变得更加相似
- 流感疫苗接种覆盖率更新
- 在这个流感季节,儿童和老年人可能会出现更严重的疾病
- 怀孕期间接种流感疫苗可减少6个月以下婴儿的流感住院和急诊
- 新的研究表明,接种流感疫苗可能会对公共健康产生重大影响,阻止数百万人就医
- 新的研究表明,接种流感疫苗将儿童急诊和急诊就诊及住院减少了近一半
- 疾病预防控制中心的新研究发现疫苗对严重流感有很强的效果
- 流感活动增加,而疫苗接种滞后
- 疾控中心庆祝支持国际疫苗倡议伙伴关系10周年
- CDC的新研究通过病毒类型和亚型观察流感的严重程度
- 新的野生轻度的活动驱动的关键信息驯服流感和重置期望
- 流感和怀孕
- 父母:帮助孩子对抗流感
- 流行性感冒术语表
- 流感临床指南
- 新型冠状病毒病毒和流感病毒共同传播时急性呼吸道疾病患者不住院的临床指南
- 新型冠状病毒和流感病毒共同传播时急性呼吸道疾病住院患者的临床指南
- 新型冠状病毒和流感病毒共同传播时住院和非住院患者的临床指南
- 流感的临床症状和体征
- 流感疫苗接种临床指南
- 谈流感疫苗推荐
- 季节性流感疫苗安全性临床指南
- 孕妇或哺乳期人群流感疫苗安全注意事项
- 季节性流感疫苗剂量和接种
- 卫生保健提供者的流感疫苗供应和分发信息
- 季节性流感疫苗供应常见问题
- 流感检测方法概述
- 机构或其他封闭环境中调查性暴发中的流感病毒检测
- 流感病毒在社区传播时考虑流感检测的指南
- 当病毒在卫生保健机构传播时,有关流感检测结果解释的信息
- FDA授权多重检测法同时检测流感病毒和新型冠状病毒
- 当流感病毒在流感季节不传播时,卫生保健提供者关于流感检测结果解释的信息
- 用于诊断流感病毒感染的快速分子检测、RT-PCR和其他分子检测的信息
- 协助医疗办公室电话评估卫生保健机构中可能患有流感的患者
- 为临床医生提供的流感快速诊断检测信息
- 快速流感诊断测试
- 关于流感抗病毒药物
- 流感抗病毒药物:临床医生总结
- 产科卫生保健提供者关于使用抗病毒药物治疗和预防流感的建议
- 卫生保健机构中的感染控制
- 医疗机构中季节性流感的感染预防和控制策略
- 使用口罩控制季节性流感病毒传播的临时指南
- 长期护理和急性后护理机构流感爆发管理临时指南
- 围产期和产后流感预防和控制指南
- 收集呼吸道样本进行流感病毒测试的实验室资料
- 疾病预防控制中心如何对美国每个季节的流感严重程度进行分类
- 2024-2025年美国流感季节:季节内严重性初步评估
- 过去流感季节严重性评估
- 流感实验室信息
- 流感病毒检测方法
- 流感基于标准的电子实验室报告指南
- 流感快速诊断检测:给临床实验室主任的信息
- 基于核酸检测的测试
- 了解流感病毒
- 流感病毒如何变化:“漂移”和“转移”
- 流通病毒抗原特性
- 流感病毒基因组测序和基因特征分析
- 流行性感冒
- 流感和有色人种社区
- 流感和医疗保健专业人员
- 流感和老年人
- 流感疫苗和怀孕
- 流感-NFID
- 专家:疫苗接种,是对抗强烈流感季节的关键信息
- 禽流感
- 公布了2026年南半球流感季节流感疫苗成分的建议
- CDC发布2024-2025年流感报告,含下一季度建议
- 2025-2026年儿童流感预防与控制建议:政策声明
- 65岁以上成年人的流感:事实
- 流感
- 流感疫苗——常见问题解答
相关文章:
- 预防和控制儿童流感的建议,2024–2025:政策声明
- 关于预防婴幼儿呼吸道合胞病毒感染的建议:政策声明
- 婴幼儿和青少年COVID-19疫苗接种建议:政策声明
- 推荐的儿童和青少年免疫计划:美国,2025年:政策声明
- 预防和控制儿童流感的建议,2024–2025:技术报告
- 2024-2025 年季节性流感疫苗有效性中期估计 — 四个疫苗有效性网络,美国,2024 年 10 月至 2025 年 2 月
- 2025 年 4 月 30 日的 NACI 声明摘要:关于 2025-2026 年季节性流感疫苗的声明
- 2025 年 1 月 10 日的 NACI 声明摘要:2025 年至 2026 年夏季 COVID-19 疫苗使用指南
- 2025 年 4 月 ACIP 会议更新:流感、COVID-19、HPV、RSV 和其他免疫接种
- 2024-2025 年 COVID-19 疫苗在 ≥18 岁成年人中的有效性中期估计 — VISION 和 IVY Networks,2024 年 9 月至 2025 年 1 月
- 2025 年秋季开始在美国使用的 COVID-19 疫苗(2025-2026 年配方)
- 2024-2025 年流感季节愈演愈烈
- 世卫组织关于免疫接种以保护婴儿感染呼吸道合胞病毒病的立场文件 2025 年 5 月
- 美国儿科学会 2025 年 8 月 19 日发布的推荐18 岁及以下儿童与青少年免疫接种程序
- 2025 年秋季疫苗指南
Powered by YARPP.