Contents
人乳头瘤病毒(HPV)疫苗产品选择的考虑因素
Considerations for human papillomavirus (HPV) vaccine product choice
背景
本文件总结了世卫组织通过资格预审的人乳头瘤病毒(HPV)疫苗产品的当前技术和规划信息,以促进各国在引进人乳头瘤病毒疫苗(或免疫规划中的产品转换)时做出知情选择。自2009年以来,已有四种HPV疫苗产品通过了世卫组织的资格预审。它们包括两种二价产品(厦门万泰沧海生物技术有限公司生产的馨可宁(Cecolin)和葛兰素史克生物制品公司生产的希瑞适(Cervarix))、一种四价产品(默沙东公司生产的Gardasil)和一种九价产品(默沙东公司生产的Gardasil-9)。一种二价产品(Walrinvax)目前正在接受世卫组织的审查,一种四价产品(Cervavac)已获得国家许可。
本文件的主要目的是提供关于HPV疫苗产品的全面信息,包括科学证据、疫苗定价、演示、冷链和储存要求等。这些信息使各国能够比较不同的人类乳头瘤病毒疫苗产品,并就将人类乳头瘤病毒疫苗纳入其国家免疫规划做出知情决定。
发展
参考最新的进行了全面审查世卫组织关于人乳头瘤病毒的立场文件 疫苗接种1,该报告于2022年12月发表,已经包含了关于HPV疫苗功效、有效性和安全性的科学证据汇编。SAGE遵循的方法和疫苗立场文件的准备过程在以下网站进行了描述:https://www . who . int/publications/m/item/who-position-paper-process。还进行了彻底的人工搜索以确定最近生成的证据,并重新访问了世卫组织立场文件中引用的原始出版物以验证科学证据。此外,产品信息是从公开来源收集的。
最终草案经过同行评审,其中包括严格审查科学证据并与各国要求保持一致。虽然这是一份专家总结,但并不是正式的世卫组织建议或指南。参与编写本文件的人员已经完成了世卫组织专家的世卫组织利益声明,并被发现在人乳头瘤病毒疫苗领域没有利益冲突。
世卫组织对人乳头瘤病毒疫苗的立场
2022年世卫组织立场文件提出了人乳头瘤病毒疫苗预防9岁或以上儿童人乳头瘤病毒相关疾病的当前政策建议,其优先目的是预防宫颈癌。2018年,宫颈癌占所有人乳头瘤病毒相关癌症的82%2。《2020年世卫组织加速消除宫颈癌这一公共卫生问题全球战略》建议,人乳头瘤病毒疫苗应纳入所有国家免疫规划,并应在2030年前覆盖90%的15岁女孩3。人乳头瘤病毒立场文件没有表示对通过资格预审的人乳头瘤病毒产品的偏好,并声明如下:
- 所有目前已获许可的二价、四价和九价人乳头瘤病毒疫苗都具有出色的安全性,并在预防主要由16型和18型人乳头瘤病毒病毒引起的宫颈癌前期癌和癌症方面具有相当的免疫原性、功效和有效性。
- HPV疫苗的选择应基于对当地相关数据的评估和多种考虑因素,包括人乳头瘤病毒相关公共卫生问题的规模(宫颈癌、其他人乳头瘤病毒相关癌症、肛门生殖器疣)、疫苗已获批准的人群、产品特性(包括单剂量方案选项的单剂量疗效)、价格和方案考虑因素。
疫苗特性
- 所有人乳头瘤病毒疫苗都是使用重组DNA和细胞培养技术生产的。它们不含活的生物制品或病毒DNA,因此没有传染性。人乳头瘤病毒疫苗是使用不同的表达系统(生产细胞)从人乳头瘤病毒的L1结构蛋白制备的病毒样颗粒(VLPs)4。HPV疫苗产品含有不同的佐剂,不含防腐剂或抗生素。它们通过肌肉注射接种。
- 当考虑四种通过资格预审的HPV疫苗产品的组成时,产品中包括的VLPs/人乳头瘤病毒类型的数量和选择存在关键差异。表1列出了目前通过资格预审的人乳头瘤病毒疫苗成分的质量差异,表2列出了目前正在接受世卫组织资格预审审查的人乳头瘤病毒疫苗成分的质量差异。
表1.通过资格预审的人乳头瘤病毒疫苗的特性和质量构成5
| 疫苗 | 二价 | 四价 | 九价 | |
| 商品名 | 馨可宁(Cecolin) | 希瑞适(Cervarix) | 四价佳达修(Gardasil), | 九价佳达修(Gardasil 9) |
| 制造商 | 厦门万泰沧海生物技术有限公司 | GSK | 默沙东 | 默沙东 |
| 世卫组织资格预审日期 | 2021.10.14 | 2009.07.08 | 2009.05.20 | 2018.02.09 |
| 抗原 (VLP类型) | HPV16 HPV18 | HPV16 HPV18 | HPV16 HPV18 HPV6* HPV11* | HPV16,HPV18, HPV31,HPV33, HPV45,HPV52, HPV58, HPV6*,HPV11* |
| 佐剂 | 铝 氢氧化物 | AS04(氢氧化物和3-脱酰基单磷酰脂质A) | 铝 硫酸羟基磷酸盐 | 铝 硫酸羟基磷酸盐 |
| 表达系统/生产细胞 | 大肠杆菌 | 来自杆状病毒 Trichoplusiani | 酿酒酵母(面包师酵母) | 酵母 酿酒酵母面包店 酵母) |
*大约90%的生殖器疣是由被认为非致癌的人乳头瘤病毒型引起的6。
表2.目前在全国获得许可(未经世卫组织资格预审)的人乳头瘤病毒疫苗的特性和质量构成
| 疫苗 | 二价 | 四价 | |
| 商品名 | 沃泽慧(Walrinvax®) | Cervavac® | |
| 制造商 | 沃森生物 | 印度血清研究所 | |
| 世卫组织资格预审状态 | 接受审查 | 未提交 | |
| 抗原 (VLP类型) | HPV16 HPV18 | HPV16 HPV18 | HPV6* HPV11* |
| 助理员 | 磷酸铝 | 氢氧化铝 | |
| 表达系统/生产细胞 | 毕赤酵母 | 汉森酵母属 | |
疫苗安全
- 作为世卫组织资格预审程序的一部分,全球疫苗安全咨询委员会(GACVS)已对人乳头瘤病毒疫苗的安全性进行了审查。未发现任何安全问题7。
- 迄今为止,除了罕见的过敏反应报告(包括过敏反应)外,上市后监测未发现严重的安全性问题。关于目前全球使用的人乳头瘤病毒疫苗的安全性,所有来源的数据继续令人放心。表3总结了疫苗接种后的局部和全身反应。
- 对人乳头瘤病毒疫苗安全性研究8的系统审查发现,在严重不良事件或新发慢性病(包括新发自身免疫性疾病)方面,二价、四价和九价人乳头瘤病毒疫苗的接受者之间几乎没有差异。
- 一项基于人群的上市后安全性监测研究表明,HPV疫苗与接种后新发慢性疾病(包括自身免疫性疾病)之间没有关联9。数据令人放心,HPV疫苗不会增加吉兰-巴雷综合征、贝尔麻痹、复杂区域疼痛综合征(CRPS)或体位性直立性心动过速综合征(POTS)的风险。没有发现人乳头瘤病毒疫苗接种与不孕症之间的关联。
表3.人乳头瘤病毒疫苗接种后的局部和全身不良事件
| 疫苗 | 二价的 | 四价 | 九价 | |
| 商品名 | 馨可宁(Cecolin) | 希瑞适(Cervarix) | 四价佳达修(Gardasil), | 九价佳达修(Gardasil 9) |
| 局部反应10 | 总体报告:注射部位疼痛(35–88%)、发红(5–40%)、肿胀(4–35%)、严重疼痛*(6%) | |||
| 可能导致比四价更多的局部反应 | 报告疼痛和肿胀的可能性略高于四价 | |||
| 系统的 反应10 | 总体报告的事件通常轻微且具有自限性:头痛、头晕、肌痛、关节痛、胃肠道症状(恶心、呕吐、腹痛) | |||
| 49% | 69% | 55% | ||
| 罕见:过敏反应,包括过敏反应 | ||||
| 特别的 考虑 | 已经观察到疫苗接种后晕厥和免疫应激相关反应11,但通过适当的准备可以将其降至最低。为了避免昏厥造成的伤害,疫苗接种者应在接种HPV疫苗后坐下观察至少15分钟。 | |||
*自发性疼痛或妨碍正常活动的疼痛。
禁忌症,注意事项和怀孕期间的使用
- 禁忌症:已知对HPV疫苗的任何成分有严重过敏反应,或在第一剂HPV疫苗后有严重过敏反应。
- 预防措施:为防止晕厥和/或因晕厥而受伤,接种HPV疫苗后,疫苗接种者应坐下观察至少15分钟。
- 在缺乏对孕妇的良好对照研究的情况下,不建议孕妇接种疫苗。接种疫苗前不需要验孕。
- 怀孕期间意外接种疫苗并非终止妊娠的指征。
- 如果在第一剂疫苗接种后发生妊娠,后续剂量(如适用)应推迟至妊娠后。
疫苗的免疫原性、效力和有效性
免疫原性
- 人乳头瘤病毒疫苗具有高度免疫原性;疫苗接种后血清阳性率接近100%。接种疫苗时,年龄越小,抗体滴度越高12。疫苗的血清学反应比自然感染后的反应强得多。
- 迄今在临床试验中观察到的高HPV疫苗效力排除了最低保护性抗体滴度的识别。
- 系统性审查和一项随机对照试验表明,接受一剂HPV疫苗的受试者的血清阳性率不低于接受两剂或更多剂疫苗的受试者1,13。
功效
- 对于初始许可和三剂方案,在使用人乳头瘤病毒病终点(即宫颈上皮内瘤样病变2级或更差(CIN2+)、原位腺癌(AIS)和高级别、外阴和阴道病变)的研究中,发现所有人乳头瘤病毒疫苗在人乳头瘤病毒天真人群中具有高疗效,接近或等于100%14,15,16。
- 随后的研究评估了9-14岁青少年的两种剂量与15-26岁青少年的三种剂量(由并非所有受试者都完成三种剂量方案的试验的事后分析得出),表明两种剂量方案组的血清转化和几何平均滴度均无劣效性17。
- 几项研究表明,单剂量注射对人乳头瘤病毒持续感染有很高的疗效与多剂量方案相当的疫苗接种方案1,18。
有效性
- 涉及超过6000万人的许可后研究的有效性数据显示,在接种疫苗计划5-8年后,人乳头瘤病毒16和人乳头瘤病毒18的患病率显著下降——13-19岁的女孩下降了83 %, 20-24岁的女性下降了66%19。有证据表明,未接种疫苗的雌性动物通过群体保护效应获得间接保护20。
- 来自一项人群研究的二价希瑞适(Cervarix)疫苗数据显示,12-13岁接种疫苗的女性对CIN3+有86%的有效性。在17岁时接种疫苗的人群中,这一比例为51%21。使用人口统计和健康登记追踪100多万10-30岁女性的四价Gardasil数据显示,与从未接种疫苗的人群相比,17岁前接种疫苗的人群患浸润性宫颈癌的风险降低了88%22。一项针对30岁以下女性的基于人群的癌症登记数据的观察性研究显示,在国家免疫计划中引入二价希瑞适(Cervarix)后,在12-13岁接种疫苗的女性中几乎消除了宫颈癌
- 在一些国家,在国家免疫方案中引入四价人乳头瘤病毒疫苗后,生殖器疣病例大幅减少,在只有女性参与的方案中,未接种疫苗的年轻男性病例减少,表明了群体保护。
- 疫苗诱导的人乳头瘤病毒型替代被认为是不太可能的,尽管现在排除它还为时过早。
表4总结了多剂量方案的免疫原性和功效信息。
表4.预先鉴定的人乳头瘤病毒疫苗的免疫原性和效力
| 疫苗 | 二价的 | 四价的 | 九价的 | |
| 商品名 | 馨可宁(Cecolin) | 希瑞适(Cervarix) | 四价佳达修(Gardasil), | 九价佳达修(Gardasil 9) |
| 免疫原性 | 所有高免疫原性(未确定保护的最低抗体滴度) | |||
| 功效 (使用原始人群中疾病终点的研究,除了馨可宁(Cecolin)) | 97.7%(95%CI为86.2–99.9);持续感染> 6个月)95.3%(95%CI70.7–99.9;持续感染> 12个月)24 | 81%(对于CIN2+,95%CI为53–94)25 93%(对于CIN3+,95%CI为79–99)26 | 98%(对于CIN2+,95%CI为93–100)27 >90% | 与四价Gardasil相比,两种疫苗针对的类型差异很小或没有差异,另外5种类型为96.7% 28 |
| 1剂功效或免疫桥接数据的可用性 | 正在进行的免疫桥接研究(针对Gardasil)29 | 有效数据可用30 | 有效数据31 | 有效数据30 |
交叉保护
- 数据表明,二价和四价人乳头瘤病毒疫苗可针对疫苗中未包含的人乳头瘤病毒病毒类型提供部分交叉保护。与使用四价Gardasil的国家相比,在引入二价希瑞适(Cervarix)疫苗的国家中,针对人乳头瘤病毒31型、33型和45型流行感染的交叉保护作用更加一致和更高。一项审查的结论是,与疫苗中针对人乳头瘤病毒病毒类型的直接保护相比,交叉保护是不一致的,并且随着时间的推移而减弱32。 Cecolin®和Gardasil-9的交叉保护程度尚不清楚。
保护期限
- 通过多剂量方案,二价希瑞适(Cervarix)和四价Gardasil疫苗的抗体滴度至少可保持12年,最近获得许可的Gardasil-9疫苗的抗体滴度至少可保持6年。对于单剂量方案,抗体滴度已显示稳定至少10年18。
- 在一项比较一剂、二剂和三剂方案的事后分析中,在所有方案的疫苗接种后至少10年内,相对于人乳头瘤病毒16/18,疫苗效力较高(> 90%)。
- 没有证据表明初级人乳头瘤病毒疫苗接种后需要加强剂量。
方案考虑
- HPV疫苗产品的几个程序特征是相似或相同的(如接种、配方、储存温度、疫苗瓶监控、损耗率)。
- 其他重要因素——如外观、CTC适应症、冷链和储存要求、每个容器的剂量和价格——因产品而异,可能需要为选择转换或纳入多种产品的国家进行额外规划(表5)。
- 人乳头瘤病毒疫苗接种的主要目标人群是9-14岁的女孩。次要目标人群,如≥15岁的女性、男孩、老年男性或与男性发生性关系的男性,只有在可行和负担得起的情况下才建议接种疫苗。并非所有目前可用的产品都获得了针对男孩的许可。
- 在引入疫苗时,计划对18岁以下的多年龄段人群进行疫苗接种时,应考虑供应可用性和冷链影响。
- 在推出所有HPV疫苗产品之前,需要对免疫工作人员进行使用培训,包括在改用双剂量小瓶产品之前应正确应用多剂量小瓶政策的情况。
表5列出了通过资格预审的人乳头瘤病毒疫苗的展示、储存要求和包装细节。
表5.通过资格预审的人乳头瘤病毒疫苗的储存和包装特性
| 疫苗 | 二价 | 四价 | 九价 | |
| 商品名 | 馨可宁(Cecolin) | 希瑞适(Cervarix) | 四价佳达修(Gardasil), | 九价佳达修(Gardasil 9) |
| 剂型*和剂量 | 液体,即用单剂量小瓶(0.5毫升/剂) | 液体,即用1和2剂量小瓶(0.5毫升/剂) | 液体,随时可用 单剂量小瓶(0.5毫升/剂) | |
| 疫苗瓶监控器 | 14型 | 30型 | 30型 | 未包括在内 |
| 储存温度和保质期 | 在+2至+8℃时:36个月 | 在+2至+8℃时:60个月 | 在+2至+8℃时:36个月 | |
| 稳定性和CTC*** | – | 从+8到+25℃:3天; 从+25至+37℃:1天 | 从+8至+40℃:4天(CTC) 从+8至+42℃:3天(CTC) | |
| 冷链体积/剂量(二次包装) | 纸箱装:10瓶–14.29 cm3 | 纸箱包含: 1瓶–28.8 cm3 10瓶–5.7 cm3 100瓶–4.8 cm3米 | 纸板箱 包含: 1小瓶–75 cm3 10瓶–15 cm3 | 纸箱包含:10个小瓶,由
|
希瑞适(Cervarix)和Gardasil人乳头瘤病毒疫苗的预灌装单剂量注射器也有市售。
* *开封的2剂小瓶中任何未使用的疫苗应在开封后6小时或免疫期结束时丢弃,以先到者为准33。
***CTC 受控温度链34。
推荐的疫苗接种时间表1,35
两剂方案
- 可从9岁开始使用,直到产品许可的最大年龄,出于程序和效率原因,建议间隔12个月。
- 两次接种之间的最小间隔:6个月。
- 剂量之间没有最大间隔;如果计划合适,可以考虑更长的时间间隔,最长可达3年或5年。
替代单剂量方案
- 可用于9-20岁的女性和男性。
- 鉴于目前的证据表明,两剂方案的功效和保护时间相当,单剂方案可能具有方案优势,更加有效和负担得起,并有助于扩大覆盖面。
- 从公共卫生的角度来看,单剂量接种方案可以带来巨大的益处,如果随着时间的推移药效减弱36,这种益处将超过保护水平降低的潜在风险。
免疫功能低下者的日程安排
- 建议免疫功能低下或HIV感染者采用多剂量方案(无论年龄或抗逆转录病毒治疗状态如何):
o至少两剂,第一剂和第二剂之间至少间隔6个月(0,6);
o在可能的情况下,按照0、1-2、6个月的接种时间表分三次接种。
互换性
- 应在多剂量疫苗接种计划中使用相同的HPV疫苗产品。
- 如果先前剂量使用的产品未知或不可用,则可以接种任何HPV疫苗来完成建议的时间表。
- Gardasil-9和希瑞适(Cervarix)联合用药的安全性和免疫原性数据可用1。
与其他疫苗合用
人乳头瘤病毒疫苗可以在同一就诊时与其他疫苗(包括活疫苗)一起使用,在不同的解剖部位使用单独的注射器.1
成本和财务考虑
- HPV疫苗的定价因产品、展示方式、采购机制和国家收入群体而异。中等收入国家和高收入国家自行采购的价格中值明显高于泛美卫生组织周转基金的价格。
- 2021年,四价HPV疫苗的MIC中位数价格为每剂39美元,而二价HPV疫苗的HIC中位数价格为27美元,九价疫苗为101.37美元。下面的图1包括根据MI4A购买数据按采购方法和收入组报告的每剂HPV疫苗价格38。
- 可用于预算目的的人乳头瘤病毒疫苗当前全球疫苗和免疫联盟指示性价格39为:馨可宁(Cecolin)每剂2.90美元、希瑞适(Cervarix)每剂5.18美元和四价Gardasil每剂4.50美元。
- 开发了关于人类乳头瘤病毒疫苗的世卫组织宫颈癌预防和控制成本计算工具(C4P),以支持各国计划将人类乳头瘤病毒疫苗引入现有的免疫规划。40有一个专门的成本计算工具来计算转换产品的成本41。
- 几项研究表明,按照目前的疫苗价格和建议的时间表,即使不假设存在交叉保护或群体保护,只为女孩接种疫苗与不接种疫苗相比也具有成本效益42。为了评估全国范围内的成本效益,可以使用主要工具43。
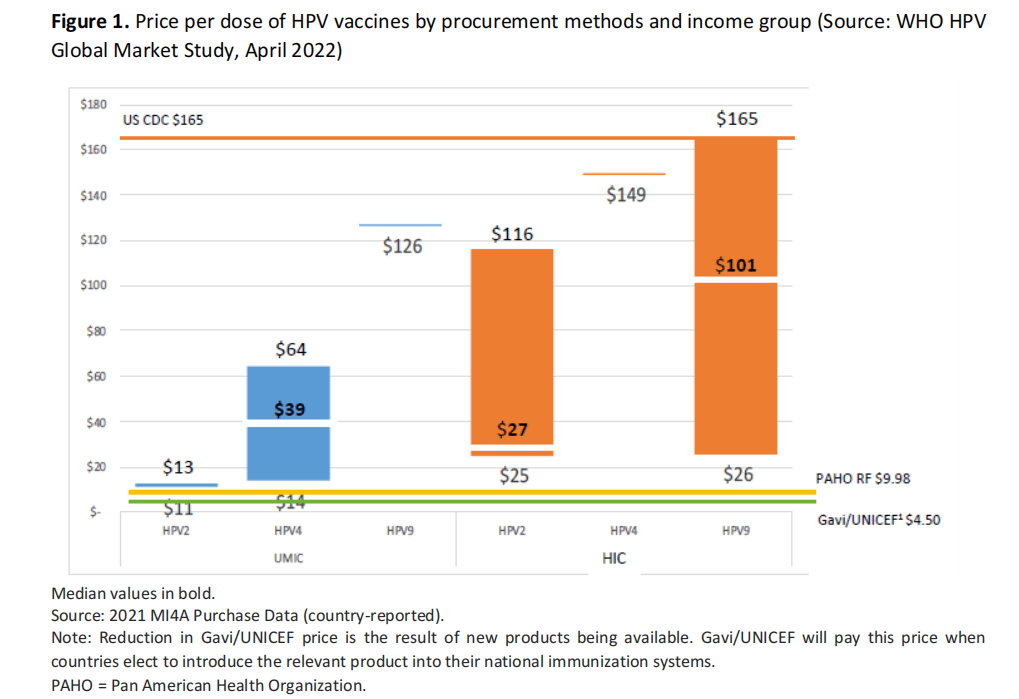
图1.按采购方法和收入组分列的每剂人乳头瘤病毒疫苗价格(来源:世卫组织·人乳头瘤病毒全球市场研究,2022年4月)
粗体显示的中值。
数据来源:2021年MI4A采购数据(国家报告)。
注:全球疫苗和免疫联盟/联合国儿童基金会价格下降是由于新产品上市。当各国选择将相关产品引入其国家免疫系统时,全球疫苗和免疫联盟/联合国儿童基金会将为此付出代价。
PAHO =泛美卫生组织。
可用性和供应
- 世卫组织监控全球HPV疫苗市场并定期发布更新。根据最新报告(2022年)44,全球供应有望在2024年改善并达到健康状况。目前,鉴于缓冲区有限,谨慎分阶段开展多年龄组疫苗接种以及各国愿意使用任何可用的人乳头瘤病毒疫苗是确保所有国家都能获得供应的最关键因素。
- 广泛采用(标签外)单剂量方案可以在短期内改善供需平衡,但从中长期来看可能会对人乳头瘤病毒市场的可持续性产生影响。
- 所有制造商要求从订购到国内交付有六个月的交付周期。
新疫苗引进决策的优先顺序
世卫组织能力工具45可用于支持标准化的国家/地区决策,以及针对引进、产品转换或时间表变更的多种产品选择方案的比较。该工具允许将证据和不同利益相关方的观点结合起来,以便提出建议并记录过程和结果。
将人类乳头瘤病毒疫苗纳入国家免疫战略
各国可考虑引进或转换人类乳头瘤病毒疫苗产品,将其作为国家免疫战略(NIS)内更广泛的免疫规划优先进程的一部分46。 NIS旨在更好地将免疫接种与其他卫生干预措施相结合,
全民健康覆盖目标和国家规划周期,侧重于长期目标、中期目标和优先战略。
致谢
本文件由世卫组织免疫、疫苗和生物制品部(IVB)与在HPV疫苗技术领域工作的世卫组织地区同事和全球合作伙伴合作编制。
1人类乳头瘤病毒疫苗:世卫组织立场文件(2022年更新)。每周流行病学记录。2022;
97:645–672 (https://www . who . int/teams/immunization-vaccines-and-biologicals/policies/position-papers/human- 乳头瘤病毒(hpv),于2023年2月18日访问)。
2 de Martel C,Georges D,Bray F,Ferlay J,Clifford GM2018年全球感染导致的癌症负担:全球发病率分析。柳叶刀全球健康。2020;8(2):e180-e190。doi:10.1016/s 2214-109 x(19)30488-7。
3世界卫生大会通过加速消除宫颈癌的全球战略。世卫组织新闻,8月19日
2020 (https://www . who . int/news/item/19-08-2020-world-health-assembly-takes-global-strategy-to-accelerate- 消除宫颈癌,于2023年10月27日访问)。
4名为病毒样颗粒(VLPs)的人乳头瘤病毒型特异性空壳由L1主要衣壳蛋白的五聚体自发自组装。
5世卫组织资格预审(网站)(https://extranet.who.int/pqweb/,于2023年10月27日访问)。
6 Patel H,Wagner M,Singhal P,Kothari S .生殖器疣发病率和流行率的系统综述。BMC感染Dis。2013年1月25日;13:39.doi: 10.1186/1471-2334-13-39。
7疫苗安全全球咨询委员会会议,2017年6月7日至8日。每周流行病学记录。2017;92:398–401 (https://www.who.int/publications/i/item/WER9228,于2023年2月18日访问)。
8占位符为:亨舍克N,伯格曼H,维拉纽瓦G,洛克YK,戈尔德SP,克罗斯比EJ等。人类乳头瘤病毒(人乳头瘤病毒)疫苗接种方案对人乳头瘤病毒相关疾病和危害的社区发病率的影响
接种疫苗。科克伦系统综述数据库。2022年–目前只有协议可用。
9人乳头瘤病毒疫苗的安全性。世卫组织疫苗安全全球咨询委员会(GACVS),2017年6月7日至8日(在线)
(关于HPV疫苗的报告https://www . who . int/groups/global-advisory-Committee-on-vaccine-safety/topics/human- 乳头瘤病毒-疫苗/安全性,于2023年10月27日访问)。
10亨斯切克N、伯格曼H、维拉纽瓦G、洛克YK、戈尔德SP、克罗斯比EJ、基尔吉乌M、德万K、莫里森j .人类乳头瘤病毒(人乳头瘤病毒)疫苗接种计划对人乳头瘤病毒相关疾病社区发病率的影响以及疫苗接种的危害。Cochrane数据库系统2022年5月31日修订版;2022(5):CD015363。doi: 10.1002/14651858。
11免疫应激反应:为项目经理和卫生专业人员编写的手册,用于预防、识别和应对免疫接种后的应激反应。日内瓦:世界卫生组织;2019(https://www.who.int/publications/i/item/9789241515948,于2023年2月18日访问)。
12在证明非劣效性的免疫桥接研究的基础上,批准将人乳头瘤病毒疫苗的原始许可年龄延长至青春期前和青春期的女孩和男孩——由于伦理考虑,这些人的疗效试验被认为是不可行的。
13沃森-琼斯D,昌格鲁查J,惠特沃思H,平托L,穆坦尼P,因丹加西J等。免疫原性和安全性
坦桑尼亚女孩接种一剂人乳头瘤病毒疫苗与两剂或三剂疫苗的比较(DoRIS):一项开放标签、随机、非劣效性试验。柳叶刀全球健康。2022;10(10):e 1473–84。doi:10.1016/2214-
109X(22)00309-6。
14未来II研究小组。预防高度宫颈病变的人乳头瘤病毒四价疫苗。英国医学。2007;356:1915–27.doi: 10.1056/nejmoa061741。
15贾兰思,贺南德兹-阿维拉M,惠勒CM,佩雷斯G,哈珀DM,利奥多尔特S等.四价疫苗
对抗人类乳头瘤病毒以预防肛门生殖器疾病。英国医学。2007;356:1928–43.doi: 10.1056/NEJMoa061760。
16帕沃嫩J、詹金斯D、博世FX、诺德P、萨尔梅隆J、惠勒CM等。预防性佐剂的功效
抗青少年人乳头瘤病毒16型和18型感染的双价L1病毒样颗粒疫苗
女性:一项III期双盲随机对照试验的中期分析。柳叶刀。2007;369(9580):2161– 70.doi:10.1016/s 0140-6736(07)60946-5
17克雷梅拉尔,罗德里格斯AC,希尔德斯海姆A,赫雷罗R,PorrasC,席夫曼M等。少于三剂二价HPV16/18疫苗效力的原理验证评估。美国国家癌症研究所。2011;103(9):1444–51.
doi: 10.1093/jnci/djr319。
18 .一剂HPV疫苗与未接种疫苗相比的功效、有效性和免疫原性
剂量,或三个剂量。科克伦回应,2022年3月(https://cdn.who.int/media/docs/default-
来源/免疫/position _ paper _ documents/人乳头瘤病毒(HPV)/1-剂量-的系统综述 hpv-vaccinec14d7ee3-e409-4a1a-afd9-c3e7e0dd2bd9.pdf?sfvrsn=174858f6_1,于2023年10月28日访问)。
19德罗莱特M,贝纳德,佩雷斯N,布里松M;人乳头瘤病毒疫苗接种影响研究小组。引入人类乳头瘤病毒疫苗接种规划后的人群水平影响和羊群效应:更新的系统综述和荟萃分析。柳叶刀。2019年8月10日;394(10197):497-509.doi:10.1016/s 0140-6736(19)30298-3
20罗森布鲁姆汞,刘易斯RM,加尔加诺JW,克雷茨TD,昂格尔,马尔科维茨勒。2003年至2018年美国引入疫苗后女性中人乳头瘤病毒疫苗型感染的患病率下降。MMWR莫尔布凡人Wkly代表2021;70(12):415–20.doi: 10.15585/mmwr.mm7012a2。
21 Palmer T,Wallace L,Pollock KG,Cuschieri K,Robertson C,卡瓦纳格K等。苏格兰12-13岁接种二价HPV疫苗后20岁时宫颈疾病患病率:回顾性人群研究。BMJ。
2019;365:I1161(https://pubmed.ncbi.nlm.nih.gov/30944092/,于2023年10月28日访问)。
22雷军,Ploner A,elf strm KM,王J,Roth A,方F等。人乳头瘤病毒疫苗接种与浸润性宫颈癌的风险。英国医学博士。2020;383(14):1340–8.doi: 10.1056/NEJMoa1917338。
23 Falcaro M,Castañ oA,NdelaB,Checchi M,Soldan K,Lopez-Bernal J等,《国家人乳头瘤病毒的影响》
英国英格兰宫颈癌和3级宫颈上皮内瘤变发病率的疫苗接种计划:一项基于登记的观察性研究。柳叶刀。2021;398(10316):2084–92.doi:10.1016/s 0140-6736(21)02178-4。
24世卫组织资格预审(网站)(https://extranet.who.int/prequal/vaccines/p/馨可宁(Cecolin)r,于2023年11月17日访问)。
25郎库什卡,波拉斯克,席勒JT,罗德里格斯AC,希夫曼M,冈萨雷斯P等。哥斯达黎加疫苗试验小组。不同人乳头瘤病毒血清学和DNA标准对疫苗效力评估的影响。流行病学杂志。2014年9月15日;180(6):599-607.doi: 10.1093/aje/kwu168。
26 Lehtinen M,Paavonen J,Wheeler CM,Jaisamrarn U,GarlandSM,Castellsagué等人,人乳头瘤病毒PATRICIA研究小组。人乳头瘤病毒-16/18 AS04佐剂疫苗对3级或以上宫颈上皮内瘤样病变的总体疗效:一项随机双盲PATRICIA试验的4年研究结束分析柳叶刀肿瘤。2012年1月;13(1):89-99.
doi:10.1016/1470-2045(11)70286-8
27克耶尔·斯克、西古尔德森·K、伊弗森·OE、埃尔南德斯-阿维拉·M、惠勒·CM、佩雷兹·G等。四价人乳头瘤病毒(6/11/16/18型)疫苗对高度宫颈和外生殖器病变持续预防效果的汇总分析。癌症预防研究。2009年10月;2(10):868-78.doi: 10.1158/1940- 6207。CAPR 09-0031。
28世卫组织资格预审(网站)(https://extranet.who.int/prequal/vaccines/p/gardasil-9,于2023年11月17日访问)。
29在年轻女孩中进行的二价HPV疫苗(ceco Lin)3期试验。CinicalTrials.gov。
(https://clinicaltrials.gov/ct2/show/NCT04508309于2023年10月28日访问)。
30 Barnabas RV,Brown ER,Onono M,Bukusi EA,Njoroge B,Winer RL等. KEN SHE研究小组.肯尼亚青春期少女和年轻女性单剂量人乳头瘤病毒疫苗接种的有效性(KEN SHE研究):一项随机对照试验的研究方案。审判。2021年9月27日;22(1):661.doi: 10.1186/s13063-021-05608-8。
31 Baisley K、Kemp TJ、Kreimer AR、Basu P、Changalucha J、Hildesheim A等。坦桑尼亚(DoRIS)9-14岁女童接种一剂HPV疫苗与历史队列接种一剂HPV疫苗的比较:一项随机对照试验的免疫桥接分析。柳叶刀全球健康。2022年十月;10(10):e1485-e1493。doi:10.1016/s 2214-109 x(22)00306-0。
32马瑞兹,格雷P,本德M,埃里克森T,坎恩H,阿普特D等。二价或四价人乳头瘤病毒疫苗诱导的中和抗体的可持续性及其与疗效的相关性:一项综合随访分析
两项随机、双盲、多中心、3期试验。柳叶刀感染疾病。2021;21(10):1458–68.
doi: 10.1016/S1473-3099。
33世卫组织政策声明:多剂量小瓶政策(MDVP)。日内瓦:世界卫生组织;2014(https://apps . who . int/iris/bitstream/handle/10665/135972/世卫组织_IVB_14.07_eng.pdf,2月18日访问
2023).
34世卫组织保健产品政策和标准(https://www.who.int/teams/immunization-vaccines-and- 生物制品/基本免疫规划/供应链/温控链(ctc),10月30日前访问)
35本文件所载的建议是基于独立专家的建议,他们考虑了现有的最佳证据、风险效益分析和其他适当因素。本文件包括关于在剂型、剂量方案、人群或批准标签中未包括的其他使用参数中使用医药产品的建议。相关利益攸关方应熟悉适用的国家法律和道德要求。世卫组织不对任何用途的任何产品的采购、分销和/或管理承担任何责任。
36目前没有证据表明功效随时间推移而减弱。
37人类乳头瘤病毒疫苗:会议介绍和关键问题(2022年4月6日对世卫组织免疫战略咨询专家小组的PowerPoint演示)。日内瓦:世界卫生组织;2022(https://cdn . who . int/media/docs/default-source/immunization/position _ paper _ documents/human- 乳头瘤病毒-(HPV)/HPV-疫苗-会议-简介-关键-问题-2022年4月。pdf,已于2023年2月18日访问)。38获取疫苗市场信息(MI4A)疫苗采购数据库。日内瓦:世界卫生
组织(免疫、疫苗和生物制品(who.int),于2023年10月28日访问)。
39免疫联盟产品菜单。哥本哈根:联合国儿童基金会供应司(https://www.unicef.org/supply/documents/gavi- 产品菜单,2023年3月2日访问)。
40世卫组织宫颈癌预防和控制成本计算工具:人乳头瘤病毒疫苗接种模块。日内瓦:世界卫生组织(https://www . who . int/publications/m/item/世卫组织-宫颈癌-预防- 以及-控制-成本-工具-人乳头瘤病毒-疫苗接种-模块于2023年10月28日访问)。
41 HPV疫苗成本计算器。华盛顿州西雅图:路径(https://www . path . org/resources/HPV-vaccine-cost-calculator/,于2023年10月28日访问)。
42伯格EA,波特诺伊A,坎波斯NG,SyS,里根C,金JJ。选择最佳HPV疫苗:九价和二价人乳头瘤病毒疫苗在48个符合Gavi条件的国家的健康影响和经济价值。国际癌症杂志。
2021;148(4):932–40.doi: 10.1002/ijc.33233
43 Abbas KM,van Zandvoort K,Brisson M,Jit M .最新人口统计学、残疾权重和宫颈癌负担对全球、区域和国家人类乳头瘤病毒疫苗接种影响估计的影响
水平:一个主要的模型研究。柳叶刀全球健康。2020;8(4):e536–44。doi:10.1016/s 2214-109 x(20)30022-x
44全球市场研究:人乳头瘤病毒。日内瓦:世界卫生组织;2022(https://cdn.who.int/media/docs/default– 来源/immunity/mi4a/who-mi4a-global-market-study-HPV . pdf?SF vrsn = 649561 B3 _ 1 & download = true,
已于2023年2月18日访问)。
45 CAPACITI决策支持工具。日内瓦:世界卫生组织
(https://www . who . int/teams/immunization-vaccines-and-biologicals/immunization-analysis-and-insights/vaccine- 影响价值/经济评估/疫苗-
优先级#:~:text =决策% 2d支持% 20工具% 20具有% 20优先级% 20和% 20可信% 20建议 修正,于2023年10月28日访问)。
46世卫组织国家免疫战略(网站)。日内瓦:世界卫生组织
(https://www . who . int/teams/immunization-vaccines-and-biologicals/vaccine-access/planning-and-financing/NIS于2023年10月28日访问)。
国际标准书号978-92-4-008916-7(电子版)
ISBN 978-92-4-008917-4(印刷版)
世界卫生组织2024年
保留一些权利。本作品根据知识共享署名-非商业性使用-类似共享3.0 IGO许可协议(CC BY-NC-SA 3.0 IGO;https://creativecommons.org/licenses/by-nc-sa/3.0/igo).
根据本许可证的条款,您可以出于非商业目的复制、再分发和改编该作品,前提是该作品被适当引用,如下所示。在使用本作品时,不应暗示世卫组织认可任何特定的组织、产品或服务。不允许使用世卫组织标志。如果您改编作品,那么您必须在相同或等效的知识共享许可下许可您的作品。如果您创建了此作品的翻译,您应该在建议的引用中添加以下免责声明:“此译文不是由世界卫生组织(世卫组织)创作的。世卫组织不对本翻译的内容或准确性负责。英文原版为具有约束力的权威版本”。
任何与许可证引起的争议有关的调解应根据世界知识产权组织的调解规则进行http://www.wipo.int/amc/en/mediation/rules/.
建议引用。Considerations for human papillomavirus (HPV) vaccine product choice. Geneva: World Health Organization; 2024. Licence:CC BY-NC-SA 3.0 IGO.
Hits: 55

This design is steller! You certainly know how to keep a reader entertained.
Between yor wit and your videos, I was almost mooved to start my own blog (well,
almost…HaHa!) Excellent job. I really enjoyed what you had
to say, and more than that, how you presented it.
Too cool!
My website: https://vavadacasino.Populiser.com