第十一章:人乳头瘤病毒
医学博士,公共卫生硕士;朱丽安啧啧,MPH伊丽莎白·昂格尔博士,医学博士;和医学博士劳里·马科维茨
- 人乳头瘤病毒(HPV)
- 发病机理
- 临床特征
- 流行病学
- 美国的长期趋势
- 预防
- 人乳头瘤病毒疫苗
- 接种疫苗的禁忌症和注意事项
- 疫苗安全
- 疫苗储存和处理
- 人乳头瘤病毒感染的监测和报告
- 致谢
- 选定的参考文献
人乳头瘤病毒(HPV)是美国最常见的性传播感染。尽管大多数人乳头瘤病毒感染是无症状的,并会自然消退,但持续性感染可发展为男性和女性的肛门生殖器疣、癌前病变以及宫颈癌、肛门生殖器癌或口咽癌。宫颈癌和性行为之间的关系被怀疑了100多年,并在20世纪60年代由流行病学研究确定。在20世纪80年代早期,宫颈癌细胞被证明含有人乳头瘤病毒DNA。20世纪90年代发表的流行病学研究表明人乳头瘤病毒和宫颈癌之间存在一致的联系;最近,人乳头瘤病毒已被确定为某些其他粘膜癌的原因。预防感染四种人乳头瘤病毒病毒的四价疫苗于2006年在美国获得使用许可,二价疫苗于2009年获得许可,九价疫苗于2014年获得许可。
人类乳头瘤病毒(HPV)
- 小DNA病毒
- 已经确定了200多种类型
- 大多数人乳头瘤病毒类型感染皮肤上皮细胞,并可导致常见的皮肤疣
- 40种类型感染粘膜上皮
人类乳头瘤病毒类型与疾病关系
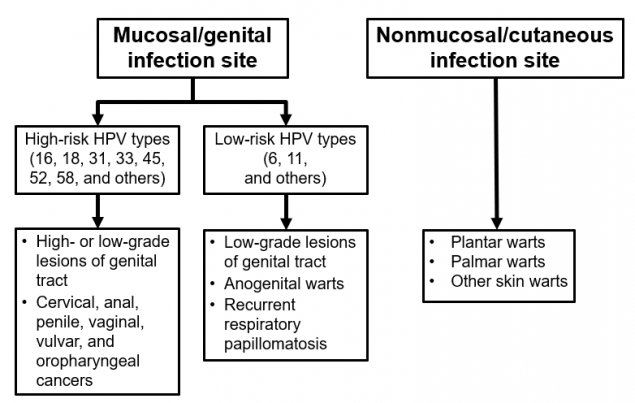
人乳头瘤病毒(HPV)
人乳头瘤病毒由一个感染上皮细胞的小型双链DNA病毒家族组成。已经确定了200多种不同的类型;它们通过它们的基因组序列来区分。大多数人乳头瘤病毒类型感染皮肤上皮细胞,并可导致常见的皮肤疣。约40种感染粘膜上皮;这些疾病根据其与宫颈癌的流行病学联系进行分类。
低风险或非致癌类型的感染,如6型或11型,可导致良性或低度宫颈细胞异常、肛门生殖器疣和呼吸道乳头状瘤。超过90%的肛门生殖器疣病例是由低风险的6型或11型人乳头瘤病毒病毒引起的。
高危或致癌的人乳头瘤病毒类型在宫颈癌和其他肛门生殖器癌症的发展中充当致癌物。高危类型(包括16型、18型和其他类型)可导致低度宫颈细胞异常、作为癌症前兆的高度宫颈细胞异常和肛门生殖器癌症。在99%的宫颈癌前病变中检测到高危人乳头瘤病毒类型。16型是全球约50%宫颈癌的原因,16型和18型合起来约占宫颈癌的66%。另外五种高危类型,31、33、45、52和58,导致另外15%的宫颈癌和11%的所有人乳头瘤病毒相关癌症。高危人乳头瘤病毒型感染被认为是宫颈癌发展的必要条件,但其本身不足以引发癌症。绝大多数感染人乳头瘤病毒病毒的女性,即使是那些高危的人乳头瘤病毒类型,也不会发展成癌症。
除了宫颈癌,高危人乳头瘤病毒感染还与不太常见的肛门生殖器癌有关,如外阴癌、阴道癌、阴茎癌和肛门癌。这些人乳头瘤病毒类型也能导致口咽癌。
发病机理
人乳头瘤病毒感染与宫颈癌的发病机制
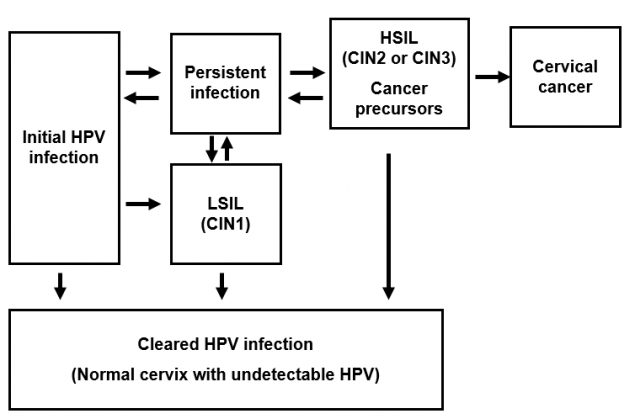
人乳头瘤病毒感染发生在基底上皮。虽然感染率很高,但大多数感染会在一两年内自行消失。一小部分感染者持续感染;持续感染是宫颈癌发展的最重要的风险因素。
在女性中,子宫颈鳞状上皮内病变(SIL)可以通过筛查检测出来。低度鳞状上皮内病变(LSIL)通常会消退。高度鳞状上皮内病变(HSIL)被认为是癌症的前兆。以前,这些类型的宫颈病变被称为宫颈上皮内瘤变(CIN)。如果不被发现和治疗,这些癌症前体可能在几年或几十年后发展成宫颈癌。
其他类型的人乳头瘤病毒相关癌症的发病机理可能遵循类似的过程,尽管对其各自的前驱病变知之甚少:肛门HSIL已被确定为肛门癌的前驱,外阴HSIL已被确定为外阴癌的前驱,阴道HSIL已被确定为阴道癌的前驱。
感染一种人乳头瘤病毒病毒并不能防止感染另一种病毒。在感染粘膜上皮的人乳头瘤病毒病毒感染者中,5%至30%感染了多种类型的病毒。
人乳头瘤病毒临床特征
- 大多数人乳头瘤病毒感染是无症状的,不会导致临床疾病
- 人乳头瘤病毒感染的临床表现包括:
- 肛门生殖器疣
- 复发性呼吸道乳头状瘤病
- 宫颈癌前兆(HSIL)
- 癌症(宫颈癌、肛门癌、阴道癌、外阴癌、阴茎癌和口咽癌)
临床特征
大多数人乳头瘤病毒感染是无症状的,不会导致临床疾病。人乳头瘤病毒感染的临床表现包括肛门生殖器疣、复发性呼吸道乳头状瘤病、癌症前体或癌症,包括宫颈癌、肛门癌、阴道癌、外阴癌、阴茎癌或口咽癌。
医疗管理
对于无症状的人乳头瘤病毒感染,不需要或不推荐特殊的治疗。建议对人乳头瘤病毒相关疾病的特定临床表现(如肛门生殖器疣、癌前病变或癌症)进行药物治疗。
实验室测试
人乳头瘤病毒不是用传统方法培养的。通过从临床标本中检测人乳头瘤病毒DNA来识别感染。人乳头瘤病毒检测的检测方法在灵敏度和类型特异性上有很大不同,检测也受取样解剖区域和标本收集方法的影响。
食品药品监督管理局(FDA)已经批准了几项人乳头瘤病毒测试,可以检测多达14种高危类型(人乳头瘤病毒16,18,31,33,35,39,45,51,52,56,58,59,66,68)。当检测到这些人乳头瘤病毒类型的任何组合存在时,检测结果被报告为阳性;某些测试专门识别人乳头瘤病毒16型和/或18型。这些检测被批准用于妇女宫颈癌筛查,作为初级筛查、细胞学联合检测或巴氏(Pap)检测异常宫颈细胞学结果的管理。人乳头瘤病毒试验既没有临床指征,也没有被批准用于男性。
人乳头瘤病毒的流行病学和基础研究通常使用核酸扩增方法,产生类型特异性结果。流行病学研究中最常用的聚合酶链反应(PCR)检测针对L1基因的遗传保守区域。
最常用的人乳头瘤病毒血清学试验是基于病毒样颗粒(VLP)的酶免疫试验。然而,用于这些检测的实验室试剂没有标准化,也没有为阳性结果设定阈值的标准。血清学结果不用于临床。
人乳头瘤病毒流行病学
- 宿主
- 人类
- 传播
- 直接接触,通常是性接触
- 时间模式
- 没有
- 传染性
- 假定为高
- 危险因素
- 性行为,包括一生中和最近性伴侣的数量增加
流行病学
出现
人乳头瘤病毒感染在世界各地极为普遍。大多数性活跃的成年人在他们一生中的某个时候都会感染人乳头瘤病毒病毒,尽管他们可能没有意识到自己被感染了。
宿主
人类是人乳头瘤病毒唯一的天然水库。乳头瘤病毒家族中的其他病毒会影响其他物种。
传播
人乳头瘤病毒病毒通过与感染者的亲密皮肤接触传播。传播最常见于阴道、阴茎、肛门或口交。
对新近获得的人乳头瘤病毒感染的研究表明,感染通常发生在首次性行为后不久。在一项对大学女性的前瞻性研究中,首次性交后24个月的累计感染率为40%,10%的感染是由人乳头瘤病毒16型引起的。
可以发生从一个身体部位到另一个身体部位的自体接种。
非常罕见的是,人乳头瘤病毒病毒从受感染母亲到婴儿的垂直传播会导致一种称为青少年发作的复发性呼吸道乳头状瘤病的疾病。
时间模式
人乳头瘤病毒感染没有已知的季节性变化。
传染性
人乳头瘤病毒病毒被认为在急性和持续性感染中都具有传染性。由于每年估计会发生大量新的感染,可以认为传染性很高。
危险因素
感染人乳头瘤病毒病毒的风险因素主要与性行为有关,包括终生和近期性伴侣数量增加。其他危险因素的流行病学研究结果不太一致,包括开始性行为的年龄较小、怀孕次数较多、遗传因素、吸烟和男性伴侣未进行包皮环切术。
人乳头瘤病毒在美国的长期趋势
- 生殖器人乳头瘤病毒是美国最常见的性传播感染
- 常见于青少年和年轻人
- 在引入疫苗之前
- 估计有7900万人被感染
- 1400万新感染/年
- 在疫苗引入后的10年内,6型、11型、16型和18型人乳头瘤病毒病毒的流行率已经下降:
- 14至19岁女性中86%
- 在20至24岁的女性中占71%
美国的长期趋势
生殖器人乳头瘤病毒感染是美国和全世界最常见的性传播感染。
根据2003-2006年(疫苗引入之前)的数据,估计美国有7900万人受到感染。每年约有1400万新人乳头瘤病毒感染病例,其中近一半发生在15至24岁的人群中。在2013年至2014年期间,在18至59岁的美国男性中,37种人乳头瘤病毒类型中任何一种的生殖器患病率为45.2%,高危人乳头瘤病毒类型的患病率为25.1%。同样在此期间,在同一年龄段的美国妇女中,37种人乳头瘤病毒型中任何一种的生殖器患病率为39.9%,高危人乳头瘤病毒型的患病率为20.4%。在美国于2006年引入四价HPV疫苗后的十年内,人乳头瘤病毒6型、11型、16型和18型的患病率在14至19岁的女性中下降了86%,在20至24岁的女性中下降了71%。
国家癌症研究所(NCI)的监测、流行病学和最终结果(SEER)计划和CDC的国家癌症登记计划提供了美国人乳头瘤病毒癌症数量的数据。平均每年报告43,999例人乳头瘤病毒相关癌症,其中女性24,886例,男性19,113例。从性别来看,人乳头瘤病毒最常见的癌症是女性的10,900例宫颈癌和男性的11,300例口咽癌。
除了91%的宫颈癌之外,人乳头瘤病毒还导致约91%的肛门癌、69%的外阴癌、75%的阴道癌、63%的阴茎癌和70%的口咽癌。
根据美国的健康声明数据,2004年(引入疫苗之前)肛门生殖器疣的发病率为每1000名女性1.2例,每1000名男性1.1例。在2003年至2010年期间,在15岁至24岁的美国女性中观察到肛门生殖器疣患病率下降,该群体最有可能受到HPV疫苗接种的影响。到2014年,年轻男性的肛门生殖器疣患病率也有所下降。
从2008年至2015年,18至24岁女性的CIN2级或更差(CIN2+)率和宫颈癌筛查率均下降。在该年龄组接受筛查的女性中,CIN2+比率显著下降,这与人乳头瘤病毒疫苗接种对人群水平的影响一致。
在2019年13至17岁的青少年中,71.5%的人接种了至少1剂HPV疫苗,54.2%的人接种了最新的人乳头瘤病毒疫苗(包括在15岁前开始接种2剂HPV疫苗系列的青少年,或在推荐的时间间隔内接种了3剂)。在女性中,73.2%接种过至少1剂HPV疫苗,56.8%接种过人乳头瘤病毒疫苗。在男性中,69.8%的人接种过至少1剂HPV疫苗,51.8%的人接种过人乳头瘤病毒疫苗。这些覆盖率估计值中的每一个都代表了从2018年起人乳头瘤病毒疫苗接种覆盖率的统计显著增加。
宫颈癌筛查
- 不建议普通风险人群进行年度宫颈癌筛查
- 对于21至29岁的人群,每3年进行一次细胞学筛查
- 对于30至65岁的人群,可选择每3年进行一次细胞学检查,每5年单独进行一次人乳头瘤病毒检查,或每5年进行一次细胞学检查加人乳头瘤病毒检查
- USPSTF和ACOG有类似的筛选建议;ACS建议,对于一般风险人群,筛查从25岁开始。
- 人乳头瘤病毒疫苗接种并不能消除宫颈癌筛查的必要性
预防
接种疫苗可以预防人乳头瘤病毒感染,通过预防人乳头瘤病毒病毒的传播,使接种疫苗的人和他们未来的性伴侣都受益。通过坚持和正确使用避孕套等物理屏障,可以减少但不能消除人乳头瘤病毒病毒的传播。
宫颈癌筛查
大多数宫颈癌病例和死亡都可以通过筛查和治疗来预防。巴氏试验检测由卫生保健提供者收集并放置在载玻片(常规巴氏试验)或液体培养基(液基细胞学)上的宫颈细胞中的癌前病变。人乳头瘤病毒的临床检验可单独或与细胞学联合(共检验)用作初步筛查,或在细胞学结果可疑后用作分类。
美国宫颈癌筛查的建议基于主要医疗和其他组织的系统证据审查,包括美国预防服务工作组(USPSTF)、美国癌症协会(ACS)和美国妇产科医师学会(ACOG)。不建议普通风险人群每年进行宫颈癌筛查。相反,从21岁到29岁,建议每3年进行一次细胞学检查。在30至65岁之间,建议选择每3年进行一次细胞学检查,每5年单独进行一次人乳头瘤病毒检查,或每5年进行一次细胞学检查加人乳头瘤病毒检查(联合检查)。联合检测可以通过收集一个样品用于细胞学检测,另一个用于人乳头瘤病毒检测,或者通过使用剩余的液体细胞学材料用于人乳头瘤病毒检测来进行。宫颈筛查项目应该以与未接种疫苗者相同的方式筛查已接种人乳头瘤病毒疫苗者。对于处于平均风险的人群,不建议在21岁之前进行筛查。对于30至65岁的人群,USPSTF更倾向于单独进行细胞学检查或初级人乳头瘤病毒检测,但联合检测也可作为一种替代方法。USPSTF和ACOG也有类似的筛查建议。ACS建议,对于一般风险人群,筛查从25岁开始。
人乳头瘤病毒疫苗
- 9vHPV (Gardasil 9)已获得许可,目前在美国销售。
- 防止人乳头瘤病毒病毒6、11、16、18、31、33、45、52、58型
- 4vHPV和2vHPV已获得许可,但目前未在美国销售。
- 4vHPV预防6型、11型、16型和18型人乳头瘤病毒病毒
- 2vHPV预防16、18型人乳头瘤病毒病毒
人乳头瘤病毒疫苗接种不能消除持续宫颈癌筛查的需要,因为高达30%的宫颈癌是由四价或二价疫苗不能预防的人乳头瘤病毒型引起的,15%的宫颈癌是由9价疫苗不能预防的人乳头瘤病毒型引起的。
人乳头瘤病毒疫苗
一种9价重组蛋白亚单位HPV疫苗(9vHPV,Gardasil 9)获准使用,目前在美国销售。另外两种人乳头瘤病毒疫苗仍在美国获得许可,但目前尚未分发:四价HPV疫苗(4vHPV,Gardasil)和二价HPV疫苗(2vHPV,Cervarix)。所有的疫苗都可以预防高风险的16型和18型人乳头瘤病毒病毒感染,这两种病毒是导致大多数宫颈癌和其他人乳头瘤病毒癌症的原因;9vHPV疫苗还可以预防另外五种高危类型的感染。此外,4vHPV和9vHPV疫苗可预防导致肛门生殖器疣的6型和11型人乳头瘤病毒病毒感染。
HPV疫苗特性
- 人乳头瘤病毒L1病毒的主要衣壳蛋白是用于免疫的抗原
- 利用重组技术生产L1蛋白
- L1蛋白自组装成病毒样颗粒(VLP)
- VLPs是非传染性和非致癌性的
- 通过肌肉注射接种
- 9vHPV含有酵母蛋白
- 9vHPV含有铝佐剂
特征
人乳头瘤病毒疫苗的抗原是人乳头瘤病毒的L1主要衣壳蛋白,通过使用重组DNA技术产生。L1蛋白自我组装成非感染性、非基因单位,称为病毒样颗粒(VLPs)。L1蛋白通过发酵生产,使用酿酒酵母酵母;9vHPV疫苗含有酵母蛋白。9vHPV疫苗包含九种人乳头瘤病毒病毒类型的VLP:两种导致肛门生殖器疣的类型(人乳头瘤病毒6型和11型)和七种可能导致癌症的类型(人乳头瘤病毒16型、18型、31型、33型、45型、52型和58型)。9vHPV疫苗通过肌肉注射给药。每剂9vHPV疫苗都含有铝作为佐剂。它不含抗生素或防腐剂。
疫苗接种计划和使用
HPV疫苗建议
- 建议11岁或12岁(最小年龄为9岁)的女性和男性进行常规疫苗接种
- 建议所有26岁以下未充分接种疫苗的人接种补充疫苗
- 不建议所有26岁以上的成年人接种疫苗
- 建议27至45岁的一些成年人共享临床决策
- 未授权给45岁以上的成年人
建议11岁或12岁的女性和男性接种人乳头瘤病毒疫苗,以预防人乳头瘤病毒感染和人乳头瘤病毒相关疾病,包括某些癌症。疫苗接种系列可以从9岁开始。建议26岁以下未充分接种疫苗的所有人接种人乳头瘤病毒疫苗。人乳头瘤病毒疫苗接种正在迎头赶上不推荐给所有26岁以上的成年人,因为在这个年龄范围内接种疫苗的公共健康益处是最小的。人乳头瘤病毒疫苗未被批准用于45岁以上的人群。
根据初始年龄和医疗条件,人乳头瘤病毒疫苗分为2剂或3剂系列。
对于在15岁之前接受第一次有效剂量的人,建议使用2剂量系列(某些免疫功能低下者除外)。第二次也是最后一次接种应在第一次接种后6至12个月进行(0、6-12个月计划)。如果在第一次接种后至少5个月才给予第二次接种,则可视为有效。如果第2次接种间隔较短,则应在第2次接种后至少12周和第1次接种后至少6至12个月再接种一次。
人乳头瘤病毒疫苗接种时间表
- 2剂系列
- 对于在15岁生日前接受首剂有效剂量的免疫活性人士
- 0,6-12个月计划
- 最小间隔为5个月
- 3剂系列
- 对于在15岁生日当天或之后接受首剂有效剂量的人
- 对于患有原发性或继发性免疫功能低下疾病的人
- 0,1-2,6个月计划
- 如果计划中断,系列不需要重启
- 不推荐接种前评估
- 对现有的人乳头瘤病毒感染、肛门生殖器疣或人乳头瘤病毒相关病变无治疗效果
对于在15岁生日当天或之后接受第一剂有效剂量的人,以及患有可能降低细胞介导或体液免疫的原发性或继发性免疫低下疾病的人,如B淋巴细胞抗体缺陷、T淋巴细胞完全或部分缺陷、人类免疫缺陷病毒(HIV)感染、恶性肿瘤、移植、自身免疫性疾病或免疫抑制治疗,其中对疫苗接种的免疫反应可能减弱,建议使用3剂系列。在3次接种方案中,第2次接种应在第1次接种后1至2个月进行,第3次接种应在第1次接种后6个月进行(0、1–2、6个月方案)。
剂量之间没有最大间隔。如果人乳头瘤病毒疫苗接种计划中断,疫苗系列不需要重新开始。对于15岁前已接种1剂HPV疫苗的人,现在年龄为15岁或以上,2剂系列被认为是足够的。如果在第1次接种后该系列被中断,则应尽快给药第2次接种。
对于有性虐待或性侵犯史的儿童,建议从9岁开始进行常规人乳头瘤病毒疫苗接种。
理想情况下,应在通过性接触暴露于人乳头瘤病毒病毒之前接种疫苗。然而,处于常规和追赶年龄范围(26岁以下)的人应该接种疫苗,即使他们过去可能接触过人乳头瘤病毒。
对于已经感染了一种或多种HPV疫苗类型的性活跃人群来说,接种疫苗提供的益处较少。然而,人乳头瘤病毒疫苗接种可以针对尚未获得的HPV疫苗类型提供保护。接受者可能被告知,预防性疫苗预计不会对现有的人乳头瘤病毒感染、肛门生殖器疣或人乳头瘤病毒相关病变产生治疗效果。
HPV疫苗应与其他适龄疫苗(如Tdap和四价脑膜炎球菌结合疫苗)在同一就诊时间进行接种。在一次就诊中接种所有指定的疫苗增加了患者按时接种每种疫苗的可能性。每种疫苗应在不同的解剖部位使用单独的注射器进行注射。
建议26岁以下的儿童接种疫苗。在这个年龄以上,对于年龄在27岁到45岁之间没有充分接种人乳头瘤病毒疫苗的一些成年人,建议共享临床决策。人乳头瘤病毒疫苗不需要与大多数26岁以上的成年人讨论;临床医生可以考虑与最有可能受益的人讨论人乳头瘤病毒疫苗接种。
关于27至45岁成人人乳头瘤病毒疫苗接种的共同临床决策考虑因素包括:
- 人乳头瘤病毒是一种非常常见的性传播感染。大多数人乳头瘤病毒感染是短暂的,无症状的,不会引起临床问题。
- 虽然新人乳头瘤病毒感染最常见于青少年和年轻成年人,但一些成年人也有感染新人乳头瘤病毒的风险。在任何年龄,有新的性伴侣都是感染新人乳头瘤病毒病毒的风险因素。
- 处于长期、相互一夫一妻制性伙伴关系中的人不太可能感染新的人乳头瘤病毒病毒。
- 大多数性活跃的成年人都接触过一些人乳头瘤病毒病毒,尽管不一定接触过疫苗接种所针对的所有人乳头瘤病毒病毒。
- 没有临床抗体测试可以确定一个人是否已经免疫或仍然对任何给定的人乳头瘤病毒类型易感。
- 在接种疫苗前没有接触过疫苗型人乳头瘤病毒的人群中,HPV疫苗的效力很高。
- 在具有人乳头瘤病毒病毒感染或疾病风险因素的人群中(例如,有多个终身性伴侣的成年人,并且可能以前感染过疫苗型人乳头瘤病毒病毒),以及在具有某些免疫妥协状况的人群中,疫苗有效性可能较低。
- 人乳头瘤病毒疫苗是预防性的(即,它们预防新的人乳头瘤病毒感染)。它们不能防止人乳头瘤病毒感染发展成疾病,减少清除人乳头瘤病毒感染的时间,或治疗人乳头瘤病毒相关疾病。
不需要接种前评估(例如,任何种类的人乳头瘤病毒检测、宫颈癌筛查或巴氏检测、妊娠检测或“处女检测”)。不建议通过接种前检测(如巴氏试验或人乳头瘤病毒试验)来确定人乳头瘤病毒疫苗接种的适宜性。
免疫实践咨询委员会(ACIP)没有优先推荐任何许可的人乳头瘤病毒疫苗。ACIP没有建议对已经完成了一系列其他推荐的人乳头瘤病毒疫苗的人进行额外的9vHPV疫苗接种。
疫苗接种者在接种疫苗期间应始终坐着。因为晕厥有时被报道与人乳头瘤病毒疫苗接种有关,临床医生应考虑在疫苗接种后观察受者15分钟。
HPV疫苗效力
- 高疫苗效力
- 超过98%的接受者在完成该系列后的一个月内产生了针对所涵盖的人乳头瘤病毒类型的抗体反应
- 没有证据表明对参与者在接种疫苗时感染的疫苗类型引起的疾病有效
- 先前感染一种人乳头瘤病毒型病毒不会降低疫苗对抗其他人乳头瘤病毒型病毒的效力
免疫原性和疫苗效力
HPV疫苗的免疫原性很强。在完成系列疫苗接种后的一个月内,超过98%的受试者产生了针对每种人乳头瘤病毒病毒的抗体反应。然而,没有已知的保护作用的血清学相关性,也没有确定保护作用所需的最低抗体滴度。临床试验中发现的高功效排除了这一阈值的识别。对接种人群的进一步随访可能有助于确定未来保护作用的血清学相关性。
所有许可的人乳头瘤病毒疫苗对预防HPV疫苗类型相关的持续感染、CIN2+和原位腺癌(AIS)都具有高效性。许可前,在III期临床试验中评估了4vHPV的临床疗效。迄今为止,持续监测表明,疫苗有效性保持在90%以上,免疫接种后至少10至12年内免疫力没有减弱。
尽管在临床试验中,在没有证据表明以前感染过HPV疫苗类型的人中证明了高效性,但是没有证据表明对参与者在接种疫苗时已经感染的疫苗类型引起的疾病有效(即,疫苗对现有的感染或疾病没有治疗效果)。接种疫苗前感染一种或多种HPV疫苗类型的参与者受到保护,免受由其他疫苗类型引起的疾病。先前感染一种人乳头瘤病毒病毒类型不会降低疫苗对其他HPV疫苗类型的效力。
HPV疫苗的禁忌症和注意事项
- 禁忌症
- 对疫苗成分或前一剂疫苗后出现严重过敏反应
- 酵母速发型过敏反应史(仅4vHPV和9vHPV)
- 对乳胶过敏(仅2vHPV)
- 预防
- 中度或重度急性疾病(推迟至症状改善时)
接种疫苗的禁忌症和注意事项
与其他疫苗一样,对疫苗成分的严重过敏反应(过敏反应)史或前一剂量后是进一步剂量的禁忌症。患者的中度或重度急性疾病(伴有或不伴有发热)被认为是接种疫苗的预防措施,尽管患有轻微疾病的人也可以接种疫苗。
4vHPV和9vHPV都是使用酿酒酵母(面包酵母),因此对有酵母速发型过敏反应史的人禁用。2vHPV不应用于对乳胶过敏的人,因为预装注射器的顶端盖帽中可能含有乳胶。
怀孕期间接种疫苗
怀孕期间接种人乳头瘤病毒疫苗
- 系列疫苗的接种应推迟到妊娠结束后
- 如果在开始系列疫苗接种后发现妇女怀孕,剩余剂量应推迟至怀孕后
- 如果在怀孕期间注射了疫苗,则没有干预的指征
- 怀孕期间接种疫苗的妇女应向制造商报告
- 接种疫苗前不需要验孕
不建议在怀孕期间使用人乳头瘤病毒疫苗。如果一个人在开始系列疫苗接种后被发现怀孕,则该系列疫苗接种的剩余时间应推迟到怀孕后。如果在怀孕期间注射了疫苗,就不需要干预。接种疫苗前不需要验孕。
9vHPV的制造商已经建立了妊娠登记处。鼓励在受孕期间或怀孕期间接触过该疫苗的妇女致电1-800-986-8999(merckpregnancyregistries . com/gardasil 9 . html)进行登记。
哺乳期或哺乳期的人可以接种HPV疫苗。
疫苗安全
HPV疫苗通常耐受性良好。通过许可前试验和许可后监测和评估,安全性已经得到了很好的确立。
HPV疫苗安全性
- HPV疫苗通常耐受性良好
- 局部反应(疼痛、发红、肿胀)
- 20%-90%
- 发烧(100℉)
- 10%-13%(类似于安慰剂接受者的报告)
- 过敏反应是罕见的,但可以发生
- 没有其他与任何HPV疫苗相关的严重不良反应
人乳头瘤病毒疫苗临床试验期间报告的最常见的不良反应是注射部位的局部反应。在许可前临床试验中,20%至90%的受试者报告了局部反应,如疼痛、发红或肿胀。10%至13%的HPV疫苗接种者报告接种后15天内温度为100℉。相似比例的安慰剂接受者报告体温升高。局部反应的频率通常随着剂量的增加而增加。然而,发热的报告并没有随着剂量的增加而显著增加。虽然罕见,过敏反应可以发生。根据CDC和FDA的监测,没有其他严重的不良事件与任何HPV疫苗显著相关。
疫苗接种者报告了疫苗接种后的各种全身不良事件,包括恶心、头晕、肌痛和不适。然而,这些症状在疫苗和安慰剂接受者中出现的频率相似。
对疫苗不良事件报告系统(VAERS)报告的许可后监测未发现任何意外不良事件,与许可前临床试验的数据一致,并支持9vHPV的安全性数据。疫苗安全数据链在2015-2017年期间监测了约839,000剂9vHPV后,没有发现任何新的安全问题。
因为有时会有晕厥的报道,所以疫苗接种者在接种疫苗时应该一直坐着。临床医生应考虑在接种疫苗后观察受者15分钟。
疫苗储存和处理
人乳头瘤病毒疫苗应保存在2℃至8℃(36℉至46℉)的冰箱中。制造商包装说明书包含附加信息。关于疫苗储存和处理的最佳实践和建议的完整信息,请参考CDC的疫苗储存和处理工具包[3 MB,65页].
人乳头瘤病毒感染的监测和报告
人乳头瘤病毒感染不是一个全国性的通知条件。有关参与疫苗可预防疾病监测活动的州和地方卫生部门工作人员指南的信息,请查阅疫苗可预防疾病监测手册。
致谢
编辑们感谢瓦莱丽·莫雷利、金吉儿·雷德蒙和莫娜·萨拉亚对本章的贡献。
选定的参考文献
CDC. Human papillomavirus vaccination for adults: updated recommendations of the Advisory Committee on Immunization Practices. MMWR 2019;68(32):698–702.
CDC. Human papillomavirus vaccination: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2014;63(RR-05):1–30.
CDC. Use of a 2-dose schedule for human papillomavirus vaccination—updated recommendations of the Advisory Committee on Immunization Practices. MMWR 2016;65(49):1405–8.
CDC. Use of 9-valent human papillomavirus (HPV) vaccine: updated HPV vaccination recommendations of the Advisory Committee on Immunization Practices. MMWR 2015;64(11):300–4.
Curry S, Krist A, Owens D, et al.; US Preventive Services Task Force. Screening for cervical cancer: US Prevention Services Task Force recommendation statement. JAMA 2018;320(7):674–86.
Donahue J, Kieke B, Lewis E, et al. Near real-time surveillance to assess the safety of the 9-valent human papillomavirus vaccine. Pediatrics 2019 Dec:144(6):e20191808.
Drolet M, Bénard É, Pérez N, et al; Vaccination Impact Study Group. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis. Lancet 2019;394(10197):497–509.
Fontham E, Wolf A, Church T, et al. Cervical cancer screening for individuals at risk: 2020 guidelines update from the American Cancer Society. Cancer J Clin 2020;1–26.
Food and Drug Administration. Prescribing information (package insert). Gardasil 9 (human papillomavirus 9-valent vaccine, recombinant). Silver Spring, MD: U.S. Department of Health and Human Services, Food and Drug Administration; 2020. Accessed September 10, 2020.
FUTURE II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med 2007;356(19):1915–27.
Gargano J, Park I, Griffin M, et al. Trends in high-grade cervical lesions and cervical cancer screening in 5 states, 2008–2015. Clin Infect Dis 2019;68(8):1282–91.
Garland S, Hernandez-Avila M, Wheeler C, et al; Females United to Unilaterally Reduce Endo/Ectocervical Disease (FUTURE) I Investigators. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med 2007;356(19):1928–43.
Giuliano A, Palefsky J, Goldstone S, et al. Efficacy of quadrivalent HPV vaccine against HPV infection and disease in males. N Engl J Med 2011;364(5):401–11.
Iverson O, Miranda M, Ulied A, et al. Immunogenicity of the 9-valent HPV vaccine using 2-dose regimens in girls and boys vs a 3-dose regimen in women. JAMA 2016;316(22):2411–21.
Joura E, Giuliano A, Iversen O, et al. Broad Spectrum HPV Vaccine Study. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med 2015;372(8):711–23.
Kjaer S, Nygárd M, Dillner J, et al. A 12-year follow-up on the long-term effectiveness of the quadrivalent human papillomavirus vaccine in 4 Nordic countries. Clin Infect Dis 2018;66(3):339–45.
McClung N, Lewis R, Gargano J, et al. Declines in vaccine-type human papillomavirus prevalence in females across racial/ethnic groups: data from a national survey. J Adolesc Health 2019;65(6):715–22.
Moreira E Jr., Block S, Ferris D, et al. Safety profile of the 9-valent HPV vaccine: a combined analysis of 7 phase III clinical trials. Pediatrics 2016;138(2):e20154387.
Muñoz N, Bosch F, de Sanjosé S, et al; International Agency for Research on Cancer Multicenter Cervical Cancer Study Group. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003;348(6):518–27.
Owusu-Edusei K Jr., Chesson H, Gift T, et al. The estimated direct medical cost of selected sexually transmitted infections in the United States, 2008. Sex Transm Dis 2013;40(3):197–201.
Palefsky J, Giuliano A, Goldstone S, et al. HPV vaccine against anal HPV infection and anal intraepithelial neoplasia. N Engl J Med 2011;365(17):1576–85.
Phillips A, Patel C, Pillsbury A, et al. Safety of human papillomavirus vaccines: an updated review. Drug Saf 2018;41(4):329–46.
Satterwhite C, Torrone E, Meites E, et al. Sexually transmitted infections among US women and men: prevalence and incidence estimates, 2008. Sex Transm Dis 2013;40(3):187–93.
Senkomago V, Henley S, Thomas C, et al. Human papillomavirus-attributable cancers—United States, 2012–2016. MMWR 2019;68(33):724–8.
Shimabukuro T, Su J, Marques P, et al. Safety of the 9-valent human papillomavirus vaccine. Pediatrics. 2019;144(6):e20191791.
Winer R, Lee S, Hughes J, et al. Genital human papillomavirus infection incidence and risk factors in a cohort of female university students. Am J Epidemiol 2003;157(3):218–26.
上次审阅的页面:2021年8月18日
内容来源:国家免疫和呼吸疾病中心




