第18a章:人类乳头瘤病毒(HPV)
疾病
人乳头瘤病毒(HPV)是一种双链DNA病毒,感染鳞状上皮,包括上呼吸道和肛门生殖道的皮肤和粘膜。大约有100种人乳头瘤病毒,其中约40种感染生殖道(McCance,2004)。虽然大多数感染是无症状和自限性的,但人乳头瘤病毒的生殖器感染与男性和女性的生殖器疣和肛门生殖器癌有关。根据与癌症发展的关系,人乳头瘤病毒病毒被分为“高风险”或“低风险”类型。
生殖器HPV通过与受感染个体的性接触传播,主要通过性交。因此,暴露的风险与性伴侣的数量、新性伴侣的介绍以及任何性伴侣的性历史有关。基于人乳头瘤病毒DNA检测的人乳头瘤病毒感染事件的研究表明,至少一种类型的人乳头瘤病毒感染的获得通常发生在初次性行为后不久,几乎40%的女性在两年内被感染((Winer et al., 2003; Winer et al.,2008)。多种类型的感染很常见(Cuschieri et al., 2004)。
避孕套的使用减少了但并没有消除性传播的风险。人乳头瘤病毒病毒的非性传播途径包括从母亲到新生儿的垂直传播。
人乳头瘤病毒被认为是宫颈癌的必要原因,并且在超过99%的宫颈癌中可检测到高危人乳头瘤病毒型的持续感染(Walboomers et al.,1999; Bouvard et al., 2009; WHO IARC, 2007)(包括 31、33、35、39、45、51、52、56、58、59和68型)。在这些高危类型中,在欧洲所有宫颈癌中,HPV16几乎占60%,HPV18占15%以上(Smith et al., 2007)。另有11种高危类型被描述过(WHO IARC, 2007)。除了宫颈癌,人乳头瘤病毒还与其他部位不太常见的癌症有因果关系,包括外阴、阴道、阴茎和肛门癌,以及一些头颈癌(Parkin., 2011; Stanley., 2007; Psyrri et al., 2008; WHO IARC, 2012; Giuliano et al., 2015)。
人类乳头瘤病毒(HPV)
大多数人乳头瘤病毒感染是短暂的,不会引起临床问题。大约70%的新感染将在一年内清除,大约90%将在两年内清除(Ho et al., 1998; Franco et al., 1999; Winer et al., 2011)。高危人乳头瘤病毒型的持续感染是宫颈癌前病变和癌性病变发展的最重要的致病因素。与其他高危类型相比,16型和18型人乳头瘤病毒病毒感染更常见。人乳头瘤病毒感染和癌前病变发展之间的时间跨度从1年到10年不等,对于浸润性癌症的发展更长(Moscicki et al., 2006)。
其他部位的人乳头瘤病毒相关癌症的自然史还不太清楚。虽然高危人乳头瘤病毒感染是阴道或外阴病变发展的危险因素,但与宫颈癌不同,只有大约40%与人乳头瘤病毒感染有关(Munozet al., 2006)。人乳头瘤病毒感染与80-90%的所有肛门鳞状细胞癌相关,并且在大多数人乳头瘤病毒相关的肛门癌中发现了人乳头瘤病毒16型和18型(Munozet al., 2006)。大约50%的阴茎癌病例可归因于人乳头瘤病毒感染(de Martel,2017)。众所周知,人乳头瘤病毒也是口咽癌的一个原因,尽管对其归因比例的估计差异很大,从6%到71%不等(Stein et al., 2015)。这种大范围可能是由于1)口咽和扁桃体癌与其他亚部位的区别的准确性;2)吸烟或嚼烟的竞争效应;以及3)组织活检的质量和使用的人乳头瘤病毒检验协议(WHO IARC, 2012; Plumber et al., 2016)。女性中人乳头瘤病毒16/18型相关口咽癌的患病率低于男性。一项对人乳头瘤病毒患病率研究的系统综述估计,总体而言,47%的口咽癌病例与人乳头瘤病毒相关(所有年龄的男性和女性合并)(Kreimer et al., 2005),但据报道,北美男性和女性中人乳头瘤病毒型16/18的患病率分别为66%和53%(Steinau et al., 2014)。一项英国研究估计口咽癌的归因比例为52% (Schache et al., 2016)。对于所有位点,人乳头瘤病毒16型比其他人乳头瘤病毒型的因果关系最强,大多数人乳头瘤病毒相关癌症与16型相关。
低风险人乳头瘤病毒型是生殖器疣的原因,这是英国最常见的病毒性性传播感染(Public Health England (PHE), 2019)。人乳头瘤病毒6型和11型导致大约90%的所有生殖器疣(Lacey et al.,2006; Garland et al., 2007; Hawkins et al., 2013)。生殖器疣在初次感染后三周到八个月出现(最常见的是两到三个月)(Oriel,1971)。在没有治疗的情况下,高达30%的个体在短期内清除了感染(Tyring et al., 1998; Edwards et al., 1998)。长期自发消退的速率尚不清楚。治疗集中于去除疣,但不一定消除感染,感染可能持续亚临床状态,并且是复发和持续病毒传播的来源。生殖器疣不会危及生命,但会导致严重的发病率。人乳头瘤病毒6型和11型感染还会导致喉乳头状瘤(Stamataki et al., 2007),这是一种上呼吸道感染。
疾病的历史和流行病学
人乳头瘤病毒感染的流行病学
由于高比例的无症状感染、不同病毒类型的不同表现以及感染和发病之间的长时间间隔,人乳头瘤病毒的监测是复杂的。在2008年引入人乳头瘤病毒疫苗接种规划之前,关于高危人乳头瘤病毒感染流行率的信息可从大型横断面研究中获得。一项英国血清流行病学研究(2002-2004年收集的血清,在引入人乳头瘤病毒疫苗接种之前)在一个未选择的人群中显示,人乳头瘤病毒感染在14岁以下的女孩中非常罕见,但从十几岁开始急剧上升。在10至29岁的妇女中,分别有11%、3%、12%和5%的人有被感染的血清学证据分别被人乳头瘤病毒病毒6型、11型、16型或18型感染(Jit et al., 2007)。
一项对2007-2009年进行常规宫颈筛查的妇女的研究发现,在接受宫颈筛查的25-29岁妇女中,有29%存在当前高危人乳头瘤病毒感染的证据(由人乳头瘤病毒DNA的存在表明),30岁后患病率随着年龄的增加而下降。任何人乳头瘤病毒类型的患病率,特别是人乳头瘤病毒16或18,在细胞学异常的妇女中较高(Howell-Jones et al., 2010)。
人类乳头瘤病毒(HPV)
一项对参加伦敦性健康诊所的18-40岁男男性接触者的横断面研究表明,四分之一(25.1%)有证据表明感染了四价疫苗(HPV16,18,6和11)中的一种人乳头瘤病毒病毒,7.4%有两种或三种类型,没有人有所有四种类型。高风险的16型和18型人乳头瘤病毒疫苗(用于二价疫苗)的流行率为17% (King et al., 2015)。
人乳头瘤病毒相关癌症的流行病学
宫颈癌仍然是全球女性中最常见的癌症之一,2018年估计有570,000例新病例和311,000例死亡(Arbyn et al., 2020)。虽然人乳头瘤病毒疫苗可以预防感染和随后的疾病,但宫颈癌的二级预防可以通过子宫颈筛查早期发现子宫颈异常来实现。在英国,通过协调呼叫和召回引入了一个全国子宫颈筛查项目,这是宫颈癌发病率和死亡率大幅下降的原因。据估计,1974年至2004年间,由于宫颈筛查,英国的死亡率下降了约60%(Peto et al., 2004)。
2017年,英格兰共诊断出2,591例新的浸润性宫颈癌病例(National Statistics, 2019)。宫颈癌发病率的高峰出现在30-34岁的妇女中,第二个较小的高峰出现在80多岁的妇女中(即妇女一生中不太可能受益于宫颈癌筛查;图1)。老年妇女仍然面临风险,50%以上的新诊断病例发生在40岁以上的妇女中,15%以上发生在65岁以上的妇女中。在英国,在未接种疫苗的队列中,患宫颈癌的终生风险估计为1/142(终生风险估计值由英国癌症研究统计信息小组根据国家统计局2016年计算)(Smittenaar et al., 2016)。在英国,大约三分之一的女性在诊断为浸润性宫颈癌的五年内死亡(National Statistics, 2011)。
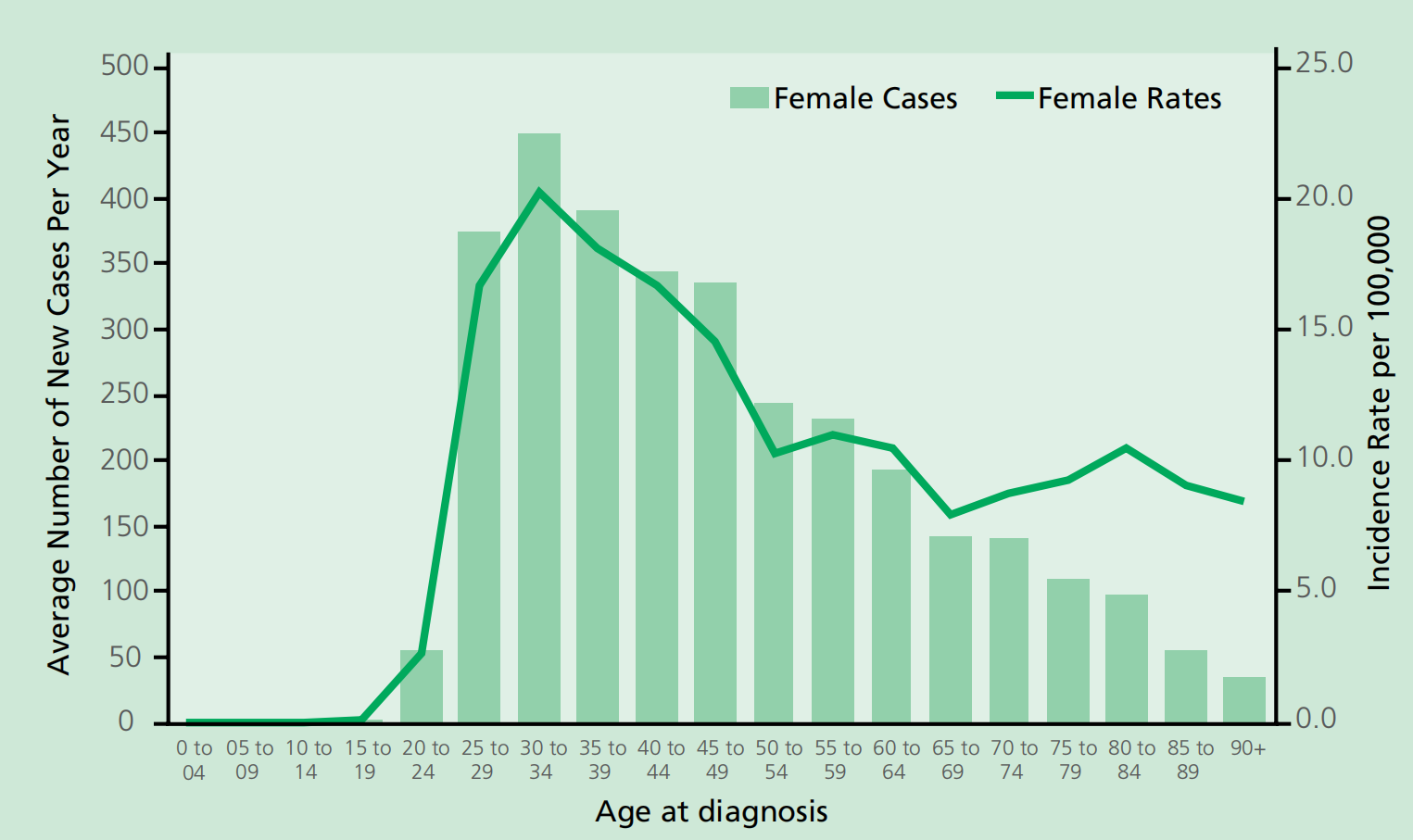
图1 2016-2018年英国每10万女性人口中每年新发宫颈癌病例的平均数量和年龄别发病率(来源:英国癌症研究)
肛门生殖器和头颈部位的人乳头瘤病毒相关癌症不太常见。在英格兰,每年大约有1,550例外阴和阴道癌症以及710例阴茎癌。2017年,980名女性和510名男性被诊断患有肛门癌(National Statistics, 2019)。虽然肛门癌在女性中比在男性中更常见,但在没有接种疫苗的情况下,男男性行为者(MSM)患肛门癌的风险高于女性(Frisch et al., 2003; Wilkinson et al, 2014),尤其是在艾滋病毒阳性者中(Machalek et al., 2012)。与异性恋男性相比,男男性行为者更有可能感染人乳头瘤病毒病毒,并承担显著增加的人乳头瘤病毒相关疾病负担和不良后果(Nyitray et al, 2011; Anic et al., 2012)。
2017年英格兰男性和女性确诊口咽癌人数分别为5038人和2549人(ONS癌症登记统计)。在过去的20年里,人乳头瘤病毒相关口咽癌的发病率在男性和女性中都有显著上升,但在男性中上升幅度更大。人乳头瘤病毒阴性口咽癌的比率也显著增加。
生殖器疣的流行病学
关于生殖器疣诊断的信息主要来自参加英国性健康服务的人。在引入国家人乳头瘤病毒免疫接种计划之前,自20世纪70年代初以来,英国性健康服务机构诊断出的生殖器疣发病率一直在上升,1987-1995年间,这一增长率有所放缓,这可能是由于开展了艾滋病毒/艾滋病公共健康宣传活动。2019年,英国各地性健康服务部门诊断出约5万例新的生殖器疣病例(Ratna et al., 2021, PHE, 2021)。24岁以下青年男女的诊断率最高。
子宫颈癌检查计划
子宫颈检查的国家政策是,根据妇女和有子宫颈的人的年龄,每三年或五年进行一次检查。24.5-49岁的人每3年受邀一次,而50-64岁的人每5年受邀一次。2019年,初级筛查测试从细胞学改为高风险人乳头瘤病毒测试,因为它对宫颈细胞变化的敏感性增加,阴性预测值高。预计年轻参与者的筛查间隔将在适当的时候延长,以反映这一改进的检测政策。国家筛查委员会也在审查证据,以告知接种疫苗的个人所需的宫颈筛查邀请的最佳数量。据报道,某些妇女群体的宫颈筛查率较低,例如一些少数民族群体和在外国出生的妇女(Webb et al., 2004; Thomas et al., 2005; Marlow et al., 2015)。此外,最贫困群体中的妇女不太可能参加筛查,但与最贫困群体相比,她们更有可能患有高风险人乳头瘤病毒,被诊断或死于宫颈癌的风险也更高。截至2018年4月,接受宫颈筛查邀请的年轻妇女人数呈下降趋势,随后在2018/19年和2019/20年,宫颈筛查覆盖率略有上升(2021年国民保健服务宫颈标准数据报告)。
人乳头瘤病毒疫苗接种方案
2008年,在对旨在减少人乳头瘤病毒相关宫颈癌负担的青少年常规人乳头瘤病毒疫苗接种计划的影响和成本效益进行详细审查后,疫苗接种和免疫联合委员会(JCVI)建议在学校中为12-13岁的女孩实施人乳头瘤病毒疫苗接种普及方案,同时为13岁至18岁以下的女孩实施补接种方案(JCVI,2008年)。国家人乳头瘤病毒免疫方案于2008年9月推出,为英国所有八年级女生(12至13岁)提供人乳头瘤病毒病毒感染疫苗,并为18岁以下的女生开展“补种”运动。
二价疫苗Cervarix是2008年9月至2012年8月提供的HPV疫苗,四价疫苗Gardasil是从2012年9月开始提供的(卫生部,2011年),两者都作为三个剂量疗程提供。2014年2月,JCVI得出结论,可建议14岁以下(含14岁)青少年使用Cervarix和Gardasil两种药物的两剂方案。自2014年9月起,在11至13岁女性(英格兰和威尔士为8年级)常规疫苗接种队列国家方案中实施了两剂Gardasil方案。
一项对在伦敦性健康诊所就诊的18-40岁男男性接触者的横断面研究表明,大多数男男性接触者,甚至是在性健康诊所就诊的高危人群中,目前都没有感染疫苗型人乳头瘤病毒病毒。数据表明,针对男男性行为者的针对性疫苗接种策略可能会带来实质性的好处(King et al., 2015),因为这一群体不太可能受益于现有女孩方案产生的群体免疫。这些研究结果被用于的影响和成本效益评估(Lin et al., 2016)。2015年11月,JCVI建议,应当为参加专门性健康服务(SSHS)和艾滋病毒诊所(JCVI,2015)的45岁及45岁以下男男性行为者引入有针对性的人乳头瘤病毒免疫接种方案。在积极的试点评估(Edelstein et al, 2018)之后,该方案从2018年4月起在全英格兰推广。该方案的目的是将预防人乳头瘤病毒感染、人乳头瘤病毒相关癌症和生殖器疣的保护措施扩大到SSHS和艾滋病毒诊所就诊的男男性行为人群。
2018年7月,JCVI建议,现有的人乳头瘤病毒女孩疫苗接种计划也可扩展至青春期男孩(JCVI.2018).由于JCVI的建议,政府宣布,从2019年9月起,国家人乳头瘤病毒免疫计划将扩大到包括青春期男孩。除了为男性肛门生殖器疣和非宫颈人乳头瘤病毒相关癌症提供个体保护外,预计这将提高英国计划的弹性,加快女性宫颈癌的控制,并有可能在英国消除HPV疫苗类型。此外,该方案还将为男男性行为人群提供早期直接保护。
疫苗接种计划的影响
在人乳头瘤病毒国家免疫接种方案推出十多年后,有证据表明,接种疫苗的影响减少了人乳头瘤病毒16/18型感染、生殖器疣、癌前病变和宫颈癌(见下文)。在英国和全球范围内,未接种人群中的群体保护证据正在出现(Drolet et al., 2015; Drolet et al., 2019)。
一项正在进行的对英格兰各地16-24岁年轻女性进行衣原体筛查的横断面研究显示,自国家计划推出以来,HPV疫苗类型的流行率有所下降。在疫苗覆盖率最高的16-18岁女性中,人乳头瘤病毒16/18岁流行率从2008年的15%降至2010/11年的8.2%,随后又降至2016年的1.6%。在最近的一年,即2018年,接种疫苗后10年,在16-18岁的孩子中没有检测到HPV16/18感染。估计疫苗接种覆盖率较低的19-21岁女性也出现了下降(从2010/11年的14.0%人乳头瘤病毒16/18型流行率降至2018年的0.7%(Mesher et al., 2018)(HPR,2020)。这些结果表明,该方案成功地提供了直接和间接保护。在苏格兰,一项为期7年的横断面研究显示,16/18型人乳头瘤病毒患病率从2009年的28.9%降至2015年的4.8%(Kavanagh K et al., 2017)。还观察到HPV31/33/45流行率的降低(在疫苗接种后的时期内,16-18岁的人群为6.5%至1.9%,19-21岁的人群为8.6%至2.8%),提供了疫苗接种的交叉保护的证据。到目前为止,没有证据表明存在类型替换,即HPV疫苗类型的减少导致其他人乳头瘤病毒类型变得更加常见。
人类乳头瘤病毒(HPV)
2019年,在前往性健康诊所的15至17岁女性中,首次发病的生殖器疣诊断率比2015年低91%(每10万人口中有16.9人对193.5人),其中大多数人在12至13岁时会获得四价HPV疫苗(预防人乳头瘤病毒16、18、6和11型)。在此期间,同龄异性恋男性的死亡率下降了81% (10.0比53.3/100,000),这表明存在实质性的群体保护(PHE,2020)。
在苏格兰,宫颈癌筛查的开始年龄在2016年有所改变(从20岁改为25岁),这意味着来自追赶队列的妇女自2010年起接受筛查,来自常规免疫队列的妇女自2015年起接受筛查。最近在苏格兰进行的一项研究表明,与1988年出生的未接种疫苗的妇女相比,在12-13岁通过国家免疫规划接种二价疫苗的第一批妇女(1995/6年出生)中,流行的宫颈上皮内瘤变(CIN)3级或更严重的发病率降低了89%(95% CI 81%至94%)(Palmer et al., 2019)。其他环境中的人群研究也显示了四价疫苗对癌前病变的主要影响(McClung et al., 2019; Herweijer et al., 2016; Gertig et al., 2013)。
英国国家人乳头瘤病毒免疫接种计划对宫颈癌影响的早期证据表明,与未接种疫苗的人群相比,在12-13岁接种二价Cervarix疫苗的年轻女性中,宫颈癌和CIN3的发病率显著降低(Falcaro et al., 2021)。这些发现表明,HPV疫苗将拯救英国数百乃至数千人的生命。
人乳头瘤病毒疫苗接种
自2006年以来,人乳头瘤病毒疫苗已经上市。目前可用的疫苗是由人乳头瘤病毒病毒外壳或衣壳的主要蛋白制成的亚单位疫苗。病毒样颗粒(VLPs)是由在酵母或杆状病毒感染的昆虫细胞(后者来自一种蛾)中生长的重组蛋白制备的。VLP模仿天然病毒的结构,但不含任何病毒DNA。它们不含活的有机体,也不会引起它们所保护的疾病。
目前有三种不同的HPV疫苗产品。Cervarix包含两种人乳头瘤病毒病毒类型的VLP(16和18-二价疫苗),Gardasil包含四种人乳头瘤病毒病毒类型的VLP(6、11、16和18-四价疫苗),Gardasil®9包含九种人乳头瘤病毒病毒类型的VLP(6、11、16、18、31、33、45、52和58-九价疫苗)。Cervarix中使用的VLP由AS04辅助,AS04含有吸附在氢氧化铝上的3-O-脱酰基-4’-单磷酰基脂质A (MPL)。Gardasil和Gardasil®9中使用的VLPs吸附在无定形羟基磷酸硫酸铝佐剂上。这些疫苗不含硫柳汞。
人类乳头瘤病毒(HPV)
人乳头瘤病毒疫苗在预防易感妇女感染疫苗所涵盖的人乳头瘤病毒病毒类型方面非常有效。在对没有既往感染证据的年轻女性进行的临床试验中,两种疫苗在预防与16型或18型人乳头瘤病毒病毒相关的癌前病变方面的有效性均超过99%(Harper et al., 2006; Ault et al., 2007; Lu et al., 2011)。目前的研究表明,保护维持至少十年(Kjaer et al., 2018; Porras et al., 2020)。根据免疫反应,预计保护将进一步扩大,可能是终身的;长期随访研究已经就绪。关于人乳头瘤病毒疫苗在男性中的功效/有效性的直接证据有限,但现有证据表明,该疫苗对生殖器人乳头瘤病毒感染和高度肛门上皮内病变是安全有效的,特别是在人乳头瘤病毒幼稚个体中(Harder et al., 2018; Giuliano et al., 2011)。Gardasil在预防年轻女性中与疫苗类型相关的生殖器疣方面也有99%的有效性(Barr et al., 2007)。
由于通过临床试验在年轻女性中证明了高效性,在免疫原性方面显示同等反应的免疫学研究已经成为推断功效和保护持续时间的可接受的“桥梁”。Gardasil的许可适应症基于Gardasil在16至45岁女性和16至26岁男性中的功效证明,以及Gardasil在9至15岁儿童和青少年中的免疫原性证明。就Cervarix而言,与年轻女孩和妇女相比,男性的免疫原性已被证明不劣于年轻女孩和妇女,从而推断其疗效。
青少年接种疫苗时,采用两剂方案进行初免和加强接种(间隔至少6个月),与老年妇女接种三剂方案的反应相当(包括Dobson et al., 2013; Safaeian et al., 2013)。2013/14年,Gardasil和Cervarix都获得了欧洲药品管理局(EMA)的许可,可以在青春期女孩中使用两剂方案(SPC Gardasil,Cervarix)。
一些其他高风险人乳头瘤病毒类型与疫苗中包含的类型密切相关,疫苗接种已被证明提供了一些针对这些类型感染的交叉保护(Brown et al., 2009; Lehtinen et al., 2012; Brotherton., 2017)。一项系统综述和荟萃分析(包括来自七项研究的数据)显示,在女性疫苗接种覆盖率至少为50%的国家,13至19岁女性中高风险HPV疫苗类型(HPV16和18)减少,也显示了人乳头瘤病毒31、33和45型减少的证据,证实了一些交叉保护(Drolet et al., 2015)。
对于九价疫苗,适应症基于非劣效性,针对女孩、女性和男性的四价疫苗中的4种疫苗类型;证明对女孩和妇女的31型、33型、45型、52型和58型人乳头瘤病毒病毒的疗效;与16岁至26岁的女孩和妇女相比,在9岁至15岁的男孩和女孩以及16岁至26岁的男子中证明了针对Gardasil®9人乳头瘤病毒型的非劣性免疫原性。Gardasil®9于2016年4月获得欧洲药品管理局(EMA)的许可批准,用于青春期女孩的两剂方案,并被许可用于9岁至14岁(包括14岁)的个人(SPC,Gardasil®9)。
2020年5月,JCVI人乳头瘤病毒小组委员会审查了最新证据,包括替代方案的免疫原性和有效性数据(JCVI HPV Subcommittee., 2020)。因此,JCVI同意在为人乳头瘤病毒项目提供一剂疫苗计划建议之前,希望看到更多关于九价疫苗的数据。证据被认为是支持从三剂方案转移到两剂方案,15岁以上个人(包括男男性行为者)。
JCVI的结论是,没有令人信服的理由继续对15岁以上开始使用三剂方案的人使用三剂方案,该方案应在适当的时候转向对所有儿童和成人(包括男男性行为者)使用两剂方案(JCVI.,2020),但在提供疫苗时感染艾滋病毒或免疫抑制的合格个体除外(JCVI.,2020)。UKHSA和NHSEI宣布,针对所有儿童和成人(包括男男性行为者)的两剂方案将于2022年4月1日在英格兰生效。
储存
疫苗应储存在原包装中,温度为+2℃至+8℃(最好是5℃ ),并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。
除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
剂型
人乳头瘤病毒疫苗都是以装在预装注射器中的VLPs悬浮液的形式提供的。在储存过程中,可能会产生白色沉淀,使用前应摇动疫苗,形成白色混浊液体。
人乳头瘤病毒免疫计划
英国许可的人乳头瘤病毒疫苗的剂量和时间表1
两剂方案(儿童、青少年和成人)
Gardasil®, Gardasil®9 和 Cervarix®
- 第一剂0.5ml HPV疫苗
- 第一剂后6至24个月,第二剂0.5ml
对于所有年龄,JCVI建议在0、6-24个月接种所有人乳头瘤病毒疫苗。6至24个月之间的任何剂量间隔在临床上都是可以接受的。如果疗程中断,应重新开始(使用相同的疫苗)但不要重复,即使第一次注射后已超过24个月。
只要有可能,所有人的免疫接种都应遵循推荐的0、6-24个月的时间表,但有一些临床数据表明,Cervarix®的两次剂量间隔可缩短至5个月。对于Gardasil®,最小间隔两次剂量之间应该是6个月。对于Gardasil® 9,两次剂量之间的最小间隔可以是5个月。
1 Gardasil® 是目前唯一为国家人乳头瘤病毒项目提供的HPV疫苗(针对青少年和男男性行为者)。Gardasil ®9将于2022年推出(详情见下文)。
三剂方案(针对HIV阳性或免疫缺陷人群)
Gardasil®和Gardasil®9
- 第一剂0.5ml HPV疫苗
- 第一剂后至少一个月,第二剂0.5ml
- 第二剂后至少三个月,第三剂0.5ml
Cervarix®
- 第一剂0.5ml HPV疫苗
- 第二剂0.5ml,第一剂后一至两个半月
- 第一剂后至少五个月,第三剂0.5ml
0、1、4-6个月的疫苗接种时间表适用于HIV阳性或免疫缺陷人群的HPV疫苗接种(见下一节)。理想情况下,所有三种剂量都应在12个月内给药。如果疗程中断,应重新开始(使用相同的疫苗),但不要重复,最好在剩余剂量之间留出适当的间隔。
没有临床数据表明第二剂和第三剂之间的间隔时间是否可以缩短到三个月以下。如果第二次给药时间较晚,且三个月后个体极有可能不再接受第三次给药,或者由于实际原因,不可能在该时间范围内安排第三次给药,则可在第二次给药后至少一个月进行第三次给药。这适用于所有目前许可的人乳头瘤病毒疫苗。
对于MSM方案,两个或三个剂量疗程的可变间隔选项是可能的。由于给药的机会性,24个月的疗程在临床上是可以接受的,前提是尽可能遵守两次给药之间的最短间隔。这将使后续剂量的给药与推荐的SSHS再就诊相一致,以避免只为接种疫苗而额外就诊的需要。
Gardasil®9简介
Gardasil®9将于2022年引入国家人乳头瘤病毒计划,以取代Gardasil®,成为国家人乳头瘤病毒计划(针对青少年和男男性行为者)提供的唯一HPV疫苗。随着计划过渡到Gardasil®9,一些人将在转换期间收到一份混合时间表。JCVI认为这两种疫苗可以互换(见下文),不应因等待替代疫苗的供应而推迟接种。对于那些使用Gardasil®开始流程的人,可以使用Gardasil®9完成流程。应根据建议的疫苗接种时间表完成疗程,对于相关个体,可在0、6-24个月或0、1、4-6个月完成(参见剂量和时间表部分)。Gardasil®9的上市时间将通过ImmForm网站(https://portal.immform.phe.gov.uk/Logon.aspx).
先前的不完全人乳头瘤病毒疫苗接种
有证据支持所有人乳头瘤病毒疫苗的互换性(JCVI,2018)。对于符合条件的HPV疫苗的个人,该流程可以在英国完成,目前在英国项目中使用疫苗。该流程应按照建议的疫苗接种时间表完成。
Gardasil®的两次给药间隔少于6个月或Gardasil®9的两次给药间隔少于5个月不应被视为足以提供长期保护,第三次给药应根据剂量和时间表部分提供的指导进行。
注射
疫苗通常通过上臂或大腿前外侧肌肉注射。这是为了降低局部反应的风险,局部反应在皮下注射疫苗时更常见(Mark et al., 1999; Zuckerman, 2000; Diggle et al., 2000)。
如果熟悉出血风险的医生认为疫苗或类似的小剂量肌肉注射可以通过这种途径合理安全地施用,则患有出血性疾病的个体可以通过肌肉注射接种疫苗。如果个体接受减少出血的药物/治疗,例如血友病的治疗,可以在给予这种药物/治疗后不久安排肌内疫苗接种。正在接受稳定抗凝治疗的个体,包括正在接受华法林治疗的个体,如果其预定的INR测试是最新的,并且其最新的INR低于其治疗范围的上限,则可以接受肌肉注射疫苗。应使用细针(等于23号或更细的口径,如25号)接种疫苗,然后用力按压该部位(不摩擦)至少2分钟。如果有任何疑问,请咨询负责处方或监测个人抗凝治疗的临床医生。
人乳头瘤病毒疫苗可以与其他疫苗(包括Td/ IPV、MMR、流感、MenACWY和乙型肝炎)同时接种。当Gardasil与dTaP、dT/IPV和dTaP/IPV疫苗同时接种时,观察到抗人乳头瘤病毒滴度降低的趋势,尽管该观察的临床意义尚不清楚。9价HPV疫苗与MenACWY dTaP同时给药不会干扰对任何这些疫苗的抗体反应(Schilling et al ., 2015)。疫苗应该在不同的部位注射,最好是在不同的肢体。如果给药在同一个肢体,它们应该至少分开2.5厘米(American Academy of Pediatrics, 2006)。应在个人记录中注明每种疫苗的注射地点。
处理
用于接种疫苗的设备,包括用过的小瓶、安瓿或注射器,应根据地方当局法规和卫生技术备忘录07-01:医疗废物的安全管理(卫生部,2013年)中的指导,通过将它们放置在适当的防穿刺“锐器”箱中进行处置。
疫苗使用建议国家青少年人乳头瘤病毒疫苗接种计划
人乳头瘤病毒青少年免疫接种方案的目标是,在男孩和女孩达到感染人乳头瘤病毒病毒的风险增加并使他们有患宫颈癌和其他人乳头瘤病毒相关癌症的风险的年龄之前,为他们接种疫苗。
在有资格接种疫苗的人群中(以及在常规项目之外的人群中)预防人乳头瘤病毒感染应该包括安全性行为的建议。所有女性,无论是否接种疫苗或没有,应大力鼓励在预定年龄参加常规子宫颈检查。
9至11岁的儿童
Cervarix® Gardasil®和Gardasil®9已获得许可,适用于9岁以上的儿童,这个年龄段的男童和女童的疫苗接种不在人乳头瘤病毒国家疫苗接种计划的覆盖范围内。
11至14岁的青少年
通常建议所有11至14岁的女孩和男孩接种人乳头瘤病毒疫苗,首剂疫苗在英格兰和威尔士的8年级、苏格兰的S1和北爱尔兰的9年级接种。两次给药方案允许第一次和第二次给药之间的时间间隔为6个月至24个月(0,6-24个月)。因此,第二剂疫苗在英格兰和威尔士的8至9年级、苏格兰的S1至S3或北爱尔兰的9至10年级提供。人乳头瘤病毒疫苗的疗程应根据剂量和时间表部分给出的指导进行。如果疗程中断,则应继续进行,但不能重复,最好在剩余剂量之间留有适当的间隔。
Gardasil®的两次给药间隔少于6个月或Gardasil®9的两次给药间隔少于5个月应被视为不足以提供长期保护,第三次给药应根据剂量和时间表部分给出的指导进行。
15至25岁的大龄青少年和成年人
国家方案中有资格接种疫苗的男性和女性一直保持到25岁。那些有资格参加常规计划的队列中的女性和男性(即,对于英国,1991年9月1日之后出生的女性和2006年9月1日之后出生的男性)从海外来到英国,并在一家全科医生诊所注册,他们在他们的原籍国可能没有提供针对人乳头瘤病毒的保护,如果他们年龄在25岁以下,应该提供疫苗接种。对于苏格兰、威尔士和北爱尔兰,由于首次接种HPV疫苗的年龄不同,合格人群的出生日期可能会有所不同。这些计划的合同安排应与相关专员核实。
如果目标队列中的老年男性或女性有不充分的疫苗接种史,应尽一切努力澄清他们接种了哪些疫苗以及何时接种的。在年满25岁之前已经开始但未完成计划的男性或女性,应尽可能以最短的间隔(见上文)完成疫苗接种流程。如果疗程中断,则应继续进行,但不能重复,最好在剩余剂量之间留有适当的间隔。
Gardasil®的两次给药间隔少于6个月或Gardasil®9的两次给药间隔少于5个月应被视为不足以提供长期保护,第三次给药应根据剂量和时间表部分给出的指导进行。
人乳头瘤病毒男男性行为者疫苗接种方案国家男男性行为者疫苗接种方案的目标是,通过在SSHS和艾滋病毒诊所提供机会性疫苗接种,将保护范围扩大到男男性行为者人群中被认为最有可能感染人乳头瘤病毒病毒及其后疾病的人。这个节目是预计在男孩通过学校方案获得资格后将持续一段时间,以便为年长的男男性行为者提供直接保护。
有关男男性行为者人乳头瘤病毒方案的更多信息,包括详细指导,请参见:https://www.gov.uk/government/collections/hpv-vaccination-for-men-who-have-sex-with-men-msm-programme#programme-documents
45岁及以下的男男性行为者
所有参加SSHS或艾滋病毒服务的年龄在45岁及45岁以下的男男性接触者,如果他们以前没有接种过疫苗,都有资格接种疫苗。
46岁及以上的男男性行为者
任何有资格参加人乳头瘤病毒MSM疫苗接种计划的人,如果在年满46岁之前开始接种,但没有完成计划,则应完成疫苗接种过程,前提是第一剂疫苗是作为试点或国家计划的一部分接种的。
变性者和其他个人
向参加SSHS或艾滋病毒诊所的个人提供HPV疫苗可能有相当大的好处,这些人没有资格参加常规的人乳头瘤病毒方案,并被认为具有与MSM人群相似的风险特征。这包括一些变性者、性工作者以及感染艾滋病毒的男女。那些感染人乳头瘤病毒病毒的风险被认为等同于有资格接种HPV疫苗的男男性接触者的风险的人,应该接受疫苗接种。对于那些以前已经完成了作为学校人乳头瘤病毒方案一部分的人乳头瘤病毒疫苗接种流程的人来说,不需要给予进一步的剂量。
禁忌症
极少数个体不能接种HPV疫苗。如有疑问,与其停止接种疫苗,不如向相关专家或当地免疫或健康保护团队寻求适当的建议。
疫苗不应注射给患有以下疾病的人:
- 确认对先前剂量的HPV疫苗有过敏反应,或
- 对疫苗的任何成分有确认的过敏反应
酵母过敏不是HPV疫苗的禁忌症。尽管Gardasil®和Gardasil®9在酵母细胞中生长,但最终的疫苗产品不含酵母作为赋形剂/成分,最多仅含有非常少量的酵母蛋白(< 0.007微克)。
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。这是为了避免混淆任何急性疾病的鉴别诊断,错误地将任何体征或症状归因于疫苗的任何可能的副作用。
怀孕和母乳喂养
在怀孕或哺乳期间注射灭活的重组病毒或细菌疫苗或类毒素没有已知的风险(Atkinson et al., 2008)。由于灭活疫苗不能复制,它们不会对母亲或胎儿造成感染。
与大多数药品一样,在获得许可之前,没有对孕妇进行HPV疫苗的具体临床试验。在临床开发项目期间,近4,000名妇女(Gardasil® = 1,894对对照= 1,925),在随访期间报告了至少一次妊娠。两组在异常类型或不良妊娠结局比例方面没有显著差异。许多孕妇在上市后期间也接触过HPV疫苗。一项涉及丹麦所有孕妇的全国性基于登记的队列研究发现,与未接种疫苗相比,四价疫苗没有与自然流产、重大出生缺陷、死产、早产、小于胎龄儿和低出生体重相关的显著风险(Scheller et al., 2017)。现有的数据非常令人放心,没有显示任何安全问题或对怀孕的伤害。
在提供HPV疫苗之前,不需要常规询问末次月经和/或妊娠测试。已知性行为活跃的女学生,包括怀孕或曾经怀孕的女学生,仍可能易受高危人乳头瘤病毒感染,因此可以根据英国的计划接种疫苗。如果一名妇女在开始一个疗程的HPV疫苗接种后发现自己怀孕了,不应该建议在无意中接种疫苗后终止妊娠。
免疫抑制和艾滋病毒感染
符合条件的人类免疫缺陷病毒(HIV)阳性的MSM应接种HPV疫苗,无论CD4细胞计数、抗逆转录病毒疗法的使用或病毒载量如何。四价HPV疫苗在HIV阳性的成人中是安全且高免疫原性的(Wilkin et al., 2010; Kojic et al 2014)。与艾滋病毒阴性个体相比,艾滋病毒阳性个体的抗体几何平均滴度水平较低(Toft et al., 2014)。尽管如此,人乳头瘤病毒疫苗似乎在该人群中表现出良好的疗效(McClymont., 2018)。
已经观察到移植患者中HPV疫苗的次优免疫原性(Kumar等人,2013)。在治疗结束和/或恢复后,应考虑增加疫苗剂量。可能需要专家的建议。
关于艾滋病毒阳性或免疫抑制人群中少于3剂的数据有限。因此,应给免疫时免疫抑制的个体和已知为HIV阳性的个体(包括正在接受抗逆转录病毒治疗的个体)提供3剂方案。这一建议得到了JCVI和WHO SAGE。
皇家儿科和儿童健康学院(https://www.rcpch.ac.uk/)、英国艾滋病毒协会(BHIVA)艾滋病毒感染成人免疫指南(BHIVA,2015;以及儿童爱滋病协会的免疫指引(https://www . chiva . org . uk/guidelines/immunization/)。
不良反应
与所有疫苗和药物一样,医疗保健专业人员和父母/护理人员应使用黄卡报告计划(http://yellowcard.mhra.gov.uk/)。
接种HPV疫苗后观察到的最常见的不良反应是注射部位轻度至中度的短暂疼痛。还报告了立即局部刺痛的感觉。注射部位也有发红的报告。其他常见的反应有头痛、肌痛、疲劳和低烧。
与Cervarix®、Gardasil®和Gardasil®9相关的不良反应的详细列表可在人乳头瘤病毒医疗从业人员疫苗接种指南中找到,网址为:https://www.gov.uk/government/publications/hpv-universal-vaccination-guidance-for-health-professionals/hpv-universal-vaccination-guidance-for-healthcare-practitioners-version-3
晕厥(血管迷走神经反应)或昏厥可在任何疫苗接种期间发生,最常见于青少年和成人。一些人在接种疫苗前也可能经历恐慌发作。《绿皮书》第8章详细描述了昏厥和惊恐发作的临床特征。接种疫苗之前或之后不久发生的昏厥和恐慌发作通常不是疫苗的直接副作用(不良反应),而是与注射过程本身相关的事件。
报告过敏反应和其他过敏反应
过敏反应是大多数疫苗非常罕见的公认副作用,应通过黄卡计划报告疑似病例(www.mhra. gov.uk/yellowcard)。绿皮书的第8章给出了区分昏厥、惊恐发作和过敏反应的迹象和症状的详细指导。如果疑似过敏反应的病例符合第8章所述的临床特征,则应通过黄卡方案报告为“过敏反应”(或适当的“过敏样反应”)。不太严重的过敏反应病例(即不包括上述过敏反应的临床特征)不应报告为过敏反应,而应报告为“过敏反应”。
自2008年以来,在全球范围内报告了一系列与人乳头瘤病毒疫苗暂时相关的疑似严重不良反应。这些疾病涉及广泛的疾病,主要是慢性综合征。来自英国、挪威、芬兰和荷兰的四项基于人群的研究发现,没有证据表明人乳头瘤病毒疫苗可能是慢性疲劳综合征的一个原因((Donegan et al., 2013; Feiring et al., 2017; Schurink-van’t Klooster et al., 2018)。来自独立学者的大量已发表的流行病学研究未发现基于广泛安全终点的严重危害证据,包括自身免疫性疾病[Macartney., 2013 et al】。国家和国际安全委员会的审查得出结论,这些担忧是没有根据的,并强烈支持疫苗的安全性和使用(WHO GACVS, 2015)。
供应
- Cervarix®由葛兰素史克公司生产。
- Gardasil®–由MSD制造。
- Gardasil®9–由MSD制造
作为国家儿童免疫规划的一部分,国家规划中使用的人乳头瘤病毒疫苗由英国Movianto有限公司(电话:01234 248631)在英国分发。
国家方案的疫苗通过ImmForm集中供应。Immform上的MSM和青少年人乳头瘤病毒方案有单独的订单行。
人类乳头瘤病毒(HPV)
正确的那个必须用于为每个计划订购疫苗量,即使ImmForm帐户持有人订购两者。
用于国家规划建议范围之外的疫苗应从制造商或药品批发商处订购。
在苏格兰,应该从当地的儿童疫苗储备中心获得供应。详情可从苏格兰国民保健服务系统的采购、调试和设施处获得(电话:0131 275 6725)。
在北爱尔兰,应该从当地的儿童疫苗储备中心获得供应。详情可向区域药品采购处索取(电话:028 9442 4346)。
参考
American Academy of Pediatrics (2006) Vaccine Administration. In: Pickering LK (ed.) Red Book: 2006. Report of the Committee on Infectious Diseases. 26th edition. Elk Grove Village, IL: American Academy of Pediatrics, pp. 18-22.
Atkinson WL, Kroger AL and Pickering LK (2008) Section 1: General aspects of vaccination, Part 7: General immunization practices. In: Plotkin S, Orenstein W and Offit P (eds) Vaccines. 5th edition. Philadelphia: WB Saunders Company, pp 83-109.Anic GM, Lee J-H, Villa LL, Lazcano-Ponce E, Gage C, Jose´ C, Silva R, Baggio ML, Quiterio M, Salmero´n J, Papenfuss MR, Abrahamsen M, Stockwell H, Rollison DE, Wu Y, Giuliano AR (2012) Risk factors for incident condyloma in a multinational cohort of men: the HIM study. J Infect Dis 205: 789–793.
Ault KA and FUTURE II Study Group (2007) Effect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: a combined analysis of four randomised clinical trials. Lancet 369(9576): 1861-8.
Barr E and Tamms G (2007) Quadrivalent human papillomavirus vaccine. Clin Infect Dis 45(5): 609-17.
Bouvard V, Baan R, Straif K, et al. A review of human carcinogens—Part B: biological agents. Lancet Oncol 2009;10: 321–22.
British HIV Association (2008) British HIV Association guidelines for immunization of HIV-infected adults 2008. HIV Med 9(10): 795-848. http://www.bhiva.org/documents/ Guidelines/Immunisation/ Immunization2008.pdf. Accessed December 2013.
Brotherton JML.Comment: Confirming cross-protection of bivalent HPV vaccine.Lancet Infect Dis 2017;17(12):1227-1228
Brown D, Kjaer S, Sigurdsson K et al. (2009) The impact of quadrivalent human papillomavirus (HPV; types 6, 11, 16, and 18) L1 virus-like particle vaccine on infection and disease due to oncogenic nonvaccine HPV types in generally HPV-naive women aged 16-26 years. J Infect Dis 199: 926-35. Cervarix SPC available at https://www.ema.europa.eu/en/documents/product-information/cervarix-epar-product-information_en.pdf.
Chin-Hong PV, Vittinghoff E et al. Age-Specific prevalence of anal human papillomavirus infection in HIVnegative sexually active men who have sex with men: the EXPLORE study. J Infect Dis 2004; 190:2070-6.
Cuschieri KS, Cubie HA, Whitley MW et al. (2004) Multiple high risk HPV infections are common in cervical neoplasia and young women in a cervical screening population. J Clin Pathol 57: 68–72.
Department of Health (2013) Health Technical Memorandum 07-01: Safe management of healthcare waste. https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/167976/HTM_07-01_Final.pdf. Accessed December 2013.
Department of Health (2011) HPV vaccination programme switching to Gardasil® from September 2012 https://webarchive.nationalarchives.gov.uk/ukgwa/20130402232333/http://immunisation.dh.gov.uk/hpv-vaccprog-switch-to-gardasil-sept-2012/ Accessed: Feb. 2012.
Daling JR, Weiss NS et al. Sexual practices, sexually transmitted diseases, and the incidence of anal cancer. N Engl J Med 1987; 317:973-7
Diggle L and Deeks J (2000) Effect of needle length on incidence of local reactions to routine immunisation in infants aged 4 months: randomised controlled trial. BMJ 321(7266): 931-3.
DiMiceli L, Pool V, Kelso JM et al. (2006) Vaccination of yeast sensitive individuals: review of safety data in the US vaccine adverse event reporting system (VAERS). Vaccine 24(6): 703-7.
Donegan K , Beau-Lejdstrom R, King B et al. Bivalent human papillomavirus vaccine and the risk of fatigue syndromes in girls in the UK. Vaccine 2013; 31: 4961-4967
Dobson SR, McNeil S, Dionne et al. (2013) Immunogenicity of 2 doses of HPV vaccine in younger adolescents vs 3 doses in young women: a randomized clinical trial. JAMA; 309 (17):1793-802.
Drolet M, Bénard E, Boily MC, et al. Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. Lancet ID, 2015. https://www.sciencedirect.com/science/article/pii/S1473309914710734?via%3Dihub
Drolet M, Bénard E, Perez N, et al. Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. Lancet , 2019. Epub ahead of print: https://doi.org/10.1016/S0140-6736(19)30298-3
Edelstein M, Iyanger N, Hennessy N et al. Implementation and evaluation of the human papillomavirus (HPV) vaccination pilot for men who have sex with men (MSM), England, April 2016 to March 2017. Euro Surveill.
2019;24(8):pii=1800055. https://doi.org/10.2807/1560-7917.ES.2019.24.8.1800055
Edwards L, Ferenczy A, Eron L et al. (1998) Self-administered topical 5% imiquimod cream for external anogenital warts. HPV Study Group. Human PapillomaVirus. Arch Dermatol 134(1): 25-30.
Falcaro M, Castañon A, Ndlela B, et al. The effects of the national HPV vaccination programme in England,
UK, on cervical cancer and grade 3 cervical intraepithelial neoplasia incidence: a register-based observational study. Lancet 2021;(Nov). doi:10.1016/S0140-6736(21)02178-4.
Feiring B, Laake I, Bakken I.J et al. HPV vaccination and risk of chronic fatigue syndrome/myalgic
encephalomyelitis: A nationwide register-based study from Norway. Vaccine 2017;35 (33): 4203-4212.
Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136(5):E359-86.
Franco EL, Villa LL, Sobrinho JP et al. (1999) Epidemiology of acquisition and clearance of cervical human papillomavirus infection in women from a high-risk area for cervical cancer. J Infect Dis 180(5): 1415-23.
Frisch M, Smith E, Grulich A, Johansen C (2003) Cancer in a population based cohort of men and women in registered homosexual partnerships. Am J Epidemiol 157: 966–972.
Gardasil Summary of Product Characteristics. Available at the electronic Medicines Compendium (eMC) : https://www.medicines.org.uk/emc/product/261/smpc Gardasil9 Summary of Product Characteristics. Available at the electronic Medicines Compendiu (eMC))m :
https://www.medicines.org.uk/emc/product/7330/smpc Garland SM, Hernandez-Avila M, Wheeler CM et al. (2007) Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med 356(19): 1928-43.
Gertig DM, Brotherton JM, Budd AC et al. Impact of a population-based HPV vaccination program on cervical abnormalities: a data linkage study. BMC Med 2013;11:227.doi:10.1186/1741-7015-11-227
Gillison ML Koch WM Capone RB et al. Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst . 2000;92 (9):709–720
Giuliano AR, Nyitray AG, Kreimer AR, et al. EUROGIN 2014 Roadmap: Differences in HPV infection natural history, transmission, and HPV-related cancer incidence by gender and anatomic site of infection. Int J Cancer. 2015;136(12):2752-2760. doi:10.1002/ijc.29082.
Giuliano AR, Palefsky JM, Goldstone S, et al. Efficacy of quadrivalent HPV vaccine against HPV Infection and disease in males. New England Journal of Medicine 2011; 364(5):401-411
Harder T, Wichmann O, Klug SJ et al. Efficacy, effectiveness and safety of vaccination against human
papillomavirus in males: a systematic review BMC Medicine (2018) 16:110
Harper DM, Franco EL, Wheeler CM et al. (2006) Sustained efficacy up to 4.5 years of a bivalent L1 virus-like
particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised control trial. Lancet 367(9518): 1247-55.
Hawkins MG, Winder DM, Ball SL, Vaughan K, Sonnex C, Stanley MA, et al. Detection of specific HPV subtypes responsible for the pathogenesis of condylomata acuminata. Virology journal. 2013;10:137
Herweijer E, Sundström K, Ploner A et al. Quadrivalent HPV vaccine effectiveness against high-grade cervical
lesions by age at vaccination: A population-based study. Int J Cancer 2016;138:2867-74. doi:10.1002/ ijc.30035
Ho GY, Bierman R, Beardsley L et al. (1998) Natural history of cervicovaginal papillomavirus infection in young women. N Engl J Med 338(7): 423-8.
Howell-Jones R, Bailey A, Beddows S et al. (2010) Multi-site study of HPV type-specific prevalence in women
with cervical cancer, intraepithelial neoplasia and normal cytology, in England. Br J Cancer, 103(2): 209-16. Erratum in: Br J Cancer (2010), 103(6): 928.
HPA (2007) Testing times – HIV and other sexually transmitted Infections in the United Kingdom: 2007. Accessed: Feb. 2012. HPA (2012) STI annual data tables. Accessed: Feb. 2012.
Jit M, Vyse A, Borrow R et al. (2007) Prevalence of human papillomavirus antibodies in young female subjects in England. Br J Cancer 97(7): 989-91.
Joint Committee on Vaccination and Immunisation. Statement on Human papillomavirus vaccines to protect against cervical cancer. July 2008. Available at: https://webarchive.nationalarchives.gov.uk/
ukgwa/20120907095410/http://www.dh.gov.uk/ab/JCVI/DH_094744
Joint Committee on Vaccination and Immunisation. (2014) Minute of the meeting on Tuesday 11 and
Wednesday 12 February 2014 available at : https://www.gov.uk/government/groups/joint-committee-onvaccination-and-immunisation#publications-and-statements.
Joint Committee on Vaccination and Immunisation statement on HPV vaccination of men who have sex with men. November 2015. Available at: https://www.gov.uk/government/publications/jcvi-statement-on-hpvvaccination-of-men-who-have-sex-with-men.
Joint Committee on Vaccination and Immunisation HPV Subcommittee (2018). Minute of the meeting on May 18 2018 available at: https://www.gov.uk/government/groups/joint-committee-on-vaccination-andimmunisation.
Joint Committee on Vaccination and Immunisation statement: extending the HPV vaccination programme – conclusions. 18 July 2018. available at: https://www.gov.uk/government/groups/joint-committee-onvaccination-and-immunisation.
Joint Committee on Vaccination and Immunisation HPV Subcommittee (2020). Minute of the meeting on May 21 2020 available at: https://www.gov.uk/government/groups/joint-committee-on-vaccination-andimmunisation.
Joint Committee on Vaccination and Immunisation (2020). Minute of the meeting on June 03 2020 available at: https://www.gov.uk/government/groups/joint-committee-on-vaccination-and- immunisation.
Joint Committee on Vaccination and Immunisation (2021). Minute of the meeting on June 22 2021 available at: https://www.gov.uk/government/groups/joint-committee-on-vaccination-and- immunisation.
Kavanagh K, Pollock KG, Cuschieri K, Palmer T, Cameron RL, Watt C, et al. Changes in the prevalence of human papillomavirus following a national bivalent human papillomavirus vaccination programme lancet infectious diseases 2017 17(12) 1293-302
Kjaer SK, Nygård M, Dillner J, J et . A 12-Year Follow-up on the Long-Term Effectiveness of the Quadrivalent Human Papillomavirus Vaccine in 4 Nordic Countries. Clin Infect Dis. 2018: 18;66(3):339-345.
King et al (2015) Human papillomavirus DNA in men who have sex with men: type-specific prevalence, risk factors and implications for vaccination strategies. British Journal of Cancer (2015), 1–9
Kojic EM, Kang M, Cespedes MS, et al. Immunogenicity and safety of the quadrivalent human papillomavirus vaccine in HIV-1-infected women. Clin Infect Dis 2014; 59:127–35.
Kumar D, Unger ER, Panicker G et al. (2013), Immunogenicity of Quadrivalent Human Papillomavirus Vaccine in Organ Transplant Recipients. American Journal of Transplantation, 13: 2411–2417.
Kitchener HC, Almonte M, Wheeler P et al. (2006) HPV testing in routine cervical screening: cross sectional data from the ARTISTIC trial. Br J Cancer 95(1): 56-61.
Kreimer AR, Clifford GM, Boyle P, Franceschi S. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev 2005; 14:467-75
Lacey CJ, Lowndes CM and Shah KV (2006) Chapter 4: Burden and management of non-cancerous HPVrelated conditions: HPV-6/11 disease. Vaccine 24 Suppl 3 S35-41.
Lehtinen M, Paavonen J, Wheeler CM et al. (2012) Overall eff icacy of HPV-16/18 AS04-adjuvanted vaccineagainst grade 3 or greater cervical intraepithelial neoplasia: 4-year end-of-study analysis of the randomised, double-blind PATRICIA trial. Lancet Oncol, 13(1): 89-99. Erratum in: Lancet Oncol (2012) Jan;13(1)e1.
Lifetime risk estimates calculated by the Statistical Information Team at Cancer Research UK. Based on Office for National Statistics (ONS) 2016-based Life expectancies and population projections. Accessed December 2017 available at: https://www.cancerresearchuk.org/health-professional/cancer-statistics/risk/lifetimerisk#heading-Zero
Lin A, Ong KJ, Hobbelen P, et al. Impact and Cost-effectiveness of Selective Human Papillomavirus Vaccination of Men Who Have Sex With Men. Clin Infect Dis. 2016;64(5):580-588.
Lu B et al. (2011) Efficacy and safety of prophylactic vaccines against cervical HPV infection and diseases among women: a systematic review and meta-analysis. BMC Infectious Diseases 11: 13.
Macartney KK, Chiu C, Georgousakis M et al. Safety of human papillomavirus vaccines: a review. Drug Saf. 2013 Jun;36(6):393-412. doi: 10.1007/s40264-013-0039-5.
de Martel C, Maucort-Boulch D, Plummer M, Franceschi S. Worldwide relative contribution of hepatitis B and C viruses in hepatocellular carcinoma. Hepatology 2015; 62: 1190–200.
Machalek DA, Poynten M, Jin F et al. Anal human papillomavirus infection and associated neoplastic lesions in men who have sex with men: a systematic review and meta-analysis. Lancet Oncol. 2012May;13(5):487- 500.
Mark A, Carlsson RM and Granstrom M (1999) Subcutaneous versus intramuscular injection for booster DT vaccination of adolescents. Vaccine 17(15-16): 2067-72.
Marlow LAV, Waller J, Wardle et al. Barriers to cervical cancer screening among ethnic minority women: a qualitative study. J Fam Plann Reprod Health Care 22015;0:1–7. doi:10.1136/jfprhc-2014-101082.
McCance DJ (2004) Papillomaviruses. In: Zuckerman AJ, Banatvala JE, Pattison JR, Griffiths P and Schoub B (eds) Principles and practice of clinical virology. 5th edition. Wiley & Sons Ltd.
McClung NM, Gargano JW, Park IU et al. Estimated Number of Cases of High-Grade Cervical Lesions
Diagnosed Among Women — United States, 2008 and 2016. MMWR 2019;68:337–343. DOI: http://dx.doi.org/10.15585/mmwr.mm6815a1McClymont E, Lee M, Raboud J et al, The Efficacy of the Quadrivalent Human Papillomavirus Vaccine in Girls
and Women Living With Human Immunodeficiency Virus, Clinical Infectious Diseases. 2018 Jul 7. doi:10.1093/cid/ciy575. [Epub ahead of print]
Mesher D, Panwar K, Thomas SL, et al The Impact of the National HPV Vaccination Programme in England Using the Bivalent HPV Vaccine: Surveillance of Type-Specific HPV in Young Females, 2010-2016. J Infect Dis (2018); 218(6):911-921
Moscicki AB, Schiffman M, Kjaer S et al. (2006) Chapter 5: Updating the natural history of HPV and anogenital cancer. Vaccine 24 Suppl 3 S42-51.
Munoz N, Castellsague X, de Gonzalez AB et al. (2006) Chapter 1: HPV in the etiology of human cancer. Vaccine 24 Suppl 3 S1-S10.
National Statistics (2011) Geographic patterns of cancer survival in England: Patients diagnosed 2002–2004, followed up to 2009 Accessed: Feb. 2012. NHS Cervical Screening Review 2011 Accessed: Feb. 2012.
Cervical Screening Programme, England – 2017-18: Report. NHS Digital accessed May 2019: https://digital.nhs.uk/data-and-information/publications/statistical/cervical-screening-annual/england—2017-18
National Statistics Cervical Screening Programme, England – 2019-20 available at: https://digital.nhs.uk/dataand-information/publications/statistical/cervical-screening-annual/england—2019-20/author-copyright-andlicensing
NHS Cervical standards data report: 1April 2019 to 31 March 2020 Published 9 April 2021 available at: https://www.gov.uk/government/publications/cervical-screening-standards-data-report/cervical-standards-datareport-1-april-2019-to-31-march-2020
Nyitray AG, Carvalho da Silva RJ, Baggio ML, Lu B, Smith D, Abrahamsen M, Papenfuss M, Villa LL, LazcanoPonce E, Giuliano AR (2011) Age-specific prevalence of and risk factors for anal human papillomavirus (HPV) among men who have sex with women and men who have sex with men: the HPV in men (HIM) study. J Infect Dis 203: 49–57.
Office for National Statistics cancer registration statistics England available at: https://www.ons.gov.uk/
peoplepopulationandcommunity/healthandsocialcare/conditionsanddiseases/datasets/
Cancerregistrationstatisticscancerregistrationstatisticsengland Oriel JD (1971) Natural history of genital warts. Br J Vener Dis 47(1): 1-13.Parkin DM (2011). British Journal of Cancer; 105, S49 – S56; Cancers attributable to infection in the UK in 2010 Suppl 3 S11-25.
Porras C, Tsang SH, Herrero R et al Efficacy of the bivalent HPV vaccine against HPV 16/18-associated precancer: long-term follow-up results from the Costa Rica Vaccine Trial. Lancet Oncol. 2020 Dec;21(12):1643-1652. doi: 10.1016/S1470-2045(20)30524-6.
Public Health England. Sexually transmitted infections and screening for chlamydia in England: 2020 report. Available from: https://www.gov.uk/government/statistics/sexually-transmitted-infections-stis-annual-datatables.
Peto J, Gilham C, Fletcher O et al. (2004) The cervical cancer epidemic that screening has prevented in the UK. Lancet 364(9430): 249-56.
Plummer M, de Martel C, Vignat J et al. Global burden of cancers attributable to infections in 2012: a synthetic analysis. Lancet Glob Health 2016; 4(9): e609–e616
Psyrri A and DiMaio D (2008) Human papillomavirus in cervical and head-and-neck cancer. Nat Clin Pract Oncol 5(1): 24-31.
Ratna N, Sonubi T, Glancy M et al. Sexually transmitted infections and screening for chlamydia in England, 2020. September 2021, Public Health England, London
Safaeian M, Porras C, Pan Y et al. (2013). Durable antibody responses following one dose of the bivalent human papillomavirus L1 virus-like particle vaccine in the Costa Rica Vaccine Trial. Cancer Prev Res;
6(11):1242-50.




