第18章:乙型肝炎
2022年2月4日
须呈报
疾病
乙型肝炎是由乙型肝炎病毒(HBV)引起的肝脏感染。许多新感染乙型肝炎的人可能患有亚临床或流感样疾病。黄疸只发生在大约10%的幼儿和30-50%的成人身上。急性感染偶尔会导致暴发性肝坏死,这通常是致命的。
这种急性疾病通常在不知不觉中开始——伴有厌食、恶心和右上腹疼痛。发烧时,通常是轻微的。不适可能是深刻的。随着黄疸的发展,尿液颜色逐渐变深,粪便颜色逐渐变浅。对于没有出现肝炎症状的患者,只能通过异常肝功能试验和/或乙肝感染的血清学标志(如乙肝表面抗原(HBsAg)、乙肝核心IgM抗体(抗HBc IgM))来检测疾病。
该病毒通过肠胃外接触受感染的血液或体液传播。传播主要发生在:
- 通过阴道或肛门性交
- 由于经皮接触造成的血液接触(例如,注射毒品者共用针头和其他设备(PWID),”针刺”伤害)
- 通过围产期母婴传播
被感染者咬后也会传播,尽管这种情况很少见。随着献血者和捐赠品的筛选,输血相关感染现在在英国已经很少见了。在这个国家,血液制品的病毒灭活已经消除了它们作为传染源的可能性。
潜伏期为40至160天,平均60至90天。目前的感染可以通过血清中HBsAg的存在来检测。这些人的血液和体液应被视为具有传染性。在大多数个体中,感染会消失,HBsAg从血清中消失,但病毒在一些慢性乙型肝炎患者中仍然存在。
慢性乙型肝炎感染被定义为血清中HBsAg持续存在六个月或更长时间。在HBsAg阳性的患者中,血清中也检测到乙肝e抗原(HBeAg)的患者传染性最强。那些HBsAg阳性和HBeAg阴性(通常是抗-HBe阳性)的人具有传染性,但通常传染性较低。一部分HBeAg阴性的慢性感染者会有较高的HBV DNA水平,并可能更具传染性。
发展为慢性乙型肝炎感染的风险取决于获得感染的年龄。慢性感染发生在90%的围产期感染者中,但在儿童期感染者中不太常见(例如,在1至5岁的儿童中为20%至50%)。在成年后感染,大约5%或更少的以前健康的人成为慢性感染(Hyams,1995)。免疫力受损的人风险更高。
全世界大约20-25%的慢性HBV感染患者患有进行性肝病,导致一些患者肝硬化。进展的风险与肝脏中活跃的病毒复制水平有关。患有慢性乙型肝炎的个体——特别是那些患有活动性炎症和/或肝硬化的个体,在这些情况下细胞更新迅速——患肝细胞癌的风险增加。
疾病的历史和流行病学
世界卫生组织(WHO)估计,全球约有2.5亿人慢性感染HBV病毒(WHO 2017)。世卫组织根据乙型肝炎表面抗原的流行程度将国家分为高(超过8%)、中等(2-8%)和低(低于2%)流行国家。在许多高流行率国家,10%或更多的人口患有慢性乙型肝炎感染。高流行率地区包括撒哈拉以南非洲、亚洲大部分地区和太平洋岛屿。中等流行区域包括亚马逊、东欧和中欧南部、中东和印度次大陆。低流行率地区包括大部分西欧和北美。自1987年以来,世卫组织一直建议普及婴儿或青少年乙肝免疫接种。截至2008年,177个国家已将乙型肝炎疫苗作为其国家婴儿免疫规划的组成部分(WHO 2009)。2016年,世界卫生大会通过了世卫组织首个关于病毒性肝炎的全球卫生部门战略,其总体愿景是消除病毒性肝炎。在婴儿免疫接种计划中扩大乙型肝炎疫苗接种覆盖率被强调为一项成功的预防干预措施。
各种传播方式的重要性因特定国家的流行程度而异。在高度流行(和流行)的地区,感染主要在儿童期获得——通过围产期传播或幼儿间的水平传播。在低流行国家,大多数感染是在成年期发生的,在这些国家,性传播或注射吸毒者共用被血液污染的针头和设备(PWID)在新感染中占很大比例。在中等流行地区,围产期、儿童和成人感染的模式是混合的,医院感染可能是重要的。
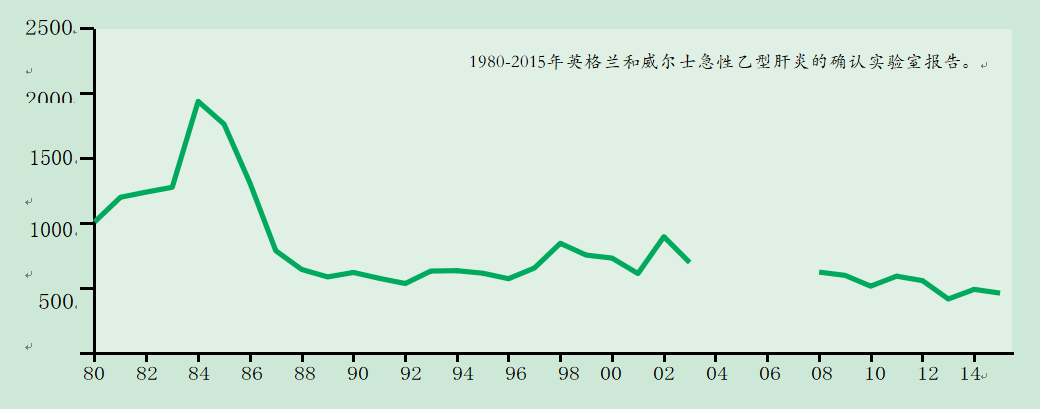
图18.1英格兰和威尔士确诊急性乙型肝炎的实验室报告。
从2008年起,HPZone上报告的病例仅与英格兰的实验室数据相匹配。由于无法区分急性和慢性病例,2004-2007年间没有数据
英国是一个流行率非常低的国家,但HBsAg的流行率在全国各地有所不同。在高流行国家出生的人感染率更高,其中许多人在出生时或幼儿期就已获得感染(Boxall et al., 1994; Aweis et al., 2001)。这反映在产前妇女的流行率上,在一些农村地区,流行率从0.05%到0.08%不等,但在某些内城地区,来自流行国家的人口较多,流行率高达1%或更高。总体而言,联合王国产前妇女的患病率约为0.4%(全国产前感染筛查监测https://www.gov.uk/government/publications/national-antenatal-infections-screening-monitoring-annual-data-tables).
在英国,急性感染的发病率较低,但在具有某些行为或职业风险因素的人群中发病率较高。因此,自20世纪80年代以来,已建议高危人群接种疫苗。急性乙型肝炎的实验室报告从1984年英格兰和威尔士略低于2000份报告的峰值下降到1992年的531份报告,这主要是由于PWIDs病例的下降(图18.1)。在其他风险群体中也出现了下降,这很可能与为应对艾滋病毒/艾滋病流行而改变风险行为有关,如避孕套的使用。高危人群中较高的疫苗接种覆盖率可能是最近发病率较低的原因之一,自2009年以来,报告病例数每年在500至600例左右波动。尽管在过去,英国大多数急性感染报告与注射毒品使用有关,但现在最常见的是异性接触,其次是男性之间的性行为。PWID的定期调查表明,在引入包括疫苗接种在内的减少危害政策后,乙型肝炎流行率低于1%(Public Health England 2016)。
由于英国是一个流行率和发病率非常低的国家,在婴儿或青少年时期使用单价乙肝疫苗的计划之前被发现不具有成本效益(Siddiqui et al., 2011)。此外,人们还担心,含有乙型肝炎的现有婴儿联合疫苗(包括2-或3-组分无细胞百日咳疫苗)可能产生较差的Hib反应。几年来,三组分无细胞百日咳混合疫苗已经在英国广泛使用。经验表明,按照英国目前的时间表,Hib加强剂在一岁内年龄,将实现充分的保护和Hib的持续控制。
因此,2014年,疫苗接种和免疫联合委员会重新评估了他们早期的建议,并建议普及乙型肝炎婴儿计划极有可能使用婴儿联合疫苗,具有成本效益(JCVI, October 2014)。已经采购了合适的疫苗,从2017年底开始进行常规婴儿免疫接种。
乙肝疫苗接种
有两类产品可用于乙型肝炎的免疫接种:一种疫苗提供主动免疫,一种特异性免疫球蛋白在等待疫苗应答时提供被动和暂时免疫。
乙肝疫苗
乙型肝炎疫苗作为单一产品或组合产品提供:
- 单价乙型肝炎疫苗(HepB)
- 二价联合疫苗:甲型肝炎和乙型肝炎(HepA/HepB)
- 含白喉/破伤风/无细胞百日咳/灭活脊髓灰质炎疫苗/乙型流感嗜血杆菌/乙型肝炎的六价联合疫苗(DTaP/IPV/Hib/HepB)
肾功能不全患者和透析患者也可获得含特异性单价乙型肝炎疫苗。
乙型肝炎疫苗包含使用重组DNA技术从酵母细胞中制备的HBsAg。抗原被吸附到氢氧化铝、磷酸铝或硫酸磷酸氢铝佐剂上。Fendrix®适用于肾功能不全的患者,由单磷酰脂质A辅助,并吸附在磷酸铝上。含乙型肝炎的疫苗是灭活的,不含活的生物体,不会引起它们所保护的疾病。在英国,硫柳汞不被用作乙型肝炎疫苗的防腐剂。
现有的疫苗通过产生针对HBsAg的特异性抗体(抗-HBs)在预防儿童和大多数成人感染方面非常有效。如果在暴露后不久接种,乙型肝炎疫苗在预防感染方面也非常有效(见下文)。理想情况下,免疫接种应在暴露后24小时内开始,尽管仍应考虑在暴露后一周内进行。
乙型肝炎免疫球蛋白
特异性乙型肝炎免疫球蛋白(HBIG)从经免疫和筛选的人类供体的血浆中获得。对所有献血者进行艾滋病毒、乙型肝炎和丙型肝炎筛查,并对所有血浆库进行这些病毒核酸的检测。生产过程中包括包膜病毒的溶剂去污剂灭活步骤。由于理论上存在从血浆产品传播vCJD的风险,英国使用的HBIG现在是从英国以外的血浆中制备的,并且供应稀缺。
HBIG提供被动免疫,在意外接种或被乙型肝炎病毒感染的血液污染后,可以立即提供临时保护。HBIG与乙肝疫苗同时注射,不影响主动免疫的发展。如果在免疫接种时已经发生感染,病毒增殖可能不会被完全抑制,但严重的疾病,最重要的是,携带状态的发展是可以预防的。
HBIG在暴露后用于提供快速保护,直到应同时注射的乙型肝炎疫苗生效。由于单独使用疫苗非常有效,因此仅建议在高风险情况下或已知对疫苗无反应的情况下,在使用疫苗的同时使用HBIG。每当需要立即保护时,应接种疫苗。必要时,HBIG也应与疫苗同时注射,理想情况下在疫苗注射后24小时内,尽管仍可考虑在暴露后一周内注射。
储存
疫苗应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
HBIG应储存在+2℃至+8℃的冰箱中。这些产品可耐受环境温度长达一周。如果需要,可以在冷链外用坚固的包装分发。
剂型
表18.1乙型肝炎疫苗的介绍
| 疫苗 | 产品 | 剂型 | 处理疫苗的说明 |
| 单价乙型肝炎
(HepB) |
Engerix B®
Fendrix® HBvaxPRO® |
注射用混悬液 | 充分摇动疫苗,以获得稍微不透明的白色悬浮液 |
| 甲型和乙型肝炎联合疫苗
(HepA高效空气过滤器) |
Twinrix Adult®
Twinrix Paediatric® |
注射用混悬液 | 充分摇动疫苗,以获得稍微不透明的悬浮液 |
| Ambirix® | 预冲注射器中的注射用混悬液 | 充分摇动疫苗,以获得稍微不透明的悬浮液 | |
| 六价乙型肝炎
(DTaP/IPV/Hib/HepB) |
Infanrix hexa® | 小瓶和悬浮液中的粉末(Hib)
DTaP/IPV/HepB注射用预冲注射器 |
按照制造商的说明将粉末重新制成液体悬浮液 |
HBIG是一种清澈的浅黄色液体或浅棕色溶液,分装在容量为500国际单位的小瓶中(200国际单位的小瓶已不再供应)。
剂量
目前,许可的疫苗每毫升含有不同浓度的抗原。应遵守适当的制造商剂量(除非下表中另有规定,例如新生儿的HBIG)。
不同的乙型肝炎疫苗产品可用于完成初级免疫过程,或在需要时,作为先前接受过另一种乙型肝炎疫苗的个体的加强剂量(Bush et al., 1991)。
乙型肝炎
表18.2按年龄分列的单价乙型肝炎疫苗剂量
| 疫苗产品 | 年龄和群体 | 剂量 | 体积 |
| Engerix B® | 0至15岁* | 10µg | 0.5ml |
| Engerix B® | 16岁或以上 | 20µg | 1.0ml |
| Fendrix® | 15岁及以上肾功能不全的患者 | 20µg | 0.5ml |
| HBvaxPRO Paediatric® | 0-15岁 | 5µg | 0.5ml |
| HBvaxPRO® | 16岁或以上 | 10µg | 1.0ml |
| HBvaxPRO40® | 成人透析和透析前患者 | 40µg | 1.0ml |
| *如果使用两剂方案(见下文),11-15岁的儿童可服用20µg Engerix B | |||
表18.3按年龄分列的含乙肝疫苗的组合剂量
| 疫苗产品 | 年龄 | 其他抗原的剂量 | HBV剂量 | 体积 |
| Twinrix
Adult® |
16岁或以上 | 720 ELISA单位HAV | 20µg | 1.0ml |
| Twinrix
Paediatric® |
1至15岁 | 360 ELISA单位HAV | 10µg | 0.5ml |
| Ambirix® | 1至15岁 | 720 ELISA单位HAV | 20µg | 1.0ml |
| Infanrix
hexa® |
6周龄–2岁 | 30国际单位(IU)白喉类毒素;40IU破伤风类毒素;
25µg百日咳类毒素(PT);25µg丝状血凝素(FHA);8 µg佩尔塔廷(PRN); 40个1型D抗原单位(DU ), 8个DU 2型和32DU 3型脊髓灰质炎病毒D抗原; 10 µg吸附的纯化Hib荚膜多糖共价结合到约25 µg破伤风类毒素上 |
10µg | 0.5ml |
表18.4 HBIG的剂量
| 年龄群 | 剂量 |
| 新生儿和0-4岁儿童 | 250IU |
| 5-9岁的儿童 | 300IU |
| 10岁或以上的成人和儿童 | 500IU |
乙型肝炎
日程安排
乙型肝炎疫苗有许多不同的免疫程序,这取决于使用的疫苗产品和暴露前后需要多快得到保护。这些时间表将在每个适应症下详细讨论。
接种
含乙型肝炎的疫苗通常在上臂或大腿前外侧肌肉注射。不得使用臀部,因为疫苗效力可能会降低。
含乙型肝炎的疫苗可与其他疫苗同时接种,包括白喉、破伤风、百日咳、脊髓灰质炎、乙型流感嗜血杆菌结合物、4CMenB、甲型肝炎、MMR、肺炎球菌结合物、口服轮状病毒和旅行疫苗。疫苗应该在不同的部位注射,最好是在不同的肢体。如果接种在同一个肢体,它们应该至少分开2.5厘米(American Academy of Pediatrics, 2003)。应在个人记录中注明每种疫苗的注射地点。
对于患有出血性疾病的患者,应通过皮下深层注射接种疫苗,以降低出血风险。
HBIG可以在臀部外上象限或大腿前外侧接种(见第4章)。如果给幼儿和婴儿服用超过3ml,或给较大的儿童和成人服用超过5ml,免疫球蛋白应分成较小的剂量,并在不同的部位接种。HBIG可以在接种乙肝疫苗的同时,在不同的地点接种。
处理
根据地方当局法规和卫生技术备忘录07-01:医疗废物的安全管理(Department of Health, 2013)中的指导,用于疫苗接种的设备,包括用过的小瓶、安瓿或部分排出的疫苗,应在疗程结束时通过密封在适当的防穿刺“锐器”盒中进行处置。
疫苗使用建议
免疫接种计划的目标是为以下人群提供至少三剂乙肝疫苗:
- 婴儿,作为常规儿童免疫接种计划的一部分,以预防未来的暴露风险(暴露前免疫接种)
- 暴露于病毒或疾病并发症高风险的个人(暴露前免疫接种)。
- 已经暴露于病毒(暴露后免疫)的个人,包括乙型肝炎感染母亲所生的婴儿
乙型肝炎
常规儿童免疫接种计划
在常规免疫接种方案中,在适当的时间间隔(8、12和16周龄)总共接种三剂疫苗被认为能提供令人满意的长期保护。适当的时间间隔由保护个人免受白喉、破伤风、百日咳、脊髓灰质炎和Hib的需要决定。
选择性新生儿免疫接种计划
暴露后免疫接种提供给乙型肝炎感染母亲所生的婴儿,通过产前筛查确定,以防止出生时或出生前后母婴传播。婴儿的免疫接种应在出生后尽快开始,不迟于24小时,然后在4周龄和8周龄后注射一剂,并在一岁时再注射一剂。从2017年底开始,由于乙型肝炎被纳入常规儿童免疫接种计划,选择性新生儿计划中的8周龄剂量将作为常规计划的一部分在DTaP/IPV/Hib/HepB提供,12周龄和16周龄的额外剂量也是如此。
选择性免疫接种计划
暴露后立即接种疫苗用于预防暴露后的感染,例如针刺伤(见下文),然后在一个月和两个月后接种。暴露前疫苗接种也用于保护暴露于病毒或疾病并发症的高风险个体。
暴露前免疫接种
初级免疫接种
10岁以下的婴儿和儿童
从2017年底开始,常规儿童计划包括三剂甲肝疫苗
一岁前,每剂之间间隔一个月的含b产品。如果第一疗程中断,应重新开始,但不能重复,允许剩余剂量间隔四周。
已完成白喉、破伤风、百日咳、Hib和脊髓灰质炎初级疗程,但未接种含乙型肝炎疫苗的1至10岁儿童不需要接种任何含乙型肝炎疫苗,除非他们属于高风险群体或暴露于乙型肝炎(见下文)。
暴露于疾病或疾病并发症的高风险人群
暴露前免疫接种用于因其生活方式、职业、共存的医疗条件或其他因素(见下文)而具有增加的乙型肝炎或该疾病并发症风险的个人。重要的是,乙型肝炎免疫接种不鼓励放松旨在防止暴露于病毒的其他措施,例如避孕套的使用和针头交换。进行免疫接种的医护人员应利用这个机会提供其他预防措施的建议,或安排转介到适当的专科服务。
如果临床上需要检测当前或过去感染的标记物,例如对感染者的家庭接触者,应在注射首剂的同时进行检测。在等待测试结果的时候,疫苗接种不应该被推迟。有明确既往暴露证据的人可能不需要进一步的剂量。建议以下人群进行暴露前免疫接种。
乙型肝炎
注射毒品者(PWID)
PWID人特别容易感染乙型肝炎。建议为以下人群接种疫苗:
- 所有当前的PWID,作为一个高度优先
- 那些间歇注射的人
- 有可能“发展”到注射的人,例如目前吸食海洛因和/或快克可卡因的人,以及严重依赖安非他明的人
- 与现有注射者生活在一起的非注射使用者
- PWID的性伴侣、子女、其他家庭和近亲
频繁更换性伴侣的人
那些频繁更换性伴侣的人、男男性行为者(MSM)以及男性和女性商业性工作者特别容易受到感染,应该接种疫苗。
一个慢性乙型肝炎感染病例或个人的密切家庭接触者
个人的性伴侣是最有传播风险的,他们和家庭密切接触者应接种疫苗。应在注射第一剂时采血
疫苗来确定他们是否已经被感染。接触者显示为HBsAg,抗-HBs或抗-HBc阳性不需要进一步免疫。应该给出正确使用避孕套的建议。
乙型肝炎阴性妇女所生的新生儿,但已知将回家与另一名乙型肝炎感染者同住,可能有立即感染乙型肝炎的风险。在这些情况下,应在出院前提供单价剂量的乙型肝炎疫苗。然后他们应该从8周龄开始继续常规的儿童期计划。
最近与急性乙型肝炎患者或HBsAg阳性者发生无保护性行为的接触者需要暴露后预防,包括HBIG(见下一节)。
从乙型肝炎高或中度流行国家收养儿童的家庭
这些家庭的成员可能处于危险之中,因为这些孩子可能会被慢性感染(Christenson, 1986; Rudin et al., 1990)。当被收养儿童的身份不明时,从任何高或中等流行国家收养儿童的家庭应被告知风险,并建议接种乙型肝炎疫苗。对这些儿童进行测试是明智的,因为将受感染的儿童转诊接受进一步治疗可能会有好处。
乙型肝炎
寄养照料者
一些需要寄养的儿童感染乙型肝炎的风险可能会增加。紧急安置可能在几个小时内完成:接受儿童作为紧急安置的寄养照料者应了解未确诊感染的风险,以及如何将所有血液传播病毒感染的传播风险降至最低。所有接受紧急安置的短期寄养照料者及其家人都应接受乙肝免疫接种。接受已知感染乙肝的儿童的长期寄养照料者(及其家人)也应接受免疫接种。
定期接受血液或血液制品的个人及其护理人员
那些定期接受血液制品的人,如血友病患者,应该接种疫苗。接受定期输血的人,例如地中海贫血或其他慢性贫血患者,应接种乙型肝炎疫苗。负责管理此类产品的护理人员也应接种疫苗。
慢性肾衰竭患者
肾衰竭患者可能需要血液透析,此时他们患乙型肝炎的风险可能会增加。肾衰竭患者对乙型肝炎疫苗的反应低于健康成人。45%至66%的慢性肾衰竭患者出现抗-HBs反应,与免疫功能正常的个体相比,其抗-HBs下降更快。然而,据报道,为慢性肾衰竭患者配制的疫苗的应答率增加(Tong et al., 2005)。建议对该患者组进行检测(参见后面的检测章节)。
对于已经接受血液透析或肾移植治疗的患者,以及其他患有慢性肾衰竭的患者,只要预计他们可能需要这些干预措施,就建议进行乙肝免疫接种。应使用为慢性肾功能不全患者配制的疫苗。
慢性肝病患者
患有慢性肝病的人感染乙型肝炎的风险可能会增加。因此,建议患有严重肝病(如任何原因引起的肝硬化)的患者接种乙肝疫苗。疫苗也应该提供给轻度肝病患者,特别是那些慢性丙型肝炎病毒感染者,他们可能有共同的危险因素,这意味着他们感染乙型肝炎的风险增加。
拘留机构的囚犯
在英国,建议所有被判刑的囚犯和所有新入狱的囚犯接种乙肝疫苗。
为有学习困难的人提供住宿的个人
与普通人群相比,在住宿条件下学习困难的个体中发现慢性乙型肝炎感染的患病率更高。密切的日常生活接触和行为问题的可能性可能导致居民感染风险增加。因此建议接种疫苗。
乙型肝炎
类似的考虑可能适用于日托、学校和严重学习障碍者中心的儿童和成人。免疫接种的决定应在当地风险评估的基础上做出。在个人行为可能导致大量定期暴露(如咬伤或被咬伤)的环境中,即使没有记录的乙型肝炎传播,也应为个人提供免疫接种。
前往或将要居住在高流行率或中等流行率地区的人前往高流行率或中等流行率地区的旅行者
前往高或中等流行地区并在国外面临危险的旅行者应接受免疫接种。使他们面临危险的行为将包括性活动、注射吸毒、从事救济援助工作和/或参与接触性运动。在不安全的治疗性注射(如不消毒而重复使用受污染的针头和注射器)是乙型肝炎危险因素的国家,旅行者也有获得感染的风险(Kane et al., 1999; Simonsen et al.,1999)。因此,在这些国家需要医疗或牙科程序的高风险个人应进行免疫接种,包括:
- 那些计划长期留在高流行或中等流行地区的人
- 在高或中度流行国家旅行探亲访友时可能需要医疗护理的儿童和其他人
- 在海外时可能需要住院治疗的慢性病患者例如透析
- 那些为了医疗保健而旅行的人
面临职业风险的个人
建议以下被认为风险增加的组接种乙肝疫苗:
- 英国和海外的医护人员(包括学生和实习生):所有可能直接接触患者血液、血染体液或组织的医护人员都需要接种疫苗。这包括任何有被血液污染的锐器伤害或被患者故意伤害或咬伤风险的工作人员。应从适当的职业健康部门获得建议。
- 实验室工作人员:任何处理可能含有病毒的材料的实验室工作人员都需要接种疫苗。
- 为有学习困难的人提供住宿和其他住宿的工作人员:在住宿的某些有学习困难的病人群体中发现乙型肝炎携带率高于一般人群。密切接触和行为问题的可能性,包括咬伤和抓伤,可能导致工作人员感染风险增加。
类似的考虑可能适用于日托机构和为有严重学习障碍的人开设的特殊学校的工作人员。免疫接种的决定应在当地风险评估的基础上做出。在客户的行为可能导致大量定期经皮暴露的情况下(如咬伤),即使没有记录的乙型肝炎传播,为员工提供免疫接种也是明智的。
- 其他职业风险群体:在一些职业群体中,如殡仪业和防腐业,存在乙型肝炎的风险,建议进行免疫接种。还建议定期接触囚犯的所有监狱工作人员进行免疫接种。
也可以考虑为警察、消防和救援人员等其他群体接种乙肝疫苗。对于这些工人,应进行可能接触频率的评估。对于经常接触的人,建议进行接触前免疫接种。对于其他群体,在事故发生时进行暴露后免疫接种可能更合适(见下文)。这种选择必须由当地职业卫生服务部门决定,或者根据适当的医疗建议做出。
暴露前免疫接种计划婴儿和儿童
DTaP/IPV/Hib/HepB建议在8、12和16周龄接种,但也可以在6周龄到10岁的任何阶段接种。
早产儿疫苗接种
根据时间表,早产儿在适当的实足年龄(即出生后的年龄,未经校正)接种疫苗非常重要。
高危个体暴露前免疫接种计划
对于大多数成人和儿童风险群体的暴露前预防,应使用加速时间表,在零个月、一个月和两个月接种疫苗。在依从性困难的群体中(如PWID和泌尿生殖医学诊所就诊者),加速时间表(零个月、一个月和两个月)实现了更高的完成率(Asboe et al., 1996)。与零个月、一个月和六个月的方案相比,这种依从性的提高可能会抵消免疫原性的轻微降低,并且通过在12个月后机会性地使用第四剂可以获得相似的应答率。零个月、一个月和六个月的替代计划只应在不需要快速保护且合规可能性较高的情况下使用。如果首次免疫被中断,它应该恢复,但不能重复。
Engerix B®也可以非常快速地接种,在第0天、第7天和第21天接种三次(Bock et al., 1995)。当使用这一方案时,第四剂应在第一剂后12个月施用,以提供更长期的保护。该时间表被许可用于18岁以上的成年人面临直接风险以及需要更快速的保护诱导的情况。这包括前往高发地区的人、残疾人和囚犯。18岁以下的青少年对疫苗的反应通常比老年人好(Plotkin和Orenstein,2004)。虽然没有针对该年龄组的许可,但非常快速计划可以用于16至18岁的人群,在这些人群中,提供快速保护和最大限度地提高依从性很重要(例如,残疾人和监狱中的人)。
Twinrix Adult®疫苗也可以在第0天、第7天和第21天接种。这将提供比其他方案更快速的乙型肝炎保护,但对甲型肝炎的完全保护将晚于含更高剂量甲型肝炎的疫苗(见第17章)。当使用这一方案时,第四剂应在第一剂后12个月施用,以提供更长期的保护。
Fendrix®建议在零、一、二、六个月接种。
对于15岁以下的儿童,含成人强度乙型肝炎疫苗(1至15岁的儿童使用Ambirix®疫苗,11至15岁的儿童使用 Engerix B®疫苗)的两剂疫苗在0个月和6个月时提供了与三剂儿童乙型肝炎疫苗相似的保护作用。
接受暴露前免疫接种者的强化剂量
乙型肝炎疫苗提供的保护的完整持续时间尚未确定(Whittle et al., 2002)。疫苗诱导的乙肝抗体水平随着时间的推移而下降,但有证据表明,免疫记忆可以在那些成功免疫的人中持续存在(Liao et al.,1999, Poovorawan et al., 2010, Bruce et al., 2016, Simons et al., 2016)。虽然一些证据表明,并不是所有的个人作出这种遗忘反应(Williams et al., 2003; Boxall et al., 2004),其临床意义尚不清楚。世卫组织的结论是,尽管对预防感染和疾病的持续时间的了解仍然不完全,但研究表明,在成功接种免疫疫苗的免疫活性个体中,对慢性感染的保护持续20-30年或更长时间。因此,世卫组织得出结论,没有令人信服的证据建议在常规免疫规划中加强乙肝疫苗剂量(WHO,2017)。
基于这一结论,英国目前的建议是,那些已经接受初级免疫疗程的人,包括根据常规儿童期计划接种疫苗的儿童和高暴露风险的个人,不需要加强剂量的含HepB疫苗,以下类别除外:
- 卫生保健工作者(包括学生和实习生),应在初级免疫接种后大约五年,向他们提供一次加强剂量的疫苗
- 肾衰竭患者(见下一节)
- 在重大风险暴露时(见下一节)
暴露后免疫接种
应迅速开始暴露后预防,以保护以下人群。
感染乙型肝炎的母亲所生的婴儿(选择性新生儿免疫接种计划)
乙型肝炎感染可在出生时或出生前后由受感染的母亲传播给婴儿(围产期传播)。此时感染的婴儿有很高的风险成为慢性病毒感染。围产期传播后慢性感染的发展在90%以上的情况下可以通过从出生时立即开始的适当疫苗接种来预防。
自1998年以来,卫生部和现在的英国国家筛查委员会(UK NSC)建议人群进行妊娠期乙型肝炎筛查(Department of Health,,1998年)。该方案的主要目标是通过为婴儿提供及时的接触后疫苗接种来减少母婴传播的风险。怀孕期间的早期识别也有助于对母亲和婴儿进行适当的评估和管理。患有乙型肝炎的孕妇应该接受多学科团队提供的护理,以确保所有方面都得到审查和管理。应该为婴儿的出生制定适当的护理计划和新生儿警报。
那些显示被感染的母亲,应该进行确认性测试和乙肝e抗原和病毒载量测试。如果未预约的母亲临产,应进行紧急HBsAg测试,以确保乙型肝炎感染母亲所生的婴儿在出生后24小时内可以适当接种疫苗。乙型肝炎e抗原和/或病毒载量也应迅速进行,以建议是否也需要HBIG。
这些母亲所生的所有婴儿都应按时接受完整疗程的疫苗接种;首剂疫苗应尽快注射,最好在出生后24小时内注射。应做出安排,确保与适当的当地机构共享信息,以促进后续行动。
高传染性母亲所生的婴儿应接受HBIG和主动免疫接种(见表18.5)。婴儿的管理应基于母亲的e抗原物和乙型肝炎病毒载量检测的结果。理想情况下,HBIG应在出生前提前订购,并在不同的地点与疫苗同时接种。如果做不到这一点,应该责令HBIG在出生后24小时内注射疫苗。
表18.5根据母亲的乙型肝炎状况为婴儿接种疫苗
| 母亲的乙肝状况 | 婴儿应该接受 | |
| 乙型肝炎疫苗 | HBIG | |
| 母亲HBsAg阳性,HBeAg阳性 | 是 | 是 |
| 母亲HBsAg阳性,HBeAg阴性,抗HBe阴性 | 是 | 是 |
| 母亲在怀孕期间患有急性乙型肝炎 | 是 | 是 |
| 母亲是HBsAg阳性和抗HBe阳性 | 是 | 不 |
| 母亲是HBsAg阳性,并且已知在本次怀孕期间的任何产前样本中HBV DNA水平等于或高于1×106IUs/ml
(不考虑HBeAg和抗HBe状态) |
是 | 是 |
| 母亲HBsAg阳性,婴儿体重不超过1500克 | 是 | 是 |
早产儿疫苗接种
有证据表明,早产低出生体重婴儿对乙型肝炎疫苗的反应较低(Losonsky et al., 1999)。因此,早产儿按时接受全部儿科剂量的乙型肝炎疫苗是很重要的。出生体重小于或等于1500克的感染乙型肝炎的母亲所生的婴儿,无论母亲的e抗原状态或病毒载量如何,除了接种疫苗外,还应接种HBIG。由于这一组婴儿接种疫苗的益处很大,因此不应停止或推迟接种疫苗。
选择性新生儿计划的暴露后时间表和随访
乙型肝炎病毒感染母亲所生的婴儿应采用加速免疫接种时间表,在出生时、出生后4周和出生后48周接种一剂含乙型肝炎病毒的疫苗。从2017年底开始,常规儿童免疫接种计划包括乙型肝炎,因此这些婴儿将在出生时和4周时接种单价疫苗,但在8周时接种含乙型肝炎的六价疫苗,而不是单价疫苗。然后,他们应该在第12周和第16周接受额外的六价疫苗剂量(见表18.6)。
一岁时再注射一剂单价HepB疫苗,同时进行乙肝表面抗原检测。在一岁时进行检测对于识别尽管接种了疫苗但仍慢性感染乙肝的婴儿非常重要,并允许及时转诊以进行进一步治疗。该测试可在一岁时注射剂量的同时进行,或在注射后不久进行。对于那些已经使用含乙型肝炎的六价疫苗完成常规初次免疫的儿童,不再推荐在3岁零4个月时再次接种含乙型肝炎疫苗。然而,学龄前强化访问(MMR和dTaP/IPV或DTaP/IPV疫苗接种)提供了一个检查儿童是否得到适当管理的机会,即完全接种乙肝疫苗并进行感染检测。
如果免疫接种延迟超过了推荐的时间间隔,则应恢复疫苗接种,但儿童更有可能被感染。在这种情况下,一岁以上婴儿的HBsAg检测尤为重要。
表18.6引入含乙型肝炎的六价疫苗后常规儿童期和选择性新生儿免疫接种计划的乙型肝炎免疫接种时间表
| 年龄 | 常规儿童方案 | 感染乙型肝炎的母亲所生的婴儿 |
| 出生 | † |
|
| 4周龄 | |
|
| 8周龄 |
|
|
| 12周龄 |
|
|
| 16周龄 |
|
|
| 1岁 | * |
|
| 三年零四个月 | * | * |
†乙型肝炎阴性妇女所生的新生儿,但已知将回家与另一名乙型肝炎感染者同住,可能有立即感染乙型肝炎的风险。在这些情况下,应在出院前提供单价剂量的乙型肝炎疫苗。然后他们应该从八周开始继续常规的儿童期计划。
*按照常规计划接种推荐的不含乙肝病毒的疫苗
可能暴露于乙型肝炎的其他人群
任何潜在暴露于乙型肝炎感染的血液或体液的个人应立即获得乙型肝炎保护。表18.7总结了现有的暴露后预防指南,具体取决于先前的疫苗接种状态和来源状态。(引自PHLS肝炎小组委员会,1992年) (https://www.gov.uk/government/collections/hepatitis-b-guidance-data-and-analysis).
性伴侣
急性乙型肝炎患者的任何性伴侣都应接受疫苗保护,如果在最后一次接触后一周内被发现,还应接受HBIG。新诊断的慢性乙型肝炎患者的性接触者应接种疫苗;如果在过去一周内第一次与新伴侣发生无保护的性接触,可以考虑HBIG。应建议个人正确使用避孕套,至少在第二次注射后,以及完成疗程以最大限度降低感染风险的重要性。
意外接种疫苗或被污染的人员
这包括那些被已知HBsAg阳性者的血液污染眼睛或口腔,或皮肤的新伤口或擦伤(如社区或职业针刺伤和咬伤)的人。遭受此类事故的个人应该用肥皂和温水彻底清洗受影响的区域,并寻求医疗建议。此类事故后的预防建议应通过电话从最近的公共卫生实验室或当地健康保护小组或随叫随到的病毒学家处获得。意外暴露后的建议也可从职业健康服务和医院感染控制官员处获得。
其他群体的暴露后时间表和随访
对于暴露后预防,应使用单价乙型肝炎疫苗(或同等强度的联合疫苗)的加速方案,在第0、1和2个月接种疫苗。如果还需要HBIG,应尽快接种,最好在接种第一剂疫苗的同时或24小时内,但不要在暴露后7天内。
其他地方总结了感染后续检测指南(PHLS肝炎小组委员会,1992年) (https://www.gov.uk/government/collections/hepatitis-b-guidance-data-and-analysis).
强化免疫
那些已经接受0、1和2个月加速方案的暴露后预防的患者,在12个月时不需要进一步的剂量,除非他们仍然处于持续的高风险中。此后,这些人不需要加强剂量的含乙型肝炎疫苗,以下类别除外:
- 卫生保健工作者,包括学生和实习生,应在初级免疫接种后大约五年,只给他们提供一次加强剂量的疫苗
- 肾衰竭患者(见下一节)
- 在随后的重大暴露时(表18.7)
表18.7报告暴露事件的乙型肝炎预防
| 显著暴露 | 非重大风险 | ||||
| 暴露前人员的HBV状态 | HBsAg阳性来源 | 未知来源 | HBsAg阴性来源 | 持续风险 | 没有进一步的风险 |
| 未接种疫苗 | 第一剂HepB疫苗加HBIG加速疗程 | HepB疫苗的加速进程 | 考虑HepB疫苗的过程 | 启动HepB疫苗进程 | 没有HBV预防放心 |
| 部分接种 | 一剂HepB疫苗并完成疗程 | 一剂HepB疫苗并完成疗程 | HepB疫苗全程 | HepB疫苗全程 | HepB疫苗全程 |
| 完全接种初级疫苗 | HepB疫苗的加强剂量,如果最后一次剂量≥1年前 | 如果最后一次剂量≥1年前,考虑HepB疫苗的加强剂量 | 没有HBV预防法。使消除疑虑 | 没有HBV预防放心 | 没有HBV预防放心 |
| 已知对HepB疫苗无应答者(抗-HBs免疫接种后1-2个月< 10mIU/ml) | HBIG | HBIG | 没有HBIG | 没有HBIG
考虑HepB疫苗的加强剂量
|
没有HBV预防放心
|
| HepB疫苗的加强剂量 | 考虑HepB疫苗的加强剂量 | 考虑HepB疫苗的加强剂量 | |||
| 第二剂HBIG应该在一个月后注射 | 第二剂HBIG应该在一个月后注射 | ||||
改编自:PHLS肝炎小组委员会(1992)。
疫苗接种反应测试
乙型肝炎疫苗非常有效;大约90%的成年人对疫苗反应良好。不良反应大多与年龄超过40岁、肥胖和吸烟有关(Roome et al., 1993)。据报道,在有酒精依赖的人群中,尤其是那些患有晚期肝病的人群中,血清转换率较低(Rosman et al., 1997)。免疫抑制或肾透析患者的反应可能不如健康人,可能需要更大或更频繁的疫苗剂量。
该疫苗对急性乙型肝炎患者无效,对已知有当前(HBsAg)或过去(抗-HBc)感染标记的个体也没有必要。然而,在等待当前或过去感染的任何测试结果时,不应推迟免疫接种。
不建议常规检测免疫后的免疫证据(抗-HBs ),除非在下述特定人群中。
那些有职业暴露风险的人
对于那些有职业暴露风险的人,尤其是医护人员和实验室工作人员,应在完成初级疫苗疗程后1至2个月检查抗-HBs滴度。根据《 Control of Substances Hazardous to Health有害健康物质控制(COSHH)条例》,每个工人都有权知道他们是否得到了保护。此类信息有助于在已知或疑似暴露于病毒后做出适当的暴露后预防决定(见上文)。
对乙型肝炎疫苗的抗体反应在个体之间差异很大。尽管通常认为10mIU/ml或更高的抗-HBs水平足以防止感染,但优选达到100mIU/ml以上的抗-HBs水平。一些抗-HBs检测在较低水平下不是特别特异,100mIU/ml的抗-HBs水平提供了建立特异性反应的更大信心。
抗-HBs水平大于或等于100mIU/ml的应答者不需要任何进一步的初始剂量。在免疫活性个体中,一旦建立了应答,就不需要进一步评估抗体水平。抗- HBs水平为10-100 mIU/ml的应答者应在那时接受一剂额外的疫苗。在免疫功能正常的个体中,不需要进一步评估抗体水平。目前的建议是,应该在初次免疫接种五年后,只给医护人员和实验室工作人员提供一次加强剂量的疫苗。
低于10mIU/ml的抗体水平被分类为对疫苗无反应,检测当前或过去感染的标记是良好的临床实践。对于无应答者,建议重复接种一个疗程的疫苗,然后在第二个疗程后一至两个月再次检测。那些抗-HBs水平仍然低于10mIU/ml的人,以及那些没有当前或过去感染标志的人,如果暴露于病毒,将需要HBIG的保护。
肾衰竭患者
免疫记忆在接受肾透析的慢性肾衰竭患者中的作用似乎尚未得到研究,只有当抗-HBs水平保持在10mIU/ml以上时,保护作用才可能持续。因此,应每年监测抗体水平,如果低于10mIU/ml,应对之前对疫苗有反应的患者进行加强剂量的疫苗接种。
加强剂量也应提供给任何打算访问乙型肝炎高流行国家和以前对疫苗有反应的血液透析患者,特别是如果他们将接受血液透析并且在过去12个月中没有接受加强剂量。
禁忌症
极少数人不能接种含乙肝疫苗。如有疑问,应寻求相关专家顾问、当地筛查和免疫团队或当地健康保护团队的适当建议,而不是扣留疫苗。
疫苗不应注射给患有以下疾病的人:
- 对先前剂量的含乙型肝炎疫苗确认过敏反应,或
- 对疫苗的任何成分的确认过敏反应
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
先前接种过DTaP/IPV/Hib/HepB或DTaP/IPV/Hib疫苗后出现全身或局部反应的儿童可继续接种后续剂量的含乙肝疫苗。这些反应包括:
- 发烧,不论其严重程度
- 低渗-低反应性发作(HHE)
- 持续哭闹或尖叫超过三小时,或
- 严重的局部反应,无论程度如何
怀孕和母乳喂养
孕妇感染乙型肝炎可能导致母亲的严重疾病和新生儿的慢性感染。如果孕妇属于高风险类别,则不应拒绝其免疫接种。没有证据表明给孕妇或哺乳期妇女接种灭活病毒或细菌疫苗或类毒素(Kroger et al., 2013)有风险。由于乙型肝炎是一种灭活疫苗,对胎儿的风险可能是微不足道的,应该在有明确感染风险的地方注射。
早产儿
根据时间表,早产儿在适当的年龄接种疫苗是很重要的。接种疫苗后窒息的发生率在早产婴儿中特别高。
住院的极早产儿(出生时≤ 28周)在接受第一次免疫接种时,应进行48-72小时的呼吸监测,尤其是那些先前有呼吸不成熟病史的婴儿。如果早产儿在第一次免疫接种后出现呼吸暂停、心动过缓或不饱和,第二次免疫接种也应在医院进行,并进行48-72小时的呼吸监测(Pfister et al., 2004; Ohlsson et al., 2004; Schulzke et al., 2005; Pourcyrous et al., 2007; Klein et al., 2008)。
由于这一组婴儿接种疫苗的益处很大,因此不应停止或推迟接种疫苗。
艾滋病毒和免疫抑制个体
乙肝疫苗可以给HIV感染者,也应该提供给那些有风险的人,因为免疫抑制的HIV阳性患者获得的感染会导致较高的慢性感染率(Bodsworth et al., 1991)。根据免疫抑制的程度,应答率通常较低(Newell and Nelson, 1998; Loke et al., 1990)。增加剂量数量或使用更高抗原含量的剂量可以改善HIV感染个体的抗-HBs应答(Rey et al., 2000; Fonseca et al., 2005)。
皇家儿科和儿童健康学院(www.rcpch.ac.uk)英国艾滋病毒协会(BHIVA)艾滋病毒感染成人免疫指南(BHIVA,2015)和儿童艾滋病毒协会(CHIVA)免疫指南http://www.chiva.org.uk/guidelines/immunisation/).
神经疾病
神经系统疾病的存在不是免疫接种的禁忌症,但如果有证据表明目前的神经系统恶化,可以考虑推迟六价DTaP/IPV/ Hib/HepB联合疫苗,以避免基础疾病的任何变化的不正确归因。这种延迟的风险应该与可预防感染的风险相平衡,并且一旦诊断和/或预期的疾病过程变得清楚,就应该立即进行疫苗接种。
HBIG的预防措施
当HBIG用于预防乙型肝炎时,必须记住它可能会干扰活病毒疫苗主动免疫的后续发展。这不适用于黄热病疫苗,因为HBIG不含大量针对这种病毒的抗体。其他活病毒疫苗接种应延期或三个月后重复。
不良反应
单价乙肝疫苗
乙型肝炎疫苗通常耐受性良好,最常见的不良反应是注射部位疼痛和发红。其他已报告但可能与因果关系无关的反应包括发热、皮疹、不适和流感样综合征、关节炎、关节痛、肌痛和肝功能检查异常。
许多流行病学研究已经研究了乙型肝炎疫苗接种与多发性硬化和外周神经系统脱髓鞘疾病如格林-巴利综合征之间的所谓关联(Shaw et al., 1988; McMahon et al., 1992),证据的权重不支持与疫苗的关联。全球疫苗安全咨询委员会(Advisory Committee on Vaccine Safety GACVS)在2002年发表了一份声明,并得出结论,乙型肝炎疫苗与多发性硬化症(MS)之间没有关联。欲了解更多信息,请访问:http://www.who.int/vaccine_safety/committee/topics/hepatitisb/multiple_sclerosis/en/
六价DTaP/IPV/Hib/HepB疫苗
注射部位通常会出现发热、疼痛、肿胀或发红,并且在后续剂量后更为常见。注射部位可能会形成一个小而无痛的结节;这通常会消失,没有任何后果。抽搐、高声尖叫、苍白、发绀和无力(HHE)很少发生(Tozzi and Olin, 1997)。研究表明,当乙型肝炎疫苗加入到DTaP/IPV/ Hib疫苗中时,经历的不良反应的频率和类型与DTaP/IPV/Hib疫苗单独接种或与单价乙型肝炎疫苗一起接种时观察到的相似。(Dhillon S, 2010)。
确诊的过敏反应极少发生。来自英国、加拿大和美国的数据表明,每百万剂量的过敏反应事件发生率为0.65至3次(Bohlke et al., 2003; Canadian Medical Association, 2002)。其他过敏情况可能更常见,但不是进一步免疫的禁忌症。
乙型肝炎免疫球蛋白(HBIG)
HBIG的耐受性很好。极少数情况下,过敏样反应发生在具有IgA抗体的低丙种球蛋白血症患者或对输血有非典型反应的患者。
任何国家都没有通过肌内使用的免疫球蛋白制剂获得血源性感染的病例记录。
供应
单价乙肝疫苗
- Engerix B®
- Fendrix®
These vaccines are available from GlaxoSmithKline
- (Tel: 0808 100 9997).
- HBvaxPRO®
- HBvaxPRO Paediatric®
- HBvaxPRO® 40
These vaccines are available from MSD
(Tel: 0800 0855511)
甲型和乙型肝炎联合疫苗
- Twinrix Paediatric®
- Twinrix Adult®
- Ambirix®
These vaccines are available from GlaxoSmithKline
(Tel: 0808 100 9997).
六价DTaP/IPV/Hib/HepB疫苗
- Infanrix hexa®
作为国家免疫计划的一部分,这种疫苗是为NHS集中购买的,只能通过ImmForm订购。作为国家儿童免疫方案一部分的疫苗是免费提供的。用于私人处方、职业健康用途或旅行的疫苗不是免费提供的,应从制造商处订购。有关ImmForm的更多信息,请访问https://www.gov.uk/government/collections/immform, 从ImmForm服务台获得,网址为helpdesk@immform.org.uk或电话:0844 376 0040。该疫苗由英国Movianto有限公司(电话:01234 248631)分销。
在苏格兰,应该从当地的儿童疫苗储备中心获得供应。详情可从苏格兰国民保健服务系统的采购、调试和设施处获得(电话:0131 275 6725)。
在北爱尔兰,应该从当地的儿童疫苗储备中心获得供应。详情可向区域药品采购处索取(电话:028 9442 2089)。
乙型肝炎免疫球蛋白
英格兰:
英国公共卫生部(PHE)狂犬病和免疫球蛋白服务中心0208 327 6204
威尔士:
威尔士公共卫生部微生物学病毒学部门,加的夫029 20 742178
苏格兰:
在苏格兰,HBIG应从当地医院的药剂科获得。这些细节可从苏格兰国民保健服务系统的采购、调试和设施处获得
0131 275 6725
北爱尔兰:
HBIG由北爱尔兰各信托医院的血库保存,用于新生儿的HBIG也由设有产科的医院保存。HBIG由北爱尔兰输血服务中心提供给医院
028 9032 1414
注意:HBIG的供应是有限的,需求应仅限于有明确适应症的患者。
用于乙型肝炎感染肝移植受者的HBIG应从生物制品实验室获得
匕首巷
埃尔斯特里
Herts WD6 3BX
(电话:020 8258 2342)
参考
乙型肝炎
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red Book: 2003 Report of the Committee on Infectious Diseases, 26th edition. Elk Grove Village, IL: American Academy of Pediatrics, p 33.
Asboe D, Rice P, de Ruiter A and Bingham JS (1996) Hepatitis B vaccination schedules in genitourinary medicine clinics. Genitourin Med 72(3): 210–12.
Aweis D, Brabin BJ, Beeching JN et al. (2001) Hepatitis B prevalence and risk factors for HBsAg carriage amongst Somali households in Liverpool. Commun Dis Public Health 4: 247–52.
Bock HL, Löscher T, Scheiermann N et al. (1995) Accelerated schedule for hepatitis B immunisation. J Travel Med 2: 213–17.
Bodsworth NJ, Cooper DA and Donovan B (1991) The influence of human immunodeficiency virus type 1 infection on the development of the hepatitis B virus carrier state. J Infect Dis 163: 1138–40.
Boxall E, Skidmore S, Evans C et al. (1994) The prevalence of hepatitis B and C in an antenatal population of various ethnic origins. Epidemiol Infect 113: 523–8.
Boxall EH, Sira J, El-Shuhkri N et al. (2004) Long term persistence of immunity to hepatitis B after vaccination during infancy in a country where endemicity is low. J Infect Dis 190: 1264–9.
BHIVA (2015) BHIVA guidelines on the use of vaccines in HIV-positive adults 2015: http://www.bhiva.org/documents/Guidelines/Vaccination/2015-Vaccination-Guidelines.pdf
Bruce MG, et al. Antibody levels and protection after hepatitis B vaccine: results of a 30-year follow-up study and response to a booster dose. J Infect Dis 2016;214:16-22
Bush LM, Moonsammy GI and Boscia JA (1991) Evaluation of initiating a hepatitis B vaccination schedule with one vaccine and completing it with another. Vaccine 9: 807–9.
Christenson B (1986) Epidemiological aspects of transmission of hepatitis B by HBsAg- positive adopted children. Scand J Infect Dis 18:105–9.
Department of Health (1998) Screening of pregnant women for hepatitis B and immunisation of babies at risk. Health Service Circular HSC 1998/127. Available on the Department of Health website at: www.dh.gov.uk/assetRoot/04/01/18/40/04011840.pdf.
Department of Health (2013) Health Technical Memorandum 07-01: Safe management of healthcare waste. https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/167976/HTM_07-01_Final.pdf.Accessed October 2014.
Dhillon S. DTPa-HBV-IPV/Hib Vaccine (Infanrix hexa): A Review of its Use as Primary and Booster Vaccination. Drugs. 2010 May 28;70(8):1021-58
Fonseca MO, Pang LW, de Paula Cavalheiro N, Barone AA, Heloisa Lopes M. Randomized trial of recombinant hepatitis B vaccine in HIV infected adult patients comparing a standard dose to a double dose. Vaccine 2005;23:2902- 8.
Hyams KC (1995) Risks of chronicity following acute hepatitis B virus infection: a review. Clin Infect Dis 20: 992–1000.
Joint Committee on Vaccination and Immunisation Minutes of the October 2014 meeting. Available at : https://www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation#minutes
Kane A, Lloyd J, Zaffran M et al. (1999) Transmission of hepatitis B, hepatitis C and human immunodeficiency viruses through unsafe injections in the developing world: model-based regional estimates. Bull World Health Org 77: 801–7.
Klein NP, Massolo ML, Greene J et al. (2008) Risk factors for developing apnea after immunization in the neonatal intensive care unit. Pediatrics 121(3): 463-9.
Kroger AT, Atkinson WL and Pickering LK (2013) General immunization practices. In: Plotkin SA, Orenstein WA and Offit PA (eds). Vaccines, 6th edition. Philadelphia: Saunders Elsevier, p 88.
Liao SS, Li RC, Li H et al. (1999) Long-term efficiency of plasma-derived hepatitis B vaccine: a 15-year followup study among Chinese children. Vaccine 17: 2661–6.
Loke RH, Murray-Lyon IM, Coleman JC et al. (1990) Diminished response to recombinant hepatitis B vaccine in homosexual men with HIV antibody: an indicator of poor prognosis. J Med Virol 31: 109–11.
Losonsky GA, Wasserman SS, Stephens I et al. (1999) Hepatitis B vaccination of premature infants. Pediatrics 103 (2): E14.
McMahon BJ, Helminiak C, Wainwright RB et al. (1992) Frequency of adverse reactions to hepatitis B in 43,618 persons. Am J Med 92: 254–6.
Newell A and Nelson M (1998) Infectious hepatitis in HIV seropositive patients. Int J STD AIDS 9: 63–9.
Ohlsson A and Lacy JB (2004) Intravenous immunoglobulin for preventing infection in preterm and/or lowbirth-weight infants. Cochrane Database Syst Rev(1): CD000361.
Pfister RE, Aeschbach V, Niksic-Stuber V et al. (2004) Safety of DTaP-based combined immunization in verylow-birth-weight premature infants: frequent but mostly benign cardiorespiratory events. J Pediatr 145(1): 58-66.
PHLS Hepatitis Subcommittee (1992) Exposure to hepatitis B virus: guidance on post exposure prophylaxis. CDR Review 2: R97–R102
Poovorawan Y, Chongsrisawat V, Theamboonlers A, Bock HL, Leyssen M, Jacquet JM. Persistence of antibodies and immune memory to hepatitis B vaccine 20 years after infant vaccination in Thailand. Vaccine. 2010;28:730–6. doi: 10.1016/j.vaccine.2009.10.074.
Pourcyrous M, Korones SB, Arheart KL et al. (2007) Primary immunization of premature infants with gestational age <35 weeks: cardiorespiratory complications and C-reactive protein responses associated with administration of single and multiple separate vaccines simultaneously. J Pediatr 151(2): 167-72.
Public Health England Shooting Up infections among people who inject drugs in the UK. http://www.drugsandalcohol.ie/26470/1/Shooting_Up_2016_Update.pdf
Rey D, Krantz V, Partisani M et al. (2000) Increasing the number of hepatitis B injections augments anti-HBs response rate in HIV-infected patients. Effects of HIV-1 viral load. Vaccine 18: 1161–5.
Roome AJ, Walsh SJ, Carter ML et al. (1993) Hepatitis B vaccine responsiveness in Connecticut public safety personnel. JAMA 270: 2931–4.
Rosman AS, Basu P, Galvin K et al. (1997) Efficacy of high and accelerated dose of hepatitis B vaccine in alcoholic patients: a randomized clinical trial. Am J Med 103: 217–22.
Rudin H, Berger R, Tobler R et al. (1990) HIV-1, hepatitis (A, B and C) and measles in Romanian children. Lancet 336: 1592–3.
Schulzke S, Heininger U, Lucking-Famira M et al. (2005 ) Apnoea and bradycardia in preterm infants following immunisation with pentavalent or hexavalent vaccines. Eur J Pediatr 164(7): 432-5.
Shaw FE, Graham DJ, Guess HA et al. (1988) Postmarketing surveillance for neurologic adverse events reported after hepatitis B vaccination: experience of the first three years. Am J Epidemiol 127: 337–52.
Siddiqui MR, Gay N, Edmunds WJ, Ramsay M. Economic evaluation of infant and adolescent hepatitis B vaccination in the UK. Vaccine. 2011 Jan 10;29(3):466-75. doi: 10.1016/j.vaccine.2010.10.075. PubMed PMID: 21073988
Simons BC, Spradling PR, Bruden DJ et al. A longitudinal hepatitis B vaccine cohort demonstrates long-lasting hepatitis B virus (HBV) cellular immunity despite loss of antibody against HBV surface antigen. J Infect Dis 2016;214:273-80.
Simonsen L, Kane A, Lloyd J, et al. (1999) Unsafe injections in the developing world and transmission of blood-borne pathogens: a review. Bull World Health Org 77: 789–800.
Tong NK, Beran J, Kee SA et al. (2005) Immunogenicity and safety of an adjuvanted hepatitis B vaccine in pre-hemodialysis and hemodialysis patients. Kidney Int 68(5): 2298–303.
Tozzi AE, Olin P. Common side effects in the Italian and Stockholm I trials. Dev Biol Stand. 1997;89: 105-8.
Whittle H, Jaffar S, Wansbrough M et al. (2002) Observational study of vaccine efficacy 14 years after trial of hepatitis B vaccination in Gambian children. BMJ 325: 569–73.
Williams IT, Goldstein ST, Tufa J et al. (2003) Long-term antibody response to hepatitis B vaccination beginning at birth and to subsequent booster vaccination. Paediatr Infect Dis J. 22: 157–63.
World Health Organization Weekly Epidemiological Record No. 40 WHO position paper on hepatitis B 2October 2009 http://www.who.int/wer/2009/wer8440.pdf?ua=1World Health Organization Global Hepatitis Report 2017 http://apps.who.int/iris/bitstream/10665/255016/1/9789241565455-eng.pdf




