Contents
- 1 摘要
- 2 介绍
- 3 方法
- 4 百日咳的背景和流行病学
- 5 破伤风的背景和流行病学
- 6 白喉的背景和流行病学
- 7 预防百日咳、破伤风和白喉的疫苗
- 8 免疫原性和有效性
- 9 DTaP联合疫苗的免疫原性
- 10 百日咳疫苗效力
- 11 许可后百日咳疫苗效力
- 12 VAERS许可和可获得的DTaP疫苗的安全性
- 13 与含有百日咳成分或破伤风类毒素成分的疫苗相关的不良事件
- 14 牛奶过敏
- 15 免疫原性和功效
- 16 许可后Tdap有效性
- 17 预防传播:间接保护(“结茧”)
- 18 Tdap的许可后安全性
- 19 附加安全数据
- 20 破伤风类毒素安全性
- 21 白喉类毒素安全性
- 22 Tdap与其他疫苗同时接种
- 23 成本效益分析
- 24 百日咳、破伤风和白喉控制战略
- 25 通过母体Tdap疫苗接种预防小婴儿百日咳
- 26 卫生保健人员预防百日咳
- 27 推荐使用百日咳、破伤风和白喉疫苗的理由
- 28 百日咳、破伤风和白喉疫苗接种的建议
- 29 使用指南
- 30 使用指南
- 31 国家疫苗伤害赔偿计划
- 32 孕妇的安全监测
- 33 未来方向
- 34 参考
- 34.0.1 表1.推荐的百日咳、白喉和破伤风疫苗接种计划—免疫实践咨询委员会,2017年
- 34.0.2 表2.DTaP、Tdap、DT和Td疫苗的禁忌症和注意事项*
- 34.0.3 表3.不属于DTaP、DT、Td和Tdap疫苗接种禁忌症的情况
- 34.0.4 图1. 1922-2016年美国报告的百日咳病例数
- 34.0.5 图2. 1990-2016年美国按年龄组划分的百日咳年发病率*
- 34.0.6 图3. 1947-2016年美国破伤风的年发病率*和死亡率
- 34.0.7 图4. 1920-2016年美国报告的白喉病例数
- 34.0.8 表4.含破伤风类毒素、白喉类毒素和无细胞百日咳抗原的疫苗组成以及7岁以下儿童批准使用疫苗类型的年龄——美国,2017年
- 34.0.9 表5.含破伤风类毒素、白喉类毒素和无细胞百日咳抗原的疫苗组成,以及7岁及以上人群批准使用疫苗类型的年龄——美国,2017年
- 34.0.10 表6.常规伤口处理中破伤风预防指南
Prevention of Pertussis, Tetanus, and Diphtheria with Vaccines in the United States: Recommendations of the Advisory Committee on Immunization Practices (ACIP)
詹妮弗·l·梁,DVM1;医学博士Tejpratap Tiwari1;医学博士佩德罗·莫罗2;医学博士南希·梅索尼埃3;医学博士亚瑟·莱因戈尔德4;马克·索耶,医学博士5;医学博士托马斯·克拉克6 (查看作者关系)
https://www.cdc.gov/mmwr/volumes/67/rr/rr6702a1.htm度量详细信息
- 摘要
- 介绍
- 方法
- 百日咳的背景和流行病学
- 破伤风的背景和流行病学
- 白喉的背景和流行病学
- 预防百日咳、破伤风和白喉的疫苗
- 百日咳、破伤风和白喉控制战略
- 推荐使用百日咳、破伤风和白喉疫苗的理由
- 百日咳、破伤风和白喉疫苗接种的建议
- 国家疫苗伤害赔偿计划
- 孕妇的安全监测
- 未来方向
- 感谢
摘要
这份报告汇编和总结了CDC免疫实践咨询委员会(ACIP)关于美国破伤风、白喉和百日咳预防和控制的所有建议。作为对以前公布的建议的全面总结,本报告不包含任何新的建议,并取代以前公布的所有报告和政策说明;它旨在供临床医生和公共卫生提供者作为一种资源使用。ACIP建议常规接种破伤风、白喉和百日咳疫苗。建议婴幼儿接种5剂系列白喉、破伤风类毒素和无细胞百日咳(DTaP)疫苗,以及1剂青少年加强剂量的破伤风类毒素、减毒白喉类毒素和无细胞百日咳(Tdap)疫苗。从未接种过Tdap的成年人也被建议接种加强剂量的Tdap。建议妇女在每次怀孕期间接种一定剂量的Tdap,无论以前是否接种过Tdap,都应在妊娠27至36周期间接种。接种Tdap后,建议青少年和成人每10年接种一次破伤风和白喉类毒素(Td)加强疫苗,以确保持续预防破伤风和白喉。
介绍
本报告汇编和总结了CDC免疫实践咨询委员会(ACIP)之前发布的所有关于美国百日咳、破伤风和白喉预防和控制的建议,特别是在引入无细胞百日咳疫苗后,不包含任何新的建议。ACIP在1991-2015年间对DTaP和Tdap的建议时间表可从以下网址获得https://stacks.cdc.gov/view/cdc/52821。本报告描述了支持这些建议的过程和使用的基本原理,供临床医生和公共卫生提供者参考。
从1940年代末到1990年代,建议婴儿和幼儿接种百日咳、白喉和破伤风疫苗,包括白喉和破伤风类毒素以及全细胞百日咳(DTP)疫苗。接种百白破通常与局部不良事件(例如注射部位的发红、肿胀和疼痛)相关,较少与严重不良事件(1,2)。由于对百白破全细胞百日咳成分的安全性关注,在1990年代开发了白喉和破伤风类毒素以及无细胞百日咳(DTaP)疫苗,并随后取代了百白破的剂量。自1997年以来,建议婴幼儿接种5剂系列DTaP(3)。2005年,ACIP建议青少年和成人接种单剂破伤风类毒素、减毒白喉类毒素和无细胞百日咳(Tdap)疫苗(4,5)。接种Tdap后,建议青少年和成人每10年或在需要伤口处理时接种一次加强剂量的破伤风和白喉类毒素(Td)疫苗(4,5)。2012年,为了减轻婴儿百日咳的负担,ACIP建议妇女在每次怀孕期间接种一剂Tdap(6)。
就本报告而言,DTaP和Tdap用作白喉类毒素、破伤风类毒素和无细胞百日咳疫苗的通称,DT和Td用于含白喉和破伤风类毒素的疫苗。在美国获得许可的任何疫苗配方都可以以适合年龄的方式用于实施这些疫苗接种建议。百白破和单价破伤风类毒素(TT)疫苗都是出于历史目的讨论的,在美国不再生产或供应。
ACIP关于百日咳、破伤风和白喉疫苗接种的建议和使用指南在本报告的其他地方有所描述(参见百日咳、破伤风和白喉疫苗的使用建议) (表1)。有关禁忌症、注意事项和特殊情况的详细信息在本报告的其他地方有所描述(参见百日咳、破伤风和白喉疫苗的使用建议) (表2和3)。2013年,在对现有数据进行审查后,ACIP不支持对普通人群进行第二剂Tdap的普遍建议(见普通人群无Tdap额外剂量)。2014年和2015年,ACIP不支持医护人员或婴儿密切接触者接种第二剂Tdap。
方法
ACIP定期审查现有信息,为疫苗建议的制定或修订提供信息。2009年2月,ACIP百日咳疫苗工作组成立,以审查和修订以前公布的DTaP、DT、Td、TT和Tdap的疫苗建议,因为1)自1997年以来新许可的DTaP疫苗产品的可用性;2)对青少年和成人Tdap建议的多个ACIP更新;3)两种Tdap疫苗产品的新美国美国食品药品监督管理局(FDA)年龄适应症;4)需要将百日咳、破伤风和白喉疫苗建议纳入单一文件;5)关于Tdap覆盖率、影响和疫苗有效性的新数据;和6)停止TT疫苗的生产和在美国的供应。从2009年4月到2015年4月,工作组每月举行电话会议。除了ACIP成员之外,该工作组还包括来自美国家庭医师学会(AAFP)、美国儿科学会(AAP)、美国妇产科医师学会(ACOG)、免疫管理者协会、疾病预防控制中心、州和地区流行病学家委员会、FDA、美国传染病学会、国家卫生研究院以及其他传染病专家(7)。*
工作组审查和审议的问题包括美国百日咳、破伤风和白喉的流行病学;年龄≥65岁的人、7-10岁的儿童、卫生保健人员和妊娠期妇女使用Tdap疫苗;最后一次接种含破伤风类毒素疫苗和接种Tdap之间的最短间隔;Tdap疫苗的有效性;和疫苗安全。工作组制定并讨论了建议选项。工作组评估了关于美国百日咳流行病学、决策分析、成本效益、规划考虑、疫苗免疫原性、疫苗安全性和Tdap疫苗上市后有效性的已发表和未发表的数据和证据。当缺乏证据时,建议会纳入工作组成员的专家意见(6,8–10)。
从2010年6月到2015年6月,在11次ACIP会议上,提交了数据审查摘要、工作组讨论和建议的拟议修改。在这11次会议期间,对建议的修改(如果有的话)要么按提交的形式获得批准,要么由ACIP进行修改,然后作为政策说明在MMWR。这些建议的摘要可从以下网址获得https://stacks.cdc.gov/view/cdc/52821。在本总结报告的准备过程中,在PubMed和谷歌学术进行了针对特定主题的非系统文献搜索,以获得印刷或在线的英文出版文献,从而提供自2005年出版的任何关于DTaP、DT、Td、TT和Tdap的ACIP疫苗建议出版以来的更新数据和信息MMWR;包含文献搜索主题、搜索术语、搜索周期和所选参考文献的文档可从以下网址获得https://stacks.cdc.gov/view/cdc/52823。该总结报告的内容已提交给ACIP,并在2016年10月的ACIP会议上获得批准。在审查过程中,CDC修改了总结,以更新和澄清措辞。ACIP会议纪要,包括ACIP成员利益冲突声明,可从以下网址获得https://www.cdc.gov/vaccine/acip/meetings/meetings-info . html。一名ACIP成员因利益冲突而弃权。
百日咳的背景和流行病学
百日咳是一种由细菌引起的急性呼吸道疾病百日咳博德特氏菌 (11)。典型的百日咳疾病的特征在于疾病的三个阶段:卡他期、发作期和恢复期(11–13)。在卡他期,感染者会出现鼻炎(鼻腔粘膜炎症)、轻度偶发性咳嗽和低烧。发作期以痉挛性咳嗽、咳嗽后呕吐和吸气性哮鸣为特征。在恢复期,症状会慢慢改善,通常持续7-10天,但也可能持续数月。影响百日咳临床表现的因素包括年龄、免疫水平、疫苗接种史和病程早期抗生素的使用(11)。
百日咳鲍特菌咳主要通过咳嗽或打喷嚏产生的雾化呼吸道飞沫在人与人之间传播。患有百日咳的人在疾病的卡他期和早期发作期最具传染性(12)。百日咳通常用抗生素治疗,抗生素用于控制症状和体征,并防止感染者将感染传播给他人。推荐用于百日咳的抗生素包括阿奇霉素、克拉霉素、红霉素或甲氧苄啶-磺胺甲恶唑(TMP-SMX)。百日咳的治疗指南以前已经发表过(14)。百日咳暴露后预防指南可从以下网址获得https://www.cdc.gov/pertussis/outbreaks/pep.html.
美国百日咳的流行病学
在美国,百日咳是一种全国通报的疾病(15)。在1934-1943年期间,在美国引入儿童百日咳疫苗接种之前,每年平均报告200,752例百日咳病例和4,034例百日咳相关死亡(16)。在20世纪40年代引入全细胞百日咳疫苗后,报告的百日咳病例数急剧下降,在1976年达到历史最低点1010例(图1) (3)。自20世纪80年代以来,报告的百日咳病例总体呈增加趋势,尤其是在青少年和成人中(17–19)。虽然百日咳本质上是周期性的,每3至5年出现一次发病高峰,但高峰已经变得更高,特别是在2004年(25,827例)、2005年(25,616例)、2010年(27,500例)和2012年(48,277例) (20–24)。报告的百日咳病例的增加可能是由于疾病负担的实际增加;然而,其他因素也影响了疾病负担的估计。这些包括诊断测试的改进、卫生保健人员和公众对百日咳认识的提高以及更好的病例报告(17,18,25–27)。越来越多的证据强烈表明,20世纪90年代末儿童疫苗系列中疫苗从全细胞百日咳疫苗到无细胞百日咳疫苗的变化导致了2000年代中期观察到的7-10岁儿童百日咳发病率的年龄特异性增加,因为免疫力下降(图2) (28–30)。
在美国,含百日咳疫苗的覆盖范围因年龄组而异。19-35个月儿童的DTaP疫苗接种覆盖率一直很高,2015年报告的≥3 剂量DTaP为95.0%,≥4 剂量DTaP为84.6%(31)。≥4 剂量DTaP的覆盖率低于健康人2020年90%的目标(32)。自2005年引入Tdap以来,13-17岁青少年的Tdap覆盖率大幅增加,从2006年的10.8%增加到2015年的86.4%(33,34)。青少年中的Tdap覆盖率达到了健康人2020年 80%的目标(35)。2015年,对于年龄≥19岁的成年人,在过去10年中接种任何含破伤风类毒素疫苗(如TT、Td或Tdap)的比例为62.1%(19-49岁)、64.1%(50-64岁)和56.9%(65岁以上);Tdap覆盖率为23.1%(36)。在孕妇中,2015-2016流感季节的Tdap覆盖率为48.8%(37)。
虽然百日咳疫苗接种已经导致百日咳病例和死亡的发生率显著降低,但是百日咳仍然在所有年龄的人群中引起发病。与所有其他年龄组相比,小于12个月的婴儿患百日咳疾病、并发症、住院和百日咳相关死亡的比率明显较高(38–40)。百日咳相关住院和死亡的最高百分比发生在小于2个月的婴儿中(CDC,未公布的数据,2016年) (38,41)。在2004-2016年期间,在所有因百日咳住院的婴儿中,54.4%的婴儿年龄小于2个月;在死亡的婴儿百日咳病例中,85.5%的婴儿年龄小于2个月,年龄太小,无法接种任何剂量的百日咳疫苗(CDC,未公布的数据,2016年)。在过去的十年中,随着百日咳流行病学的变化,已经观察到百日咳传播给婴儿的来源发生了变化,兄弟姐妹而不是母亲是婴儿百日咳感染的最常见来源(40,42,43)。
虽然与其他年龄组相比,婴儿报告的百日咳发病率明显较高,但自2000年代中期以来,儿童和青少年中报告的百日咳病例数量的增加归因于无细胞百日咳疫苗诱导的免疫力减弱(图2)。这种增加首先在7-10岁的儿童中观察到,他们是在1997年从百白破疫苗(DTP)转换为专门接种5剂无细胞百日咳(DTaP)疫苗的第一批出生队列中(28)。随着这一出生队列的老龄化,2012年在13-14岁人群中也观察到百日咳病例报告的增加(29,44)。对国家监测数据的持续监测将允许进一步表征无细胞百日咳疫苗对过去十年中观察到的百日咳流行病学演变的影响。
破伤风的背景和流行病学
破伤风是一种威胁生命但可通过疫苗预防的疾病,由以下细菌产生的一种强效神经毒素引起破伤风梭菌。这种微生物是一种无处不在的、形成孢子的、能动的革兰氏阳性杆菌,在土壤和动物粪便中浓度很高。破伤风梭菌孢子通过皮肤或粘膜的裂口进入体内。破伤风梭菌孢子的萌芽在厌氧条件下产生,例如在深度穿刺伤口或钝伤导致的坏死组织中。破伤风梭菌杆菌滋生并产生破伤风毒素,这是一种强大的外毒素,与神经组织不可逆地结合,引起骨骼肌痉挛和僵硬。人际间的直接传播破伤风梭菌不发生(45)。
从受伤到症状出现的潜伏期从3天到21天不等(中值:7天),极端情况下从1天到几个月不等。潜伏期取决于伤口的严重程度和部位。潜伏期越短,疾病越严重,预后越差;较长的潜伏期与离中枢神经系统最远的损伤有关。病程是可变的,但通常在消退前持续≥4周。恢复期通常是漫长的,康复后可能会出现长期的神经系统后遗症和智力及行为异常。破伤风的病死率在婴儿和老年人中最高,在没有高质量医疗护理的情况下可高达100%,但即使在现代医疗保健设施中也约为10%-20%(46)。
美国破伤风的流行病学
破伤风在美国是一种全国性的疾病(15)。在20世纪40年代中期引入含破伤风类毒素(TT)疫苗的普遍接种后,美国报告的破伤风发病率下降了98%以上,从1947年国家报告开始时的每100,000人口0.39下降到2016年的每100,000人口0.01(CDC,未公布的数据,2016年) (图3)。发病率的下降发生在所有年龄组。在此期间,破伤风死亡率也同样下降。发病率和死亡率的下降归因于广泛使用含破伤风类毒素的疫苗;改善伤口管理,包括在急诊室使用破伤风预防剂;改善分娩期间的卫生状况;母体免疫水平提高;和扩大的城市化(45)。
破伤风主要发生在老年人(47)。在2001-2016年期间,向国家法定传染病监测系统报告了3例新生儿破伤风病例和459例非新生儿破伤风病例。非新生儿病例的中位年龄为44.0岁(范围:2-95岁);60%的病例发生在男性(CDC,未公布的数据,2016)。年龄≥65岁的人患破伤风疾病和死亡的风险高于年龄< 65岁的人(48)。破伤风几乎只发生在未接种疫苗或未充分接种疫苗的人或疫苗接种史不明或不确定的人中。美国报告的破伤风病死率从18%(1998-2000年)下降到8.0%(2001-2016年) (CDC,未发表的数据,2016年)(48,49)。
群体免疫
与预防破伤风相关的循环抗破伤风抗体的最低水平是检测特异性的。保护所需的循环抗破伤风抗体的可接种水平是0.01 IU/mL,如在体内毒素中和试验中测量的。当使用体外方法,如标准的酶联免疫吸附试验(ELISA)时,至少0.1-0.2 IU/mL的抗体水平读数被认为是保护性的(50)。
美国国家健康和营养检查调查(NHANES III)是1988-1994年期间在美国进行的一项基于人群的国家血清调查,发现大约80%的12-19岁青少年和> 80%的20-39岁成年人具有血清保护性浓度的抗破伤风类毒素抗体(51)。在这项调查中,使用标准的ELISA测试来评估抗体水平,水平> 0.15 IU/mL被认为是保护性的。破伤风毒素循环抗体缺乏保护水平的人的比例随着年龄的增长而增加,妇女下降的速度更快。到70岁时,只有45%的男性和21%的女性具有破伤风抗体保护水平。以前服过兵役与男性破伤风保护性抗体的较高流行率相关,可能是因为服兵役期间的常规疫苗接种。老年人中可检测抗体的低流行率和破伤风病例的高比例反映了可能从未接种过初次百白破疫苗接种的老年人的高比例,或者如果他们从未接种过随后的含破伤风类毒素的加强剂量(48,51)。
预防
对破伤风毒素的免疫很少是自然获得的,但破伤风是可以通过使用含破伤风类毒素的高效疫苗(即DTaP、DT、Td或Tdap)来预防的(50)。在7岁之前完成5剂DTaP儿童期疫苗接种系列,对于发展持续到青春期的抗破伤风抗体保护水平是必要的,此时需要加强剂量的疫苗;此后,建议在整个成年期给予十年一次的Td加强剂,以保持对破伤风的保护(52)。
白喉的背景和流行病学
呼吸道白喉是一种急性传染性传染病,由产毒菌株引起白喉棒状杆菌,为不运动、无包膜、棒状、革兰氏阳性杆菌。虽然罕见,但会产生毒素溃疡棒状杆菌也会导致类似白喉的疾病(53)。接种含白喉类毒素的疫苗(即DTaP、DT、Tdap或Td)可预防白喉(54)。产毒素菌株白喉棒状杆菌通过在鼻咽或皮肤病变中繁殖和产生白喉毒素,可在易感人群中引起疾病。呼吸道白喉的典型特征是一层灰色的假膜,它牢固地附着在鼻咽、扁桃体或喉的粘膜上。假膜延伸到气管-支气管树可能导致危及生命的气道阻塞。此外,白喉毒素的全身吸收和传播可引起毒素介导的心脏和神经并发症(55)。
美国白喉的流行病学
在美国,白喉是一种全国性的传染病(15)。所有解剖部位报告的白喉病例从1921年的约200,000例下降到1940年的15,536例(图4)。在20世纪40年代末普及儿童疫苗接种后,这一下降趋势继续,1980年,仅报告了两起白喉病例(56)。自1980年以来,皮肤白喉不再需要报告,只有呼吸道病例需要向NNDSS报告。在1996年至2016年期间,共报告了13例病例(CDC,未公布的数据,2016年) (21–23,57–63)。尽管2004-2011年期间没有报告病例,但2012年发生了一例白喉毒素基因(“tox”)聚合酶链反应(PCR)检测呈阳性的可能病例,以及一例非产毒性培养呈阳性的病例白喉棒状杆菌2014年被举报(24,47)。
尽管美国儿童DTaP疫苗接种覆盖率> 80%,但在缺乏十年加强剂的情况下,儿童疫苗接种获得的免疫力减弱,老年人可能得不到充分保护(51)。NHANES III的分析表明,全部人口样本中仅有60%对白喉(定义为抗白喉类毒素浓度> 0.1 IU/mL)具有免疫力。随着年龄的增长,这种免疫力逐渐下降,从6-11岁的91%和12-19岁青少年的80%下降到60-69岁的大约30%(54)。来自2015年全国免疫调查(NIS)的数据表明,61.6%的19-49岁成年人在过去10年中接种过任何含破伤风类毒素的疫苗接种,64.1%(50-64岁)和56.9%(65岁以上) (36)。
尽管在美国很少见,但在去有地方病的国家旅行时,接触白喉仍然是可能的†或来自输入病例(64)。有关白喉的临床管理(包括白喉抗毒素的使用)和公共卫生响应的信息,请访问https://www.cdc.gov/diphtheria/clinicians.html.
预防百日咳、破伤风和白喉的疫苗
在美国,不同组成、配方和组合的疫苗被许可并可用于不同年龄组,以预防百日咳、破伤风和白喉(表4和5)。疫苗接种的适应症和年龄可能因疫苗产品和许可而异。在某些情况下,建议在标签外使用Tdap疫苗,包括在最后一次接种含破伤风类毒素的疫苗和接种Tdap之间没有最短间隔,为7-10岁的儿童进行补充疫苗接种,以及在每次怀孕期间为妇女接种疫苗(6,8)。
破伤风成分
TT疫苗于1938年在美国上市。20世纪40年代后,破伤风类毒素可与白喉类毒素结合使用,疫苗中有或没有全细胞百日咳抗原。尽管在1960年以前主要使用单一抗原TT,但Td的使用已经取代了TT;TT于2013年停产。
在美国,生产的破伤风类毒素吸附在铝盐佐剂(氢氧化铝、磷酸铝或硫酸铝)上,不含硫柳汞,高度纯化,甲醛< 0.02%,铝< 1.25毫克。含破伤风类毒素疫苗的儿科配方(DT和DTaP)含有5-10个絮凝极限(Lf)单位的抗原(表4)。青少年和成人制剂(Td和Tdap)每0.5 ml剂量含有≤5 Lf单位的破伤风类毒素(表5)。需要一剂以上的疫苗来诱导免疫保护,并且需要加强剂量来维持保护。
免疫原性和有效性
尽管尚未进行破伤风类毒素预防疾病的随机对照临床试验,但观察性研究的证据一致支持疫苗接种的有效性。美国陆军人员的破伤风发病率从第一次世界大战期间的13.4/100,000(当时人员未接种疫苗)下降到第二次世界大战期间的0.44/100,000(当时人员常规接种TT疫苗并在受伤后接种疫苗) (65)。在两次世界大战期间的同一时期,在英国陆军人员中也进行了类似的观察(66)。破伤风类毒素的有效性非常高,虽然不是100%。尽管关于最低保护性抗破伤风抗体临界值的数据很少,但通过体内毒素中和试验得出的0.01 IU/mL及以上的水平是有保护作用的,这一点已被普遍接种(46,54)。一剂破伤风类毒素疫苗几乎不能提供免疫力。接种3剂含破伤风类毒素的疫苗后,几乎所有婴儿和成人的保护性破伤风抗毒素滴度都大于0.1 IU/mL。使用3剂破伤风类毒素进行的一系列初级免疫诱导了0.2 IU/mL的平均抗破伤风水平,并且来自初级疫苗接种的抗体水平提供了大约3-5年的破伤风保护(67–69)。额外的破伤风加强剂量可增强免疫反应并延长保护性免疫的持续时间。4-8岁和青春期的加强剂量提供持久的保护性免疫,建议从最后一次剂量开始持续20-30年(50)。
白喉成分
白喉类毒素在1923年被证明具有免疫原性,此后被用作抗白喉(70)。当白喉类毒素吸附到佐剂(最常见的是氢氧化铝或磷酸铝)上时,其免疫原性得到改善。到20世纪40年代中期,白喉类毒素与破伤风类毒素和百日咳疫苗混合作为DTP,后来被吸附到铝盐上,用于常规的儿童疫苗接种计划。在美国,只有含有吸附在铝盐佐剂上的甲醛灭活白喉毒素的疫苗与破伤风类毒素结合,并含有或不含无细胞百日咳疫苗(表4和5)。需要一剂以上的疫苗来诱导免疫保护,并且需要加强剂量来维持保护(71)。
免疫原性和有效性
尽管还没有进行过白喉类毒素预防疾病有效性的随机对照临床试验,但来自观察性研究的有力证据支持疫苗接种的有效性(72)。白喉类毒素的有效性很高,虽然不是100%。接种3剂含白喉类毒素的疫苗后,几乎所有婴儿的白喉抗毒素滴度都大于0.01 IU/mL(71,73,74)。尽管一些DTaP产品产生的几何平均滴度低于接种DTP疫苗后观察到的滴度,但这些差异被认为不太可能具有临床意义。对于年龄≥19岁的成年人的初次接种,数据表明,几乎所有成年人在接种3剂含白喉类毒素的疫苗(75,76)。0.01至0.09 IU/mL的白喉抗毒素水平提供了一定程度的保护,而≥0.1 IU/mL的水平被认为是保护性的,并且> 1.0 IU/mL的水平与长期保护有关(77)。尽管循环白喉抗毒素的水平不能提供绝对的保护,但大多数报告表明白喉棒状杆菌先前接种过疫苗的人感染较轻,不太可能致命(56,78,79)。疫苗未能保护所有接触过白喉棒状杆菌强调维持较高的疫苗接种覆盖率和群体免疫对预防或限制传播和暴发的重要性,已有疫苗接种计划的工业化国家白喉病例的消失就是证明。
虽然世界范围内用于初级疫苗接种的各种方案(婴儿期3剂或15个月大时4剂)似乎在生命早期提供了足够的白喉保护,但在4-6岁时需要加强剂量以维持整个学龄期间的保护(71)。20世纪90年代在前苏维埃社会主义共和国联盟的大规模流行有力地表明,在婴儿中维持含白喉类毒素的初级系列疫苗的高接种覆盖率,并在入学时和一生中给予加强剂量,对于维持人群免疫力非常重要(80)。在发达国家,白喉得到了很好的控制,在儿童时期之后,很少有或没有机会接触和自然增强对感染的免疫力。世界卫生组织(WHO)建议,生活在低流行区或疾病非流行区的人应在完成初级系列疫苗接种约10年后接种加强剂量的白喉和破伤风混合类毒素疫苗,随后在一生中每10年接种一次(70)。
含破伤风和白喉类毒素的疫苗
截至2016年,1个DT疫苗产品和2个Td疫苗产品获得FDA许可,在美国上市(表4和表5);TT疫苗的生产已于2013年停止,在美国也不再有售。
DT
DT产品(无商品名称;Sanofi Pasteur,Swiftwater,Pennsylvania)获得了FDA的许可,可用于对7岁以下的儿童进行白喉和破伤风的主动疫苗接种,这些儿童禁用百日咳疫苗成分,或者在卫生保健提供者决定不应接种百日咳疫苗的情况下。与白喉疫苗相比,白喉类毒素在白喉疫苗中的浓度更高。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 142732 . pdf。
Td
FDA批准Tenivac (Sanofi Pasteur,Swiftwater,Pennsylvania)作为7岁以上人群破伤风和白喉的加强疫苗。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 152826 . pdf)。
Td产品(无商品名称;马萨诸塞州波士顿MassBiologics公司生产;由Grifols,洛杉矶,加利福尼亚州分销)获得FDA许可,可用于预防年龄≥7岁人群的破伤风和白喉的主动疫苗接种。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 164127 . pdf)。
无细胞百日咳成分
在美国,所有可用于预防百日咳的疫苗都是与破伤风和白喉类毒素结合的无细胞百日咳制剂。根据制造商的不同,无细胞百日咳疫苗中包含的百日咳抗原有:百日咳毒素(PT)、丝状血凝素(FHA)、百日咳杆菌素(PRN)和/或2型和3型菌毛(FIM)。百日咳抗原的存在量因疫苗类型和制造商而异(表4和5)。在美国,没有“纯百日咳”疫苗获得许可。
免疫原性数据的解释
疫苗效力研究已经证明了抗百日咳抗体的存在和对百日咳疾病的保护之间的相关性,但是没有公认的对百日咳保护的明确血清学或实验室相关性(81–85)。抗体研究可用于比较单一疫苗在不同条件下或不同研究中引发的免疫反应,而效力研究对于测量每种百日咳疫苗赋予的临床保护作用很重要(54)。
新百日咳疫苗的许可是基于总体安全性和在临床试验中证明免疫原性不劣于美国许可的儿科DTaP产品(86)。在非劣效性试验中,当基于研究组之间临床可接种差异的预定义且狭窄的界限,一种新产品至少与对照品一样好时,免疫原性、疗效或安全性终点得到证明(87)。
DTaP疫苗
DTaP疫苗由百日咳抗原以及白喉和破伤风类毒素组成(表4)。根据疫苗类型和制造商,百日咳抗原的组成和数量以及白喉和破伤风类毒素的数量有所不同。根据具体的DTaP产品,FDA批准的DTaP疫苗使用年龄指示有所不同(表4)。关于DTaP疫苗的免疫原性和安全性的数据已经发表(3,88–94)。
许可和可用的DTaP疫苗
截至2016年,有两种DTaP疫苗获得FDA许可,在美国上市:Infanrix(葛兰素史克[GSK],Rixensart,比利时)和Daptacel(赛诺菲巴斯德,宾夕法尼亚州斯威夫特沃特)。这些疫苗的免疫原性和安全性数据已经发表(3,88,89,91)。
Infanrix (GSK)获得FDA许可,可用于6周至6岁婴儿和儿童的白喉、破伤风和百日咳主动疫苗接种,分为5个剂量系列。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 124514 . pdf)。
Daptacel (Sanofi Pasteur)获得FDA许可,可用于6周至6岁婴儿和儿童的白喉、破伤风和百日咳主动疫苗接种,分为5剂系列。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 103037 . pdf)。
包含DTaP的许可和可用的联合疫苗
截至2016年,含有DTaP疫苗成分的四种组合疫苗获得了FDA的许可,并在美国上市:DTaP-IPV-HepB (Pediarix,GSK,Rixensart,比利时),DTaP-IPV (Kinrix,GSK,Rixensart,比利时),DTaP-IPV/Hib (Pentacel,Sanofi Pasteur,Swiftwater,Pennsylvania),以及DTaP-IPV (Quadracel,Sanofi Pasteur,Swiftwater,Pennsylvania)。具有DTaP的组合疫苗已被证明是安全的和免疫原性的,并且与单独施用的DTaP相比具有相似的安全性和抗体应答(95–97)。
DTaP-IPV-HepB (Pediarix)包含DTaP、灭活脊髓灰质炎病毒(IPV)和乙型肝炎(重组)(HepB)。FDA批准Pediarix用于乙型肝炎表面抗原(HBsAg)阴性母亲所生婴儿的3剂系列。Pediarix疫苗可以在6周至6岁时使用。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 241874 . pdf)。
DTaP-IPV (Kinrix)包含DTaP和IPV。美国食品和药物管理局批准Kinrix作为百白破疫苗系列的第五剂和IPV系列的第四剂用于4-6岁的儿童,这些儿童以前的百白破疫苗剂量为前3剂百白破(Infanrix,GSK)和/或百白破-HepB-IPV (Pediarix,GSK)以及第四剂百白破(Infanrix)。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 241453 . pdf)。
DTaP-IPV/Hib (Pentacel)包含DTaP、IPV和b型流感嗜血杆菌(Hib)结合物。FDA批准Pentacel在6周至4岁的儿童中作为4个剂量系列使用。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 109810 . pdf)。
DTaP-IPV (Quadracel)包含DTaP和IPV。FDA批准Quadracel作为DTaP疫苗系列的第五剂和IPV系列的第四或第五剂用于4至6岁的儿童,这些儿童之前已经接种了4剂Pentacel和/或Daptacel疫苗。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 439903 . pdf)。
DTaP疫苗的免疫原性、效力和有效性
DTaP疫苗的免疫原性
Infanrix(GSK):在2个月、4个月和6个月时接种3剂Infanrix疫苗后一个月,≥83%的儿童对PT、FHA和PRN产生了4倍或更高的抗体应答(98)。所有儿童的白喉抗毒素滴度≥0.1 IU/mL,破伤风抗毒素滴度≥0.01 IU/mL(即这些疾病的免疫指征) (3)。无论前3剂是Infanrix疫苗还是DTP疫苗,在第4剂Infanrix疫苗后,80%以上的15-20个月的儿童对每种百日咳疫苗抗原的血清抗体增加了4倍或更多(99)。FDA批准不需要第五剂的免疫原性数据(100)。
Daptacel(赛诺菲巴斯德):在4剂Daptacel后,美国婴儿对百日咳抗原的抗体反应与瑞典婴儿相似,在瑞典婴儿中,在接种3剂Daptacel后证实了疗效(88,101)。98.5%的儿童达到白喉抗毒素水平≥1.0 IU/mL,100%的儿童达到破伤风抗毒素水平≥1.0 IU/mL(101)。在4-6岁儿童中使用Daptacel作为第五剂的许可是基于这样的假设,即以前接种过该疫苗的儿童将对相同疫苗的加强剂量产生强烈的免疫反应。对于白喉和破伤风,预计大多数儿童在加强疫苗接种后将具有保护性抗体水平(102)。
DTaP联合疫苗的免疫原性
Pediarix(GSK)(HepB-IPV DTaP):儿科所有抗原的免疫反应(白喉和破伤风类毒素;百日咳抗原;乙肝病毒;和灭活的1型、2型和3型脊髓灰质炎病毒)在2、4和6个月龄时接种3剂后,与分别接种3剂Infanrix [DTaP (GSK)]、ENGERIX-B (HepB)和口服脊髓灰质炎病毒疫苗(89)。
Kinrix(葛兰素史克)(IPV DTaP公司):Kinrix中所有抗原的免疫原性(白喉和破伤风类毒素;百日咳抗原;和灭活的1型、2型和3型脊髓灰质炎病毒)在有或没有联合施用第二剂麻疹、腮腺炎和风疹(MMR)疫苗(92)。
Pentacel(赛诺菲巴斯德)(DTaP-IPV/Hib):五联(白喉和破伤风类毒素;百日咳抗原;灭活的1型、2型和3型脊髓灰质炎病毒;和b型流感嗜血杆菌结合物)通常与分别施用组分疫苗(86,103)。没有测量第一次和第二次剂量后的免疫反应(93)。
Quadracel(赛诺菲巴斯德)(DTaP-IPV):Quadracel(白喉和破伤风类毒素;百日咳抗原;和灭活的1型、2型和3型脊髓灰质炎病毒)在有或没有联合施用第二剂MMR和水痘疫苗的组(DTaP-IPV和分别施用的DTaP [Daptacel]和IPV [IPOL,赛诺菲巴斯德]疫苗)之间不劣于94)。
百日咳疫苗效力
两种DTaP疫苗产品(Infanrix [GSK]和Daptacel [Sanofi Pasteur])的功效在许可前试验中进行了评估,参与者在2个月、4个月和6个月时接种了3剂系列疫苗(104–106)。三剂百白破疫苗对百日咳疫苗效力的评估§范围从79%到89%,接种第三剂后的随访时间长达2年(104–106)。
许可后百日咳疫苗效力
对5剂DTaP系列的评估表明,百日咳疫苗的估计总有效率为88.7% (95%可信区间[CI]= 79.4%–93.8%);在第五剂百白破疫苗注射后的第一年内,疫苗有效性为98.1% (95%可信区间= 96.1%–99.1%)(28)。然而,自接种第五剂DTaP后,疫苗效力随着时间的增加而下降;在第五剂DTaP后≥5年,疫苗有效性估计为71.2%(95% CI = 45.8%–84.8%)(28)。其他研究支持DTaP疫苗效力逐渐降低和在接种第五剂后百日咳风险增加的发现(107,108)。相反,对DTaP的早期评估表明,在5岁以下儿童接种5剂DTaP后的有限时间内,对百日咳的疫苗效力为100%,但该评估是在ACIP发布5剂DTaP建议后不久进行的,且大多数参与者已接种DTP作为前3剂(109)。
DTaP的许可后安全监督
自美国引入无细胞百日咳疫苗以来进行的研究支持DTaP(110–123)。这些研究的摘要可从以下网址获得https://stacks.cdc.gov/view/cdc/52822。这些研究中有许多是通过在美国的两个系统,即疫苗不良事件报告系统(VAERS)和疫苗安全数据链(VSD)对接种疫苗后的不良事件进行监测而进行的。VAERS是一个由CDC和FDA联合运作的国家被动监测系统,接收来自卫生保健人员、制造商、疫苗接种者和其他人(124)。VSD是美国疾病预防控制中心和八个管理式医疗机构的合作项目,允许进行有计划的疫苗接种安全性研究,并及时调查医学文献审查、VAERS报告、疫苗接种计划变更或新疫苗引进产生的假设(125)。
VAERS许可和可获得的DTaP疫苗的安全性
在1990年1月1日至2015年7月31日期间,VAERS收到了46,448份报告,涉及在此期间在美国上市的五种百白破疫苗之一(Daptacel、Infanrix、Kinrix、Pediarix和Pentacel);44,061份(95%)报告涉及6岁以下儿童。在40,868例(88%)病例报告中,DTaP疫苗与一种或多种其他疫苗同时施用(CDC,未发表的数据,2016)。从接种疫苗到不良事件发生的中位时间为1天。最常报告的不良事件是注射部位红斑(11,879 [26%])、发热(9,225 [20%])、注射部位肿胀(6,964 [15%])、注射部位以外的红斑部位或未指明的部位(5,339 [12%])和注射部位发热(4,468 [10%])。当每个疫苗品牌的VAERS DTaP报告与VAERS数据库中所有其他灭活疫苗的报告进行单独比较时,没有观察到相关的不良事件模式。
在所有DTaP疫苗相关的报告中,有5,205例(11%)被编码为严重(即报告了以下结果之一:死亡、危及生命的疾病、住院、住院时间延长或永久残疾)。在编码为严重的报告中,最常见的不良事件是发热(1,795 [35%])、呕吐(1,420 [27%])、易怒(1,101 [21%])、癫痫发作(938 [18%])和肠套叠(746 [14%])。在728例肠套叠报告中,97%同时接种了轮状病毒疫苗。肠套叠与美国许可的轮状病毒疫苗产品(126,127)。
在研究期间,VAERS共报告了793例接种百白破疫苗后死亡的病例(CDC,未发表的数据,2016年)。682份(86%)报告提供了尸检报告或其他类型的医疗记录,并审查了死亡原因。在338份(49.6%)报告中,最常见的死亡原因是婴儿猝死综合征(SIDS)。其他死亡类别包括窒息(47人[6.8%]);呼吸系统疾病(44例[6.5%]);循环系统疾病(27例[3.9%]);某些传染病或寄生虫病(27人[3.9%]);神经系统疾病(24例[3.5%]);先天畸形、畸形和染色体异常(23例,占3.4%)。在90例(13.2%)死亡报告中,原因未确定,在62例(9.1%)死亡报告中,报告了各种其他原因(例如,钝器创伤)。这些报告的频率与美国总体婴儿死亡率数据中观察到的频率以及其他推荐儿童疫苗接种者中观察到的频率相似(128)。最近的两项VSD研究没有表明任何类型疫苗接种后死亡的因果关系或风险增加(129,130)。
与含有百日咳成分或破伤风类毒素成分的疫苗相关的不良事件
含有百日咳成分的疫苗
由于担心含有无细胞百日咳成分的疫苗可能会引起神经系统反应或加重潜在的神经系统疾病,ACIP建议对疑似或正在发生神经系统疾病(包括癫痫发作)的婴儿推迟接种百日咳疫苗,主要是因为担心接种疫苗(特别是全细胞制剂)后的神经系统事件可能会干扰随后对婴儿神经系统状态的评估(3,12,131)。
在全细胞百日咳疫苗时代,医学研究所(IOM)得出结论,有证据支持接种儿科百白破使用和急性脑病之间的因果关系(132)。在改用DTaP疫苗后,IOM审查了含无细胞百日咳疫苗和几种神经系统结果之间因果关系的证据(133)。证据不足以接种或拒绝接种接种含无细胞百日咳疫苗与脑炎、脑病、婴儿痉挛、癫痫发作、共济失调、自闭症、急性播散性脑脊髓炎、横贯性脊髓炎、视神经炎、成人多发性硬化症发作、成人多发性硬化症复发、儿童多发性硬化症复发、格林-巴利综合征、慢性炎性播散性多发性神经病、眼阵挛肌阵挛综合征或贝尔麻痹(133)。
儿童DTP疫苗接种后7天内出现的脑病病史(不能归因于其他可识别的原因)的儿童禁用。虽然加拿大在1993-2002年期间对接种了650万剂百日咳疫苗的儿童进行的积极监测未能确定任何与全细胞或无细胞百日咳疫苗有因果关系的急性脑病病例,但日本在23年期间的许可后监测表明,1970-1974年期间接种百白破疫苗时,每1000万剂疫苗接种7天内的脑病/脑炎(死亡)发生率为7.6例,1989-2000年期间接种百白破疫苗时,每1000万剂疫苗接种0.5例113,134)。
ACIP建议,在治疗方案建立和病情稳定之前,患有神经系统疾病的婴儿不要接种小儿DTaP疫苗(表2)(3)。前一剂DTP/DTaP后< 3天的癫痫发作史(发热或无发热)、受接种者中控制良好的癫痫发作史或癫痫发作或其他神经疾病家族史不是接种百日咳成分疫苗的禁忌症或预防措施(表3)(3)。
低渗-低反应性发作(HHE)和长时间哭闹是DTaP较少报告的不良事件,与DTP历史报告相比(111,135,136)。据了解,接种百白破/百白破疫苗后的HHE和长时间哭闹均与严重后遗症无关,且在接种百白破/百白破疫苗以外的疫苗后均有不良事件报告(135,136)。在接种后续DTP/DTaP剂量的儿童中,很少报告HHE复发(135,136)。单一、不复杂的HHE或长期哭闹事件并不排除接种疫苗,接种疫苗的益处大于额外事件的风险。
ACIP建议疫苗提供者和父母评估对接种小儿百白破/百白破疫苗后出现DTaP, DT, Td, 或Tdap疫苗禁忌症和注意事项表(表2)中所列任何事件的幼儿进行后续剂量百日咳疫苗接种的风险和益处。与接种无细胞疫苗相比,接种全细胞百日咳疫苗后记录的所有这些事件更加频繁(3,110,111,136,137)。
含破伤风类毒素的疫苗
与最近关于含无细胞百日咳疫苗的结论一样,IOM还得出结论认为,证据不足以接种或拒绝接种含白喉类毒素和破伤风类毒素疫苗与脑炎、脑病、婴儿痉挛、癫痫发作、共济失调、自闭症、急性播散性脑脊髓炎、横贯性脊髓炎、视神经炎、成人多发性硬化症发作、成人多发性硬化症复发、儿童多发性硬化症复发、格林-巴利综合征、慢性炎性播散性多发性神经病、眼阵挛肌阵挛综合征或贝尔麻痹(133)。ACIP建议,接种含破伤风类毒素疫苗后不到6周出现的格林-巴利综合征是随后接种含破伤风类毒素疫苗的一种预防措施(52)。
IOM得出结论,来自包含破伤风类毒素的疫苗的病例报告和非对照研究的证据支持包含破伤风类毒素的疫苗和臂神经炎之间的因果关系(133)。尽管通过疫苗伤害赔偿计划(VICP),臂神经炎被认为是可赔偿的事件,但ACIP认为接种含破伤风类毒素的疫苗后发生臂神经炎并不排除将来在同一人身上使用;臂神经炎通常是自限性的(52,132,138)。
牛奶过敏
DTaP和Tdap疫苗可能包括来自生产过程中使用的成分的残留牛奶过敏原(139)。因为有报道称,有严重牛奶过敏病史的儿童和青少年在接种后1小时内对加强剂量的DTaP或Tdap产生过敏反应(139,140),对VAERS的数据进行了前瞻性审查。在VAERS,未发现牛奶蛋白过敏患者出现过敏反应的安全性信号,由此得出结论,牛奶过敏患者可以耐受这些疫苗,牛奶过敏不是接种DTaP或Tdap的禁忌症或预防措施(140);疫苗提供者应该继续按照建议给牛奶过敏的人接种疫苗,并强烈考虑监测患者的过敏反应。
DTaP与其他疫苗同时接种
疫苗的同时接种被定义为在同一天的临床中,在不同的解剖位置接种一种以上的疫苗,并且不在同一注射器(52)。在含DTaP的联合疫苗出现之前,建议在同一天门诊接种DTaP疫苗和其他疫苗。关于前3剂DTaP与其他儿童疫苗同时接种的有限历史数据表明,对这些抗原的应答没有干扰(3)。
最近一项关于DTaP与其他疫苗同时接种的安全性研究表明,儿童在接种灭活流感疫苗(IIV)的同时接种肺炎球菌13价结合物(PCV13)疫苗或DTaP(123)。其他研究未显示DTaP后热性惊厥的风险增加,除非同时给予IIV(114,115,121,122)。这些疫苗的任何组合引起热性惊厥的风险都很小;ACIP建议同时接种这些疫苗。
Tdap疫苗
两种Tdap产品获准用于青少年和成人,作为破伤风、白喉和百日咳的单剂量加强疫苗:Boostrix (GlaxoSmithKline,Rixensart,Belgium)和Adacel (Sanofi Pasteur,Swiftwater,Pennsylvania)。批准使用的年龄指示根据具体的Tdap产品和许可证而有所不同(表5)。这两种Tdap产品都含有百日咳抗原和白喉及破伤风类毒素(表5)。百日咳抗原的组成和含量不同,两种Tdap产品中白喉类毒素的含量也不同。关于这些疫苗的免疫原性和安全性的数据摘要已经发表(4,5)。
FDA批准Adacel (赛诺菲巴斯德)作为10-64岁人群(141)。Adacel含有与Daptacel(儿科DTaP)相同的破伤风类毒素、白喉类毒素和五种百日咳抗原(PT、PRN、FHA和FIM ),但配制时减少了类毒素和抗原的数量(表5)。Adacel不含硫柳汞或其他防腐剂。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 142764 . pdf)。
FDA批准Boostrix (GSK)作为单一剂量用于年龄≥10岁的人群(142)。Boostrix疫苗含有与Infanrix疫苗(儿科DTaP疫苗)相同的破伤风类毒素、白喉类毒素和三种百日咳抗原(PT、PRN和FHA ),但配制时减少了类毒素和抗原的含量(表5)。Boostrix不含硫柳汞或其他防腐剂。包装说明书中提供了更多信息(https://www . FDA . gov/downloads/biologicsbloodvacines/UCM 152842 . pdf)。
免疫原性和功效
这两种Tdap产品均在临床试验的基础上获得许可,临床试验证明其免疫原性不劣于美国许可的Td或儿科DTaP产品,且总体安全性与美国许可的Td产品相当(143,144)。确定每种Tdap产品的破伤风和白喉类毒素成分的效力是基于与美国许可的Td相比对这些抗原的保护性免疫应答率的比较,并使用已建立的保护性血清学相关性(45,72)。评估了达到保护性抗破伤风和抗白喉抗体浓度(> 0.1 IU/mL)的人的百分比以及接种疫苗后1个月对这些抗原中每一种的加强应答。
由于尚未建立公认的百日咳保护作用的血清学或实验室相关性,因此Tdap许可证不要求在青少年或成人中进行无细胞百日咳疫苗的临床终点疗效研究。相反,在具有临床终点的效力试验中,Tdap疫苗的百日咳成分的效力是使用血清学桥梁对接种了DTaP的婴儿进行推断的(145)。将青少年和成人在单剂Tdap后对每种百日咳疫苗抗原的免疫应答与接种3剂儿科DTaP的婴儿的免疫应答进行比较,所述DTaP包含与被评估的Tdap相同的百日咳组分(141,142)。还评估了根据预定标准对百日咳疫苗抗原具有可接种的加强应答的人的百分比。预定义的下限被定义为DTaP儿科DTaP的GMC比率的95% CI的下限。使用血清学桥梁对接种了3剂DTaP的婴儿推断出许可前Tdap疫苗的效力,范围为79%至89%(105,106)。
许可后Tdap有效性
根据2005年Tdap青少年和成人推荐方案,在儿童时期接种过百白破和百白破联合疫苗的青少年中,在具有类似疫苗和推荐方案的环境中,Tdap的许可后百日咳疫苗有效性估计值在66%至78%之间(146–148)。在儿童时期仅接种过DTaP的青少年中,在一项匹配的病例对照研究中,Tdap抗百日咳疫苗的总体估计有效性为63.9%(95% CI = 50%–74%)(29)。在接种Tdap疫苗的一年内,百日咳疫苗的初始有效性为73%(95% CI = 60%–82%),但在2–4年后,疫苗接种后的有效性下降至34%(95% CI =-0.03%–58%)(29)。另一项计算青少年Tdap疫苗有效性的研究发现,在接种疫苗后的第一年内,有效性为68.8%(95% CI = 59.7%–75.9%);接种疫苗后≥4年,疫苗有效性为8.9% (95%可信区间=-30.6%–36.4%)(149)。正如在DTaP中观察到的,Tdap疫苗的效力随着接种后时间的增加而显著下降(29,149,150)。虽然没有研究评估在婴儿时期仅接种百白破疫苗的人群中Tdap疫苗的有效性,但是已经观察到在开始百白破系列疫苗接种的儿童中百日咳的报告发生率显著低于那些开始百白破疫苗接种的儿童(151,152)。
预防传播:间接保护(“结茧”)
当首次推荐Tdap时,预计该疫苗将预防青少年和成人的百日咳,从而预防百日咳的传播百日咳鲍特菌咳接触者(如婴儿)。通过Tdap疫苗为成年人提供间接保护是“结茧”策略的前提,以预防处于严重百日咳发病率和死亡率最高风险的婴幼儿的百日咳。有限数量的研究评估了Tdap疫苗预防婴儿百日咳传播的有效性,但证据不确定。虽然一项研究发现,母亲产后接种Tdap的婴儿患百日咳的风险略有下降,但另一项研究发现,母亲产后接种疫苗和结茧并不能减少婴儿的百日咳(153,154)。
动物模型研究表明,无细胞百日咳疫苗可以预防疾病,但不能预防百日咳的感染或传播百日咳鲍特菌咳或者密切相关的物种,支气管败血性布鲁氏菌 (155–157)。虽然尚不清楚这些动物模型是否完全代表人类疾病,但专家认为接种无细胞百日咳疫苗的人会感染并传播百日咳鲍特菌咳 (158,159)。与未接种百日咳疫苗的人相比,接种百日咳疫苗的人患严重疾病的可能性较低(160)。尽管据推测,患有不太严重疾病的接种过疫苗的人不太可能传播百日咳鲍特菌咳由于咳嗽不太频繁或不太严重,最近的证据表明,接种无细胞百日咳疫苗不能预防传播,因此不能提供间接的百日咳保护(155–157)。
Tdap的许可后安全性
自2005年首次批准和推荐这两种Tdap产品以来,这两种疫苗产品的标签适应症已经扩大,ACIP Tdap公司的推荐标准也已经更新(6,8–10,161–163)。这些建议的摘要可从以下网址获得https://stacks.cdc.gov/view/cdc/52821。对10-64岁人群接种Tdap疫苗后不良事件的常规VAERS监测和VSD研究提供了令人放心的数据,支持许可前临床试验的安全性数据,并未证明Tdap与以下罕见不良事件之间有任何关联:脑病-脑炎-脑膜炎;麻痹综合征;癫痫发作;脑神经疾病;和格林-巴利综合征(164–166)。有医生参与的局部反应并不常见,并且与同时或连续注射含白喉类毒素的疫苗(Td/Tdap和MenACWY-D[脑膜炎球菌血清群A、C、W和Y]Menactra,赛诺菲巴斯德)没有差异(167)。Tdap疫苗接种后,未观察到接种医学治疗的神经系统或过敏反应的风险增加,与匹配的历史Td受者相比,在Tdap(168)。尽管2016年的一项研究发现,Tdap疫苗接种后急性播散性脑脊髓炎的风险增加,但这一发现是基于两名Tdap疫苗接种者的病例,可能与疫苗接种无关(169)。自2009年以来,来自VAERS、VSD和其他研究的安全性数据在最初未被常规推荐接种Tdap的人群(如年龄≥65岁的成年人和孕妇)中可用,并由ACIP(6,8–10)。
年龄≥65岁的人
对于年龄≥65岁的成年人,Tdap疫苗的安全性与Td疫苗相当(170,171)。在年龄≥65岁的人群中,接种Tdap后最常见的不良事件是局部注射部位反应,在Tdap后未发现异常或意外的不良事件(170)。此外,老年人接种Tdap和Td后,以下预先指定事件的风险相当:脑膜炎、脑炎和脑病;脑神经疾病,包括贝尔氏麻痹;格林-巴利综合征;臂神经炎;麻痹综合征;医学上参与的炎症或过敏事件;过敏反应和全身反应(171)。
Td后的Tdap间隔
当Tdap于2005年获得许可时,尚未研究Td或儿科DTP/DTaP后间隔< 5年接种一剂Tdap的安全性。对Td后间隔< 5年(包括短至18个月)接种Tdap的安全性评估表明,间隔短得多的安全性是可以接种的(172–174)。两项研究在成人中进行,这些成人在接种含Td疫苗后< 2年内接种了Tdap或Tdap灭活脊髓灰质炎(Tdap-IPV)联合疫苗(173,174)。观察到的不良事件仅限于局部反应,包括疼痛(68%–83%)、红斑(20%–25%)和肿胀(19%–38%)(173,174)。虽然没有发生严重的不良事件,但这些研究中的受试者人数很少,不能排除罕见但严重的不良事件的可能性。ACIP得出结论,尽管Td和Tdap疫苗接种之间较长的间隔可以减少局部反应的发生,但预防百日咳的益处超过了不良事件的潜在风险(8)。
7-10岁的人
ACIP得出结论,未完成儿童期DTaP系列的7-10岁人群的Tdap总体安全性和局部反应频率可能与接种4剂DTaP的儿童相似(8)。虽然这两种Tdap产品都被批准用于10岁以下的儿童,但尚未公布Tdap对从未接种过含百日咳疫苗的7-9岁儿童的安全性数据。综述了几项评估Tdap或Tdap-IPV作为4-8岁儿童第五剂无细胞百日咳疫苗的安全性和免疫原性的研究(175–179)。未观察到严重局部反应或全身不良事件的风险增加(175–179)。接种Tdap后15天内最常报告的不良事件是疼痛(40%–56%)、红斑(34%–53%)和肿胀(24%–45%)。与接种DTaP或DTaP-IPV的受试者相比,在Tdap或Tdap-IPV受试者中观察到或报道的局部反应较少,但差异无统计学意义。当比较4-6岁和7-8岁儿童接种Tdap-IPV疫苗后主动或被动不良反应的频率时,没有发现差异(179)。
孕妇
2011年,当ACIP首次考虑在妊娠期间使用Tdap时,关于妇女及其婴儿的安全性数据有限(9);许可前评估没有研究孕妇使用加强剂量Tdap的安全性。ACIP回顾了来自VAERS、赛诺菲巴斯德(Adacel)和葛兰素史克(Boostrix)建立的妊娠登记处以及小型研究(174,180–183)。ACIP得出结论,这些研究并未表明接种Tdap的孕妇或其新生儿出现不良事件的风险升高或异常模式,少数报告的严重不良事件被认为不太可能是由疫苗引起的(9)。这些研究的摘要可从以下网址获得https://stacks.cdc.gov/view/cdc/52820.
当ACIP考虑建议在每次怀孕期间接种Tdap疫苗时,关于先前接种过Tdap疫苗的孕妇的Tdap加强剂量的安全性信息尚不可用(6)。两次间隔很近的含破伤风类毒素疫苗的安全性数据仅限于在21天内或≤2年内接种Td和Tdap或Tdap-IPV疫苗,以及在5年间隔内接种2次Tdap疫苗的非孕妇人群;在报告的少数严重不良事件中,没有一起是由疫苗引起的(172–174,184,185)。非孕妇接种第二剂Tdap的耐受性良好;注射部位疼痛是最常报告的不良事件(184–188)。在相同受试者和首次接种Tdap的对照组中,第二剂Tdap后报告的不良事件频率与第一剂相似。
在多次近距离妊娠期间接种疫苗的孕妇中,理论上存在严重局部反应的风险。这些严重的局部反应是过敏反应,与接种多剂疫苗的人接种含有破伤风类毒素、破伤风和白喉类毒素和/或百日咳抗原的疫苗有关。关于多剂量含破伤风类毒素疫苗和过敏反应的大部分数据都是历史数据,且严重不良事件的风险可能已因当前含有较低浓度破伤风类毒素的配方而降低(45,189,190)。最近的研究规模较小,不包括怀孕的受试者;因此,该研究结果不排除孕妇接种Tdap后出现罕见但严重不良事件的可能性(6)。
ACIP认识到,在随后的妊娠期间使用Tdap时,需要进行严重不良事件的安全性研究,但其结论是,预防太小而不能完全接种疫苗的婴儿的百日咳发病率和死亡率的潜在益处超过了接种Tdap的孕妇可能出现局部严重不良事件的理论担忧。ACIP还得出结论,含破伤风类毒素疫苗的经验表明,每次怀孕接种Tdap的妇女没有发生严重不良事件的额外风险(6)。
来自美国和其他地方的关于怀孕期间孕妇及其婴儿接种Tdap疫苗的安全性的其他数据继续令人放心,没有不良事件(包括不良分娩结果)增加的报告,也没有观察到新的或意外的疫苗安全问题(191–209);这些研究的摘要可从以下网址获得https://stacks.cdc.gov/view/cdc/52820。未发现妊娠期接种Tdap与重大畸形、死产、早产、小于胎龄儿或高血压疾病的风险增加相关(193–195,197,208)。一项研究观察到绒毛膜羊膜炎的风险略有增加,尽管绒毛膜羊膜炎是早产的一个风险因素,但在该队列中没有相关的早产或小于胎龄儿的增加(193)。作者得出结论,绒毛膜羊膜炎风险的小幅增加可能是由于结果确定中的残留混杂或异质性(193)。一项对1990年至2014年VAERS数据库的审查发现,在3389份妊娠报告中,有31份报告是在接种任何疫苗后发生绒毛膜羊膜炎的(198)。
对年龄在14-49岁的孕妇同时和依次接种Tdap和流感疫苗的安全性进行的评估发现,与依次接种相比,同时接种的孕妇出现发烧或任何需要医疗护理的急性不良事件的风险在统计学上没有显著增加。两组间未观察到早产、低出生体重或小于胎龄儿的差异(196)。
关于之前接种过含破伤风类毒素疫苗的孕妇在怀孕期间间隔很短时间接种Tdap的安全性的数据有限。一项研究发现,与怀孕期间接种Tdap疫苗接种5年以上的妇女相比,在怀孕期间接种疫苗接种≤5年的妇女,急性不良事件(即发热、过敏和局部反应)或不良出生结局(即小于胎龄儿、早产和低出生体重)的风险没有增加,这表明最近接种含有破伤风类毒素的疫苗接种不会增加怀孕期间接种Tdap疫苗后不良事件的风险(195)。
附加安全数据
与百日咳成分疫苗相关的神经系统和全身事件
对含有百日咳成分的疫苗在引起神经系统反应或加重潜在神经系统疾病中的可能作用的担忧由来已久(12,131)。尽管接种含百日咳成分的疫苗后出现神经系统后遗症的情况很少,但含无细胞百日咳疫苗和神经系统结果之间因果关系的证据尚不明确(133)。对患有进行性或未控制的潜在神经系统疾病的青少年接种疫苗的关注必须与百日咳的潜在发病率进行权衡;患有严重神经疾病的青少年可能有患严重百日咳的风险(CDC,未发表的数据,2005)(39)。ACIP不认为受种者有控制良好的癫痫发作史或癫痫发作家族史(发热或无热)或其他神经系统疾病是接种百日咳疫苗的禁忌症或预防措施(表3)(3)。
ACIP建议,对于在接种小儿百白破/百白破疫苗后,出现表中所列的DTaP, DT, Td, 和Tdap疫苗禁忌症和注意事项的任何事件的幼儿,应评估使用后续剂量的百日咳疫苗的风险和益处(表2);与接种无细胞疫苗相比,接种全细胞百日咳疫苗后记录的所有这些事件更加频繁(3,110,111,136,137)。对于青少年和成人,这些事件(如热性惊厥和HHE)要么不会发生,要么比婴儿和儿童的此类事件更不值得临床关注。综上所述,这些信息支持对有儿科DTaP/DTP项下所列事件病史的青少年使用Tdap(表2)。
ACIP建议患有不稳定的进行性神经疾病的青少年在病情稳定前不要接种Tdap疫苗。然而,慢性且稳定的进行性神经系统疾病(如痴呆)在成年人中更为常见,Tdap使随后的神经系统评估复杂化的可能性在临床上不太受关注。因此,在成人中稳定的慢性进行性神经疾病并不构成延迟Tdap的理由;这与不稳定或发展中的神经疾病(如脑血管事件和急性脑病)形成对比(5)。
阿尔萨斯反应
接种疫苗后很少报告Arthus反应(III型超敏反应),但可能在接种含破伤风类毒素或白喉类毒素的疫苗后发生(CDC,未发表的数据,2005)(54,132,210–214)。Arthus反应是一种与免疫复合物沉积和补体激活有关的局部血管炎。免疫复合物在疫苗抗原局部浓度高和循环抗体浓度高的情况下形成(210,211,213,215)。Arthus反应的特征是剧烈疼痛、肿胀、硬结、水肿、出血,偶尔坏死。这些症状和体征通常在接种疫苗后4-12小时出现;相比之下,过敏反应(一种即时I型超敏反应)通常在接种疫苗后几分钟内发生。与广泛的肢体肿胀一样,Arthus反应通常会消失,不会留下后遗症。ACIP建议,接种一剂破伤风类毒素或含白喉类毒素的疫苗后出现Arthus反应的人,接种含破伤风类毒素的疫苗的频率不应超过每10年一次,即使作为伤口处理的一部分用于破伤风预防(54)。
破伤风类毒素安全性
破伤风类毒素是全球使用最广泛的疫苗之一,可作为单组分疫苗(TT)或与白喉类毒素(DT和Td)和百日咳抗原(DTP、DTaP和Tdap)联合使用。历史上,接种TT疫苗后的轻度局部反应(即发红、疼痛和压痛以及轻度肿胀)是常见的(0–95%)。全身反应(即发热、不适、头痛和淋巴结病)不太常见,但可能发生,尤其是在接种加强剂量疫苗后。严重反应,包括神经系统(如周围神经病变,特别是臂丛神经病变、格林-巴利综合征、癫痫发作和急性脑病)和过敏反应(过敏反应)极为罕见(45,216)。
国际移民组织的一项评估得出结论,来自涉及含破伤风类毒素疫苗的病例报告和非对照研究的证据支持含破伤风类毒素疫苗和臂神经炎之间的因果关系(133)。尽管通过国家疫苗伤害赔偿计划(VICP ),臂神经炎被认为是可赔偿的事件,但ACIP认为接种含破伤风类毒素的疫苗后发生臂神经炎并不排除它们将来在同一人身上的使用;臂神经炎通常是自限性的(52,132,138)。
与最近关于含无细胞百日咳疫苗的结论一样,IOM还得出结论认为,证据不足以接种或拒绝接种含白喉类毒素和破伤风类毒素疫苗与脑炎、脑病、婴儿痉挛、癫痫发作、共济失调、自闭症、急性播散性脑脊髓炎、横贯性脊髓炎、视神经炎、成人多发性硬化症发作、成人多发性硬化症复发、儿童多发性硬化症复发、格林-巴利综合征、慢性炎性播散性多发性神经病、眼阵挛肌阵挛综合征或贝尔麻痹(133)。ACIP认为,接种含破伤风类毒素疫苗后不到6周出现的格林-巴利综合征是随后接种含破伤风类毒素疫苗的一项预防措施(52)。涵盖青少年和成人人群接种的200万剂Tdap的主动监测数据未能证明接种含破伤风类毒素的疫苗与接种疫苗后6周内发生格林-巴利综合征之间存在关联(164,165,217)。
孕妇
含破伤风类毒素的疫苗对孕妇是安全的。没有证据表明怀孕期间注射破伤风和白喉类毒素会导致畸形(54)。在孕妇中进行的破伤风类毒素现场试验显示,在预防孕产妇和新生儿破伤风(50,218–222)。
关节炎
虽然接种破伤风类毒素疫苗和关节炎之间的因果关系在生物学上似乎是合理的,但接种破伤风疫苗和关节炎之间可能存在联系的证据有限(132)。1994年,根据病例报告、病例系列和非对照观察研究,IOM得出结论,证据不足以证明接种破伤风类毒素和关节炎之间的因果联系(132)。在对证据的第二次审查中,海洋金属组织根据几份案例报告和两项病例对照研究得出了类似的结论(133)。第一项病例对照研究发现接种破伤风类毒素疫苗后银屑病关节炎的风险增加(优势比[OR]:1.91;95%可信区间= 1.0%-3.7%)(223)。在第二项研究中,研究人员得出结论,破伤风类毒素或白喉疫苗不会增加类风湿性关节炎的风险(224)。这两项研究都有严重的局限性和低精确度(133)。
一家大型健康维护组织最近开展的一项研究评估了接种破伤风、流感和乙型肝炎疫苗后患类风湿性关节炎的风险,采用队列和病例对照设计来确定接种疫苗后不同时间间隔的风险(225)。该研究未发现在任何评估间隔期内破伤风疫苗相关的类风湿性关节炎风险显著增加(225)。
白喉类毒素安全性
含有白喉类毒素的疫苗的反应原性是常见的。所有可用的含百日咳的疫苗包括白喉类毒素,并且不同形式的白喉类毒素在某些结合疫苗中用作载体蛋白(MenACWY-D[Menactra,Sanofi Pasteur],MenACWY-CRM[Menveo,GlaxoSmithKline,Rixensart,Belgium],13价肺炎球菌多糖-蛋白结合疫苗[PCV13,Prevnar13,Wyeth Pharmaceuticals Inc .,Collegeville,Pennsylvania,Pfizer Inc .,New York,New York的子公司])。含白喉类毒素疫苗不良事件的报告频率因疫苗配方、白喉类毒素剂量、既往疫苗接种史和接种前抗白喉类毒素抗体水平而异。虽然局部注射部位反应很常见,但其中只有一小部分具有临床意义(226)。施用白喉类毒素与过敏反应无关。
因为白喉类毒素不作为单价白喉类毒素疫苗接种,所以很难确定单独白喉类毒素的反应原性。然而,在一项对180名受试者进行的研究中,比较了DTaP(白喉类毒素≥10 IU)与Td(白喉类毒素≥2 IU)和单价白喉类毒素(白喉类毒素≥2 IU)的反应原性,单价白喉类毒素受试者中出现局部反应(如红斑、硬结、发热和触痛)的受试者比例普遍低于其他两组受试者(227)。与Td相比,DTaP接种者的反应原性增加并没有一致的模式(227)。此外,来自几项对照研究的数据表明,接种Td后比接种TT疫苗后更容易出现发热和局部反应(190,228,229)。一般而言,接种DT或DTaP疫苗后,婴儿报告的常见全身体征和症状(即温度≥38℃[≥100.4℉]、哭闹≥1小时、易怒、嗜睡、食欲不振和呕吐)以及局部反应(即发红、肿胀和触痛)的频率相当(230)。
孕妇
含白喉类毒素的疫苗对孕妇是安全的。没有证据表明怀孕期间注射破伤风和白喉类毒素会导致畸形(54)。20世纪40年代在孕妇中进行的白喉类毒素随机试验证明了母体抗白喉抗体的有效经胎盘转移和对婴儿白喉的保护(231–234)。
Tdap与其他疫苗同时接种
在青少年和成人中进行的上市前和上市后研究评估并支持了Tdap与一种或两种其他疫苗(如MenACWY、HepB和人乳头瘤病毒[HPV]以及三价灭活流感疫苗)同时或依次接种时的安全性和免疫原性(141,167,235–242)。在大多数这些研究中,当Tdap与另一种疫苗同时或相继接种时,在安全性方面没有观察到差异。然而,当与HepB疫苗(141)。同时接种组(22.5%)和顺序接种组(17.9%)均报告有关节肿胀或疼痛,大多数关节不适症状轻微,平均持续时间为1.8天(141)。
当与其他疫苗同时施用时,Tdap具有免疫原性。同时接种组与顺序接种组相比,达到白喉和破伤风抗体保护水平的受试者比例相似(235–242)。当Tdap与MenACWY-D、人乳头瘤病毒(二价或四价)或HepB疫苗同时或依次接种时,对百日咳抗原的免疫应答是相似的,尽管在同时接种后,对具有MenACWY-CRM(Menveo,Novartis)和三价灭活流感疫苗的百日咳抗原的免疫应答较低(141,235–241)。当Tdap与MenACWY-CRM(Menveo,Novartis)同时接种时,对三种百日咳抗原中的两种的免疫反应较低,但这一发现的临床相关性(如果有的话)尚不清楚(237)。当对19-64岁的成年人接种Tdap和三价灭活流感疫苗时,同时接种组对百日咳抗原的免疫应答低于顺序接种组,但不劣于顺序接种组,除了Adacel 的PRN和Boostrix的FHA和PRN(235,236)。不符合这些抗原的非劣效性标准的临床意义(如果有的话)尚不清楚(235)。对于年龄≥65岁的成年人,与分别接种Boostrix疫苗和三价灭活流感疫苗相比,同时接种这两种疫苗也是安全且具有免疫原性的(242)。
成本效益分析
作为考虑在特定人群中使用Tdap的建议的一部分,对特定的疫苗接种策略和目标人群进行了成本效益分析。这些被认为适用于年龄≥65岁的成年人和妊娠期妇女。
为年龄≥65岁的成年人接种疫苗
ACIP审查了两项关于在年龄≥65岁的健康人中用单剂量Tdap替代十年一次Td加强剂的流行病学和经济影响的成本效益分析(CDC,未发表的数据,2012年) (243)。这两个模型都是为了评估年龄≥65岁的成人接种Tdap疫苗的流行病学和经济影响而开发的,并且都证明了对老年人施用一剂Tdap可导致百日咳病例数和其他结果(例如门诊、住院和死亡)的适度减少(CDC,未发表的数据,2012年) (243)。从两个具有相似发病率的模型(每100,000人100-104例)来看,每个质量调整生命年节省的成本在30,946美元到62,716美元之间,每个病例避免的成本在1,966美元到3,263美元之间(CDC,未发表的数据,2012年) (243)。模型结果对百日咳发病率最敏感;然而,敏感性分析显示,即使假设百日咳漏报的估计范围,在该人群中,Tdap疫苗接种与没有Tdap疫苗接种相比可能是成本有效的。由于这两个成本效益模型的一致性,ACIP的结论是每个病例避免的成本和每个质量调整生命年节省的成本是适度的(10)。
产妇Tdap疫苗接种和结茧
开发了一个决策和成本效益模型,以评估孕期与产后(有或无结茧)接种Tdap疫苗的可能影响和成本效益。该模型显示,怀孕期间接种Tdap疫苗比产后接种疫苗更能降低婴儿百日咳的年发病率,使病例减少33%对20%,住院率减少38%对19%,死亡率减少49%对16%。孕期疫苗接种节省的每质量调整生命年成本为414,523美元,而产后疫苗接种节省的成本为1,172,825美元。减少婴儿百日咳的两个主要驱动因素是通过在婴儿出生前接种疫苗早期间接保护母亲,以及通过母体抗体的经胎盘转移为婴儿提供被动免疫。稳健条件下的敏感性分析,包括降低的Tdap疫苗效力,没有改变孕期接种疫苗的相对益处(244)。
百日咳、破伤风和白喉控制战略
常规DTaP、Tdap和Td疫苗接种
在美国,报道的破伤风和白喉病例很少。尽管婴儿、儿童和青少年的疫苗接种率很高,但血清学和调查数据表明,成人破伤风和白喉疫苗接种不足,而且随着年龄的增长,接种率下降(36,51)。通过坚持ACIP推荐的疫苗加强剂量方案来维持破伤风和白喉的血清保护对所有年龄的成人都是重要的。
与破伤风和白喉相反,尽管DTaP疫苗在婴儿和儿童中的覆盖率较高,且Tdap在青少年中的覆盖率也在增加,但美国报告的百日咳发病率一直在增加(245)。虽然无细胞百日咳疫苗提供的疫苗诱导的保护随着时间的推移而减弱,但疫苗接种仍然是对抗百日咳的最佳保护。ACIP认识到,并非所有百日咳病例都可以预防。然而,用现有的许可疫苗维持幼儿(DTaP)和青少年(Tdap)的疫苗覆盖率,并在成年人(尤其是孕妇)中实现高Tdap覆盖率,是预防百日咳的最佳可用手段。
通过母体Tdap疫苗接种预防小婴儿百日咳
由于年幼婴儿因百日咳住院和死亡的风险仍然很高,ACIP努力优化疫苗接种计划策略,以预防太小而无法接种的婴儿患百日咳。非常小的婴儿部分依赖于被动获得的母体抗体,母体抗体被认为可以保护婴儿免受感染,并在不同时期内减轻婴儿各种传染病的严重程度(246,247)。在ACIP推荐孕妇接种疫苗之前,几项研究提供了证据支持百日咳抗体存在有效的经胎盘转移(181,248,249)。这些研究表明,与未接种疫苗的母亲相比,母亲在怀孕前或怀孕期间接种Tdap的新生儿在出生时具有更高的百日咳抗体浓度(181,248,249)。
通过对怀孕27至36周的Tdap妇女进行疫苗接种来预防新生儿百日咳的策略有80%-91%的有效性(CDC,未公布的数据,2016年) (250–253)。一项研究发现,在感染百日咳的婴儿中,怀孕期间接种Tdap疫苗的母亲所生的婴儿比未接种疫苗的母亲所生的婴儿患百日咳的程度轻;母亲接种疫苗在预防感染百日咳的婴儿住院方面有58%的有效性(254)。
从妊娠27周到36周接种疫苗
Tdap可以在怀孕期间的任何时间接种,但是在妊娠末三个月期间的疫苗接种可能提供最高浓度的母体抗体以在接近出生时转移(247)。母体免疫球蛋白G的大量主动转运不会在妊娠30周之前发生(255)。在接种Tdap后,至少需要2周来产生针对疫苗抗原的最大免疫反应(256,257)。一项研究指出,在接种Tdap后,母体抗体迅速减弱;在妊娠早期或中期接种Tdap的孕妇在足月时抗体水平较低,这表明可能需要在妊娠后期施用Tdap,以获得高水平的抗体转移给婴儿(247)。因此,为了优化从母亲到婴儿运输的疫苗诱导的抗百日咳抗体的浓度,ACIP在2012年得出结论,孕妇应在妊娠晚期接种Tdap疫苗,优选在妊娠27至36周(6)。
自2012年以来可用的新数据表明,在27至36周的时间段内早期接种疫苗将最大限度地将被动抗体转移给婴儿(C. Mary Healy,贝勒医学院,未发表的数据,2016年) (258–260);然而,尚不清楚这如何转化为预防婴儿百日咳的有效性。三项研究表明,在母亲在妊娠27至36周期间接种Tdap的婴儿中,母亲“较早”(例如,妊娠27至32周)接种Tdap的婴儿的脐带血中抗脑震荡抗体浓度明显高于那些“较晚”(例如,妊娠32周后)接种Tdap的婴儿(C. Mary Healy,Baylor College of Medicine,未发表的数据,2016年) (259,260)。第四项研究表明,那些早在妊娠22至26周接种Tdap的人产生了与那些在妊娠27至36周接种的人相似的抗体水平(258)。这些研究支持这样的观察,即在27至36周期间早期接种疫苗,或者甚至稍微早于27周,可能优化母体抗体的产生和向婴儿的转移。
确保孕妇接种Tdap病毒感染和婴儿出生之间有足够的时间,以便最大限度地产生和转移母体抗体,这一点非常重要,可以通过在早于目前指导的27-36周的孕周接种疫苗来实现。然而,ACIP谨慎地不将较高的新生儿母体抗体浓度(可能通过早期母体Tdap疫苗接种获得)与预防婴儿期百日咳的类似或更好的效果等同起来。此外,还不清楚妊娠早期母体接种疫苗是否会导致母体抗体的产生和转移,其浓度在婴儿第一次接种DTaP前一直保持在保护水平。由于缺乏孕27周前接种疫苗的有效性数据,ACIP得出结论,在孕27-36周早期接种疫苗将最大限度地将被动抗体转移给婴儿(261)。
每次怀孕期间接种疫苗
对接种一剂Tdap后抗脑震荡抗体持久性的研究表明,一年后,健康、非妊娠成人(186,262,263);孕妇体内的抗体动力学很可能是相似的。关于前2年内接种Tdap的妇女所生婴儿的母体抗脑震荡抗体浓度,一项研究的结果表明,在怀孕前接种疫苗的孕妇中,抗脑震荡抗体浓度迅速下降,不可能高到足以为婴儿提供被动保护(247)。因为在接种疫苗后的第一年内抗体水平显著下降,ACIP得出结论,在怀孕期间单剂量的Tdap不足以为随后的怀孕提供保护(6)。
对婴儿初次接种免疫反应的干扰
母系来源的经胎盘抗百日咳抗体的存在可能会干扰婴儿对随后主动接种推荐的DTaP疫苗的反应,这可能会使婴儿在婴儿期后期有患病的风险。在英国,与未接种疫苗的母亲所生的婴儿相比,在怀孕期间接种Tdap-IPV疫苗的母亲所生的婴儿在2-3-4个月的第三剂疫苗后3-6周测量时,具有较低的PT、FHA和FIM抗体(264)。白喉抗体也较低,在2-4个月接种PCV13疫苗时,一些CRM结合肺炎球菌抗原的抗体也较低。相反,抗破伤风抗体和抗Hib抗体反应增强。在美国和加拿大,与母亲在妊娠期间未接种疫苗的婴儿相比,母亲在妊娠期间接种Tdap疫苗的婴儿,在接种第三剂2-4-6个月DTaP疫苗后,百日咳抗体水平略有下降(7.2%-48.3%);然而,在第四剂DTaP后,两组婴儿的百日咳抗体水平相当(S. A. Halperin,Dalhousie大学,未发表的数据,2011年) (192,249)。因为对百日咳的保护相关性还没有很好的定义,接种DTaP后婴儿免疫反应降低的临床重要性还不清楚。然而,对婴儿免疫反应的任何干扰都可能是短暂的,因为循环母体抗体迅速下降(265)。虽然不知道母源抗体的水平对婴儿百日咳有保护作用,但ACIP得出结论,保护新生儿免受母源抗体的潜在益处超过了将百日咳疾病负担转移到婴儿后期的潜在风险,并强调了及时接种第四剂DTaP的重要性(9)。
“结茧”
ACIP建议孕期妇女接种Tdap疫苗以预防婴儿百日咳。在该建议被发展为对孕妇进行Tdap疫苗接种之前,预防婴儿百日咳的主要策略是对婴儿的密切接触者进行Tdap疫苗接种,假设接种Tdap疫苗将降低百日咳暴露和传播给婴儿的风险,该策略被称为“结茧”(5)。
结茧计划取得的成功有限,并且在实施和计划可持续性方面面临着巨大的后勤和财政挑战(43,266–268)。这些项目在产后母亲中实现了中等程度的Tdap覆盖率,但在为其他家庭成员接种疫苗方面不太成功(268,269)。关于结茧预防百日咳传染给婴儿的有效性和影响的证据是不确定的(153,154,270)。最近的流行病学和动物模型证据表明,Tdap疫苗不能预防传播,因此不能对百日咳的密切接触者提供间接保护(155,156,159)。然而,与未接种过百日咳疫苗的人相比,接种过百日咳疫苗并被感染的人通常感染较轻,这可能使他们将百日咳传染给他人的效率较低(160)。
当2005年推荐Tdap疫苗接种时,母亲被确定为婴儿百日咳的主要来源(271,272)。这种情况似乎已经改变,现在兄弟姐妹被确定为婴儿百日咳感染的主要来源(40,42,43)。婴儿百日咳来源的这种转变,以及最近的证据表明Tdap疫苗接种不能预防百日咳的传播百日咳鲍特菌咳强调了通过怀孕期间妇女的Tdap疫苗接种为新生儿提供母体抗脑震荡抗体的重要性(155,156,159)。建议所有年龄≥11岁且之前未接种过一剂Tdap的人接种一剂;在家庭中怀孕为审查密切接触者的Tdap疫苗接种状况提供了机会,以确保他们是最新的。
卫生保健人员预防百日咳
据了解,美国的卫生保健人员患白喉或破伤风的风险并不比普通人群高。然而,对于百日咳,职业暴露发生在卫生保健机构中,并且已经记录了百日咳在各种卫生保健机构中的院内传播(273–288)。在这些情况下,指示病例可能发生在卫生保健提供者、患者或医院来访者(273–288)。尽管患者暴露的频率和强度可能导致医护人员感染,并随后传播给其他患者,但医护人员患百日咳的风险和负担很难量化。对美国卫生保健人员中百日咳风险的少数基于人群的估计表明,卫生保健人员中百日咳的风险与青少年和成人一般人群中的风险相当(289–291)。
自2005年以来,ACIP已建议卫生保健人员接种单剂量Tdap,以保护他们免受百日咳,并可能减少向患者、同事、家庭成员和社区人员的传播。卫生保健人员中基于医院的Tdap覆盖率可能取决于机构采用的Tdap疫苗接种计划的类型;报告的覆盖范围从30%(活动)到100%(医院要求) (292,293)。在全国范围内,卫生保健人员的Tdap覆盖率为42.1%(36)。
先前评估为卫生保健人员接种Tdap疫苗以预防医院内百日咳爆发的可能益处和成本的模型表明,卫生保健人员接种疫苗显著降低了医院内爆发的风险,并且节省了成本(294,295)。然而,模型输入包括对Tdap百日咳疫苗效力的估计,高于目前的估计,并假设疫苗接种将减少百日咳传播,从而防止继发性病例。目前的数据不支持Tdap疫苗可以预防传播的假设。
暴露于百日咳的医护人员的管理
根据所使用的方法,在卫生保健机构中管理百日咳暴露可能是复杂、耗时和昂贵的。必须对患有咳嗽疾病的暴露的卫生保健人员进行评估,可能需要进行诊断测试、使用预防性抗菌药物,并可能禁止其工作。几项研究表明,在卫生保健机构中调查百日咳暴发和实施控制措施的成本是巨大的。在12个月的时间里,在卫生保健机构中管理百日咳暴露的成本从84,000美元到98,000美元(284,294)。处理以医院为基础的百日咳爆发的相关成本从74,000美元到263,000美元(285,288)。自2005年Tdap医护人员建议颁布以来,只有一项研究试图确定是否有必要给予Tdap疫苗接种的医护人员暴露后抗菌预防,但由于研究期间疾病风险较低,结果不确定(296)。
卫生保健人员暴露后预防指南
当医护人员暴露于百日咳时,Tdap疫苗接种状况不会改变评估暴露后预防的方法。建议与有患严重疾病风险的人(如住院新生儿、新生婴儿和慢性呼吸系统疾病患者)接触的医护人员进行暴露后预防。其他卫生保健人员可以接种暴露后预防或在百日咳暴露后21天仔细监测。卫生保健人员应在出现百日咳的体征和症状时使用抗生素进行治疗,并在接种适当抗生素治疗的前5天内禁止工作。在暴露于百日咳的医护人员中,推荐用于暴露后预防的抗菌药物包括阿奇霉素、克拉霉素、红霉素和甲氧苄啶-磺胺甲恶唑(TMP-SMX)。百日咳暴露后预防指南可从以下网址获得https://www.cdc.gov/mmwr/PDF/rr/rr5414.pdf.
普通人群没有额外剂量的Tdap
除了孕妇之外,对于年龄≥11岁的人,仅推荐单次加强剂量的Tdap。两种可用的Tdap产品均被批准用作单次加强剂量(141,142)。Tdap提供预防破伤风、白喉和百日咳的保护,但在接种Tdap后的2至4年内,对百日咳感染的保护开始下降(29,149,150)。
临床试验表明,间隔5年或10年注射第二剂Tdap是安全且具有免疫原性的(184–188)。免疫原性研究表明,白喉和破伤风抗体水平在接种Tdap(186,188,262,263,297–301)。然而,抗百日咳抗体在第一年后迅速下降,表明保护作用减弱,这可能会限制第二剂Tdap对美国百日咳总体负担的影响(186,188,262,263,297–301)。额外剂量Tdap后的抗体衰减和临床保护作用可能与第一剂Tdap后观察到的情况相似。
ACIP认识到百日咳在美国的负担越来越重,需要一种有效的策略来减轻这种负担。一个决策分析模型评估了对11岁时接种第一次Tdap的人以5年或10年间隔给予额外剂量的Tdap的常规计划的流行病学和经济影响,该模型表明,可归因于常规使用第二剂Tdap的百日咳疾病负担的减少是有限的(302)。在该模型中,与建议相比,可预防病例的比例在3%至5%之间(302)。ACIP的结论是,数据不支持常规第二剂Tdap的一般建议,并且常规建议第二剂Tdap的公共卫生影响将是有限的(303)。
推荐使用百日咳、破伤风和白喉疫苗的理由
在疫苗出现之前,百日咳、破伤风和白喉是常见疾病,会导致严重的发病率和死亡率。由于常规的DTP/DTaP儿童疫苗接种方案和针对青少年和成人的含破伤风类毒素疫苗的十年加强剂量,所有三种疾病的病例数量都显著下降;破伤风和白喉病例在美国很少见。就百日咳而言,在普及儿童百日咳疫苗接种后,报告的病例数量急剧下降(3)。然而,即使有持续的高疫苗覆盖率,报告的百日咳发病率在1980年代开始增加。
1997年,ACIP建议DTaP取代所有DTP剂量;从那时起,这些儿童疫苗建议没有任何变化(3)。在2005年,为了解决青少年和成人百日咳发病率增加的问题,ACIP建议对11-64岁的人使用单剂Tdap作为破伤风、白喉和百日咳的加强免疫,目的是为11-12岁的人提供常规疫苗接种(4,5)。此外,建议特殊人群,包括医护人员和婴儿的密切接触者,接种一剂Tdap。
自2005年颁布《ACIP·Tdap建议》以来,几项研究查明了在执行《青少年和成人建议》方面的障碍和方案差距。实施的障碍包括关于最后一剂含破伤风类毒素疫苗后Tdap接种时间的指导语言混乱,以及卫生保健人员接种疫苗的障碍。2005年提出建议时的规划缺口包括缺乏许可用于7-10岁儿童和≥65岁成人的Tdap疫苗。2011年和2012年,ACIP为这些年龄组推荐了一剂Tdap,并澄清了关于Tdap疫苗接种时间和医护人员疫苗接种的措辞(8,10,304)。
与年龄较大的儿童和成人相比,年龄小于12个月的婴儿患百日咳的比率明显较高(图2 ),并且百日咳相关死亡的负担最重。大多数百日咳相关的住院和死亡发生在年龄≤2个月的婴儿中,这些婴儿太小而不能接种疫苗。保护最小婴儿免于百日咳发病率和死亡率的愿望促使ACIP在2011年建议在怀孕期间给妇女施用一剂Tdap,但仅针对从未接种过Tdap的孕妇(9)。由于接种疫苗后抗体水平大幅下降,ACIP得出结论,在一次怀孕期间接种单一剂量的Tdap不会为随后怀孕的婴儿提供保护。2012年,对建议进行了修订;ACIP建议在每次怀孕期间使用Tdap(6)。
百日咳、破伤风和白喉疫苗接种的建议
建议所有人接种常规百日咳、破伤风和白喉疫苗接种。疫苗类型、产品、剂量数量和加强剂量建议基于年龄和妊娠状况(表4和表5)。在彻底审查了关于Tdap疫苗接种的风险和益处的现有数据后,提出了Tdap疫苗的适应症外使用建议,包括以下人群:孕妇、7-10岁的儿童和≥65岁的人(对于一种Tdap产品) (6,8–10)。在提出这些建议时,ACIP确定,尽管数据有限,但标签外Tdap疫苗在预防百日咳和降低百日咳相关发病率和死亡率方面的益处超过了不良事件的风险。
一般性建议
2个月至6岁的儿童
2个月至6岁儿童的常规百日咳、破伤风和白喉疫苗接种计划包括5剂含白喉、破伤风类毒素和百日咳抗原(DTaP)的疫苗,分别在2、4、6、15至18个月和4至6岁时接种。
应在2、4和6个月大时注射三剂(首剂)。
第四剂(第一次加强剂)应给予15-18个月的儿童,以保持学龄前儿童足够的免疫力。
第五剂(第二次加强剂)应给予4-6岁的儿童,以在上学的最初几年提供持续的预防疾病的保护。
使用指南
第一剂DTaP可以在6周龄时接种。
第四剂DTaP应在第三剂DTaP后至少6个月接种,且不应给小于12个月的儿童接种。
如果系列中的第四剂DTaP是在年龄≥4岁时施用的,则没有必要施用第五剂DTaP。
11-18岁的人
11-18岁的人应该接种单剂量的Tdap,最好是在11-12岁的预防性保健随访时。为确保持续预防破伤风和白喉,应在一生中每10年注射一次强化剂量的Td。
年龄≥19岁的人
年龄≥19岁且以前未接种过一次Tdap的人应接种一次Tdap,而不是十年一次的Td加强剂量。如有需要,Tdap的剂量不应延迟,且应在不考虑最后一次含破伤风或白喉类毒素疫苗接种间隔的情况下使用。为确保持续预防破伤风和白喉,应在一生中每10年注射一次强化剂量的Td。
孕妇
ACIP建议产前护理提供者对所有孕妇实施Tdap免疫计划。卫生保健人员应在每次怀孕期间给予一定剂量的Tdap,无论患者之前是否有疫苗接种史。
使用指南
Tdap应在妊娠27至36周之间接种,尽管它可以在妊娠期间的任何时间接种。现有数据表明,在27-36周的时间段内尽早接种疫苗将最大限度地将被动抗体转移给婴儿。
孕妇可以同时接种Tdap和灭活流感疫苗。
如果女性在当前妊娠期间未接种Tdap,且之前未接种过Tdap(即在青春期、成年期或前一次妊娠期间),则应在产后立即接种Tdap。如果一名妇女在当前怀孕期间没有接种Tdap,但之前接种过Tdap,那么她在产后就不应该接种Tdap。
特殊人群疫苗接种
2个月至6岁的儿童
百日咳疫苗接种的禁忌症。对于年龄< 7岁、有百日咳疫苗接种禁忌症的儿童(表2),应使用DT代替DTaP来完成适合年龄的系列。以前未接种疫苗的儿童在年龄< 12个月时接种第一剂DT,应接种总共4剂DT,前3剂间隔4-8周,第4剂在6-12个月后(类似于推荐的DTaP方案)。
年龄≥12个月且禁用百日咳疫苗的未接种儿童应间隔4-8周接种2剂DT,然后在6-12个月后接种第3剂,以完成初次系列。在第一个生日后已经接种了1或2剂DT或DTaP并且禁止接种百日咳疫苗的儿童应接种总共3剂适合其年龄的含有白喉和破伤风类毒素的制剂,第三剂在第二剂后6至12个月接种。
4-6岁的儿童在4岁生日前完成了一系列初级DT,应在入学时接种第五剂DT,以提供对疾病的持续保护。
个人癫痫发作史。在有癫痫发作史的婴儿和儿童中,谨慎的做法是推迟百日咳疫苗接种,直到儿童的神经状况得到评估。神经系统状况稳定(包括癫痫发作得到良好控制)的婴儿和儿童可以接种DTaP疫苗。在治疗方案建立和病情稳定之前,患有神经系统疾病的婴儿不应接种疫苗。癫痫家族史与百日咳疫苗接种并不矛盾。
年龄≥11岁的人
婴儿的密切接触者。年龄≥11岁、与年龄≤12个月的婴儿有过或预期有过密切接触的人(如父母、兄弟姐妹、祖父母、儿童保健提供者和医疗保健提供者)以及从未接种过Tdap的人应接种一剂Tdap。理想情况下,这些人应在与婴儿接触前至少2周接种Tdap,以产生对百日咳疫苗抗原的免疫反应。
医护人员。如果以前没有接种过Tdap,所有卫生保健人员应尽快接种单剂Tdap。接种1剂Tdap后,卫生保健人员应根据推荐的时间表接种常规Td加强免疫。
住院和门诊护理机构应考虑采取措施,最大限度地提高卫生保健人员的疫苗接种率(例如,关于疫苗接种好处的教育、方便获取、免费提供Tdap)。
疫苗史不完整或未知的人
2个月至6岁的儿童
对于未完全接种DTaP疫苗的7岁以下人群,可在以下网站获得补种计划和最小剂量间隔https://www . CDC . gov/vaccines/schedules/hcp/child-adolescent.html. 。对于DTaP疫苗接种史不完整的患者,无论两次接种之间间隔多长时间,都不需要重新开始疫苗接种。
由于担心不良反应,在七岁生日之前,接种含白喉和破伤风类毒素的疫苗(如DTaP、DT和DTP)的总剂量不应超过6剂。只有记录的剂量计入最大6次剂量。
7-18岁的人
未完全接种DTaP疫苗的7-18岁人群应接种一剂Tdap,作为后续系列的一剂(最好是第一剂);如果需要额外剂量,使用Td疫苗。对于DTaP疫苗接种史不完整的人,无论两次接种之间经过了多长时间,都不需要重新开始疫苗接种。可从以下网址获得补充计划和最小剂量间隔https://www . CDC . gov/vaccines/schedules/hcp/child-adolescent.html. .
对于7-10岁接种一剂Tdap作为补充系列的人群,青少年Tdap疫苗剂量应在11-12岁时进行。
18岁以上的人
从未接种过百日咳、破伤风或白喉疫苗的18岁以上的人应接种三次含破伤风和白喉类毒素的疫苗接种,其中包括1剂Tdap。首选方案是单剂Tdap,然后在Tdap后至少4周接种一剂Td,6至12个月后再接种一剂Td。然而,单剂Tdap可以替代3剂主药系列中的任何Td剂量。
未完全接种破伤风和白喉疫苗的18岁以上人员应接种1剂Tdap(最好是第一剂);如果需要额外的含破伤风类毒素的剂量,使用Td疫苗。或者,在18岁以上的人可能接种了破伤风和白喉疫苗但不能出示证明文件的情况下,疫苗提供者可以考虑进行破伤风和白喉毒素抗体的血清学检测,以避免不必要的接种。如果破伤风和白喉抗毒素水平均> 0.01 IU/mL,则推定之前接种过破伤风和白喉类毒素疫苗,并指示接种单剂Tdap。
预防产科和新生儿破伤风
已完成儿童期免疫计划且最近一次接种是在10年前的孕妇应接种含破伤风类毒素疫苗的加强剂量,以预防新生儿破伤风。如果以前未接种过疫苗的妇女在怀孕期间接种了至少两次间隔适当的含破伤风类毒素的疫苗,则新生儿破伤风的风险极小;根据目前的指南,孕期接种的剂量之一应该是Tdap。她应该在推荐的时间间隔内完成3剂初级系列。
破伤风预防用于伤口管理
ACIP已建议在需要时,接种含破伤风类毒素的疫苗和破伤风免疫球蛋白(TIG ),作为预防破伤风的标准伤口管理的一部分(表6)。如果距离最后一次注射含破伤风类毒素的疫苗已超过五年,则含破伤风类毒素的疫苗应作为伤口处理的一部分。如果含破伤风类毒素的疫苗适用于≥11岁的人群,则Tdap是以前未接种过Tdap或Tdap史未知的人群的首选。如果孕妇需要接种含破伤风类毒素的疫苗,应使用Tdap。对于以前接种过Tdap疫苗的非孕妇,如果需要接种含破伤风类毒素的疫苗,应使用Td。如果需要接种含破伤风类毒素的疫苗,但无法获得破伤风类毒素,可使用Tdap。
已完成3剂初级破伤风疫苗接种系列并在不到5年前接种含破伤风类毒素疫苗的人可获得预防破伤风的保护,不需要含破伤风类毒素疫苗或TIG作为伤口管理的一部分。应尝试确定患者是否完成了3剂破伤风疫苗接种系列。未知或不确定既往破伤风疫苗接种史的人应被视为之前没有接种过含破伤风类毒素的疫苗。没有完成初级系列的人可能需要含破伤风类毒素的疫苗,并在伤口处理时被动接种TIG疫苗(表6)。当TIG和含破伤风类毒素的疫苗都适用时,应在不同的解剖部位使用不同的注射器注射。感染了人类免疫缺陷病毒(HIV)或严重免疫缺陷的人,如果伤口被污染,也应该接种TIG,不管他们是否有破伤风免疫接种史。
前一剂含破伤风类毒素疫苗后有Arthus反应史的人不应接种含破伤风类毒素疫苗,直到最近一次接种后> 10年;无论伤口状况如何(例如,即使被污染或严重),都建议采用这一时间间隔。在所有情况下,应根据破伤风的初次疫苗接种史决定是否接种TIG疫苗(表6)。
特殊情况
婴儿和7岁以下儿童的加速计划
对于年龄小于7岁的婴儿或儿童,旅行、潜在失访或暴露于百日咳的风险增加等情况可能需要加快计划以尽早提供保护。婴儿一满6周就可以开始加速接种,第二次和第三次DTaP接种不得早于前一次接种后4周。第四剂DTaP不应在婴儿12个月大之前接种,且应与第三剂至少间隔6个月。儿童在4岁之前不应注射第五剂DTaP。当考虑加速时间表时,提供者还应考虑其他推荐疫苗和健康儿童访视的时间。
百日咳的历史
根据常规建议,有百日咳病史的人应接种含百日咳疫苗(即DTaP或Tdap)。尽管百日咳疾病可能赋予针对百日咳的天然免疫,但针对随后的百日咳疾病的免疫反应可能是次优的,并且由感染诱导的保护持续时间不能提供长期免疫(305,306)。
从破伤风或白喉中康复的人
破伤风或白喉感染并不一定赋予抗再感染的免疫力(54,307,308);因此,应根据时间表在疾病康复时开始积极接种疫苗。已完成初级破伤风疫苗接种系列的人应在康复期间尽快接种加强剂量。未知或不确定既往破伤风疫苗接种史的人应被视为以前没有接种过含破伤风类毒素的疫苗,应开始接种3剂破伤风和白喉类毒素疫苗系列。
疫苗管理
所有负责接种疫苗的卫生保健人员都应意识到接种疫苗后晕厥的可能性,尤其是在青少年中,并应采取适当措施防止潜在伤害。提供者应强烈考虑在接种疫苗后观察患者15分钟。如果发生晕厥,应观察疫苗接种者,直到症状消失(52)。
无细胞百日咳疫苗
百日咳、破伤风和白喉疫苗系列有六种疫苗获得许可(表4)。DTaP的剂量是0.5毫升,肌肉注射。对于婴儿和2岁以下的儿童,优选的肌肉注射部位是大腿的前外侧(52)。对于年龄≥3岁的儿童,首选部位是三角肌(52)。DTaP可以在不同的解剖部位与其他疫苗同时施用。
无细胞百日咳疫苗的互换使用。只要可行,同一DTaP产品应用于所有剂量的疫苗接种系列。关于使用不同制造商生产的DTaP疫苗进行连续剂量的初次或加强免疫接种系列的安全性、免疫原性和效力的数据有限。然而,疫苗提供者可能不知道或没有以前给儿童接种的DTaP疫苗的类型;这两种情况都不应该成为接种疫苗的障碍。任何经许可的DTaP疫苗均可用于完成疫苗接种系列。
第三次和第四次DTaP剂量之间的最小间隔。建议第三剂和第四剂DTaP之间的最小间隔为6个月,接种第四剂DTaP的最小年龄为12个月。然而,如果在第三剂DTaP后至少4个月接种,且儿童年龄≥12个月,则第四剂DTaP被认为是有效的。
DT
在百日咳疫苗成分被禁用或医生决定不接种百日咳疫苗的情况下,一种疫苗被许可用于7岁以下儿童的白喉和破伤风主动免疫接种(表4)。DT的剂量为0.5毫升,肌肉注射。对于婴儿和2岁以下的儿童,优选的肌肉注射部位是大腿的前外侧(52)。对于年龄≥3岁的儿童,首选部位是三角肌(52)。
Tdap
两种疫苗获准用于青少年和成人的百日咳、破伤风和白喉疫苗加强剂量(表5)。Tdap的剂量为0.5毫升,通过肌内接种,优选进入三角肌(52)。Tdap可以在不同的解剖部位与其他疫苗同时接种。
Td和Tdap之间的时间间隔。ACIP建议,对于百日咳疫苗接种,如有需要,应接种Tdap,而不考虑自上次接种含破伤风或白喉类毒素的疫苗以来的间隔时间。ACIP的结论是,虽然Td和Tdap疫苗接种之间较长的间隔可以减少局部反应的发生,但预防百日咳的益处超过了不良事件的潜在风险。对于年龄≥7岁且疫苗史不完整或未知的人,含破伤风类毒素疫苗的剂量间隔应遵循补充系列时间表。
Tdap产品适用于年龄≥65岁的成人。提供者不应错过为年龄≥65岁的Tdap患者接种疫苗的机会。在可行的情况下,Boostrix(批准用于≥10岁的人群)应用于≥65岁的成人,而不是Adacel(批准用于10-64岁的人群);然而,ACIP得出结论,对年龄≥65岁的人接种任何一种疫苗都是免疫原性的,并能提供保护。一剂Tdap产品被认为是有效的;因此,提供者可以使用他们现有的Tdap疫苗。
Td
对于破伤风和白喉类毒素吸附疫苗,有两种许可的疫苗(表5)。Td的剂量为0.5毫升,通过肌肉注射接种,优选注射到三角肌(52)。
疏忽管理
无细胞百日咳疫苗
DTaP不适用于年龄≥7岁的人。如果7-10岁完全接种疫苗的儿童不慎接种了DTaP,该剂量应计为青少年Tdap剂量。如果7-10岁的儿童无意中接种了DTaP,该剂量应算作后续系列的Tdap剂量,儿童应接种Tdap的青少年加强剂量。如果年龄≥11岁的人不慎接种DTaP,该剂量应计为Tdap剂量,且该人不应接种额外剂量的Tdap。
Tdap
2个月至6岁的儿童。如果在破伤风-白喉-百日咳疫苗接种系列的前3剂中的任何一剂中不慎使用了Tdap而不是DTaP,则Tdap剂量不应视为有效,应使用替代剂量的DTaP。DTaP的替代剂量可以在意外Tdap剂量后的任何间隔尽快接种。DTaP系列的剩余剂量应按照常规时间表接种,在DTaP的替代剂量和下一剂DTaP之间至少间隔四周。当该儿童年龄为11-12岁时,应按照建议接种青少年Tdap剂量。
如果无意中将Tdap作为破伤风-白喉-百日咳疫苗接种系列的第四剂或第五剂注射,Tdap剂量应算作有效剂量,无需重复注射;接种第四剂Tdap的儿童应完成儿科DTaP计划。当该儿童年龄为11-12岁时,应按照建议接种青少年Tdap剂量。
已完全接种疫苗的7-10岁儿童。¶如果Tdap是无意中接种的,Tdap剂量不应被视为有效。当该儿童年龄为11-12岁时,应按照建议接种青少年Tdap剂量。
普通人群Tdap的额外剂量
这两种Tdap产品都获准作为主动加强免疫的单剂使用;Boostrix被批准用于年龄≥10岁的人群,Adacel被批准用于年龄在10-64岁的人群。Tdap未获准多次接种,也不建议多次接种,但建议孕妇在每次怀孕期间接种一剂Tdap。如果给以前接种过Tdap的人注射一剂Tdap,该剂量应算作含破伤风类毒素疫苗的下一次加强剂量。
禁忌症和注意事项
在注射每剂疫苗前,提供者应筛查患者的疫苗禁忌症和预防措施(表2)。禁忌症是指患者出现严重不良反应的风险增加的情况。当出现禁忌症时,不应接种疫苗。相比之下,某些情况通常被误解为禁忌症(即,不是推迟接种疫苗的有效理由)(表3)。一般来说,当预防措施存在时,疫苗接种应该推迟。然而,如果对疫苗保护的感知益处超过了不良反应的风险,则在预防措施存在的情况下可能需要接种疫苗。
对于DTaP疫苗,提供者和父母应该评估施用后续剂量的含百日咳疫苗的风险和益处。在进一步百日咳疫苗接种的益处超过可能的风险的情况下(例如,在百日咳爆发期间),应在后续剂量中施用DTaP疫苗。
疫苗不良事件的报告
疫苗接种后出现的具有临床意义的严重不良事件应向VAERS报告,地址为https://vaers.hhs.gov/reportevent.html。VAERS是一项上市后安全监督计划,旨在收集在美国许可使用的疫苗接种后发生的不良事件(可能的副作用)的相关信息。
报告可以通过在线、邮件或传真安全归档。VAERS表格可从VAERS网站下载或通过电子邮件(info@vaers.org)、电话(800-822-7967)或传真(877-721-0366)。有关VAERS和疫苗安全性的更多信息可在https://vaers.hhs.gov/about/index获得,或致电800-822-7967。
国家疫苗伤害赔偿计划
根据1986年《国家儿童疫苗伤害法》(经修订)制定的《国家疫苗伤害赔偿方案》(VICP)提供了一种机制,通过这种机制,可以代表被确定因接种VICP覆盖的疫苗而受伤或死亡的人支付赔偿金。《国家儿童疫苗伤害法案》要求医疗保健提供者报告任何被制造商列为进一步接种疫苗禁忌症的不良事件,或任何在接种疫苗后特定时间段内发生的接种疫苗后可报告事件VAERS表中列出的不良事件。疫苗伤害表列出了VICP承保的疫苗以及可能支付赔偿的伤害和情况(包括死亡)。如果伤害或病症未包括在表中,或者未在表中规定的时间段内发生,个人必须证明疫苗导致了伤害或病症。对于有资格获得赔偿的人,伤害的一般提交截止日期要求在疫苗伤害的第一个迹象或症状出现后3年内提交索赔;对于死亡,索赔必须在疫苗相关死亡发生后2年内提出,且不得超过导致死亡的疫苗相关损伤的第一个体征或症状开始后4年。当VICP承保新疫苗或在表格中添加新的伤害/病症时,不符合一般提交截止日期的索赔必须在疫苗或伤害/病症被添加到表格中之日起2年内提交,因为伤害/病症发生在表格变更前8年内。接种VICP疫苗的人可能有资格提出索赔。关于VICP的附加信息是可用的https://www.hrsa.gov/vaccinecompensation/index.html或致电800–338–2382。
孕妇的安全监测
Tdap执政后对孕妇的安全性监测包括在VAERS加强监测和利用VSD评估妊娠期急性不良事件、影响母亲的不良妊娠结局和分娩结局。
尽管美国食品和药物管理局没有要求,赛诺菲巴斯德和葛兰素史克在两种Tdap疫苗的许可期间建立了妊娠登记处,以收集在妊娠期间不慎使用Tdap疫苗后发生的不良事件的数据。ACIP建议在每次怀孕期间接种Tdap疫苗。这两种Tdap产品都不适用于孕妇;产品标签中缺乏关于孕妇使用该产品的具体“适应症和用法”声明,并不排除在怀孕期间使用这些疫苗。这两家制药公司继续保持怀孕登记。医疗保健提供者可向相应公司的妊娠登记处报告怀孕期间的Tdap疫苗接种情况,无论是哪三个月:赛诺菲巴斯德(Adacel)电话:800-822-2463,葛兰素史克(Boostrix)电话:888-452-9622。
未来方向
自20世纪90年代初以来,美国经历了百日咳病例报告数量的显著增加和百日咳流行病学特征的变化。从全细胞百日咳疫苗(DTP)转换为无细胞百日咳疫苗(DTaP)对百日咳流行病学特征的影响仍在研究中。DTaP和Tdap疫苗仍然是预防百日咳疾病的最有效工具,并且与DTP相比,严重不良事件较少,但迄今为止的数据表明,它们不能提供长期保护,可能无法预防传播。
自从2005年为青少年和成人引入单一Tdap加强疫苗以来,对该建议进行了修改,以减少青少年和成人吸收和覆盖Tdap的障碍,并减少婴儿百日咳的负担。青少年的高疫苗覆盖率正在实现,并已达到健康人2020目标(80%),但在成年人中实现高覆盖率仍是一个挑战(35)。尽管在怀孕期间为妇女接种疫苗存在挑战,但教育提供者和孕妇的集中努力已导致Tdap覆盖率逐步提高。需要持续努力增加每次妊娠的Tdap覆盖率,以优化对小婴儿严重百日咳的预防。需要随着时间的推移监测和评估对Tdap建议所做修改的效果,以了解其对百日咳,特别是婴儿百日咳的有效性和影响。
随着美国百日咳的流行病学特征继续发展,以及对无细胞百日咳疫苗了解的增加,将来可能需要重新评估免疫策略。展望未来,由于对无细胞百日咳疫苗和百日咳感染的免疫反应的理解存在差距,以及缺乏公认的、确定的保护免于百日咳的血清学或实验室相关性,改进当前预防和控制策略的能力受到限制。鉴于对当前百日咳疫苗提供的保护持久性的现有理解,优化当前的百日咳疫苗接种计划和保护百日咳相关死亡风险最高的婴儿是当务之急。
致谢
本报告部分基于医学博士阿曼达·科恩的贡献;阿曼达·福克纳,公共卫生硕士;还有赵博贤博士;国家免疫和呼吸道疾病中心;马克·梅索尼埃博士;公共卫生科学服务办公室;和日本东京国立传染病研究所医学博士Hajime Kamiya博士。
对应编制人:美国疾病预防控制中心国家免疫与呼吸系统疾病中心。电子邮件:JLiang@cdc.gov.
1美国疾病预防控制中心国家免疫与呼吸系统疾病中心细菌性疾病科;2美国疾病预防控制中心新发和人畜共患传染病中心医疗质量促进部;3美国疾病预防控制中心国家免疫和呼吸疾病中心主任办公室;4加州大学伯克利分校;加州伯克利;5加州大学圣地亚哥分校;加州拉荷亚;6美国疾病预防控制中心慢性疾病预防与健康促进中心生殖健康部
CDC采纳ACIP对MMWR建议和报告的建议、MMWR政策说明和免疫计划(儿童/青少年、成人):儿童、青少年和成人常规使用疫苗的建议由免疫实践咨询委员会(ACIP)制定。ACIP是一个联邦咨询委员会,为CDC主任提供关于在美国平民中使用疫苗和相关制剂控制疫苗可预防疾病的外部专家建议和指导。儿童和青少年常规使用疫苗的建议尽可能与美国儿科学会(AAP)、美国家庭医师学会(AAFP)和美国妇产科医师学会(ACOG)的建议保持一致。成人常规使用疫苗的建议与AAFP、ACOG和美国内科医师学会(ACP)的建议一致。由CDC主任批准的ACIP建议在《发病率和死亡率周报》( MMWR)上发表之日成为机构指南。更多信息请访问https://www.cdc.gov/vaccines/acip.
关系披露
CDC计划者和内容专家希望公开他们与商业产品制造商、商业服务供应商或商业支持者没有经济利益或其他关系。本报告讨论了在以下情况下未标示使用白喉、破伤风类毒素和无细胞百日咳(DTaP)疫苗或破伤风类毒素、减毒白喉类毒素和无细胞百日咳(Tdap)疫苗的情况:
.如DTaP包装说明书所示,以下情况被视为预防措施而非禁忌症:进行性神经障碍,包括婴儿痉挛、未控制的癫痫或进行性脑病。
.第四剂DTaP的接种年龄可以小于包装说明书中所示的批准年龄。
.最后一次接种含破伤风类毒素的疫苗和接种Tdap之间的最短间隔可能短于包装说明书上注明的5年。
.Tdap的接种年龄可能低于包装说明书中所示的批准年龄。
.Tdap管理局为18岁以上的人提供破伤风和白喉补充疫苗。
.建议妊娠期妇女接种Tdap。
.Adacel (Tdap,赛诺菲巴斯德,Swiftwater,宾夕法尼亚州)的接种年龄可能大于包装插页中所示的批准年龄。
.在超过包装说明书中标明的批准年龄时,无意中使用了DTaP。
.不小心在比包装插页所示批准年龄更小的年龄接种了Tdap。
*工作组成员名单见第43页。
†信息可从以下网址获得http://wwwnc.cdc.gov/travel/page/yellowbook-home.
§病例定义为百日咳确诊病例,发作性咳嗽≥21天,经培养或血清学证实为百日咳杆菌感染。
¶完全接种的定义是接种了5次有效剂量的DTaP或4次有效剂量的DTaP(如果第4次剂量是在第4个生日当天或之后施用的话)。
参考
1.科迪CL,巴拉夫LJ,樱桃JD,马西SM,曼克拉克CR。婴儿和儿童接种百白破和百白破疫苗相关不良反应的性质和发生率。儿科学1981;68:650–60.PubMed
2.龙SS,德福瑞斯特A,史密斯DG,拉扎罗C,瓦西拉克GF。婴儿接种白喉-破伤风-百日咳疫苗不良反应的纵向研究。儿科1990;85:294–302.PubMed
3.疾病控制中心。百日咳疫苗接种:在婴幼儿中使用无细胞百日咳疫苗。免疫实践咨询委员会的建议(ACIP)。MMWR 1997年报告;46(编号RR-7):1–25。PubMed
4.Broder KR,Cortese MM,Iskander JK等,《预防青少年破伤风、白喉和百日咳:免疫实践咨询委员会的破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗的使用建议》( ACIP)。MMWR建议代表2006;55(编号RR-3):1–34。PubMed
5.Kretsinger K,Broder KR,Cortese MM,等.预防成人破伤风、白喉和百日咳:免疫实践咨询委员会(ACIP)的破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗的使用建议,以及ACIP的建议,由卫生保健感染控制实践咨询委员会(HICPAC)支持,在卫生保健人员中使用Tdap。MMWR建议代表2006;55(编号RR-17):1–37。PubMed
6.疾病控制中心。孕妇使用破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗的更新建议(Tdap)——免疫实践咨询委员会(ACIP),2012年。MMWR莫布凡人周刊2013年代表;62:131–5.PubMed
7.美国免疫政策的发展:免疫实践咨询委员会的作用。Ann实习生Med 2009150:45–9.交叉引用 PubMed
8.疾病控制中心。免疫实践咨询委员会关于使用破伤风类毒素、减毒白喉类毒素和无细胞百日咳(Tdap)疫苗的最新建议,2010年。MMWR莫布凡人周刊2011年代表;60:13–5.PubMed
9.疾病控制中心。孕妇和与12个月以下婴儿有过或预期有过密切接触的人使用破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗的最新建议(Tdap)——免疫实践咨询委员会(ACIP),2011年。MMWR莫布凡人周刊2011年代表;60:1424–6.PubMed
10.疾病控制中心。65岁及以上成人使用破伤风类毒素、减毒白喉类毒素和无细胞百日咳(Tdap)疫苗的最新建议——免疫实践咨询委员会(ACIP),2012年。2012年Morb摩伯凡人周刊代表;61:468–70.PubMed
11.百日咳疫苗。载于:Plotkin SA,Orenstein WA,Offit PA,eds。疫苗。第五版。宾夕法尼亚州费城:桑德斯/爱思唯尔;2012:447–92.
12.胡德·里·戈登·JE。百日咳及其流行病学异常。美国医学博士学位1951年;222:333–61.交叉引用 PubMed
13.樱桃JD。成人百日咳的流行病学、临床和实验室方面。Clin Infect Dis 199928(补编2):S112–7。交叉引用 PubMed
14.推荐用于百日咳治疗和暴露后预防的抗菌药物:2005 CDC指南。MMWR建议代表2005;54(编号RR-14):1–16。PubMed
15.NNDSS。当前和历史条件下的监视案例定义。佐治亚州亚特兰大:美国卫生与公众服务部;2017.https://wwwn.cdc.gov/nndss/conditions/
16.疾病控制中心。1979年年度总结:美国报告的发病率和死亡率。1980年Morb莫尔博《凡人周报》;28:12–7.
17.法里索公里,科奇SL,泽尔尔,布林克EW,瓦西拉克SG,柏特莱卡宾夕法尼亚州。1980-1989年美国百日咳的流行病学特征。临床感染Dis 199214:708–19.交叉引用 PubMed
18.疾病控制中心。百日咳——美国,2001-2003年。MMWR莫布凡人周刊代表2005;54:1283–6.PubMed
19.Güris D,Strebel PM,Bardenheier B,等,《美国百日咳流行病学的变化:1990-1996年青少年和成人报告发病率的增加》。Clin Infect Dis 199928:1230–7.交叉引用
20.樱桃JD。英国和美国的百日咳流行病学和百日咳免疫:一项比较研究。1984年现代问题儿科杂志;14:1–78.交叉引用 PubMed
21.Jajosky RA,Hall PA,Adams DA,等,《应报告疾病摘要》——美国,2004年。MMWR莫布凡人周刊代表2006;53(53)。PubMed
22.McNabb SJ,Jajosky RA,Hall-Baker PA,等,《应报告疾病概要——美国,2005年》。MMWR莫布凡人周刊代表2007;54(53)。PubMed
23.亚当斯达,加拉格尔卡,Jajosky RA,等。应报告的疾病摘要-美国,2010年。2012年Morb摩伯凡人周刊代表;59(53)。PubMed
24.Adams DA,Jajosky RA,Ajani U,等,《应报告疾病概要——美国,2012年》。MMWR莫布凡人周刊2014年代表;61(53)。PubMed
25.1990-1996年美国百日咳流行病学的变化:青少年和成人发病率的增加。Clin Infect Dis 199928:1230–7.交叉引用
26.田中M,Vitek CR,Pascual FB,Bisgard KM,泰特JE,墨菲电视。1980-1999年美国婴儿百日咳的趋势。JAMA 2003290:2968–75.交叉引用 PubMed
27.Yih WK,列特SM,des Vignes FN,Garrison KM,Sipe PL,Marchant CD。1989-1998年马萨诸塞州青少年和成人百日咳发病率的增加。j传染疾病2000年;182:1409–16.交叉引用
28.Misegades LK,Winter K,Harriman K,等。2010年,加利福尼亚州,儿童百日咳与接种5剂百日咳疫苗之间的关系。JAMA 2012308:2126–32.交叉引用 PubMed
29.2012年华盛顿州百日咳流行期间Tdap疫苗对青少年的有效性。儿科2015;135:981–9.交叉引用 PubMed
30.甘比尔M,克拉克TA,柯西梅兹S,塔尔托夫西,斯维尔德罗DL,弗格森NM。疫苗效力和保护期的变化解释了最近美国百日咳发病率的上升。2015年PLOS国际电脑展;11:e1004138。交叉引用 PubMed
31.Hill HA,Elam-Evans LD,Yankey D,Singleton JA,Dietz V .美国19-35个月儿童的疫苗接种覆盖率,2015年。MMWR莫布凡人Wkly代表2016;65:1065–71.交叉引用 PubMed
32.美国卫生与公众服务部。IID-7.1。在19至35个月的儿童中保持4剂白喉-破伤风-无细胞百日咳(DTaP)疫苗的有效接种覆盖率。DC华盛顿州:美国卫生与公众服务部;2018.https://www.healthypeople.gov/node/4712/data_details
33.疾病控制中心。美国2006年13-17岁青少年的全国疫苗接种覆盖率。MMWR莫布凡人周刊代表2007;56:885–8.PubMed
34.Reagan-Steiner S,Yankey D,Jeyarajah J,等,《美国13-17岁青少年的国家、地区、州和选定的局部地区疫苗接种覆盖率》, 2015年。MMWR莫布凡人Wkly代表2016;65:850–8.交叉引用 PubMed
35.美国卫生与公众服务部。IID-11.1提高13至15岁青少年破伤风-白喉-无细胞百日咳(Tdap)加强疫苗的接种覆盖率。DC华盛顿州:美国卫生与公众服务部;2018.https://www.healthypeople.gov/node/4654/data_details
36.Williams WW,Lu,O’Halloran A,等,《成年人口疫苗接种率监测》,美国,2015年。2017年MMWR调查峰会;66:1–28.交叉引用 PubMed
37.卡恩克,丁H,Fiebelkorn A,等。孕妇和Tdap疫苗接种,互联网小组调查,美国,2016年4月。佐治亚州亚特兰大市:美国卫生与公众服务部,CDC2016.https://www . CDC . gov/vaccines/imz-managers/coverage/adultvaxview/tdap-report-2016 . html
38.Sutter RW,Cochi SL。1985-1988年美国百日咳住院和死亡率。评估国家报告的完整性。JAMA 1992267:386–91.交叉引用 PubMed
39.Vitek CR,Pascual FB,Baughman AL,Murphy TV。20世纪90年代美国婴儿百日咳死亡率的增加。儿科传染病杂志2003;22:628–34.交叉引用 PubMed
40.美国婴儿百日咳感染的来源。儿科2015;136:635–41.交叉引用 PubMed
41.蒂瓦里茨,鲍曼铝,克拉克塔。首次百日咳疫苗剂量和预防婴儿死亡。儿科2015;135:990–9.交叉引用 PubMed
42.德·格里夫,莫伊·弗勒,韦斯特霍夫·A,等,《家庭百日咳疾病负担:如何保护婴幼儿》。Clin Infect Dis 201050:1339–45.交叉引用 PubMed
43.威利克,左Y,马卡特尼KK,麦金太尔铅。小婴儿百日咳感染的来源:一项对关键证据的回顾,为cocoon策略的目标提供信息。疫苗2013;31:618–25.交叉引用 PubMed
44.疾病控制中心。百日咳疫情—华盛顿,2012年。MMWR莫布凡人周刊2012年代表;61:517–22.PubMed
45.罗珀MH,瓦西拉克SG,蒂瓦里TS,奥伦斯坦WA。破伤风类毒素。载于:Plotkin SA,Orenstein WA,Offit PA,eds。疫苗。第五版。宾夕法尼亚州费城:桑德斯/爱思唯尔;2012:746–77.
46.世界卫生组织。破伤风疫苗:世卫组织立场文件——2017年2月。Wkly流行病研究中心2017;92:53–76.PubMed
47.亚当斯达,托马斯KR,亚约斯基RA,等;国家传染病报告小组。2014年美国应报告的传染病和状况汇总。MMWR莫布凡人Wkly代表2016;63:1–152.交叉引用 PubMed
48.疾病控制中心。破伤风监测——美国,2001-2008年。MMWR莫布凡人周刊2011年代表;60:365–9.PubMed
49.帕斯夸尔FB,麦金莱埃尔,扎纳迪LR,科尔特斯MM,墨菲电视。破伤风监测——美国,1998-2000年。2003年夏季MMWR调查;52:1–8.PubMed
50.借用R,巴尔默P,罗珀MH。免疫系列的免疫学基础——模块3:2006年破伤风更新。瑞士日内瓦:世界卫生组织;2007.
51.麦克奎蓝GM,Kruszon-Moran D,Deforest A,Chu SY,Wharton M .美国白喉和破伤风的血清学免疫。安实习医师医学2002;136:660–6.交叉引用 PubMed
55.疾病控制中心。关于免疫接种的一般性建议——免疫接种实践咨询委员会的建议(ACIP)。MMWR 2011年建议报告;60(编号RR-2):1–64。PubMed
56.两例由产毒性溃疡棒状杆菌引起的白喉样疾病的调查。Clin Infect Dis 200846:395–401.交叉引用 PubMed
57.疾病控制中心。白喉、破伤风和百日咳:疫苗使用和其他预防措施的建议:免疫实践咨询委员会的建议(ACIP)。MMWR 1991年报告;40(编号RR-10):1–28。PubMed
58.科利尔·RJ。白喉毒素:作用方式和结构。Bacteriol Rev 197539:54–85.PubMed
59.陈RT,布鲁姆CV,温斯坦RA,韦弗R,蔡TF。美国的白喉,1971-1981。1985年美国公共卫生杂志;75:1393–7.交叉引用 PubMed
60.疾病控制中心。美国1997年法定传染病摘要。1998年Morb莫尔布世界周代表;46(54)。PubMed
61.疾病控制中心。2001年美国法定传染病概要。2003年Morb莫尔布世界周代表;50(53)。PubMed
62.Groseclose SL,Brathwaite WS,Hall PA,等。应报告疾病摘要——美国,2002年。2004年Morb摩勃·摩尔·韦克利代表;51(53)。PubMed
63.Hopkins RS,Jajosky RA,Hall PA,等应报告疾病摘要——美国,2003年。MMWR莫布凡人周刊代表2005;52(54)。PubMed
64.McNabb SJ,Jajosky RA,Hall-Baker PA,等。2006年美国法定传染病概要。MMWR莫布凡人周刊代表2008;55(53)。PubMed
65.亚当斯达,加拉格尔公里,Jajosky RA,等。应报告的疾病摘要-美国,2011年。MMWR莫布凡人周刊2013年代表;60(53)。PubMed
66.疾病控制中心。应报告的疾病和死亡率表。MMWR莫布凡人Wkly代表2016;65:38.PubMed
67.疾病控制中心。2003年,一名去宾夕法尼亚州海地的美国旅行者患致命的呼吸性白喉。2004年Morb摩勃·摩尔·韦克利代表;52:1285–6.PubMed
68.长AP。破伤风类毒素,它在美国军队中的使用。Am J公共卫生国家卫生1943;33:53–7.交叉引用 PubMed
69.博伊德JS。1939-1945年非洲和欧洲战场上的破伤风。柳叶刀1946;1:113–9.交叉引用 PubMed
70.Volk VK,Gottshall RY,Anderson HD,Top FH,Bunney WE,Serfling RE。白喉和破伤风类毒素加强剂量的抗原反应。非机构儿童初次接种后7至13年。1962年公共卫生代表;77:185–94.交叉引用 PubMed
71.婴儿无细胞百日咳疫苗和标准百日咳疫苗与白喉和破伤风疫苗反应原性和抗原性的差异。j传染Dis 1988157:731–7.交叉引用 PubMed
72.一种新的高纯度百日咳疫苗在婴儿和儿童中的评价。J Infect Dis 1989160:832–7.交叉引用 PubMed
73.世界卫生组织。白喉疫苗:世卫组织立场文件。Wkly流行病学记录2006;3:24–32.
74.奥伦斯坦WA,韦斯菲尔德JS,哈尔西纳。白喉、破伤风类毒素和百日咳混合疫苗。在:哈尔西纳,德夸德罗斯,加州,编辑。免疫的最新进展:文献综述。DC华盛顿:泛美卫生组织;1983:30–51.
75.蒂瓦里TS,沃顿m白喉类毒素。载于:Plotkin SA,Orenstein WA,Offit PA,eds。疫苗。第五版。宾夕法尼亚州费城:桑德斯/爱思唯尔;2012:153–66.
76.巴金RM,萨缪尔森JS,哥特林LP,巴金SZ。白喉-破伤风类毒素疫苗和吸附白喉-破伤风类毒素-百日咳疫苗的初次免疫:时间表的比较。儿科传染病1985;4:168–71.交叉引用 PubMed
77.Barkin RM,Pichichero ME,Samuelson JS,Barkin SZ。儿童白喉和破伤风类毒素疫苗:作为第一系列接种时的临床和免疫反应。《儿科杂志》1985年;106:779–81.交叉引用 PubMed
78.费里BJ,贝纳森,小福塞斯,马,明蒂DW。用减少剂量的吸附白喉类毒素对青少年和成人进行白喉免疫。1981年澳大利亚医学杂志;1:128–30.PubMed
79.迈尔斯镁,贝克曼化学武器,沃斯丁岭,汉金斯华盛顿。破伤风和白喉类毒素的初级免疫。大龄儿童和成人的反应率和免疫原性。JAMA 1982248:2478–80.交叉引用 PubMed
80.枫树包装。欧洲地区白喉实验室诊断手册。哥本哈根:世界卫生组织欧洲区域免疫扩大方案;1994.国际比较方案/扩大免疫方案038(C0)
81.鲍尔股份公司奈迪奇MJ。白喉;对洛杉矶县医院10年间观察到的1,433例病例的研究。美国医学博士1954年;17:229–45.交叉引用 PubMed
82.布鲁克斯GF,贝内特JV,费尔德曼RA。美国的白喉,1959-1970。j传染Dis 1974129:172–8.交叉引用 PubMed
83.Dittmann S,Wharton M,Vitek C,等,《前苏维埃社会主义共和国联盟国家成功控制流行性白喉:经验教训》。j传染疾病2000年;181(补编1):S10–22。交叉引用 PubMed
84.Cherry JD,Gornbein J,Heininger U,Stehr K .对百日咳博德特氏菌咳嗽疾病免疫血清学相关性的研究。1998年疫苗;16:1901–6.交叉引用 PubMed
85.Storsaeter J,Hallander HO,Gustafsson L,Olin P .家庭暴露于百日咳疫苗后与保护相关的抗百日咳抗体水平百日咳博德特氏菌。1998年疫苗;16:1907–16.交叉引用 PubMed
86.Taranger J,Trollfors B,Lagergå rd T,等.疫苗接种后血清中百日咳毒素IgG抗体与后续百日咳保护之间的相关性j传染疾病2000年;181:1010–3.交叉引用 PubMed
87.Storsaeter J,Hallander HO,Gustafsson L,Olin P .低水平的抗百日咳抗体加上无百日咳病史与家庭暴露于以下物质后的易感性相关百日咳博德特氏菌。2003年疫苗;21:3542–9.交叉引用 PubMed
88.Hellwig SM,罗德里格斯ME,柏柏尔人GA,范·德·温克尔·JG,Mooi FR。pertactin抗体在乳腺癌中的重要作用百日咳博德特氏菌豁免权。j传染疾病2003年;188:738–42.交叉引用 PubMed
89.布莱克S,格林伯格DP。白喉、破伤风、五组分无细胞百日咳、脊髓灰质炎病毒和b型流感嗜血杆菌疫苗。专家Rev疫苗2005;4:793–805.交叉引用 PubMed
90.美国食品药品监督管理局。国际协调会议;临床试验统计原则指南;可用性—FDA。注意。美联储登记册1998年;63:49583–98.PubMed
91.疾病控制中心。美国食品药品监督管理局批准第五种无细胞百日咳疫苗用于婴幼儿——美国,2002年。2002年Morb莫尔博世界周代表;51:574.PubMed
92.疾病控制中心。婴儿用白喉、破伤风类毒素和吸附无细胞百日咳、乙型肝炎(重组)和脊髓灰质炎病毒联合疫苗(PEDIARIX)的FDA许可。2003年Morb莫尔布世界周代表;52:203–4.PubMed
93.疾病控制中心。FDA批准白喉、破伤风类毒素和无细胞百日咳吸附疫苗(INFANRIX)连续第五次接种DTaP疫苗。2003年Morb莫尔布世界周代表;52:921.
94.美国食品药品监督管理局。产品批准信息——许可行动,批准函:DAPTACEL。马里兰州洛克维尔:美国卫生与公众服务部,美国食品药品监督管理局,生物制品评估与研究中心;2008.http://way back . archive-it . org/7993/20170723024602/https:/www . FDA . gov/BiologicsBloodVaccines/Vaccines/approved products/UCM 103039 . htm
95.疾病控制中心。白喉和破伤风类毒素和无细胞百日咳吸附和灭活脊髓灰质炎病毒疫苗的许可和加强剂量使用指南。MMWR莫布凡人周刊代表2008;57:1078–9.PubMed
96.疾病控制中心。白喉、破伤风类毒素和无细胞百日咳吸附、灭活脊髓灰质炎病毒的许可,以及嗜血杆菌结合疫苗和婴儿和儿童使用指南。MMWR莫布凡人周刊代表2008;57:1079–80.PubMed
97.白喉、破伤风类毒素和无细胞百日咳吸附和灭活脊髓灰质炎病毒疫苗的许可和加强剂量使用指南。MMWR莫布凡人周刊2015年代表;64:948–9.交叉引用 PubMed
98.五价白喉、破伤风、百日咳、乙型肝炎和脊髓灰质炎联合疫苗在婴儿中的安全性和免疫原性。儿科传染病杂志2001;20:973–80.交叉引用 PubMed
99.格拉法、布拉特MM、格林伯格DP、皮希切罗M、诺列加FR;Pentacel研究小组。在美国婴幼儿中,五价疫苗的安全性和免疫原性与单独给予许可的等效疫苗进行比较,以及学龄前加强剂量前抗体的持久性:一项随机临床试验。儿科2009;123:301–12.交叉引用 PubMed
100.韦斯顿WM,克莱恩NP。Kinrix:一种用于4-6岁儿童的新型DTaP-IPV联合疫苗。专家Rev疫苗2008;7:1309–20.交叉引用 PubMed
101.13种无细胞百日咳疫苗的比较:概述和血清学反应。儿科学1995;96:548–57.PubMed
102.Pichichero ME,Deloria MA,Rennels MB,等。15-20个月大的儿童第四次接种12种无细胞百日咳疫苗和1种全细胞百日咳疫苗的安全性和免疫原性比较。儿科学1997;100:772–88.交叉引用 PubMed
103.美国食品药品监督管理局。对Infanrix(吸附的白喉和破伤风类毒素和无细胞百日咳疫苗)许可申请的补充进行临床审查,以包括第五剂适应症。马里兰州洛克维尔:美国卫生与公众服务部,美国食品药品监督管理局,生物制品评估与研究中心;2003.http://way back . archive-it . org/7993/20170723024620/https://www . FDA . gov/BiologicsBloodVaccines/Vaccines/approved products/UCM 103005 . htm
104.赛诺菲巴斯德。Daptacel(吸附白喉和破伤风类毒素和无细胞百日咳疫苗)[包装插页]。宾夕法尼亚州斯威夫特沃特:赛诺菲巴斯德;2017.https://www . FDA . gov/BiologicsBloodVaccines/Vaccines/approved products/UCM 101572 . htm
105.美国食品药品监督管理局。管制行动的基本摘要DAPTACEL。马里兰州洛克维尔:美国卫生与公众服务部,美国食品药品监督管理局,生物制品评估与研究中心;2011.http://way back . archive-it . org/7993/20170723024601/https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 263449 . pdfpdf图标
106.赛诺菲巴斯德。五联(白喉和破伤风类毒素和无细胞百日咳吸附,灭活脊髓灰质炎病毒和嗜血杆菌b结合物(破伤风类毒素结合物)疫苗。宾夕法尼亚州斯威夫特沃特:赛诺菲巴斯德;2017.https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 109810 . pdfpdf图标
107.Greco D,Salmaso S,Mastrantonio P,等;Progetto Pertosse工作组。针对百日咳的两种无细胞疫苗和一种全细胞疫苗的对照试验。英国医学杂志1996;334:341–8.交叉引用 PubMed
108.施密特·HJ,冯·柯尼希,奈斯·A等。家庭暴露后无细胞百日咳疫苗在幼儿期的功效。JAMA 1996275:37–41.交叉引用 PubMed
109.Gustafsson L,Hallander HO,Olin P,Reizenstein E,Storsaeter J .一项两组分无细胞百日咳疫苗、五组分无细胞百日咳疫苗和全细胞百日咳疫苗的对照试验。英国医学杂志1996;334:349–55.交叉引用 PubMed
110.儿童接种第五剂无细胞百日咳疫苗后保护作用减弱。英国医学杂志2012;367:1012–9.交叉引用 PubMed
111.5剂DTaP后对百日咳的免疫力减弱。儿科2013;131:e 1047–52。交叉引用 PubMed
112.Bisgard KM,Rhodes P,Connelly BL,等。1998-2001年美国6-59个月儿童百日咳疫苗的有效性。儿科2005;116:e285–94。交叉引用 PubMed
113.无细胞百日咳疫苗与全细胞百日咳疫苗的安全性。上市后评估。1996年儿科和青少年医学;150:457–60.交叉引用 PubMed
114.Braun MM,Mootrey GT,Salive ME,Chen RT,Ellenberg SSVAERS工作组。美国婴儿接种无细胞百日咳疫苗:对疫苗不良事件报告系统(VAERS)前两年数据的评估。儿科2000;106:E51。交叉引用 PubMed
115.Jackson LA,Carste BA,Malais D,Froeschle J .对无细胞百日咳疫苗与白喉和破伤风类毒素结合后接种医疗护理的注射部位反应、癫痫发作、过敏反应和发热事件进行回顾性人群评估。儿科传染病杂志2002;21:781–6.交叉引用 PubMed
116.摩尔DL,勒·索克斯N,舍费尔D,哈尔佩林SA;加拿大儿科学会/加拿大卫生部免疫监测方案成员。缺乏百日咳疫苗相关脑病的证据:1993-2002年加拿大IMPACT的主动监测。儿科传染病杂志2004;23:568–71.交叉引用 PubMed
117.Zangwill KM,Eriksen E,Lee M,等:一项基于人群的大型管理式医疗机构中白喉、破伤风、无细胞百日咳、乙型肝炎和灭活脊髓灰质炎混合疫苗的许可后安全性评估。儿科2008;122:e 1179–85。交叉引用 PubMed
118.黄WT,Gargiullo PM,Broder KR,等;疫苗安全数据链团队。无细胞百日咳疫苗与儿童早期癫痫发作之间缺乏关联。儿科2010;126:263–9.交叉引用 PubMed
119.Andrews N,Stowe J,Wise L,Miller E .白喉/破伤风/全细胞百日咳的许可后安全性比较/b型流感嗜血杆菌疫苗和5合1白喉/破伤风/无细胞百日咳/流感嗜血杆菌英国的b型/脊髓灰质炎疫苗。疫苗2010;28:7215–20.交叉引用 PubMed
120.杰克逊·拉、于·奥、尼尔森·JC等;疫苗安全数据链团队。注射部位和有医生参与的无细胞百日咳疫苗局部反应的风险。儿科2011;127:e581–7。交叉引用 PubMed
121.接种白喉、破伤风、无细胞百日咳、灭活脊髓灰质炎病毒疫苗后出现热性惊厥和癫痫的风险b型流感嗜血杆菌. JAMA 2012307:823–31.交叉引用 PubMed
122.1至6岁儿童的疫苗接种部位和局部反应风险。儿科2013;131:283–9.交叉引用 PubMed
123.Nelson JC,Yu O,Dominguez-Islas CP,等.将分组序贯方法应用于观察性上市后疫苗安全性监测:DTaP-IPV-Hib五价组合疫苗安全性研究的结果.美国流行病学杂志2013;177:131–41.交叉引用 PubMed
124.戴利梅芳,Yih WK,格兰兹JM,等。白喉,破伤风,无细胞百日咳和灭活脊髓灰质炎(DTaP-IPV)疫苗的安全性。疫苗2014;32:3019–24.交叉引用 PubMed
125.Kawai AT,Martin D,Kulldorff M,等。2010-2011年三价灭活流感疫苗后的热性惊厥。儿科2015;136:e848–55。交叉引用 PubMed
126.Duffy J,Weintraub E,Hambidge SJ,等。疫苗安全数据链。6-23个月儿童接种疫苗后的热性惊厥风险。儿科2016;138:e20160320。交叉引用 PubMed
127.岛屋TT,Nguyen M,Martin D,DeStefano F .疫苗不良事件报告系统中的安全性监测(VAERS)。疫苗2015;33:4398–405.交叉引用 PubMed
128.疫苗安全数据链:一个监测免疫安全性的模型。儿科2011;127(补编1):S45–53。交叉引用 PubMed
129.单价轮状病毒疫苗接种后肠套叠的风险。英国医学杂志2014;370:513–9.交叉引用 PubMed
130.美国婴儿接种轮状病毒疫苗后肠套叠的风险。英国医学杂志2014;370:503–12.交叉引用 PubMed
131.徐J,墨菲SL,Kochanek KD,Bastian BA。死亡人数:2013年的最终数据。2016年国家生命统计报告;64:1–119.PubMed
132.McCarthy NL,Weintraub E,Vellozzi C,等,《接种疫苗人群的死亡率和死因模式》。Am J Prev Med 201345:91–7.交叉引用 PubMed
133.McCarthy NL,Gee J,Sukumaran L,等。儿童、青少年和年轻成人的疫苗接种和30天死亡率风险。儿科2016;137:e20152970。交叉引用 PubMed
134.疾病控制中心。更新:疫苗副作用、不良反应、禁忌症和注意事项。免疫实践咨询委员会的建议(ACIP)。MMWR 1996年报告;45(编号RR-12):1–35。PubMed
135.除百日咳和风疹外,与儿童疫苗相关的不良事件。医学研究所报告摘要。JAMA 1994271:1602–5.交叉引用 PubMed
136.医学研究所。疫苗的副作用:证据和因果关系。华盛顿DC:美国国家学院出版社;2011.
.Kuno-Sakai H,Kimura M .日本无细胞百日咳疫苗的安全性和有效性,通过23年的常规免疫接种评估。儿科杂志2004年;46:650–5.交叉引用 PubMed
137.古德温H,纳什M,黄金M,希斯TC,伯吉斯MA。既往低渗低反应发作后的儿童疫苗接种。1999年儿童保健;35:549–52.交叉引用 PubMed
138.DuVernoy TS,博朗MM;VAERS工作组。1996-1998年向疫苗不良事件报告系统(VAERS)报告的低渗-低反应事件。儿科2000;106:E52。交叉引用 PubMed
139.勒·索克斯·N、巴罗曼·NJ、摩尔·DL、怀汀·S、沙伊菲勒·D、哈尔佩林·S .加拿大儿科学会/加拿大卫生部免疫监测方案—-正在实施(IMPACT)。自从加拿大改用无细胞百日咳疫苗后,因热性惊厥住院和向医院急诊科报告的低渗低反应性事件减少:来自IMPACT的报告。儿科2003;112:e348。交叉引用 PubMed
140.Fenichel GM。评估:免疫接种的神经病学风险:美国神经病学学会治疗和技术评估小组委员会的报告。神经病学1999;52:1546–52.交叉引用 PubMed
141.对牛奶过敏的儿童对白喉、破伤风和百日咳疫苗的过敏反应。变态反应临床免疫学杂志2011;128:215–8.交叉引用 PubMed
142.斯莱特JE,拉宾RL,马丁d。对牛奶过敏和白喉,破伤风,百日咳疫苗的评论。变态反应临床免疫学杂志2011;128:434,作者回复435。交叉引用 PubMed
143.赛诺菲巴斯德。Adacel (吸附破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗)[包装插页]。宾夕法尼亚州斯威夫特沃特:赛诺菲巴斯德;2017.https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 142764 . pdfpdf图标
144.葛兰素史克。Boostrix(破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗,吸附)[包装插页]。北卡罗来纳州研究三角园:葛兰素史克;2017.https://www . FDA . gov/downloads/biologicsbloodvacines/UCM 152842 . pdfpdf图标
145.美国食品药品监督管理局。赛诺菲巴斯德。Adacel 简报文件。马里兰州贝塞斯达:美国卫生与公众服务部,美国食品药品监督管理局,生物评估与研究中心;2005.https://www . FDA . gov/ohrms/dockets/AC/05/briefing/2005-4097 B1 _ 6 . pdfpdf图标
146.美国食品药品监督管理局。葛兰素史克生物制品公司。Boostrix简报文件。马里兰州贝塞斯达:美国卫生与公众服务部,美国食品药品监督管理局,生物评估与研究中心;2005.https://www.fda.gov.ohrms/ac/05/briefing/2005-4097B1_3.pdfpdf图标
147.美国食品药品监督管理局。疫苗及相关生物制品咨询委员会会议。马里兰州贝塞斯达:美国食品药品监督管理局;1997.
148.等级C,奎因何,麦金太尔PB。澳大利亚高中生集体免疫后百日咳疫苗的效果。儿科传染病杂志2009;28:152–3.交叉引用 PubMed
149.青少年和成人破伤风、低剂量白喉和无细胞百日咳疫苗的效力。Clin Infect Dis 201051:315–21.交叉引用 PubMed
150.与共循环相关的百日咳样疾病大爆发的流行病学和实验室特征霍尔梅氏博德特氏菌和百日咳博德特氏菌俄亥俄州,2010年至2011年。Clin Infect Dis 201356:322–31.交叉引用 PubMed
151.Klein NP,Bartlett J,Fireman B,Baxter R在青少年中的有效性减弱。儿科2016;137:e20153326。交叉引用 PubMed
152.Koepke R,Eickhoff JC,Ayele RA,等.评估破伤风-白喉-无细胞百日咳疫苗(Tdap)预防百日咳的有效性:Tdap布兰德提出的免疫力迅速减弱和有效性差异的证据.J Infect Dis 2014210:942–53.交叉引用 PubMed
153.谢里登SL,Ware RS,格林伍德K,兰伯特SB。北美爆发的青春期前儿童接种无细胞百日咳疫苗后免疫持久性意外受限。Clin Infect Dis 201255:1434–5,作者回复1435–6。交叉引用 PubMed
154.Liko J,Robison SG,Cieslak PR。用全细胞百日咳疫苗与无细胞百日咳疫苗引发。英国医学杂志2013;368:581–2.交叉引用 PubMed
155.卡斯塔尼尼拉,希利厘米,伦奇马,伍顿上海,穆尼奥斯调频,贝克希杰。母亲产后破伤风和白喉类毒素以及无细胞百日咳免疫对婴儿百日咳感染的影响。Clin Infect Dis 201254:78–84.交叉引用 PubMed
156.奎因何,斯内林TL,哈比格A,邱C,辐条PJ,麦金太尔PB。父母Tdap加强剂与婴儿百日咳:一项病例对照研究。儿科2014;134:713–20.交叉引用 PubMed
157.格贝尔.艾姆,张X,哈维尔等。百日咳博德特氏菌感染或疫苗接种基本上保护小鼠免受支气管败血杆菌感染。PLoS One 20094:e6778。交叉引用 PubMed
158.沃费尔JM,齐默尔曼李,默克尔TJ。在非人灵长类动物模型中,无细胞百日咳疫苗可以预防疾病,但不能预防感染和传播。美国国家科学院院刊2014;111:787–92.交叉引用 PubMed
159.Smallridge WE,Rolin OY,Jacobs NT,Harvill ET。全细胞疫苗和无细胞疫苗对博德特氏菌传播的不同影响。J Infect Dis 2014209:1981–8.交叉引用 PubMed
160.世界卫生组织。百日咳疫苗:世卫组织立场文件—2015年9月。Wkly流行病学会2015;90:433–58.PubMed
161.特雷纳EA,尼科尔森TL,默克尔TJ。百日咳博德特氏菌传输。Pathog Dis 201573:ftv068。交叉引用 PubMed
162.McNamara LA,Skoff T,Faulkner A,等.美国,2010-2012年,接种适龄百日咳疫苗的人群百日咳严重程度降低Clin Infect Dis 201765:811–8.交叉引用 PubMed
163.疾病控制中心。FDA批准扩大破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗的年龄适应症。MMWR莫布凡人周刊代表2009;58:374–5.PubMed
164.疾病控制中心。FDA批准扩大破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗的年龄适应症。MMWR莫布凡人周刊2011年代表;60:1279–80.PubMed
165.美国食品药品监督管理局。管制行动的基本概要——ada cel。马里兰州洛克维尔:美国卫生与公众服务部,美国食品药品监督管理局,生物制品评估与研究中心;2014.http://way back . archive-it . org/7993/20170723151952/https://www . FDA . gov/downloads/BiologicsBloodVaccines/Vaccines/approved products/UCM 392043 . pdfpdf图标
166.Yih WK,诺丁JD,Kulldorff M,等.对青少年和成人破伤风-白喉-无细胞百日咳(Tdap)疫苗安全性的评估,采用疫苗安全数据链中不良事件的主动监测。疫苗2009;27:4257–62.交叉引用 PubMed
167.诺丁法学博士,Yih WK,库尔多夫M,温特劳布E. Tdap和GBS信。疫苗2011;29:1122.交叉引用 PubMed
168.张,奥康纳总理,斯莱德巴,吴宇杰。美国青少年和成人破伤风、白喉和无细胞百日咳疫苗的上市后安全性监测:2005-2007年。疫苗2013;31:1447–52.交叉引用 PubMed
169.青少年接种含白喉类毒素疫苗后出现局部反应的风险:疫苗安全性数据链研究。疫苗2009;27:4912–6.交叉引用 PubMed
170.Klein NP,Hansen J,Lewis E,等。在美国健康维护组织中对青少年队列接种破伤风类毒素、减毒白喉类毒素和三组分无细胞百日咳疫苗的上市后安全性评价。儿科传染病杂志2010;29:613–7.交叉引用 PubMed
171.疫苗后的急性脱髓鞘事件:一项以病例为中心的分析。Clin Infect Dis 201663:1456–62.交叉引用 PubMed
172.Moro PL,Yue X,Lewis P,Haber P,Broder k . 2005-2010年向疫苗不良事件报告系统(VAERS)报告的65岁及以上成人接种破伤风类毒素、减毒白喉类毒素和无细胞百日咳(Tdap)疫苗后的不良事件。疫苗2011;29:9404–8.交叉引用 PubMed
173.曾海峰,席立山,钱磊,等;疫苗安全数据链(VSD)团队。老年人群无标签使用破伤风-白喉-无细胞百日咳疫苗的安全性。Clin Infect Dis 201356:315–21.交叉引用
174.预先接种破伤风-白喉疫苗后多久可以接种成人破伤风-白喉-无细胞百日咳疫苗?儿科传染病杂志2006;25:195–200.交叉引用 PubMed
175.健康年轻成人在Td-IPV加强剂量后一个月接种Tdap-IPV的安全性:一项安慰剂对照试验。Hum疫苗2009;5:315–21.交叉引用 PubMed
176.Talbot EA,Brown KH,Kirkland KB,Baughman AL,Halperin SA,Broder KR。接种破伤风-白喉-无细胞百日咳疫苗(Tdap)后不到2年进行免疫接种的安全性:呼吸系统疾病爆发期间卫生保健人员大规模疫苗接种活动的经验。疫苗2010;28:8001–7.交叉引用 PubMed
177.沙伊弗勒DW,哈尔佩林SA,奥奇尼奥JJ,福格森AC,斯科沃龙斯基DM。一种改良疫苗降低了学龄前加强剂量白喉-破伤风-无细胞百日咳疫苗大注射部位反应的发生率:一项随机对照试验的结果。儿科传染病杂志2005;24:1059–66.交叉引用 PubMed
178.兰利·JM、普雷迪·G、瓜斯帕里尼·R等。一种吸附了破伤风和白喉类毒素的青少年-成人制剂与无细胞百日咳疫苗组合物相比,在4-6岁儿童中具有相当的免疫原性,但反应原性低于吸附了灭活脊髓灰质炎疫苗的儿童制剂。疫苗2007;25:1121–5.交叉引用 PubMed
179.Sä nger R,Behre U,Krause KH,等:对4-8岁儿童使用抗原含量降低的dTpa-IPV疫苗进行加强免疫接种和1年随访。2007年欧洲儿科杂志;166:1229–36.交叉引用 PubMed
180.Meyer CU,Habermehl P,Knuf M,Hoet B,Wolter J,Zepp F .无细胞百日咳加强疫苗在儿童中的免疫原性和反应原性:标准儿科与抗原含量减少的配方。Hum疫苗2008;4:203–9.交叉引用 PubMed
181.免疫实践咨询委员会(ACIP)。总结报告:2010年10月27日至28日(会议纪要)。佐治亚州亚特兰大市:美国卫生与公众服务部,CDC2010.https://www . CDC . gov/vaccines/acip/meetings/downloads/min-archive/min-oct 10 . pdfpdf图标
182.Pichichero ME,Rennels MB,Edwards KM,等。用于青少年和成人的破伤风、白喉和五组分百日咳混合疫苗。JAMA 2005293:3003–11.交叉引用 PubMed
183.Gall SA,Myers J,Pichichero M .破伤风-白喉-百日咳疫苗的母体免疫:对母体和新生儿血清抗体水平的影响。美国妇产科杂志2011;204:334 . E1–5。交叉引用 PubMed
184.孕妇接种破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗后的不良事件报告。美国妇产科杂志2012;207:59.1–7。交叉引用 PubMed
185.沙基布JH,Korgenski K,盛X,瓦尔纳MW,帕维亚在,宾顿CL。妊娠期破伤风、白喉、无细胞百日咳疫苗:妊娠和婴儿健康结果。2013年儿科杂志;163:1422–6.交叉引用 PubMed
186.Halperin SA,McNeil S,Langley J,等.前一剂破伤风类毒素、减毒白喉类毒素和吸附无细胞百日咳疫苗(Tdap)4-5年后再次接种的青少年和成人的耐受性和抗体反应疫苗2011;29:8459–65.交叉引用 PubMed
187.努夫M、维特尔V、塞尔索F、拉马克里什南G、范德梅伦O、雅克特·JM。重复施用抗原含量减少的白喉-破伤风-无细胞百日咳和脊髓灰质炎疫苗(dTpa-IPV;布斯特里克斯·IPV)。Hum疫苗2010;6:554–61.交叉引用 PubMed
188.波尔,范德米伦,Ng SP,塞尔索F,拉马克里什南G,雅克·JM。抗原含量减少的白喉、破伤风、无细胞百日咳疫苗(Boostrix)的十年加强剂量在成人中具有免疫原性且耐受性良好。疫苗2010;29:45–50.交叉引用 PubMed
189.成人接种破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗10年后的免疫应答。疫苗2012;30:974–82.交叉引用 PubMed
190.Mertsola J,Van Der Meeren O,He Q,等.年轻人十年一次接种抗原含量降低的白喉和破伤风类毒素和无细胞百日咳疫苗。Clin Infect Dis 201051:656–62.交叉引用 PubMed
191.埃德萨尔G,埃利奥特MW,皮布尔斯TC,埃德雷德MC。过量使用破伤风类毒素加强剂。JAMA 1967202:111–3.交叉引用 PubMed
192.Levine L,Ipsen J Jr,McComb JA。成人免疫。成人用破伤风和白喉混合液体类毒素的制备和评价。Am J Hyg 196173:20–35.PubMed
193.Wang M,Khromava A,Mahmood A,Dickson N .接种破伤风-白喉-无细胞百日咳(Tdap)疫苗的孕妇:Adacel疫苗妊娠登记数据的6年研究第27届国际药物流行病学和治疗风险管理会议录(ICPE);2011年8月14日至17日;伊利诺伊州芝加哥;2011年:S60–1。
194.穆尼奥斯FM,邦德NH,马卡图M,等。母亲和婴儿孕期破伤风白喉和无细胞百日咳(Tdap)免疫的安全性和免疫原性:一项随机临床试验。JAMA 2014311:1760–9.交叉引用 PubMed
195.对产妇百日咳疫苗接种与产科事件和分娩结局之间关系的评估。JAMA 2014312:1897–904.交叉引用 PubMed
196.英国孕妇接种百日咳疫苗的安全性:观察性研究。BMJ青奥会;349:g4219。交叉引用 PubMed
197.Sukumaran L,McCarthy NL,Kharbanda EO,等:既往接种过含破伤风疫苗的孕妇中,Tdap疫苗接种与急性事件和不良分娩结局的相关性。JAMA 2015314:1581–7.交叉引用 PubMed
198.Sukumaran L,McCarthy NL,Kharbanda EO,等。破伤风类毒素、减毒白喉类毒素、无细胞百日咳和流感疫苗在妊娠期的安全性。产科妇科2015;126:1069–74.交叉引用 PubMed
199.摩根JL,巴加里老,麦金太尔DD,谢菲尔德JS。产前接种破伤风、白喉和无细胞百日咳疫苗后的妊娠结局。产科妇科2015;125:1433–8.交叉引用 PubMed
200.达特瓦尼H,莫罗PL,哈灵顿T,布罗德KR。疫苗不良事件报告系统中接种疫苗后的绒毛膜羊膜炎。疫苗2015;33:3110–3.交叉引用 PubMed
201.Moro PL,Cragan J,Tepper N,等,《疫苗不良事件报告系统(VAERS)》2011–2015年对妊娠期破伤风类毒素、减毒白喉类毒素和无细胞百日咳(Tdap)疫苗的加强监测。疫苗2016;34:2349–53.交叉引用 PubMed
202.越南妊娠期百日咳疫苗接种:妊娠期百日咳疫苗接种的随机对照试验结果。疫苗2016;34:151–9.交叉引用 PubMed
203.发展中国家母亲免疫计划对百日咳的影响。疫苗2016;34:6223–8.交叉引用 PubMed
204.里根AK,特雷西乐,布莱斯CC,里士满电脑,埃夫勒光伏。一项评估孕期接种百日咳和流感疫苗的反应原性的前瞻性队列研究。疫苗2016;34:2299–304.交叉引用 PubMed
205.贝伦森AB,希斯JM,拉赫曼M,拉兹th,鲁普RE,萨尔蓬科。孕期接种百日咳疫苗妇女的母婴结局。Hum Vaccin Immunother 201612:1965–71.交叉引用 PubMed
206.Petousis-Harris H,Walls T,Watson D,Paynter J,Graham P,Turner N疫苗在孕妇中的安全性:一项观察性研究。2016年BMJ公开赛;6:e010911。交叉引用 PubMed
207.德西瓦米,瓦兹奎-贝尼格森,诺丁法学博士,等。Tdap怀孕期间接种疫苗和小头畸形和其他结构性出生缺陷的后代。JAMA 2016316:1823–5.交叉引用 PubMed
208.Kharbanda EO,瓦兹奎-Benitez G,Lipkind HS,等,《孕产妇Tdap疫苗接种:疫苗安全数据链中的覆盖率和急性安全性结果,2007-2013》。疫苗2016;34:968–73.交叉引用 PubMed
209.比利时孕期百日咳疫苗接种:一项前瞻性对照队列研究的结果疫苗2016;34:142–50.交叉引用 PubMed
210.Walls T,Graham P,peto USS-Harris H,Hill L,Austin N .妊娠期间接种Tdap疫苗后的婴儿结局:一项观察性研究。2016年BMJ公开赛;6:e009536。交叉引用 PubMed
211.比利亚雷亚尔·佩雷斯·JZ、拉米雷斯·阿兰达·JM。Tdap疫苗对墨西哥孕妇安全性和免疫原性的随机临床试验。Hum Vaccin Immunother 201713:128–35.交叉引用 PubMed
212.Relyveld EH,Bizzini B,Gupta RK。减少人类对破伤风和白喉类毒素疫苗不良反应的合理方法。1998年疫苗;16:1016–23.交叉引用 PubMed
213.弗罗利希H,维尔马r。阿瑟对重组乙型肝炎病毒疫苗的反应。Clin Infect Dis 200133:906–8.交叉引用 PubMed
214.太爱了。免疫复合物过敏性疾病。载于:Parslow TG,Stites DP,Terr AI,Imboden JB,eds。医学免疫学。纽约州纽约市:兰格医学图书/麦格劳-希尔;2001:380–5.
215.莫耶莱特,汉森集成电路。与疫苗接种相关的风险和不良事件的机制作用。变态反应临床免疫学杂志2004;114:1010–20,测验1021。交叉引用 PubMed
216.尼克尔斯·AF,尼克尔斯-塔苏吉·N,皮耶尔德·热。抗感染疫苗接种后的皮肤不良反应。美国临床皮肤病学杂志2005;6:79–87.交叉引用 PubMed
217.疫苗过敏和假性过敏。2003年欧洲皮肤病学杂志;13:10–5.PubMed
218.夸斯特大学,亨内森西,威德马克室。破伤风疫苗接种后的单神经炎和多神经炎(1970-1977)。开发生物站1979;43:25–32.PubMed
219.Tuttle J,Chen RT,Rantala H,Cherry JD,Rhodes PH,Hadler S .美国成人和儿童接种含破伤风类毒素疫苗后发生格林-巴利综合征的风险Am J公共卫生1997;87:2045–8.交叉引用 PubMed
220.新几内亚新生儿破伤风:施菲尔德FD,塔克VM,威斯布鲁克GR。孕期主动免疫的效果。BMJ 1961;2:785–9.交叉引用 PubMed
221.麦克伦南R,施菲尔德FD,皮特曼M,哈德度MC,巴里勒MF。新几内亚新生儿破伤风免疫接种。孕妇对佐剂和普通类毒素的抗毒素反应。公牛世界卫生组织1965年;32:683–97.PubMed
222.纽维尔KW,杜亚斯莱曼A,勒布朗博士,加尔塞斯奥索里奥n .使用类毒素预防新生儿破伤风。双盲对照现场试验的最终报告。公牛世界卫生组织1966年;35:863–71.PubMed
223.《新几内亚新生儿破伤风免疫接种》。公牛世界卫生组织1970年;43:439–51.PubMed
224.Rahman M,Chen LC,Chakraborty J,等。破伤风类毒素用于预防新生儿破伤风。1.通过对孟加拉国农村地区的非孕妇和孕妇进行免疫接种来降低新生儿死亡率。公牛世界卫生组织1982;60:261–7.PubMed
225.帕蒂森E,哈里森BJ,格里菲斯行政长官,西尔曼AJ,布鲁斯在。银屑病关节炎发展的环境危险因素:一项病例对照研究的结果安Rheum Dis 200867:672–6.交叉引用 PubMed
226.Bengtsson C、Kapetanovic MC、llberg H等;EIRA学习小组。成人普通疫苗接种不会增加患类风湿性关节炎的风险:来自瑞典EIRA研究的结果。安Rheum Dis 201069:1831–3.交叉引用 PubMed
227.Ray P,Black S,Shinefield H,等;疫苗安全数据链团队。15-59岁人群接种破伤风、流感和乙型肝炎疫苗后患类风湿性关节炎的风险。疫苗2011;29:6592–7.交叉引用 PubMed
228.Jackson LA,Yu O,Belongia EA,等。青少年接种破伤风和白喉类毒素疫苗后出现医疗不良事件的频率:一项疫苗安全性数据链研究。BMC Infect Dis 20099:165.交叉引用 PubMed
229.Bartels I,Jüngert J,Lugauer S,Stehr K,Heininger U .成人单剂量白喉-破伤风-无细胞百日咳组分疫苗(DTaP)与白喉-破伤风类毒素(Td)和白喉类毒素疫苗(d)的免疫原性和反应原性比较。2001年疫苗;19:3137–45.交叉引用 PubMed
230.鲍威尔CE。破伤风类毒素加强剂与破伤风-白喉类毒素加强剂发病率的比较。安急救医学1985;14:33–5.交叉引用 PubMed
231.执事SP,兰福德DT,牧羊人WM,骑士PA。吸附破伤风疫苗与成人型破伤风-白喉疫苗的临床对比研究。j . Hyg(Lond)1982年;89:513–9.交叉引用 PubMed
232.Schmitt-Grohé S,Stehr K,Cherry JD等;百日咳疫苗研究小组。在德国对接种Lederle/Takeda无细胞百日咳成分DTP (DTaP)疫苗、Lederle全细胞成分DTP (DTP)疫苗或DT疫苗的婴儿进行的一项疗效比较试验中出现的轻微不良事件。开发生物站1997;89:113–8.PubMed
233.Liebling J,Schmitz HE。孕妇主动接种疫苗后,婴儿在出生后第一年内预防白喉。1943年《儿科杂志》;23:430–6.。交叉引用
234.对白喉的天然抗毒免疫力下降。1948年《儿童学报》;35:117–29.交叉引用 PubMed
.瓦尔奎斯特B,默里U,佩尔松NG。新生儿和婴儿白喉免疫接种。1948年《儿童学报》;35:130–48.交叉引用 PubMed
235.Cohen P,Schneck H,Dubow E .产前多重免疫。1951年《儿科杂志》;38:696–704.交叉引用 PubMed
236.McNeil SA,Noya F,Dionne M,等.成人破伤风和白喉类毒素吸附制剂与无细胞百日咳(Tdap)疫苗和三价灭活流感疫苗同时接种和序贯接种的安全性和免疫原性比较疫苗2007;25:3464–74.交叉引用 PubMed
237.成人破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗与流感疫苗合用时的安全性和免疫原性。Hum疫苗2009;5:858–66.交叉引用 PubMed
238.Gasparini R,Conversano M,Bona G,等:一项关于MenACWY-CRM安全性、耐受性和免疫原性的随机试验,MenACWY-CRM是一种研究中的四价脑膜炎球菌糖缀合疫苗,在青少年和年轻成人中与破伤风、减毒白喉和无细胞百日咳联合疫苗同时施用。Clin疫苗免疫2010;17:537–44.交叉引用 PubMed
239.雷辛格KS,Block SL,Collins-Ogle M等;025号协议调查员。gardasil与Menactra和Adacel同时接种的安全性、耐受性和免疫原性。儿科2010;125:1142–51.交叉引用 PubMed
240.研究中的四价脑膜炎球菌糖缀合物疫苗MenACWY-CRM与Tdap疫苗和人乳头瘤病毒疫苗同时或相继用于青少年时的安全性和免疫原性。疫苗2010;28:3171–9.交叉引用 PubMed
241.Weston WM,Friedland LR,Wu X,Howe B .破伤风-白喉-无细胞百日咳(Tdap)和四价脑膜炎球菌结合物(MCV4)疫苗联合接种与单独接种的免疫原性和反应原性比较。疫苗2011;29:1017–22.交叉引用 PubMed
242.Wheeler CM,Harvey BM,Pichichero ME,等.人乳头瘤病毒-16/18 AS04-佐剂疫苗与破伤风类毒素、减毒白喉类毒素、无细胞百日咳疫苗和/或脑膜炎球菌结合疫苗对11至18岁健康女孩的免疫原性和安全性:一项随机开放试验的结果。儿科传染病杂志2011;30:e225–34。交叉引用 PubMed
243.Weston WM,Friedland LR,Wu X,Howe B岁及以上成人接种破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗(Boostrix):两项随机试验的结果疫苗2012;30:1721–8.交叉引用 PubMed
244.McGarry LJ,Krishnarajah G,Hill G,等。Tdap预防老年人百日咳的成本-效果分析。PLoS One 20138:e67260。交叉引用 PubMed
245.Terranella A,Asay GR,Messonnier ML,Clark TA,梁。妊娠剂量Tdap和产后茧化预防婴儿百日咳:决策分析。儿科2013;131:e 1748–56。交叉引用 PubMed
246.克拉克塔。变化中的百日咳流行病学:一切旧的又是新的。J Infect Dis 2014209:978–81.交叉引用 PubMed
247.范里一家,温德尔博一家,英格兰一家。母亲百日咳抗体在婴儿中的作用。儿科传染病杂志2005;24(补编):第62-5页。交叉引用 PubMed
248.希利CM,伦奇马,贝克CJ。母亲破伤风、白喉和无细胞百日咳(Tdap)联合免疫接种时机的重要性和对婴儿的保护。Clin Infect Dis 201356:539–44.交叉引用 PubMed
249.Leuridan E,Hens N,Peeters N,de Witte L,Van der Meeren O,Van Damme P .孕前百日咳加强剂量对幼儿母体抗体滴度的影响。儿科传染病杂志2011;30:608–10.交叉引用 PubMed
250.母亲在妊娠期间接种Tdap疫苗的婴儿的免疫反应。儿科传染病杂志2013;32:1257–60.交叉引用 PubMed
251.Amirthalingam G,Andrews N,Campbell H,等:《英格兰母亲百日咳疫苗接种的有效性:一项观察性研究》。柳叶刀2014;384:1521–8.交叉引用 PubMed
252.Dabrera G,Amirthalingam G,Andrews N,等。2012-2013年英格兰和威尔士评估产妇百日咳疫苗接种保护新生儿有效性的病例对照研究。Clin Infect Dis 201560:333–7.交叉引用 PubMed
253.Amirthalingam G,Campbell H,Ribeiro S,等:《英国引入母亲百日咳免疫计划3年后的持续有效性》。Clin Infect Dis 201663(补编第4号):S236–43。交叉引用 PubMed
254.产前和产后接种破伤风、白喉和无细胞百日咳疫苗预防婴儿百日咳的效果。Clin Infect Dis 201764:3–8.交叉引用 PubMed
255.出生前接种破伤风、白喉和无细胞百日咳疫苗对婴儿百日咳严重程度的影响。Clin Infect Dis 201764:9–14.交叉引用 PubMed
256.英格兰JA。母亲免疫对婴儿免疫反应的影响。2007年比较病理学杂志;137(补编1):S16–9。交叉引用 PubMed
257.育龄妇女和产后妇女对破伤风-白喉-无细胞百日咳疫苗的抗体反应动力学。临床感染Dis 201153:885–92.交叉引用 PubMed
258.柯克兰KB,塔尔博特EA,德克尔MD,爱德华兹公里。卫生保健人员对破伤风-白喉-无细胞百日咳疫苗的百日咳免疫反应动力学:对暴发控制的意义。Clin Infect Dis 200949:584–7.交叉引用 PubMed
259.Eberhardt CS,Blanchard-Rohner G,lematre B,等。妊娠早期的母体免疫可最大限度地提高抗体转移和预期的婴儿百日咳血清阳性率。Clin Infect Dis 201662:829–36 .交叉引用 PubMed
260.Abu Raya B,Srugo I,凯塞尔A等.孕期母亲接种破伤风、白喉和无细胞百日咳(Tdap)疫苗的时间对新生儿百日咳抗体水平的影响——一项前瞻性研究疫苗2014;32:5787–93.交叉引用 PubMed
261.奈杜马,马尔贾迪R,戴维斯塔克ML,华莱士EM,贾尔斯ML。妊娠期百日咳疫苗接种的最佳孕期:一项前瞻性队列研究。我是妇产科医生。2016;215:237 E1–6。交叉引用
262.免疫实践咨询委员会。总结报告:2016年10月19-20日(会议纪要)。佐治亚州亚特兰大市:美国卫生与公众服务部,CDC2016.https://www . CDC . gov/vaccines/acip/meetings/downloads/min-archive/min-2016-10 . pdfpdf图标
263.Weston W,Messier M,Friedland LR,Wu X,Howe B .成人无细胞百日咳、白喉和破伤风类毒素联合疫苗加强接种后3年的抗体持久性。疫苗2011;29:8483–6.交叉引用 PubMed
264.青少年和成人破伤风、白喉和5组分无细胞百日咳混合疫苗加强免疫10年后的体液免疫。疫苗2012;30:2647–53.交叉引用 PubMed
265.妊娠期间接种含百日咳疫苗的妇女所生婴儿初次免疫后的抗体反应:一项采用历史对照的单组观察性研究。Clin Infect Dis 201561:1637–44.交叉引用 PubMed
266.范萨维奇J,德克尔医学博士,爱德华兹公里,销售上海,卡尔松DT。婴儿百日咳抗体的自然史及其对疫苗应答的影响。j传染疾病,1990年;161:487–92.交叉引用 PubMed
267.叶的,明克C,金米,奈洛尔的,臧尔公里,所有雷德新泽西州。基于医院的产后程序对产后妇女百日咳疫苗接种的有效性。我是妇产科医生。2014;210:237 e1-6。
268.Rosenblum E,McBane S,Wang W,Sawyer M.《在一个以医院为基础的疫苗诊所中通过对家庭成员进行免疫来保护新生儿:2010年加州百日咳流行期间的一个成功的Tdap结茧计划》。2014年公共卫生代表;129:245–51.交叉引用 PubMed
269.希利厘米,伦奇马,卡斯塔尼尼拉,贝克希杰。高危产后人群的百日咳免疫接种。疫苗2009;27:5599–602.交叉引用 PubMed
270.希利CM,伦奇马,贝克CJ。在高危人群中实施百日咳疫苗接种。临床感染Dis 201152:157–62.交叉引用 PubMed
271.Blain AE,Lewis M,Banerjee,等。对预防婴儿百日咳的结茧策略的评估——美国,2011年。Clin Infect Dis 201663(补编第4号):S221–6。交叉引用 PubMed
272.Wendelboe AM,Njamkepo E,Bourillon A,等;婴儿百日咳研究小组。的传输百日咳博德特氏菌给年幼的婴儿。儿科传染病杂志2007;26:293–9.交叉引用 PubMed
273.Bisgard KM,Pascual FB,Ehresmann KR,等。婴儿百日咳:谁是源头?儿科传染病杂志2004;23:985–9.交叉引用 PubMed
274.医院内百日咳:可能由医院来访者传播。Am J Dis Child 1980134:520–1.PubMed
275.Steketee RW,Wassilak SG,Adkins WN Jr等:在一个发育障碍者机构中百日咳暴发中红霉素预防的高发病率和有效性的证据j传染Dis 1988157:434–40.交叉引用 PubMed
276.费希尔MC,龙SS,麦高恩KL,卡塞尔斯E,史密斯DG。在一个残疾人居住设施中爆发百日咳。《儿科杂志》1989年;114:934–9.交叉引用 PubMed
277.Addiss DG,Davis JP,Meade BD,等。威斯康星一家疗养院的百日咳爆发。j传染疾病调查1991年;164:704–10.交叉引用 PubMed
278.克里斯蒂光盘,格洛弗上午,威尔基兆焦耳,马克思毫升,Reising SF,哈钦森纳米。1993年辛辛那提大流行期间地区儿科医院对百日咳的控制。传染病控制医院流行病1995年;16:556–63.交叉引用 PubMed
279.无细胞百日咳疫苗在成人医院工作人员中的使用和安全性。j传染疾病调查1995年;171:1053–6.交叉引用 PubMed
280.疾病控制中心。2003年肯塔基州、宾夕法尼亚州和俄勒冈州与医院相关的百日咳爆发。MMWR莫布凡人周刊代表2005;54:67–71.PubMed
281.布雷BR,穆雷CJ,普塔克J,柯克兰KB,蒙特罗J,塔尔博特EA。血液肿瘤监护病房百日咳的爆发:对成人疫苗接种政策的影响。传染病控制医院,2006年;27:92–5.交叉引用 PubMed
282.帕斯夸尔FB,麦考尔CL,麦克默雷A,佩顿T,史密斯F,比斯加德公里。医院外科医护人员爆发百日咳。传染病控制医院,2006年;27:546–52.交叉引用 PubMed
283.Vranken P,Pogue M,Romalewski C,Ratard R年路易斯安那州新生儿重症监护室爆发百日咳。Am J感染控制2006;34:550–4.交叉引用 PubMed
284.Bryant KA,Humbaugh K,Brothers K,等:《暴露于医护人员后控制新生儿中间护理室百日咳爆发的措施》。传染病控制医院,2006年;27:541–5.交叉引用 PubMed
285.Zivna I,Bergin D,Casavant J,等百日咳博德特氏菌马萨诸塞州三级医疗系统的暴露。传染病控制医院,2007年;28:708–12.交叉引用 PubMed
286.两次院内百日咳暴发及其相关费用——华盛顿金县,2004。传染病控制医院,2007年;28:537–43.交叉引用 PubMed
287.疾病控制中心。2004年德克萨斯州新生儿医院获得性百日咳。MMWR莫布凡人周刊代表2008;57:600–3.PubMed
288.一家三级医疗中心百日咳暴发的流行病学和控制以及与这些暴发相关的资源消耗。传染病控制医院,2009年;30:467–73.交叉引用 PubMed
289.Yasmin S,Sunenshine R,Bisgard KM等,《亚利桑那州医疗保健相关的百日咳爆发:挑战和经济影响》, 2011年。j . 2014年儿科感染疾病分类;3:81–4.交叉引用 PubMed
290.De Serres G,Shadmani R,Duval B,等。青少年和成人百日咳发病率。j传染疾病2000年;182:174–9.交叉引用 PubMed
291.赖特西南,德克尔MD,爱德华兹公里。医护人员百日咳感染的发病率。传染病控制医院,1999年;20:120–3.交叉引用 PubMed
292.樱桃JD。百日咳控制的现状和未来。Clin Infect Dis 201051:663–7 .交叉引用 PubMed
293.教学医院百日咳免疫计划的实施:联邦政府强制卫生保健工作者接种百日咳疫苗的争论。Am J感染控制2008;36:392–8.交叉引用 PubMed
294.韦伯DJ,康索利有限公司,西克伯特-贝内特E,鲁塔拉瓦。随着时间的推移,对强制性破伤风、白喉和百日咳疫苗接种需求的评估。传染病控制医院,2012年;33:81–3.交叉引用 PubMed
295.Calugar A,Ortega-Sánchez IR,Tiwari T,Oakes L,Jahre JA,Murphy TV。医院内百日咳:爆发的代价和卫生保健工作者接种疫苗的益处。Clin Infect Dis 200642:981–8.交叉引用 PubMed
296.格里尔阿尔,菲斯曼DN。使用模型确定成本效益干预:儿科卫生保健工作者的百日咳疫苗接种。儿科2011;128:e591–9。PubMed
297.Goins WP,Edwards KM,Vnencak-Jones CL,等。接种疫苗的医护人员接触百日咳后预防感染的两种策略的比较。Clin Infect Dis 201254:938–45.交叉引用 PubMed
298.Barreto L,Guasparini R,Meekison W,Noya F,Young L,Mills E .青少年和成人破伤风、白喉和5组分无细胞百日咳混合疫苗加强免疫后5年的体液免疫。疫苗2007;25:8172–9.交叉引用 PubMed
299.Edelman KJ,He Q,Mä kinen JP,等.无细胞百日咳疫苗加强免疫3年后青少年的百日咳特异性细胞介导免疫和体液免疫。Clin Infect Dis 200439:179–85.交叉引用 PubMed
300.麦金太尔铅,特恩布尔调频,伊根上午,伯吉斯马,沃尔特JM,舒尔曼LM。接种抗原含量减少的白喉-破伤风-无细胞百日咳疫苗三年后成人的高水平抗体。2004年疫苗;23:380–5.交叉引用 PubMed
301.Edelman K,He Q,Mä kinen J,等。青春期加强免疫后5年对百日咳的免疫力。Clin Infect Dis 200744:1271–7.交叉引用 PubMed
302.McIntyre PB,Burgess MA,Egan A,Schuerman L,Hoet B.《抗原含量减少的白喉、破伤风和百日咳疫苗的成人加强接种:接种后5年的免疫原性》。疫苗2009;27:1062–6.交叉引用 PubMed
303.卡米亚H,赵BH,梅索尼埃ML,克拉克塔,梁。美国接种第二剂破伤风类毒素、减毒白喉类毒素和无细胞百日咳(Tdap)疫苗预防百日咳的影响和成本效益。疫苗2016;34:1832–8.交叉引用 PubMed
304.免疫实践咨询委员会。总结报告:2013年6月19日至20日(会议纪要)。佐治亚州亚特兰大市:美国卫生与公众服务部,CDC2013.https://www . CDC . gov/vaccines/acip/meetings/downloads/min-archive/min-jun 13 . pdfpdf图标
305.谢弗A,阿特金森W,弗里德曼C,等。保健人员的免疫接种:免疫接种实践咨询委员会的建议(ACIP)。MMWR 2011年建议报告;60(RR-7):1–45。PubMed
306.van der Zee A,Agterberg C,Peeters M,Mooi F,Schellekens J. A百日咳博德特氏菌和副百日咳博德特氏菌聚合酶链反应:使用高度免疫人群中疑似百日咳患者的样本与培养和血清学进行比较。j传染疾病调查1996年;174:89–96.交叉引用 PubMed
307.文德尔博上午,范里阿,萨尔马索S,英语JA。自然感染或接种疫苗后对百日咳免疫的持续时间。儿科传染病杂志2005;24(补编):S58至61。交叉引用 PubMed
308.美国儿科学会。白喉。在:金伯利D,布雷迪山,杰克逊马,长党卫军,编辑。红皮书:传染病委员会2015年报告,第30版。伊利诺伊州埃尔克格罗夫村:美国儿科学会;2015325–9.
309.美国儿科学会。破伤风。在:金伯利D,布雷迪山,杰克逊马,长党卫军,编辑。红皮书:传染病委员会2015年报告,第30版。伊利诺伊州埃尔克格罗夫村:美国儿科学会;2015:773–8.
表1.推荐的百日咳、白喉和破伤风疫苗接种计划—免疫实践咨询委员会,2017年
| 疫苗 | 年龄组/适应症 | 推荐时间表 |
| DTaP* | 2个月至6年 | 初级(3剂) 2、4和6个月大时注射1剂 第一次加强剂 15-18月龄时注射1剂 第二次加强剂 4-6岁时接种1剂 |
| Tdap† | 7-10岁§ | 不常规推荐;参考“疫苗史不完整或未知的人” |
| 11-18岁 | 11-12岁,1剂 13-18岁,如果之前未接种Tdap疫苗,则注射1剂 | |
| ≥19岁 | 如果之前未接种Tdap疫苗,则注射1剂 | |
| 孕妇¶ | 每次怀孕1剂;首选怀孕27-36周 | |
| Td† | 助推器 每10年1剂 | |
缩写:DTaP =白喉和破伤风类毒素以及无细胞百日咳疫苗;Td =破伤风和白喉类毒素疫苗;Tdap =破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗。
*有关许可使用的疫苗类型和年龄,请参见表4。
†许可使用的疫苗类型和年龄见表5。
§7-9岁儿童Tdap的适应症外使用。
¶Tdap的标签外使用。
表2.DTaP、Tdap、DT和Td疫苗的禁忌症和注意事项*
| 疫苗 | 禁忌症 | 预防措施* |
| 无细胞百日咳疫苗 | 前一剂后或对疫苗成分的严重过敏反应(如过敏反应)†, 在前一剂DTP或DTaP接种后7天内,非由其他可识别原因引起的脑病(如昏迷、意识水平下降或长时间癫痫发作)¶ | 进行性或不稳定性神经障碍,包括婴儿痉挛、不受控制的癫痫发作或进行性脑病;推迟DTaP,直到神经状况澄清和稳定 前一剂含破伤风类毒素疫苗后< 6周的格林-巴利综合征 既往接种含破伤风或白喉类毒素的疫苗后,有Arthus型超敏反应史;推迟接种疫苗,直到距离最后一次接种含破伤风类毒素的疫苗至少10年 伴或不伴发热的中度或重度急性疾病 |
| Tdap | 前一剂后或对疫苗成分的严重过敏反应(如过敏反应)§ 在前一剂DTP、DTaP或Tdap接种后7天内出现非其他可识别原因引起的脑病(如昏迷、意识水平下降或癫痫持续发作** | 进行性或不稳定性神经障碍、不受控制的癫痫发作或进行性脑病,直到治疗方案已经建立且病情已经稳定;这些预防措施是针对百日咳成分的 前一剂含破伤风类毒素疫苗接种后< 6周的格林-巴利综合征 既往接种含破伤风或白喉类毒素的疫苗后,有Arthus型超敏反应史;推迟接种疫苗,直到最后一次接种含破伤风类毒素的疫苗后至少10年 伴或不伴发热的中度或重度急性疾病 |
| DT,Td | 前一剂后或对疫苗成分的严重过敏反应(如过敏反应)§ | 前一剂含破伤风类毒素疫苗后< 6周的格林-巴利综合征 既往接种含破伤风或白喉类毒素的疫苗后,有Arthus型超敏反应史;推迟接种疫苗,直到最后一次接种含破伤风类毒素的疫苗后至少10年 伴或不伴发热的中度或重度急性疾病 |
缩写:DT =白喉和破伤风类毒素疫苗;DTaP =白喉和破伤风类毒素以及无细胞百日咳疫苗;DTP =白喉类毒素、破伤风类毒素和全细胞百日咳疫苗;MenACWY =四价脑膜炎球菌结合疫苗,血清群A、C、W、Y疫苗;Td =破伤风和白喉类毒素疫苗;Tdap =破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗。
*应仔细审查列为预防措施的事件或情况。在这些情况下,应该考虑对人使用特定疫苗的益处和风险。如果认为疫苗的风险大于益处,就不应该接种疫苗。如果认为接种疫苗的益处大于风险,就应该接种疫苗。是否以及何时对患有或疑似潜在神经系统疾病的儿童进行DTaP治疗应根据具体情况而定。
†进一步接种DTaP三种成分中的任何一种都应推迟,因为不确定疫苗的哪种成分可能起作用。
§由于破伤风疫苗接种的重要性,出现过敏反应的人应转介给过敏症专科医生,以确定他们是否对破伤风类毒素有特异性过敏,以及是否可以对破伤风类毒素脱敏。
¶在这种情况下,应在疫苗接种计划的剩余剂量内接种DT疫苗,以确保预防白喉和破伤风。
**该禁忌症适用于百日咳成分,这些人应接种Td而非Tdap。
表3.不属于DTaP、DT、Td和Tdap疫苗接种禁忌症的情况
| 疫苗 | 通常被误解为禁忌症的情况 (即疫苗可以在这些条件下施用) |
| DTaP、DT、Td、Tdap通用 | 轻度急性疾病,伴有或不伴有发热 轻度至中度局部反应(即肿胀、发红、疼痛);前一次用药后出现低热或中度发热 外表良好的人以前没有体检 当前抗菌疗法 疾病的恢复期 早产 最近接触过传染病 青霉素过敏史、其他非疫苗过敏史、亲属过敏史或接种过敏源提取物免疫治疗史 |
| 无细胞百日咳疫苗 | 前一剂DTP/DTaP后出现< 105℉(< 40.5℃)的发烧、烦躁或轻度嗜睡 癫痫家族史 婴儿猝死综合征家族史 DTP或DTaP接种后不良事件的家族史 稳定的神经状况(例如,脑瘫、控制良好的癫痫发作或发育迟缓) 接种前一剂DTP/DTaP后48小时内出现虚脱或休克样状态(即低渗低反应性发作) 接种前一剂DTP/DTaP后3天内有癫痫发作史,伴有或不伴有发热 接种前一剂DTP/DTaP后48小时内持续哭闹超过3小时的持续史 |
| Tdap | 接种前一剂百白破或百白破疫苗后48小时内出现≥105℉(≥40.5℃)的发热 接种前一剂DTP/DTaP后48小时内出现虚脱或休克样状态(即低渗低反应性发作) 接种前一剂DTP/DTaP后3天内有癫痫发作史,伴有或不伴有发热 接种前一剂DTP/DTaP后48小时内持续哭闹超过3小时的持续史 DTP/DTaP/Td后肢体广泛肿胀的病史,不属于Arthus型反应 稳定的神经障碍 臂神经炎病史 母乳喂养 免疫抑制 |
缩写:DT =白喉和破伤风类毒素疫苗;DTaP =白喉和破伤风类毒素以及无细胞百日咳疫苗;DTP =白喉类毒素、破伤风类毒素和全细胞百日咳疫苗;Td =破伤风和白喉类毒素疫苗;Tdap =破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗。
来源:改编自疾控中心。关于免疫的一般性建议:免疫实践咨询委员会的建议(ACIP)。MMWR 2011年建议报告;60(编号RR-2)。
图1. 1922-2016年美国报告的百日咳病例数
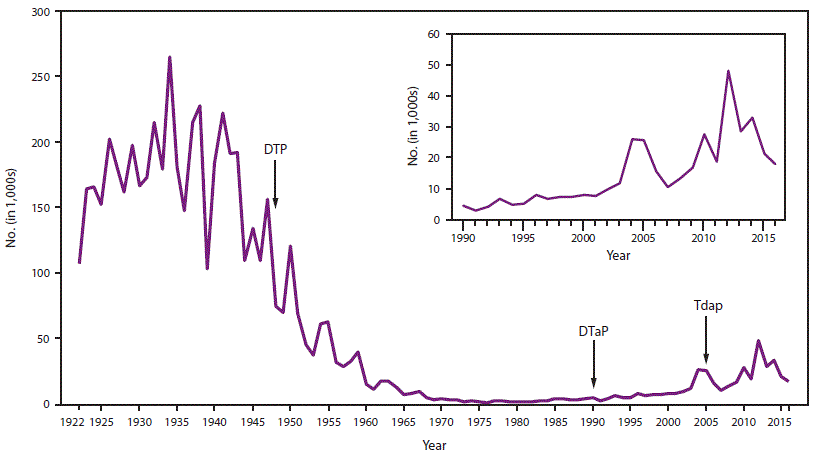
缩写:DTaP =白喉和破伤风类毒素以及无细胞百日咳疫苗;DTP =白喉类毒素、破伤风类毒素和全细胞百日咳疫苗;Tdap =破伤风类毒素、减毒白喉类毒素和无细胞百日咳疫苗。
来源:国家法定疾病监测系统和补充百日咳监测系统,1922-1949年,美国公共卫生服务的被动报告。
图2. 1990-2016年美国按年龄组划分的百日咳年发病率*
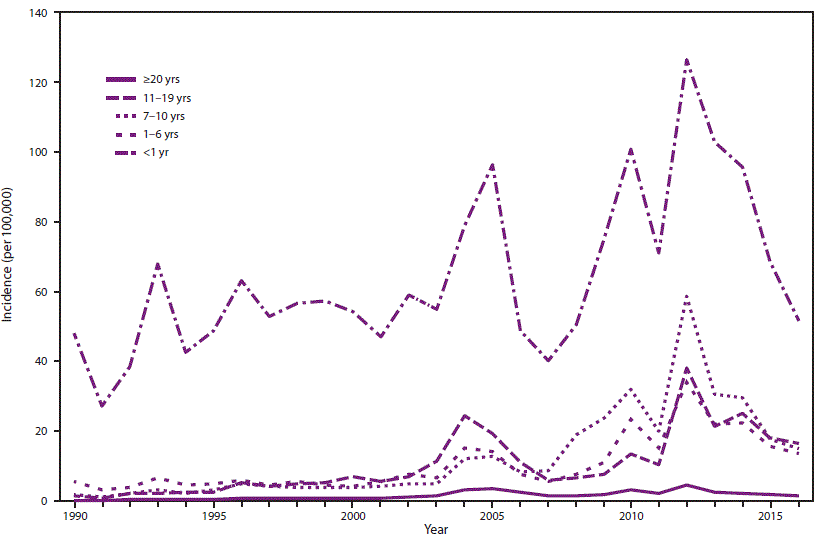
来源:国家法定传染病监测系统和百日咳补充监测系统。
*每10万人口。
图3. 1947-2016年美国破伤风的年发病率*和死亡率
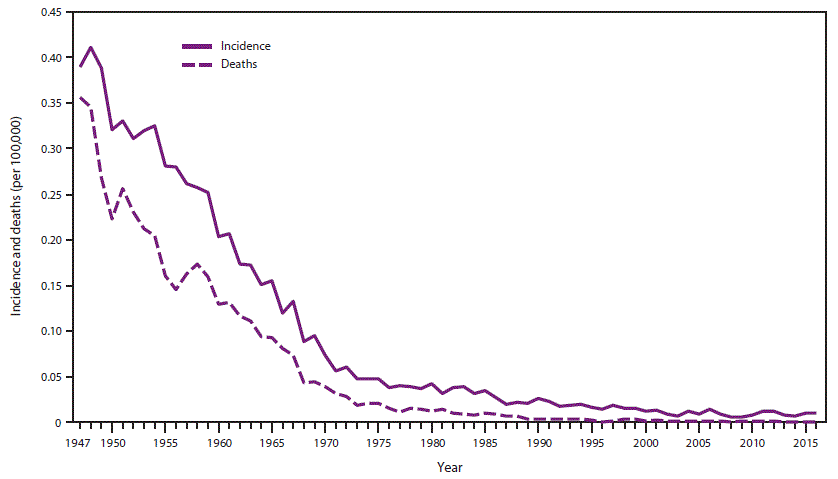
来源:国家法定疾病监测系统和对美国公共卫生服务的被动报告。
*每10万人口。
图4. 1920-2016年美国报告的白喉病例数
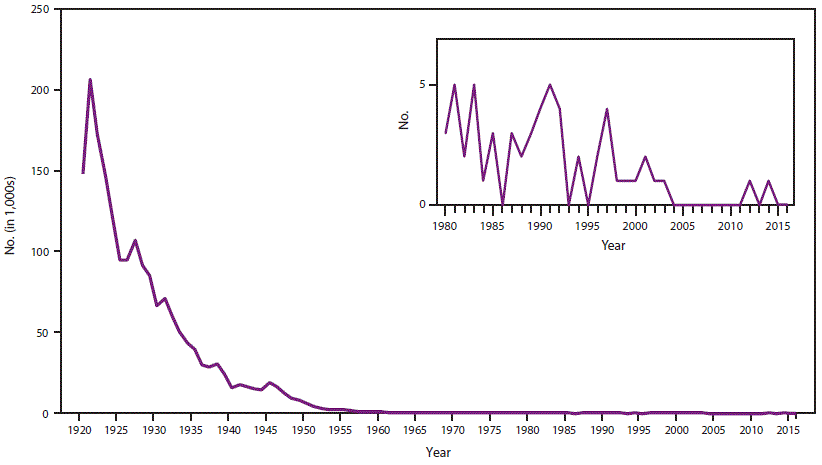
来源:国家法定疾病监测系统和对美国公共卫生服务的被动报告。
表4.含破伤风类毒素、白喉类毒素和无细胞百日咳抗原的疫苗组成以及7岁以下儿童批准使用疫苗类型的年龄——美国,2017年
| 疫苗类型 | 商号 | 制造商 | 百日咳抗原(μg) | 白喉类毒素 | 破伤风类毒素 | 常规和补充免疫计划中批准使用的年龄 | |||||||
| PT | FHA | PRN | FIM | 2个月 | 4个月 | 6个月 | 15-18个月 | 4-6岁 | |||||
| DTaP疫苗* | |||||||||||||
| 无细胞百日咳疫苗 | Infanrix | 葛兰素史克公司 | 25 | 25 | 8 | 25 | 10 | X† | X | X | X | X | |
| 无细胞百日咳疫苗 | Daptacel | 赛诺菲巴斯德公司。 | 10 | 5 | 3 | 5 | 15 | 5 | X† | X | X | X | X |
| DTaP混合疫苗* | |||||||||||||
| IPV-HepB | Pediarix | 葛兰素史克公司 | 25 | 25 | 8 | 25 | 10 | X† | X | X | X | X§ | |
| DTaP-IPV Hib | Pentacel | 赛诺菲巴斯德公司。 | 20 | 20 | 3 | 5 | 15 | 5 | X† | X | X | X | X¶ |
| DTaP-IPV | Kinrix | 葛兰素史克公司 | 25 | 25 | 8 | 25 | 10 | X | |||||
| DTaP-IPV | Quadracel | 赛诺菲巴斯德公司。 | 20 | 20 | 3 | 5 | 15 | 5 | X | ||||
| DT疫苗* | |||||||||||||
| DT(Dark Trace) | 没有商品名称 | 赛诺菲巴斯德公司。 | 6.7 | 5 | X† | X | X | X | X | ||||
缩写:DT=白喉和破伤风类毒素疫苗;DTaP =白喉和破伤风类毒素以及无细胞百日咳疫苗;FDA=美国美国食品药品监督管理局;FHA =丝状血凝素;FIM =2型和3型菌。HepB =乙型肝炎;Hib =b型流感嗜血杆菌;IPV =灭活脊髓灰质炎病毒;Lf =絮凝单位的极限;PRN =百日咳粘着素;PT =百日咳毒素。
*疫苗剂量及用法:0.5mL肌肉注射。
†FDA批准用于6周大的婴儿。
§FDA批准用于6岁以下儿童(7岁前)。
¶FDA批准用于4岁以下儿童(5岁前)。
表5.含破伤风类毒素、白喉类毒素和无细胞百日咳抗原的疫苗组成,以及7岁及以上人群批准使用疫苗类型的年龄——美国,2017年
| 疫苗类型 | 商号 | 制造商 | 批准用于常规和补充免疫计划的年龄(岁) | 百日咳抗原(μg) | 白喉类毒素 | 破伤风类毒素 | |||
| PT | FHA | PRN | FIM | ||||||
| Tdap疫苗* | |||||||||
| Tdap | Adacel | 赛诺菲巴斯德公司。 | 10–64 | 2.5 | 5 | 3 | 5 | 2 | 5 |
| Tdap | Boostrix | 葛兰素史克公司 | ≥10 | 8 | 8 | 2.5 | 2.5 | 5 | |
| Td疫苗* | |||||||||
| Td | 没有商品名称 | MassBiologics | ≥7 | 2 | 2 | ||||
| Td | Tenivac | 赛诺菲巴斯德公司。 | ≥7 | 2 | 5 | ||||
缩写:FHA =丝状血凝素;FIM =型和3型伞毛。Lf =絮凝单位的极限;PRN =百日咳粘着素;PT =百日咳毒素;Td =破伤风和白喉类毒素疫苗;Tdap =破伤风类毒素、减毒白喉类毒素疫苗和无细胞百日咳疫苗。
*疫苗剂量及用法:0.5mL肌肉注射。
表6.常规伤口处理中破伤风预防指南
| 含吸附破伤风类毒素疫苗的剂量 | 干净的小伤口 | 所有其他伤口* | ||
| DTaP、Tdap或Td† | TIG | DTaP、Tdap或Td† | TIG§ | |
| 未知或< 3 | 是 | 不 | 是 | 是 |
| ≥3 | 不¶ | 不 | 没有** | 不 |
缩写:DTaP =白喉和破伤风类毒素以及无细胞百日咳疫苗;Tdap =破伤风类毒素、还原白喉类毒素和无细胞百日咳;Td =破伤风和白喉类毒素;破伤风免疫球蛋白。
*例如但不限于被污垢、粪便、土壤和唾液污染的伤口;刺伤;撕脱;以及由导弹、挤压、烧伤和冻伤造成的伤口。
†建议7岁以下儿童使用DTaP。对于年龄≥11岁且之前未接种过Tdap的人,Tdap优于Td。未完全接种百日咳、破伤风或白喉疫苗的7岁以上人士应接种一剂Tdap,用于伤口处理,并作为补充疫苗系列的一部分。
§感染艾滋病毒或严重免疫缺陷的人,如果伤口被污染,也应该接种TIG,不管他们是否有破伤风免疫史。
¶是的,如果距离最后一次注射含破伤风类毒素的疫苗超过10年。
**是的,如果距离最后一次接种含破伤风类毒素的疫苗≥5年。
本文的建议引用: Liang JL, Tiwari T, Moro P, et al. Prevention of Pertussis, Tetanus, and Diphtheria with Vaccines in the United States: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2018;67(No. RR-2):1–44. DOI: http://dx.doi.org/10.15585/mmwr.rr6702a1external icon.
Page last reviewed: April 26, 2018
Content source: Centers for Disease Control and Prevention
Hits: 66
