生物反应器细胞培养制备人用狂犬病疫苗
查力1高军² 侯剑英1 白珠穆2 袁德明1杨俊伟² 李旭 1 李庆岸2 陈焕玉1孙非非2赵红梅 1周德水1
基金项目:辽宁省海外学子创业资金资助项目(辽科发[2005] 40号)
作者单位:1辽宁成大生物技术有限公司(沈阳110026);2辽宁 省生物医学工程研究院有限公司(沈阳110026).
通讯作者:查力,Tel:024-25521863,E-mail:syedcchali408@vip. sina.com
【摘要】 目的 应用生物反应器培养细胞和病毒,大规模生产人用狂犬病疫苗。方法 以巴斯德 PV2061 为毒种,以143代以内Vero细胞为培养基质,应用生物反应器,每升投放25 g 微载体,灌流式细胞培养,连续收获病毒液,经浓缩、灭活、 纯化,制成 Vero细胞狂犬病疫苗。结果 细胞培养密度达1.2×107~1.5×10⁷个/ml,病毒感染后可连续收获18~22 d, 病毒最高滴度8.5 LogLDø/ml,平均滴度7.6 LogLD50/ml。经柱层析纯化,杂蛋白去除率达99.95%以上,总蛋白含量≤80 μg/g,DNA含量≤10 pg/0.5ml,GP 含量3.5~4.5 IU/0.5ml,效力≥4.5 IU/0.5 ml 。 结论 应用生物反应器细胞培养,可以大规模生产 优质 Vero 细胞人用狂犬病疫苗。
【关键词】 生物反应器;微载体;Vero 细胞;狂犬病疫苗
2002年6月,辽宁成大生物技术公司从美国 BARI公司独家引进微载体生物反应器细胞培养技 术,经过消化、吸收、再创新,制备人用狂犬病疫苗获得成功。该产品通过临床安全性和免疫效果观察及上市后国内20个省约22万人的免疫接种安全性调查,表明具有良好的耐受性、较高的免疫原性和较好 的保护效力。
材料与方法
1. 细胞及毒种
Vero 细胞134 代,来自美国 ATCC; 巴斯德 PV2061狂犬病固定毒株,来自美国 CDC。
2. 生物反应器及微载体
New Brunswick Scientific Co.LTD.USA 制造, 30L;Cytodex-1,美 国 Healthy Care 公司生产[1,2]。
3.GP 标准品
第5批国际标准苗,来自 WHO 生物参考实验室——英国 NIBSC[3]。GP检测采用ELISA方法[4]。
4. 人用狂犬病纯化疫苗的制备(Vero细胞)
4.1 细胞的制备:取工作细胞库138代 Vero 细胞,分种到培养瓶,长成单层后,消化,并连续传代至141代,细胞密度达1.0×10⁶~1.2×10⁶个/ ml,接种到含有25 g/L 微载体的生物反应器内,进行灌 流培养。生物反应器细胞培养最高限定代次不超过 143 代。
4.2 病毒原液的制备:细胞培养5d, 密度达到 1 .2×10⁷~1 .5×107个/ ml, 接 种 PV2061 病毒,将 反应器温度调至33~35℃,换含1%小牛血清的维持液,灌流培养。3 d 开始收获,并视细胞病变状况,可连续收获18~22 d。间隔2d 取样,进行病毒 滴定及 GP检测。
4.3 病毒液浓缩、灭活和纯化:按《中华人民共 和国药典(三部)》2005版进行超滤浓缩,用β-丙内酯灭活,经检验合格后,柱层析纯化[5]。按《中华人民共 和国药典(三部)》2005版标准,进行全面检验。
结 果
1. 微载体细胞感染病毒后的病变特征
微载体细胞均匀致密,感染病毒后,细胞出现病变,但没有转瓶细胞病变明显,以轻微、缓慢圆缩和脱落为特征,并且,在病毒滴度达到高峰时,细胞病变仍不明显,而在病变趋于明显时,病毒滴度已经下 降,见图1。
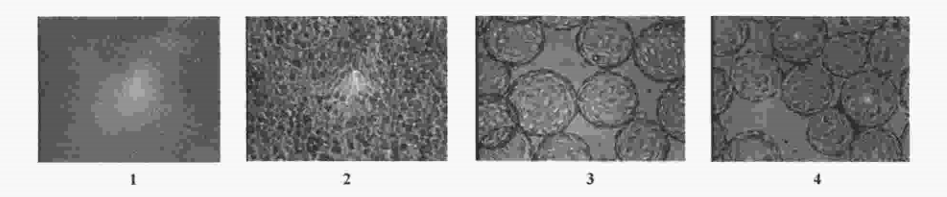
1:Vero cells in spinner before inoculation;2:Vero cells in spinner 5 d after inoculation;3:Vero cells in microcarrier before inoculation;4:Vero cells in microcarrier 5 d after inoculation.
图1 微载体和转瓶培养的Vero 细胞感染病毒后的病变特征
Fig 1.Pathological changes of Vero cells inoculated with virus culture in spinner and in microcarrier
2. 微载体不同投放量细胞培养密度、病毒滴度 和收获天数的比较
微载体不同投放量的试验结果显示,细胞培养、密度随着微载体投放量的增加而提高,病毒的滴度和收获次数也不同。投放25 g/L 微载体,细胞密度、达到1.5×107个/ml, 分别高于5 g/L 微载体细胞密度的5倍,15 g/L 微载体的1.88倍,略高于20 g/L 微 载体细胞的密度。而收获的病毒液平均滴度,25 g/L 微载体分别高于5 g/L 微载体0.9 Log 值,15 g/L 0.6 Log值,20 g/L 0.4 Log 值。病毒液的有效收获时间,25 g/L 较 5g/L 多9~11 d, 比15 g/L多3~ 5 d,与20 g/L 基本相等,见表1。
表1 微载体不同投放量的细胞密度、病毒滴度和收获时间 的比较
Tab 1.Cell density,virus titer and harvest time at various microcarrier densities
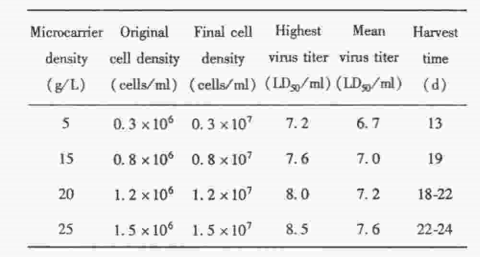
3. 三种不同工艺病毒滴度和收获时间的比较
对生物反应器、转瓶和细胞工厂(一次性塑料多层培养瓶)3 种不同工艺病毒滴度和收获时间进 行比较。25 g/L 微载体细胞感染的病毒,最高滴度达8.5 LogLD50/ml,平均滴度7.6 LogLD50/ml,有效 收获次数范围在22~24 d。转瓶工艺病毒高峰期一 般在感染病毒后96 h, 最高滴度达6.5 LogLD50/ml, 间隙收获一般4次左右,大约13~15 d 。但在转瓶培养的最后一次收获液中,病毒滴度很难达到 6.0 LogLD50/ml(规程要求高于6.0 LogLD50/ml 为 有效滴度)。细胞工厂与转瓶工艺水平差异无显著 意义(t=0.208,P>0.05),见图2。

图2 3种不同工艺病毒滴度和收获时间的比较
Fig 2.Titers and harvest time of virus bulks by three procedure
4.病毒收获液 GP与病毒滴度的关系
对两个生物反应器不同天数收获的病毒液进行 检测,结果显示病毒滴度高时,GP值也高,随着培养 时间的延长,病毒滴度逐渐下降,CP 值呈明显下降 趋势,见图3。
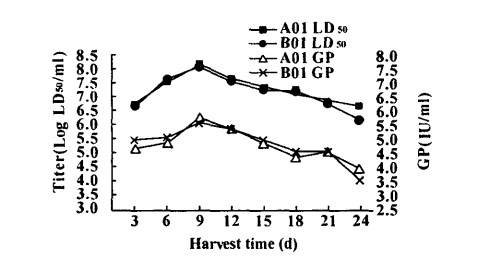
图 3 不同天数病毒收获液 GP 含量和病毒滴度
Fig 3.GP content and titer of virus bulk at different harvest time
5.层析纯化
连续收获的病毒液经超滤浓缩,检验合格后,进行柱层析纯化。以 Sepharose 凝胶系统为层析介质 进行层析,可见3个280 nm 吸收峰,首峰为狂犬病毒峰,第2峰为杂蛋白峰,其中主要是 BSA和 DNA, 第3峰为小分子物质峰,见图4。对3批中试产品, 柱层析纯化后各项指标检测结果见表2。

图 4 病毒液的 Sepharose 层析图
Fig 4.Purification of virus bulk by Sephadex chromatography
表 2 3批中试产品纯化效果
Tab 2.Purification of 3 lots of pilot product

讨 论
微载体生物反应器动物细胞培养技术是国家 863计划的重点研究课题。2002年辽宁成大生物技术公司引进这一技术,促进了我国在短期内,高起点、规模化生产优质人用狂犬病疫苗。该技术的主要特点是:生物反应器投放25 g/L 微载体,高密度细胞通过连续灌流方式培养,病毒连续收获,使生物反应器内保持细胞生长的营养环境,从而避免了高 密度细胞代谢产物的积累;pH、DO 值的持续稳定, 抑制了高密度细胞代谢中的消耗性衰竭;由于改进了生物反应器的设计,在灌流时防止了微载体的自然沉降,并令其充分悬浮,使生物反应器中高密度细胞正常存活时间和病毒连续收获周期明显延长。生物反应器灌流技术不仅能提高细胞生长的密度,而且还有助于产物的纯化。
生物反应器技术优势不仅在于生产的规模,更在于产品的质量。用微载体生物反应器培养技术和 下游特殊纯化工艺制备的人用狂犬病纯化疫苗 (Vero 细胞),抗原含量高,3批中试产品经检验,效 力分别为5.70、7.01 和6.02 IU/0.5 ml 。GP 纯化回收率在75%以上,杂蛋白去除率在99.95%以上, 终产品各项指标均达到 WHO 的质量标准[6.7],与国 际先进的 Vero 细胞疫苗同等水平。
综上所述,该项技术具有综合成本低、批量大、 批间差异小、所获病毒抗原量高等优点。另外,全封 闭的管道化生产流程和自动过程监控、控制技术,不 仅减轻了劳动强度,简化了手工操作程序,而且生产 疫苗所需人员和 GMP 生产车间及水、电、原材料成 本,也大大低于转瓶或其它培养方式生产疫苗。
微载体生物反应器高密度细胞培养作为多种病 毒性疫苗和有关生物制品规模化生产的平台技术, 有待于今后逐步应用到其它病毒性疫苗生产中去。
参考文献
[1]Cytidex”1:Beaded microcariers for cell culure,Pharmacia FineChemicals,Technical Booklet Seriws,Uppsala,Sweden 1978.
[2]Van Wezel AL.Micricarrier cultures of animal cells.In:Kruse PF, Pattersson MK,eds.Tissue culture:metbods and applications.New York:Academic Press,1973.372-377.
[3]WHO ILBS.5th international reference material for rabie vaccine. Hertfordshire EN63QC United Kingdom Version 2 dated 15th Febru- ary 2000.
[4]Laboratory techniques in rabies(fourth edition).WHO Geneva. 1996.383-388.
[5]Van Wezel AL,Van Herwaarden JAM,Can De Heuvel-de-Rijk. Large-scale concentration and preparation of virus suspension from microcarrier culture for the preparation of inactivated virus vaccines.Develop Boil Standard,1979,42:65-69.
[6]WHO tech Rep Ser No.700,1984.
[7]WHO tech Rep Ser No.747,1987.
来源:查力,高军,侯剑英,白珠穆,袁德明,杨俊伟,李旭,李庆岸,陈焕玉,孙非非,赵红梅,周德水.生物反应器细胞培养制备人用狂犬病疫苗[J].中国生物制品学杂志,2006,(第3期):288-290.
►辽宁成大生物技术公司是中国首家上市生物反应器工艺的人用狂犬病疫苗高新技术企业;
►成大速达®全球累计超过1亿人使用。
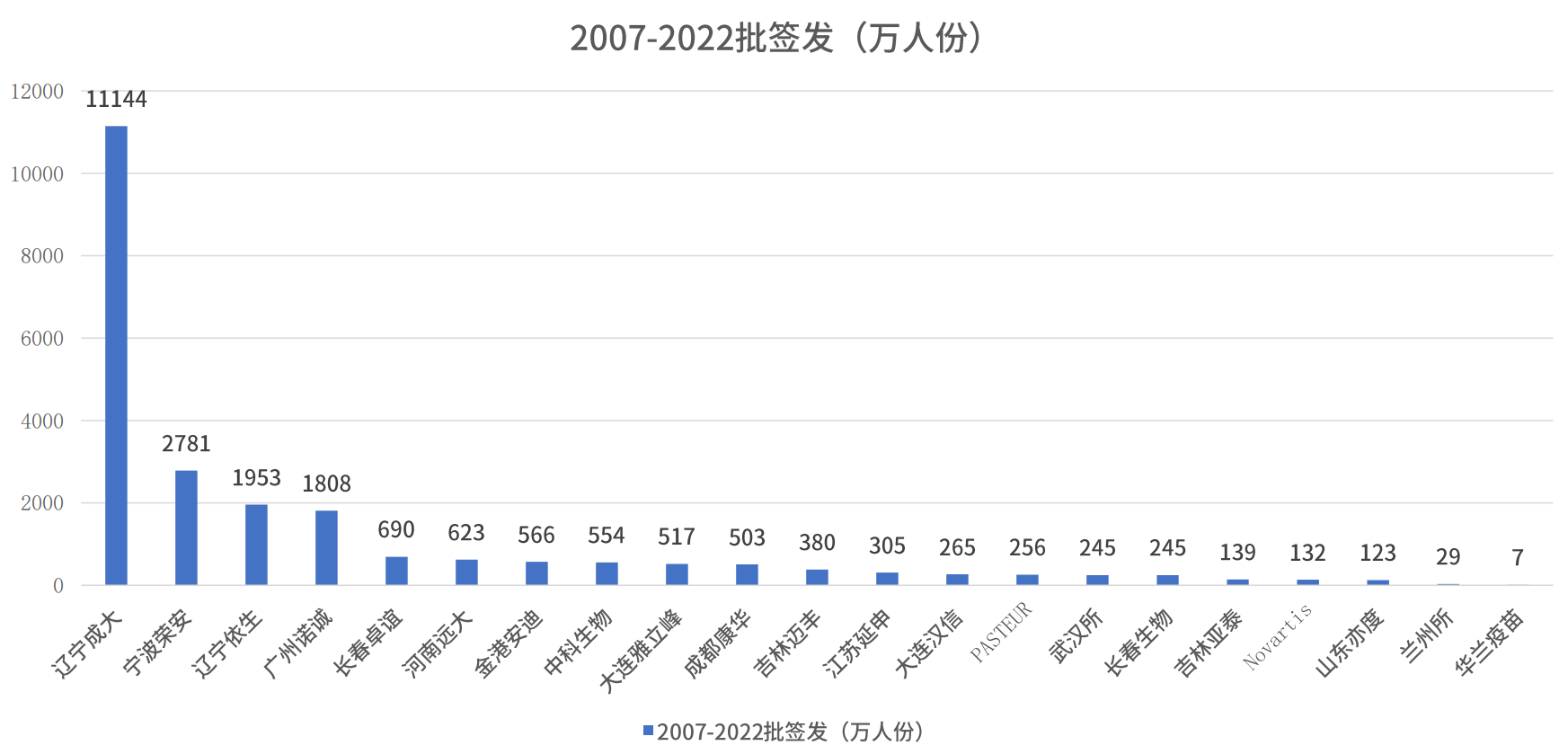
图 中国人用狂犬病疫苗批签发统计




您好孟博士,我想问一下如果小伤口沾到狗的唾液,但过去7个多月了,狗还活着,是邻居家养的狗,用补打疫苗吗?如果需要补打,三针可以吗?求您回复我
1.打不打无所谓;
2.可以打3针;
3.个人观点供参考,其它谨遵医嘱;如果需要了解更多相关知识请参考狂犬病暴露后管理指南(英国 2023年1月)