狂犬病疫苗的效力、免疫原性和有效性:体外和体内方法
Potency, immunogenicity, and efficacy of rabies vaccine: In vitro and in vivo approach
首次发布:2024年2月27日
https://doi.org/10.1002/iid3.1198
摘要
背景
狂犬病是一种潜在的致命病毒,影响着150多个国家。尽管狂犬病疫苗和免疫球蛋白早在1908年就已问世,但孟加拉国在疫苗生产方面还是个新手。我们检查了当地生产的狂犬病疫苗的质量是否不合格。
方法
从2020年3月到2023年5月,通过三种体内和体外方法分析了20种疫苗的效力和免疫原性。进行了单径向免疫扩散、荧光抗体病毒中和和NIH测试,以评估疫苗对狂犬病病毒提供足够保护的功效。
结果
狂犬病疫苗的效力通过体外SRID方法通过测量糖蛋白含量来确定。计算每批平均16份样品。20个批次的最小和最大平均均值分别为5.058和5.346。方差计算为0.00566。我们发现变异系数(CV)在9.36%和14.80%之间。100%样品是令人满意的,因为这些样品的效价超过2.5 IU/mL。为了观察免疫原性,我们应用FAVN方法测定抗体滴度。对每批中的平均16份进行计数,以量化抗体滴度。抗体滴度的平均值在2.389至3.3875之间。由于数据的分散性,变异系数略低。最后,我们实施了一种体内方法,即NIH测试方法,以确定基于死亡率的效力。我们发现平均值为4.777 IU/SHD,标准偏差为1.13 IU/SHD。在NIH测试中,所有20个批次都100%令人满意。
结论
这项研究表明,孟加拉国生产的狂犬病人用疫苗的效力足以提供足够的免疫原性。我们的研究为致力于根除狂犬病的医护人员提供了有力的证据。
1导言
嗜神经性狂犬病病毒(RABV),也称为狂犬病病毒,是人和动物狂犬病的原因。狂犬病可以通过接触动物唾液传播,也可能通过接触人类唾液传播。许多哺乳动物物种已被证明在野外被它感染,在实验室中,人们发现来自哺乳动物、鸟类、爬行动物和昆虫的细胞培养物也可能被感染。1在除南极洲以外的所有大陆上,已有150多个国家报告了狂犬病。2大多数病例记录在亚洲和非洲;然而,在过去的10年里,欧洲也报告了一些病例,特别是在回国的旅行者中。3
RABV包含包膜和单链负向RNA基因组。该病毒的RNA基因组有五个高度保守排列的基因。这些基因产生病毒RNA聚合酶(L)、核蛋白(N)、磷蛋白(P)、基质蛋白(M)和糖蛋白(G)。4整个基因组序列的长度从11,615到11,966 nt不等。5
每年,狂犬病导致数万人死亡,其中大部分发生在亚洲和非洲,40%的死者是15岁以下的儿童。犬是人类狂犬病死亡的主要原因,占所有人类狂犬病病例的99%。暴露后预防(PEP)、一系列狂犬病疫苗接种,以及在必要时提供狂犬病免疫球蛋白或单克隆抗体,都是可能接触过潜在狂犬病动物的人的选择。在全球范围内,狂犬病每年造成86亿美元的损失。6
1885年7月6日,路易斯·巴斯德给一名被人咬伤的病人注射了第一剂狂犬病疫苗。7 1967年,人二倍体细胞狂犬病疫苗(HDCV)的研究开始。RABV的减毒Pitman-Moore L503株用于产生灭活的HDCV。8
随着这些进步,世卫组织目前提供了纯化鸡胚胎细胞疫苗和纯化Vero细胞狂犬病疫苗。9根据制造商的建议,PEP和PrEP(暴露前预防)方案需要一系列疫苗剂量。到目前为止,大多数疫苗生产商建议(I)PrEP采用三剂1点肌肉注射方案,(ii)PEP采用第0、3、7、14和28天的1点肌肉注射五剂方案或四剂萨格勒布方案(第0天2点肌肉注射和第7和21天1点肌肉注射)。10此外,一些制造商提供泰国红十字会2点ID方案,在第0、3、7和28天进行四次PEP门诊。6, 11 CCEEVs在人类和动物中使用都是安全的,并且使用从含胚卵或细胞培养物中产生的灭活RABV。9, 11首批世卫组织批准的纯化Vero细胞狂犬病疫苗,如维尔博VERORAB和成大速达SPEEDA。12, 13目前使用的野生动物口服狂犬病疫苗有两种:改良活病毒SAG2和SAD B19。14其次,编码狂犬病糖蛋白基因的重组痘苗病毒主要在美国和西欧使用。15重复接种疫苗可以保持高度的细胞介导的细胞毒活性,抗体的存在对致敏淋巴细胞的二次激活没有影响。16
琼脂凝胶沉淀试验,称为单径向免疫扩散(SRID),其中琼脂凝胶填充有具有已知特异性的抗体,并将含有目标抗原的样品放置在凝胶的一个孔中。17最初的快速荧光病灶抑制试验(RFFIT)已被修改为一种称为FAVN试验(荧光抗体病毒中和试验)的微型试验。活病毒FAVN测试用于评估动物在免疫后是否具有足够的狂犬病抗体。高于0.5 IU/mL的抗体浓度被认为足以防御狂犬病。18NIH(NIH)建立了NIH试验,这是一种用于评估狂犬病疫苗效力的体内试验。在该实验中,小鼠在暴露于RABV之前首先接种狂犬病疫苗,以评估灭活狂犬病疫苗提供的保护水平。19
该研究旨在评估孟加拉国生产的狂犬病疫苗的质量和有效性,并与国际知名品牌进行比较。本地生产的疫苗有效可靠吗?我们采用世卫组织批准的体内和体外方法,通过效价、免疫原性和疗效研究来确定质量。
2材料和方法
2.1研究设计
制造商向国家监管机构提供样品用于批次放行。然后在孟加拉国卫生和家庭福利部下属的药品管理总局国家控制实验室对样本进行分析。从2020年3月到2023年5月,共有三个实验室、一个动物馆和五个兽医诊所参与其中。狂犬病疫苗是在Vero细胞上生产的灭活RABV的冻干形式。用注射用水(WFI)复溶后,疫苗为透明、无色、无菌溶液。该研究旨在分析20个不同批次的狂犬病疫苗。采用了三种免疫化学方法。每种方法都有两组:实验组和对照组。每个测试组随机选择16个样品。对于阳性对照组,我们使用参考疫苗;WFI作为阴性对照组。犬参与了FAVN,小鼠参与了NIH体内效力测试方法。用于试验组的16只独立动物,一只用于阳性对照,一只用于阴性对照,被设计为实验单个单元。总共360只犬用于FAVN试验,每批18只(试验组16只,对照组2只)。20, 21这些犬的年龄不小于9个月,体重不低于10公斤。他们之前没有接种疫苗,在接种疫苗后的120-180天内采集了血液。犬和母犬都被选中。NIH试验中总共使用2920只小鼠,每批146只(96只用于免疫接种,48只用于返滴定,2只用于对照组)。22, 23选择体重为11-15克、年龄为21-27天的健康瑞士白化雌性小鼠进行NIH测试。在检疫和初步健康检查后随机选择犬和小鼠。只有分析师和医疗技术专家知道对照组和测试组。动物管理员和其他实验室人员没有被告知此事。在NIH激发试验后,我们观察到典型的临床症状,如毛皮起皱、驼背、缓慢或环形运动、警觉性丧失、抖动、颤抖、抽搐、瘫痪、濒死状态和死亡。用Combistat软件(6.01版)进行统计分析。实验步骤在材料和方法部分描述。我们的实验结果用表格描述1−3.
表1.20批狂犬病人疫苗样本的SRID检测结果。
| 批号 | 编号 | 标准效价(平均值±标准差) IU/mL | 样品效价(平均值±标准差) IU/mL | 标准品的变异系数(%) | 样本的变异系数(%) | 标准偏差 | 样本方差 | 皮尔逊相关系数 | 回归(R2) | 效力的接受值 | p值(双尾t-测试) | 阳转率(%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| BN-20001 | 16 | 5.355 0.451 | 5.126 0.759 | 8.422035481 | 14.806867 | 100 | ||||||
| BN-20002 | 16 | 5.465 0.451 | 5.305 0.713 | 8.252516011 | 13.440151 | 100 | ||||||
| BN-21001 | 16 | 5.355 0.451 | 5.282 0.682 | 8.422035481 | 12.911776 | 100 | ||||||
| BN-21002 | 16 | 5.41 0.45 | 5.314 0.632 | 8.31792976 | 11.893113 | 100 | ||||||
| BN-21003 | 16 | 5.41 0.45 | 5.219 0.640 | 8.31792976 | 12.262886 | 100 | ||||||
| BN-21004 | 16 | 5.355 0.451 | 5.211 0.684 | 8.422035481 | 13.126079 | 100 | ||||||
| BN-21005 | 16 | 5.41 0.45 | 5.274 0.681 | 8.31792976 | 12.9124 | 100 | ||||||
| BN-21006 | 16 | 5.355 0.451 | 5.22 0.689 | 8.422035481 | 13.199234 | 100 | ||||||
| BN-21007 | 16 | 5.465 0.451 | 5.346 0.608 | 8.252516011 | 11.372989 | 100 | ||||||
| BN-22001 | 16 | 5.355 0.451 | 5.22 0.543 | 8.422035481 | 10.402299 | 0.003144 | 0.00566 | 0.7 | 0.4641 | 2.5 IU/mL | .00000000001268 | 100 |
| BN-22002 | 16 | 5.355 0.451 | 5.16 0.657 | 8.422035481 | 12.732558 | 100 | ||||||
| BN-22003 | 16 | 5.355 0.451 | 5.094 0.644 | 8.422035481 | 12.642324 | 100 | ||||||
| BN-22004 | 16 | 5.355 0.451 | 5.133 0.662 | 8.422035481 | 12.896941 | 100 | ||||||
| BN-22005 | 16 | 5.41 0.454 | 5.291 0.637 | 8.391866913 | 12.037037 | 100 | ||||||
| BN-22006 | 16 | 5.41 0.454 | 5.256 0.574 | 8.391866913 | 10.920852 | 100 | ||||||
| BN-22007 | 16 | 5.355 0.451 | 5.155 0.640 | 8.422035481 | 12.415131 | 100 | ||||||
| BN-22008 | 16 | 5.465 0.451 | 5.221 0.542 | 8.252516011 | 10.381153 | 100 | ||||||
| BN-23001 | 16 | 5.52 0.44 | 5.268 0.493 | 7.971014493 | 9.3583903 | 100 | ||||||
| BN-23002 | 16 | 5.3 0.44 | 5.085 0.576 | 8.301886792 | 11.327434 | 100 | ||||||
| BN-23003 | 16 | 5.465 0.451 | 5.261 0.613 | 8.252516011 | 11.651777 | 100 |
- 缩写:SRID,单向放射免疫扩散。
表2.用FAVN法检测狂犬病疫苗免疫犬血清的敏感性和抗体滴度的统计分析。
| 批号 | 接种疫苗的犬的数量 | 首次接种疫苗后抗体测试的日期 | 滴度 IU/mL平均标准差 | 滴度 IU/mL平均标准差 | 阳转率(≥0.5 IU/mL) | CV | 差异 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| <0.5 IU/mL | 0.5–1 IU/mL | 1-2 IU/mL | 2–5 IU/mL | ≥5 IU/mL | |||||||
| BN-20001 | 16 | 120−150 | 1 (6.25%) | 2 (12.5%) | 5 (31.25%) | 6 (37.5%) | 2 (12.5%) | 2.7325 1.77 | 93.75 | 0.647914203 | 0.063155058 |
| BN-20002 | 16 | 120−180 | 0 (0%) | 2 (12.5%) | 6 (37.5%) | 6 (37.5%) | 2 (12.5%) | 2.591875 1.63 | 100 | 0.626446737 | 0.064823885 |
| BN-21001 | 16 | 120−150 | 0 (0%) | 1 (6.25%) | 4 (25.0%) | 7 (43.75%) | 4 (25.0%) | 3.281875 1.74 | 100 | 0.530462762 | 0.062323592 |
| BN-21002 | 16 | 120−180 | 0 (0%) | 0 (0%) | 6 (37.5%) | 7 (43.75%) | 3 (18.75%) | 3.036875 1.60 | 100 | 0.526802108 | 0.058381107 |
| BN-21003 | 16 | 120−180 | 1 (6.25%) | 2 (12.5%) | 6 (37.5%) | 5 (31.25%) | 2 (12.5%) | 2.56625 1.73 | 93.75 | 0.676610626 | 0.060991107 |
| BN-21004 | 16 | 120−180 | 1 (6.25%) | 1 (6.25%) | 4 (25.0%) | 7 (43.75%) | 3 (18.75%) | 3.060625 1.87 | 93.75 | 0.614054853 | 0.056945927 |
| BN-21005 | 16 | 120−150 | 1 (6.25%) | 2 (12.5%) | 5 (31.25%) | 5 (31.25%) | 3 (18.75%) | 2.703125 1.90 | 93.75 | 0.706145549 | 0.059636745 |
| BN-21006 | 16 | 120−180 | 2 (12.5%) | 2 (12.5%) | 4 (25.0%) | 6 (37.5%) | 2 (12.5%) | 2.389375 1.70 | 87.50 | 0.712767839 | 0.060437713 |
| BN-21007 | 16 | 120−150 | 0 (0%) | 1 (6.25%) | 3 (18.75%) | 9 (56.25%) | 3 (18.75%) | 2.66875 1.61 | 100 | 0.60382208 | 0.038758689 |
| BN-22001 | 16 | 120−180 | 1 (6.25%) | 1 (6.25%) | 5 (31.25%) | 7 (43.75%) | 2 (12.5%) | 2.71 1.68 | 93.75 | 0.622677372 | 0.03275483 |
| BN-22002 | 16 | 120−150 | 0 (0%) | 2 (12.5%) | 5 (31.25%) | 8 (50.5%) | 1 (6.25%) | 3.09125 1.71 | 100 | 0.553639936 | 0.026335488 |
| BN-22003 | 16 | 120−180 | 2 (12.5%) | 1 (6.25%) | 4 (25.0%) | 6 (37.5%) | 3 (18.75%) | 2.961875 1.65 | 87.50 | 0.558414424 | 0.028892429 |
| BN-22004 | 16 | 120−180 | 0 (0%) | 1 (6.25%) | 5 (31.25%) | 9 (56.25%) | 1 (6.25%) | 2.960625 1.41 | 100 | 0.478174442 | 0.031841992 |
| BN-22005 | 16 | 120−180 | 0 (0%) | 2 (12.5%) | 6 (37.5%) | 7 (43.75%) | 1 (6.25%) | 2.93875 1.74 | 100 | 0.594718666 | 0.035386368 |
| BN-22006 | 16 | 120−150 | 1 (6.25%) | 1 (6.25%) | 4 (25.0%) | 8 (50.0%) | 2 (12.5%) | 2.9775 1.728 | 93.75 | 0.580541401 | 0.03886594 |
| BN-22007 | 16 | 120−180 | 1 (6.25%) | 2 (12.5%) | 5 (31.25%) | 5 (31.25%) | 3 (18.75%) | 2.8125 1.36 | 93.75 | 0.48241696 | 0.044636188 |
| BN-22008 | 16 | 120−150 | 2 (12.5%) | 1 (6.25%) | 4 (25.0%) | 4 (25.0%) | 5 (31.25%) | 2.9425 1.60 | 87.50 | 0.544904619 | 0.032226831 |
| BN-23001 | 16 | 120−180 | 1 (6.25%) | 2 (12.5%) | 5 (31.25%) | 6 (37.5%) | 2 (12.5%) | 3.025 1.54 | 93.75 | 0.511167458 | 0.022751823 |
| BN-23002 | 16 | 120−150 | 0 (0%) | 2 (12.5%) | 5 (31.25%) | 8 (50.0%) | 1 (6.25%) | 3.3875 1.59 | 100 | 0.470798888 | 0.003562598 |
| BN-23003 | 16 | 120−180 | 1 (6.25%) | 1 (6.25%) | 6 (37.5%) | 7 (43.75%) | 1 (6.25%) | 3.268125 1.59 | 93.75 | 0.487861107 | 0 |
- 缩写:FAVN,荧光抗体病毒中和。
表3.接种14天后已测试批次狂犬病人用疫苗的NIH检测结果。
| 序列号 | 批号 | 受攻击小鼠的数量 | 标准 IU/SHD的效力 | 标准效力平均值 | 样品 IU/SHD的效力 | 样本效力平均值 | 世卫组织设定的最低效力 | 回归R2 | p值 | 样本的CV | 标准品的CV | 阳转率(%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | BN-20001 | 16 | 6.22 | 5.899±0.52 IU/SHD | 4.78 | 4.777 1.13 IU/SHD | 2.5 IU/SHD | 0.972 | .00026 | 0.2364 | 0.0842 | 100 |
| 2 | BN-20002 | 16 | 6.48 | 5.51 | 0.2051 | 0.0809 | 100 | |||||
| 3 | BN-21001 | 16 | 6.08 | 4.24 | 0.2665 | 0.0862 | 100 | |||||
| 4 | BN-21002 | 16 | 5.42 | 3.66 | 0.3087 | 0.0967 | 100 | |||||
| 5 | BN-21003 | 16 | 5.96 | 5.18 | 0.2181 | 0.0879 | 100 | |||||
| 6 | BN-21004 | 16 | 6.14 | 4.38 | 0.2580 | 0.0853 | 100 | |||||
| 7 | BN-21005 | 16 | 5.34 | 2.86 | 0.3951 | 0.0981 | 100 | |||||
| 8 | BN-21006 | 16 | 6.52 | 6.18 | 0.1828 | 0.0804 | 100 | |||||
| 9 | BN-21007 | 16 | 5.56 | 3.74 | 0.3021 | 0.0942 | 100 | |||||
| 10 | BN-22001 | 16 | 6.84 | 6.18 | 0.1828 | 0.0766 | 100 | |||||
| 11 | BN-22002 | 16 | 5.27 | 5.02 | 0.2251 | 0.0994 | 100 | |||||
| 12 | BN-22003 | 16 | 5.42 | 4.36 | 0.2592 | 0.0967 | 100 | |||||
| 13 | BN-22004 | 16 | 6.28 | 6.03 | 0.1874 | 0.0834 | 100 | |||||
| 14 | BN-22005 | 16 | 5.47 | 4.94 | 0.2287 | 0.0958 | 100 | |||||
| 15 | BN-22006 | 16 | 5.13 | 2.86 | 0.3951 | 0.1021 | 100 | |||||
| 16 | BN-22007 | 16 | 6.16 | 5.73 | 0.1972 | 0.0851 | 100 | |||||
| 17 | BN-22008 | 16 | 5.92 | 4.85 | 0.2330 | 0.0885 | 100 | |||||
| 18 | BN-23001 | 16 | 6.68 | 6.37 | 0.1774 | 0.0784 | 100 | |||||
| 19 | BN-23002 | 16 | 5.17 | 2.95 | 0.3831 | 0.1014 | 100 | |||||
| 20 | BN-23003 | 16 | 5.92 | 5.72 | 0.1976 | 0.0885 | 100 |
- 缩写:NIH,NIH。
2.2用SRID法估算狂犬病疫苗中糖蛋白的含量
简言之,0.1 M的Tris缓冲液(MERCK目录号,648315);叠氮化钠(适马-阿尔德里奇;化学文摘社编号26628-22-8);氯化钠(沙尔劳实验室;欧洲委员会编号:231-598-3);染色溶液,考马斯亮蓝(Thermo Scientific和Thermo Fisher目录号:20279);乙醇(德山纯化学有限公司;化学文摘社编号:64-17-5);乙酸(大正化学;化学文摘社编号:【64-19-7】);甘油(默克公司;化学文摘社编号:104091)是根据Mayner RE,24, 25和特定制造商指南。重构后,将标准品在0.9% NaCl中连续稀释至糖蛋白的1:4、1:8、1:16、1:32和1:64。样品也用1.0毫升WFI复溶,并按类似标准稀释。制备1%的琼脂糖溶液,每次稀释都形成直径为3 mm的孔。向孔中加入4微升(最大值)参考标准和样品。10分钟后,将装有凝结凝胶的箔纸包裹的托盘转移至水分室。孵育24小时后,分离凝结的凝胶并转移到染色盘中。用染色溶液染色后,取出凝结的凝胶并用脱色溶液洗涤15分钟。干燥后,通过自动区域读数器测量标准和样品的扩散圆直径。根据公式(公式在未公布的数据中)使用校准的Microsoft Excel计算区域面积。
2.3血清抗体试验:FAVN试验
病毒中和试验可以在细胞培养中进行。根据Cliquet等人描述的方法通过FAVN试验测量血清样品的抗体滴度。20攻击病毒悬浮液(CVS)-11(CVS-11,ATCC VR-959)病毒是在BHK-21 C13细胞中产生的。在DMEM培养BHK-21 C13细胞后(赛默飞世尔科技;目录号11965092)培养基,然后在未感染的金黄地鼠(BHK-21 C13,ATCC目录号CCL-10)细胞中感染、生长和收获细胞。TCID50采用试验计算病毒滴度。简而言之,在微孔板中制备测试血清和对照血清的三倍系列稀释液。每份血清稀释液一式四份进行测试,其中一份为对照平板,四份为待测血清平板。50微升(100 TCID50)的挑战RABV CVS-11(储存在80°C)也添加到每个孔中。使用补充有10%胎牛血清的DMEM(适马-阿尔德里奇;化学有限公司产品编号A4781)。微孔板在5%的二氧化碳中于37℃孵育1小时2加湿培养箱。细胞保存在补充有10% FCS和抗生素的GMEM中。使用血细胞计数器(Neubauer室)计算细胞浓度。保持最终浓度为4 × 105细胞/毫升。然后向每个孔中加入50μL BHK-21细胞悬液,将板在37℃下孵育48小时。在室温下将细胞固定在80%冷丙酮中30分钟后,通过加入异硫氰酸荧光素(FITC)(适马-阿尔德里奇;目录号34321)-缀合的抗狂犬病单克隆抗体,在37℃孵育30分钟,然后用磷酸盐缓冲盐水(PBS)-吐温20洗涤。通过荧光显微镜(蔡司轴镜5;卡尔·蔡司)。阅读是定性的;记录细胞中荧光焦点的存在与否。使用Spearman的rber公式(公式在未公布的数据中)计算50%的终点,作为2/4细胞无荧光的最高稀释度的倒数。在所有试验中,抗狂犬病血清(AFSSA)作为阳性对照,来自未接种疫苗的犬的血液作为阴性对照,数据以RABV中和抗体的IU(IU)/mL计算。21, 26
2.4 NIH试验(小鼠攻击试验)
试剂制备
NaCl(沙尔劳实验室;产品代码:SO0225)、KCL(默克公司;目录号:1049360500)2邮局(post office)4(默克集团;目录号:1048731000)和Na2高压氧4。2H2o(沙尔劳实验室;产品代码:SO0339)放入1000 mL容量瓶中,用纯化水填充体积至标记水平,以制备磷酸盐缓冲液。用于疫苗的PBS通过溶解NaCl、Na2高压氧4(沙尔劳实验室;产品编号:SO0227)和KH2邮局(post office)4.溶液pH值调整至7.2-8.0并高压灭菌。使用胎牛血清(适马-奥尔德里奇;ES-009-B或Thermo Fisher Gibco FBS-16000044)并与PBS混合。该体积用用于病毒检测的PBS填充至刻度。用一安瓿速溶冷冻病毒(ATCC VR 959;CVS-11)并用2%马血清稀释剂稀释。
2.4.2 RABV滴度检测
用6周龄的小鼠测定了中位有效剂量(ED 50)。制备CVS上清液的10倍系列稀释液,将0.03 mL每种CVS以10只小鼠为一组进行脑内接种。在第1天和第14天之间的前5天观察小鼠的任何死亡。在第14天,使用Reed-Muench公式测试抗体滴度(测试和数据未公布)。
对于第一次免疫接种,试验疫苗和标准疫苗用1毫升WFI复溶。然后,使用PBS制备标准疫苗和试验疫苗的三种五倍稀释液(1:25、1:125和1:625)。
免疫接种
隔离期结束后,进行第一次免疫接种,每次稀释选择16只健康的瑞士白化小鼠(8只雄性和8只雌性)。每种稀释液以1.0毫升的剂量腹膜内注射给每只小鼠。每只老鼠都放在一个单独的盒子里,并贴上适当的标签。在第一次免疫后的第7天,我们进行第二次免疫,第二次免疫以相同的方式进行。
攻击测试
在第一次免疫后的第14天,稀释CSV悬浮液以获得滴度为50 LD50/0.03毫升。然后,在第一次免疫的第14天,免疫小鼠和含有约50 LD的病毒悬液50/0.03毫升滴定度。向每只小鼠注射0.03毫升病毒悬浮液。老鼠被关在观察室里。效价为50 LD50/0.03毫升被认为是10。在15毫升falcon管中将0.2毫升10倍体积的悬浮液与1.8毫升PBS混合,制成10倍体积的悬浮液−1稀释。然后是10−2, 10−3和10−4对攻击性病毒进行稀释以进行毒力滴定(返滴定)。同一天,取体重1115克的健康小鼠。然后每次稀释0.03毫升攻击病毒(10−1, 10−2, 10−3和10−4)注射到每只小鼠的大脑内。
观察
从攻击之日起每天观察小鼠14天,并记录死亡。攻击后第5天或之后死亡或表现出脑病典型症状的小鼠包括在内。
参考疫苗
在Nil-2细胞系中产生并使用-丙内酯灭活的RABV的Pitman Moore毒株是称为生物参考制剂(BRP)批号5的冻干疫苗的基础,该疫苗目前正由欧洲药品质量管理局分发。该参考疫苗的指定滴度为每瓶10 IU。
2.4.7测试结果的统计分析和验证
全有或全无反应是NIH效价测试的基础。因此,采用了一个平行线模型,其中至少有三个点用于BRP 5号和正在考虑的疫苗接种。使用CombiStat软件版本6.01进行统计分析。
3结果
表1显示了SRID确定的疫苗效力。16个测试物品的平均效力用标准偏差表示。这是一个统一的、可重复的结果的批内比较。标准品的效力为4.97或5.85,因为这是一个已知的浓度。虽然接受效价是2.5 IU/mL,但我们总是发现效价值≥4.0 IU/mL,这是一个很好的无界值。还检查了标准品的一致性,包括均匀性和可重复性。标准品和样品的平均值从未低于2.5 IU/mL。甚至每批的最小值也大于验收值。将批间结果与几项统计分析进行比较。对方差进行分析,以找出标准品和样品平均值的分散度。降水圈面积以毫米为单位测量。20个批次的平均效力差异未显示任何显著差异。为了确定标准品和样品之间的线性关系,我们使用了皮尔逊相关系数。我们发现相关系数值为0.7,这意味着标准品的效力和样品的效力之间存在显著的正相关。当我们通过变异系数(CV)检查平均效价周围20个批次的相对分散度时,我们发现变异系数每次都小于15%。在表格中1,我们摘录线性回归(R2)样品和标准品之间。回归值计算为0.4641,公认的显著性值为0.001319449。双尾的概率值t-测试小于0.001,这在统计上具有高度显著性。在数字上1,我们揭示了两条趋势线作为线性回归的替代表达式。批次内和批次间的每一个测试样品的回归都有很大不同。因此,我们从每批中取16个样本的平均值。数字2是从区域阅读器上捕捉到的照片。沉淀区的直径随着稀释而逐渐减小。
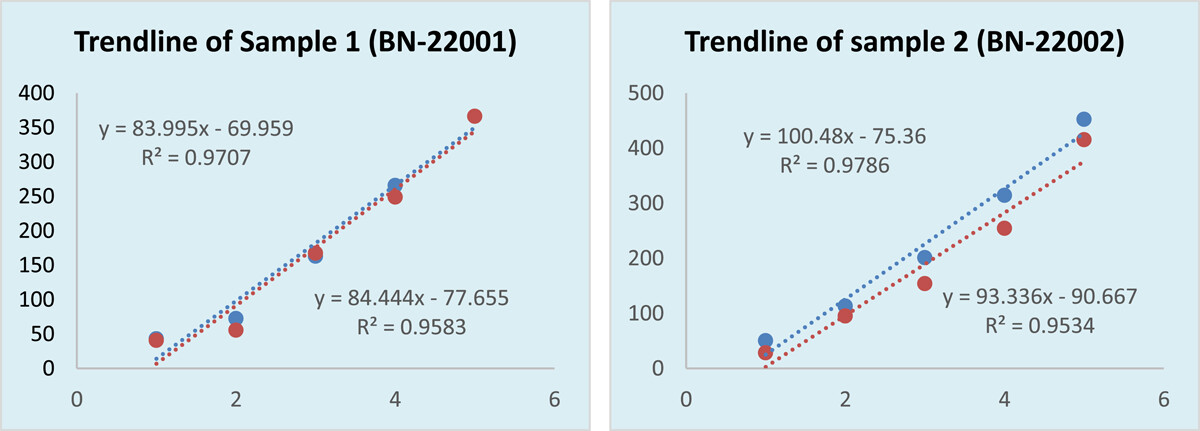
图1
显示集中趋势的直线(x-轴)对区域面积(y-轴)。直线方程表示直线的斜率和测试样品的相关系数。这里,蓝色表示标准品,红色表示样品。
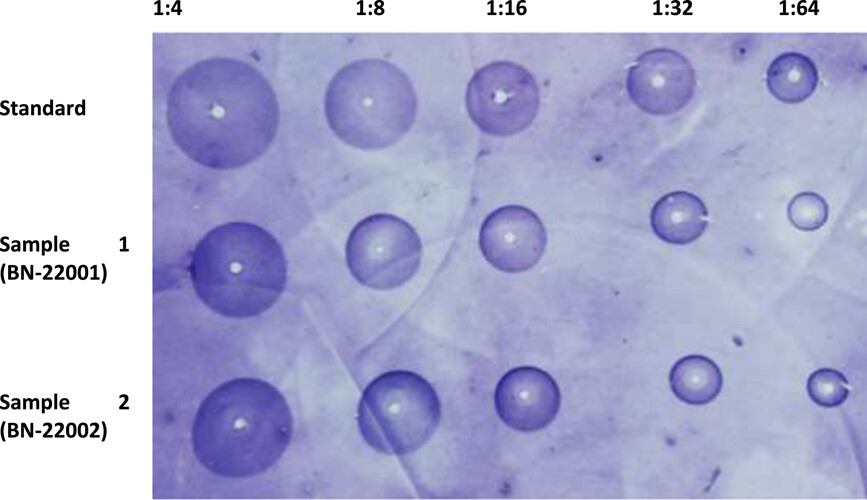
图2
单向放射免疫扩散试验显示狂犬病病毒糖蛋白产生的条带。此处显示了不同稀释度下沉淀区的直径。
3.1通过SRID方法测定的样品效价
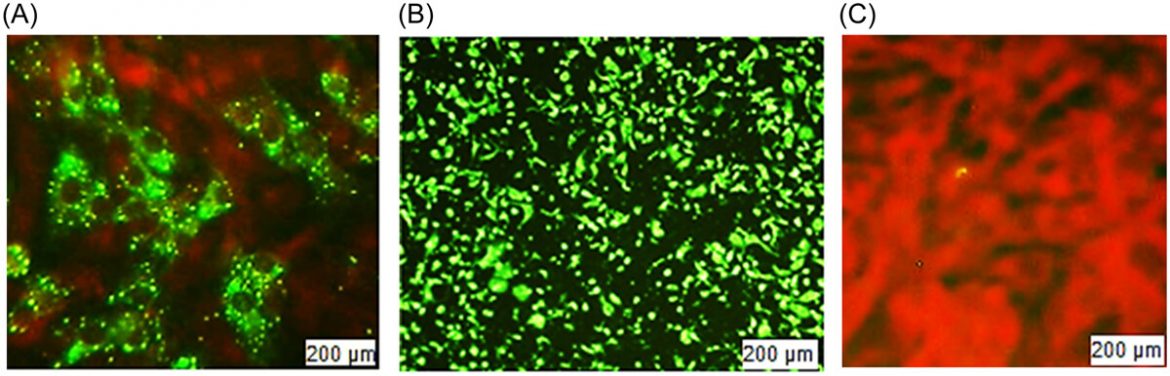
FAVN也是一种体外方法,有助于通过抗体滴度定量来确定免疫原性。我们将定量分为五类:<0.5、0.5-1、1-2、2-5和≥5 IU/mL(表2)。测试了20个批次;每批包含 16支样品,用于注射到之前未免疫的16只犬中。接种疫苗后,在120-180天内收集了第一批血样。最多数量的犬产生的抗体在25 IU/mL以内,其次是12 IU/mL。根据世卫组织指南,FAVN方法的抗体滴度阈值上限≥0.5 IU/mL。但是在20个批次中,有12个批次的一个或两个样品的效价低于0.5 IU/mL,占每批 16支样品的6.25%-12.5%。因此,尽管不满意的百分比非常小,但不可能对所有20个批次都获得100%满意的结果。我们发现八个批次的批内 阳转率为100%。同时,其他批次的范围在87.5-93.75之间,令人满意。如果文章的数量可以增加,结果将更加统计平衡。如果我们考虑16个样品的平均效力,它比单篇文章的效力更容易接受。所有平均值均大于2.0 IU/mL,高于阈值。计算出的批间平均值在2.39-3.38 IU/mL范围内。抗体滴度的标准偏差用表中的平均值表示2表示数据分布偏离平均值,变化很大。方差在0到0.065之间,中值为0.0388。我们计算CV来寻找概率分布的离差。因此,我们的最小和最大变异相关性分别为0.471和0.713,中位数为0.569。这里,CV表示现有的可变性很高,值分散在更大的范围内。在图中3中,我们显示了带有标准误差的抗体滴度平均值。该图用图形表示了每批产品的平均值。但是我们不能从这个图表中推断出任何不满意的结果。对均匀度、线性度和重现性的统计分析显示,同一批次内有显著差异,但批间数据的平均值显示有统计学意义的数据(p> .05).对于更大的范围、标准差和方差,这种批内结果是不一致的。在图中4中,我们展示了BHK-21细胞和CSV-11病毒的高和低抗体滴度的显微镜图像。用丙酮固定BHK-21细胞的阴性对照,并用不含CSV-11病毒的FITC染色,也显示在图中4。在与CSV-11病毒孵育48小时后,在荧光显微镜下观察转染的BHK-21细胞以观察绿色荧光。在图中4A绿色荧光在暗红色背景下发光。结果是定性的,这意味着只能检测到存在或不存在;显微镜无法测量定量。但是较低的抗体滴度产生较少的绿色荧光(图4A),而较高的抗体滴度提供了绿色背景(图4B).当BHK-21细胞用丙酮固定并用没有CVS-11病毒感染的FITC染色时,没有产生抗体,并且在暗红色背景下发出绿色荧光(图4C).我们还在每个批次中进行了阴性对照测试(数据未显示)。与其他样本和阳性对照一样,来自未接种疫苗的犬的血液感染了CSV-11。阴性对照在20次检测中产生了0.03-0.18 IU/mL的病毒抗体滴度。在某些情况下,第120-180天检查的抗体滴度比第120-150天检查的平均滴度高,但这种一致性并不总是确定的。在少数情况下,120-150天的比120-180天的平均抗体滴度更高。因此,疫苗接种后的天数可能并不总是产生大量抗体滴度的决定因素,而年龄、种族、体型和繁殖等其他变量可能会产生影响。当我们通过SRID方法计算抗原(糖蛋白)效价时,我们发现了一个均匀且显著的效价量(≥2.5 IU/mL),但我们无法产生具有均匀量的抗体。

图3
热图表示抗体滴度的数量。红色块显示抗体滴度≤0.5 IU/mL。深红色块表示值≥0.5。所有其他绿色块的值≥1.0至6.5。
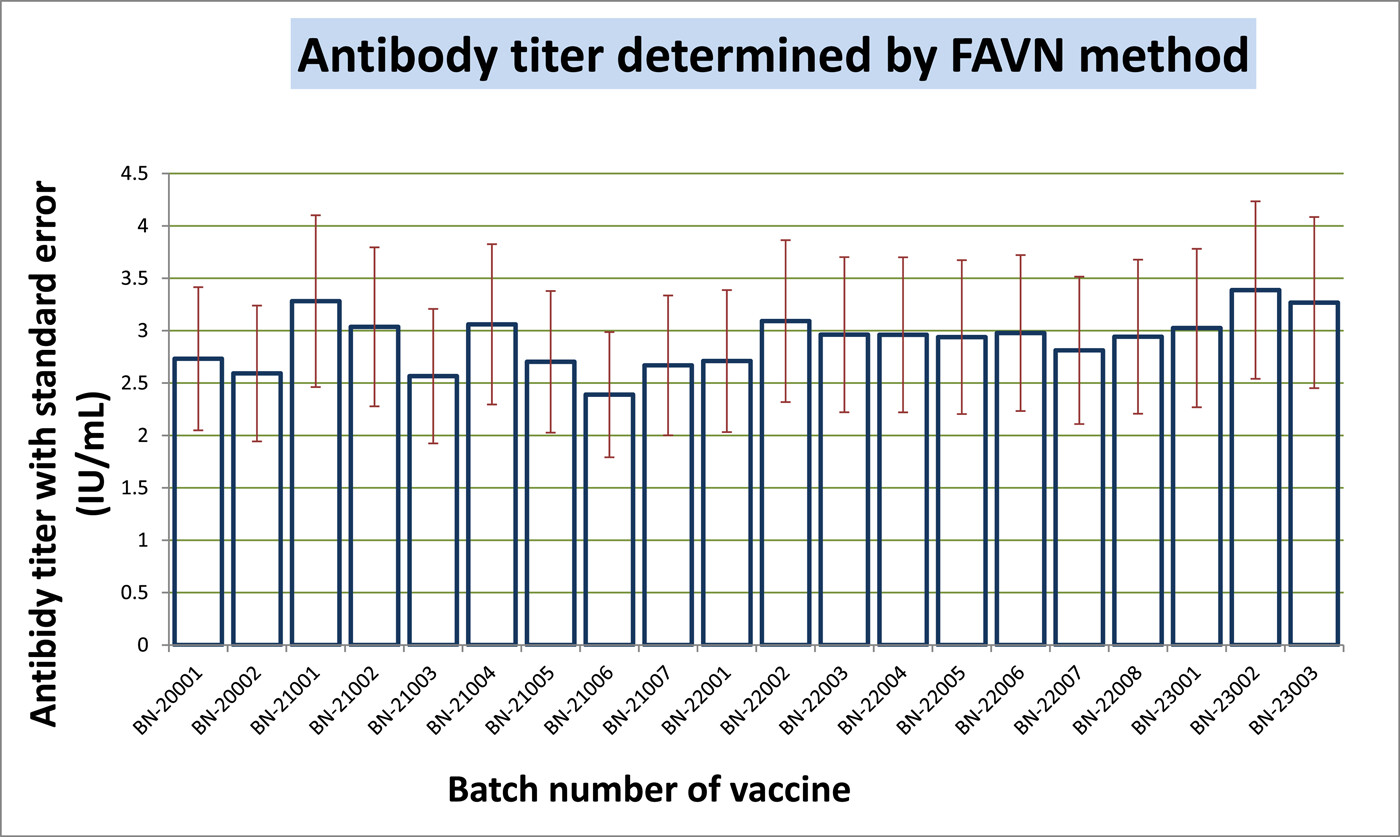
图4
通过FAVN测试方法检测狂犬病抗体,会产生一个带有标准误差的条形图。荧光抗体病毒中和。
NIH检测目前是疫苗分发的关键要求,用于评估狂犬病疫苗接种的有效性。这项测试完全是在体内进行的,因为它需要对小鼠进行免疫,然后让它们接受病毒攻击。测试设计由20个批次组成;每批包含 16支样品,用于注射到16只小鼠体内。标准品的效力非常一致,平均值为5.899 IU/SHD,标准偏差为0.52 IU/SHD(表3).人用狂犬病疫苗的最低效价为2.5 IU/mL。每个样品的效价都高于2.5 IU/SHD。20个批次的平均效价为4.78 IU/SHD,标准偏差为1.13 IU/SHD。20个批次中没有一个批次的检测值≤2.5 IU/SHD,这表明没有不合格结果。最低效价为2.86 IU/SHD,最高效价为6.37 IU/SHD。尽管最小值接近阈值,但平均值和中值分别为4.77 IU/SHD和4.895 IU/SHD,这表明我们获得的数据具有良好的集中趋势。尽管标准品的平均效价高于样品效价,但差异是相当的。我们计算了p-针对双尾的值t-假设两个样本的方差相等。我们的计算p-值为0.00026,这在统计上非常显著。除了标准差之外,我们还计算了CV来衡量数据点的离散度。样品的变异系数总是大于标准品。这意味着与标准品更均匀的数据相比,样本数据更分散。如果我们观察20个样品的效力,变异系数在17.74%和39.51%之间,这带来了更高的方差和标准差。我们对回归进行了分析,以了解标准品效力和样品效力之间的关系。回归值(R2)为0.972,大于0.95,在统计学上是可靠的。因此,体内试验方法证实了疫苗能够提供针对RABV的完全保护。根据不同稀释度疫苗的存活能力,所有20个批次的疫苗都在NIH效力试验中不合格。通过一致性、线性和重复性进行的批间效力比较表明,我们的数据是一致的,回归是线性的,平均值与标准差是一致的。在图中5,显示标准品和样品效力的趋势图。所有样品和标准品均通过测试,高于阈值限制(图6).
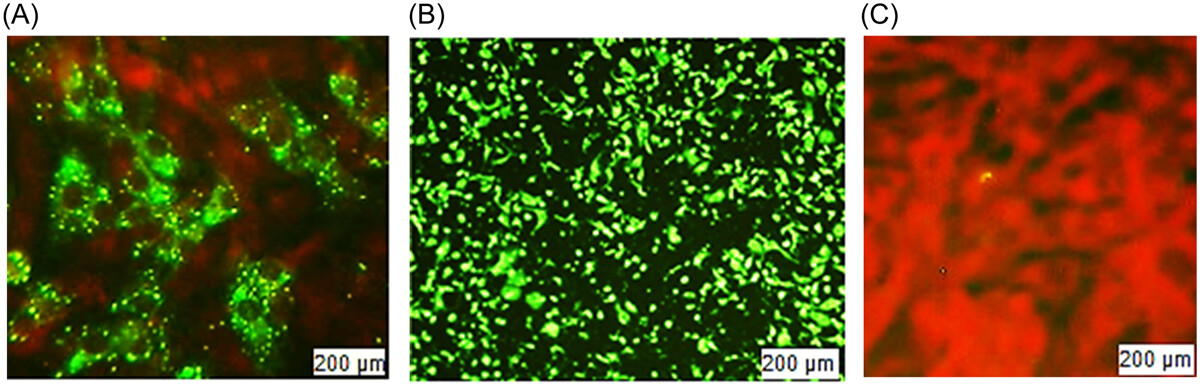
图5
图片来自蔡司Axioscope 5荧光显微镜,由Axiocam 208拍摄,并在培养48小时后由ZEN成像软件处理。荧光抗体病毒中和试验。(A)(较高稀释度和低滴度)在用CSV-11转染48小时后,用FITC染色的BHK-21细胞。(B)(较低稀释度和较高滴度)在用CSV-11转染48小时后。(C)阴性对照,BHK-21细胞被固定并用丙酮和FITC染色,但不加入CVS。CVS,挑战病毒悬浮;FITC异硫氰酸荧光素。
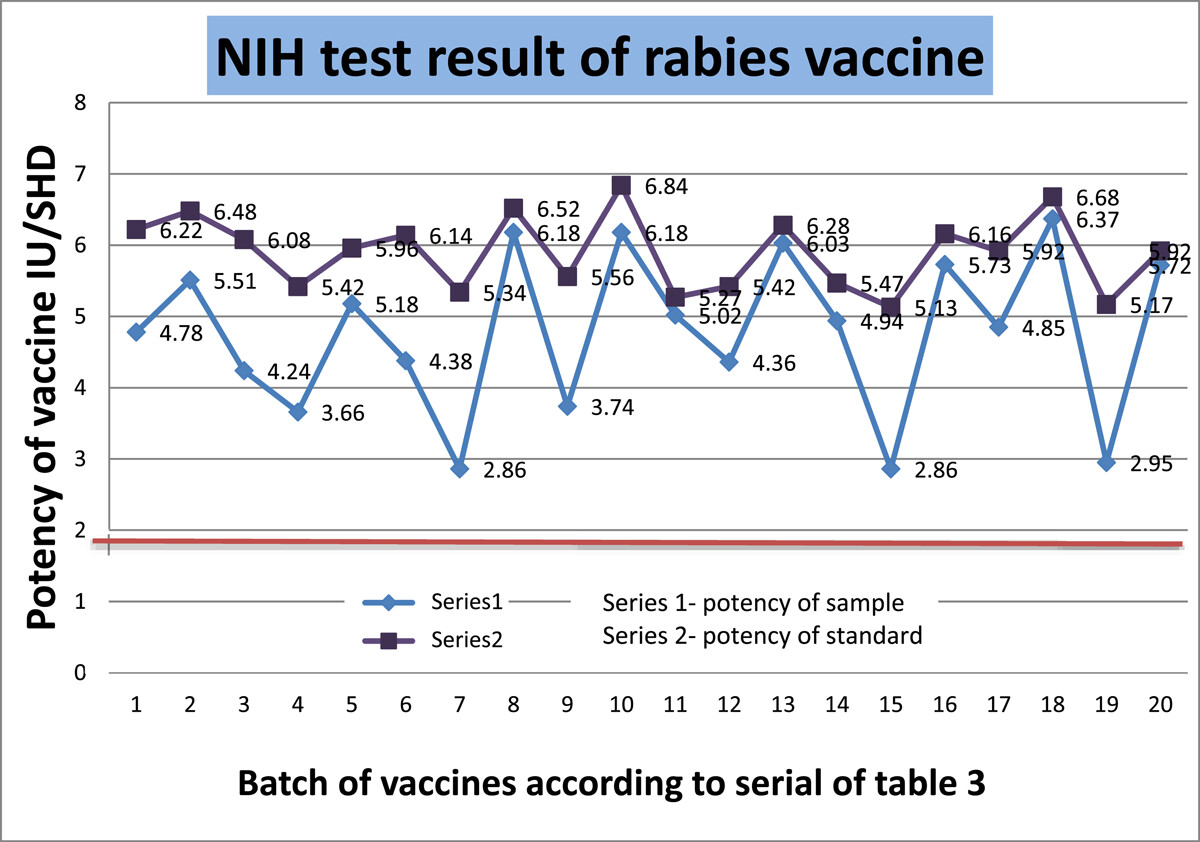
图6
用美国国家卫生研究院方法测定狂犬疫苗的效力。NIH。
4讨论
近年来,发展中国家的人类狂犬病病例稳步上升。在一项全国流行病学调查中,只有2%的患者被其他动物感染,而95%的患者被犬咬伤。27为了在中国和其他新兴国家消除人类狂犬病,管理和预防犬类和人类狂犬病至关重要。在有大量野生动物传播的地区,预防、管理和消除野生动物狂犬病的唯一方法是开展大规模疫苗接种运动。
在我们的SRID结果表中显示1很明显,标准品的效力和样品的效力具有线性关系。20批SRID的结果与世卫组织阈值极限相比100%令人满意。此外,每批16个样品的平均值显示其效力高于规定。28因此,很容易理解SRID方法可能有助于定量和定性评估狂犬病疫苗,以及出于研究目的分析狂犬病糖蛋白抗原。SRID测试快速简便,并且具有提供替代检测系统的优势,这减少了使用传染性病毒进行动物保护测试的必要性。29SRID试验可能有助于在体外确定疫苗的抗原浓度,并可以补充体内试验的数据,这些数据往往差异很大。所有20个批次效价平均值的变异系数在10%至14%之间,表明SRID方法测得的效价之间具有良好的一致性。这种SRID方法不太麻烦且耗时较少,但其重现性和线性显著。弗格森等人30描述了SRID的主要局限性,该方法不能确定宿主的免疫原性。威廉姆斯等人31在确定病毒疫苗的效力时,还使用方差和回归分析发现了稳定、敏感和可重复的结果。沃洛霍夫等人32发现酶联免疫吸附测定(ELISA)技术具有更高的通量,似乎更快更可靠,并且可能是一种更简单的替代方法。拉贾塞卡兰33观察到接受狂犬病ELISA检测的312份野猪样本中有42.31%(132/312)显示出抗体。但经ELISA检测,仅有28.4%(98/345)的狐狸样本显示出狂犬病抗体。在测试最后一批疫苗之前,生产过程中的糖蛋白含量是其效力的有用预测指标,可以使用SRID试验进行测试;然而,间接和免疫捕获等ELISA方法显示出高通量,似乎更快、更可靠,并且可能是更简单的替代方法。34, 35与Ferguson等人和Williams等人相比,我们结果的效力具有更高的平均值和更低的SD值,但具有更大的CV%,回归和相关系数。我们的糖蛋白含量的总体阳转率也更高。
有一些被广泛接受和世卫组织批准的狂犬病中和抗体滴度定量方法:RFFIT、小鼠中和试验、ELISA和FAVN试验。21, 23, 36FAVN测试是一种改进的技术,一种调整的RFFIT,这是一种公认的计算抗体滴度的世卫组织程序。病毒感染细胞中荧光灶的数量必须用RFFIT手动计数,37但是FAVN是无偏见的,能够实现自动大批量检测。尽管ERA、Hep-Flury和CTN-181比CVS-11更安全,但最好使用致病性攻击病毒(如CVS-11株)而不是疫苗株本身来评估疫苗接种的有效性。在RABV中和抗体测试中,CVS-11毒株作为攻击病毒已获得广泛认可。38我们使用了CVS-11病毒株,并用荧光显微镜很容易地在感染细胞中观察到它。通过FAVN测试,我们在接种疫苗的犬的血液中检测到了高水平的病毒中和抗体。根据平均值,结果是令人满意的。此外,我们的批间效力结果显示出与WOAH和世卫组织参考文献的良好一致性。每批的平均值远远大于阈值限制。虽然我们没有对这种疫苗进行人体试验。39发现疫苗来自同一批次,与人血清样本相比,犬血清样本具有较高的检测一致性。因为获得的滴度比标准FAVN的滴度大,所以当使用FAVN方法作为标准VNA试验时,仔细评估约0.5 IU/mL的VNA滴度是否足够保护是重要的。39滴度<0.5 IU/mL的犬血清被认为是疫苗接种失败。疫苗接种失败的后果是不可描述的,因为疫苗不能提供对狂犬病疫苗的充分反应的证据。我们没有多次测试同一份血清样本,因此取消了重复性测试。因此,当FAVN技术的滴度约为0.5 IU/mL时,我们应该用传统的FAVN和RFFIT进行确认。VNA实验中使用的攻击病毒株之间的G蛋白抗原构象可能存在变化,这可以解释RFFIT-GFP和RFFIT之间的差异。目前还没有很多关于在野生动物身上发现狂犬病抗体的调查。Paquot等人40 1988年在比利时对野猪和狍子进行了初步调查。克利凯等人。41进行了一项研究,他们发现40.2%(43/107)的测试样本的抗体滴度高于0.5 IU/mL。当他们采用RFFIT方法时,32.6%的样品效价大于1 IU/mL。文古特等人。42 2011年通过ELISA方法在28%的样本中检测到狂犬病抗体,与FAVN和RFFIT比较的阈值为0.5 IU/mL。为了确定狂犬病中和抗体的浓度,FAVN试验和原始RFFIT都被认为是可靠的。然而,这些技术具有缺点,包括由于使用实时RABV而需要昂贵、耗时且训练有素的工作人员。43 Wasniewski等人44还有Robardet等人45发现结果之间的差异是因为几个地区的采样和栖息地对免疫力有影响。需要更多的研究来正确理解这一观察结果。达斯卡卢等人。34发现ELISA和FAVN之间的总体一致性为65.66%。超过86%的ELISA阳性样本的FAVN检测结果是相关的。只有36.59%接受FAVN检测并在ELISA检测中呈阴性的样本也呈阴性。Jakel等人46和克利凯等人47观察从接种疫苗的犬中发现的结果之间的显著差异,这表明免疫原性的变化。此外,Jakel等人46证明如果犬已经接受了一次或两次疫苗接种,则在疫苗接种后4个月内取样的犬达到抗体反应截止值的机会比在稍后时间点独立检查的犬高得多。随着免疫反应的发展,犬的同种型从IgM反应转变为IgG反应。48认为这种较低的反应可能与缺乏免疫保护无关,因为总免疫球蛋白测量值可能更多地由IgG所占。这与曼斯菲尔德等人的研究结果一致。49以及肯尼迪等人。48这表明与成年人相比,1岁以下的犬随着年龄的增长出现低抗体滴度的风险更高。
到2030年通过犬类疫苗接种计划消除犬类狂犬病的战略目标要求成功控制犬类狂犬病,因为犬类是全球每年6万人死亡的主要原因。50根据世卫组织和WOAH的建议,狂犬病疫苗接种应获得相关部门的许可,并遵守任何适用的国家或国际标准。商业疫苗接种的审批程序还应包括监管机构的独立核查21, 51 Servat等人52测试了122批狂犬病疫苗,超过99%的样本通过了效力测试。但他们发现NIH是一种有问题的方法,因为即使在重复测试后,也只有42%的检测符合验证参数。Krä mer等人53试图通过狂犬病疫苗来验证NIH测试,他们发现了具有统计学意义的效力,这种效力是可重复和可靠的。Daas等人54描述了生物RABV标准品的制备过程,九个实验室参与了该过程以开发高效标准品。Pitman Moore狂犬病毒株被用来通过用β-丙内酯灭活它来制造疫苗。根据研究结果,该批狂犬病疫苗的效价为11iu/瓶。他们获得的结果显示了良好的重复性和再现性,具有100%令人满意的效价。莫雷拉等人55我们能够估计狂犬病疫苗的效力,并获得2.5 IU/SHD的临床有效效力,这是令人满意的。结果显示,NIH试验和标准贯入试验确定的效力之间有很强的相关性。该检测能够区分有效疫苗和次有效疫苗。马查多等人56评估人用狂犬病疫苗的效力。他们通过CV%和置信区间来评估可靠性,但结果的影响通过回归、线性和平行性来衡量。结果具有统计学意义,我们能够在每次稀释中减少8只小鼠。Lin等人建立了另一种针对NIH检测的TRFIA和ELISA检测方法。57在理想情况下,RABV糖蛋白的效价是良好的,并且当用于实际样品时,该方法产生了令人满意的效果。对于从当前TRFIA和ELISA测试中获得的效力值,相关系数为0.912,而从当前TRFIA和NIH测试中获得的相关系数为0.903。根据这些早期发现,TRFIA可以以更好的性能取代ELISA,并可能为NIH测试提供一种有前途的替代方法。NIH有一个可变的方法。NIH测试是一个过时的程序,可变性很高,最近没有经过任何改进。这种测试的其他缺点包括昂贵、耗时、需要大量动物以及给动物带来巨大痛苦。52销售不合格或假冒的人用疫苗会导致接种无效疫苗,这是一个全球性问题;因此,这些结果仍然很有趣。因此,儿童和成年人都无意中得不到这种可以预防的疾病的保护。50
尽管人类狂犬病可以通过接种疫苗完全治愈,但它仍会持续感染人类。狂犬病疫苗非常有效,没有风险,而且耐受性良好。像孟加拉国这样的发展中国家,生物制药并不普遍,其疫苗接种计划主要依赖进口疫苗。制造高质量的狂犬病疫苗是疲软经济的福音。如果本地制造产品能够提供有效的结果,该国肯定会节省大量进口成本。我们的研究将为一种新开发的产品提供清晰可靠的数据,该产品可确保大量人口免受致命疾病的威胁。这项研究可能有助于主管当局组织和实施大规模肠胃外疫苗接种。国家政府应该确保当地疫苗的效力足以达到国际标准,禁止生产不合格疫苗。如果狂犬病疫苗有效并具有国际质量,它们应该用于帮助世界实现2030年无犬导致人类狂犬病死亡的目标。
5结论
可以得出结论,标准疫苗和样本疫苗之间的剂量反应关系令人满意。SRID对20个不同批次的狂犬病疫苗样本的检测结果表明,SRID技术可能有助于狂犬病疫苗的定量和定性检测以及狂犬病糖蛋白抗原的分析研究。FAVN也是一种有效的方法,用于定量血清RABV病毒中和抗体并区分具有和不具有足够免疫反应的动物。NIH试验已经证明了一种极限试验的可行性、可重复性和可靠性,该试验在血清学试验中使用了相对较少数量的动物,而不是体内效力试验中的全部疫苗接种挑战。我们的扩大免疫计划承诺通过大规模疫苗接种计划消除狂犬病,但依赖进口的疫苗接种计划需要巨额预算。我们的研究暗示了孟加拉国生产的狂犬病疫苗的标准和质量。我们的本地疫苗可以提供足够的免疫原性来对抗RABV,因为它具有高效力,能够预防致命的狂犬病。
5.1我们研究的局限性
我们在整个旅程中有许多限制。对于FAVN测试,我们不能管理同一物种和纯种犬。NIH测试的挑战病毒标准购自ATCC。我们没有任何设备来生成CSV。尽管ELISA方法在体外效力测试中更加精确和准确,但我们采用了SRID方法,这不是一种现代的测试方法。我们只测试了20批,因为老鼠的价格和维护成本都很高。
5.2未来前景
我们的研究为本地生产的狂犬病疫苗提供了可靠的证据,这将有助于根除孟加拉国乃至世界各地的狂犬病,这是世卫组织设定的目标。
作者投稿
Fahima Akter为数据管理、形式分析、可视化和原始草案做出了贡献。Md. Shamimuzzaman参与概念化、数据监管、资金获取、调查、方法、项目管理、资源、软件、监督、验证和写作——审查和编辑。
感谢
作者感谢微生物、化学和动物实验室的所有分析师和同事。我们还要感谢参与从不同兽医诊所和动物收容所的接种过疫苗的犬身上收集血液样本的医疗助理。特别感谢喂养老鼠的管理员。这项研究得到了孟加拉国卫生和家庭福利部卫生服务司第四个HPNSDP(卫生、人口和营养部门发展方案)加强药品管理项目的部分资助(批准号:127-12703-224021021)。
利益冲突声明
作者声明没有利益冲突。
道德声明
本研究是根据卫生和家庭福利部药品管理总局国家控制实验室伦理委员会的要求进行的。ERC的号码是NC-AL-GNL-ERC-23-002/F1-01。
支持信息
| Filename | Description |
|---|---|
| iid31198-sup-0001-Text_and_data_not_for_publication.docx23.8 KB | Supporting information. |
Please note: The publisher is not responsible for the content or functionality of any supporting information supplied by the authors. Any queries (other than missing content) should be directed to the corresponding author for the article.
参考
1Carter J, Saunders VA. Virology: Principles and Applications [Internet]. Wiley (Symbian Press); 2007. https://books.google.com.bd/books?id=EKRgZCdr-74C
2 World Health Organization. Rabies [Internet]. 2023. https://www.who.int/health-topics/rabies#tab=tab_1
3Riccardi N, Giacomelli A, Antonello RM, Gobbi F, Angheben A. Rabies in Europe: an epidemiological and clinical update. Eur J Intern Med. 2021; 8: 15-20. http://www.ejinme.com/article/S0953620521001254/fulltext
4Finke S, Conzelmann KK. Replication strategies of rabies virus. Virus Res. 2005; 111(2): 120-131.
CASPubMedWeb of Science®Google Scholar
5 Rabies virus, complete genome: nucleotide. NCBI. 2023. https://www.ncbi.nlm.nih.gov/nuccore/9627197
6 World Health Organization. Rabies [Internet]. 2023. https://www.who.int/news-room/fact-sheets/detail/rabies
7Bordenave G. Louis Pasteur (1822-1895). Microbes Infect. 2003; 5: 553-560.
CASPubMedWeb of Science®Google Scholar
8 WHO. Human vaccines. 2023. http://web.archive.org/web/20121103135631/http:/www.who.int/rabies/vaccines/human_vaccines/en/index.html
9Ambrozaitis A, Laiskonis A, Balciuniene L, Banzhoff A, Malerczyk C. Rabies post-exposure prophylaxis vaccination with purified chick embryo cell vaccine (PCECV) and purified vero cell rabies vaccine (PVRV) in a four-site intradermal schedule (4-0-2-0-1-1): an immunogenic, cost-effective and practical regimen. Vaccine. 2006; 24(19): 4116-4121. https://www.sciencedirect.com/science/article/pii/S0264410X06002180
CASPubMedWeb of Science®Google Scholar
10 WHO. Weekly epidemiological record Relevé épidémiologique hebdomadaire. 2018;(16): 201-220.
11Hotez PJ, Molyneux DH, Fenwick A, et al. Control of neglected tropical diseases. N Engl J Med. 2007; 357(10): 1018-1027. https://www.who.int/teams/control-of-neglected-tropical-diseases/rabies/vaccinations-and-immunization
CASPubMedWeb of Science®Google Scholar
12Toovey S. Preventing rabies with the Verorab® vaccine: 1985–2005. Travel Med Infect Dis. 2007; 5(6): 327-348.
13Yu P, Huang Y, Zhang Y, Tang Q, Liang G. Production and evaluation of a chromatographically purified Vero cell rabies vaccine (PVRV) in China using microcarrier technology. Hum Vaccines Immunother. 2012; 8(9): 1230-1235.
CASPubMedWeb of Science®Google Scholar
14 World Health Organization. Field application of oral rabies vaccines for dogs: Report of a WHO consultation organized in collaboration with the Office International des Epizooties (OIE) World [Internet]. Who-emerging and other communicable diseases, surveillance and control. 2021. https://www.who.int/en/news-room/fact-sheets/detail/arsenic
15Maki J, Guiot AL, Aubert M, et al. Oral vaccination of wildlife using a vaccinia-rabies-glycoprotein recombinant virus vaccine (RABORAL V-RG®): a global review. Vet Res. 2017; 48(1): 57.
PubMedWeb of Science®Google Scholar
16Rodriguez-Morales A, Chacón-Cruz E, Husni R, Ulloa-Gutierrez R. WA Orenstein, PA Offit, KM Edwards, SA Plotkin, eds. Plotkin’s Vaccines. 8th ed., 2023.
17Miceli GS, Torroba J, Torres W, Esteves Madero J, Díaz AM. Evaluation of standard reagents for radial-immunodiffusion assays. Rev Inst Med Trop Sao Paulo. 2000; 42(3): 153-156.
18Cliquet F, Wasniewski M. The fluorescent antibody virus neutralization test. Current Laboratory Techniques in Rabies Diagnosis, Research and Prevention. Academic Press; 2015: 217-231.
19Toinon A, Moreno N, Chausse H, et al. Potency test to discriminate between differentially over-inactivated rabies vaccines: agreement between the NIH assay and a G-protein based ELISA. Biologicals. 2019; 60: 49-54. https://www.sciencedirect.com/science/article/pii/S1045105618303282
CASPubMedWeb of Science®Google Scholar
20Cliquet F, Aubert M, Sagné L. Development of a fluorescent antibody virus neutralisation test (FAVN test) for the quantitation of rabies-neutralising antibody. J Immunol Methods. 1998; 212(1): 79-87. https://www.sciencedirect.com/science/article/pii/S0022175997002123
CASPubMedWeb of Science®Google Scholar
21Rupprecht CE, Fooks AR, Abela-Ridder B. Laboratory Techniques in Rabies. Vol 1, 5th ed. World Health Organization; 2019: 304. https://www.who.int/rabies/resources/9789241515306/en/
22Commission BP. British pharmacopoeia 2019 [Internet]. Stationery Office; 2018. https://books.google.com.bd/books?id=7eQsuQEACAAJ
23Rupprecht CE, Fooks AR, Abela-Ridder B. Laboratory Techniques in Rabies. Vol 2. World Health Organization; 2019: 1-192. https://apps.who.int/iris/bitstream/handle/10665/310836/9789241515153-eng.pdf
24Mayner RE, Needy CF. Evaluation of the single radial-immunodiffusion assay for measuring the glycoprotein content of rabies vaccines. J Biol Stand. 1987; 15(1): 1-10.
25Williams MS. Single-radial-immunodiffusion as an in vitro potency assay for human inactivated viral vaccines. Vet Microbiol. 1993; 37(3-4): 253-262.
CASPubMedWeb of Science®Google Scholar
26 WOAH-World Organization for Animal Health. Rabies (infection with Rabies virus and other lyssaviruses). WOAH Terr Man 2023 [Internet]. 2023; 578-612. https://talk.ictvonline.org/ictv-reports/ictv_online_report/
27Hu R, Tang Q, Tang J, Fooks AR. Rabies in China: an update. Vector-Borne Zoonotic Dis. 2009; 9(1): 1-12.
PubMedWeb of Science®Google Scholar
28 World Health Organization. WHO expert committee on rabies [meeting held in Geneva from 24 to 30 September 1991]: eighth report [Internet]. World Health Organization; 1992. https://iris.who.int/handle/10665/39308
29Ferguson M, Schild GC. A single-radial-immunodiffusion technique for the assay of rabies glycoprotein antigen: application for potency tests of vaccines against rabies. J Gen Virol. 1982; 59(1): 197-201.
30Ferguson M, Seagroatt V, Schild GC. A collaborative study on the use of single radial immunodiffusion for the assay of rabies virus glycoprotein. J Biol Stand. 1984; 12(3): 283-294.
31Wood JM, Mumford J, Schild GC, Webster RG, Nicholson KG. Single-radial-immunodiffusion potency tests of inactivated influenza vaccines for use in man and animals. Dev Biol Stand. 1986; 64: 169-177.
32Volokhov DV, Furtak V, Allen C, et al. Robust humoral immune response against rabies virus in rabbits and guinea pigs immunized with plasmid DNA vectors encoding rabies virus glycoproteins: an approach to the production of polyclonal antibody reagents. Mol Cell Probes. 2022; 64:101833.
CASPubMedWeb of Science®Google Scholar
33Rajasekaran A. In vitro potency testing of rabies vaccines. Current Laboratory Techniques in Rabies Diagnosis, Research and Prevention, 2015; 2: 281-289.
34Dascalu MA, Wasniewski M, Picard-Meyer E, et al. Detection of rabies antibodies in wild boars in north-east Romania by a rabies ELISA test. BMC Vet Res. 2019; 15(1): 466.
PubMedWeb of Science®Google Scholar
35Gairola S, Gautam M, Waghmare S. A novel ELISA for quantification of glycoprotein in human rabies vaccines using a clinically proven virus neutralizing human monoclonal antibody. Hum Vaccines Immunother. 2020; 16(8): 1857-1865. doi:10.1080/21645515.2019.1709350
CASPubMedWeb of Science®Google Scholar
36Zhang X, Wu X, He Q, et al. Research progress on substitution of in vivo method(s) by in vitro method(s) for human vaccine potency assays. Expert Rev Vaccines. 2023; 22(1): 270-277. doi:10.1080/14760584.2023.2178421
CASPubMedWeb of Science®Google Scholar
37Ondrejková A, Suli J, Ondrejka R, et al. Comparison of the detection and quantification of rabies antibodies in canine sera. Vet Med (Praha). 2002; 47(8): 218-221.
CASWeb of Science®Google Scholar
38Yu P, Lv X, Shen X, Tang Q, Liang G. Establishment and preliminary application of a rapid fluorescent focus inhibition test (RFFIT) for rabies virus. Virologica Sinica. 2013; 28(4): 223-227.
39Xue X, Zheng X, Liang H, et al. Generation of recombinant rabies virus CVS-11 expressing eGFP applied to the rapid virus neutralization test. Viruses. 2014; 6(4): 1578-1589.
40Paquot A, Brochier B, Thomas I, Pastoret PP. Vaccination campaigns of the red fox (Vulpes vulpes) against rabies in Belgium: ingestion of vaccine baits by the red deer (Cervus elaphus), the roe deer (Capreolus capreolus) and the wild boar (Sus scrofa). Ann Med Vet. 1988; 132: 697-702.
41Cliquet F, Masson E, Aubert M. Consumption by wild boars of rabies vaccine baits distributed for foxes-trials on a wild population restricted in a hunting park. In: DE Annales, ed. Annales de medecine veterinaire. Vol 4000. Annales Medecine Veterinaire Universite Liege; 1995: 15-19.
42Vengušt G, Hostnik P, Cerovšek M, Cilenšek P, Malovrh T. Presence of antibodies against rabies in wild boars. Acta Vet Hung. 2011; 59(1): 149-154.
PubMedWeb of Science®Google Scholar
43Brucellosis OIE. Manual of diagnostic tests and vaccines for terrestrial animals. World Organisation for Animal Health. 2009;12-30.
44Wasniewski M, Almeida I, Baur A, et al. First international collaborative study to evaluate rabies antibody detection method for use in monitoring the effectiveness of oral vaccination programmes in fox and raccoon dog in Europe. J Virol Methods. 2016; 238: 77-85. https://www.sciencedirect.com/science/article/pii/S0166093416303408
CASPubMedWeb of Science®Google Scholar
45Robardet E, Cliquet F. Review of the analysis related to rabies diagnosis and follow-up of oral vaccination performed in NRLs in the EU, 2010. Rabies Bull Eur. 2011; 35: 11-14.
46Jakel V, König M, Cussler K, Hanschmann K, Thiel HJ. Factors influencing the antibody response to vaccination against rabies. Dev Biol (Basel). 2008; 131: 431-437. http://europepmc.org/abstract/MED/18634505
CASPubMedWeb of Science®Google Scholar
47Cliquet F, Verdier Y, Sagne L, et al. Neutralising antibody titration in 25,000 sera of dogs and cats vaccinated against rabies in France, in the framework of the new regulations that offer an alternative to quarantine. Revue Scientifique et Technique de l’OIE. 2003; 22(3): 857-866.
48Kennedy LJ, Lunt M, Barnes A, et al. Factors influencing the antibody response of dogs vaccinated against rabies. Vaccine. 2007; 25(51): 8500-8507. https://www.sciencedirect.com/science/article/pii/S0264410X07011541
CASPubMedWeb of Science®Google Scholar
49Mansfield KL, Sayers R, Fooks AR, Burr PD, Snodgrass D. Factors affecting the serological response of dogs and cats to rabies vaccination. Vet Rec. 2004; 154(14): 423-426.
CASPubMedWeb of Science®Google Scholar
50Taylor E, Banyard AC, Bourhy H, et al. Avoiding preventable deaths: the scourge of counterfeit rabies vaccines. Vaccine. 2019; 37(17): 2285-2287. https://www.sciencedirect.com/science/article/pii/S0264410X1930369X
PubMedWeb of Science®Google Scholar
51Tidman R, Fahrion AS, Thumbi SM, et al. United against rabies forum: the first 2 years. Front Public Heal. 2023; 11(3):1010071.
52Servat A, kempff S, Labadie A, Schereffer JL, Boué F, Cliquet F. In vivo potency tests of rabies inactivated vaccines for veterinary use. A 2-year retrospective analysis of data according to the criteria of the European Pharmacopoeia. Pharmeur Bio Sci Notes. 2008; 20: 655-664.
53Krämer B, Bruckner L, Daas A, Milne C. Collaborative study for validation of a serological potency assay for rabies vaccine (inactivated) for veterinary use. Pharmeuropa Bio Sci Notes. 2010; 2010(2): 37-55.
54Daas A, Milne C. Establishment of batch 4 of the Biological Reference Preparation (BRP) for rabies vaccine (inactivated) for veterinary use. Pharmeuropa Bio. 2004; 2004(1): 17-22.
55Moreira WC, Freitas JFS, Machado NS, Almeida AECC, Moura WC. Development and pre-validation of a quantitative multi-dose serological assay for potency testing of inactivated rabies vaccines for human use. J Virol Methods. 2019; 263: 54-59. https://www.sciencedirect.com/science/article/pii/S0166093418303276
CASPubMedWeb of Science®Google Scholar
56Machado NS, Moreira WC, Freitas J, Almeida A, Moura WC. Potency evaluation of rabies vaccine for human use: the impact of reducing the number of animals per dilution: part 2. Biologicals: J Int Associa Biol Standardization. 2020; 66: 30-34.
57Lin G, Chen S, Zhao H, et al. A time-resolved fluoroimmunoassay to assay the rabies virus glycoprotein: application for estimation of human rabies vaccine potency. Sci Rep [Internet]. 2017; 7(1): 1-9. doi:10.1038/s41598-017-07687-7
PubMedWeb of Science®Google Scholar



孟博士,您好!昨天小孩不相信碰到狗鼻子或者嘴巴,过10秒左右小孩跑过来我这边不小心狗唾液或者狗的鼻涕甩到我新鲜伤口上有风险的吗?
看医生
孟教授,您好!我于今年3月份注射狂犬疫苗加强针,4月8号在晚上逛时感觉后颈有东西碰到,但不疼也没发现蝙蝠,但是回来发现有两个疙瘩,怕是被蝙蝠咬的。打扰一下如果是蝙蝠咬的,我当前安全吗?(我在南京)谢谢啦
安全
请问我加强针多久可以不考虑任何抓咬