无血清纯化Vero细胞狂苗(PVRV-NG2)与两种已经上市的狂苗(PVRV; Verorab®)和(HDCV; Imovax Rabies®)的III期临床研究
Immunogenicity and Safety of a Purified Vero Rabies Vaccine – Serum Free, Compared With Two Licensed Vaccines, in a Simulated Rabies Post-Exposure Regimen in Healthy Adults in France: A Randomized Controlled Phase III Trial
Pineda-Peña AC, Jiang Q, Petit C, Korejwo-Peyramond J, Donazzolo Y, Latreille M, Homery MC, Babin V, Benamor S, Pichon S, Guinet-Morlot F, Minutello AM. Immunogenicity and Safety of a Purified Vero Rabies Vaccine – Serum Free, Compared With Two Licensed Vaccines, in a Simulated Rabies Post-Exposure Regimen in Healthy Adults in France: A Randomized Controlled Phase III Trial. Clin Infect Dis. 2024 Mar 13:ciae137. doi: 10.1093/cid/ciae137. Epub ahead of print. PMID: 38478634.
背景 下一代Vero细胞狂犬病疫苗(PVRV-NG2)是使用与上市的纯化Vero细胞疫苗(PVRV;Verorab®)和人二倍体细胞疫苗(HDCV; Imovax Rabies®)。
方法 这项在法国进行的双中心、改良双盲、III期研究评估了PVRV-NG2在模拟暴露后预防(PEP)方案中同时使用和不使用肌肉注射人狂犬病免疫球蛋白(HRIG)的免疫原性非劣效性和安全性,并与PVRV+HRIG和HDCV+HRIG进行了比较。年龄≥18岁的健康成年人(N=640)按照3:1:1:1的比例进行随机分组,分别接受PVRV-NG2疫苗+HRIG、PVRV疫苗+HRIG、HDCV疫苗+HRIG或PVRV-NG2疫苗(在第0、3、7、14和28天进行单次疫苗注射,适用组在第0天注射HRIG )。使用快速荧光灶抑制试验评估了疫苗接种前(D0)和接种后(D14、D28和D42)的抗狂犬病病毒中和抗体。如果PVRV-NG2+HRIG和PVRV+HRIG/HDCV+HRIG之间的比例差异的95%置信区间下限在第28天大于5%,则证明非劣效性(基于达到RVNA滴度 ≥0.5 IU/mL(主要目标)的参与者比例)。在最后一次注射后6个月内对安全性进行评估。
结果 与PVRV+HRIG和HDCV+HRIG相比,PVRV-NG2+HRIG的非劣性得到了证明。几乎所有参与者(99.6%,PVRV-NG2+HRIG;100%,PVRV+HRIG;98.7%,HDCV+HRIG;100%,仅PVRV-NG2)在第28天达到RVNA滴度≥0.5 IU/mL。同时使用HRIG的两组在所有时间点的几何平均滴度相似。PVRV-NG2疫苗和对照疫苗的安全性相似。
结论 在一个模拟的PEP环境中,PVRV-NG2+HRIG显示出与目前的标准护理疫苗相当的免疫原性和安全性。
临床试验注册。NCT03965962。
关键词。狂犬病;免疫原性;PVRV-NG2;暴露后预防;安全。
介绍
狂犬病每年在全球造成约59000人死亡,其中约95%发生在亚洲和非洲【1,2】。狂犬病几乎总是致命的【3】。疫苗是最有效的预防措施,用于高危个体的暴露前预防或暴露于潜在狂犬病动物的个体的暴露后预防(PEP)【4】,根据国家指南,在某些情况下与狂犬病免疫球蛋白联合使用。因此,提供狂犬病疫苗是预防狂犬病死亡的重要因素。目前,有几种特性良好的许可疫苗,包括纯化的Vero细胞疫苗(PVRV;Verorab®、赛诺菲)和人二倍体细胞疫苗(HDCV Imovax Rabies®,赛诺菲)【5、6】。
为了保障狂犬病疫苗的供应,开发了下一代PVRV狂犬病疫苗(PVRV-NG、赛诺菲)。PVRV-NG是一种不含血清和抗生素的高纯度Vero细胞狂犬病疫苗,使用与许可的HDCV和PVRV疫苗相同的Pitman–Moore病毒株开发。与已获许可的Vero细胞狂犬病疫苗相比,PVRV-NG的残留DNA含量更低(<100皮克/剂),且不含动物/人类来源的原料,从而将污染风险降至最低【7-9】,符合当前世界卫生组织(WHO)和欧洲药品管理局的建议【10,11】。已经开发了两种PVRV-NG配方:PVRV-NG和PVRV-NG2【9,12-15】【世卫组织通用试验编号:U1111-1117-7447;稿件已提交】。基于与HDCV相似的免疫原性和安全性特征,PVRV-NG2公司被选为III期研究的评估对象【15】。
这项III期研究评估了在健康成人中与人狂犬病免疫球蛋白(HRIG)作为模拟PEP共同给药时,PVRV-NG2疫苗与标准护理疫苗(PVRV和HDCV)相比的免疫原性非劣效性。还评估了PVRV-NG2作为独立疫苗的安全性和免疫原性。
方法
参与者
这是一项III期、改良、双盲、对照、随机研究,于2019年7月1日至2021年1月19日在法国的2个中心进行(NCT03965962)。年龄≥18岁的健康成年人有资格入选。主要排除标准是狂犬病暴露的高风险以及在研究疫苗接种前后4周内接受过任何狂犬病疫苗或任何疫苗;在线的“方法”部分提供了排除标准的完整列表补充材料。参与者在D0和D56(活动阶段)之间总共接受了7次随访监测,6个月后进行了一次电话安全随访。
伦理学
本研究符合赫尔辛基宣言和国际人用药品技术要求协调委员会制定的标准、良好临床实践使用指南以及所有地方和/或国家法规和指令。在执行任何研究程序之前,已获得参与者的知情书面同意。
随机化和盲法
参与者按照3:1:1:1的比例随机分组,使用带有置换模块的交互式语音应答/网络应答系统接受PVRV-NG2+HRIG、PVRV+HRIG、HDCV+HRIG或PVRV-NG2单独治疗。参与者按研究中心分层。对于伴有HRIG的3个组,参与者、研究人员、安全性或实验室结果评估人员和主办方人员对接种的疫苗不知情,而PVRV-NG2单独以公开方式接种疫苗。接种疫苗的人员未被隐藏。
疫苗和HRIG
根据模拟PEP Essen方案,所有参与者在研究期间计划接受五次疫苗注射,在第0天、第3天、第7天、第7天、D14和第28天各注射一次【16,17】。在第0天对PVRV-NG2+HRIG、PVRV+HRIG和HDCV+HRIG组的参与者使用HRIG。PVRV -NG2、PVRV和HDCV以冻干粉的形式提供,需要在使用前立即用0.5毫升(PVRV-NG2和PVRV)或1毫升(HDCV)稀释剂复溶。每剂疫苗含有≥2.5 IU的灭活狂犬病病毒(Wistar Rabies Pitman Moore/WI 38 1503-3M毒株),使用美国国立卫生研究院(NIH)效力试验确认并发布【16】。如前所述,通过酶联免疫吸附试验(ELISA)测量每种疫苗的抗原含量【18,19】。所有批次的实际抗原含量如下:PVRV-NG2(批号:S4497)为8.0IU/剂,PVRV(R1B31)为2.7IU/剂,HDCV(分别为P1E78和T1G37)为7.3和7.6IU/剂。疫苗通过肌肉注射到上臂的三角肌区域。随后的注射在交替侧进行,距离前一次注射部位至少3厘米。HRIG作为理论浓度为150 IU/mL的即用型溶液提供,用于以20 IU/Kg体重进行肌肉注射。总的HRIG体积被分成几份,在大腿前外侧至少相隔3 cm的不同部位给药(该部位远离疫苗注射部位,以尽量减少干扰)。
免疫原性评估
参与者在第一次疫苗接种前在D0(基线滴度)、D14、D28和D42提供血样,以使用快速荧光灶抑制试验(RFFIT)测量抗狂犬病病毒中和抗体滴度(RVNA)【20,21】。RVNA滴度以IU/mL报告。计算RVNA几何平均滴度。
安全评估
所有参与者都有一张日记卡来记录他们的反应。每次疫苗接种后7天记录征求注射部位的反应。在第一次和第二次疫苗接种之间、第二次和第三次疫苗接种之间以及每次剩余疫苗接种后的7天内记录征求的全身反应。在每次接种疫苗后的28天内记录主动注射部位反应。在每次疫苗接种之间以及最后一次疫苗接种后的28天内记录自发的系统不良事件(AE)。在最后一次接种疫苗后长达6个月的整个研究期间,记录了严重不良事件(SAE)、特别关注的不良事件(AESI)和妊娠病例。接种疫苗后30分钟内发生的AE和ARs被归类为立即发生。
统计分析
主要目的是证明在与HRIG联合用药时,PVRV-NG2与PVRV和HDCV相比的非劣效性,即在第28天达到RVNA滴度≥0.5 IU/mL的参与者比例。如果PVRV-NG2+HRIG组与每种比较疫苗(PVRV+HRIG和HDCV+HRIG)之间的比例差异的95%置信区间(CI)下限在第28天大于5%,则证明主要目标的非劣效性。比例差异的95%置信区间是在没有连续性校正的情况下使用威尔逊评分法计算的【22】。
次要目标是证明PVRV-NG2+HRIG组的充分性,并描述PVRV-NG2、HDCV和PVRV与HRIG联合用药以及PVRV-NG2单独用药在所有时间点诱导的免疫反应。如果PVRV-NG2+HRIG组参与者在第28天达到RVNA滴度 ≥0.5 IU/mL(世卫组织充分免疫应答标准)的比例的95%置信区间下限≥95%,则证明充分性。我们还使用免疫实践咨询委员会(ACIP)标准【17】(即在RFFIT检测中所有时间点血清稀释度为1:5时完全中和的参与者比例)研究了狂犬病疫苗接种反应充分的证据。
在线的“方法”部分包含了样品量计算和分析组的全部详细信息补充材料。主要在符合方案分析集(PPAS)中评估主要和次要免疫原性目标。结果在全分析集(FAS)和免疫原性全分析集(FASI)中得到确认,免疫原性全分析集是FAS的子集,但排除了D0滴度缺失或滴度≥0.5 IU/mL的参与者(方法,在线补充材料).对所有接种≥1剂疫苗的参与者进行了安全性目标评估(安全性分析集;SafAS)。对于免疫原性和安全性参数,使用单一比例的精确二项分布(克洛普-皮尔逊法)计算比例点估计的95%置信区间。
使用SAS企业指南5.1版软件进行统计分析。
结果
参与者
总的来说,640名参与者被纳入并随机分组(PVRV-NG2+HRIG,n = 320;PVRV+HRIG,n = 107;HDCV+HRIG,n = 107;仅PVRV-NG2,n=106),其中594人(92.8%)完成了活动阶段(图1)。活动阶段研究中止的主要原因是方案偏差(n=40),其次是参与者退出(n=4)、失访(n=1)和AE(n = 1)(图1)。参与者的基线特征在FAS的各个研究组中相似(表1)和电力采购协议(补充表1).大多数(95.6%)参与者是高加索人/白人;59.7%为女性,平均年龄为46.2岁。
免疫原性
在PPAS中,与PVRV+HRIG组(差异0.42%,95%可信区间2.33%,4.35%)和HDCV+HRIG组(差异0.86%,95%可信区间1.32%,6.50%)相比,PVRV-NG2+HRIG组在第28天达到RVNA滴度≥0.5 IU/mL的参与者比例方面表现出非劣效性(表2)。在FAS和FASI人群中也观察到非劣效性(结果部分,在线补充材料)。
在PVRV-NG2+HRIG组中证明了充分性,99.6%(95%可信区间97.7%,100.0%)的参与者在第28天达到RNVA滴度≥0.5 UI/mL。在每个时间点,所有组中RVNA滴度 ≥0.5 IU/mL的参与者比例相似(图2)。在D14达到RVNA滴度≥0.5 IU/mL的参与者比例从PVRV+HRIG组的88.0%(95%可信区间78.4%,94.4%)到PVRV-NG2组的97.1%(95%可信区间89.9%,99.6%)不等。在第28天,达到RVNA滴度≥0.5 IU/mL的参与者比例为98.7%(95%可信区间为93.1%;100%)到100%(95%置信区间95.3%;100%)。在PVRV+HRIG和PVRV-NG2单独组中;两名参与者(PVRV-NG2+HRIG组和HDCV+HRIG组各一名)未达到RVNA滴度≥0.5 IU/mL。在第42天,PVRV-NG2+HRIG组、PVRV+HRIG组和PVRV-NG2单独组的所有参与者,以及HDCV+HRIG组的98.7%(95% CI 92.9%;100%)的RVNA滴度≥为0.5IU/mL(图2)。来自HDCV+HRIG组的参与者在第28天未达到RVNA滴度≥0.5 IU/mL,属于在第42天未达到RVNA滴度≥0.5 IU/mL的参与者(结果部分,在线补充材料)。
在同时服用HRIG的各组中,RVNA GMT相似,但在所有疫苗接种后时间点,PVRV-NG2单独用药组高于其他组(图3;表3)。
在每个时间点,所有组中根据ACIP标准达到完全中和的参与者比例相似(补充表2)。在D14,PVRV-HRIG组中所有测定的1:5稀释完全中和的参与者和其他3组中98.7%测定的1:5稀释完全中和的参与者报告完全中和。在第28天,几乎所有在1:5稀释时确定中和的参与者都报告了完全中和(HDCV+HRIG组为98.7%,PVRV-NG2+HRIG、PVRV+HRIG和PVRV-NG2单独组为100%)。在第42天,所有组中的所有参与者都在1:5稀释度下实现了完全确定的中和。
安全
研究期间未观察到重大安全问题(补充表3;补充表4).四名参与者报告了至少一次即时主动不良事件,首选术语为“晕厥”或“晕厥前期”(PVRV-NG2+HRIG,n = 3/320;PVRV-NG2单独,n = 1/104);没有一个被认为与疫苗有关(补充表3).
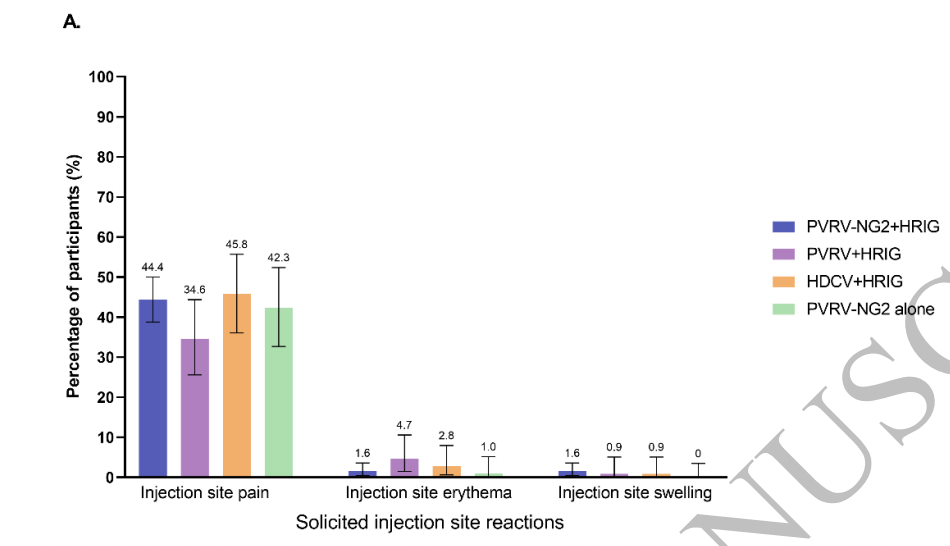
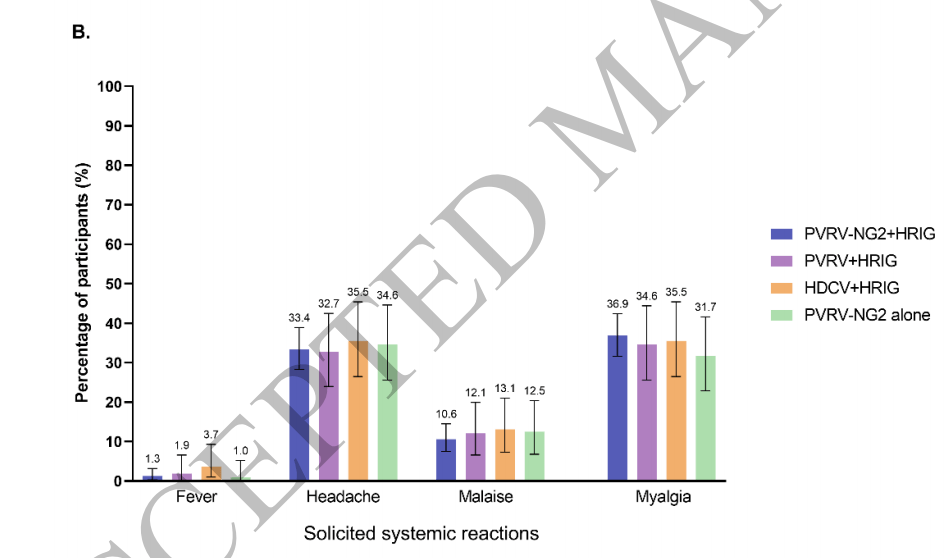
报告至少一个征求意见的参与者比例在各组中相似,在57.0%和63.4%之间(补充表3)。最常见的注射部位反应是疼痛(图4a),最常见的全身反应是头痛(图4b)。大多数征求反应的强度为轻度至中度,并在3天内得到解决。一名参与者报告称,HDCV+HRIG组在第四次注射后第28天出现3级注射部位反应,该反应在未经治疗的情况下于2天内消退。8名参与者报告了3级全身反应:PVRV-NG2+HRIG组3/320,PVRV+HRIG组2/107,HDCV+HRIG组1/107,PVRV-NG2单独组2/104(补充表3)。在每次后续疫苗接种后,报告征集反应的参与者比例下降(补充表4)。
在各组中,在D28之前报告的主动ARs的比例从5.6%到10.3%不等(补充表3)。大多数为1级严重程度,并在接种疫苗后3天内解决。PVRV-NG2+HRIG组中的一名68岁女性报告了2例ARs(中度腹痛和中度腹泻)。她接受了药物治疗并停止了研究。没有其他AE导致研究中止。
研究期间,11名参与者报告了12例严重不良事件(PVRV-NG2+HRIG,n = 4;PVRV+HRIG,n = 4;和PVRV+NG2单独,n = 3;补充表3)。来自PVRV+HRIG组的不同参与者的两例SAE被研究者视为与研究疫苗相关,但被主办方评估为无关。一名参与者在第五剂后38天报告了运动障碍,另一名参与者在第五剂后14天报告了总体身体健康状况恶化。没有研究终止的病例,所有参与者都康复了。研究期间未报告AE或死亡。
讨论
这项III期研究首次在第28天证明了PVRV- NG2疫苗相对于标准护理疫苗PVRV和HDCV的免疫原性非劣效性,同时将HRIG作为模拟5剂PEP Essen方案在成人中给药。PVRV-NG2+HRIG的充分性也在第28天得到了证明,因为达到RVNA滴度≥0.5 IU/mL的参与者比例的95%置信区间下限为≥95%。与PVRV+HRIG和HDCV+HRIG相比,PVRV-NG2+HRIG和PVRV-NG2单独具有相似的免疫原性和安全性。
HDCV现已在15个国家获得许可,PVRV已在全球约80个国家获得许可,其安全性、免疫原性和有效性已得到公认,这已被30多年的上市后经验所证明。
在PPAS中,2名参与者(1名在PVRV-NG2+HRIG组,1名在HDCV+HRIG组)在第28天没有达到RVNA滴度≥0.5 IU/mL。到第42天(第五次疫苗接种后14天),除了HDCV+HRIG组的一名81岁男性外,所有参与者的RVNA滴度均≥0.5 IU/mL。尽管免疫衰老可能至少部分解释了在81岁男性中观察到的免疫反应降低,但额外的测试并未显示这2名患者存在任何免疫抑制疾病【4,17,23】。先前的研究还报告了少量针对狂犬病【24-26】和其他疾病【27,28】的许可疫苗的低反应或慢反应或无反应,而不存在已知的基础或免疫抑制疾病。免疫机制尚不清楚,很可能与宿主相关而非疫苗相关【27,28】。
在第一次接种疫苗后14天内,伴随HRIG组的参与者中RVNA滴度≥0.5 IU/mL的比例(在88.0%和94.1%之间)与之前评估健康参与者或怀疑接触狂犬病的参与者的许可狂犬病疫苗的研究结果一致【5,25,29-33】。这些先前研究中的一些参与者也未能达到RVNA滴度≥0.5 IU/mL,无论是否使用狂犬病疫苗以及使用不同的PEP方案【30-34】。参考实验室的经验支持了这一点,其中1.4%至13%的参与者未达到阈值【32,35,36】,此前在PVRV-NG临床开发期间进行的研究(世卫组织通用试验编号: U1111-1117-7447;手稿正在编写中】【15】。在我们的研究中,几乎所有参与者都报告了疫苗接种后所有时间点的完全中和(研究准备时的ACIP标准)。然而,由于在最近的许可狂犬病疫苗研究中观察到RVNA滴度略有下降的趋势,因此很难与早期的狂犬病疫苗临床研究进行比较【34】。在最近的研究中观察到RVNA滴度较低的原因可能是多因素的,可能包括中和或血清转化阈值的不同定义、HRIG干扰以及由于缺乏标准化或所用参考文献的差异而导致的不同实验室间RFFIT的可变性..然而,RFFIT测量抗体作为保护的替代物,尚不清楚低于推荐阈值的水平是否足以提供保护【36】。
在这项研究中,在D14达到RVNA滴度 ≥0.5 IU/mL的参与者比例在PVRV-NG2组高于PVRV-NG2+HRIG组或其他合并HRIG的组,这表明HRIG的干扰。这与之前的非临床观察结果一致【37】。HRIG干扰的影响不太可能具有临床意义,因为HRIG本身会提供即时保护【32,38,39】。在这项模拟PEP研究中,根据ACIP指南【17】,HRIG剂量基于150 IU/mL的最低理论效价,但实际HRIG效价为189.95 IU/mL。与ACIP指南相反,英国指南建议根据HRIG批次的真实效价而不是最低理论效价来确定HRIG剂量,以避免高HRIG水平可能导致干扰和抑制对狂犬病疫苗的免疫反应【40,41】。
PVRV-NG2单独使用或与HRIG联合使用时耐受性良好。PVRV-NG2+HRIG组报告的AE频率和严重程度与其他组相似。与其他组相比,PVRV+HRIG组出现的频率更高,但差异无统计学意义。所有严重不良事件均已解决,无一例导致研究终止。未发现新的安全性问题。PVRV-NG2的安全性与调查该疫苗的早期II期研究一致(NCT03145766)。
这项模拟PEP研究有局限性。该研究是在健康成人中进行的,因此不能反映世卫组织建议的伤口周围联合使用HRIG的实际情况;然而,根据ACIP指南【17】,注射了全部剂量。我们的研究也缺乏持久性数据,该数据将被纳入一项配套研究(NCT04127786)。这项研究的优势包括评估主要目标的高统计能力和使用经验证的RFFIT技术【21,42】。
结论
这项研究表明,与标准护理疫苗相比,与HRIG同时接种的下一代狂犬病疫苗PVRV-NG2的免疫原性非劣效性。PVRV-NG2的安全性状况良好,4组不良事件的频率和严重程度相当,未发现新的安全性问题.
笔记
致谢。作者要感谢参与这项研究的志愿者。英国伦敦施普林格医疗保健有限公司的科学传播博士霍利·麦卡利斯特和朱丽叶·格雷为手稿的编写提供了编辑帮助。赛诺菲公司为这项援助提供了资金。作者代表赛诺菲感谢Anirban Sanyal博士和Gouthami Kannabattula的编辑协助和稿件协调。
作者投稿。ACPP、CP、SP、FGM、JK和AMM参与了概念和研究设计。ACPP、QJ、CP、JK、YD、ML、MCH、VB、SB、FGM和AMM参与了数据采集、分析和解释。VB参与了监测活动的协调。所有作者都认可了这份手稿的最终版本。
提供资金. 这项研究由赛诺菲公司资助和赞助。赛诺菲参与了研究设计并管理研究的所有操作方面,包括数据收集、分析和解释、本文的准备以及提交文章进行出版的决定。
潜在利益冲突。ACPP、QJ、CP、JKP、VB、SB、SP、FGM和AMM是赛诺菲的员工,可能持有公司的股份和/或股票期权。所有其他作者声明没有利益冲突。YD作为其中一个调查点的调查员和首席执行官报告了其他财务或非财务利益。
数据共享声明:合格的研究人员可以要求访问患者水平数据和相关研究文件,包括临床研究报告、研究方案及任何修订、空白病例报告表、统计分析计划和数据集规格。患者层面的数据将被匿名化,研究文件将被编辑以保护试验参与者的隐私。
有关赛诺菲数据共享标准、合格研究和访问征求流程的更多详情,请访问:https://www.vivli.org/.
数据的先前显示:该研究在2022年美国热带医学和卫生学会上发表(发表编号:l B- 5464;海报会议C;https://www . EMA . Europa . eu/en/miniming-risk-transmission-animal-spongiform-encephalopathy-agents-human-veterinary-medical)。
关键点:下一代狂犬病疫苗PVRV-NG2在健康成年人的模拟暴露后预防III期试验中与人狂犬病免疫球蛋白共同给药或作为独立疫苗给药时,显示出与标准护理疫苗相比的免疫原性非劣效性和良好的安全性。
参考
1.汉普森·K,库德维尔·L,伦博·T,等:<地方性犬狂犬病的全球负担评估》。PLOS没有太多2015;9(4):e 0003709。
2.世界卫生组织(世卫组织)。狂犬病流行病学和负担。可从以下网址获得:
https://www.who.int/activities/improving-狂犬病/狂犬病流行病学和负担数据。2023年1月接入。
3.世界卫生组织(世卫组织)。狂犬病。可从以下网址获得:https://www.who.int/news房间/概况/细节/狂犬病。2023年1月接入。
4.世界卫生组织(世卫组织)。狂犬病疫苗:世卫组织立场文件–2018年4月,2018 .
5.王世元,孙建峰,刘平,等。人二倍体细胞疫苗的免疫原性和安全性
(HDCV)与纯化Vero细胞疫苗(PVRV)与纯化鸡胚细胞疫苗(PCECV)用于暴露后预防:一项系统综述和荟萃分析。流感疫苗免疫疗法2022; 18(1): 2027714.
6.用Verorab®疫苗预防狂犬病:1985 -2005年20年的临床经验。旅行医学和传染病2007; 5(6): 327-48.
7.帕慕科格鲁特。基于ARisk的建立无动物成分设施的方法,2009 2009年12月1日
8.普罗特金、罗宾逊·JM、坎宁安·G、伊克巴尔·R、拉森<疫苗生产的复杂性和成本——概述》。疫苗2017; 35(33): 4064-71.
9.根据中国健康儿童和成人的暴露后方案接种下一代无血清高纯度Vero细胞狂犬病疫苗,其安全性和免疫原性与参考疫苗Verorab®相同。疫苗2013; 31(50): 5940-7.
10.世界卫生组织(世卫组织)。关于传染性海绵状脑病的世卫组织指南
与生物和药物产品相关的脑病。日内瓦:世界卫生组织,2003 .
11.欧洲医药机构。将传播动物海绵状血管瘤的风险降至最低通过人用和兽用药品传播的脑病因子-科学指南可从以下网址获取:https://www . EMA . Europa . eu/en/documents/scientific-guideline/minimizing-risk-transmission-animal-spongiform-encephalopathy-agents-human-veterinary-medicinal _ en . pdf。
12.Pichon S,Guinet-Morlot F,Minutello M,等。一种无血清纯化vero细胞狂犬病疫苗在健康成人暴露前使用时与参考疫苗Verorab®一样安全且具有免疫原性:一项随机对照II期试验的结果。疫苗2013; 31(18): 2295-301.
13.健康成人接种无血清纯化Vero狂犬病疫苗的安全性和免疫原性:一项随机II期暴露前预防研究。疫苗2022; 40(33): 4780-7.
14.QuiambaoB,Montalban C,MinutelloAM,等。无血清纯化Vero狂犬病疫苗对儿童安全且具有免疫原性:一项随机II期暴露前预防方案研究的结果。疫苗2022; 40(35): 5170-8.
15.Pichon S,Guinet-Morlot F,Saleh J,等。三种剂量水平的高纯度Vero细胞狂犬病疫苗的安全性和免疫原性:一项在健康成人中采用模拟暴露后方案的随机、对照、观察者盲法II期研究。人类疫苗免疫疗法2023; 19(3): 2275453.
16.世界卫生组织。世卫组织狂犬病专家咨询:第二次报告。日内瓦:世界卫生组织,2013 .
17.Rupprecht CE,Briggs D,Brown CM,等
暴露后预防预防人类狂犬病:免疫实践咨询委员会的建议。MMWR建议和报告:发病率和死亡率每周报告建议和报告2010;59(Rr-2):1-9。
18.莫格奥克斯,波里耶布,拉冈,等。使用ELISA进行体外糖蛋白定量检测替代体内人狂犬病疫苗效力检测-一项国际研究的结果
协作学习。疫苗2017; 35(6): 966-71.
19.夏博-里乌M,莫雷诺N,金查德F,等。基于G蛋白的ELISA作为狂犬病疫苗的效力试验。生物制品:国际生物标准化协会杂志2017; 46: 124-9.
20.史密斯JS,雅戈PA,贝尔总经理。一种快速可重复的狂犬病中和抗体检测方法。世界卫生组织公报1973; 48(5): 535-41.
21.快速荧光灶抑制试验的优化和验证:狂犬病病毒中和抗体检测方法的改进。免疫学方法杂志2019; 474: 112626.
22.纽科姆公园。独立比例差异的区间估计:十一种方法的比较。医学统计学1998; 17(8): 873-90.
23.Soentjens P,Croughs M,BurmC等。狂犬病免疫球蛋白的给药时间和暴露后预防的抗体反应的充分性:比利时的一项描述性回顾性研究。临床学报2021; 76(2): 91-7.
24.Audran R .,Depraetere G .,Genton B .,Spertini F .,Uwanyiligira M .,市长C ea。狂犬病暴露后预防的免疫反应差:试图了解潜在的机制。JSM热带医学研究中心2016 .
25.Uwanyiligira M,Landry P,Genton B,de Valliere S .鉴于新的疾病控制和预防中心和世界卫生组织,狂犬病暴露后预防在常规实践中的应用组织建议。临床感染疾病2012; 55(2): 201-5.
26.Sudarshan M,Ravish H,Ashwathnarayana D .先前接种疫苗的受试者再次暴露于狂犬病后加强疫苗接种的时间间隔。亚洲生物医学2011; 5: 589-93.
27.Wiedermann U,Garner-Spitzer E,Wagner A .常规疫苗接种失败的原因和对策?人类疫苗免疫疗法2016; 12(1): 239-43.
28.亚普XZ,麦考尔MBB,绍尔温RW。快速和激烈对缓慢和平稳:在受控人类疟疾感染模型中对疟原虫免疫反应的异质性。免疫Rev2020; 293(1): 253-69.
29.Gogtay NJ,Munshi R,Ashwath Narayana DH,等。新型人类狂犬病的比较抗人狂犬病免疫球蛋白单克隆抗体用于暴露后预防:一项2/3期随机、单盲、非劣效性对照研究。临床感染疾病2018; 66(3): 387-95.
30.印度和德国生产的纯化鸡胚细胞狂犬病疫苗的免疫原性和安全性比较:一项随机、单盲、多中心、IV期临床研究。人类疫苗免疫疗法2017; 13(7): 1531-8.
31.Preiss S,Chanthavanich P,Chen LH,等。狂犬病暴露后预防纯化鸡胚细胞疫苗:系统文献综述和荟萃分析。专家Rev疫苗2018; 17(6): 525-45.
32.Matson MA,Schenker E,Stein M,Zamfirova V,Nguyen HB,Bergman GE。人免疫球蛋白模拟暴露后预防的安全性和有效性结果(HRIGKEDRAB)与活性疫苗在健康受试者中共同给药:一项2/3期对比试验。人类疫苗免疫疗法2020; 16(2): 452-9.
33.Hobart-Porter N,Stein M,TohN,AmegaN,Nguyen HB,Linakis J .疑似暴露的儿童患者使用狂犬病免疫球蛋白的安全性和有效性。人类疫苗免疫疗法2021; 17(7): 2090-6.
34.莫雷利F,奥加德C,布瑞H,等。狂犬病疫苗在暴露后的免疫原性预防(PEP)或模拟PEP方案:系统文献综述和荟萃分析。在美洲第三十三届拉比亚会议上发表;
https://wwwrabiesintheamericasorg/previous-meetings。墨西哥,2022 .
35.加州汉伦市摩尔SM。狂犬病特异性抗体:测量预防致命疾病的替代物。PLoS Negl Trop Dis2010;4⑶:e595。
36.摩尔SM。狂犬病血清学的挑战:定义解释的背景。病毒2021; 13(8): 1516.
37.Bernard M-C,Boudet F,Pineda-peaa-C,Guinet-Morlot F .同时给予狂犬病免疫球蛋白对商品和候选人狂犬病疫苗在仓鼠中免疫原性的抑制作用。科学报告2022; 12(1): 6570.
38.Loofbourow JC,Cabasso VJ,Roby RE,Anuskiewicz W .狂犬病免疫球蛋白(人)。临床试验和剂量确定。睡衣裤1971; 217(13): 1825-31.
39.布克斯塔弗铅,阿克普诺努P,阮血红蛋白,天鹅JT,豪温顿燃气轮机。施用狂犬病免疫球蛋白:改善伤口浸润的循证指导。药物疗法2021; 41(8): 644-8.
40.UHS代理处。狂犬病暴露后管理指南可从以下网址获得:
https://assets.publishing.service.gov。uk/government/uploads/system/uploads/attachment _ data/file/1 037545/Guidelines _ on _ rabies _ post-exposure _ treatment January _ 2021 . pdf。
41.英国健康安全局。狂犬病暴露后管理指南。可从以下网址获得:
https://assets.publishing.service.gov。uk/government/uploads/system/uploads/attachment _ data/file/1 127806/uk HSA-狂犬病指南-暴露后治疗-2023年1月。pdf
42.Timiryasova TM,Hodge SA,Zheng L,等。用于狂犬病快速荧光灶抑制试验的内部狂犬病参考标准的制备和鉴定。科学报告2020; 10(1): 9893.
表1.基线人口统计(全分析集)
参见原文
表2.PVRV-NG2与PVRV和HDCV相比的非劣效性:D28时RVNA滴度≥0.5 IU/mL的参与者比例(符合方案的分析集)
|
PVRV-NG2+HRIG N=239 |
PVRV+HRIG
N=77 |
HDCV+HRIG
N=78 |
PVRV-NG2+HRIG
–PVRV+HRIG |
PVRV-NG2+HRIG HDCV+HRIG |
||||||
|
n/M |
%
(95%CI) |
n/M | % (95%CI) | n/M | % (95%CI) | 差异%(95%CI) | 非劣 | 差异%(95%CI) | 非劣 | |
| RVNA
IU/mL |
238/239 | 99.6
(97.7100) |
77/77 | 100
(95.3,100) |
77/7
8 |
98.7
(93.1, 100) |
-0.42
(-2.33, 4.35) |
是 | 0.86
(-1.32, 6.5) |
是 |
缩写:CI,置信区间;M,具有端点可用数据的参与者数量;n,达到RVNA滴度≥0.5 IU/mL的参与者人数;N,每个协议分析集中的参与者数量;RFFIT,快速荧光灶抑制试验。
表3.RNVA几何平均滴度(每方案分析集)
|
PVRV-NG2+HRIG N=239 |
PVRV+HRIG
N=77 |
HDCV+HRIG
N=78 |
PVRV-NG2 N=77 |
|
| D14(第3剂后7天) | ||||
| M |
213 |
75 | 68 |
69 |
| GMT (95% CI) |
2.40 (2.09, 2.76) |
1.86 (1.44, 2.41) | 1.83 (1.46, 2.28) |
5.41 (4.24,6.90)
|
|
范围 (最小值,最大值) |
0.17–33.30 | 0.30–38.10 | 0.14– 16.50 |
0.20–48.40 |
| D28(第4剂后14天) | ||||
| M |
239 |
77 | 78 |
77 |
| GMT (95% CI) |
6.49 (5.75, 7.34) |
5.03 (3.94, 6.44) | 5.51 (4.35, 6.96) |
12.4 (10.5,14.5) |
| 范围
(最小值,最大值) |
0.35–235.00 |
0.67–132.00 | 0.10–95.70 |
2.41–54.20 |
| D42(第5剂后14天) | ||||
| M |
226 |
74 | 76 |
76 |
| GMT (95% CI) |
13.60 (12.30,15.0) |
9.47 (7.96, 11.30) | 10.70 (8.97,12.70) |
19.80 (17.50,22.5) |
|
范围 (最小值,最大值) |
1.14– 171.00 |
2.04–68.30 | 0.30–77.90 |
5.86–78.80 |
缩写:CI,置信区间;GMT,几何平均滴度;N,每个协议分析集中的参与者数量;M,具有相关终点数据的受试者人数
图例
图1.参与者的配置。
*两名随机接受PVRV-NG2单独治疗的参与者无意中接受了PVRV- NG2+HRIG治疗。每次访视的N差异并不反映N中断,因为少数受试者缺席了一次访视,但通过参加额外的访视完成了活动阶段。一名参与者缺席了一次访视,并在停药前参加了第二次访视。d,日;M,月。
参见原文
图2.按疫苗接种组(PPAS)划分,在D14、D28和D42RVNA 滴度≥0.5 IU/mL的参与者百分比。
d,日;RVNA,狂犬病病毒中和抗体。

图3.疫苗接种组(PPAS)在D14、D28和D42的RVNA几何平均数。
d,日;GMT,几何平均滴度;PPAS,每协议分析集。

图4.任何疫苗注射后7天内出现征求注射部位反应(A)或征求全身反应(B)的参与者百分比(SafAS)。安全分析
图形摘要




