
| 世界卫生组织技术报告系列 |
世界卫生组织狂犬病专家磋商会
第三版报告
世界卫生组织
| 世界卫生组织相关出版物选编 |
| 世界卫生组织关于狂犬病疫苗的意见书
《流行病学周报》,2010年,85:309-320 世界卫生组织狂犬病专家磋商会第二版报告 日内瓦,世界卫生组织,“2013年世界卫生组织技术报告系列”,第982号 世界卫生组织狂犬病专家磋商会第一版报告 日内瓦,世界卫生组织,“2005年世界卫生组织技术报告系列”,第931号 世界卫生组织狂犬病专家委员会第八版报告 日内瓦,世界卫生组织,“1992年世界卫生组织技术报告系列”,第824号 狂犬病实验室检测技术第四版 日内瓦,世界卫生组织,1996年 |
| 更多相关信息及其他世界卫生组织出版物参见
世界卫生组织出版社,瑞士日内瓦27(邮编:1211) ▪ www.who.int/bookorders 电话: + 41 22 791 3264;传真:+ 41 22 791 4857;电子邮箱:bookorders@who.int |
 世界卫生组织技术报告系列
世界卫生组织技术报告系列
1012
世界卫生组织狂犬病专家磋商会
第三版报告
本报告包含国际专家组的集体意见,不一定代表世界卫生组织的决定或公开政策
世界卫生组织
卫生组织
世界组织狂犬病专家磋商会第三版报告
(世界卫生组织技术报告系列第1012号)
ISBN 978-92-4-121021-8
ISSN 0512-3054
©世界卫生组织,2018年
保留部分权利。本文件可通过知识共享署名许可协议 – 非商业性使用 – ShareAlike 3.0 IGO许可下获得(CC BY-NC-SA 3.0 IGO ;https://creativecommons.org/ licenses/by-nc-sa/3.0/igo)。
根据上述许可证条款,可对本文件进行非商业目的的复制、分发和改编,但应按下述要求引用本文件。使用本文件时,不可暗示世界卫生组织认可了任何特定组织、产品或服务。不可使用世界卫生组织的徽标。如对本文件进行改编,则改编作品须使用相同或相当的“知识共享许可证”。如对本文件进行翻译,除注明建议使用的索引外,还应注明以下免责声明:“译文不是由世界卫生组织(WHO)提供。世界卫生组织不对译文的内容或准确性负责。内容以英文版原文为准。”
对于任何与许可证相关的纠纷,将按照世界知识产权组织(http://www.wipo.int/amc/en/mediation/rules)的调解规则进行调解。
建议使用的索引。世界卫生组织狂犬病专家磋商会第三版报告。日内瓦:世界卫生组织;2018年(世界组织技术报告系列第1012号)。许可证:CC BY-NC-SA 3.0 IGO。
图书在版编目(CIP)数据。CIP数据请见http://apps.who.int/iris。
销售、版权和许可证。购买世界组织出版物,请登录 http://apps.who.int/bookorders。若提交 商业用途申请和有关版权及许可证的问题,请登录 http://www.who.int/about/licensing。
第三方资料。如欲使用本文件中源于第三方的资料(表格、数字或图像等),则由使用者自行决定是否需要取得复制许可并从版权方获得许可。因文件中属于第三方版权的内容而引发的侵犯版权索赔风险,完全由使用者承担。
一般免责声明。本出版物采用的名称和陈述的材料并不代表世界卫生组织对任何国家、领土、城市或地区或其当局的合法地位,或其边境或边界的划定有任何意见。地图上的虚线表示可能尚未完全达成一致的大致边界线。
凡提及特定公司或某些制造商的产品时,并不意味着它们已被世界卫生组织认可或推荐,或比其它未提及的同类公司或产品更好。除了差错和疏忽外,专利产品的名称均冠以大写字母,以示区别。
世界卫生组织已采取一切合理的预防措施来核实本出版物所包含的信息。但是,世界卫生组织不对这些内容做任何明确或含蓄的保证。解释和使用这些材料的责任由读者自行承担。世界卫生组织对于因使用这些材料而造成的损失一概不承担责任。
该出版物包含国际专家组的集体意见,不一定代表世界卫生组织的决议或政策。
设计: WHP (Sophie Guetaneh Aguettant)。
印刷地点:意大利。
目录
8.预防人类狂犬病57
8.1一般考虑57
8.2暴露前预防58
8.3暴露后预防60
8.4使用被动免疫狂犬病免疫球蛋白68
8.5禁忌和预防预防69
8.6供应限制70
8.7前往狂犬病感染国家和地区和迹象暴露前预防70
8.8教育预防咬伤72
8.9参考
附录3 截至2017年8月,世界各地的人类狂犬病疫苗及其生产商 100
附录4 采用细胞培养或鸡胚生产的现代狂犬病疫苗替代神经组织疫苗的四个步骤 102
附录5 截至2017年8月,全世界狂犬病免疫球蛋白(RIG)产品及其生产商 103
附录15 狂犬病、神经病毒学、病毒性人畜共患病和人畜共患病控制WHO合作中心 130
| ASEAN | 东南亚国家联盟 |
| CCEEV | 浓缩、纯化的细胞培养和基于含胚卵的狂犬病疫苗 |
| CSF | 脑脊液 |
| DALY | 伤残调整寿命年 |
| DHIS2 | 地区健康信息软件第2版 |
| DRIT | 直接快速免疫组织化学试验 |
| ELISA | 酶联免疫吸附测定 |
| FAT | 直接荧光抗体试验 |
| FAVN | 荧光抗体病毒中和 |
| GARC | 全球防治狂犬病联盟 |
| mAb | 单克隆抗体 |
| OIE | 世界动物卫生组织 |
| ORV | 口服狂犬病疫苗 |
| PAHO | 泛美卫生组织 |
| PARACON | 泛非狂犬病控制网络 |
| PEP | 暴露后免疫 |
| PrEP | 暴露前免疫 |
| RABV | 狂犬病病毒 |
| REDIPRA | 美洲狂犬病预防和控制国家计划负责人会议 |
| RFFIT | 快速荧光灶抑制试验 |
| RIG | 狂犬病免疫球蛋白 |
| RT-PCR | 逆转录聚合酶链反应 |
| USA | 美国 |
世界卫生组织狂犬病专家磋商会议于2017年4月26日至28日在泰国曼谷举行。Thiravat Hemachudha博士(朱拉隆功大学医学院)、Jedsada Chokdamrongsuk博士(泰国疾病控制司司长)和Suthipong Wacharasindhu院长(朱拉隆功大学医学院)向参会者致欢迎词,强调了狂犬病的重要性,作为一种可预防的疾病,狂犬病每年造成全世界数万人死亡。Chokdamrongsuk博士概述泰国承诺到2020年消除因狂犬病造成的人类死亡。
Bernadette Abela-Ridder博士(世界卫生组织被忽视人兽共患病专家)描述了狂犬病等被忽视的热带疾病对贫困和弱势群体的影响,以及投资改善卫生系统的好处。联合国第三个可持续发展目标在于促进各年龄段所有人的健康和福祉,包括到2030年终止狂犬病等被忽视的热带疾病带来的负担,并确保所有人以可承受的公平的价格获得高质量的卫生服务,从而实现全民健康覆盖。狂犬病,作为一种可预防的人畜共患疾病病,是检测卫生系统运行的良好指标,也是“同一个健康”合作的范本。2015年启动的全球狂犬病框架体系证明了在多种环境下狂犬病可被消除的概念,声明了到2030年全世界实现狂犬病零死亡的共同目标。
Thiravat Hemachudha博士和Christine Fehlner-Gardiner博士被任命为主席,Susan Moore博士和Joss Kessels女士被任命为此次磋商会的报告人。参会者名单见附录1。
本报告中的信息为狂犬病预防和控制的最新信息,取代2012年出版的第二版世界卫生组织狂犬病专家磋商会报告(1)。
疾病负担的相关信息被广泛应用于确定公共卫生工作的重点,为疾病预防分配资源以及评估干预措施的影响和成本效益(2)。这一章集中讨论犬介导的狂犬病,这是引发人类狂犬病的主要原因。
世界许多地区狂犬病死亡病例存在严重漏报。为解决这一问题,在不丹(3)、柬埔寨(4)和坦桑尼亚联合共和国(5)以及非洲、亚洲(6)甚至全世界(7)都使用了概率决策树模型来估算死亡率。进行上述估算的实践研究包括社区调查(8)、大规模口头追溯调查(9)、主动监测和追踪暴露者(9)以及用于评定不确定性的蒙特卡罗模拟(7)。
标准化衡量指标,如伤残调整寿命年 (DALY),包括过早死亡率和疾病导致的残疾;由于狂犬病的迅速致死性,因而其导致的残疾在疾病负担中所占比例很小。在少数仍使用神经组织疫苗的地方,神经组织疫苗会导致免疫失败,并造成严重的副作用,这种副作用在0.03-0.08%的病例中会持续4-7个月(6)。
对狂犬病负担的最新综合估算包括死亡率或发病率造成的生产力损失(以伤残调整寿命年表示)、狂犬病疫苗和免疫球蛋白等直接成本,以及患者的交通成本和收入损失等间接成本。牲畜损失以及犬类疫苗接种等监测和预防措施的费用也包括在内(7)。
狂犬病是一种被忽视的疾病。在无组织控制或监测的地方,狂犬病相关数据很少。监测能力不足、漏报、频繁的误诊以及缺乏部门间的协调等均会导致这种疾病负担程度被低估。若缺乏具体数据,可根据流行病学标准、社会经济标准和地理标准对国家进行分类,用于推断估测(7);更好的监测和强化的区域和全球报告系统将提高估测的准确性及防控方案的影响度(10)。应该鼓励进行特定国家的疾病负担研究和监测升级(见第11节),从而获得更多可靠的全球估测数据。
图1显示了经犬传播的人类狂犬病的全球负担。
图1
经犬传播的人类狂犬病的全球负担
A:人类狂犬病死亡数;B:人均死亡率(每10万人口);灰色覆盖国家没有犬狂犬病
资料来源: 参考文献7
2.2.1 无犬狂犬病的国家
如果一个国家的居民、犬类或其他动物物种确认至少两年没有出现过地方性获得的犬介导的狂犬病病例(完整病例定义见第12节),那么该国就被定义为无犬狂犬病的国家。西欧、加拿大、美国(USA)、日本和一些拉丁美洲国家已经消除了犬介导的狂犬病。澳大利亚和许多太平洋岛国则一直没有犬介导的狂犬病。然而,这些国家仍可能有输入性病例(11),为保持无狂犬病的状态,监测狂犬病病毒在野生动物和/或蝙蝠中的地方性传播,为生活在犬介导的狂犬病流行地区或前往该地区的人群进行暴露前免疫(PrEP)和暴露后免疫(PEP)同样会产生相应费用(12)。
2.2.2 犬狂犬病地方性流行的国家
拉丁美洲和加勒比海
通过持续控制,该地区的人和犬狂犬病病例显著减少(13)。2013年至2016年,只有玻利维亚、巴西、多米尼加共和国、危地马拉、海地、洪都拉斯、秘鲁和委内瑞拉发现了犬传播的人类狂犬病(14)。2016年,据报道美洲有10人死于犬狂犬病,海地8人,危地马拉2人(14);23人死于犬以外其他动物传播的狂犬病,其中巴西3人,哥伦比亚2人,危地马拉1人,墨西哥2人,秘鲁15人。阿根廷和玻利维亚仍在生产供人类使用的神经组织疫苗,玻利维亚、萨尔瓦多和洪都拉斯在继续生产供动物使用的神经组织疫苗(表1)。
表1
仍在生产人类或动物使用的神经组织疫苗的国家
| 使用对象 | 国家 |
| 人类 | 阿尔及利亚、阿根廷、埃塞俄比亚 |
| 人类和动物 | 玻利维亚 |
| 仅限动物 | 萨尔瓦多、洪都拉斯、赞比亚 |
资料来源: 参考文献14
亚洲
据估计,亚洲每年有35172人因犬介导的狂犬病而死亡(占全球死亡人数的59.6%)以及大约220万伤残调整寿命年的损失(7)。印度狂犬病死亡的人数在亚洲(占狂犬病死亡人数的59.9%)以及全世界均居首位(占狂犬病死亡人数的35%)。孟加拉国、缅甸和巴基斯坦神经组织疫苗的使用情况也被进行了估测;然而,这些国家已分别从2011年、2013年和2015年停止使用神经组织疫苗。亚洲在暴露后免疫上花费的费用最高,每年估计高达15亿美元(18)。尽管普遍存在漏报和估测值不确定的问题,但狂犬病仍是亚洲的一个主要负担,尤其是对农村贫困人口而言。
非洲
在非洲,每年约有21476人死于犬狂犬病(占全球死亡人数的36.4%),损失134万伤残调整寿命年 (7)。阿尔及利亚和埃塞俄比亚仍在生产人用神经组织疫苗(表1)(17)。在一项全球成本研究中发现非洲在暴露后免疫上的花费最少(占全球非死亡成本的3.28%),死亡成本最高(45%)。这表明,如果提高获得暴露后免疫的机会,或者降低犬介导的狂犬病的患病率,许多人可以得到拯救(15)。
中亚和中东
据估计,中亚因犬介导的狂犬病造成的疾病负担为1875人死亡和14310伤残调整寿命年,中东为229人死亡和1875伤残调整寿命年(7)。
2.2.3 蝙蝠狂犬病
虽然蝙蝠狂犬病在全世界人类病例中所占比例相对较小,但现在这种狂犬病在美洲人类狂犬病病例中占大多数(13、16 )。比如在北美,与被陆地食肉动物咬伤相比,人们在与蝙蝠接触后寻求暴露后免疫的倾向降低;2015年,美国记录的患狂犬病的蝙蝠数量首次超过患狂犬病的浣熊,这表明蝙蝠狂犬病的患病率越来越高亦或者报告的水平有所提高(17)。在美洲的其他大部分地区,吸血蝙蝠是人患狂犬病的主要来源。吸血蝙蝠狂犬病也是牲畜死亡的一个主要原因,在这种蝙蝠活动范围内(从阿根廷、乌拉圭到墨西哥北部),人类的生存和商业农场主们的利益都受到了影响(18)。在非洲、亚洲和大洋洲,与蝙蝠相关的人类狂犬病病例仍然很少,这也可能是由于监测能力有限以及病毒特征存在漏报的情况。蝙蝠狂犬病病毒属详见第3节和第10节描述。
全世界每年因犬介导的狂犬病死亡的人数估计有59000人,相关损失为370万伤残调整寿命年(7)。据估计,大多数死亡发生在亚洲(59.6%)和非洲(36.4%)(表2),大部分伤残调整寿命年是由于过早死亡(> 99%)导致的,少数为使用神经组织疫苗后的副作用(0.8%)导致的。在概率决策树模型中,犬介导的狂犬病的总经济成本估算为86亿美元(95%置信区间,29-215亿美元)(7)。在百万死亡研究中,一项强化的口头尸检调查显示,2005年印度有12700人(95%可信区间,10000-15500人)是由于狂躁型狂犬病而死亡(见第4节)。这项调查不包括麻痹型狂犬病 (19)。
与犬介导的狂犬病相关的主要成本因地区而异。其中包括过早死亡导致的生产力损失(总成本的55%)、暴露后免疫成本(20%)以及医疗单位和犬伤受害者的直接成本(20%)。然而,在大多数由犬介导的狂犬病流行地区,用于犬只疫苗接种的支出不到1.5%,但拉丁美洲除外,该地区有17%的费用用于犬只疫苗接种(7)。对个人而言,救命的暴露后免疫成本可能非常高,相当于亚洲一个国民总收入的3.87%(亚洲人平均31天的工资),非洲为5.80%(非洲人平均51天的工资)(1)。上述数值可能大大低估了高危人群的真实成本,如农村贫困人口。牲畜损失对那些依靠牲畜维持生计的人的影响也是不成比例的。
目前,大部分的疾病负担是由最负担不起的人承担着。提高暴露后免疫的实用性可以降低死亡人数,但代价高昂。通过持续的大规模犬类免疫接种可以减少犬狂犬病的发病率,如果风险评估得当,暴露后免疫成本会随着时间的推移而降低(见第12节)(20)。国家犬类疫苗接种计划和暴露后免疫获取机会的改善需要持续不断的努力,但会带来大量健康益处,特别是对世界上最贫穷的地区而言。
表2
世界各地死于狂犬病的估计人数(95%置信区间)
| 估测年份 | 参考文献或资料来源 | 方法 | 非洲 | 中国 | 印度 | 其他亚洲国家 | 全亚洲 | 全亚洲和全非洲 | 世界 |
| 2003 | (8) | 多中心研究(社区调查和医院记录) | 20 565 (16 931–24 198) | ||||||
| 2003 | (6) | 概率决策树法 | 23 700 (6 900– 45 900) | 2336 (565–5049) | 19 713 (4 192– 39 733) | 9489 (2281– 19 503) | 30–000 (8100– 61 400) | 55 270 (23 910– 93 057) | |
| 2005 | (19) | 口头尸检 | 12 700 (10 000– 15 000) | ||||||
| 2010 | (21) | 国家监测数据 | 2213 | ||||||
| 2010 | PRP | 概率决策树法 | 23 800 (21 000– 28 000 | 7450 (2 000– 13 000) | 16 450 (6 000– 27 000) | 10 550 a (6 000– 14 000) | 34 500 (14 000– 54 000) | 58 300 (35 000– 82 000) | 61 000 (37 000–86 000) |
| 2015 | (7) | 概率决策树法 | 21 502 | 6 002 (1 000- 11 000) | 20 847 (7 000 – 55 000) | 8 126 a | 37 045 | 58 547 | 59 000 (25 000– 159 000) |
PRP——狂犬病预防伙伴联盟
狂犬病负担
世界卫生组织
a不包括中亚
1. Mur1. WHO expert consultation on rabies: second report. Geneva: World Health Organization; 2013 (http://apps.who.int/iris/ bitstream/10665/85346/1/9789240690943_eng.pdf).
2. Murray CJ, editor. Summary measures of population health: concepts, ethics, measurement and applications. Geneva: World Health Organization; 2002.
5. Cleaveland S, Fevre EM, Kaare M, Coleman PG. Estimating human rabies mortality in the United Republic of Tanzania from dog bite injuries. Bull World Health Org. 2002;80:304–10.
3. Tenzin T, Dhand NK, Gyeltshen T, Firestone S, Zangmo C, Dema C et al. Dog bites in humans and estimating human rabies mortality in rabies endemic areas of Bhutan. PLoS Negl Trop Dis. 2011;5(11):e1391.
4. Ly S, Buchy P, Heng NY, Ong S, Chhor N, Bourhy H et al. Rabies situation in Cambodia. PLoS Negl Trop Dis. 2009;3(9):e511.
6. Knobel DL, Cleaveland S, Coleman PG, Fèvre EM, Meltzer MI, Miranda ME et al. Re-evaluating the burden of rabies in Africa and Asia. Bull World Health Org. 2005;83(5):360–8.
7. Hampson K, Coudeville L, Lembo T, Sambo M, Kieffer A, Attlan M et al. Estimating the global burden of endemic canine rabies. PLoS Negl Trop Dis. 2015;9(4):e0003709.
8. Sudarshan MK, Madhusudana SN, Mahendra BJ, Rao NS, Narayana DA, Rahman SA et al. Assessing the burden of human rabies in India: results of a national multi-center epidemiological survey. Int J Infect Dis. 2007;11(1):29–35.
9. Hampson K, Dobson A, Kaare M, Dushoff J, Magoto M, Sindoya E et al. Rabies exposures, post-exposure prophylaxis and deaths in a region of endemic canine rabies. PLoS Negl Trop Dis. 2008;2(11):e339.
10. Taylor LH, Hampson K, Fahrion A, Abela-Ridder B, Nel LH. Difficulties in estimating the human burden of canine rabies. Acta Trop. 2017;165:133– 40.
11. Carrara P, Parola P, Brouqui P, Gautret P. Imported human rabies cases worldwide, 1990–2012. PLoS Negl Trop Dis. 2013;7(5):e2209.
狂犬病负担
12. Cliquet FE, Picard-Meyer E, Robardet E. Rabies in Europe: what are the risks? Didcot: Taylor & Francis; 2014;905–8.
13. Vigilato MA, Clavijo A, Knobl T, Silva HM, Cosivi O, Schneider MC et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Phil Trans R Soc London B Biol Sci. 2013;368(1623):20120143.
14. Human rabies: 2016 updates and call for data. Wkly Epidemiol Rec. 2017;92(7):77–86.
15. Anderson A, Shwiff SA. The cost of canine rabies on four continents. Transbound Emerg Dis. 2015;62(4):446–52.
16. Vigilato MA, Cosivi O, Knöbl T, Clavijo A, Silva HM. Rabies update for Latin America and the Caribbean. Emerg Infect Dis. 2013;19(4):678.
17. Birhane MG, Cleaton JM, Monroe BP, Wadhwa A, Orciari LA, Yager P et al. Rabies surveillance in the United States during 2015. J Am Vet Med Assoc. 2017;250(10):1117–30.
18. Johnson N, Aréchiga-Ceballos N, Aguilar-Setien A. Vampire bat rabies: ecology, epidemiology and control. Viruses. 2014;6(5):1911–28.
19. Suraweera W, Morris SK, Kumar R, Warrell DA, Warrell MJ, Jha P et al. Deaths from symptomatically identifiable furious rabies in India: a nationally representative mortality survey. PLoS Negl Trop Dis. 2012;6(10):e1847.
20. Undurraga EA, Meltzer MI, Tran CH, Atkins CY, Etheart MD, Millien MF et al. Cost–effectiveness evaluation of a novel integrated bite case management program for the control of human rabies, Haiti 2014–2015. Am J Trop Med Hyg. 2017;96(6):1307–17.
21. Yu J, Li H, Tang Q, Rayner S, Han N, Guo Z et al. The spatial and temporal dynamics of rabies in China. PLoS Negl Trop Dis. 2012;6(5):e1640.
狂犬病是由狂犬病病毒属感染引起的急性脑炎(1)。狂犬病脑炎的病原体属于单股反链病毒目、弹状病毒科,狂犬病病毒属(2)。狂犬病病毒属有一个长12kb不分节段负链RNA基因组,编码五种病毒蛋白(3´至5´):核蛋白(N)、磷酸蛋白(P)、基质蛋白(M)、糖蛋白(G)和RNA依赖的RNA聚合酶(或大蛋白L)。狂犬病病毒属颗粒为子弹形,长100-300nm,直径75nm。狂犬病病毒属由两个结构和功能单位组成:一个内部螺旋状排列的核衣壳和一个外部包膜。核衣壳由包含基因组RNA及紧密盘绕的N 蛋白与L和P蛋白一起构成的核糖核蛋白复合体组成。核衣壳负责转录和复制:N-RNA模板由L蛋白及其辅助因子P 蛋白进行加工,L蛋白包含大部分RNA聚合酶活性。脂质膜在出芽过程中从宿主细胞质膜获得。圆形糖蛋白纤突(5-10nm长,直径约3nm)由三个糖基化的胞外域组成,突起于病毒膜,连接病毒粒子和宿主细胞受体。M蛋白形成的低聚物结合在核衣壳的外侧,保持病毒粒子结构的硬度并提供给病毒糖蛋白及其囊膜一个结合平台(3、4)。
直到20世纪五十年代,狂犬病病毒一直被认为是唯一的。通过对来自尼日利亚的血清学相关病毒的鉴定——狐蝠科蝙蝠的拉各斯(Lagos)蝙蝠病毒和鼩鼱分离到的蒙古拉(Mokola)病毒——发现狂犬病病毒群的结构更加复杂,由此出现了狂犬病相关病毒和狂犬病血清群的术语(5)。另外一种血清学相关的病毒,杜文海格病毒,是1970年在南非被食虫蝙蝠咬伤后死于狂犬病的一个病人身上分离得到的,代表第四种血清型(6)。
从20世纪五十年代以来,从欧洲和美洲蝙蝠身上分离到的病毒与杜文海格病毒血清学相关并且最初归类为杜文海格血清型(7) 。此后,单克隆抗体的应用使狂犬病血清型的分类可以细化(8)。欧洲蝙蝠狂犬病病毒属不仅与非洲杜文海格病毒相互区别,并进一步被分成两个独特的血清型,暂时称为“生物型”(9)。这种区分随后得到基因测序和种系进化分析的支持。狂犬病相关病毒多样性的广泛种系进化研究产生了新的专业术语“基因型”,自此基因型广泛应用于科学文献中(10)。新基因型得到鉴定,有关基因型鉴别的定量标准也随之产生(11、12)。
为了容纳越来越多的狂犬病相关病毒,国际病毒分类委员会主持设立了狂犬病病毒属。属的名称来自于希腊神话:丽沙(Lyssa,Λυσσα)是一个女神,代表疯狂和愤怒的灵魂。现有的“基因型”作为狂犬病病毒属分类的基础,限定于符合国际委员会的正式规则,并应用于更复杂的本质研究中,诸如病毒种类。最近,为将每一种类定义为一种独特的狂犬病病毒属,对该属的命名进行了更新(2、13)。
狂犬病病毒属种类的界定标准包括(13、15):
■ 遗传距离,完整N基因核苷酸序列同源性达到80-82%的临界值,与其他基因相比较可以提供更好的定量结论,或者是N+P+M+G+L基因的联合编码区核苷酸序列有80-81%的同源性。一般来说,所有属于同一种类的分离株均较阈值有更高的同源性,除了目前归在Lagos 蝙蝠病毒属种的病毒以外。因此,一些作者建议将Lagos 蝙蝠病毒进一步分成几种基因型(14)。然而,由于缺少其他足够的界定特征,Lagos 蝙蝠病毒属仍然没有分成为几个种类,尽管这些代表株在大多数种系进化重建的过程中分化成为一个单系簇;
■ 用各种进化模型获得的拓扑结构和种系进化树的一致性;
■ 用核衣壳蛋白单克隆抗体反应的抗原模式(来源于血清学交叉反应和多克隆抗血清的狂犬病病毒属血清型定义);以及
■ 在可行的情况下,额外的特性,例如生态特性、宿主、地理范围和病理特征等。
目前,国际病毒分类委员会明确了14 种狂犬病病毒属种类(表3)。根据遗传距离和血清学交叉反应特性,该病毒属分为三个谱系(图2)。
表3
目前包含在狂犬病病毒属内的病毒
| 大洲 | 分离株的地理分布 | 狂犬病病毒属种类 | 最容易被感染的哺乳动物物种 | 属于哪个谱系?是否有疫苗保护? | 是否报道有人类死亡? |
| 全部大洲 | 除澳大利亚、南极洲和几个岛屿外,世界各地的陆生哺乳动物;仅限新大陆的蝙蝠 | 一般狂犬病病毒 | 所有哺乳动物,主要是犬类 | I/是 | 是,59000
人死亡/年 |
| 非洲 | 坦桑尼亚联合共和国 | 伊科马狂犬病病毒b | 非洲灵猫 | III/否 | 否 |
| 中非共和国、加纳、肯尼亚、尼日利亚、塞内加尔、南非;从埃及或多哥返回法国的旅行者 | Lagos 蝙蝠病毒 | 大量食果性蝙蝠种类,偶尔会溢出感染家犬和家猫 | II/否 | 否 | |
| 喀麦隆、中非共和国、埃塞俄比亚、尼日利亚、
南非、津巴布韦 |
蒙古拉狂犬病病毒 | 鼩鼱(麝鼩属)、家猫和啮齿动物 | II/否 | 是,2 | |
| 肯尼亚 | 希莫尼蝙蝠狂犬病病毒b | 康氏叶鼻蝠 | II/否 | 否 | |
| 肯尼亚c、南非 | 杜文海格狂犬病病毒 | 未知 | I/是 | 是,3 | |
| 津巴布韦 | 杜文海格狂犬病病毒 | 埃及切面蝙蝠 | I/是 | 是,3 | |
| 欧洲 | 法国、德国、西班牙 | 欧洲蝙蝠狂犬病病毒1型 | 大棕蝠 | I/是 | 是,2 |
| 芬兰、法国、德国、卢森堡、荷兰、瑞士、英国 | 欧洲蝙蝠狂犬病病毒2型 | 水鼠耳蝠 | I/是 | 是,2 | |
| 法国、德国、波兰 | 波克罗蝙蝠狂犬病病毒 | 纳氏鼠耳蝠 | I/是 | 否 | |
| 西班牙 | Lleida蝙蝠狂犬病病毒b | 长翼蝠 | III/否 | 否 | |
| 芬兰 | Kotolahti蝙蝠狂犬病病毒e | 布氏鼠耳蝠 | I | 否 | |
| 欧亚大陆 | 吉尔吉斯斯坦 | 阿拉万狂犬病病毒b | 狭耳鼠耳蝠 | I/是 | 否 |
| 中国d、俄罗斯联邦 | 伊尔库特狂犬病病毒 | 白腹管鼻蝠 | I/是 | 是,1 | |
| 塔吉克斯坦 | Khujand 狂犬病病毒b | 须鼠耳蝠 | I/是 | 否 | |
| 肯尼亚、俄罗斯联邦e | 西高加索蝙蝠狂犬病病毒b | 长翼蝠 | III/否 | 否 | |
| 澳大拉西亚 | 澳大利亚 | 澳大利亚蝙蝠狂犬病病毒 | 黑色飞狐或相关属种 | I/是 | 是,3 |
| 黄腹鞘尾蝙蝠 | |||||
| 亚洲 | 斯里兰卡 | Gannoruwa蝙蝠狂犬病病毒 | 印度狐蝠 | I/是 | 否 |
| 台湾 | 台湾蝙蝠狂犬病病毒e | 东亚家蝠 | I/是 | 否 |
a 美洲有超过50种蝙蝠与狂犬病病毒感染有关;只有。
b 只描述了一个单独分离株。
c 荷兰报道的病例,但是在肯尼亚发生的感染。
d 国际病毒分类委员会尚未将其列入狂犬病病毒属
e 在肯尼亚感染的血清学证据
图2
蝙蝠相关狂犬病病毒属的多样性
罗马数字是指抗原谱系。象形图代表报告的溢出感染事件。
*仅表示单一分离;^表示没有可用的分离株;?没有与蝙蝠种类关联的报道;$尚未被国际病毒分类委员会归类为狂犬病病毒属。
©皇家版权,2018年。经英国动植物卫生署A. Fooks教授与A. Banyard博士授权使用
谱系I包括一般狂犬病病毒(RABV)、欧洲蝙蝠狂犬病病毒1型和2型、波克罗蝙蝠狂犬病病毒、杜文海格狂犬病病毒、澳大利亚蝙蝠狂犬病病毒、阿拉万狂犬病病毒、Kjujand狂犬病病毒和伊尔库特狂犬病病毒。谱系II包括Lagos 蝙蝠病毒、蒙古拉狂犬病病毒和希莫尼蝙蝠狂犬病病毒,谱系III包括西高加索蝙蝠狂犬病病毒和伊科马狂犬病病毒。
另外两种可能归类到狂犬病病毒属的病毒也有所描述。Gannoruwa蝙蝠狂犬病病毒是从斯里兰卡的Pteropus medius蝙蝠中分离出来的,与狂犬病病毒和澳大利亚蝙蝠狂犬病病毒密切相关(15)。此外,另一种新型Lleida蝙蝠狂犬病病毒的全基因组特征与西班牙长翼蝠分离的病毒相似(16)。虽然Gannoruwa蝙蝠狂犬病病毒可能会被归入谱系I,但是Lleida蝙蝠狂犬病病毒与谱系III的两种病毒——伊科马狂犬病病毒和西高加索蝙蝠狂犬病病毒——有很大的差异。在台湾的东亚家蝠中报道了另外一种新型狂犬病病毒——台湾蝙蝠狂犬病病毒;如果要将这种病毒界定为单独的狂犬病病毒属种,还需要更多的遗传数据(17),就像芬兰分离得到的Kotolahti 蝙蝠狂犬病病毒一样,在正式分类前应该对其进行进一步的特征鉴定。
持续在蝙蝠中进行狂犬病病毒属的鉴定工作,导致出现这样一个假设,认为所有狂犬病病毒都起源于蝙蝠。虽然17种已承认的和提议的狂犬病病毒属种中有15种的宿主已经确定是蝙蝠,但是在蝙蝠中没有发现蒙古拉和伊科马狂犬病病毒,它们的宿主仍有待确定(17)。
狂犬病病毒属在核衣壳水平上表现出广泛的抗原交叉反应,主要是因为N蛋白的序列保守性。因此,可以用相似的试剂进行免疫荧光诊断。G蛋白的胞外域(携带主要抗原位点)更容易变异,同一谱系(胞外域氨基酸同源性,>74%)的狂犬病病毒属之间存在交叉中和作用,而不同谱系(胞外域氨基酸同源性,<62%)的病毒之间则没有此作用。实验证明显示目前应用的疫苗株均属于谱系I的狂犬病病毒属,对谱系II和III的狂犬病病毒属的感染无效。
1. Fooks AR, Banyard AC, Horton DL, Johnson N, McElhinney LM, Jackson AC. Current status of rabies and prospects for elimination. Lancet. 2014;384(9951):1389–99.
2. Amarasinghe GK, Bào Y, Basler CF, Bavari S, Beer M, Bejerman N et al. Taxonomy of the order Mononegavirales: update 2017. Arch Virol. 2017;162(8):2493–504.
3. Graham SC, Assenberg R, Delmas O, Verma A, Gholami A, Talbi C et al. Rhabdovirus matrix protein structures reveal a novel mode of self- association. PLoS Pathog. 2008;4(12):e1000251.
4. Ge P, Tsao J, Schein S, Green TJ, Luo M, Zhou ZH. Cryo-EM model of the bullet-shaped vesicular stomatitis virus. Science. 2010;327(5966):689– 93.
5. Boulger LR, Porterfield JS. Isolation of a virus from Nigerian fruit bats. Trans R Soc Trop Med Hyg. 1958;52(5):421–4.
6. Shope RE, Murphy FA, Harrison AK, Causey OR, Kemp GE, Simpson DI et al. Two African viruses serologically and morphologically related to rabies virus. J Virol. 1970;6(5):690–2.
7. Shope RE. Rabies-related viruses. Yale J Biol Med. 1982;55(3-4):271–5.
8. Meredith CD, Prossouw AP, Koch HP. An unusual case of human rabies thought to be of chiropteran origin. S Afr Med J. 1971;45(28):767–9.
9. Schneider LG. Antigenic variants of rabies virus. Comp Immunol Microbiol Infect Dis. 1982;5(1–3):101–7.
10. Schneider LG, Barnard BJ, Schneider HP, Ødegaard ØA, Müller J, Selimov M et al. Application of monoclonal antibodies for epidemiological investigations and oral vaccination studies. In: Kuwert EK, Merieux C, Koprowski H, Bogel K, editors. Rabies in the tropics. Proceedings of a WHO consultation. Berlin: Springer; 1985;47–59.
11. Wiktor TJ, Koprowski H. Monoclonal antibodies against rabies virus produced by somatic cell hybridization: detection of antigenic variants. Proc Natl Acad Sci. 1978;75(8):3938–42.
12. Dietzschold B, Rupprecht CE, Tollis M, Lafon M, Mattei J, Wiktor TJ et al. Antigenic diversity of the glycoprotein and nucleocapsid proteins of rabies and rabies-related viruses: implications for epidemiology and control of rabies. Rev Infect Dis. 1988;10(Suppl.4):S785–98.
13. Bourhy HE, Kissi B, Lafon M, Sacramento D, Tordo N. Antigenic and molecular characterization of bat rabies virus in Europe. J Clin Microbiol. 1992;30(9):2419–26.
14. King A, Davies P, Lawrie A. The rabies viruses of bats. Vet Microbiol. 1990;23(1–4):165–74.
15. Bourhy H, Kissi B, Tordo N. Molecular diversity of the Lyssavirus genus. Virology. 1993;194(1):70–81.
16. Davis PL, Holmes EC, Larrous F, Van der Poel WH, Tjørnehøj K, Alonso WJ et al. Phylogeography, population dynamics, and molecular evolution of European bat lyssaviruses. J Virol. 2005;79(16):10487–97.
17. Fraser GC, Hooper PT, Lunt RA, Gould AR, Gleeson LJ, Hyatt AD et al. Encephalitis caused by a lyssavirus in fruit bats in Australia. Emerg Infect Dis. 1996;2(4):327.
18. Kuzmin IV, Orciari LA, Arai YT, Smith JS, Hanlon CA, Kameoka Y et al. Bat lyssaviruses (Aravan and Khujand) from Central Asia: phylogenetic relationships according to N, P and G gene sequences. Virus Res. 2003;97(2):65–79.
19. Freuling CM, Beer M, Conraths FJ, Finke S, Hoffmann B, Keller B et al. Novel lyssavirus in Natterer’s bat, Germany. Emerg Infect Dis. 2011;17(8):1519.
20. Evans JS, Horton DL, Easton AJ, Fooks AR, Banyard AC. Rabies virus vaccines: is there a need for a pan-lyssavirus vaccine? Vaccine. 2012;30(52):7447–54.
21. Afonso CL, Amarasinghe GK, Bányai K, Bào Y, Basler CF, Bavari S et al. Taxonomy of the order Mononegavirales: update 2016. Arch Virol. 2016;161(8):2351–60.
22. Markotter W, Kuzmin I, Rupprecht CE, Nel LH. Phylogeny of Lagos bat virus: challenges for lyssavirus taxonomy. Virus Res. 2008;135(1):10–21.
23. Gunawardena PS, Marston DA, Ellis RJ, Wise EL, Karawita AC, Breed AC et al. Lyssavirus in Indian flying foxes, Sri Lanka. Emerg Infect Dis. 2016;22(8):1456.
24. Ceballos NA, Morón SV, Berciano JM, Nicolás O, López CA, Juste J et al. Novel lyssavirus in bat, Spain. Emerg Infect Dis. 2013;19(5):793.
25. Banyard AC, Fooks AR. The impact of novel lyssavirus discovery. Microbiol Aust. 2017;38(1):17–21.13.
发病机理的大部分内容是针对一般狂犬病病毒的,不过其他狂犬病病毒属的发病机理可能也是相似的(见第3节)。狂犬病病毒通过伤口或与粘膜表面直接接触而进入体内,但病毒不能穿过没有损伤的皮肤。狂犬病病毒在暴露部位的肌肉组织中复制,然后通过运动神经元的终板和轴突到达中枢神经系统(1-5)。病毒粒子以运输小泡(6)为载体,快速地沿运动轴突以独有的逆向运输方式到达中枢神经系统而不被感觉或交感神经末梢所摄取(1-3、5)。病毒也可以通过较深的伤口直接进入周围神经的运动神经元轴突(1、3、4)。在一些蝙蝠狂犬病病毒变异株中,由于皮肤嗜性病毒繁殖也可能在感觉神经上发生(3、7、8)。根据侵入的病毒量、受伤部位运动神经元终板的密度以及病毒接近中枢神经系统的距离,病毒潜伏期从5天到几年不等(一般为2-3 个月,很少超过1年)(3-5)。肌肉特异性微型RNA可能通过抑制病毒在肌肉中的转录和复制影响其潜伏期(9、10)。估测的病毒移动速度取决于病毒是向心性的逆向轴突运输还是离心性扩散。在向心性逆向轴突运输中,移动较快,约为5-100mm/天,甚至更快,其原因是处于不同距离(如10μm至2cm)的具有相同突触排列的神经元群会同时被感染(1、5)。与之相反,离心性扩散的速度会较慢,可能是缘于病毒为被动扩散而非主动扩散(1-3、5)。
第一阶段的快速向心移动会导致病毒在中枢神经系统内广泛跨神经元穿行,并通过最初感染的运动神经元与脊髓中间神经元之间的中央连接感染背根神经节(1-3、5)。然后病毒从中枢神经系统离心移动缓慢通过在运动神经元轴突的顺向轴浆流动进入腹侧根和神经以及在感染的背根神经节外周感觉神经元轴突,从而通过这些感觉神经感染肌梭、皮肤、毛囊以及其他非神经组织,如唾液腺、心肌、肺部以及腹部内脏器官(3-5)。到狂犬病临床发病时,病毒已经广泛分布于中枢神经系统以及神经外的器官中(11)。
临床初始特异性症状是在咬伤的部位有神经性疼痛。这种情况是由于病毒在背根神经节复制和细胞免疫引发的炎症造成的(12)。人类狂犬病症状可以表现为狂躁型或麻痹型,并且两者均不能与狂犬病病毒在中枢神经系统内的解剖定位相关联(12-14)。最主要的临床体征可能由不同的位点特异性反应引起(14);神经功能损伤也解释了昏迷症状的发生。电生理学方法研究病理机制发现麻痹型狂犬病的虚弱无力与外周神经轴突病变或者脑白质变性有关(7、12)。病毒优先侵入运动神经元途径解释了为什么狂躁型狂犬病前角细胞功能障碍引起的亚临床症状要先于感觉丧失,并且最初发生在与咬伤部位相对应的躯体部分,渐渐扩展到其他部位(3、5、12) 。同样的原因也可以解释麻痹型狂犬病患者的前兆性症状和体征(3-5)。犬介导的麻痹型狂犬病的弥散张量成像显示脑干部位神经束的完整性受损,影响了病毒向前脑的传播(5、15、16)。病毒免疫逃避策略加血脑屏障的完整性阻碍了中枢神经系统中病毒的清除(4、16-21)。在感染狂犬病的患者中没有发现免疫抑制或加速神经元死亡的证据(15、16)。
现今具有非典型临床症状和/或神经影像学特征的狂犬病患者越来越多(4、22-26)。然而这些究竟是由非典型的病毒变异株,还是宿主免疫反应或是大剂量病毒接种(例如在狂犬病感染者作为供体的器官移植病例中)造成的尚不清楚。如果没有重症监护,患者在出现临床症状7-10天内会发生死亡(5、7)。
1. Ugolini G. Use of rabies virus as a transneuronal tracer of neuronal connections: implications for the understanding of rabies pathogenesis. Dev Biol (Basel). 2008;131:493–506.
2. Ugolini G. Advances in viral transneuronal tracing. J Neurosci Methods. 2010;194(1):2-0.
3. Ugolini G. Rabies virus as a transneuronal tracer of neuronal connections. Adv Virus Res. 2011:79:165–202.
4. Hemachudha T, Laothamatas J, Rupprecht CE. Human rabies: a disease of complex neuropathogenetic mechanisms and diagnostic challenges. Lancet Neurol. 2002:1(2):101–9.
5. Hemachudha T, Ugolini G, Wacharapluesadee S, Sungkarat W, Shuangshoti S, Laothamatas J. Human rabies: neuropathogenesis, diagnosis, and management. Lancet Neurol. 2013;12(5):498–513.
6. Klingen Y, Conzelmann KK, Finke S. Double-labeled rabies virus: live tracking of enveloped virus transport. J Virol. 2008;82(1):237–45.
7. Hemachudha T, Wacharapluesadee S, Mitrabhakdi E, Wilde H, Morimoto K, Lewis AR. Pathophysiology of human paralytic rabies. J Neurovirol. 2005;11(1):93–100.
8. Morimoto K, Patel M, Corisdeo S, Hooper DC, Fu ZF, Rupprecht CE et al. Characterization of a unique variant of bat rabies virus responsible for newly emerging human cases in North America. Proc Natl Acad Sci U S A. 1996;93(11):5653–8.
9. Israsena N, Supavonwong P, Ratanasetyuth N, Khawplod P, Hemachudha T. Inhibition of rabies virus replication by multiple artificial microRNAs. Antiviral Res. 2009;84(1):76–83.
10. Israsena N, Mahavihakanont A, Hemachudha T. Rabies virus infection and microRNAs. In: Adv Virus Res. 2011;79:329–44.
11. Hemachudha T, Wacharapluesadee S, Laothamatas J, Wilde H. Rabies. Curr Neurol Neurosci Rep. 2006;6:460.
12. Mitrabhakdi E, Shuangshoti S, Wannakrairot P, Lewis RA, Susuki K, Laothamatas J et al. Difference in neuropathogenetic mechanisms in human furious and paralytic rabies. J Neurol Sci. 2005;238(1):3–10.
13. Dumrongphol H, Srikiatkhachorn A, Hemachudha T, Kotchabhakdi N, Govitrapong P. Alteration of muscarinic acetylcholine receptors in rabies viral-infected dog brains. J Neurol Sci. 1996;137(1):1–6.
14. Thanomsridetchai N, Singhto N, Tepsumethanon V, Shuangshoti S, Wacharapluesadee S, Sinchaikul S et al. Comprehensive proteome analysis of hippocampus, brainstem, and spinal cord from paralytic and furious dogs naturally infected with rabies. J Proteome Res. 2011;10(11):4911–24.
15. Laothamatas J, Wacharapluesadee S, Lumlertdacha B, Ampawong S, Tepsumethanon V, Shuangshoti S et al. Furious and paralytic rabies of canine origin: neuroimaging with virological and cytokine studies. J Neurovirol. 2008;14(2):119–29.
16. Laothamatas J, Sungkarat W, Hemachudha T. Neuroimaging in rabies. Adv Virus Res. 2011;79:309–27.
17. Lafon M. Evasive strategies in rabies virus infection. Adv Virus Res. 2011;79:33–53.
18. Laothamatas J, Hemachudha T, Mitrabhakdi E, Wannakrairot P, Tulayadaechanont S. MR imaging in human rabies. Am J Neuroradiol. 2003;24(6):1102–9.
19. Roy A, Phares TW, Koprowski H, Hooper DC. Failure to open the blood–brain barrier and deliver immune effectors to central nervous system tissues leads to the lethal outcome of silver-haired bat rabies virus infection. J Virol. 2007;81(3):1110–8.
20. Roy A, Hooper DC. Immune evasion by rabies viruses through the maintenance of blood–brain barrier integrity. J Neurovirol. 2008;14(5):401–11.
21. Kasempimolporn S, Hemachudha T, Khawplod P, Manatsathit S. Human immune response to rabies nucleocapsid and glycoprotein antigens. Clin Exp Immunol. 1991;84(2):195–9.
22. Hemachudha T, Phuapradit P. Rabies. Curr Opin Neurol. 1997;10(3): 260–7.
23. Burton EC, Burns DK, Opatowsky MJ, El-Feky WH, Fischbach B, Melton L et al. Rabies encephalomyelitis: clinical, neuroradiological, and pathological findings in 4 transplant recipients. Arch Neurol. 2005;62(6):873–82.
24. Maier T, Schwarting A, Mauer D, Ross RS, Martens A, Kliem V et al. Management and outcomes after multiple corneal and solid organ transplantations from a donor infected with rabies virus. Clin Infect Dis. 2010;50(8):1112–9.
25. Shantavasinkul P, Tantawichien T, Wacharapluesadee S, Jeamanukoolkit A, Udomchaisakul P, Chattranukulchai P et al. Failure of rabies postexposure prophylaxis in patients presenting with unusual manifestations. Clin Infect Dis. 2010;50(1):77–9.
26. Human rabies – Minnesota, 2007. Morbid Mortal Wkly Rep. 2008;57(17):460–2.
狂犬病是由狂犬病病毒引起的一种急性、进行性脑炎。狂犬病脑炎的临床诊断可能很难,应尽可能用实验室诊断方法进行确诊。在过去的十年间,用于临床病例确认的实验室诊断技术取得了显著的进步,包括通过病毒抗原、抗体和扩增子表达来验证临床病例。每个国家至少应该有一个具有应用目前推荐的现代技术进行狂犬病诊断和病例确认能力的国家性标准实验室(1-3)。缺乏专业知识的地区可以向世界卫生组织合作中心(第13.1.3节)以及世界动物卫生组织(OIE)的对照中心和联合国粮食与农业组织的对照实验室(见第13节)寻求培训支持以及参考诊断能力支持。
所有国家均应使用狂犬病标准定义,该定义是基于对人类和动物狂犬病疑似病例的实验室监测而来的。人类狂犬病的疑似临床病例定义如下: 病例具有急性神经性综合征(如脑炎),主要表现为机能亢奋(如狂躁型狂犬病)或者麻痹综合征(如麻痹型狂犬病),如果没有得到重症监护治疗,患者通常会在初始症状出现后7-10天内进行性发展为昏迷和死亡,这通常是由于心脏或呼吸衰竭所致。这些症状可能包括以下任何一种:恐风、恐水、感觉异常或局部疼痛、吞咽困难、局部虚弱、恶心或呕吐(4)。在进行临床病例确认时应使用下列实验室诊断标准中的一种或几种:
■ 样本(如脑组织、皮肤)中检测到病毒抗原;
■ 细胞培养或实验动物样本中分离到病毒;
■ 未接种疫苗者的脑脊液(CSF)或血清中检测到病毒特异性抗体;
■ 样本(如脑组织、皮肤、唾液、浓缩尿)中检测到病毒核酸。
狂犬病病例分类如下:
■ 疑似病例: 符合临床病例定义的病例;
■ 可能病例:疑似病例,同时具有与疑似、可能或确认的狂犬病动物接触的可靠病史(见第11节表16);
■ 确认病例: 实验室确认为狂犬病的疑似或可能病例。
可能的狂犬病暴露记录数据模板见附录2。
如果个体出现了狂犬病相关症状,又有文件证明曾接触到实验室确诊的狂犬病动物,那么对其的狂犬病推测诊断并不难。狂犬病的典型症状包括对触觉、听觉、视觉或嗅觉的刺激有痉挛反应(如恐风症和恐水症),交替出现周期性清醒、烦躁、错觉和自主神经功能障碍症状(5)。痉挛会发生在主要表现为兴奋的狂犬病患者中。自发性的呼吸痉挛会持续发生直至死亡,这些表现常常可以帮助诊断。麻痹型狂犬病很少出现兴奋,这样的患者中仅有50%会出现恐惧性痉挛。在麻痹型狂犬病的早期阶段,典型体征包括在叩诊部位的肌水肿,通常在胸部、三角肌和大腿,毛发竖立和肌束震颤。
如果没有明确暴露史和典型症状,单从临床表现诊断狂犬病是困难的并且通常也是不可靠的。某些患者可以表现为麻痹或与格林-巴利综合征相似的症状,或者出现其他非典型特征(5)。非典型狂犬病的出现越来越普遍,这种情况可能会造成狂犬病误诊或者漏报。现今已有关于非典型狂犬病病例的详细临床信息报告,特别是与蝙蝠或者其它野生动物暴露有关的病例(6)。
对潜在感染狂犬病的患者在采取适当预防措施情况下进行磁共振成像检查,可能有助于诊断(5、7)。无论临床类型如何,当脑干、海马、下丘脑、深层和皮层下白质以及深层和皮质灰质的T2成像出现模糊、微弱的异常高信号时提示有狂犬病感染。疾病晚期,当患者进入昏迷状态时,钆增强可以清楚地显示。当进行意识状态比较时,这些特征可以用来鉴别狂犬病与其他病毒性脑炎,不仅仅从位置上、还从T2成像的表现以及对比增强等方面进行鉴别(7)。脑部CT(计算机化断层显象)几乎没有诊断价值。
在没有足够的流行病学调查和实验室确认的情况下,狂犬病可能被误诊并且将死亡归于其他更常见和更熟悉的脑炎原因(如疟疾流行地区的脑疟疾)(1)。在所有不明原因的急性、进行性病毒性脑炎病人的鉴别诊断中,狂犬病都应当纳入诊断范围,即便是在狂犬病罕见的地区,因为狂犬病可以在当地野生动物(如蝙蝠、猫鼬、狐狸和豺狼;见第10节)中传播,也有可能在去地方性动物病流行地区旅行时受到感染;而且人类及动物的狂犬病输入病例也一直在发生(1、4)。鉴于已有通过接受实体器官移植感染狂犬病病毒的报告,因此所有有脑炎症状的捐献器官者均应采集生前或死后样本利用推荐的实验室方法进行筛查和检测以确定其是否具有传染风险(1)。
5.3.1 生物安全
狂犬病是目前已知的所有传染病中病死率最高的。因此,安全性对于从事狂犬病病毒属相关工作至关重要。一般来说,生物安全2级实验室的安全操作适用于动物处理、尸体解剖、样本采集、制备、处理等常规的实验室活动(2、3)。除了符合基本设施要求之外,预防措施还包括个人防护设备(如服装、手套、护目镜)和暴露前狂犬病疫苗接种。在某些情况下,如生产大量浓缩病毒、进行可能产生气溶胶的操作(例如组织悬液匀化)、分离新型狂犬病病毒操作中采用的预防措施的保护效果尚不清楚时,可考虑采用生物安全3级。应严格遵守所有关于传染性病原操作的国家安全指南。
5.3.2 人类活体诊断的取样
分泌物、体液(唾液、脊髓液、泪液等)和组织(皮肤活体组织样本,包括后颈部毛囊)可用于存活狂犬病病人的诊断(1、2)。虽然血清和脑脊液在生前诊断中可能不是非常灵敏的样本,尤其是在疾病早期,但阳性结果可以提供宝贵的诊断信息。要达到最佳诊断灵敏度,至少需要三份唾液样本,取样需要间隔3-6小时,并进行皮肤活体组织(包括毛囊)。样本最好在-20℃及以下保存。
5.3.3 人类和动物死后诊断的取样
脑组织对于人类和动物死后诊断而言都是最佳样本(2、3)。在许多情况下,因为家庭许可或与动物大脑切除相关的实际和生物安全问题等因素,可能无法切除大脑进行死后取样。这些难题有的可以通过有效成熟的样本采集技术来解决,只需要通过侵入性较小的途径(3),例如通过眼眶或枕骨大孔。
诊断样本可以在不打开颅骨的情况下收集,例如沿眼睛方向将5mm吸管或2ml一次性塑料吸管插入枕骨孔,或者使用套管针在眼眶后壁上钻孔,并插入塑料吸管或吸管。样本可以从延髓、小脑底部、海马、皮质收集。当使用吸管时,应该用手指将其夹住,防止材料在抽出时漏出。
在检测前最好将大脑组织冷藏或冷冻。如果无法实现,可以将样本在环境温度下保存在50%甘油盐水溶液中。不建议将甘油中的样本冷冻。在检测前必须进行清洗,去除甘油;在直接荧光抗体试验前不建议使用丙酮固定。
如果使用合适的组织和试验,对化学固定的病毒抗原样本的检查可能更具灵敏性和特异性,但不推荐用于常规诊断。如果样本泡在福尔马林中,那么在用石蜡包埋前,大脑固定的时间大约应为7-14天。应将湿组织样本从福尔马林转移到无水乙醇中,用于随后的分子诊断和抗原检测。
对于病毒株的分子研究和基因特性鉴定,将疑似感染狂犬病病毒的脑组织或体液浸渍到含有适当灭活化学品的滤纸上,这样可以在环境温度下安全、稳定、经济有效地运送样品。但是,装运前应确保进行了有效的病毒灭活。
5.3.4 样本运输
诊断样本应根据样本类型进行冷冻或冷藏。如上所述,取样后应保持冷链运输。用于狂犬病诊断的样本应按照国家和国际条例进行运送以避免暴露风险(8)。世界卫生组织对有关感染性物质运输的建议中给出了包装说明(8)。相关运输分类信息可查阅国际航空运输协会网站(http://www.iata.org/publications/dgr/Pages/index.aspx)
只有通过适当的实验室检测方法才能得出可靠的确信的狂犬病诊断。基本的检测技术可以参照世界卫生组织出版的《狂犬病实验室技术》(2)和世界动物卫生组织的《陆生动物诊断试验和疫苗手册》(3)。狂犬病的标准诊断试验总结见表4。表5列出了自1996年世界卫生组织实验室技术公布和世界动物卫生组织手册发布以来的其他试验信息,包括每项试验的指示和性能。下列章节也简要描述了诊断试验。无论使用哪种实验室技术,强烈建议执行常规的质量管理(2、3)。世界卫生组织将于2018年出版一份更新的实验室手册。
表4
狂犬病的标准诊断试验
| 抗原检测 | RNA检测 | 病毒分离 | 抗体检测 | |||||
| 属种
(试验时间) |
样本a | 试验b | 样本 | 试验 | 样本 | 试验 | 样本 | 试验 |
| 人类(生前c) | 皮肤/毛囊 | FAT | 皮肤/毛囊、唾液
眼泪、脑脊液 |
RT- PCRd | 唾液、眼泪、脑脊液 | RTCIT
MI |
血清、脑脊液 | RFFIT、FAVN试验
IFA ELISA |
| 人类(死后) | 大脑
皮肤/毛囊 |
FAT DRIT
IHC |
大脑
皮肤/毛囊 |
RT-PCR | 大脑 | RTCIT
MI |
NA | NA |
| 动物(死后) | 大脑 | FAT DRIT
IHC |
大脑 | RT-PCR | 大脑 | RTCIT
MI |
NA | NA |
缩写:CSF——脑脊液;DRIT——直接快速免疫组织化学试验;ELISA——酶联免疫吸附测定;FAT——直接荧光抗体试验;FAVN——荧光抗体病毒中和;IFA——间接免疫荧光;IHC——福尔马林固定样本的免疫组织化学;MI——小鼠接种试验;NA——不适用;RTCIT——狂犬病细胞培养接种试验;RT-PCR——逆逆转录聚合酶链反应
a 如列出了多个样本类型,粗体显示的样本的诊断灵敏度最高。
b 如列出了不止一个试验,最好采用粗体显示的试验。
c 生前样本中的阳性结果可以确诊,但阴性结果不能排除狂犬病。
d RT-PCR可能采用常规模式也可采用实时模式。
表5
自1996年发布的世界卫生组织《狂犬病实验室技术》(2)以来引入的狂犬病诊断试验
| 试验 | 目标 | 样本类型 | 目的 | 实验室 | 优点 | 缺点 | 备注 |
|---|---|---|---|---|---|---|---|
| 直接快速免疫组织化学试验(DRIT)(10、25) | 病毒蛋白(核蛋白) | 大脑 | 初步死后诊断;加强的监控 | 中央和地方网络 | 高灵敏度和特异性;包括从疑似狂犬病的哺乳动物身上收集的中枢神经系统印片的光学显微镜技术;快速;适用于野外条件下的监控;需要来自世界动物卫生组织和世界卫生组织参考实验室或自产的具有生物素标记的单克隆或多克隆抗体 | 需要基本的实验室设备、试剂和培训。目前无法购买到产品 | 被认为是世界动物卫生组织推荐的另一个同等的主要死后诊断试验;多种抗体可供选择,因此可检测所有已知狂犬病病毒属;在北美作为日常使用技术,用于加强对野生动物狂犬病口服
疫苗接种计划的监测 |
| 间接快速免疫组织化学试验(IRIT)(17、26) | 病毒蛋白 | 大脑 | 确诊病例的抗原分型 | 中央参考和本地网络 | 在光学显微镜下通过单克隆抗体分型来鉴定犬狂犬病病毒;世界卫生组织合作中心可大量提供这种试验 | 同上 | 通过消除犬介导的狂犬病计划,抗原变体分型已经在整个拉丁美洲中广泛传播 |
| 用于狂犬病病毒检测的免疫层析试验(即:横流装置)(12、14) | 病毒蛋白(核蛋白) | 大脑 | 家畜和野生动物中狂犬病病毒的筛选 | 中央和地方网络 | 技术要求低;包容性要求低;可以在采样点使用;适用于野外条件下的监控 | 需要对一些试剂盒进行更好的标准化和质量控制 | 不能替代目前推荐的参考技术,但对于缺乏监控的国家可能会有所帮助 |
| RT-PCR(常规和实时)(16、27、 28) | 病毒RNA | 生前组织(如唾液、颈部皮肤、脑脊液、眼泪、角膜洗液)和死后组织(如中枢神经系统) | 初步诊断;病毒变异体分型 | 中央参考实验室 | 高灵敏度和特异性;人类狂犬病的生前诊断,用于确认临床诊断和患者管理,隔离看护机构和暴露后免疫,切断接触;也可用于脑组织(人或动物)的死后鉴定;扩增材料可以进行测序,以进一步鉴定病毒。 | 技术要求高;灵敏度取决于所收集样本的类型;大约100%用颈背皮肤活检以及至少三份唾液样本;如果这些要求没有得到满足,阴性试验结果不能排除狂犬病的诊断;要求严格进行质量保证且样品得到很好的保存。 | 获取脑组织仍然是人类狂犬病诊断的难题;因此,此类试验可能是唯一可行的,特别是对于生前试验 |
| 竞争性酶联免疫吸附测定(试剂盒)(29、30 ) | 宿主抗体(动物) | 血清;滤纸上吸附的血清;肌肉提取物 | 狂犬病病毒抗体的检测和鉴定;抗体对疫苗接种的反应测定;血清学监测 | 中央和地方网络 | 实验室间重复性好;供应商受控;内部控制;不具有属种特异性;无需针头、注射器或真空试管,直接在现场即可轻松、快速取样 | 需要一些基本的实验室设备;可能还需要进行其他验证步骤a | 目前可获得的试剂盒被用于测定犬类疫苗和野生动物口服狂犬病疫苗的抗体反应,而不是人类抗体 |
| 间接酶联免疫吸附测定(试剂盒)(23) | 宿主抗体(人类、动物) | 血清、血浆 | 狂犬病病毒抗体的检测和鉴定;抗体对疫苗接种的反应的测量;血清学监测 | 中央和地方网络 | 实验室间具有良好重复性;供应商受控;内部控制 | 需要一些基本的实验室设备;可能不是对所有属种都有用;可能需要进行其他验证步骤;a可以只检测某些狂犬病病毒抗体同型(如免疫球蛋白G) | 有助于确认暴露人员的免疫反应或免疫受损患者在暴露后免疫期间的免疫反应,或当与推荐的暴露后免疫计划出现重大偏差时,确认免疫反应;可用于血清学调查 |
| 用于狂犬病病毒抗体的免疫层析试验(即:横流装置)(31) | 宿主抗体(动物) | 血清 | 狂犬病病毒抗体的筛选,如对疫苗接种的反应;血清学监测 | 中央和地方网络 | 技术要求低;包容性要求低;可以在取样点使用 | 仅用于确定狂犬病疫苗接种后体液免疫反应的筛选试验 | 适用于没有快速荧光灶抑制试验、荧光抗体病毒中和试验或酶联免疫吸附测定所需设备地区的犬介导的狂犬病疫苗接种或当地疫苗接种诊所 |
a 中和抗体水平的相关性可能取决于试剂盒抗原和狂犬病病毒疫苗株之间的同源性以及宿主基因。为实现试验目的,适当截止水平的确定需要验证。
5.4.1 病毒抗原检测
直接荧光抗体试验(FAT)是诊断动物和人类狂犬病的一种快速、灵敏、特异的方法(2、3、9),也是狂犬病诊断的金标准。然而,该试验的准确性依赖于检测者的经验、抗狂犬病结合物的质量、荧光显微镜等相关设备以及样本质量。该试验是抗狂犬病多克隆球蛋白潜伏后或与异硫氰酸荧光素标记的单克隆抗体结合发生广泛交叉反应后的脑组织印片或涂片显微镜检测。诊断性结合物应是高质量的,并且需要确定病毒特异性抗原最佳显现和检测的工作浓度。脑干或小脑样本的组织印片(或涂片)可确保检测高灵敏度,优先推荐。也可以使用海马(阿蒙氏角),但并非确诊所必需。
酶联免疫吸附测定(ELISA)和直接快速免疫组织化学试验(DRIT)等检测狂犬病病毒抗原的其他方法,在一些实验室也能得出一致的可重复的结果。直接快速免疫组织化学试验的大量评估表明其灵敏度和特异性至少能够与直接荧光抗体试验相媲美(10、25)。直接快速免疫组织化学试验可以使用光学显微镜进行快速的现场检测,而且如果其试剂可以在市场上购得,该试验方法还有助于进行分散的流行病学调查。本次磋商会推荐将直接快速免疫组织化学试验作为直接荧光抗体试验的一种替代方法以改善分散式的实验室监测。
可以通过已验证的免疫组织化学方法从神经元中检测到福尔马林固定的脑组织中典型的胞浆内包涵体(11);然而,脑组织的福尔马林固定并不适用于常规诊断,因为它会延迟检测结果,并且不如直接荧光抗体试验或直接快速免疫组织化学试验灵敏。
在野外条件下进行的狂犬病病毒抗原快速检测的横向流动检测已经得到了发展,有的表现出良好的结果(12-14),然而,这些检测仍然需要根据国际标准进行充分验证(2、13)。然而,在难以将样本运送到实验室或缺乏实验室诊断设施的情况下,这类检测可能有助于监测;同时也可以提高一线工作人员对狂犬病监测的参与度。
5.4.2 病毒分离
只有进行病毒分离才可以确认病毒抗原检测结果以及进一步扩增或明确分离株特性(2)。狂犬病病毒属可以通过细胞培养分离,如神经母细胞瘤细胞,或通过小鼠颅内接种分离。动物病毒分离应尽可能采用其他可以替代的方法取代。鼠神经母细胞瘤细胞(如NA C1300)用于狂犬病病毒的现场分离株时比其他测试过的细胞系更灵敏(2)。病毒通过神经母细胞瘤细胞培养分离至少具有与动物接种分离相同的效率,特别是在病毒量少的时候。细胞培养分离还可以减少诊断所需时间,将小鼠接种试验所需的10-21天减少至仅2-4天 。然而,如果条件并不适合,例如脑组织腐烂,也有可能得到假阴性结果。在无法使用细胞培养设施或分子方法时,可以使用动物接种法。如果需要尽快得到结果,乳鼠(<3 日龄)比断乳期或成年的小鼠更好,因为乳鼠比年长的动物更加敏感。接种病毒后4 天开始,通过接种数量足够的小鼠,然后连续杀死小鼠,并采用荧光抗体试验法进行检查,这可以缩短观察期(15)。
5.4.3 病毒RNA检测
分子方法,如逆转录聚合酶链反应(RT-PCR)和其他扩增技术,在许多国家发挥着越来越重要的作用(16、17)。如果能得到脑组织,应使用直接荧光抗体试验或直接快速免疫组织化学试验进行病毒抗原的初步诊断(2)。分子技术可用于实验室中的验证性测试和流行病学调查,这些实验室具有严格的质量控制程序,并具有使用这种技术的经验和专业知识。分子技术也可以用于人类生前诊断。强烈推荐在分子检测方法中应用强阳性对照或过程中质量控制。
许多实验室方法可以用于患者活着时确定该临床病例是否患狂犬病(1);然而应用生前技术诊断动物狂犬病却困难重重。诊断狂犬病技术的灵敏度因疾病阶段、免疫状况、间歇性病毒排出以及技术人员培训情况的不同会出现很大差异。经过验证的阳性结果表明有狂犬病,但阴性结果不一定能排除感染的可能。
对疑似狂犬病的患者进行狂犬病诊断时从多方面分析会更有价值,包括致病病原及潜在感染源的特异性特征,特别是在缺乏动物暴露史的情况下;在公共健康调查中确定有可能暴露于同一动物的其他人群;采取适当控制感染的措施来预防因接触患者而造成的暴露;对暴露于患者感染性分泌物的人群提供暴露后免疫措施;病例终结以及安抚病人家庭成员;斟酌实验性治疗方案;若接受治疗,则监测病毒载荷及患者反应;较少创伤的技术,用于记载人类疾病负担,减少尸检;若检测为阴性,则提示其他感染性病原体。
5.5.1 病毒抗原检测
采用直接荧光抗体试验可以在狂犬病临床病例的皮肤活体组织标本或毛囊中检测到病毒抗原(18)。检测结果与患者的抗体状态无关,并且在病程早期样本检测也可能呈阳性。皮肤样本通常取自颈后部,内有包含周围神经的毛囊。需要检测多个截面以确定围绕毛囊的基部是否含有病毒抗原。样本的质量极其重要,例如毛囊的缺失会降低检测的灵敏度。由于需要有低温恒温器来制备冷冻皮肤组织切片,所以此项技术并非适用于所有环境;如果缺乏相应设备,可以用检测病毒RNA来替代(16、27、28)。角膜印片的直接荧光抗体试验在大多数临床环境下是不可靠的,因此为避免角膜划痕风险不推荐将其用作常规检测,尤其是对于脑炎而非狂犬病的患者。免疫层析法已发展为用于直接检测动物脑组织中的狂犬病病毒抗原(12),但在应用于人类生前诊断前,该方法仍需要标准化和严格质量控制。
5.5.2 病毒抗体检测
考虑到病毒的发病机理,很难在人类狂犬病的生前诊断中使用血清学试验,因为狂犬病病毒特异性抗体可能只在人类感染后期出现在血清和脑脊液中。
在未免疫患者的血清或脑脊液中的中和抗体可以通过病毒中和试验来测定,包括快速荧光灶抑制试验(RFFIT)和荧光抗体病毒中和(FAVN)试验(19)。然而,这种检测对生前诊断的灵敏度很低,通常在临床症状出现后平均7-8天,血清中才会出现病毒中和抗体。脑脊液中很少发现病毒抗体,这取决于疾病的临床阶段。用验证后的酶联免疫吸附测定法测定的抗狂犬病病毒G蛋白抗体(免疫球蛋白G亚类)滴度与用病毒中和试验测定的结果有很好的相关性,并且酶联免疫吸附测定法更方便常规操作(20、21)。然而,酶联免疫吸附测定法无法检测到暴露后首次产生的免疫球蛋白M狂犬病特异性抗体。快速检测其他病毒抗原(如核蛋白)的抗体(免疫球蛋白G和M)也可能是有用的,因为这些抗体可能比中和抗体出现的时间早(4)。
5.5.3 病毒RNA检测
分子检测方法对于狂犬病诊断而言具有高灵敏度(1、2)。然而就像所有的实验室方法一样,分子检测方法需要标准化和严格的质量控制。狂犬病病毒RNA不仅能在许多生物体液和组织样本(如唾液、脑脊髓液、眼泪、皮肤、浓缩尿液和毛囊)中检测到和扩增到。由于病毒间歇性排出,应对连续样本进行检测。皮肤活检(包括毛囊)和唾液的灵敏度最高。
5.5.4 病毒分离
在生前诊断中,最好采用唾液或其他生物样本进行病毒分离,从而得到明确诊断和病毒特征(1-3)。分离成功率取决于患者的免疫状态(没有抗体的患者更容易分离出病毒)、病毒排出的间歇以及细胞培养中连续传代的次数。即使在病程晚期,这些样本中也可能没有感染性病毒。液体样本或者拭子采集后应冷冻保存,拭子内容物应放入采集液中。采集液中绝不能加入防腐剂。
推荐使用快速荧光灶抑制试验病毒中和抗体测定和荧光抗体病毒中和试验测量疫苗接种后的免疫反应,并确定是否需要加强疫苗接种,这是由于它们与动物研究中的保护水平相关(19、22)。病毒中和测定用于确定免疫缺陷患者的保护性抗体水平,评估新疫苗或疫苗接种计划,并根据个体风险因素决定在中和抗体水平接近临界值时是否进行加强疫苗接种。
由于酶联免疫吸附测定法更容易实施,因而可用于常规筛选,以确定暴露前或暴露后接种疫苗后是否出现了免疫反应(21)。用酶联免疫吸附测定法测量结合抗体和用快速荧光灶抑制试验和荧光抗体病毒中和试验测量中和抗体,两者在本质上是不同的,解释结果时应考虑到这一点(23)。通过验证后的酶联免疫吸附测定法测定的针对狂犬病病毒G蛋白的疫苗接种后抗体(免疫球蛋白G亚类)滴度与通过病毒中和测定的滴度具有较强相关性(21)。在使用市售试剂盒之前,应在当地条件下评估其性能特征(即适当截止水平、灵敏度和特异性)(23)。就监测计划的目的而言,应考虑和评估试剂盒的局限性,如属种特异性、检测到的免疫球蛋白类别和线性范围(22)。
建议参与实施质量保证和能力计划,确保通过快速荧光灶抑制试验、荧光抗体病毒中和试验或酶联免疫吸附测定进行狂犬病血清学检测的实验室结果有效。
快速荧光灶抑制试验、荧光抗体病毒中和试验、验证后的酶联免疫吸附测定可用于测量动物接种疫苗后的免疫反应(19、22)。当对疫苗质量、疫苗贮存(如冷链运输系统的维护)或疫苗输送的有效性有任何不确定性时,测量接种后的免疫反应很重要。疫苗接种后的样本应在预期最高滴度的时间点或接近该时间点进行测定(疫苗接种后大约4周)。该时间点后采集的样本的血清学结果可能难以解释,因为即使动物仍然在保护期不会被感染,抗体滴度也可能会迅速下降。由于抗体下降的速度变化不定,而且可能很快,因此不建议在接种疫苗后4周以上再进行血清学调查来监测接种后覆盖率或人群免疫力(19、24)。推荐在国际动物迁移和贸易中使用快速荧光灶抑制试验(32)和荧光抗体病毒中和(19)测定法(3)。病毒中和(如快速荧光灶抑制试验、荧光抗体病毒中和试验)和酶联免疫吸附测定都适用于监测狂犬病控制体系内接种动物的抗体反应。
酶联免疫吸附测定可采用试剂盒模式,可以是间接的或有对比性的。为进行检测,在测定验证合格后,可以使用酶联免疫吸附测定。如上所述,在使用市售试剂盒之前,应在当地条件下评估其性能特征。.
应用分子技术已经对数以千计的来自于人类、家养和野生动物的狂犬病病毒分离株进行了比较,引导了狂犬病病毒属的基础鉴定和分类,并揭示了从特定地理区域或物种分离到的病毒分离株具有独特的基因序列。在大多数情况下,这些差异可以用来确定主要的宿主动物(如蝙蝠、犬类、狐狸),在缺乏明确暴露史的情况下可以推断传染源(1、2)。
1. Dacheux L, Wacharapluesadee S, Hemachudha T, Meslin FX, Buchy P, Reynes JM et al. More accurate insight into the incidence of human rabies in developing countries through validated laboratory techniques. PLoS Negl Trop Dis. 2010;4(11):e765.
2. Meslin FX, Kaplan MM, Koprowski H, editors. Laboratory techniques in rabies. Fourth edition. Geneva: World Health Organization; 1996:9–27.
3. Rabies (infection with rabies virus). Chapter 2.1.17. Manual of diagnostic tests and vaccines for terrestrial animals. Vol. 2. Paris: World Organisation for Animal Health; 2017.
4. Petersen BW, Rupprecht CE. Human rabies epidemiology and diagnosis. In: Tkachev S, editor. Non-flavivirus encephalitis. InTech; 2011. doi: 10.5772/21708.
5. Rupprecht CE, Hemachudha T. Rabies. In: Scheld WM, Whitley RJ, Marra CM, editors. Infections of the central nervous system. Philadelphia: Lippincott, Williams & Wilkins; 2004.
6. Feder HM, Petersen BW, Robertson KL, Rupprecht CE. Rabies: still a uniformly fatal disease? Historical occurrence, epidemiological trends, and paradigm shifts. Curr Infect Dis Rep. 2012;14(4):408–22.
7. Laothamatas J, Hemachudha T, Mitrabhakdi E, Wannakrairot P, Tulayadaechanont S. MR imaging in human rabies. Am J Neuroradiol. 2003;24(6):1102–9.
8. Guidance on the regulations for the transport of infectious substances 2017–2018. Geneva: World Health Organization; 2017.
9. Robardet E, Picard-Meyer E, Andrieu S, Servat A, Cliquet F. International interlaboratory trials on rabies diagnosis: an overview of results and variation in reference diagnosis techniques (fluorescent antibody test, rabies tissue culture infection test, mouse inoculation test) and molecular biology techniques. J Virol Methods. 2011;177(1):15–25.
10. Coetzer A, Sabeta CT, Markotter W, Rupprecht CE, Nel LH. Comparison of biotinylated monoclonal and polyclonal antibodies in an evaluation of a direct rapid immunohistochemical test for the routine diagnosis of rabies in southern Africa. PLoS Negl Trop Dis. 2014;8(9):e3189.
11. Stein LT, Rech RR, Harrison L, Brown CC. Immunohistochemical study of rabies virus within the central nervous system of domestic and wildlife species. Vet Pathol. 2010;47(4):630–3.
12. Servat A, Picard-Meyer E, Robardet E, Muzniece Z, Must K, Cliquet F. Evaluation of a rapid immunochromatographic diagnostic test for the detection of rabies from brain material of European mammals. Biologicals. 2012;40(1):61–6.
13. Eggerbauer E, de Benedictis P, Hoffmann B, Mettenleiter TC, Schlottau K, Ngoepe EC et al. Evaluation of six commercially available rapid immunochromatographic tests for the diagnosis of rabies in brain material. PLoS Negl Trop Dis. 2016;10(6):e0004776.
14. Léchenne M, Naïssengar K, Lepelletier A, Alfaroukh IO, Bourhy H, Zinsstag J et al. Validation of a rapid rabies diagnostic tool for field surveillance in developing countries. PLoS Negl Trop Dis. 2016;10(10):e0005010.
15. Webster WA, Casey GA, Charlton KM. The mouse inoculation test in rabies diagnosis: early diagnosis in mice during the incubation period. Can J Comp Med. 1976;40(3):322.
16. Faye M, Dacheux L, Weidmann M, Diop SA, Loucoubar C, Bourhy H et al. Development and validation of sensitive real-time RT-PCR assay for broad detection of rabies virus. J Virol Methods. 2017;243:120–30.
17. Mani RS, Madhusudana SN. Laboratory diagnosis of human rabies: recent advances. Sci World J. 2013;2013:569712.
18. Crepin P, Audry L, Rotivel Y, Gacoin A, Caroff C, Bourhy H. Intravitam diagnosis of human rabies by PCR using saliva and cerebrospinal fluid. J Clin Microbiol. 1998;36(4):1117–21.
19. Cliquet F, Aubert M, Sagne L. Development of a fluorescent antibody virus neutralisation test (FAVN test) for the quantitation of rabies- neutralising antibody. J Immunol Methods. 1998;212(1):79–87.
20. Welch RJ, Anderson BL, Litwin CM. An evaluation of two commercially available ELISAs and one in-house reference laboratory ELISA for the determination of human anti-rabies virus antibodies. J Med Microbiol. 2009;58(6):806–10.
21. Feyssaguet M, Dacheux L, Audry L, Compoint A, Morize JL, Blanchard I et al. Multicenter comparative study of a new ELISA, PLATELIA™ RABIES II, for the detection and titration of anti-rabies glycoprotein antibodies and comparison with the rapid fluorescent focus inhibition test (RFFIT) on human samples from vaccinated and non-vaccinated people. Vaccine. 2007;25(12):2244–51.
22. Moore SM, Hanlon CA. Rabies-specific antibodies: measuring surrogates of protection against a fatal disease. PLoS Negl Trop Dis. 2010;4(3):e595.
23. Moore SM, Pralle S, Engelman L, Hartschuh H, Smith M. Rabies vaccine response measurement is assay dependent. Biologicals. 2016;44(6):481– 6.
24. Moore SM, Gilbert A, Vos A, Freuling CM, Ellis C, Kliemt J et al. Rabies virus antibodies from oral vaccination as a correlate of protection against lethal infection in wildlife. Trop Med Infect Dis. 2017;2(3):31.
25. Rupprecht C, Cliquet F, Fehlner-Gardiner C, Fooks AR, Mueller T, Saveta C et al. Progress in the development of a direct rapid immunohistochemical test for diagnosing rabies. In: News from Colleagues. Paris: World Organisation for Animal Health; 2014;3:87–95 (https://www.oie.int/doc/ ged/D14185.PDF).
26. Dyer JL, Niezgoda M, Orciari LA, Yager PA, Ellison JA, Rupprecht CE. Evaluation of an indirect rapid immunohistochemistry test for the differentiation of rabies virus variants. J Virol Methods. 2013;190(1– 2):29–33.
27. Dacheux L, Larrous F, Lavenir R, Lepelletier A, Faouzi A, Troupin C et al. Dual combined real-time reverse transcription polymerase chain reaction assay for the diagnosis of lyssavirus infection. PLoS Negl Trop Dis. 2016;10(7):e0004812.
28. Mani RS, Madhusudana SN, Mahadevan A, Reddy V, Belludi AY, Shankar SK. Utility of real‐time Taqman PCR for antemortem and postmortem diagnosis of human rabies. J Med Virol. 2014;86(10):1804–12.
29. Bedeković T, Šimić I, Krešić N, Lojkić I, Mihaljević Ž, Sučec I et al. Evaluation of ELISA for the detection of rabies virus antibodies from the thoracic liquid and muscle extract samples in the monitoring of fox oral vaccination campaigns. BMC Vet Res. 2016;12(1):76.
30. Wasniewski M, Almeida I, Baur A, Bedekovic T, Boncea D, Chaves LB et al. First international collaborative study to evaluate rabies antibody detection method for use in monitoring the effectiveness of oral vaccination programmes in fox and raccoon dog in Europe. J Virol Methods. 2016;238:77–85.
31. Manalo DL, Yamada K, Watanabe I, Miranda ME, Lapiz SM, Tapdasan E et al. A comparative study of the rapina and the virus‐neutralizing test (rffit) for the estimation of antirabies‐neutralizing antibody levels in dog samples. Zoonoses Public Health. 2017;64(5):355–62.
32. Smith JS, Yager PA, Baer GM. A rapid reproducible test for determining rabies neutralizing antibody. Bull World Health Organ. 1973; (48): 535- 541.
狂犬病被认为是一种极易致命的疾病,据记载每年有数万人死于狂犬病,只有少数存活者。在世界范围内,每年可能至少有59000名疑似或确诊狂犬病患者死亡(1)。死亡人群绝大多数在亚洲和非洲贫困的农村地区,这些地区犬介导的狂犬病发病率很高,而且人们可能难以及时获得负担得起的完善的暴露后免疫。
这些患者中,大多数人至少最初是在偏远医疗中心甚至乡村医疗中心接受治疗的,这些医疗中心内,用于基本伤口护理和狂犬病预防的人力和物力资源往往极其有限或根本没有。一旦出现临床症状,狂犬病就无法得到有效的治疗。因此,几乎所有狂犬病患者都会死亡。
图3提出了一种算法,用于指导确认或疑似狂犬病的人类病例的管理。
图3
用于指导确认或疑似人类狂犬病病例管理的建议算法
资料来源:参考文献2-5
大多数狂犬病患者是有清醒意识的,并且清楚疾病的性质和结果。他们通常极度焦虑,尤其是明显有兴奋症状时(“狂躁型”狂犬病)。此外,由于狂犬病病毒可能通过接触传播,他们经常会被隔离起来。不幸的是,在一些国家,许多狂犬病患者被医院拒之门外,只能接受家人的临终关怀。建议尽可能为临床狂犬病患者提供医院护理,减少他们的痛苦,并确保他们能够得到充分、尊重的姑息治疗。
虽然几乎所有的狂犬病患者都会死亡,但是医护人员仍然可以发挥重要作用,为患者提供及时、有效、全面、热心、感性的治疗。这一点即使只有极其有限的设备和药物也可以做到(4)。鉴于在大多数情况下死亡是不可避免的,尤其是一旦确诊后,治疗应该集中在舒适性上,如大剂量镇静(巴比妥类药物、吗啡)和避免插管或生命维持措施(1)。
大多数狂犬病患者不适合在重症监护室接受积极治疗(见第6.4节)。所有狂犬病预防和管理指南内均应包含对狂犬病患者的姑息治疗(无论是在医院还是在家里)相关内容。在每一个医疗环境下,狂犬病患者(和其他绝症患者)均应能够获得姑息治疗,并且必须对医护人员进行培训,以提供有效的姑息治疗。世界卫生组织在其姑息治疗相关网页上提供了关于姑息治疗的一些资料和世界卫生组织姑息治疗指南(包括基本药物)(6)。
确诊患有狂犬病的患者应在适当的医疗机构接受充分的水化、镇静和护理,最好是在无气流、安静的房间,并提供有适当的情绪和生理支持(4、7)。应该尊重患者的隐私、尊严和文化需求。确保家人在患者临终时能够与他们沟通,这必须是优先考虑的事情。诊断完成后应尽快与家人讨论相关的事宜。
地西泮等苯二氮平类药物对镇静和肌肉放松有效,可以通过皮下注射、静脉注射或直肠给药。劳拉西泮和咪达唑仑可作为苯二氮平类药物的替代品。吗啡可以通过皮下或静脉注射用于镇痛,但非常偏远的医疗中心通常很难有吗啡。推荐使用氟哌啶醇作为主要镇定剂用于躁动、烦乱、幻觉和攻击(8),但一些内科医师则避免使用该药物,因为其副作用及其镇静效果比其他药物更不易控制。可用抗胆碱能药物(如东莨菪碱)治疗过量流涎。药物应采用滴定,以避免过度镇静(需插管)。
多次静脉注射或皮下注射吗啡或苯二氮卓类药物能有效缓解狂犬病患者(1)的症状:严重躁动、焦虑和肌肉痉挛。一旦诊断出狂躁型型狂犬病,应避免侵入性治疗。
最好在医院进行狂犬病患者的姑息治疗,静脉注射药物以最大程度减少干扰和痛苦。狂犬病不是在病人护理期间可能爆发的接触传染病,仅在特殊情况下,如器官移植,才有关于人际间传播的记录(见第8.3.2节)。当狂犬病患者和/或其家属要求出院或拒绝入院时(如,出于文化或宗教原因),医护团队应考虑非卧床式缓解(药物治疗和个人防护设备)。如需要转院,非静脉注射给药或非肠道路径(含鼻胃管或直肠内路径)继续给药可能为优选给药方式。对于医护团队来说,转院需求可能是他们最初选择较轻镇静治疗的另一原因(4)。
在大多数狂犬病患者死亡之际,应通知仍寻求治疗的家属并劝告其接受患者濒死的消息。护理狂犬病患者可能引起医护人员、亲友以及媒体和公众的焦虑。采取常规预防措施,特别是在插管和抽吸期间,人类狂犬病不会对医护人员构成危险。
经过仔细评估后,应向被认为处于风险中的医护人员提供暴露后免疫(PEP),并提醒他们遵守屏障护理和穿戴个人防护设备(标准预防措施,包括戴手套、眼镜和面罩,以防手术中出现飞溅)的重要性,所有传染性疾病都应遵循此建议。接收狂犬病患者的医院可考虑为可能参与狂犬病患者治疗的医护人员提供暴露前免疫(见第8.2节)。
对患者伴侣来说,暴露后免疫(PEP)有时是必要的,因为在疾病早期的亲密接触和性交构成了传播的假设风险(唾液中存在传染性狂犬病病毒(RABV));然而,没有报告明确证实了人际间传播。
应识别出接触过同一咬人动物的人,并接受足够的暴露后免疫措施(PEP)。狂犬病病毒(RABV)的病理生物学和流行病学表明,婴儿从母乳中感染狂犬病的风险类似于饮用患狂犬病动物的乳汁:这不构成相应的公共健康风险(见第8.3.2节)。
据明确记载全球至少有15例存活者(9)。除一个病例外,所有幸存者在狂犬病临床症状发作前都接种了一剂或多剂狂犬病疫苗。狂犬病存活者的免疫反应与血清和脑脊液(CSF)中的中和抗狂犬病病毒(RABV)抗体水平有关。
目前的“积极”治疗方案,如密尔沃基疗法(11),无法保证存活者没有严重后遗症。但在某些特殊情况下,可考虑采用积极治疗。积极治疗应在拥有训练有素团队的机构进行,这些团队有相关的治疗经验并就狂犬病患者情况与专家进行过沟通协商,经过与家属讨论集体决定,并且排除了患者有其他威胁生命但可治愈疾病(狂犬病脑炎的鉴别诊断)后,使用伦理上预先接受的治疗方案。
6.4.1 重症监护(对症治疗)
1969年报道的第一位有记录的狂犬病存活者仅接受了未插管的重症监护(10)。自2004年在美国成功治愈一名青少年后,一种被称为密尔沃基疗法(11)的治疗方法被多次使用,然而迄今为止还没有完全证明这种疗法是成功的(12)。在过去几年中,印度报告了6例有充分证据证明的存活病例(尽管有严重的神经功能缺损)(13、14),且症状出现后依然存活数周的案例也不断上升。这可能是因为人们对狂犬病的认识提高,且狂犬病流行国家更易获得犬伤急救护理。
然而,积极的临床治疗方案常常与高失败风险相关联,且难以实施,尤其是在资源有限的情况下。因此,仅少数保持警觉或有轻度抑郁的狂犬病患者被认为是积极治疗的候选人。能否实施主要取决于获得足够资源的及时性,包括急救护理设施和一个有能力的团队(3)。有患者在接受重症监护后得以存活,但仍然处于植物人状态,其血清和脑脊液(CSF)抗体产生较早,但没有发现明显的病毒或病毒核糖核酸(RNA)(表明病毒已从体内清除)。尽管如此,这些因素对于预测结果来说极不可靠的(1、15)。
在考虑对狂犬病患者使用“积极”治疗方式时,应记住以下几点(1):
■ 狂犬病几乎都是致命的,但也有极少数患者康复,在大多数情况下伴随这严重的后遗症,这可能会对患者及其家属和护理人员产生糟糕的长期影响。
■ 大多数存活者,无论是否接受治疗,都有强烈的早期免疫反应。虽然蝙蝠狂犬病病毒导致的病例更容易在血清和/或脑脊液中产生抗体,但犬犬介导的狂犬病病例却与此不同。大多数蝙蝠狂犬病病毒引起的病例都未存活下来。
■ 目前,无法准确预测哪些患者可能康复。
■ 以符合伦理的方式进行了精心计划和验证研究,以确定治疗方案、免疫调节程序,并鼓励使用新药,含抗病毒药物。
■ 人类狂犬病治疗必须是安全的,且不会对患者造成进一步伤害。
6.4.2 狂犬病特效疗法
能够促进药物、抗体和免疫效应细胞进入血脑屏障和血脊髓屏障的药剂且在非昏迷阶段(1)保持完整,以及清除非神经器官(尤其是心脏)中病毒的药剂可能都是有用的。目前,正在研究有效抗狂犬病的抗病毒药物,但需证明这些药物是合理安全的,不会造成进一步伤害(17~19)。一种被批准用于人类抗核糖核酸(RNA)病毒感染的药物已问世,对部分狂犬病病例可能会有益处(20、21)。任何情况下,在临床团队对患者使用抢救性治疗方案前,需对该方案进行说明并提交至伦理委员会批准。
疑似死于狂犬病的患者尸体应贴上传染性标签,而不是“接触传染性”(非空气传播或飞沫传播)。如标准预防措施到位,传染风险是极低的(22)。血液中不含狂犬病病毒(RABV),但病毒存在于许多其他组织和液体中,如中枢神经系统和唾液腺(1)。进行尸体防腐或尸体解剖应小心进行,准备适当预防措施并配备个人防护设备。组织和体液的处理方式应与其他传染病一样。根据其宗教习俗,应允许埋葬或火葬死者尸体。
狂犬病病毒(RABV)在患病后期存在于许多组织中,移植有神经症状和狂犬病症状捐赠者的器官之前,应格外注意。据记载有几例因器官和组织移植而导致的狂犬病病例(23~25)。常见或高度致命性感染疾病的检测应与移植活体器官的紧迫性相平衡。角膜移植在发展中国家很常见,在不能排除死者是否死于狂犬病的情况下,不应进行角膜移植。
1. Hemachudha T, Ugolini G, Wacharapluesadee S, Sungkarat W, Shuangshoti S, Laothamatas J. Human rabies: neuropathogenesis, diagnosis, and management. Lancet Neurol. 2013;12(5):498–513.
2. Wilde H, Hemachudha T, Jackson AC. Viewpoint: management of human rabies. Trans R Soc Trop Med Hyg. 2008;102(10):979–82.
3. Jackson AC, Warrell MJ, Rupprecht CE, Ertl HC, Dietzschold B, O’Reilly M et al. Management of rabies in humans. Clin Infect Dis. 2003;36(1):60– 3.
4. Tarantola A, Crabol Y, Mahendra BJ, In S, Barennes H, Bourhy H et al. Caring for patients with rabies in developing countries – the neglected importance of palliative care. Trop Med Int Health. 2016;21(4):564–7.
5. Lindqvist O, Lunquist G, Dickman A, Bükki J, Lunder U, Hagelin CL et al. Four essential drugs needed for quality care of the dying: a Delphi- study based international expert consensus opinion. J Palliat Med. 2013;16(1):38–43.
6. Planning and implementing palliative care services: a guide for programme managers. Geneva: World Health Organization; 2016.
7. Daher ED, Júnior S, Ferreira MT, Barros FA, Gurgel TM, Patrocínio RM. Renal involvement in human rabies: clinical manifestations and autopsy findings of nine cases from northeast of Brazil. Rev Inst Med Trop Sao Paulo. 2005;47(6):315–20.
8. Marsden SC, Cabanban CR. Rabies: a significant palliative care issue. Prog Palliat Care. 2006;14(2):62–7.
9. Jackson AC. Human rabies: a 2016 update. Curr Infect Dis Rep. 2016;18(11):38.
10. Hattwick MA, Weis TT, Stechschulte, Baer GM, Gregg MB. Recovery from rabies: a case report. Ann Int Med. 1972;76(6):931–42.
11. Willoughby RE Jr, Tieves KS, Hoffman GM, Ghanayem NS, Amlie- Lefond CM, Schwabe MJ et al. Survival after treatment of rabies with induction of coma. N Engl J Med. 2005;352(24):2508–14.
12. Zeiler FA, Jackson AC. Critical appraisal of the Milwaukee protocol for rabies: this failed approach should be abandoned. Can J Neurol Sci. 2016;43(1):44–51.
13. Mani RS, Anand AM, Madhusudana SN. Human rabies in India: an audit from a rabies diagnostic laboratory. Trop Med Int Health. 2016;21(4):556–63.
14. Subramaniam R. Human rabies survivors in India: an emerging paradox?. PLoS Negl Trop Dis. 2016;10(7):e0004774.
15. Feder HM, Petersen BW, Robertson KL, Rupprecht CE. Rabies: still a uniformly fatal disease? Historical occurrence, epidemiological trends, and paradigm shifts. Curr Infect Dis Rep. 2012;14(4):408–22.
16. Tarantola A, Goutard F, Newton P, De Lamballerie X, Lortholary O, Cappelle J et al. Estimating the burden of Japanese encephalitis virus and other encephalitides in countries of the Mekong region. PLoS Negl Trop Dis. 2014;8(1):e2533.
17. Assenberg R, Delmas O, Morin B, Graham SC, De Lamballerie X, Laubert C et al. Genomics and structure/function studies of Rhabdoviridae proteins involved in replication and transcription. Antiviral Res. 2010;87(2):149–61.
技术报告系列第 1012, 2018
世界卫生组织
18. Dacheux L, Delmas O, Bourhy H. Human rabies encephalitis prevention and treatment: progress since Pasteur’s discovery. Infect Disord Drug Targets. 2011;11(3):251–99.
19. Appolinario CM, Jackson AC. Antiviral therapy for human rabies. Antivir Ther. 2015;20(1):1.
20. Virojanapirom P, Lumlertdacha B, Wipattanakitchareon A, Hemachudha T. T-705 as a potential therapeutic agent for rabies. J Infect Dis. 2016;214(3):502–3.
21. Yamada K, Noguchi K, Komeno T, Furuta Y, Nishizono A. Efficacy of favipiravir (T-705) in rabies postexposure prophylaxis. J Infect Dis. 2015;213(8):1253–61.
22. Siegel JD, Rhinehart E, Jackson M, Chiarello L. 2007 guideline for isolation precautions: preventing transmission of infectious agents in health care settings. Am J Infect Control. 2007;35(10):S65–164.
23. Srinivasan A, Burton EC, Kuehnert MJ, Rupprecht C, Sutker WL, Ksiazek TG et al. Transmission of rabies virus from an organ donor to four transplant recipients. N Engl J Med. 2005;352(11):1103–11.
24. Maier T, Schwarting A, Mauer D, Ross RS, Martens A, Kliem V et al. Management and outcomes after multiple corneal and solid organ transplantations from a donor infected with rabies virus. Clin Infect Dis. 2010;50(8):1112–9.
25. Ross RS, Wolters B, Hoffmann B, Geue L, Viazov S, Grüner N et al. Instructive even after a decade: complete results of initial virological diagnostics and re-evaluation of molecular data in the German rabies virus “outbreak” caused by transplantations. Int J Med Microbiol. 2015;305(7):636–43.
自40多年前研发面世以来,浓缩、纯化的细胞培养和禽胚狂犬病疫苗(统称为CCEEV)已证明为安全有效的预防狂犬病的疫苗。这些疫苗既适用于暴露前免疫,也适用于暴露后免疫,且在全球范围内,已有数百万人使用(1)。暴露后立即接种CCEEV,结合恰当的伤口处理并联合使用狂犬病免疫球蛋白可以有效的预防狂犬病,即使是发生了高风险的暴露(1)(见第8节)。
人用狂犬病疫苗包括:
■ 细胞培养疫苗:纯化鸡胚疫苗、纯化Vero细胞狂犬病疫苗和人二倍体细胞疫苗(见第7.1.1节);
■ 鸭胚疫苗(见第7.1.1节);
■ 神经组织疫苗(见第7.1.2节)。世界卫生组织建议不要使用神经组织疫苗,因为该疫苗会引起严重不良反应,且其免疫原性低于其他疫苗
目前,有三种人用狂犬病疫苗通过了世界卫生组织预认证:葛兰素史克(GSK)生产的Rabavert®和Rabipur®及赛诺菲巴斯德(Sanofi Pasteur)生产的Verorab®(细胞培养疫苗)。另外还有两种狂犬病疫苗正进行世界卫生组织预认证评估。
7.1.1 采用细胞和禽胚培养技术生产的狂犬病疫苗
CCEEV是通过在细胞基质如人二倍体细胞、Vero细胞、原代鸡胚细胞或原代鸭胚细胞或含胚卵鸭蛋中繁殖狂犬病病毒(RABV)而产生的。附录3概述了目前可用的人用狂犬病疫苗及其生产商。
在细胞培养物(或胚卵)中生长后,病毒收获物被浓缩、纯化、灭活并冻干。在一些CCEEV中,人血白蛋白或经加工的明胶被用作稳定剂。不论是供肌肉注射还是皮内注射用的人用狂犬病疫苗均不装在多剂量的玻璃瓶中,经世界卫生组织预认证的狂犬病疫苗不含防腐剂,如硫柳汞。这些疫苗的保质期≥3年,避光储存在2~8°C的温度条件下。用无菌稀释剂重新配制后,疫苗应立即使用,如保存在+ 2~8℃(2)下,应在6小时内使用,因为部分已使用的狂犬病疫苗小瓶可能会被污染。
人用狂犬病疫苗应符合世界卫生组织生物标准品专家委员会推荐的特征、生产和控制建议(3)。世界卫生组织目前的建议仅适用于细胞培养或禽胚生产的灭活狂犬病疫苗。
7.1.2 神经组织疫苗
神经组织疫苗会引起更为严重的不良反应,产生的免疫原性也比CCEEVs低。世界卫生组织强烈建议停止生产和使用神经组织疫苗,并用CCEEV替代。神经组织疫苗现仅在阿尔及利亚、阿根廷、玻利维亚和埃塞俄比亚生产供人类使用。
磋商会再次强烈建议停止生产和使用基于动物中枢神经系统的疫苗(含乳鼠脑),并用CCEEV代替。用细胞培养或禽胚生产的现代狂犬病疫苗替代神经组织疫苗的四步策略已完成(4),并作为本报告的附录4附上。
由联合国机构供应的疫苗都应当进行世界卫生组织预认证。预认证确保了疫苗的质量、安全性和有效性及在中低收入国家免疫项目中的适用性。预认证是一个既定程序,由疫苗制造商自愿发起,世界卫生组织对取得所在国许可的疫苗进行初步和持续评估。首次预认证后会定期对产品进行重新评估,以确保质量。
疫苗必须在其制造国获得许可,此为预认证的先决条件。疫苗特性,如效价、热稳定性、产品展示、标记和冷链数据等,必须适用于国家免疫项目。生产商还必须满足国际质量标准和良好生产管理规范。预认证包括审查生产过程和质量控制程序,测试产品批次的一致性,世界卫生组织与负责国家监管机构的观察员一起审核生产设施,确保持续可接受性及定期重新评估。持续合规性也是受监控的。目前有三种肌内注射的狂犬病疫苗通过世界卫生组织预认证:纯化Vero细胞狂犬病疫苗、纯化鸡胚细胞疫苗和纯化鸭胚疫苗。可在线获取世界卫生组织预认证的疫苗清单(https:// extranet.who.int/gavi/PQ_Web/)。
磋商会鼓励狂犬病疫苗制造商进入世界卫生组织预认证程序,并鼓励成员国购买世界卫生组织预认证疫苗。
7.3.1 效价要求、试验和标准
CCEEVs的最低效价为2.5IU/剂肌内注射,如小鼠保护效价试验(5)中所确定的。基于血清中和反应(6、7~9)、较少动物(10)、外周挑战(11)及其他(12)的替代试验正在进行中。应当在世界卫生组织合作中心、国家监管机构和控制实验室与制造商合作的多中心研究中确定这些替代试验的有效性。
目前无证据表明应对2.5IU/剂肌内注射的效价和0.1mL/剂皮内注射剂量进行修订(相当于每剂量效价≥0.25 IU)(见第9.3.3和9.3.4节)。疫苗和免疫球蛋白的标准查询网址:http://www.nibsc.org/search.aspx?cx=004532883405257870201:nbpiibbtndm&c of=FORID%3A10&ie=UTF-8&q=rabies&sa=Search&filter=0。
狂犬病疫苗国际化标准用于标准化小鼠保护试验和G蛋白含量的体外试验。2008年,在一项合作研究中,候选疫苗对照第五项国际标准进行了校准,成为第六项狂犬病疫苗国际标准。当在小鼠保护试验中使用时,用1mL蒸馏水稀释后,该标准包含8IU每安瓿,即8 IU/mL。其他单位用于体外试验,如酶联免疫试验和单径免疫扩散试验,以测定狂犬病病毒(RABV)G蛋白抗原含量(13)。
7.3.2 狂犬病疫苗的特征和评价
十几个种类的或基因型的狂犬病病毒属被描述为狂犬病的病原体(见第3节)。由于狂犬病病毒属基因组差异较大,而狂犬病病毒(RABV)是迄今为止人类狂犬病的最常见致病病毒,也是迄今为止疫苗中使用的唯一病毒。除I类谱系外,现有的疫苗可能无法抵御其他的狂犬病病毒属(见第3节)。应仔细选择疫苗中使用的病毒株,并定期评估病毒株的抗原性以及用于生产的细胞系的特性和纯度。建议通过对疫苗病毒株的全基因组测序来全面说明狂犬病病毒的基因特征。
世界卫生组织公布了灭活狂犬病疫苗的非临床和临床评估的一般原则(3)。临床前试验是开始人体临床试验的先决条件,包括免疫原性研究(概念证明)和动物安全性试验。狂犬病疫苗的临床研发应包括其用于暴露前和暴露后免疫的评估,含各种疫苗接种方案和给药途径、保护起效、保护范围和保护持续时间及追加疫苗注射的要求和时间。临床试验应遵循WHO良好临床试验规范(14)中所述的原则,及WHO 用于疫苗临床评估指南中的设计、执行和分析(3)。所有临床试验均应得到相关国家监管机构的批准。
目前生产的狂犬病疫苗都是单剂量肌内注射剂型。CCEEVs用0.5mL或1mL 溶剂复溶至一个剂量的肌内注射小瓶中,其效价大于等于每剂2.5IU,可用于暴露前免疫和暴露后免疫。
采用肌内注射的细胞培养疫苗的成本限制了其在广大狂犬病地区的广泛使用。WHO提倡将这些疫苗皮内注射,作为对安全、免疫原性及节约成本和剂量的肌内注射的替代方案。皮内注射用于完整的暴露后免疫程序仅需1到2瓶疫苗,因此与肌肉注射相比,此方法使用的疫苗量及其直接费用减少了60%到80%(15)。尚未有证据表明皮内注射所使用的疫苗比推荐用于肌肉注射给药的疫苗有更高的效价(16)。皮内接种以较低的剂量产生同等的免疫反应,从而在暴露前免疫和暴露后免疫中节约了疫苗用量。应当通过适当培训来确保疫苗完全在皮内滴注,并避免意外皮下注射。两种给药途径在加强免疫时都可诱导快速回忆应答。
一旦打开,小瓶应在+2℃~8℃温度条件下储存不超过6~8小时。之后,小瓶中的任何剩余疫苗都可用于暴露前免疫,而不是被丢弃,尤其是对于活跃在动物疾病控制领域的专业人员或定期护理临床狂犬病患者的卫生机构工作人员(见第8.2节)。为类似时期的患者安排后续的暴露前免疫随访可有助于最大限度地减少浪费。即便如此,皮内注射给药对暴露前免疫和暴露后免疫来说依然是既经济又有效(15)。
疫苗制造商应提供临床证据来证明新产品在皮内注射给药时具有免疫原性、有效性和安全性,且具有药品标签上注明的皮内接种适用性。给药应遵守世界卫生组织的给药途径指南,并符合国家药品监管当局批准的标准。特别是,疫苗应与一种已知免疫原性、效价和安全性的疫苗进行对比,通过荧光抗体病毒中和试验(FAVN)(见第5节),并且这些结果已发表在国际性同行评审期刊。
在那些已批准皮内注射给药用于暴露前免疫或暴露后免疫的国家,狂犬病疫苗经证实通过皮内注射给药是安全且有效的,其制造商应应对疫苗进行登记,并在药品说明书中注明该疫苗可以用于皮内注射。鼓励各国对国家法规进行修订,允许使用皮内注射给药狂犬病疫苗以降低成本。
一般说来,CCEEVs是安全且耐受良好的。但是,仍有可能发生不良反应,这在某种程度上取决于灭活狂犬病病毒(RABV)的纯度,且可能存在批次差异(17)。35%~45%的疫苗接种人群中,注射部位会出现轻微短暂的红疹、疼痛或肿胀,尤其是在皮内加强接种后。5%~15%的疫苗接种人群中还观察到一些轻微的全身不良反应,如短暂发热、头痛、眩晕及胃肠道症状等。严重的不良反应很少,包括格林-巴利综合征和过敏反应(18)。
高质量的CCEEVs接种、及时恰当的伤口处理,疫苗冷链运输、遵守疫苗接种方案,满足以上要求后真正的免疫失败是极罕见的。然而,就医延迟、不当的伤口护理、未被注意到的伤口、直接神经接种及患者不遵守疫苗接种方案及其他因素(如,疫苗和冷链质量)可能会导致治疗失败和随后死亡(19)。也有报道称,在使用了非WHO预认证疫苗和无疗效的疫苗(即“假”疫苗)后,出现了治疗失败和死亡。
即使在中和抗体的滴度水平降低至不可测量之后,CCEEVs依然建立了免疫记忆并假定此免疫记忆在个体生命中持续存在。临床数据证实,几十年前接受过暴露前免疫和暴露后免疫的,无论首次或加强免疫使用何种途径(肌内注射或皮内注射),也不管加强免疫期间是否有狂犬病病毒(RABV)特定抗体滴定,接种疫苗的人在7天内(20~22)对加强免疫均有反应。此外,公布的数据表明,首次狂犬病疫苗接种后无需定期加强免疫(23),对因职业原因使其持续或频繁暴露于风险中的人群需要额外预防措施的除外(见第8.2节)。然而,所有接种过疫苗的个体随后又发生狂犬病暴露的,根据世界卫生组织对暴露的定义,该个体应接受一次简短的暴露后免疫,相关内容见第8节。
在估算的每年接受暴露后免疫的2000万人中,暴露后免疫失败,即患者及时接受了正确的治疗但仍死亡,是极少见的。据报道,少数几次暴露后免疫失败都发生在发展中国家,且几乎都与世界卫生组织推荐的预防方案有一处或多处偏离(19)。导致死亡的与推荐方案的主要偏差有:狂犬病预防免疫的延迟;狂犬病免疫球蛋白的缺乏或不恰当使用(例如,未成功注射至所有咬伤部位);未进行原发性伤口护理或原发性伤口护理不当;和/或狂犬病疫苗质量低劣(24)。
暴露前免疫或暴露后免疫少于两剂的III级暴露者以及免疫系统严重受损的II级暴露者(如,艾滋病患者或移植接受者)应同时接种有效的狂犬病疫苗和狂犬病免疫球蛋白(25、26)。狂犬病免疫球蛋白更适宜于注射在受伤部位及其周围,以中和残留的狂犬病病毒(RABV)(见第8.4节)。
三种类别的生物制品可用于被动免疫:人狂犬病免疫球蛋白、马狂犬病免疫球蛋白和由马免疫球蛋白制成的高纯度F(ab’)2片段(27)。被疑似或证实为狂犬病动物造成开放性伤口的患者应接受被动免疫,详见第8节。附录5概述了目前可用的狂犬病免疫球蛋白产品及其生产商。
狂犬病免疫球蛋白应与第一剂疫苗同时使用,并在伤口部位和伤口周围注射。如狂犬病免疫球蛋白无法获得,则严格的伤口清洁和深度冲洗,使用强效防腐剂,及时接种第一剂CCEEV是提高存活率的关键因素,且应在患者就诊时及时进行。人免疫球蛋白最大给药剂量应为:20 IU/kg体重,马免疫球蛋白最大给药剂量应为:40 IU/kg体重。马免疫球蛋白比人免疫球蛋白产品要便宜许多,并且大多数新型马免疫球蛋白制品是有效的、高度纯化和安全的,几乎无不良反应。在< 1~3%的接种者中,可能在高纯度马狂犬病免疫球蛋白给药后1周发生血清病。过敏反应风险低(1/150000),并且此过敏反应通常是可治疗的。
在马狂犬病免疫球蛋白给药前不建议做皮肤测试,因为这些测试很难预测严重的不良反应,这些测试在需要给药的时候不应当作为不注射马免疫球蛋白的依据。应当在具备应对过敏反应的条件下注射马免疫球蛋白。
狂犬病免疫球蛋白在世界范围内供应短缺。新技术可能引入单克隆抗体用于暴露后免疫。世界卫生组织推荐使用至少包含抗狂犬病病毒的两种抗体的单克隆抗体“鸡尾酒”,作为狂犬病免疫球蛋白的替代品用于暴露后免疫(28)。已测试了几种抗狂犬病的人类单克隆抗体。印度血清研究所上市的第一个(单个单克隆抗体)最近获得了许可(29)。迄今为止,研究表明其性能与人类狂犬病免疫球蛋白相当。此单克隆抗体的可用性可填补关键公共卫生缺口。因为单克隆抗体是通过重组技术制备的,所以不太容易出现可用性、安全性和纯度等问题。根据流行病学条件和地理环境,建议将单克隆抗体用于公共卫生计划,并在上市后使用期间监测其安全性和有效性(临床结果)。
应世界卫生组织国际标准生物实验室要求,位于英国赫特福德郡波特斯巴的英国国家生物制品检定所制备并分发了人免疫球蛋白的第二个国际标准制剂(13)。目前世界卫生组织标准化参考血清含量为30IU每安瓿。
1. Rabies vaccines: WHO position paper – recommendations. Vaccine. 2010;28(44):7140–2.
2. WHO policy statement: multi-dose vial policy (MDVP) – revision 2014. Geneva: World Health Organization; 2014 (Report No. WHO/ IVB/14.07).
3. WHO Expert Committee on Biological Standardization: Sixty-third Report. Geneva: World Health Organization; 2013 (WHO Technical Report Series No. 980).
4. Human and dog rabies prevention and control: report of the WHO/Bill & Melinda Gates Foundation consultation, Annecy, France, 7–9 October 2009. Geneva: World Health Organization; 2010 (http://apps.who.int/ iris/bitstream/10665/70253/1/WHO_HTM_NTD_NZD_2010.1_eng. pdf).
5. Servat A, Cliquet F. Mouse potency testing of rabies vaccines. In: Rupprecht C, Nagarajan T, editors. Current laboratory techniques in rabies diagnosis, research and prevention. Vol. 2. Cambridge (MA): Academic Press; 2015:269–79.
6. Kamphuis E, Krämer B, Schildger H, Duchow K. Potency testing of inactivated rabies vaccines using a serological method. Dev Biol (Basel). 2012;134:23–7.
7. Aavula SM, Abhinay G, Nimmagadda SV, Maithal K. A novel in vitro ELISA for estimation of glycoprotein content in human rabies vaccines. J Immunoassay Immunochem. 2017;38(4):400–10.
8. Chabaud-Riou M, Moreno N, Guinchard F, Nicolai MC, Niogret-Siohan E, Sève N et al. G-protein based ELISA as a potency test for rabies vaccines. Biologicals. 2017;46:124–9.
9. Morgeaux S, Poirier B, Ragan CI, Wilkinson D, Arabin U, Guinet-Morlot F et al. Replacement of in vivo human rabies vaccine potency testing by in vitro glycoprotein quantification using ELISA – Results of an international collaborative study. Vaccine. 2017;35(6):966–71.
10. de Moura WC, de Araujo HP, Cabello PH, Romijn PC, Leite JP. Potency evaluation of rabies vaccine for human use: the impact of the reduction in the number of animals per dilution. J Virol Methods. 2009;158(1– 2):84–92.
11. Wunderli PS, Dreesen DW, Miller TJ, Baer GM. The rabies peripheral challenge test: more accurate determination of vaccine potency. Vaccine. 2006;24(49–50):7115–23.
12. Stokes W, McFarland R, Kulpa-Eddy J, Gatewood D, Levis R, Halder M et al. Report on the international workshop on alternative methods for human and veterinary rabies vaccine testing: state of the science and planning the way forward. Biologicals. 2012;40(5):369–81.
13. National Institute of Biological Standards and Control. WHO international standard. Sixth international standard for rabies vaccine 2008. Potters Bar; 2013 (http://www.nibsc.org/documents/ifu/07-162. pdf).
14. WHO Expert Committee on the Use of Essential Drugs. Sixth report, Annex 3. Geneva: World Health Organization; 1995 (WHO Technical Report Series No. 850).
15. Hampson K, Cleaveland S, Briggs D. Evaluation of cost–effective strategies for rabies post-exposure vaccination in low-income countries. PLoS Negl Trop Dis. 2011;5(3):e982.
16. Sudarshan MK, Gangaboraiah B, Ravish HS, Narayana DH. Assessing the relationship between antigenicity and immunogenicity of human rabies vaccines when administered by intradermal route: results of a metaanalysis. Human Vaccines. 2010;6(7):562–5.
17. Finke S, Karger A, Freuling C, Müller T. Assessment of inactivated human rabies vaccines: biochemical characterization and genetic identification of virus strains. Vaccine. 2012;30(24):3603–9.
18. Grading of scientific evidence. Table III. Safety of cell-culture-based rabies vaccines. Geneva: World Health Organization; 2010 (http://www. who.int/immunization/rabies_grad_safety.pdf?ua=1).
19. Wilde H. Failures of post-exposure rabies prophylaxis. Vaccine. 2007;25(44):7605–9.
20. Cramer JP, Jelinek T, Paulke-Korinek M, Reisinger EC, Dieckmann S, Alberer M et al. One-year immunogenicity kinetics and safety of a purified chick embryo cell rabies vaccine and an inactivated Vero cell- derived Japanese encephalitis vaccine administered concomitantly according to a new, 1-week, accelerated primary series. J Travel Med. 2016;23(3).
21. Kessels JA, Recuenco S, Navarro-Vela AM, Deray R, Vigilato M, Ertl H et al. Pre-exposure rabies prophylaxis: a systematic review. Bull World Health Organ. 2017;95(3):210.
22. Jonker EF, Visser LG. Single visit rabies pre-exposure priming induces a robust anamnestic antibody response after simulated post-exposure vaccination: results of a dose-finding study. J Travel Med. 2017;24(5).
23. Strady A, Lang J, Lienard M, Blondeau C, Jaussaud R, Plotkin SA. Antibody persistence following preexposure regimens of cell-culture rabies vaccines: 10-year follow-up and proposal for a new booster policy. J Infect Dis. 1998;177(5):1290–5.
24. Rupprecht CE, Briggs D, Brown CM, Franka R, Katz SL, Kerr HD et al. Evidence for a 4-dose vaccine schedule for human rabies post- exposure prophylaxis in previously non-vaccinated individuals. Vaccine. 2009;27(51):7141–8.
25. WHO Guide for rabies pre and post exposure prophylaxis in humans. Geneva: World Health Organization; 2014 (http://www.who.int/rabies/ PEP_Prophylaxis_guideline_15_12_2014.pdf).
26. Wilde H, Khawplod P, Hemachudha T, Sitprija V. Postexposure treatment of rabies infection: can it be done without immunoglobulin? Clin Infect Dis. 2002:477–80.
27. Lang J, Attanath P, Quiambao B, Singhasivanon V, Chanthavanich P, Montalban C et al. Evaluation of the safety, immunogenicity, and pharmacokinetic profile of a new, highly purified, heat-treated equine rabies immunoglobulin, administered either alone or in association with a purified, Vero-cell rabies vaccine. Acta Trop. 1998;70(3):317–33.
28. WHO consultation on a rabies monoclonal antibody cocktail for rabies post exposure treatment. Geneva, WHO, 23–24 May 2002. Geneva: World Health Organization; 2002.
29. Gogtay NJ, Munshi R, Ashwath Narayana DH, Mahendra BJ, Kshirsagar V, Gunale B et al. Comparison of a novel human rabies monoclonal antibody to human rabies immunoglobulin forpostexposure prophylaxis: a phase 2/3, randomized, single-blind, noninferiority, controlled study. Clin Infect Dis. 2017;66(3):387–95.
8.人类狂犬病的预防
狂犬病几乎总是致命的,但通过暴露前预防或暴露/可疑暴露后 预防,我们可以预防该病发生。预防中狂犬病疫苗和免疫球蛋白的 成分和应用,应符合WHO 对其生产和质控的要求,并满足皮内注射 或肌内注射的免疫原性和安全性要求(见第7节和8.3.4)。
8.1 综合考虑
强烈推荐由于职业或其他活动导致具有狂犬病病毒(RABV) 和 其他狂犬病病毒属病毒高暴露风险的人群,以及特殊情况下,偏远 地区居民,接受暴露前免疫 (PrEP) 。 对于旅行者,仅当其目的地 偏远以至无法及时获得恰当的暴露后处置 (PEP) 时,或很可能与野 生动物特别是蝙蝠接触时,才推荐进行PrEP (见8 . 7)。
证据表明,暴露与 RABV后,即使在严重暴露的情况下,及时使 用狂犬病疫苗,并进行正确的伤口冲洗和伤口处理,同时使用狂犬 病免疫球蛋白(RIG), 几乎可以100%防止狂犬病发生。当暴露于 疑似、可能或确定的狂犬病动物(见第11节)或对导致暴露的因素 有疑问时,如可能,应启动PEP 并寻求医疗建议。
疫苗可经皮内或肌内注射。用肌注用狂犬病疫苗做皮内注射是 安全的,尽管这构成了标签示外使用。皮内注射的推荐给药部位包 括三角肌、大腿前外侧或肩甲上区等回流至局部淋巴结的部位(见 附件6、7)。肌内注射给药的推荐部位包括:成人及≥2岁儿童为 上臂三角肌区域;<2岁儿童为大腿前外侧(见附件7)。狂犬病疫 苗不应在臀部给药,因为臀部注射不能可靠诱导足够的免疫应答。
实际给药部位根据患者隐私和社会文化的接受程度选择。
皮内注射疫苗1剂的剂量为0.1ml, 肌内注射1剂的剂量为1
瓶,无论容器大小。第0天为首次给药日期。疫苗接种方案应尽可
能按时完成,但即使未能严格按照程序给药,也无需重启接种方案, 因为几天的变化不太可能影响免疫应答的产生。妊娠和哺乳期也可
使用狂犬病疫苗和RIG。
8.2 暴露前免疫 (PrEP)
因职业、旅行而存在狂犬病病毒或蝙蝠型狂犬病病毒属病原高 暴露风险的个体(见8.8)或居住在狂犬病流行区且无法及时获得 适当PEP 的居民,均推荐接受PrEP 。 接 受PrEP 者,咬伤后无需再 使用RIG。如果在暴露后给予PEP, 疫苗诱导的免疫记忆可能是持续终身的。已公布的数据表明,在初次免疫后,无需周期性加强免疫, 除非个体的职业存在持续或频繁的暴露风险(见8.2.1)。
表6概述了WHO 推荐的PrEP 方案。为节约成本,经皮内注射的 PrEP 应给予足够多的个体,以保证一瓶疫苗可以在开封后6-8小时 内用完。有证据支持,5岁-47岁的健康人可采用单次暴露前免疫,即在第0天注射2剂皮内或1剂肌注疫苗(6-9)。仅在时间不允许 接种PrEP 的第2针或旅行目的地可以及时获得狂犬病疫苗时,才考 虑采用单次暴露前免疫;第2针应在返回后立刻或尽快接种。如在 接种第2针前发生暴露,则应接受完整的PEP 处置。目前没有证据 支持单次暴露前免疫足以诱导长期免疫(>1年)。
表6WHO推荐的PrEP方案和替代方案
| PrEP方案 | 全程免疫时间 | 每次接种点数(第 0,3,7,14,21-28) | 参考文献 |
| WHO推荐皮内注射方案 | |||
| 接种2次 | 7天 | 2-0-2-0-0 | 1-4 |
| WHO推荐肌内注射方案 | |||
| 接种2次 | 7天 | 1-0-1-0-0 | 5 |
| 特殊情况下可考虑的PrEP方案 | |||
| 单次皮内接种 | 1天 | 2-0-0-0-0 | 6-9 |
| 单次肌注接种 | 1天 | 1-0-0-0-0 | 6-9 |
目前普遍认为,在首次接种的7 天内不会产生有效的免疫应答。 因此,在此期间暴露者应接受包括RIG(III 级暴露)在内的完整的 PEP。在暴露前曾接种过至少2剂次疫苗,但未能完成PEP 程序者,
应视为已接种过疫苗。
8.2.1 职业人群PrEP 建议及计划性 PrEP 建议
感染 RABV的风险取决于暴露性质、当地流行情况和 PEP生物制 品的可及性。推荐职业暴露高风险人群,尤其是兽医接受PrEP; 此 外,经常接触狂犬病患者的医护人员也可以考虑接受PrEP 。 接触高 浓度RABV 活病毒或狂犬病病毒属其他活病毒的实验室工作人员,应 每1-2年检测血清抗体水平,确保维持足够的免疫水平,以避免未 察觉的暴露,并采取措施降低风险。实验室负责人或雇主应负责评 估工作人员的暴露风险并为其提供抗体水平检测。仅当暴露风险持 续存在时,才推荐进行血清学检测和加强免疫。如果不能进行血清 学检测,可以考虑在分配到危险的工作岗位之前预先进行常规的加 强免疫;然而,定期加强免疫注射仅推荐存在持续或频繁职业暴露 风险的人群,作为额外的预防措施。如条件允许,应首选抗体监测。 无持续暴露风险的专业人员,如某些兽医和动物健康官员,建议每2年检测血清抗体水平。由于疫苗的诱导免疫大多可持续几十年,故仅在血清 RABV 中和抗体滴度降至<0 .5 IU/ml 时才推荐加强免疫。
对于绝大多数地方而言,在全人群中开展 PrEP 不符合成本效益, 故不推荐;但对于缺乏 PEP 的偏远地区,如年度狗咬伤率>5%或吸
血蝙蝠暴露普遍存在,则应考虑开展广泛的PrEP 。 该决策应基于强 有力的流行病学证据和当地情况。且不应当因PrEP 而忽视大规模犬 只免疫,以从源头控制狂犬病(见第9节)。
在高危地区生活的居民或旅客完成初次PrEP 或 PEP后,无需进 行加强免疫。
8 . 2 . 2免疫功能受损人群 PrEP 建 议
有记录的免疫缺陷患者应进行个体化评估。免疫缺陷患者应根 据表6的方案进行皮内或肌注PrEP, 并在第21-28天进行第三针免 疫。目前认为,处于临床监测并已接受良好治疗的免疫缺陷患者,如接受抗逆转录病毒治疗的HIV 感染者,可以对狂犬病疫苗和其他 疫苗产生正常的免疫应答,故不需作为免疫功能低下处理(10)。 如发生暴露应接受包括 RIG 在内的完整的 PEP处置。
8.3 暴露后处置
WHO 规定的 I 级 或III 级暴露者(见8 . 3 . 1和附件8)应立即 接受 PEP处置。具体包括以下步骤:
应尽快处理所有抓伤和咬伤部位;使用肥皂和大量清水彻底反 复冲洗和清洗伤口约15分钟。有条件时,可使用外用杀病毒剂处理 伤口。强烈建议不要对伤口进行局部用药。
III 级暴露者需使用 RIG 。如需缝合伤口,应在完成 RIG 局部注 射且进行适当伤口处理之后,予以松散缝合(见8.3.4),如需注 射破伤风疫苗,应在缝合前注射。
暴露后,应尽快接种狂犬病疫苗, WHO 推荐的疫苗种类见8.3.4。
8.3.1 RABV 可疑暴露评价
暴露分级和PEP(见附件8)。
在狂犬病地方性流行的国家或地区,暴露于疑似、可能或确诊 为狂犬病动物(家养或野生)的暴露等级划分如下:
I 级暴露:接触或喂养动物;完好的皮肤被舔舐:无暴露,无 需 PEP;
II 级暴露:裸露的皮肤被轻咬;无出血的轻微抓伤或擦伤:暴 露,应尽快接受PEP 并注射疫苗;如暴露于蝙蝠视为 II 级暴露;
III 级暴露:单处或多处贯穿皮肤的咬伤或抓伤;粘膜被动物唾液污染(如被舔舐);破损皮肤被舔舐;暴露于蝙蝠:严重暴露; 需接受PEP 并注射狂犬病疫苗和RIG。
对 于 Ⅱ 级 和III 级暴露,彻底的伤口处理(见8.3. 1)至关重 要。绝大多数病例的潜伏期为2-3个月,约2%-3%的病例潜伏期>1 年,另有1例病例潜伏期达8年(11,12)。
因此,当生物制剂有限时,对疑似和可能暴露的追溯期限可以
限于12个月以内。但如暴露于确诊的狂犬病动物,则无论暴露期限, 均应注射狂犬病疫苗,哪怕暴露发生于数年之前。
RABV潜在暴露的风险评估
被动物,尤其是狗,咬、舔舐或抓挠是非常普遍的,据报道, 全球咬伤的发生率达0.1-5%(13-15)。即使在以犬为主要传染源 的狂犬病流行地区,大部分致伤的家养动物也并非狂犬病动物(16),尽管不同地区的比例不同且存在低估。暴露人群的就诊比 例可能受当地就医文化、狂犬病监测能力和流行状况影响;国家狂 犬病规划应考虑将狂犬病监测系统评估纳入常规工作,以提高大众 对动物咬伤导致狂犬病的风险的认知。确定是否暴露于RABV 应考虑 的因素包括:
该国家狂犬病流行情况;
暴露严重程度(见8 . 3 . 1);
动物的种类和临床表现(见11节动物狂犬病的定义); 动物免疫情况(狗和猫);
是否能观察(狗和猫);
实验室检测结果。
暴露于动物的风险应尽可能由受过培训,熟悉动物狂犬病症状
的专业人士进行评估(表7)。由多部门共同应对狂犬病动物暴露, 具备此类机制的体系被称为“一体化咬伤病例管理”体系(见第11 节)。该机制可提高RABV 暴露者的发现能力,提高患者对疫苗接种 的依从性,并减少不必要的疫苗或RIG 使用(16,17)。行为异常的 野生动物患狂犬病的风险可能很高,应在当地流行背景下对可疑暴
露进行评估(18)。
除了上述标准外, PEP 还可以减轻被咬伤者及其亲属对狂犬病
恐惧的心理负担。无法评估风险或观察的致伤动物应视为有狂犬病, 并立即给予PEP 处置。头面部暴露和幼儿暴露可能潜伏期更短,如
怀疑致伤动物为狂犬病动物,应立即给予 PEP。 致伤动物符合动物
狂犬病疑似、可能或确诊定义的暴露者,应立刻接受 PEP 。如可能, 符合动物狂犬病疑似或可能定义的致伤动物可以采用符合人道主义的安乐死,并进行狂犬病病毒检测。如检测结果阴性,则可中断
PEP。如中断 PEP前,暴露者已按流程接种了至少2剂细胞培养疫苗 (皮内或肌注),则应视为已完成PrEP (见8 . 2)。
一般情况下,犬、猫及家养雪貂被专业人员判定为健康,并可 完成10日观察,意味着这些动物传播狂犬病的风险极低(20)。如 致伤动物不满足动物狂犬病疑似定义并可被观察,则应彻底冲洗伤 口并告知患者预防狂犬病,但在观察期可暂推迟PEP 。如果动物在观察期间死亡、逃脱或表现出与动物狂犬病一致的症状,应立即启 动 PEP。仅当具备健全的监测体系,专业人员可及时对致伤动物进 行评估且实验室检测能力可靠时,才能推迟PEP ( 表 8 ) 。
表7 RABV暴露风险评估表(基于暴露类型和犬只表现
|
暴露情况 |
基于暴露水平的 死亡概率 | 咬伤时收集的信息 | 隔离或实验室检测 | |||||||
| 犬表现出狂犬 病症状 | 犬随后死 亡 | 犬主动攻 击 | 流浪狗 | 一犬伤多 人 | 犬只未免 疫 | 犬健康且可隔 离观察 | 咬伤后10天
犬仍健康 |
实验室检 测阴性 | ||
| 头颈部咬伤 | 45.0% | 高 | 高 | 高 | 高 | 高 | 高 | 低 | 无 | 无 |
| 多处严重咬伤 | 27.5% | 高 | 高 | 高 | 高 | 中 | 中 | 低 | 无 | 无 |
| 幼儿咬伤 | 27.5% | 高 | 高 | 高 | 高 | 中 | 中 | 低 | 无 | 无 |
| 四肢咬伤 | 5.0% | 高 | 中 | 中 | 中 | 中 | 低 | 低 | 无 | 无 |
| 轻微咬伤(皮 肤无破损) | 1.0% | 中 | 中 | 中 | 中 | 中 | 低 | 低 | 无 | 无 |
| 狗患狂犬病的可能性 | 62.2% | 39.7% | 15.0% | 13.9% | 10.6% | 4.7% | 0.08% | 0.0% | 0.0% | |
来源:参考文献19,已获得授权
1: 风险评估的依据为犬患有狂犬病的可能性,和若犬为狂犬病犬,则不同严重程度的暴露导致死亡的可能性。
当动物被判定为疑似、可能或确诊的动物狂犬病后(见11 节 ) , 应立即进行回顾性风险评估,以发现所有可能的同源暴露者并给予
其 PEP 。目前认为,犬、猫和家养雪貂自发病前10天至整个临床症 状期均有传染性(21,22)。其他动物的传染期目前尚未充分描述, 通常推荐调查至临床症状出现前14天。如确诊人狂犬病病例,应开 展回顾性调查,凡暴露于同一致病动物者均应接受PEP, 包括数月 前的暴露者。
表8基于监测能力的PEP建议
| 狂犬病监测系统 | 监测系统描述 | 启动PEP时机 | 终止PEP时机 |
|
无常规监测 |
无能够进行动物狂犬 病评估的受过培训的 专业人员;
实验室无法及时进行 样品检测 |
立即启动 |
不可终止,除非有受 过培训的专业人员确 认致伤动物在咬人10 日后仍健康。 |
|
有限的监测 |
部分社区有能够进行 动物狂犬病评估的专 业人员 ;
实验室具备检测能 力,但检测和结果反 馈可能延迟。 |
立即启动 |
不可终止,除非具备 检测资质的实验室得
出阴性结果 或 有受过培训的专业人 员确认致伤动物在咬 人10日后仍健康。 |
|
健全的监测体系(如 包含“一体化咬伤病 例管理”) |
发生暴露的社区中随 时可以找到能够进行 动物狂犬病评估的专 业人员 ;
实验室具备检测能 力,且能够及时检测 样本并在咬伤后几日 内反馈结果。 |
头、颈或其他神经高 度发达的部位被咬
伤,多处或深在伤 口,儿童咬伤,应立 刻启动PEP。 如动物能被观察,且 被专业人员判定为低 风险,则可延迟启动 PEP。 |
不可终止,除非具备 检测资质的实验室得 出阴性结果, 或 有受过培训的专业人 员确认致伤动物在咬 人10日后仍健康。 |
由于体型较小且严重暴露风险更高,儿童应立刻接受PEP。
通常,经健全的监测体系确认无人间狂犬病的地区,被动物咬 伤、抓伤或其他接触(除接触蝙蝠外)无需接受PEP; 但该决定需 基于熟悉当地狂犬病流行情况的专家的判断。
上文的建议是一个总得指南;可以在不同情况和地区中使用, 例如当难以获得可靠的暴露史(如婴儿)时,或在狂犬病地方性流 行地区,致伤动物的后续观察和/或实验室检测不可及时。
8.3.2 不典型暴露
目前尚未证实狂犬病存在人传人传播,但器官移植可以致病,此外,还有一例可能的围产期狂犬病(23,24)。在这种极低的风险 下,需考虑是否为暴露于病人的暴露者提供PEP, 此外,当狂犬病 疫苗和 RIG 不足时,应优先提供给暴露于疑似狂犬病动物的Ⅱ级和 IIⅡ 级暴露者(23)。然而,患者的唾液、泪液和神经组织中可以 检 出RABV, 这代表了人与人之间的传播可能有理论上的可行性。如 果在传染期暴露于传染物(Ⅱ级或 III 级暴露),则应接受相应治 疗。被患者咬伤,或在医疗行为、亲吻或亲密接触中粘膜被传染物 污染等,均是人传人的可能途径。尚无证据表明母乳喂养传播狂犬 病的风险,但流行病学和病理学证据显示其不会对公众健康造成威 胁。
绝大多数人感染狂犬病是因为咬伤导致的,其他途径非常罕见。 动物实验表明,食用染病动物可以传播狂犬病,但目前尚无人类食 用狂犬病动物的生肉导致感染的报告(25,26)。但建议不要食用狂 犬病动物,尤其是生肉。在加工狂犬病动物的过程中发生I 级或 III 级暴露(见8.3.1)应考虑接受PEP处置。
在狂犬病牛的奶中未分离出RABV, 且从未发现有人因饮用生奶 导致狂犬病。尽管不推荐饮用狂犬病动物的生奶,但亦无证据表明 上述行为可感染RABV, 故不推荐给予PEP 处置。经过巴氏杀菌的牛 奶不存在传播RABV 的风险。
投喂野生动物、触碰它们的食物,或当野生动物被惊吓、困住 或逼至绝境时,很容易咬伤人类,猴子尤为常见。这种情况应尽量 避免以减少不必要的PEP 。啮齿动物感染狂犬病非常罕见(27), 目前尚无因啮齿动物咬伤而导致的人狂犬病病例报告。
极为罕见的情况下,可能因为在实验室处理含有高浓度狂犬病 活病毒的材料,或在有大量感染狂犬病的蝙蝠的洞穴中吸入含有病毒的气溶胶感染狂犬病(28)。野生食肉动物和蝙蝠(食肉目和翼 手 目 ) 是RABV的储存宿主,传播狂犬病的风险远高于其他野生动物。 8.3.3 伤口处理迅速的伤口处理是 PEP 中重要的环节之一,所有的抓伤和咬伤 均需处理。推荐的急救程序包括:立即用水和肥皂彻底冲洗伤口, 并用碘伏或其他具有杀病毒活性的物质清洗。如果没有肥皂或杀病 毒制剂,则用水对伤口进行彻底而广泛的冲洗。眼睛和粘膜要用清 水彻底冲洗。狂犬病流行地区的居民应学习简单的伤口处理,并谨 记不要进一步污染或扩大伤口。
无论部位,伤口流血均提示严重暴露,应注射人或马RIG。大 多数严重咬伤的伤口应每日换药,必要时再进行二期缝合。如果伤 口清洗后必须缝合,应首先用人或马RIG 充分局部浸润,并延迟数 小时再缝合,以便于 RIG 可以在缝合前扩散入组织。二期缝合可以 降低伤口感染风险,如处理得当,愈合后更加美观。伤口感染不影 响 RIG注射(29)。手指或脚趾尖、耳垂、鼻和生殖器末端咬伤可 以正常注射RIG, 但要注意避免局部组织压力过高,以免出现压力 综合征(30)。可能被污染的伤口可以给予抗生素及破伤风疫苗。
8.3.4 WHO 推荐的 PEP 方案
由于各国的临床护理条件和偏好不同, WHO 建议列出优选的 PEP 方案和替代方案,上述方案均已进行过免疫原性、预后、可行性和成 本 效 益 评 估 ( 表 9 ) 。WHO 承认皮内途径(与肌注)具有同等疗效, 对于每周接诊多例新伤患的门诊,皮内给药是PEP首选的、最具成本效益的途径。用肌注用狂犬病疫苗做皮内注射是安全的,尽管这 构成了标签示外使用。
成年人的推荐疫苗注射部位始终为上臂三角肌区域;<2岁的 儿童推荐给药部位为大腿前外侧区域(见附件7)。皮内注射疫苗1 剂的剂量为0 . 1ml, 肌内注射1剂的剂量为1瓶,无论容器大小。医护人员需注意避免因注射器、针座的死腔,导致实际给药剂量不 足0 . 1ml (可使用胰岛素针头)。注射首剂的日期计为第0天。孕 期和哺乳期可以正常应用狂犬病疫苗和RIG, 且完全可以接受必要 的 PEP 处 置 ,WHO 推荐的所有方案均可以选用。
观察性研究表明,不得已时更换疫苗品种和/或给药途径是可行 的(39)。此时无需重新启动PEP, 只需要按照新途径的注射方案 完成 PEP 即可。
表9 WHO推荐的PEP方案和替代方案
|
PEP方案 |
全程免疫时间 |
每次接种点数(第
0,3,7,14,21 -28 天 ) |
参考文献 |
| WHO推荐的皮内注射方案 | |||
| 1周,2点法 | 7天 | 2-2-2-0-0 | a |
| WHO推荐的肌内注射方案 | |||
| 2周 | 14-28天 | 1-1-1-1-0 | 31 |
| 3周 | 21天 | 2-0-1-0-1 | 32 |
| 可产生免疫原性的皮内注射替代方案 | |||
| 1个月,2点法 | ≤28天 | 2-2-2-0-2 | 33 |
| 1个月,简化4点法 | ≤28天 | 4-0-2-0-1 | 34,35 |
| 1周,4点法 | 7天 | 4-4-4-0-0 | 36-38 |
a:Tarantola等,PEP皮内注射流程可简化,并不会对临床预后造成显著影响,柬埔寨, 2003-2014(待发表)
8.3.5免疫功能受损人群PEP 建议
多种因素可以引起免疫抑制或影响免疫调节通路损害免疫应答。 大多数情况下,我们无法判断(需要接受PEP 的)患者免疫抑制的 病因和严重程度。但常规疫苗研究发现,如果患者本身处于良好的 管理下,如正在接受治疗和监测的HIV患者,则可能对疫苗产生类 似于健康人或轻度免疫功能受损者的免疫应答(10)。
临床经验表明,无论何时,无论疫苗接种途径如何,都应选用 最佳 PEP 方案(能够产生最强的免疫原性、高质量的疫苗和 RIG))c 细致而彻底的伤口清洗是为免疫功能低下患者进行紧急处理中最重 要的环节。如果可能,建议在疫苗接种2-4周后检测患者血清狂犬 病病毒中和抗体水平,以评估是否需要额外接种疫苗。如有可能,建议咨询传染病专家或正在为患者提供免疫治疗的临床专家,或询 问患者的既往史。由于造成免疫功能受损的病因复杂,而可获得的 信息有限,提示有必要开展针对性研究。
8.3.6 既往免疫人群再次接受PEP
对于能够提供全程PrEP 或 PEP记录的暴露者或再次暴露者,以 及未能完成PEP但至少接种过2剂次狂犬病疫苗者,建议如下:
无需使用RIG;
皮内注射流程:在第0天和第3天各接种一剂皮内注射; 4 点法只需在第0天接种;
肌内注射流程:在第0天和第3天各接种一剂(一整瓶);
如患者不能提供既往曾接受过完整的PrEP, 或相当于PrEP 的 PEP 证明,则应接受完整的PEP, 包 括RIG (如有必要)。
8.4 狂犬病免疫球蛋白的被动免疫
狂犬病免疫球蛋白在被动免疫中发挥的作用是,在患者接种疫苗后,机体产生自身抗体之前,在暴露部位提供中和性抗体。因此, 如药物充足,除已接受过PrEP 的暴露者外(见8 . 2),所有 IIⅡ 级 暴露者均应使用RIG。如 果RIG 可用的数量有限,建议优先提供给具有额外高风险因素的(见8.3.1),风险最高的暴露者使用,在 使用过程中应注意节约。无论能否获得RIG, 均应接种疫苗。RIG 为一次性给药,暴露后最好在首剂疫苗接种后尽快使用。最好不要晚于首剂疫苗接种后的第7天,无论是否在第3天和第7 天注射了疫苗,因为此时疫苗诱导的主动免疫已经生成,会造成RIG的浪费。人RIG的最大剂量为20IU 每公斤体重,马血清免疫球 蛋白和F(ab’)2 片段为40IU 每公斤体重。
所有的免疫球蛋白,或解剖结构允许的最大剂量(避免产生筋 膜室综合征),应仔细的注射到伤口内或伤口周围(或暴露部位) 证据表明,相比于仅在伤口浸润,将剩余的 RIG 在远离伤口的部位 肌内注射并不会令患者获益或益处极其有限(40-43)。但如果很可能存在其他小伤口(例如儿童无法指明全部伤口),暴露于蝙蝠或暴露途径非咬伤,则建议将剩余的 RIG, 在解剖结构允许的情况下, 尽量肌内注射在可能的暴露部位附近。上述措施也适用于无伤口的粘膜暴露,或考虑使用RIG 冲洗。怀疑暴露于含有 RABV 的气溶胶时, 也推荐注射RIG。
避免使用同一注射器或将狂犬病疫苗和RIG 混合。如损伤严重 或多处创伤,导致需要的免疫球蛋白量超过最大剂量,可用无菌生 理盐水稀释,但需保证有效、安全,对全部伤口进行浸润注射。
一种抗狂犬病单克隆抗体 (mAb) 已于2017在印度获得许可,目前正在当地临床应用。根据地理和流行病学背景,推荐mAb 作为 RIG 的一种替代品使用。WHO 建议组建注册部门以监测mAb产品在狂 犬病 PEP 中的临床使用和转归。
8.5 PEP的禁忌症和预防措施
PEP 没有禁忌。PEP 对婴儿、孕妇及免疫功能低下的个体,包括 HIV/AIDS 患儿,均是安全的。跟其他疫苗一样, PEP 也需要根据暴 露程度实施,实施者应接受过PEP处置和可能不良反应处理的正确 培训。
与所有的疫苗一样,受种者在接种狂犬病疫苗后至少需要观察 15-20分钟。如果对疫苗中任何成分出现过严重的副反应,则严禁 使用同种疫苗进行PrEP 或PEP, 应更换疫苗产品。
8.6 供应不足
政府和主管部门应制定规章,以确保所有狂犬病的疑似、可能 和确诊暴露者都能够及时获得专业的PEP, 包括在私营机构中。各 国均应推荐皮内给药。应尽可能开展成本效益研究,以确定储备狂 犬病疫苗和生物制剂的最佳方案(44-47)。
对于没有常规储备疫苗和RIG, 或储备不足的地区,应考虑优 先供应高危暴露者。如果RIG 有限,则应优先给予符合下列标准的 暴露者:
多处咬伤;
深在伤口;
头、颈、手等神经高度发达的部位被咬伤;
重度免疫功能缺陷;
被确诊或可能的狂犬病动物咬伤;
蝙蝠的抓伤、咬伤或粘膜暴露。
RIG 和疫苗的供给限于高风险暴露可能会危害低风险人群,在
实施前应慎重考虑。评估与疑似狂犬病动物相关的风险(见8.3. 1) 可以减少狂犬病生物制剂不必要的使用,在 RIG 和/或疫苗供应不足
时应予以考虑。
8.7 狂犬病流行国家和地区的旅行及 PEP 建议
建议向旅行者发布暴露于RABV 的个体风险评估,需要考虑如下 因素:目的地的偏远程度,当地狂犬病流行情况以及在流行环境中 停留的累积持续时间。将在偏远的农村地区开展大量户外活动的旅 行者以及目的地未必能够及时获得有效 PEP 的旅行者,均应考虑PrEP 。此外,如果经常参与探洞等可能直接接触蝙蝠的活动,也建 议接受PrEP 。前往受狂犬病影响的国家和地区的旅行者需警惕狂犬 病风险,如发生暴露需寻求PEP 处置。
前往受狂犬病影响的国家和地区的旅行者应避免接触流浪动物, 尤其是犬、猫和猴子,以及流浪和被捕获的野生动物。对于探洞者来说,如果洞穴中有蝙蝠栖息,偶然暴露在洞穴的空气中并不需要 担心,但要注意不可摆弄蝙蝠。直接接触蝙蝠后需接受PEP 处置
(见8.3.1)。
图4展示了不同国家RABV 和其他狂犬病毒属病毒的循环风险, 由低到高分为无、低风险、中风险和高风险四级。分级是基于主要 宿主动物或传播者,涉及的病毒种类(以犬为传播媒介的狂犬病流 行地图见第2节),以及可靠的基于实验室的宿主动物监测系统的 可及性。还应考虑到是否能获得适当的医疗服务和狂犬病疫苗、免 疫球蛋白的可及性。
Rabies,countries or areas at risk
图4 RABV和其他狂犬病属病毒四种风险等级国家和地区分布图
无风险和低风险地区可及时获得适当的医疗服务、狂犬病疫苗 和免疫球蛋白,并可获得可靠的基于实验室的监测数据。中等风险 和高风险地区,能否获得适当的医疗服务、狂犬病疫苗和免疫球蛋 白取决于当地条件,而且并非所有地方都能保证其及时性;可获得 部分基于实验室的监测数据,但可能不包括所有储存宿主或不能覆 盖全国。
所有推荐暴露前和暴露后使用的疫苗证书见附件9。
8.8 预防咬伤的宣教
为降低狂犬病风险,减少PEP 和伤口处理支出,消除犬咬伤对 暴露者造成的心理创伤,重建健康的人-犬关心,应实施预防狗咬伤 的方案。尽管证据质量不佳,Meta 分析表明防止咬伤的教育在影响 儿童行为方面是成功的(48,49)。目前尚无证据表明类似方案可以 影响犬咬伤率。人类对犬的行为是知识、情感和经验之间复杂的相 互作用的结果(19,50),而防止犬咬伤的教育在涉及活犬时最为有 效。这种教育的复杂性意味着他们可能比狂犬病其他方面的教育需 要更多的时间和资源。
应仔细考虑狂犬病教育方案各组成部分的成本和收益。建议开 展认知度、态度和行为调查,以确定狂犬病教育计划的每一阶段。 根据当地环境,在存在狂犬病野生动物循环的地区,防止咬伤的教 育还应包括相应行为教育,尤其是强调不要接触或摆弄蝙蝠。
8.9 参 考 文 献
1.Lau CL,Hohl N.Immunogenicity of a modified intradermal preexposure rabies vaccination schedule using a purified chick embryo cell vaccine:an observational study.Travel Med Infect Dis.2013;11(6):427-30.
2.Mills DJ,Lau CL,Fearnley EJ,Weinstein P.The immunogenicity of a modified intradermal pre-exposure rabies vaccination schedulea case series of 420 travelers.J Travel Med.2011;18(5):327-32.
3.Soentjens P,Andries P,Aerssens A,Tsoumanis A,Ravinetto R,Heuninckx W et al.Pre-exposure intradermal rabies vaccination:a randomized trial in healthy adults on shortening the schedule from 28 to 7 days.Submitted to Clin Infect Dis.
4.Recuenco S,Warnock E,Osinubi MO,Rupprecht CE.A single center,open label study of intradermal administration of an inactivated purified chick embryo cell culture rabies virus vaccine in adults.Vaccine.2017;35(34):4315-20.
5.Wieten RW,Leenstra T,van Thiel PP,van Vugt M,Stijnis C,Goorhuis A et al. Rabies vaccinations:are abbreviated intradermal schedules the future?.Clin Infect Dis.2012;56(3):414-9.
6.Khawplod P,Jaijaroensup W,Sawangvaree A,Prakongsri S,Wilde H.One clinic visit for pre-exposure rabies vaccination(a preliminary one year study).Vaccine.2012;30(19):2918-20.
7.Suandork P,Pancharoen C,Kumperasart S,Sungdee A,Pattamadilok S, Sawanpanyalert P.Accelerated neutralizing antibody response to rabies vaccination six month after a single intramuscular pre-exposure dose. Bangkok: Chulalongkorn University;2007
(http://cuir.car.chula.ac.th/handle/123456789/14363).
8.Jonker EF,Visser LG.Single visit rabies pre-exposure priming induces a robust anamnestic antibody response after simulated post-exposure vaccination: results of a dose-finding study.J Travel Med.2017;24(5).
9.Soentjens P.Preliminary results of intradermal booster doses(two or four) during one visit at one year after a single visit intradermal pre-exposure vaccination:an open-label randomized clinical trial on rabies boostability. Free communication FC6.04 at the 15th Conference of the International Society of Travel Medicine,Barcelona,14-18 May 2017.
10.Simani OE,Izu A,Violari A,Cotton MF,van Niekerk N,Adrian PV et al. Effect of HIV-1 exposure and antiretroviral treatment strategies in HIV infected children on immunogenicity of vaccines during infancy.Aids. 2014;28(4):531-41.
11.Boland TA,McGuone D,Jindal J,Rocha M,Cumming M,Rupprecht CE et al.Phylogenetic and epidemiologic evidence of multiyear incubation in human rabies.Ann Neurol.2014;75(1):155-60.
12.Baer GM.The natural history of rabies.2nd edition.Boca Raton(FL):CRC Press;1991.
13.Fenelon N,Dely P,Katz MA,Schaad ND,Dismer A,Moran D et al.Knowledge,attitudes and practices regarding rabies risk in community members and healthcare professionals:Petionville,Haiti,2013.Epidemiol Infect. 2017;145(8):1624-34.
14.Ponsich A,Goutard F,Sorn S,Tarantola A.A prospective study on the incidence of dog bites and management in a rural Cambodian,rabies endemic setting.Act a Trop.2016;160:62-7.
15.Sultanov AA,Abdrakhmanov SK,Abdybekova AM,Karatayev BS,Torgerson PR. Rabies in Kazakhstan.PLoS Negl Trop Dis.2016;10(8):e0004889.
16.Wallace RM,Reses H,Franka R,Dilius P,Fenelon N,Orciari L et al.Establishment of a canine rabies burden in Haiti through the implementation of a novel surveillance program.PLoS Negl Trop Dis.2015;9(11):e0004245.
17.Lapiz SM,Miranda ME,Garcia RG,Daguro LI,Paman MD,Madrinan FP et al.
Implementation of an intersectoral program to eliminate human and canine rabies: the Bohol Rabies Prevention and Elimination Project.PLoS Negl Trop Dis.2012;6(12):e1891.
18.Birhane MG,Cleaton JM,Monroe BP,Wadhwa A,Orciari LA,Yager P et al. Rabies surveillance in the United States during 2015.J Am Vet Med Assoc.2017;250(10):1117-30.
19.Medley AM,Millien MF,Blanton JD,Ma X,Augustin P,Crowdis K et al. Retrospective cohort study to assess the risk of rabies in biting dogs,2013- 2015,Republic of Haiti.Trop Med Infect Dis.2017;2(2):14.
20.Tepsumethanon V,Wilde H,Meslin FX.Six criteria for rabies diagnosis in living dogs.J Med Assoc Thai.2005;88(3):419-22.
21.Niezgoda M,Briggs DJ,Shaddock J,Rupprecht CE.Viral excretion in domestic ferrets (Mustela putorius furo)inoculated with a raccoon rabies isolate.Am J Vet Res.1998;59(12):1629-32.
22.Tepsumethanon V,Lumlertdacha B,Mitmoonpitak C,Sitprija V,Meslin FX,Wilde H. Survival of naturally infected rabid dogs and cats.Clin Infect Dis. 2004;39(2):278-80.
23.Rupprecht CE,Nagarajan T,Ertl H.Current status and development of vaccines and other biologics for human rabies prevention.Expert RevVaccin. 2016;15(6):731-49.
24.Aguèmon CT,Tarantola A,Zoumènou E,Goyet S,Assouto P,Ly S et al.Rabies transmission risks during peripartum -two cases and a review ofthe literature. Vaccine.2016;34(15):1752-7.
25.Bell JF,Moore GJ.Susceptibility of carnivora to rabies virus administeredorally.Am J Epidemiol.1971;93(3):176-82.
26.Wertheim HFL,Nguyen KAT,de Jong MD,Taylor WRJ,Le TV,Nguyen HH et al. Furious rabies after an atypical exposure.PLoS Med.2009;6(3):e1000044.
27.Fitzpatrick JL,Dyer JL,Blanton JD,Kuzmin IV,Rupprecht CE.Rabies inrodents and lagomorphs in the United States,1995-2010.J Am Vet MedAssoc. 2014;245(3):333-7.
28.Johnson N,Phillpotts R,Fooks AR.Airborne transmission of lyssaviruses.J Med Microbiol.2006;55(6):785-90.
29.Wilde H,Bhanganada K,Chutivongse S,Siakasem A,Boonchai W,SupichC.Is injection of contaminated animal bite wounds with rabies immuneglobulin a safe practice?Trans R Soc Trop Med Hyg. 1992;86(1):86-8.
30.Suwansrinon K,Jaijaroensup W,Wilde H,Sitprija V.Is injecting afinger with rabies immunoglobulin dangerous?Am J Trop Med Hyg.2006;75(2):363-4.
31.Kamoltham T,Singhsa J,Promsaranee U,Sonthon P,Mathean P,Thinyounyong W. Elimination of human rabies in a canine endemicprovince in Thailand:five-year programme.Bull World Health Organ.2003;81(5):375-81.
32.Chutivongse S,Wilde H,Fishbein DB,Baer GM,Hemachudha T.Oneyearstudy of the 2-1-1 intramuscular postexposure rabies vaccineregimen in 100 severely exposed Thai patients using rabies immuneglobulin and Vero cell rabies vaccine. Vaccine.1991;9(8):573-6.
33.Madhusudana SN,Sanjay TV,Mahendra BJ,Sudarshan MK,NarayanaDH,Giri A et al.Comparison of safety and immunogenicity of purifiedchick embryo cell rabies vaccine(PCECV)and purified vero cell rabiesvaccine(PVRV)using the Thai Red Cross intradermal regimen at a doseof 0.1 mL.Hum Vaccin.2006;2(5):200-4.
34.Warrell MJ,Riddell A,Yu LM,Phipps J,Diggle L,Bourhy H et al. Asimplified 4-site economical intradermal post-exposure rabies vaccineregimen: a randomised controlled comparison with standard methods.PLoS Negl Trop Dis.2008;2(4):e224.
35.Ambrozaitis A,LaiSkonis A,Bal iuniene L,Banzhoff A,Malerczyk C.Rabies postexposure prophylaxis vaccination with purified chick embryocell vaccin (PCECV)and purified Vero cell rabies vaccine(PVRV)ina four-site intradermal schedule(4-0-2-0-1-1):an immunogenic,cost-effective and practical regimen.
Vaccine.2006;24(19):4116-21.
36.Narayana A,Manoharan A,Narayan MS,Kalappa SM,Biligumba G,Haradanahalli R et al.Comparison of safety and immunogenicity of2 WHO prequalified rabies vaccines administered by one week,4 siteintra dermal regimen(4-4-4-0-0)in animal bite cases.Hum VaccinImmunother.2015;11(7):1748-53.
37.Shantavasinkul P,Tantawichien T,Wilde H,Sawangvaree A,Kumchat A,Ruksaket N et al.Postexposure rabies prophylaxis completed in 1 week:preliminary study.Clin Infect Dis.2010;50(1):56-60.
38.Sudarshan MK,Narayana DH,Madhusudana SN,Holla R,Ashwin BY,Gangaboraiah B et al. Evaluation of a one week intradermal regimen forrabies post-exposure prophylaxis:results of a randomized,open label,active-controlled trial in healthy adult volunteers in India.Hum VaccinImmunother.2012;8(8):1077-81.
39.Ravish HS,Sudarshan MK,Madhusudana SN,Annadani RR,NarayanaDH,Belludi AY et al.Assessing safety and immunogenicity of postexposureprophylaxis following interchangeability of rabies vaccines inhumans.Hum Vaccin Immunother. 2014;10(5):1354-8.
40.Bharti OK,Madhusudana SN, Gaunta PL,Belludi AY.Local infiltration ofrabies immunoglobulins without systemic intramuscular administration:an alternative cost effective approach for passive immunization againstrabies.Hum Vaccin Immunother.2016;12(3):837-42.
41.Bharti OK,Madhusudana SN,Wilde H.Injecting rabies immunoglobulin(RIG) into wounds only:a significant saving of lives and costly RIG.HumVaccin Immunother.2017;13(4):762-5.
42.Madhusudana SN,Ashwin BY,Sudarshan S.Feasibility of reducingrabies immunoglobulin dosage for passive immunization againstrabies:results of in vitro and in vivo studies.Hum Vaccin Immunother.2013;9(9):1914-7.
43.Saesow N,Chaiwatanarat T,Mitmoonpitak C,Wilde H.Diffusion andfate of intramuscularly injected human rabies immune globulin.ActaTrop. 2000;76(3):289-92.
44.Abbas SS,Kakkar M,Rogawski ET.Costs analysis of a population levelrabies control programme in Tamil Nadu,India.PLoS Negl Trop Dis.2014;8(2):e2721.
45.Fitzpatrick MC,Shah HA,Pandey A,Bilinski AM,Kakkar M,Clark ADet al. One health approach to cost-effective rabies control in India.ProcNatl Acad Sci US A.2016;113(51):14574-81.
46.Hampson K,Cleaveland S,Briggs D.Evaluation of cost-effectivestrategies for rabies post-exposure vaccination in low-income countries.PLoS Negl Trop Dis. 2011;5(3):e982.
47.Mindekem R,Lechenne MS,Oussiguéré A,Kebkiba B,Moto DD,Alfaroukh IO et al.Cost description and comparative cost efficiency of post-exposure prophylaxis and canine mass vaccination against rabies inN’Djamena,Chad. Front Vet Sci.2017;4:38.
48.Duperrex 0,Blackhall K,Burri M,Jeannot E.Education of children and adolescents for the prevention of dog bite injuries.Cochrane DatabaseSyst Rev.2009;15(2):CD004726.
49.Shen J,Rouse J,Godbole M,Wells HL,Boppana S,Schwebel DC.Systematic review:interventions to educate children about dog safetyand prevent pediatric dog-bite injuries:a meta-analytic review.J PediatrPsychol.2016;42(7):779-91. 50.Mathews JR,Lattal KA.A behavioral analysis of dog bites to children.J Dev Behav Pediatr.1994;15(1):44-52.
由于超过95%的人类狂犬病是由犬只传播的,因此控制和消除犬狂犬病,就从源头上预防了狂犬病。在北美、西欧、日本以及亚洲和南美洲部分地区,犬介导的狂犬病已被消灭;然而,此类狂犬病在100多个国家和地区仍很普遍,主要存在于发展中国家(见第2节)。
动物狂犬病的临床症状差异很大。临床上出现以下任何症状的动物被定义为患有狂犬病:
■ 唾液分泌过多
■ 瘫痪
■ 嗜睡
■ 无端的异常攻击(如,对两人或两人以上、动物和/或无生命的物体发起撕咬)
■ 异常发声
■ 夜间活动物种开始日间活动。
动物狂犬病病例分为:
■ 疑似病例:与动物狂犬病的临床病例定义相符的病例;
■ 可能病例:疑似病例,有与疑似、可能或确认患有狂犬病动物接触的可靠历史,和/或该疑似动物在观察到患病后4~5天内被捕杀、死亡或消失;
■ 确定病例:经实验室确认为狂犬病的病例;
■ 非病例:实验室试验或流行病学调查排除的疑似或可能病例(即尚在检疫合格期的动物)。
实验室确诊应通过世界卫生组织或世界动物卫生组织定义的标准诊断试验进行(见第5节)(1)。如使用其他诊断试验,根据初始试验的敏感性和特异性,可能需要用国际认可的二级试验来确认结果(尤其是阴性结果)。据报道,当人类接触可疑动物时,准确诊断动物是否有狂犬病尤为重要。
由于狂犬病控制计划涉及多个机构和部门,包括动物和公共卫生机构和部门,因此需要采取“同一健康”策略,开展有效的部门间合作。采用按国际标准生产的疫苗进行大规模的非肠道犬类疫苗接种行动是控制犬介导的狂犬病的支柱(1~4)。为控制并最终消灭狂犬病,必须经常发起此类行动(通常为每年一次),使疫苗接种率至少为70%(5、6),这应足以维持易感人群所需的群体免疫水平,尽管在行动间隔期间有犬数量出现更替(出生、死亡、动物移动)。应定期评估接种率,并提供适当的流行病学咨询,以确保在所有目标地区达成目标。至关重要的是,狂犬病疫苗接种计划要足够灵活,以便及时、充分地应对流行病状况变化。
提高社区意识、参与和动员可改善疫苗接种活动的效果、成本效益和可持续性及狂犬病病例的监测和管理。当犬只无饲主管理,或者无饲主声称负责疫苗接种时,职业犬类管理者可用人道方式捕捉和栓住犬只,以接种疫苗,职业犬类管理者需接受适当培训,以确保他们能够高效、可靠和人道地捕捉犬只;不熟练的处理会伤害自身和犬只,并可能使未来的疫苗接种更加困难。由于犬类管理者可能会有更高的犬只咬伤率,因此强烈建议其在接触犬只前接种疫苗(见第8.2节)。
口服狂犬病疫苗接种(ORV)可在不栓住或捕捉犬只的情况下提高疫苗接种率,并且应作为一种补充措施以提高犬狂犬病控制计划中的疫苗接种率(见第9.2.3节)。
疫苗接种计划的负责人应考虑当地犬群的生态,包括是否为家犬且活动受限,家犬且自由流放,由社区拥有或无主。此信息确保了这种方法可最大限度地接近犬只,并适应社会文化背景。散养家犬在狂犬病传播中起着关键作用,因此必须被纳入疫苗接种活动内。
经反复证明,大量犬只接种疫苗对控制犬介导的狂犬病是有效的,从长远来看,清除犬只不会降低犬只密度或控制狂犬病,因此,大规模扑杀犬只不应成为狂犬病控制策略的一部分:因为这是无效的,并可能会对疫苗接种计划产生反作用,尤其是以散养家犬为目标时。有关人道主义犬群管理的更多信息,请参见世界动物卫生组织《陆生动物诊断试验和疫苗手册》中的第7.7章:“流浪犬群管理”(7)。
对疑似患有狂犬病的犬只实施安乐死,可防止进一步将狂犬病传染给人类和其他动物,也能防止犬只遭受更多痛苦(动物狂犬病病例定义请参见第9.1节)。如犬只的狂犬病临床诊断不明确,可进行隔离观察;但是,如症状有所发展,则应实施人道安乐死(7)。
9.2.1 犬狂犬病控制计划的主要组成部分
下面列出了犬狂犬病控制计划的内容。
■ 根据对当地流行病学、教育和意识形态、大规模犬只免疫以及风险人群暴露后免疫或暴露前免疫准备的了解,建立国家战略、协调中心和委员会去起草、制定、实施并监控狂犬病消除的长期计划(见第8节)。
■ 加强兽医服务、公共卫生和野生生物管理等部门间的跨部门合作,设计有科学依据的消灭人类和动物狂犬病的方法。
■ 支持将狂犬病控制活动纳入各级卫生服务,并将其与其他公共卫生或动物疾病控制计划相协调。狂犬病控制措施的综合交付在加强卫生和兽医服务交付方面可能有更广泛的益处,尤其是在偏远地区和被忽视的社区,有助于改善部门间协作并建立社区信任。
■ 促进与制药业和制药机构的合作,提供疫苗,包括人用疫苗和兽用疫苗;并促进技术合作,以确保高质量疫苗的正确储存、迅速交付和适当给药。
■ 在技术合作或人道主义援助的框架内,向双边、多边、公共和私人机构及其他捐助者寻求资助。
■ 开展运动和教育计划,提高对负责任养犬、对疑似狂犬病动物咬伤的基本护理及如何避免产生暴露的认识。
■ 加强监测和诊断能力,包括快速诊断试验和狂犬病公告系统。
■ 开展有效的跨境合作,以控制并消除狂犬病。
9.2.2 犬只疫苗接种战略规划和管理
在享有充分资源的情况下应对疫苗接种进行战略规划和良好管理。狂犬病预防伙伴联盟编制的“狂犬病蓝图”提供了犬只疫苗接种规划和执行指南 (http: //caninerabiesblueprint.org/)(8)。另一个可用于战略规划和资金分配的工具是“基于犬只疫苗接种的犬介导人类狂犬病死亡控制的规划援助”(9)。
犬类生态学研究
在规划疫苗接种时,应估计犬只数量,并确定犬只习性,以计算所需资源和接近犬只进行疫苗接种的方法(8)。可通过人与犬的比例来估算犬数量;但是,此比例差异较大,且不良的人口普查数据可能会降低犬数量的估计准确性。此外,城市地区养犬的低报告率和不同的养犬模式使得很难准确估计犬数量。估计犬数量的其他方法包括调查和捕捉一标记一再捕捉法,涵盖了散养家犬群。方法详情见“犬狂犬病蓝图”。此调查通常与疫苗接种后调查有效地结合在一起,以评估接种率,并可为未来的活动修订犬只估计数量(10、11)。从犬类登记所获得的信息是有用的,但是,这不包括未登记犬或无主犬,仅使用此资源会低估犬只总数量。
疫苗接种和免疫覆盖
尽管该地区的平均接种率很高,但即使一小部分社区的犬只接种率较低或不完整,甚至数据缺失,都可能会助长狂犬病继续存在,并危及消灭狂犬病的前景。
在接种覆盖广的邻近地区进行疫苗接种比在许多小区域、单独区域进行疫苗接种有效(12)。
疫情爆发时,不推荐将反应性疫苗接种作为常规(如每年一次)、系统的、积极主动的疫苗接种活动的替代方案,除非有更大规模的监测表明,在剩余的几个疫源地,发病率已经降低至低水平。反应策略控制狂犬病需要更长时间,并且相比在整个地区的系统预防接种,不大可能成功。如疫苗接种方案涵盖了精心设计的教育活动、跨部门和跨学科合作、社区参与、地方的规划和执行承诺、高质量疫苗提供、媒体支持以及适当当局对活动的有效全面协调和监督,就可实现所需的免疫覆盖率。
犬只疫苗接种活动实施和监测
在大型接种活动中,不论体重、健康状况或先前疫苗接种情况如何,所有的犬都应接种疫苗,包括新生犬。虽然我们的目标应该是对尽可能多的犬接种疫苗,通过对至少70%的狂犬病易感犬群进行疫苗接种,即可获得群体免疫力。
接种率低的一个原因是:幼犬占犬群的较大一部分却未接种疫苗(13),大多是因为疫苗制造商或国家指南不推荐接种。然而,在南非、突尼斯和坦桑尼亚联合共和国的研究表明,幼犬(小于3个月)在接种高质量疫苗时会产生有效的免疫反应并且不会产生不良反应。因此,犬主人和疫苗接种团队应意识到,幼犬(包括新生犬)也应接种疫苗,以确保足够的犬群接种率,尽管这可能意味着会超出说明书范围使用。
给犬只进行疫苗接种活动的四种基本方法:挨家挨户访问、在社区公认点设立固定疫苗接种站、由流动小组和流动“街头疫苗接种”小组设立的临时疫苗接种站。通常,只有当接种站位置不到500米或步行10分钟左右时,才会得到足够关注。应由地方机构决定所用方法,因为方法选取取决于社区社会文化背景。可使用多种方法的组合。
狂犬病疫苗的接种可与其他健康干预措施(如,驱虫、绝育和其他疫苗接种方案)结合,可以为犬只带来额外的健康益处,并鼓励犬主人和兽医参与疫苗接种活动(14)。
接种活动时间安排
狂犬病疫苗接种活动通常每年进行一次,但在犬狂犬病发病率和/或犬群流动率高或该方案尚未达到预期效果的地区,可能需要更频繁进行疫苗接种活动。持续不到1个月的强化疫苗接种活动在拉丁美洲、亚洲和非洲地区已有效地控制了狂犬病。然而,活动应覆盖至少70%的犬群,追求速度不应影响接种率。可在周末、学习期间或放假期间组织活动以提高参与度,因为孩子们往往会带他们的犬接种疫苗。
检测疫苗接种活动
建议对接种疫苗的犬进行登记和永久性标识,然而,为确定成本效益高、安全、快速、简单,适用于现场,并为犬只和犬主人接受的识别方法,仍需进行研究。即使缺乏对犬进行永久性标识的资源或能力,也不应影响疫苗接种活动的实施。使用彩色标签、喷绘或喷射标记或塑料项圈作为临时标志已被证明有助于识别已接种疫苗的犬,并可激励犬主人带其宠物去接种疫苗。为评估接种率并区分未接种疫苗犬只,以进行后续疫苗接种,有必要对接种疫苗犬只进行临时或永久标识。在大规模犬只疫苗接种活动(包括口服狂犬病疫苗接种活动)中,常规血清监测可能很昂贵,且如出现以下情况则无需进行常规血清监测:
■ 使用了按国际标准制造的高质量疫苗;
■ 疫苗接种团队已经培训,并已使用了适当的注射技术,犬只控制和疫苗瓶管理;
■ 自始至终保持冷链状态。
如多次年度疫苗接种活动已达到目标接种率,但并未使动物狂犬病病例数量减少,则可能未遵循上述一个或多个因素,或对犬只接种率计算的估算不准确。设计良好的血清学研究和其他研究(例如,疫苗效价,冷链监测)可确保接种后的抗体反应。血清学检测应在疫苗接种后28天或28天左右的抗体峰值反应期间进行,因为如在疫苗接种后进行更长时间的取样,抗体滴度的快速下降会使血清学结果难以解释。
经适当验证的酶联免疫吸附试验(ELISA)可作血清中和试验的替代方案(见第5节)。
犬疫苗接种的成本效益
与单独进行暴露后免疫相比,犬疫苗接种与暴露后免疫的结合在预防人类狂犬病致死方面具有更高的成本效益(15~17)。然而,对暴露后免疫的需求并不总是随着犬狂犬病发病率的降低而减少。
乍得一项关于犬饲养主对犬登记或疫苗接种活动费用贡献影响的研究表明:与免费疫苗接种活动相比,收费疫苗接种活动增加了每只接种犬只的费用,降低了犬群的接种率(18)。在菲律宾,居民愿意为犬只疫苗接种支付的费用平均为1.67美元,愿意为犬只登记支付的费用平均为0.70美元,这取决于社会经济和人口因素,如年龄、收入、所拥有犬数量和居住地(19)。因此,在收取这些费用之前,应考虑这些因素。如缴费会影响疫苗接种,则应免费提供干预(登记、标记、疫苗接种、证书递送),并将成本与狂犬病控制的公共健康益处相平衡。
使用的疫苗
由于疫苗易受温度变化(包括冷冻)影响,因此必须小心确保冷链在可接受的温度范围内(2~8℃)。诱导免疫至少持续2年的疫苗应用于每年所有犬只的复种活动中。
复种无不良影响。尽管有犬只已接种了诱导长期免疫的疫苗,则可能无需进行每年的犬只加强接种,且更有选择性的疫苗接种可能会节约成本,但是犬主人及其犬只远离接种点,则可能会发出令人困惑的信息。此外,在许多活动中,复种的直接成本可能低于活动中的固定成本。
对3个月以下的幼犬接种高质量灭活狂犬病疫苗已证实能有效地转化血清(20)。在流行区,所有犬只,包括小于3个月的幼犬,都应包含在疫苗接种活动中。
如签发疫苗接种证书,则预先印制的证书可能会提高效率。由于母体抗体可能会干扰疫苗接种,仅在幼犬接受了增强剂量后才能获得疫苗接种证书。
可用疫苗
已开发出用于家养哺乳动物和野生动物狂犬病预防的兽用疫苗。这些疫苗要么为灭活(杀死)产品、要么为改性活性产品或是重组产品。无论采用何种疫苗生产方法,都应明确记录原料质量和标准(如,病毒主种子、特定无病原体胚胎蛋、细胞种子),尤其是无菌性、安全性和效价等方面。
动物狂犬病疫苗应经国家主管部门批准,并符合国家疫苗要求。如在效价、无菌性、安全性和功效方面无关于兽用生物制品的适当国家法规,则应参考相关的国际标准。有关犬只和野生动物狂犬病的可用兽用疫苗的更多信息,包括效价要求,请参见世界动物卫生组织《陆生动物诊断试验和疫苗手册》第2.1.17章:狂犬病(狂犬病病毒感染)(1)。
神经组织疫苗会引起更严重的不良反应,且其产生的免疫原性比现代细胞培养疫苗低。世界卫生组织和世界动物卫生组织强烈建议停止生产和使用神经组织疫苗,并用现代细胞培养疫苗替代。也不鼓励使用由禽胚卵或细胞培养的菌株生产的改性活病毒疫苗对犬只进行肠胃外接种。应使用灭活疫苗进行疫苗接种(有或无佐剂)。
安全注意事项
所有控制犬只的疫苗接种团队成员都应在活动前接受暴露前免疫。活动中暴露的人员应全程进行暴露后免疫。
如意外接触改性狂犬病病毒活疫苗,应寻求医疗援助并考虑暴露后免疫。评估重组疫苗(如,含有活痘或腺病毒载体的疫苗)对动物、人类和环境的潜在风险,且在实地使用前确定缓解或治疗方法,尤其是在人类用药时。
有关动物狂犬病疫苗安全性最低要求的详细信息,请参见世界动物卫生组织《陆生动物诊断试验和疫苗手册》第2.1.17章:狂犬病(狂犬病病毒感染)(1)。
9.2.3 口服狂犬病疫苗接种活动
口服狂犬病疫苗已成功地控制了某些狂犬病野生动物宿主(21)。犬只口服狂犬病疫苗接种是一种补充措施,可在大规模非肠道犬只疫苗接种活动中增加接种率,如因散养家犬群的存在而影响了70%的接种率的情况下。各国应在其狂犬病控制战略中评估非肠道接种和口服狂犬病疫苗接种的适宜性和必要性。附录10概述了目前可用的口服狂犬病疫苗接种产品。
目标犬群
仅考虑对在正常情况下不能非肠道接种疫苗的半限制和非限制犬只(及无法控制的有主、完全限制的犬只)进行口服狂犬病疫苗接种。很可能只有在尝试了大规模非肠道疫苗接种运动后,才能识别这类犬只。口服狂犬病疫苗接种有助于提高难以接触的犬亚群的接种率。
分配方法
口服狂犬病疫苗接种已被用于相对较小的野外试验中,为犬只接种疫苗(22~25)。为了限制非目标物种(包括人类)接触疫苗和诱饵的可能性,已使用了“分发”模式,在此模式下,诱饵将呈现给街头的犬只(无论是有主或无主)。口服疫苗诱饵可与挨家挨户或中心站非肠道活动同时实施,例如针对有攻击性和难以控制的犬只。口服狂犬病疫苗接种应始终由训练有素的疫苗接种员进行。
有效性
胃肠道外疫苗接种仍是免疫的主要方法。经反复证明,在适当接种疫苗的犬只中,超95%会产生强有力的免疫反应。胃肠道外疫苗直接注射到皮下或肌肉组织中,几乎保证了疫苗会被合格的宿主免疫系统识别。由于分娩和免疫学方面的几个重要问题,犬口服疫苗不能保证达到如此高的血清转换率。口服疫苗需要犬只被引诱至诱饵处,咀嚼诱饵并咬碎小药囊或泡罩,且疫苗以正确的量沉积在口腔粘膜上。此外,口服疫苗是经改性的活构建体或重组构建体,且必须在宿主体内复制才能诱导免疫反应。出于这些原因,胃肠道外接种灭活疫苗是易接近犬只的首选;口服狂犬病疫苗接种对半限制、非限制和不可接近的犬亚群的效用明显是有益的(25)。
安全性
根据国际标准许可的口服狂犬病疫苗被认为是安全的;然而,在现场进行口服狂犬病疫苗接种前,应始终对安全性进行全面评估。在海地,对改性活狂犬病病毒口服疫苗的安全性评估表明,通过分发方法,接触口服狂犬病疫苗诱饵导致人类死亡的概率为10亿分之0,且通过分发方法,犬咬伤导致人类死亡的概率变为10亿分之0.3(假设未给任何暴露人员进行暴露后免疫)。在突尼斯,挨家挨户发放诱饵时(等同于分发方法),未发生诱饵暴露,而在“样线”分发时,观察到1.4%的接触率(26)。
各国有责任研究将口服狂犬病疫苗接种引入其狂犬病控制策略的机会。如口服疫苗含转基因改性生物体,则应考虑其释放到环境中的法律影响。世界卫生组织建议在大规模应用之前,在试点研究中使用口服狂犬病疫苗接种,以评估其可行性和有效性。研究人员和项目设计者应评估产品,识别潜在危险,并评估与引入环境相关的风险。
世界动物卫生组织《陆生动物诊断试验和疫苗手册》第2.1.17章:狂犬病(狂犬病病毒感染)(1)中说明了调查与执行口服狂犬病疫苗接种的指导原则。正在考虑使用犬口服狂犬病疫苗接种的国家应确保目标和非目标物种(包括人类)上病毒结构的安全性(25)。正如欧洲和美国在野生动物狂犬病疫苗接种方面所示,选择安全、有效的口服狂犬病疫苗构建体和适当非目标暴露疫苗应急计划可使人类风险微乎其微(27)。应特别注意低收入社区的安全,在这些社区中,可能在人口高密度地区进行口服狂犬病疫苗接种,免疫缺陷的患病率较高,获得医疗服务的可靠性较低,识字率也可能较低,因此人们可能无法识别警告标签。
在选择了疫苗和诱饵系统后,在将疫苗诱饵放置在环境中之前,应向公众提供足够信息,以便获得公众的大幅支持和合作。这些信息应包含与疫苗相关的潜在风险,以及如与人类或其他非目标发生接触可获得的援助。
建立监测系统来检测人类与疫苗和/或诱饵的接触,并建立记录和追踪人类接触疫苗情况的规则,这是至关重要的。如意外接触改性活狂犬病病毒疫苗,应寻求医疗援助并考虑暴露后免疫(见第8节)。应报告直接接触疫苗和接触最近接种疫苗的动物(即一至几小时前)的暴露情况。无证据表明口服狂犬病疫苗在唾液中主动排泄,但是,由于口服后口腔中存有液体疫苗,所以至少1小时内或最好使更长时间内,应避免或尽量减少与刚服用口服疫苗犬只接触(25)。监测计划应能够检测出进行口服狂犬病疫苗接种地区的狂犬病犬,所有阳性样本都应进行分子表征,以确保疫苗不会回复至毒性状态。
国际组织,特别是世界卫生组织和世界动物卫生组织(包括它们的参考中心网络),与各国政府合作,评估实地使用和应用每种产品(改良活疫苗、重组疫苗和其他构建体)对目标物种和非目标物种造成的相关风险;确定每种产品的功效和安全要求;并定义实地分发标准。评估犬口服狂犬病疫苗使用情况的主要标准是:
■ 原产地(制造商);
■ 疫苗类型:改性活病毒、重组活病毒或其他构建体;
■ 目标动物的安全;
■ 非目标动物的安全;
■ 非人灵长类动物的安全;
■ 接种的主要目标动物的体液免疫发展;
■ 毒性攻击保护研究结果;
■ 诱饵分配方法的诱饵接触率;
■ 诱饵基质对圈养和散养家犬的吸引力;
■ 诱饵基质在实地条件下的热稳定性及预测;
■ 将存活的狂犬病病毒排泄至环境中(唾液和粪便样本);
■ 成本效益;
■ 在任何国家和/或目前由国际公众和/或动物卫生机构推荐用于实地使用的产品的现行许可;
■ 社区支持犬口服狂犬病疫苗接种;
■ 对可能直接接触疫苗或接触最近接种疫苗犬只的人员进行接种疫苗后检测的可能性;
■ 接触或潜在接触疫苗人员进行暴露后免疫(暴露后免疫适用于疫苗构建体,可能包括除狂犬病病毒属以外的试剂)。
应从相关国家监管当局和/或相关国际准则(世界动物卫生组织、世界卫生组织、《欧洲药典》、《美国联邦法典》)获取相关程序、试验和医疗方案的详情。
许可证发放
在使用口服狂犬病疫苗接种的国家将许可该疫苗用于犬只;然而,许多受犬介导的狂犬病影响的国家缺乏监管机构来为生物产品颁发许可证,并依靠其他国家或许可证。这就造成了一个全球性困境,因为那些能为疫苗产品颁发许可证的国家(和疫苗制造商)通常不受犬介导狂犬病的影响,也没有为犬用口服疫苗产品颁发许可证的动机。
鼓励制造商根据国际标准为犬用口服狂犬病疫苗接种产品发放许可证,以帮助狂犬病流行国家的监管当局迅速批准将口服狂犬病疫苗接种用于狂犬病项目中。正考虑使用口服狂犬病疫苗接种和有能力为该产品发放许可证的国家应在大规模现场使用前,优先考虑评估口服狂犬病疫苗接种产品并为该产品发放许可证。如无法发放许可证,各国应考虑对已获许可的非犬类口服狂犬病疫苗接种产品进行药品核准标示外使用,但前提是已进行了充分地安全性和有效性研究。
动物的国际间转运对人类公共健康意义重大,因为这可能引发狂犬病在新的国家或地区传播、突现或再度出现。从无狂犬病或被认为有狂犬病感染的国家进口家养、圈养野生动物和野生哺乳动物的相关条例应符合世界动物卫生组织国际标准,包括出示有效的国际兽医证明(28)。有关动物的国际间转运更多信息,请参见世界动物卫生组织陆生动物卫生法典第8.14章(29)。
犬群的人道主义管理主要通过负责任的犬主、提供绝育服务及基本的犬健康护理来实现(7)。在犬介导的狂犬病控制背景下,犬群管理目标在于改善并保持接种率,并减少危险的犬行为。减少犬群数量未必是降低狂犬病病例数量的有效手段,尽管这可能存在其他益处(如,犬福利或犬扰民等方面)(30)。因此,犬群管理对犬介导的狂犬病控制可能是有益的。
人道主义犬群管理是降低犬群流动率和创造健康、持续犬群环境的有效策略。由于犬群的地位和组成因国家而异,没有一种能在所有的情况下行之有效的干预方法。当局应与了解当地犬群的人一起合作,以了解犬的所属关系、犬群数量统计学和当地社区对犬的态度。此信息为形成长期、可持续管理的定制管理工具包奠定基础(8、31)。有关人道主义犬群管理更多信息,请参见世界动物卫生组织陆生动物卫生法典第7.7章(7)。
应优先考虑为犬只接种疫苗,因为这是减少犬介导的狂犬病的最有效手段(32)。一个公开可用的随机模型可比较各种预算拨款对绝育和疫苗接种的影响,成本和预计人类死亡相关信息,请访问网站:https://bioecon.shinyapps.io/CanineRabiesWebApp/。在下列情况下,应对犬进行绝育:
■ 绝育的资金和时间都与疫苗接种资金和时间不同;
■ 已达到较高接种率,且有多余的可用资金;
■ 绝育和疫苗接种的成本都很低。
也可在罕见生态环境中考虑绝育,如这可显著延长犬寿命,没有对额外犬只的需求和向往,且绝育成本较低时。鼓励各国首先投资大规模的疫苗接种活动。
自1983年正式承诺消除犬介导狂犬病导致的人类死亡以来,拉丁美洲国家已减少了90%以上的犬狂犬病病例,人类死亡病例也有相应的下降(4)。通过每年对超5000 万只犬进行大规模疫苗接种和对存在狂犬病潜在风险的人进行适当处置(暴露前免疫和暴露后免疫)以及流行病学监测,绝大多数目标已实现。拉丁美洲疫苗接种活动的成功归功于公共卫生部门的中心协调作用和社区参与狂犬病控制(33)。
夸祖鲁-纳塔尔省(南非)和米沙鄢群岛(菲律宾)的概念验证测试方案也通过大规模犬只疫苗接种和扩大暴露后免疫使用范围,减少了人类狂犬病病例的数量。在夸祖鲁-纳塔尔省,每年进行的犬只疫苗接种活动大大减少了狂犬病病例数量,且犬介导的狂犬病病例也减少了80%以上。随着重启支持和重燃势头,该项目正在整个南部非洲推广。在米沙鄢群岛,狂犬病消除区域项目是狂犬病控制国家项目的一部分,由农业、卫生和教育部门联合实施,涉及在米沙鄢群岛西部、东部和中部及保和岛实施犬只疫苗接种活动(3)。开展深入的教育活动,让社区参与到活动中,增加犬只疫苗接种和宠物主人的责任心,提高监测和诊断能力并增加获得暴露后免疫的机会。在米沙鄢群岛开始控制活动后的6年内,人类狂犬病病例数量减少了约一半,且两个省、五个岛屿城市和五个较小岛屿已宣称无狂犬病(34)。
2010年,孟加拉国发起了一项国家战略:到2020年消灭狂犬病,并由卫生部、畜牧部和地方政府合作进行。该战略包括宣传、交流和社会动员、犬咬伤管理、大型犬只疫苗接种和犬群管理。2011年,犬疫苗接种已从一个自治市扩大至64个自治市和市。针对捕犬手和接种员的能力建设的滚雪球技术已培养了数千名专业捕犬手,在一个有83%散养犬的国家,这是必不可少的。通过地方活动,该项目在1周内实现了70%的最低犬群接种率,并减少了市政当局计划外的杀犬行为。到2020年,计划进行三轮疫苗接种,覆盖约160万只犬。通过此战略,人类狂犬病病例从2011年前的每年2000多例减少至2016年向世界卫生组织通报的不到200例(35、36)。
在乍得恩贾梅纳,2012年和2013年开展了大规模犬只疫苗接种活动,接种率达到70%,使年度犬狂犬病发病率从2012年的0.7/1000下降至2014年的0.07/1000(37)。活动结束后,在9个多月(2014年1月至10月)内,恩贾梅纳无犬狂犬病病例报告。一个符合犬数量和流行病学数据的确定性传播模型表明,犬狂犬病传播已被疫苗接种活动中断了(9)。2015年和2016年,据报道,狂犬病病例出现在城镇周边,然后又出现在城镇中心,这表明重新引入先前的犬只疫苗接种区域是一个持续性威胁,必须在更大的区域范围内协调大规模的干预,以取得可持续效果。河流等地理边界是短期屏障;然而,犬活动受到人类活动的强烈驱使,且狂犬病可能因为人类转运犬只而穿越自然屏障传播至更远的地方。
1. Chapter 2.1.17: Rabies (infection with rabies virus). In: Manual of diagnostic tests and vaccines for terrestrial animals, Vol. 2. Paris: World Organisation for Animal Health; 2016.
2. Harischandra PA, Gunesekera A, Janakan N, Gongal G, Abela-Ridder B. Sri Lanka takes action towards a target of zero rabies death by 2020. WHO South East Asia J Public Health. 2016;5(2):112–6.
3. Lapiz SM, Miranda ME, Garcia RG, Daguro LI, Paman MD, Madrinan FP et al. Implementation of an intersectoral program to eliminate human and canine rabies: the Bohol Rabies Prevention and Elimination Project. PLoS Negl Trop Dis. 2012;6(12):e1891.
4. Vigilato MA, Clavijo A, Knobl T, Silva HM, Cosivi O, Schneider MC et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Phil Trans R Soc B. 2013;368(1623):20120143.
5. Cleaveland S, Kaare M, Tiringa P, Mlengeya T, Barrat J. A dog rabies vaccination campaign in rural Africa: impact on the incidence of dog rabies and human dog-bite injuries. Vaccine. 2003;21(17–18):1965–73.
6. Coleman PG, Dye C. Immunization coverage required to prevent outbreaks of dog rabies. Vaccine. 1996;14(3):185–6.
7. Chapter 7.7. Stray dog population control. In: Manual of diagnostic tests and vaccines for terrestrial animals. Paris: World Organisation for Animal Health; 2016 (http://www.oie.int/index. php?id=169&L=0&htmfile=chapitre_aw_stray_dog.htm).
8. Lembo T, Partners for Rabies Prevention. The blueprint for rabies prevention and control: a novel operational toolkit for rabies elimination. PLoS Negl Trop Dis. 2012;6(2):e1388.
9. Undurraga EA, Meltzer MI, Tran CH, Atkins CY, Etheart MD, Millien MF et al. Cost–effectiveness evaluation of a novel integrated bite case management program for the control of human rabies, Haiti 2014–2015. Am J Trop Med Hyg. 2017;96(6):1307–17.
10. Darkaoui S, Fassi Fihri O, Schereffer JL, Aboulfidaa N, Wasniewski M, Zouine K et al. Immunogenicity and efficacy of Rabivac vaccine for animal rabies control in Morocco. Clin Exp Vaccin Res. 2016;5(1):60–9.
11. Gibson AD, Handel IG, Shervell K, Roux T, Mayer D, Muyila S et al. The vaccination of 35,000 dogs in 20 working days using combined static point and door-to-door methods in Blantyre, Malawi. PLoS Negl Trop Dis. 2016;10(7):e0004824.
12. Townsend SE, Sumantra IP, Bagus GN, Brum E, Cleaveland S, Crafter S et al. Designing programs for eliminating canine rabies from islands: Bali, Indonesia as a case study. PLoS Negl Trop Dis. 2013;7(8):e2372.
13. Kaare M, Lembo T, Hampson K, Ernest E, Estes A, Mentzel C et al. Rabies control in rural Africa: evaluating strategies for effective domestic dog vaccination. Vaccine. 2009;27(1):152–60.
14. Knobel DL, Arega S, Reininghaus B, Simpson GJ, Gessner BD, Stryhn H et al. Rabies vaccine is associated with decreased all-cause mortality in dogs. Vaccine. 2017;35(31):3844–9.
15. Bögel K, Meslin FX. Economics of human and canine rabies elimination: guidelines for programme orientation. Bull World Health Organ. 1990;68(3):281.
16. Cleaveland S, Kaare M, Knobel D, Laurenson MK. Canine vaccination – providing broader benefits for disease control. Vet Microbiol. 2006;117(1):43–50.
17. Léchenne M, Oussiguere A, Naissengar K, Mindekem R, Mosimann L, Rives G et al. Operational performance and analysis of two rabies vaccination campaigns in N’Djamena, Chad. Vaccine. 2016;34(4):571–7.
18. Durr S, Mindekem R, Kaninga Y, Moto DD, Meltzer MI, Vounatsou P et al. Effectiveness of dog rabies vaccination programmes: comparison of owner-charged and free vaccination campaigns. Epidemiol Infect. 2009;137(11):1558–67.
19. Birhane MG, Miranda ME, Dyer JL, Blanton JD, Recuenco S. Willingness to pay for dog rabies vaccine and registration in Ilocos Norte, Philippines (2012). PLoS Negl Trop Dis. 2016;10(3):e0004486.
20. Morters MK, McNabb S, Horton DL, Fooks AR, Schoeman JP, Whay HR et al. Effective vaccination against rabies in puppies in rabies endemic regions. Vet Rec. 2015;177(6):150.
21. Freuling CM, Hampson K, Selhorst T, Schröder R, Meslin FX, Mettenleiter TC et al. The elimination of fox rabies from Europe: determinants of success and lessons for the future. Phil Trans R Soc B. 2013;368(1623):20120142.
22. Estrada R, Vos A, De Leon R, Mueller T. Field trial with oral vaccination of dogs against rabies in the Philippines. BMC Infect Dis. 2001;1(1):23.
23. Smith TG, Millien M, Vos A, Fracciterne FA, Crowdis K, Chirodea C et al. Evaluation of immune responses in dogs to oral rabies vaccine under field conditions. Vaccine. 2017: doi: 10.1016/j.vaccine.2017.09.096.
24. Darkaoui S, Boué F, Demerson JM, Fassi Fihri O, Yahia KI, Cliquet F. First trials of oral vaccination with rabies SAG2 dog baits in Morocco. Clin Exp Vaccin Res. 2014;3(2):220–6.
25. Guidance for research on oral rabies vaccines and field application of oral vaccination of dogs against rabies. Geneva: World Health Organization; 2007.
26. Matter HC, Schumacher CL, Kharmachi H, Hammami S, Tlatli A, Jemli J et al. Field evaluation of two bait delivery systems for the oral immunization of dogs against rabies in Tunisia. Vaccine. 1998;16(7):657– 65.
27. Scientific Panel on Animal Health and Welfare (AHAW). Update on oral vaccination of foxes and raccoon dogs against rabies. EFSA J. 2015;13(7):4164. Doi: 10.2903/j.efsa.2015.4164.
28. Chapter 5.11: Model veterinary certificates for international movement of dogs, cats, and ferrets originating from countries considered infected with rabies. In: Terrestrial Animal Health Code. Paris: World Organisation for Animal Health; 2016 (http://www.oie.int/index. php?id=169&L=0&htmfile=chapitre_certif_rabies.htm).
29. Chapter 8.14: Infection with rabies virus. In: Terrestrial Animal Health Code. Paris: World Organisation for Animal Health; 2016 (http://www. oie.int/index.php?id=169&L=0&htmfile=chapitre_aw_stray_dog.htm).
30. Taylor LH, Wallace RM, Balaram D, Lindenmayer JM, Eckery DC, Mutonono-Watkiss B et al. The role of dog population management in rabies elimination – a review of current approaches and future opportunities. Front Vet Sci. 2017;4:109.
31. Macpherson CNL, Meslin FX, Wandeler AI, editors. Dogs, zoonoses and public health. Second edition. Wallingford: CAB International; 2013.
32. Morters MK, Restif O, Hampson K, Cleaveland S, Wood JL, Conlan AJ. Evidence‐based control of canine rabies: a critical review of population density reduction. J Anim Ecol. 2013;82(1):6–14.
33. Background of the Meeting of Directors of National Programs for the Prevention and Control of Rabies (REDIPRA). São Bento: Pan American Foot-and-Mouth Disease Center; 2017 (http://www.paho.org/panaftosa/ index.php?option=com_content&view=article&id=798:antecedentes- de-la-redipra&Itemid=0).
34. From concept to completion (website). Geneva: World Health Organization; 2017 (http://www.who.int/neglected_diseases/news/ from-concept-to-completion-elimination-of-canine-rabies/en/).
35. Annual Report 2012. Dhaka: Communicable Disease Control Unit, Directorate General of Health Services, Ministry of Health and Family Welfare; 2012.
36. Annual report book. Atlanta (GA): Centers for Disease Control and Prevention; 2012.
37. Coleman PG, Dye C. Immunization coverage required to prevent outbreaks of dog rabies. Vaccine. 1996;14(3):185–6.
狂犬病是一种与许多食肉目和翼手目物种相关的病毒性人畜共患病,且食肉类和翼手类动物是狂犬病病毒的主要宿主。翼手目物种是几乎所有其他狂犬病病毒属的主要宿主(见第3节)。随着鉴定病毒变异株和系统发育的分子方法的发展,对于狂犬病病毒流行病学的了解显著增加。
表10概述了食肉动物狂犬病流行病学和生态学。反映了有记录的狂犬病传播病例;也可能有未记录到的其他食肉动物物种狂犬病传播病例。
表10
食肉动物狂犬病流行病学和生态学
| 国家/地区 | 狂犬病物种记录 | 注(参考) |
|---|---|---|
| 非洲 | 家犬 | 狂犬病病毒的主要宿主(1)
频繁的狂犬病病毒溢出感染威胁着濒危的野生非洲犬科动物,如埃塞俄比亚狼(C. simensis)和非洲野犬(Lycaon pictus)(2~4) |
| 南部非洲 | 豺狼(Canis adustus
和C. mesomelas) |
犬狂犬病病毒变异体的持续传播(5) |
| 高级检测(即,综合咬伤病例管理) | 大耳狐(Otocyon megalotis) | 犬狂犬病病毒变异体的持续传播(6) |
| 猫鼬(獴科) | 狂犬病病毒变异体的持续传播(7) | |
| 纳米比亚 | 扭角林羚(Tragelaphus strepsiceros) | 犬狂犬病病毒导致极高死亡率的原因(8)
疑似扭角林羚间直接经口感染 |
| 亚洲大陆 | 赤狐(Vulpes vulpes) | 多见于森林-草原地带和草原地带 |
| 俄罗斯远东地区、中国北方和朝鲜半岛 | 貉(Nyctereutes procyonoides) | (9) |
| 中国南方和中国台湾 | 鼬獾(Melogale moschata) | 被认为是人类狂犬病的主要宿主
可能是中国台湾唯一的储存宿主(10) |
| 以色列、约旦河西岸地区、加沙地带和土耳其 | 赤狐(V. vulpes) | 持续的犬类狂犬病病毒溢出感染导致土耳其最近出现狂犬病(11) |
| 伊朗伊斯兰共和国、阿曼、沙特阿拉伯和也门 | 赤狐(V. vulpes)亚洲胡狼(C. aureus) | 报告的病例数量增加(12) |
| 中东和亚洲的其他国家 | 赤狐(V. vulpes) | 有限的系统发育证据表明,在犬狂犬病流行的地区,野生动物并不呈现出一个独立的传播循环(13)。 |
| 欧洲 | 赤狐(V. vulpes) | 未出现在北欧、西欧和中欧地区(14、15)
流行于东欧和东南欧 |
| 貉(N. procyonoides) | 第二大最常报告的受感染物种
被认为是另一个主要野生动物宿主(16) 未识别出主要的适应变异体 |
|
| 北美洲 | 许多主要狂犬病病毒宿主和重叠地理范围,这给动物狂犬病控制带来了挑战。每个野生物种至少保持一种主要的宿主特异性狂犬病病毒,但可能被其他狂犬病病毒变异体感染。在所有地区,对野生动物和家畜的溢出感染都很常见。 | |
| 赤狐(V. vulpes) | 口服疫苗接种对控制至关重要 | |
| 灰狐(Urocyon cinereoargenteus) | 主要宿主,特别是在美国西南部
通过口服接种疫苗,德克萨斯州消灭了狂犬病 |
|
| 郊狼(Canis latrans) | ||
| 美国加拿大东部边境 | 浣熊(Procyon lotor) | 主要宿主(17) |
| 极地地区 | 北极狐(V. lagopus) | 主要宿主(17)
维持北极血统中的宿主特异性狂犬病病毒变异体 也在中亚和东南亚发现了类北极型狂犬病病毒(18、19) |
| 加州中部平原 | 条纹臭鼬(Mephitis mephitis) | 主要宿主(20) |
| 墨西哥 | 臭鼬(Spilogale属)白鼻浣熊(Nasua nasua) | 主要宿主 |
| 南美洲 | 狨猴(Callithrix jacchus)
食蟹狐(Cerdocyon thous)蜜熊(Potus flavus)白鼻浣熊 |
在几个物种中检测到不同的病毒(21~23)
野生动物监测不足以作出重大流行病学推断,更多信息请参见:http:// www.paho.org/panaftosa |
| 加勒比群岛,包括古巴、多米尼加共和国、格林纳达、海地和波多黎各 | 红颊獴(Herpestes auropunctatus) | 主要宿主 |
虽然不同地区蝙蝠有不同的品种,但在世界各地的蝙蝠中都发现了狂犬病病毒属(表11)(也参见第3节中的表3)。蝙蝠已被确定为除蒙古拉病毒和伊科马狂犬病病毒之外所有狂犬病病毒的载体(见第3节),这两种病毒的真正宿主至今未明。此观察结果强烈表明,蝙蝠是狂犬病病毒属的主要宿主。
不同于那些食肉类动物狂犬病宿主,蝙蝠有几个特点,如体积小,寿命长,固有的较低群体增长率和各种界限分明的生态小环境。因此,蝙蝠狂犬病病毒属的特点不同于那些导致食肉动物患狂犬病的病毒。对蝙蝠体内携带狂犬病病毒属所涉及的因素,还知之甚少。对仅被分离出一次的狂犬病病毒属还不甚了解。
表11
蝙蝠狂犬病病毒属的流行病学和生态学
10.2.1 美洲食虫蝙蝠狂犬病
迄今为止,美洲所有的蝙蝠狂犬病病毒属都被归类为一般狂犬病病毒。自从北美消除了犬介导狂犬病以来,大多数本地人感染死亡病例都是由蝙蝠所携狂犬病病毒引起的(23)。狂犬病病毒在基因和抗原性方面的许多不同变异株在大量食虫蝙蝠物种中循环,同一物种中有几个变异株,且变异株的地理分布互相重叠。食虫蝙蝠物种间的跨物种传播和种族发生间距之间似乎存在反向关联(34)。常常发现陆生动物溢出感染。
10.2.2 吸血蝠狂犬病
吸血蝠介导的狂犬病是美洲亚热带和热带地区(从墨西哥到阿根廷)的主要公共健康问题之一。吸血蝠体内存在一种与其他美洲蝙蝠病毒相关的狂犬病病毒变异体,主要由普通吸血蝠的不同亚科携带(Desmodus rotundus)(见表11)(34),并经常传播给家畜和人类。在过去的十年里,南美洲由D. rotundus传播的狂犬病病毒使人类感染率大幅上升,特别是在亚马逊雨林的偏远地区,那里的蝙蝠通常以吸食人血为主(35)。吸血蝠传播的牛狂犬病对畜牧业也有明显的经济影响。
在世界各地狂犬病流行地区对成千上万的野生和人类生态关联啮齿动物进行的测试只揭示了狂犬病病毒感染的终端溢出感染例外情况。这表明啮齿动物不是主要宿主,对狂犬病病毒的传播或携带也不起作用。被啮齿类动物咬伤后无需采用暴露后免疫措施 (见第8.3.2节)。
狂犬病病毒经常由更广泛的主要宿主(如家犬)导致溢出感染,被认为是导致世界上几种高度濒危食肉动物物种灭绝的原因之一。因此,对于高度濒危的贝尔山国家公园的埃塞俄比亚狼(Canis simensis)、非洲东部和南部的非洲野犬(Lycaon pictus)以及以色列的阿富汗狐(Vulpes cana),爆发狂犬病病毒对保护工作构成了威胁。消除犬介导狂犬病将减少狂犬病的威胁和此类濒危种群的灭绝风险。
在北半球任何出现野生动物狂犬病的地方,都有狼群(Canis lupus)狂犬病的记录;然而,狼变得狂躁仅仅是由于溢出感染,并没有在狂犬病传播中发挥主要作用。尽管狼很容易感染并死于狂犬病,它们并不能独立于其他野生动物维持狂犬病病毒的循环之外,原因是狼的种群密度和动态不支持流行病传播,且狼的高度地域特性阻隔了狂犬病在种群间的迅速传播。然而,一旦狼群成员被感染,由于狼的高度社会性以及成员之间的定期接触,狂犬病会导致狼群大量死亡。从狼身上分离出来的狂犬病病毒基因组成与在其附近更广泛的主要食肉动物宿主(家犬或野生物种)中发现的相同。虽然狼不是真正的主要宿主,但是狼和大多数其他食肉动物(如狐狸、郊狼)可以将狂犬病病毒传播给其他易受感染的宿主。因为它们会进行长途迁徙,一般认为携带狂犬病病毒的狼会将野生动物狂犬病重新引入无狂犬病区域。
10.5.1 减少动物数量
基于狂犬病传播依赖密度的原理(发病率随宿主密度成比例增加),过去消除野生动物狂犬病的策略包括通过扑杀降低主要宿主密度。然而,狂犬病在野生动物中的传播可能并不像过去想象的那样依赖密度;因此,降低宿主群体密度不太可能有效地控制或消除狂犬病(36)。导致野生食肉动物数量减少的大规模扑杀运动未能消除狂犬病,可证实这一结论(37)。因此,出于人道、经济和生态原因,不建议将降低主要宿主密度作为控制野生动物狂犬病的手段。
10.5.2 免疫法
大规模接种是比扑杀更有效的控制方法,其降低发病率对于所有野生动物宿主物种都有效。此方法分别出现在欧洲和北美,20世纪70年代末为狐狸研发的口服狂犬病疫苗接种策略已经被应用于在北欧、西欧、中欧、加拿大和美国的大部分地区并消灭狐狸狂犬病。它的成功源于开发了有效和安全的疫苗、对各种物种有吸引力的机器制造的诱饵、自动化且计算机支持的空中诱饵分配、适当的疫苗接种策略和强有力的政治承诺(17)。
对某个野生食肉动物主要宿主物种有效的口服狂犬病疫苗接种策略不一定对其他物种有效。例如,虽然经改良的狐狸口服狂犬病疫苗接种策略已经非常成功地用于其他主要野生动物宿主,如郊狼、灰狐和狸,但用于浣熊时还需经过优化(38)。其他主要野生动物宿主,如猫鼬和臭鼬,也需要采用其他接种策略。
由于口服狂犬病疫苗接种方案旨在消除特定区域的野生动物狂犬病,或者通过建立免疫屏障(遏制、防疫封锁线)来防止疾病传播,它们必须产生足够的群体免疫,以减少主要目标野生宿主的传播(即疾病的有效繁殖率下降至1以下)。所需的群体免疫水平取决于狂犬病在特定目标物种和群体中的传播动态以及当地条件。
在该领域使用的口服狂犬病疫苗接种必须符合世界动物卫生组织和世界卫生组织以及国家或国际监管当局对生物制剂的要求,即免疫原性、功效、安全性和稳定性,并获得许可或注册(见第9.2.3节)。应为各个目标野生动物物种设计诱饵,以确保疫苗被释放到敏感的目标组织(口咽粘膜或扁桃体)上,从而引发免疫反应。诱饵包装应具有三种功能:携带目标物种的引诱剂,含有用于诱饵中的生物标记物(例如四环素),用于评估目标群体对诱饵的吸收,并保护疫苗泡罩、胶囊或小袋免受紫外线照射,以确保病毒滴度的稳定性。相关标准(39)中规定了诱饵包装的具体要求。诱饵必须是耐热的,以保证其适口性和疫苗株滴度的稳定性。在取得市场授权之前,应在不同温度以及现场不同的景观、温度和湿度条件下对其进行测试(39)。通过空气散播的疫苗诱饵落地时不应破裂。警告标签应印在泡罩或诱饵基质上。
若使用经证实有效、稳定且诱饵包装具有吸引力的口服狂犬病疫苗诱饵,目标群体的诱饵摄取和群体免疫取决于其他因素,如食饵引诱法、诱饵的适当空间分布、口服狂犬病疫苗接种活动的时间和频率以及诱饵竞争对手的数量。
10.5.3 规划、实施和评估野生动物口服狂犬病疫苗接种方案
当主要宿主是野生动物时,口服狂犬病疫苗已经成为防止地理扩散以及控制和消除狂犬病的必要工具。根据对目标和非目标物种(野生和家养)狂犬病病例的可靠监测和实验室研究结果,对当前狂犬病形势进行流行病学评估是口服狂犬病疫苗接种方案的基础。规划、实施和评估大规模疫苗接种活动或现场试验的基本要求可从网上获取:https://rabiesblueprint.org/。口服狂犬病疫苗接种项目应包括公共健康的成本效益分析。
规划
强有力的政治承诺是任何口服狂犬病疫苗接种项目确保其法律框架、规划、组织和评估的先决条件,应成立包容各方的全国狂犬病委员会。有效的口服狂犬病疫苗接种方案应基于全面的规划,该规划须概述接种方案的好处、目标、角色(参与机构)、责任和指挥链以及基础设施(实验室要求和设备、冷藏链)、时间框架、估计成本和资金。该规划还应包括关于连续几年覆盖地区的信息,同时考虑到野生动物种群的移动模式、地理特征、邻国的狂犬病情况、疫苗接种策略(时间、诱饵分布模式、诱饵密度、飞行路线距离)、安全注意事项以及对接种活动的监视和监测。应估计目标种群的规模,并在实施该方案之前,确定目标物种中生物标记的基线水平(如适用)。
由于长期、大规模的方法是最有效的,该方案应是长期可持续的,须具备足够的财政、行政和后勤支持。在最后一次确诊狂犬病病例后,口服狂犬病疫苗接种活动应至少持续2年。世界卫生组织可应要求提供必要的专业知识。
实施
应具备足够的基础设施和物流来保证最佳诱饵分配(机场、飞机、诱饵储存设施、人员)和最终广泛的覆盖范围。口服狂犬病疫苗接种活动的时间安排和疫苗诱饵的分布模式应基于目标物种的生理习性和栖息地以及景观特征。在温带气候区(欧洲),口服狂犬病疫苗接种活动通常每年进行两次(春季和秋季),或者在目标物种密度较低的地区(北美)和亚热带气候区(地中海盆地),每年进行一次。诱饵主要通过固定翼机或直升机(38)散播。人工散布应作为空中散播的补充方式,或可在人口稠密或定居地区作为散播诱饵的唯一方式。
在散播疫苗诱饵之前,国家狂犬病委员会应为所有利益相关者(包括猎人、设陷阱捕兽者、野生动物服务局工作人员、森林官员、医生、兽医和地方当局)组织地方会议,详细讨论该方案并商定各方责任。应发布新闻稿,向公众宣传该方案所涵盖的范围、活动时间以及意外接触疫苗时应采取的适当措施。
在现场处理和运送疫苗诱饵时,应严格遵守适当的储存、运输条件和冷链要求。例如,在欧洲,散播疫苗诱饵的最佳模式是相距大约500米的平行飞行路线,不过飞行路线距离可以根据目标物种的种群密度和地貌特征进行调整。在空中散播期间,可使用全球定位系统(GPS)以及飞行路线和诱饵投放坐标的数字记录。
应具备足够的实验室设施和训练有素的人员来进行建议的狂犬病常规诊断标准测试(见第5节),并通过检测生物标志物、血清学、病毒滴定和狂犬病病毒分离株的特征来监测接种活动。质量保证体系应到位。
评估
主管当局和人员应意识到对口服狂犬病疫苗接种活动进行充分监控的重要性。监控包括样本采样、及时报告狂犬病病例、数据库管理、及时进行流行病学数据分析和结果处理,以监测疫苗接种活动的进展。定期向包括主管当局在内的利益相关方传递信息至关重要。应指派专家对人类和动物中占主导地位并不断变化的流行病学状况进行调查,评估接种活动并定期向主管当局报告。应召集所有利益相关方举行全国会议,讨论该方案的进展以及活动未来可能需要对该策略进行的任何调整。
监控和监测疫苗接种的有效性对于评估和调整疫苗接种活动十分重要。狂犬病的发病率是任何口服狂犬病疫苗接种方案的主要效能指标,也是证明消除狂犬病的主要指标。应采用基于风险的采样方案,在该方案中,对生病、疑似患有狂犬病、行为异常、被发现死亡或与人类接触有关的“指标动物”进行检查。动物的数量应足以论证统计上可接受的确定度(40)。通常应在疫苗分发之前、期间和之后,在疫苗接种区以及邻近地区,特别是那些没有发现狂犬病的地区进行监测,以便尽早发现狂犬病传播或再次感染,确保迅速做出反应并采取对策。对从接种区动物中分离出来的狂犬病病毒应进行表征划分。
口服狂犬病疫苗接种方案在诱饵摄取、血清阳性率和狂犬病病毒分离株表征方面的效能是通过对目标物种中被猎杀或捕获的动物进行充分取样来衡量的。例如,在美国,该方案包括对散播诱饵前和散播后的血清学监测以及有针对性的公共健康监测(例如“路毙动物”和“公害”动物报告)。应在疫苗接种区选择用于监测口服狂犬病疫苗接种活动的参考区域,在该区域,可保证具备满足统计所需量、均匀分布的样本,以便测试目标物种中是否存在四环素(用于诱饵中)和血清学标记。
应收集所有动物的基本特征,例如物种、发现和提交日期、位置(经纬度)、年龄、性别、实验室调查结果(荧光抗体或细胞培养分离试验、病毒特征、生物标记检测、血清学),以进行流行病学分析(包括时间和空间模式)。为了消除野生动物中的狂犬病,应建立“渐进控制途径”和零狂犬病状态的国际认证程序。
国际合作
规划、实施和评估口服狂犬病疫苗接种方案的国际合作和协调确保了方案的成功和成本效益。在决定政策时,应与邻国进行联系交流,并应保持联系直到消除狂犬病。与邻近地区和国家的公共卫生和兽医当局的代表定期举行多边会议,确保共同边界活动的协调和透明度。建议世界卫生组织合作中心、世界动物卫生组织参考实验室和其他国际组织进行参与。在国际会议上介绍口服狂犬病疫苗接种方案的成果有助于保持消除狂犬病的意识和承诺。
其他选择
在北美的一些地区,设陷阱捕获野生食肉动物,并在进行胃肠道外疫苗接种(陷阱-接种-释放)后释放它们的策略取得了明显成功,主要用于臭鼬和浣熊(39)。
消除蝙蝠狂犬病面临的挑战是缺乏有效的疫苗来对抗众多的狂犬病病毒属,以及缺乏有效的蝙蝠疫苗接种传送系统。因此,消除蝙蝠狂犬病是不可行的。尽管感染的后果也很严重,蝙蝠狂犬病相关的公共健康风险(除了吸血蝠传播的风险之外)低于食肉动物狂犬病的相关风险。
翼手目生物在全球生态中发挥着重要作用,例如帮助许多珍贵植物传播种子和授粉,从而恢复被砍伐或破坏的雨林,并为支持当地经济的水果生产和多样化动物种群提供保证。此外,1300多种蝙蝠中有许多会消耗大量昆虫,包括一些危害最大的农业害虫。因此,任何滥杀蝙蝠的方法都应该被排除在外(尤其因为大多数国家都保护非吸血蝙蝠)。
公众教育是预防蝙蝠传播人类狂犬病的关键。其中应包括避免与蝙蝠发生潜在传染性接触、在接触蝙蝠后进行适当的医疗护理、以及防止蝙蝠在医院和学校等“敏感”建筑中建立聚居地的基本信息。
可以通过给牛接种疫苗和其他卫生措施(例如对自然和人工吸血蝠窝进行识别、监测和地理定位)来控制吸血蝠传播的牛狂犬病。在许多拉丁美洲国家的国家卫生立法中,控制吸血蝠传播狂犬病的方法是控制主要宿主物种的数量,这在预防牛群狂犬病方面取得了成功。应审查并更新当前的策略,并进行研究以促进吸血蝠控制方面的创新。对于其他可能暴露于狂犬病病毒的情况,建议在人体暴露于吸血蝙蝠的情况下立即进行暴露后免疫。鉴于一些偏远地区的人群高度暴露于吸血蝠狂犬病病毒,应考虑对生活在高度地方性兽疫区、抗狂犬病生物制品资源有限的人群进行预防接种。
一般公众应尽量避免直接接触野生动物,尤其是行为异常和生病的动物。任何被野生动物或家畜咬伤的人,特别是在野生动物狂犬病流行的地区,都应寻求医疗救助(见第8.3节)。在已经宣布没有陆地狂犬病的国家,公众意识到任何可能暴露于蝙蝠狂犬病的人都应得到及时的暴露后免疫措施尤为重要。除了出于保护目的之外,任何野生动物转移都应被禁止或极力劝阻。
1. Weyer J, Szmyd-Potapczuk AV, Blumberg LH, Leman PA, Markotter W, Swanepoel R et al. Epidemiology of human rabies in South Africa, 1983– 2007. Virus Res. 2011;155(1):283–90.
2. Haydon DT, Randall DA, Matthews L, Knobel DL, Tallents LA, Gravenor MB et al. Low-coverage vaccination strategies for the conservation of endangeredspecies.Nature. 2006;443(7112):692.
3. Woodroffe R, Prager KC, Munson L, Conrad PA, Dubovi EJ, Mazet JA. Contact with domestic dogs increases pathogen exposure in endangered African wild dogs (Lycaon pictus). PloS One. 2012;7(1):e30099.
4. Johnson N, Mansfield KL, Marston DA, Wilson C, Goddard T, Selden D et al. A new outbreak of rabies in rare Ethiopian wolves (Canis simensis).ArchVirol. 2010;155(7):1175–7.
5. Zulu GC, Sabeta CT, Nel LH. Molecular epidemiology of rabies: focus on domestic dogs (Canis familiaris) and black-backed jackals (Canis mesomelas) from northern South Africa. Virus Res. 2009;140(1–2):71–8.
6. Sabeta CT, Mansfield KL, McElhinney LM, Fooks AR, Nel LH.Molecular epidemiology of rabies in bat-eared foxes (Otocyon megalotis) in South Africa. Virus Res. 2007;129(1):1–10.
7. Van Zyl N, Markotter W, Nel LH. Evolutionary history of African mongoose rabies. Virus Res. 2010;150(1–2):93–102.
8. Scott TP, Hassel R, Nel LH. Rabies in kudu (Tragelaphus strepsiceros). Berl MünchTierärztl Wochenschr. 2012;125:226–41.
9. Shao XQ, Yan XJ, Luo GL, Zhang HL, Chai XL, Wang FX et al. Genetic evidence for domestic raccoon dog rabies caused by Arctic-like rabies virus in Inner Mongolia, China. Epidemiol Infect. 2011;139(4):629–35.
10. Chang JC, Tsai KJ, Hsu WC, Tu YC, Chuang WC, Chang CY et al. Rabies virus infection in ferret badgers (Melogale moschata subaurantiaca) in Taiwan: a retrospective study. J Wildl Dis. 2015;51(4):923–8.
11. Vos A, Freuling C, Eskiizmirliler S, Ün H, Aylan O, Johnson N et al. Rabies in foxes, Aegean region, Turkey. Emerg Infect Dis. 2009;15(10):1620.
12. Aylan O, El-Sayed AF, Farahtaj F, Janani AR, Lugach O, Tarkhan-Mouravi O et al. Report of the first meeting of the Middle East and Eastern Europe rabies expert bureau, Istanbul, Turkey (June 8–9, 2010). Adv Prev Med. 2011;2011:812515.
13. Horton DL, McElhinney LM, Freuling CM, Marston DA, Banyard AC, Goharrriz H et al. Complex epidemiology of a zoonotic disease in a culturally diverse region: phylogeography of rabies virus in the Middle East. PLoS Negl Trop Dis. 2015;9(3):e0003569.
14. Cliquet FE. Picard-Meyer E, Robardet E. Rabies in Europe: what are the risks? Milton Park: Taylor & Francis; 2014:905–8.
15. Freuling CM, Hampson K, Selhorst T, Schröder R, Meslin FX, Mettenleiter TC et al. The elimination of fox rabies from Europe: determinants of success and lessons for the future. Phil Trans R Soc B. 2013;368(1623):20120142.
16. Bourhy H, Kissi B, Audry L, Smreczak M, Sadkowska-Todys M, Kulonen K et al. Ecology and evolution of rabies virus in Europe. J Gen Virol. 1999;80(10):2545–57.
17. Rupprecht CE, Barrett J, Briggs D, Cliquet F, Fooks AR, Lumlertdacha B et al. Can rabies be eradicated?. Dev Biol (Basel). 2008;131:95–121.
18. Nadin-Davis SA, Sheen M, Wandeler AI. Recent emergence of the Arctic rabies virus lineage. Virus Res. 2012;163(1):352–62.
19. Kuzmin IV, Hughes GJ, Botvinkin AD, Gribencha SG, Rupprecht CE. Arctic and Arctic-like rabies viruses: distribution, phylogeny and evolutionary history.Epidemiol Infect. 2008;136(4):509–19.
20. Gould AR, Kattenbelt JA, Gumley SG, Lunt RA. Characterisation of an Australian bat lyssavirus variant isolated from an insectivorous bat. Virus Res. 2002;89(1):1–28.
21. Vargas-Linares E, Romaní-Romaní F, López-Ingunza R, Arrasco- Alegre J, Yagui-Moscoso M. Rabia en Potos flavus identificados en el departamento de Madre de Dios, Perú [Rabies identified in Potos flavus in the province of Madre de Dios, Peru]. Rev Peru Med Exp Salud Publica. 2014;31(1):88–93.
22. Aréchiga-Ceballos N, Velasco-Villa A, Shi M, Flores-Chávez S, Barrón B, Cuevas-Domínguez E et al. New rabies virus variant found during an epizootic in white-nosed coatis from the Yucatan Peninsula. Epidemiol Infect. 2010;138(11):1586–9.
23. Condori-Condori RE, Streicker DG, Cabezas-Sanchez C, Velasco-Villa
A. Enzootic and epizootic rabies associated with vampire bats, Peru. Emerg Infect Dis. 2013;19(9):1463.
24. De Serres G, Dallaire F, Côte M, Skowronski DM. Bat rabies in the United States and Canada from 1950 through 2007: human cases with and without bat contact. Clin Infect Dis. 2008;46(9):1329–37.
25. Markotter W, Van CE, Kuzmin IV, Rupprecht CE, Paweska JT, Swanepoel R et al. Epidemiology and pathogenicity of African bat lyssaviruses. Dev Biol (Basel). 2008;131:317–25.
26. Kuzmin IV, Mayer AE, Niezgoda M, Markotter W, Agwanda B, Breiman RF et al. Shimoni bat virus, a new representative of the Lyssavirus genus. Virus Res. 2010;149(2):197–210.
27. Schatz J, Fooks AR, McElhinney L, Horton D, Echevarria J, Vázquez‐ Moron S et al. Bat rabies surveillance in Europe. Zoonoses Public Health. 2013;60(1):22–34.
28. Banyard AC, Hayman D, Johnson N, McElhinney L, Fooks AR. Bats and lyssaviruses. Adv Virus Res. 2011;79:239–89.
29. Kuzmin IV, Hughes GJ, Botvinkin AD, Orciari LA, Rupprecht CE. Phylogenetic relationships of Irkut and West Caucasian bat viruses within the Lyssavirus genus and suggested quantitative criteria based on the N gene sequence for lyssavirus genotype definition. Virus Res. 2005;111(1):28–43.
30. Picard-Meyer E, Servat A, Robardet E, Moinet M, Borel C, Cliquet F. Isolation of Bokeloh bat lyssavirus in Myotis nattereri in France. Arch Virol. 2013;158(11):2333–40.
31. Ceballos NA, Morón SV, Berciano JM, Nicolás O, López CA, Juste J et al. Novel lyssavirus in bat, Spain. Emerg Infect Dis. 2013;19(5):793.
32. Kuzmin IV, Orciari LA, Arai YT, Smith JS, Hanlon CA, Kameoka Y et al. Bat lyssaviruses (Aravan and Khujand) from Central Asia: phylogenetic relationships according to N, P and G gene sequences. Virus Res. 2003;97(2):65–79.
33. Gunawardena PS, Marston DA, Ellis RJ, Wise EL, Karawita AC, Breed AC et al. Lyssavirus in Indian flying foxes, Sri Lanka. Emerg Infect Dis. 2016;22(8):1456.
34. Streicker DG, Recuenco S, Valderrama W, Benavides JG, Vargas I, Pacheco V et al. Ecological and anthropogenic drivers of rabies exposure in vampire bats: implications for transmission and control. Proc R Soc B. 2012;279(1742):3384–92).
35. Schneider MC, Romijn PC, Uieda W, Tamayo H, Silva DF, Belotto A et al. Rabies transmitted by vampire bats to humans: an emerging zoonotic disease in Latin America? Rev Panam Salud Publica. 2009;25(3):260–9.
36. Morters MK, Restif O, Hampson K, Cleaveland S, Wood JL, Conlan AJ. Evidence‐based control of canine rabies: a critical review of population density reduction. J Anim Ecol. 2013;82(1):6–14.
37. King AA, Fooks AR, Aubert M, Wandeler AI. Historical perspective of rabies in Europe and the Mediterranean Basin. Paris: World Organisation for Animal Health; 2004.
38. Slate D, Algeo TP, Nelson KM, Chipman RB, Donovan D, Blanton JD et al. Oral rabies vaccination in North America: opportunities, complexities, and challenges. PLoS Negl Trop Dis. 2009;3(12):e549.
39. Scientific Panel on Animal Health and Welfare (AHAW). Update on oral vaccination of foxes and raccoon dogs against rabies. EFSA J. 2015;13(7):4164.Doi:10.2903/j.efsa.2015.4164.
40. Cliquet F, Freuling C, Smreczak M, Van der Poel WH, Horton D, Fooks AR et al. Development of harmonised schemes for monitoring and reporting of rabies in animals in the European Union. Scientific report submitted to EFSA. Parma: European Food Safety Authority; 2010 (https://www.efsa.europa.eu/en/supporting/pub/67e).
有效控制和消除疾病需要有效的监测。公共健康监测包括持续、系统地收集、分析、处理并传播卫生事件的相关信息(1、2)。其目的可能是证明疾病在人类和动物中的存在和分布,作为疾病控制、提高对疾病情况的认识、或最终记录疾病消除的一部分(3)。根据这一定义,监测总是与具体的控制活动和即时反应联系在一起,因此不同于监控。监控是间歇进行的,包括对监测系统或干预中常规过程的分析。在狂犬病控制中,监控可能包括动物种群和疫苗接种覆盖率的横断面测量,以及口服疫苗接种活动后的大规模非肠道疫苗接种或诱饵摄取过程中对犬的标记进行观察(4)。不系统的监控可能包括某些活动中动物种群和疫苗接种覆盖率的横断面测量。第10节详细介绍了口服狂犬病疫苗接种方案中的监控和野生动物的强化监测。检测、评估、通报和报告卫生事件的能力是《国际卫生条例》(2005)(5)的重要组成部分,也是高质量兽医机构的原则。
监测系统的设计和实施应根据规定的公共卫生目标或干预措施进行定制(6、7)。狂犬病的相关干预措施应适应该疾病的流行病学和研究领域的能力。在地方性流行阶段,如未进行系统的狂犬病控制,主要目标应是在时空上和风险群体中确定人类和动物的疾病负担。实际上,这一阶段的监测可能是被动的,因为基于疾病的高发率,即使评估较少的人或动物,病例也很可能被发现。除了对人体感染的相关动物进行诊断试验之外,在资源或后勤可能不足以进行验证试验(9)时,第5节中和世界动物卫生组织《陆生动物诊断试验和疫苗手册》(8)第2.1.17章中描述的试验可以用来补充“金标准”诊断,如直接荧光抗体和直接快速免疫组织化学检测,以提高病例检出率。随着狂犬病控制方案在某地区的确立,监测目标应进行调整。除了持续的被动公共健康监测之外,有针对性的主动监测对于核实动物疫苗接种和其他干预措施也是必要的。随着控制范围的扩大,采用更加敏感的金标准诊断试验,确保试验人员的熟练程度变得越来越重要。监测数据的质量与其用于通告干预措施管理决策直接相关。随着控制活动将人类狂犬病病例数量减少到零(验证),并最终消除目标动物狂犬病(验证),如第12节所述,需要进行额外的监测。
不管狂犬病控制状况如何,在监测期间检测出狂犬病病毒抗原的概率取决于其发病率、认识和警惕程度,以及为确认狂犬病进行样本收集和运输所需的适当基础设施和物流。为了提高狂犬病认识和警惕程度,并确保狂犬病被确认为优先事项,人类和动物狂犬病必须在全国范围内进行通报。国家卫生和兽医部门应广泛宣传标准病例定义(表12和13)。应根据公布的协议,通过适当的渠道报告监测数据,以促进及时的数据共享和分析(如果可以的话尽可能通过现有的国家传染病报告电子监测或健康管理信息系统)。
表12
动物病例定义和相应的监测活动
| 病例 | 定义 | 监测活动 |
| 疑似 | 符合动物狂犬病临床定义的病例
临床病例定义:具有下列任何一种迹象(10、14)的动物 ■ 唾液分泌过多, ■ 瘫痪, ■ 嗜睡, ■ 无端的异常攻击(对两人或两人以上、动物和/或无生命的物体发起撕咬) ■ 异常发声以及 ■ 夜间活动物种开始日间活动 |
将疑似患有狂犬病的动物通知相关地方当局。
如有的话,收集动物的历史档案(所有权状况、疫苗接种状况、先前暴露情况、症状出现日期) (见附录2)。收集中枢神经系统样本进行实验室诊断(如有的话)。 |
| 可能 | 疑似病例,且与疑似、可能或确认患有狂犬病的动物和/或
疑似患有狂犬病、在观察到狂犬病后的4 – 5天内被杀死、死亡或消失的动物有过可靠接触史 |
系统记录次要信息,并链接到历史档案。根据国家协议通知有关当局。 |
| 已确认 | 实验室a确认的疑似或可能的动物病例 | 通知有关当局,以跟进任何人类或动物暴露情况。
系统记录实验室诊断,并链接到病例记录。 |
| 非病例 | 排除在外的可疑或可能病例
通过实验室测试或流行病学调查(即合格动物的适当检疫期)。 |
通知有关当局,以跟进任何人类或动物暴露情况。
系统记录实验室诊断,并链接到历史档案。 |
a 实验室确诊应通过世界卫生组织(见第5节)或世界动物卫生组织手册(8)定义的标准诊断测试进行。如使用其他诊断测试,根据其敏感性和特异性,可能需要通过二次试验进行确认,尤其是在阴性结果的情况下。
表13
人类病例定义和相应的监测活动
| 病例 | 定义 | 监测活动 |
| 疑似 | 符合临床病例定义的病例:表现为急性神经系统综合征(即脑炎)的患者,主要表现为功能亢进(狂躁型狂犬病)或麻痹综合征(麻痹型狂犬病),最终常由于心脏或呼吸衰竭导致昏迷和死亡(若没有实施重症护理,通常在第一次症状出现后7 – 10天内发生)。该综合症可能包括以下任何症状:恐风症、恐水症、感觉异常或局部疼痛、吞咽困难、局部虚弱、恶心或呕吐。 | 根据国家协议通知有关地方当局。
根据国家协议从患者身上收集适当的样本。进行口头尸检,收集患者的病历,以便进一步表征(附录11)。 |
| 可能 | 疑似病例,同时具有与疑似、可能或确认的狂犬病动物接触的可靠病史(见表12); | 确定相关患者和/或动物的接触人,以便后续跟进。 |
| 已确认 | 实验室确认为狂犬病的疑似或极可能病例。a | 系统记录实验室诊断并链接到口头尸检信息。
根据国家协议,将确认的人类狂犬病病例通知相关当局。 |
a 人类狂犬病的尸检诊断取决于收集的样本和可用的诊断测试(见第5节)。
狂犬病监测提供的最低流行病学指标是人类和动物年发病率以及暴露后预防发生率的相关信息(作为疑似和确认暴露于狂犬病的指标)(表14)。发病率的测量对于狂犬病预防和控制中确保对于病例和暴发进行适当管理,监测发展趋势以评估干预措施的有效性,以及估计疾病负担是必不可少的。常规狂犬病监测中不建议进行狂犬病特异性抗体检测。
表14
监控人类狂犬病暴露后预防措施的使用情况
| 暴露或暴露后预防类别 | 监测活动 | |
| 疑似暴露 | 有被疑似、可能或确认患有狂犬病的动物咬伤、抓伤或接触传染性物质病史的求诊人(见表12)。 | 根据国家协议评估风险(见第8节),以确定是否需要进行额外调查。 |
| 已进行暴露后预防 | 已推荐疑似暴露人员进行暴露后预防。且该人员已接种了至少一剂狂犬病疫苗和/或狂犬病免疫球蛋白。 | 根据国家标准协议通知有关当局。如协议所示,对暴露进行调查,以确定疑似狂犬病动物以及其他人或动物是否暴露。
系统地记录调查中的信息。 系统记录接受暴露后预防患者的信息,包括基本人口统计数据和注射生物制剂的日期,直到完成或后续随访中断。 |
| 未接受暴露后预防 | 被建议进行暴露后预防的疑似暴露人员,以及
未接种狂犬病疫苗或狂犬病免疫球蛋白的人员 |
需要时,启动可疑暴露调查,以记录未启动暴露后预防的原因,并识别疑似狂犬病动物和进一步暴露。
根据国家标准协议通知有关当局。 |
最佳监测将针对所有人类和动物疑似狂犬病病例。病例定义应有助于系统地识别疑似病例,并根据临床、流行病学和诊断特征对病例进行进一步分类。监测协议应规定各病例分类所需的活动(例如,识别疑似病例,通知地方卫生当局,开始收集原始数据)。应向报告结构中的相关人员和官员分发监测和病例管理协议。诊断确认是人类和动物病例的金标准,尽管临床病例也可以通过人类病例的口头尸检(附录11)和根据病例定义(表12)与调查表格(附录12)对犬只进行评估来确认。
对未报告人类暴露的健康动物进行积极监测很少会返回有价值的监测数据,因为必须测试大量动物才能识别一起狂犬病病例。当被动监测数据中聚集大量对照组动物时,在风险较高的动物中观察到病例的比例(例如涉及人类暴露的病例,“路毙动物”)可能会被削弱,这表明若观察方式不正确,监测出暴露于狂犬病的总体风险会变低。动物健康专家(如私人和公共兽医、兽医专业人员助理、动物检疫员和狩猎监督官)最有可能在专业环境中发现患有临床狂犬病的动物。他们也最有可能在社区层面(最先发现病例的地方)从事动物狂犬病监测。他们应该清楚疑似病例的临床症状、样本收集方法和报告流程。
当某人被疑似患有狂犬病的动物咬伤时,所有程序通常会交叉进行。“综合咬伤病例管理”包括对疑似患有狂犬病的动物进行调查,并与动物和人类健康调查人员分享信息以进行适当的风险评估(第8节)。此类方案为资源密集型,但最终有助于通过积极识别疑似暴露(特别是在犬介导的狂犬病流行地区)来预防狂犬病导致的人类死亡,并能提高监测的整体质量(10、12)。咬伤发生后应立即进行验伤分类,包括确定咬人动物的疫苗接种状况,如怀疑有狂犬病,需后续跟进,比如观察动物(猫和犬10天)或者进行尸检。此外,现场医疗和兽医工作人员的及时反应可确保病例的适当管理和后续跟进,并提高了病例检出率;还可以激励现场和医院工作人员继续报告病例。反应包括对报告和诊断试验结果的及时反馈,对病例管理的建议以及将要采取的狂犬病控制措施。在已经确立狂犬病控制方案的国家,综合咬伤病例管理可以确保在风险评估和诊断输入的基础上更有针对性地使用暴露后预防,从而减少对低风险暴露的暴露后预防管理。
除了例行报告外,对流行病学监测数据的分析还可以估计狂犬病趋势和空间动态;了解物种(包括人类)的趋势是任何干预计划的基础。此类分析应定期进行(例如每月一次),并至少每年提交更详细的报告。应根据调查和病例的数量来估计基本趋势(人类暴露后预防、狂犬病患者和狂犬病动物,参见表12-14)。应绘制监测数据地图,以确定病例的分布情况。在可能的情况下,应将监测系统的病例和非病例报告都绘入地图,以确定监测覆盖范围中可能导致缺乏观察病例的任何缺口。更详细的报告应包括控制活动及其对狂犬病疾病负担的影响。
还应定期监控并评估监测系统,以确定监测目标是否正在实现,并改进整个系统(1,5)。例行监测可包括评估每月报告的及时性和完整性。当发现不足之处时,应采取行动,以确保能够及时准确地分析年度报告结果。应定期对监测系统进行更广泛的评估(例如每隔几年或目标发生变化时),以确保其有效运行,并可为公共卫生干预提供有用的高质量数据。公共健康监测系统评估指南已经出版(1)。
在所有情况下,特别是在以消除病毒为目标的地区,鼓励对人类和动物病例中的病毒分离株进行常规表征,以确定感染来源及其地理来源(13)。即使在消除狂犬病后,也应继续对人和动物进行监测,并利用病毒表征来记录狂犬病的传入或未被识别的狂犬病在国内的传播(3)。
通过世界动物卫生信息系统(www.oie.int/wahid)及时向世界动物卫生组织通报动物狂犬病病例是世界动物卫生组织成员的法律义务(3)。为保证透明度并便于比较和汇总全球数据以进行宣传,国家数据应与其他区域和全球报告系统共享,例如世界卫生组织全球卫生观察站(http://www.who.int/gho/neglected_diseases/rabies/en/)、世界卫生组织地区卫生信息软件系统(第2版;DHIS2)和其他区域数据库,如欧洲狂犬病通报(http://www.who-rabies-bulletin.org/);狂犬病流行病学监测区域信息系统(SIRVERA; sirvera.panaftosa.org.br/index.php)和拉丁美洲狂犬病流行病学信息系统(SIEPI);以及非洲的泛非狂犬病控制网络(PARACON)狂犬病流行病学通报(paracon.rabiesalliance.org/bulletin/)。
已为记录指标最低数据准备了一个模板(附录13)。可以通过下载在线完成,网址是: http://www.who.int/ rabies/advancing_global_rabies_data_collection/en/。它是被忽视热带疾病监测和控制综合平台(基于DHIS2)的一部分,可帮助将针对特定疾病的监测活动纳入更有效、可持续的健康信息系统。被忽视的热带疾病和世界卫生组织其他部门的许多方案,包括结核病、艾滋病毒/艾滋病、疟疾、健康信息系统以及信息管理和技术方案,可共同建设并支持一体化。在全球范围,该系统将充当高质量数据的数据库,并允许在单个地点识别及分析趋势并监测和评价所有方案。该平台还将有助于确认或验证消除目标(见第12节)。公众可获得的数据将继续通过全球卫生观察站显示。在可能的情况下,这些全球和区域报告系统的运营者应合作改善系统之间的互操作性,以减少国家主管部门的冗余数据请求和条目。
1. German RR, Lee LM, Horan J, Milstein R, Pertowski C, Waller M. Updated guidelines for evaluating public health surveillance systems. MMWR Recomm Rep. 2001;50 (1–35).
2. Kasolo F, Yoti Z, Bakyaita N, Gaturuku P, Katz R, Fischer JE et al. IDSR as a platform for implementing IHR in African countries. Biosecur Bioterror. 2013;11(3):163–9.
3. Section 1. Animal disease diagnosis, surveillance and notification. In: Terrestrial Animal Health Code. Paris: World Organisation for Animal Health; 2016.
4. Cliquet F, Freuling C, Smreczak M, Van der Poel WH, Horton D, Fooks AR et al. Development of harmonised schemes for monitoring and reporting of rabies in animals in the European Union. Scientific report submitted to EFSA. Parma: European Food Safety Authority; 2010 (https://www.efsa.europa.eu/en/supporting/pub/67e).
5. InternationalHealthRegulations(2005).Geneva:World Health Organization; 2005 (http://apps.who.int/iris/bitstre am/10665/246107/1/9789241580496-eng.pdf?ua=1).
6. Technical guidelines for integrated disease surveillance and response in the African Region. Second edition. Brazzaville: WHO Regional Office for Africa; 2010 (http://www.afro.who.int/publications/technical- guidelines-integrated-disease-surveillance-and-response-african- region-0).
7. Thulke HH, Eisinger D, Freuling C, Fröhlich A, Globig A, Grimm V et al. Situation-based surveillance: adapting investigations to actual epidemic situations. J Wildl Dis. 2009;45(4):1089–103.
8. Chapter 2.1.17: Rabies (infection with rabies virus). In: Manual of diagnostic tests and vaccines for terrestrial animals, Vol. 2. Paris: World Organisation for Animal Health; 2016.
9. Duong V, Tarantola A, Ong S, Mey C, Choeung R, Ly S et al. Laboratory diagnostics in dog-mediated rabies: an overview of performance and a proposed strategy for various settings. Int J Infect Dis. 2016;46:107–14.
10. Undurraga EA, Meltzer MI, Tran CH, Atkins CY, Etheart MD, Millien MF et al. Cost–effectiveness evaluation of a novel integrated bite case management program for the control of human rabies, Haiti 2014–2015. Am J Trop Med Hyg. 2017;96(6):1307–17.
11. Rabies (infection with rabies virus). Chapter 2.1.17.Manual of diagnostic tests and vaccines for terrestrial animals.Vol. 2. Paris: World Organisation for Animal Health; 2017.
12. Wallace RM, Reses H, Franka R, Dilius P, Fenelon N, Orciari L et al. Establishment of a canine rabies burden in Haiti through the implementation of a novel surveillance program. PLoS Negl Trop Dis. 2015;9(11):e0004245.
13. Mollentze N, Weyer J, Markotter W, Le Roux K, Nel LH. Dog rabies in southern Africa: regional surveillance and phylogeographical analyses are an important component of control and elimination strategies. Virus Genes.2013;47(3):569–73.
14. Tepsumethanon V, Wilde H, Meslin FX. Six criteria for rabies diagnosis in living dogs.J Med Assoc Thai. 2005 Mar 1;88(3):419–22.
为实现到2030年,犬介导的狂犬病死亡率为零的目标,需在全球范围内采取协调一致的程序以确认并衡量各国在实现这一目标方面取得的进展(1)。此类程序必须考虑到不同的进展状态,即一些国家尚未达到人类狂犬病零死亡率(见下文的验证),而另一些国家已经或即将阻断狂犬病的传播。
图5以国家数据为基础,显示了消除狂犬病(就犬类和人类狂犬病病例而言)的五个连续阶段:从地方性流行到消除,再到保持无病状态。“地方性流行”指的是在一个地方病流行而控制措施有限的国家每月确诊狂犬病病例的数量。“控制”指大规模干预后狂犬病发病率急剧下降。“零死亡”表示犬-人类狂犬病传播被阻断,无人死亡。“消除”表示狂犬病传播被阻断,且无犬类病例。“维持”是指继续保持无病状态,例如通过防止犬类或人类狂犬病侵入和/或再次出现。
图5
通过实施持续的大规模犬只疫苗接种计划,各国地方性狂犬病逐渐得到控制,直至消除犬介导的狂犬病
本节的目的是定义各国为达到以下目标所进行的活动:
■ 确认消除狂犬病是一项公共健康问题,即达到人类狂犬病零死亡,定义为在正在进行并继续维持狂犬病全面监测、并证明在人类和动物群体中具备有效狂犬病控制方案的国家,至少24个月没有人死于犬介导的狂犬病。除了犬类狂犬病以外,由狂犬病病毒变异株引起的病例不应妨碍人类狂犬病零死亡或狂犬病传播阻断的确认。世界卫生组织将在书面证据审查中对达到人类狂犬病零死亡进行验证(见第12.3节和附录14)。
■ 根据国际标准,在具有高品质监测的情况下,对消除犬介导的狂犬病即阻断狂犬病传播的验证,定义为至少24个月内没有出现犬介导的狂犬病病例。相关国际组织正在讨论验证狂犬病传播阻断的拟议程序(见第12.4节和附录14)。
■ 经验证后被确认宣布为无狂犬病状态,并确认无犬类狂犬病和陆地狂犬病的国家或地区。此类定义旨在帮助公共卫生部门评估与狂犬病患者接触后感染狂犬病的风险。出于动物迁移方面的考虑,它们不同于目前世界动物卫生组织对无狂犬病国家的定义(2)。
一个无犬类狂犬病的国家或地区是指:
■ 在过去的24个月内,确认未出现人、犬、猫或任何其他物种因犬介导的狂犬病病毒引起的本地获得性感染病例。
■ 分子特征和流行病学调查显示,任何本地阳性病例都是野生动物的溢出感染。若确认了食肉动物的输入病例后,分子特征确认了病毒的非本土来源,并且流行病学前后追踪没有发现犬类继发感染的证据,那么该国或地区的状况不会受到影响。
一个无陆地狂犬病的国家或地区是指:
■ 在过去24个月内,确认未出现人类或任何家养或野生动物物种(不包括蝙蝠)因犬介导的狂犬病病毒或野生食肉动物狂犬病病毒引起的本土获得性感染病例。
■ 分子特征和流行病学调查显示,任何本地阳性病例都是蝙蝠(蝙蝠狂犬病变异株和蝙蝠丽沙病毒属)的溢出感染。
若确认了输入病例后,风险评估和/或分子特征确认了病毒的非本土来源,并且流行病学前后追踪没有发现任何野生动物或家养食肉动物继发感染的证据,那么该国或地区的状况不会受到影响。实验室确认的一些野生动物(如猫鼬)感染应被视为狂犬病存在和传播的证明。
确认无狂犬病状态的措施必须以可独立评估的可靠证据和数据为基础,若过早中止控制可能导致狂犬病死灰复燃,对公共健康、经济和政治产生重大影响。无狂犬病状态验证和核实的核心要求如下。
■ 所有动物物种和人类狂犬病都应进行通报。
■ 进行持续有效的监测,并符合世界卫生组织和世界动物卫生组织关于监测和诊断测试的标准(见第5节和第11节)。
■ 对全国主要易感家畜和野生动物物种进行充分、有针对性的取样。
■ 国家狂犬病控制战略(大规模犬只接种和人类暴露后预防)在控制狂犬病方面非常有效。
■ 制定了防止狂犬病感染动物入境的措施(见第9.3节)。
第12.2节和第12.3节分别包含更详细的验证和核实拟议流程摘要。
数据收集的区域平台确保了各区域之间的一致性以及验证和核实的充分性,例如欧洲狂犬病通报、泛非狂犬病控制网络(PARACON)狂犬病流行病学通报、狂犬病流行病学公告和拉丁美洲狂犬病流行病学监测区域信息系统。需要通过国际动物健康信息系统及时通报世界动物卫生组织,并酌情通报区域数据收集平台。此类平台应支持提交用于验证和核实的基本指标数据,并应提供包含其他国家和地区信息的重要档案库。
狂犬病流行地区所有国家的目标是实现人类狂犬病零死亡,并最终阻断犬介导狂犬病的全国及地区性传播。如同脊髓灰质炎模型一样,可举行年度区域会议,审查国家方案协调员或世界动物卫生组织相关代表在两年后提交的无狂犬病状态文件(在强化监测下未发现任何病例),从而进行对狂犬病传播阻断的区域性核查。
指标:24个月内无人死于狂犬病
若某国要取得国际公认已经消除了狂犬病这一公共健康问题(24个月内无人类感染死亡),在该国人类和动物狂犬病必须得到通报,且必须提供以下证据:
■ 有效的国家狂犬病控制和消除战略;
■ 由于实施了国家狂犬病控制和消除战略,犬狂犬病病例数量减少;
■ 由于实施了国家狂犬病控制和消除战略,狂犬病导致的死亡人数减少。
若某国已经证实阻断了犬介导的狂犬病传播(见下文),那么它也将被视为已经消除了狂犬病这一公共健康问题。
附录14提供了一份验证是否达到人类狂犬病零死亡的拟议文件草案模板。
以下为证实狂犬病传播阻断的一种方法;不过核查要求仍在讨论中。
指标:24个月未出现犬介导的狂犬病病例
若某国要取得国际公认已经消除了犬介导的狂犬病,在该国人类和动物狂犬病必须得到通报,该国应能够记录至少24个月内未出现犬介导的狂犬病病例(即未出现由于犬类狂犬病病毒变异株导致的动物病例),并提供以下情况的证据:
■ 消除后战略或应急计划,包括提供犬类疫苗和暴露后预防,对其他国家或地区引入狂犬病的监测和流行病学调查程序;
■ 由于实施了国家狂犬病消除战略,犬介导的动物狂犬病病例数量减少到零;
■ 维持犬介导的人类狂犬病病例数量为零。
根据世界动物卫生组织程序(3),鉴于核查需要一定时间,建议各国首先单方面宣布消除了犬介导的狂犬病。随后世界动物卫生组织自行宣告所需的文件将得到审查,以核实狂犬病传播已经被阻断。附录14显示了核实狂犬病传播阻断所需的拟议档案模板。
1. Abela-Ridder B, Knopf L, Martin S, Taylor L, Torres G, De BaloghK. 2016: the beginning of the end of rabies? Lancet Global Health. 2016;4(11):e780–1.
2. Terrestrial animal health code. Paris: World Organisation for Animal Health;2011 (https://www.oie.int/doc/ged/D10905.PDF).
3. Chapter 1.6. Procedures for self declaration and for official recognition by the OIE. In: Terrestrial Animal Health Code. Paris: World Organisation for Animal Health; 2011 (http://www.oie.int/index. php?id=169&L=0&htmfile=chapitre_selfdeclaration.htm).
自2011年狂犬病被确定为三方(世界卫生组织、联合国粮农组织和世界动物卫生组织)优先事项以来,该疾病已成为人类和动物卫生部门之间协调一致的“健康一体”方法的典型案例(1、2)。2017年,更新版三方概念文件(3)发布,重申了这一承诺。2015年,世界卫生组织、世界动物卫生组织携联合国粮食和农业组织及全球防治狂犬病联盟(GARC)于日内瓦召开全球狂犬病会议,聚集了涉及兽医和人类健康的合作伙伴和利益相关方、政府及私营企业(4),并发布了《消除犬介导的人类狂犬病的全球框架》;该框架概述了为实现到2030年全球人类狂犬病零死亡共同目标的承诺和行动(5)。许多合作伙伴为预防、控制和消除人类狂犬病和动物狂犬病做出了全球性、地区性以及国家级的贡献,其中包括东南亚国家联盟(ASEAN)、南亚区域合作联盟、国际人道协会、抗击狂犬病组织、兽医无国界组织、世界动物保护协会和比尔及梅琳达•盖茨基金会。帮助了全球标准和政策的制定、资源调动、区域协调并给予国家计划直接支持。
13.1.1 世界卫生组织总部
世界卫生组织制定全球规范和标准,与合作伙伴和利益相关方密切合作,并支持各国控制和消除狂犬病。自2002年以来,世界卫生组织一直运营着提供人类狂犬病和动物狂犬病相关信息、宣传材料以及世界卫生组织精选报告和同行审评文章的网站(http://www.who.int/rabies/en/)。
世界卫生组织推动着全球人类狂犬病病例的数据收集,目前与世界动物卫生组织合作,协调国家、地区性和全球性动物报告系统(通过世界动物卫生信息系统)和人类狂犬病报告系统(通过世界卫生组织)。利用此类数据绘制了全球狂犬病分布图(6),发布地址包括全球卫生观察站(http://www.who.int/gho/neglected_diseases/rabies/en/),利益相关者和各部门间可共同使用。
2009年至2015年间,世界卫生组织在夸祖鲁-纳塔尔、坦桑尼亚东南部和菲律宾米沙鄢群岛开展了由比尔及梅琳达•盖茨基金会资助的狂犬病消除试点项目(7)。这些项目在减少犬类和人类狂犬病病例方面大获成功,证明了在不同的国家消除狂犬病的想法是可行的。而从中吸取的经验教训也体现在了促进狂犬病控制的国际倡议中(8)。
自全球框架启动以来,世界卫生组织与合作伙伴一直保持合作,制定一项全球战略计划,旨在到2030年实现犬介导的狂犬病患者零死亡。计划要求以国家为主,辅以国际伙伴(世界卫生组织、粮农组织、世界动物卫生组织和全球防治狂犬病联盟),共同支持、增强和促进国家实体控制消除狂犬病。
2017年,世界卫生组织修订了其《关于狂犬病疫苗和狂犬病免疫球蛋白的立场》,该立场得到了免疫接种咨询专家组的认可。更新后的文件提供了更可行的项目建议,以获得负担得起的狂犬病生物制品,特别针对服务匮乏的地区。疫苗和狂犬病免疫球蛋白的使用指南以及暴露后预防和暴露前预防方案也已更新。据估计,若采用更新后的皮内暴露后预防方案,每1000瓶狂犬病疫苗可额外治疗近500名患者,比传统肌肉内预防方案(如Essen方案)治疗的数量有所增加。
世界卫生组织正在为将人类狂犬病疫苗纳入2018年全球疫苗免疫联盟(Gavi,疫苗联盟)疫苗投资策略建立证据基础。如果成功纳入其中,意味着低收入和中等收入的疫苗联盟合格国家可获得人类狂犬病疫苗接种的补贴。2013年,疫苗联盟投资评估了非洲和亚洲低收入地区改善狂犬病暴露后预防的操作可行性、公共卫生影响和成本。根据在20多个国家进行的对暴露后预防分布和输送系统特征的研究,可预测狂犬病疫苗需求以及使用方式。这些研究按国家和城乡分类确定了暴露后预防和狂犬病免疫球蛋白的可用性、可获得性和使用成本,指出了以下分类原因和风险因素:
■ 一些国家的暴露后预防可用性及供应有限;
■ 狂犬病病例漏报;
■ 缺乏对暴露后预防使用的定期监控;
■ 患者没有进行或没有完成暴露后预防。
由于中央对狂犬病生物制品的预算拨款少、治疗中心对暴露后预防的使用效率低和/或缺乏对疫苗需求的准确预测,经常出现缺货。这些项目还推动了各国家其他活动的开展,如国家狂犬病策略或指导方针的更新以及狂犬病报告和监测系统的改进。
13.1.2 世界卫生组织地区办公室
东南亚
世界卫生组织东南亚地区办公室积极制定标准和准则,发布推荐规范,并为成员国进行预防和控制该区域人类狂犬病和动物狂犬病提供技术支持。提倡使用成本效率皮内接种来提高现代狂犬病疫苗的可用性和可负担性,并逐步淘汰神经组织疫苗的生产和使用。孟加拉国、柬埔寨、印度、老挝人民民主共和国、缅甸、尼泊尔、巴基斯坦和越南已不采用神经组织疫苗。在孟加拉国、印度和斯里兰卡,医学和兽医实验室专业人员接受了实践培训,学习诊断狂犬病的直接快速免疫组化试验和直接荧光抗体试验。
东盟的地区性消除战略目标是通过逐步控制狂犬病流行国家的犬狂犬病、预防人类狂犬病、保持无狂犬病地区的状态,到2020年消除该地区的人类狂犬病(9、10)。世界卫生组织目前与东盟秘书处、成员国、粮农组织和世界动物卫生组织合作,为该战略的制定和实施提供技术支持。
世界卫生组织东南亚地区办公室还与南亚区域合作联盟秘书处及成员国合作,共同倡导南亚区域狂犬病协调控制活动。2015年在斯里兰卡科伦坡举行的一次关于预防和控制该地区狂犬病的研讨会建议加强狂犬病监测、提升实验室网络、推动犬只疫苗接种活动和人性化犬群管理(11)。
美洲
1983年,泛美卫生组织(PAHO)兽医公共卫生部/世界卫生组织美洲地区办公室启动了在美洲消除犬介导的人类狂犬病的官方计划。最初的目标是消除拉丁美洲主要城市的狂犬病。1992年,对该目标进行了扩大,包括了对小企业集团和农村地区犬介导的人类狂犬病的消除。自该计划启动以来,美洲的人类狂犬病和犬类狂犬病病例减少了90%以上。
该计划将监测列为优先事项,增加了获得人类狂犬病预防、大规模犬只疫苗接种和有效治疗的渠道。美洲狂犬病流行病学监测区域信息系统(http://sirvera.panaftosa.org.br/)根据成员国卫生部和农业部输入的官方数据发布关于人类狂犬病和动物狂犬病的报告。可在线咨询1970年之后的数据。泛美卫生组织成员国可使用泛美卫生组织循环基金购买高质量、挽救生命的人类狂犬病疫苗和免疫球蛋白用于预防。2015年,犬类狂犬病疫苗的购买成本纳入国家狂犬病计划循环基金,用于犬类大规模接种活动。
每2年在美洲召开一次的预防和控制狂犬病国家计划负责人会议(REDIPRA),讨论狂犬病的流行现状,并更新预防控制狂犬病策略。泛美卫生组织兽医公共卫生部组织的美洲各国间卫生和农业高级别部长级会议上,预防和控制狂犬病国家计划负责人会议中得出的结论和建议被提交给卫生和农业部长审议和批准。2016年,泛美卫生组织第五十九届指导委员会通过了CD55.R9号决议,其中包括《2016-2022年消除被忽视传染病的行动和消除后行动计划》,并促进在2022年或更早消除美洲其余地区犬介导的人类狂犬病(12)。
13.1.3 世界卫生组织狂犬病合作中心网络
世界卫生组织狂犬病合作中心网络支持世界卫生组织在国家、国家间、地区、地区间和全球各级的活动(http://apps.who.int/whocc/List.aspx?tor=rabies&)。合作中心通过为狂犬病相关活动提供信息、服务、研究和培训增强了成员国的机构职能,包括诊断、监督、研究、监测和评估人类狂犬病和动物狂犬病消除计划。
世界卫生组织根据共同商定的工作计划正式指定了合作中心,通常为期4年,在世界卫生组织对其业绩进行年度评估后,可以延期。工作计划取决于合作中心的专业性或特殊性,但通常包括:
■ 收集、整理和宣传狂犬病信息;
■ 狂犬病诊断试剂和预防及治疗物质的标准化及其应用方法和程序;
■ 相关技术的设计和应用;
■ 提供对照品和其他服务;
■ 在组织领导下参与协作研究;
■ 培训,包括研究培训;
■ 协调若干机构开展的活动。
世界卫生组织指定14个对照研究狂犬病的合作中心,其中亚洲有四个,欧洲有五个,美洲有五个(附录15)。
参与狂犬病活动的三个主要国际组织(世界卫生组织、粮农组织和世界动物卫生组织)和全球防治狂犬病联盟以及非政府组织、动物福利组织和其他公共和私人利益相关方共同减轻狂犬病的全球负担。
13.2.1 全球活动
联合国粮食及农业组织(FAO)
粮农组织在提高对控制动物狂犬病的认识水平、为动物狂犬病控制提供政策建议和技术支持,为控制狂犬病做出贡献。支持在塞拉利昂学校建立动物健康俱乐部,并特别关注狂犬病对畜牧生产的影响(13)。为逐步消除狂犬病,粮农组织在非洲、高加索和亚洲组织全球利益相关方进行预防狂犬病的磋商,协助各国确定其狂犬病控制需求(14)。
从国家层面,粮农组织派出了紧急管理中心——动物健康代表团,以控制巴厘岛、印度尼西亚和越南爆发的狂犬病。由此,巴厘岛建立了综合咬伤病例管理,改善了人类和动物卫生部门之间的沟通,并加强了团队培训,确保成功捕获难以处理的流浪犬并为其接种疫苗(15)。粮农组织通过意大利威尼斯实验动物预防研究所(粮农组织狂犬病参考中心)和西非狂犬病实验室网络(RESOLAB)以及在非洲南部实验室进行能力验证,提高了诊断能力。
粮农组织还参与了犬只数量管理,在刚果共和国狂犬病爆发后携同世界动物保护协会进行了关于捕捉、处理和疫苗接种的培训(16)。2013年,狂犬病被列为粮农组织《跨界动物疫病全球渐进控制框架》的优先事项(17)。
世界动物卫生组织(OIE)
世界动物卫生组织为政府间组织,发布科学标准、指导方针和规范,以改善动物健康和福利,同时在全世界推广强有力的兽医服务。
国际间商定的动物狂犬病疫苗和其他生物产品生产和控制的诊断实验室方法和要求发布于世界动物卫生组织《陆生动物诊断试验和疫苗手册》(18)。世界动物卫生组织《陆生动物诊断试验和疫苗手册》(19)列出了国际上为控制动物狂犬病和控制流浪犬数量而采取的措施,包括推动负责任养犬。
世界动物健康信息系统(www.oie.int/wahid)为全球在线网络通知系统,支持世界动物卫生组织成员国报告动物狂犬病信息。“兽医机构效能”、实验室偶合计划以及参考实验室和合作中心网络为动物狂犬病的诊断、控制和消除提供政策咨询、策略设计和技术援助,并帮助各国提升其兽医服务、实验室、监测和报告。
在2016年世界动物卫生组织世界代表大会上,成员国同意继续努力推动消除狂犬病的政治意愿和长期社会承诺的发展(20)。他们要求世界动物卫生组织和相关各方继续致力于在2030年前消除犬介导的人类狂犬病,将其作为公共利益中的重点。
全球防治狂犬病联盟(GARC)、狂犬病预防伙伴联盟和世界狂犬病日
全球防治狂犬病联盟是第一个注册的专门致力于减轻狂犬病全球负担的慈善机构。其任务是消除狂犬病造成的人类死亡,减轻动物尤其是犬类的狂犬病负担(www. rabiesalliance.org/)。
全球防治狂犬病联盟推动建立了狂犬病预防伙伴联盟(21),后者为非正式团体,由关注狂犬病的主要国际机构组成,包括世界卫生组织、粮农组织、世界动物卫生组织、世界卫生组织和世界动物卫生组织狂犬病合作中心和参考实验室、非政府动物福利组织、狂犬病专家网络和行业代表。狂犬病预防伙伴联盟发起了宣传狂犬病的消除及控制的研究和项目,包括:重新评估犬介导的狂犬病的全球负担(22)、对须申报的狂犬病的全球调查(23)和狂犬病预防和控制蓝图(24),其中包括逐步消除狂犬病的方法(25)。
全球防治狂犬病联盟的世界狂犬病日运动(rabiesalliance.org/world-rabies- day/)于2006年发起,旨在提高人们预防人类狂犬病和动物狂犬病的意识并调动资源应对此类狂犬病。据登记,在过去10年中该运动在116个国家举办了1717次活动,活动范围从认识运动到遛犬再到专业培训研讨会;受其影响,各国政府宣布改进狂犬病控制政策(26)。
最近,全球防治狂犬病联盟组织了多个为建立狂犬病控制能力的专业课程,这些课程可以从全球防治狂犬病联盟教育平台(https://rabiesalliance.org/ capacity-building/gep)免费获得,其中包括狂犬病教育者证书(培训社区教育者)、动物处理和疫苗接种证书(针对动物卫生技术人员和犬疫苗接种人员)、社区护理人员证书(针对社区志愿者)和社区医护证书(针对医护专业人员)。
抗击狂犬病组织
抗击狂犬病组织为国际间非政府组织,在疾病流行地区实施狂犬病消除计划。旗舰项目通过与地方政府的合作将其总部设在印度果阿州、贾坎德邦的兰契市和马拉维南部地区。这些运动包括大规模的犬只疫苗接种、狂犬病教育、社区意识以及对犬介导的狂犬病的监测。已开发一款独特的基于地理空间技术的智能手机应用改进对控制策略的流行病学评估,并指导团队前往偏远地区。迄今为止,该平台在亚洲、非洲和欧洲已输入了80多万条数据。2016年,共有213423只犬接种了疫苗,54万名儿童接受了狂犬病教育,64只患狂犬病的犬检测出狂犬病病毒抗原。马拉维的运动结合了中心疫苗接种和挨户疫苗接种,而在印度的运动中使用了捕获-接种-释放和挨户接种的方法。在果阿,政府为此类运动提供财务支持,政府诊断调查组设立了直接荧光抗体试验测试设施,以便及时检测和报告狂犬病病例。自2014年加强狂犬病控制以来,报告的狂犬病死亡人数从2014年的17人下降到2015年的5人、2016年的1人。并且通过合作伙伴组织在斯里兰卡、乌干达和坦桑尼亚联合共和国开展了试点运动,支持有效的现场方案,促进更广泛的应用。
世界动物保护协会
世界动物保护协会是致力于消除虐待动物行为的国际间非政府组织,在管理世界各地社区的散养家犬方面很专业。该组织与各国政府和国际组织(包括世界卫生组织、世界动物卫生组织、粮农组织和全球防治狂犬病联盟、其他非政府组织和当地社区)合作,促进人道管理犬只数量(www.worldanimalprotection.org)。世界动物保护协会提倡一种“同一个健康”的方法来管理犬的数量,并提倡有效、合乎道德、可持续的干预措施来实现犬和人之间的和谐共处(27)。2011~2016年,其“红色颈圈”运动的目标是结束孟加拉国、中国、印度尼西亚、菲律宾和坦桑尼亚联合共和国(桑给巴尔)等地因狂犬病而不人道地扑杀犬的行为。在非洲,世界动物保护协会正与肯尼亚政府合作,试点测试其国家狂犬病消除策略,并与塞拉利昂合作制定其国家狂犬病消除和犬只数量管理战略。该协会与全球防治狂犬病联盟合作,通过泛非狂犬病控制网络在其他几个非洲国家消除狂犬病,还在巴西、中国和哥斯达黎加合作开发“同一个健康”的犬只数量管理方法。
13.2.2 区域网络
非洲
泛非狂犬病控制网络成立于2015年,旨在加强非洲狂犬病专家网络的能力。是南部和东部非洲狂犬病小组和非洲狂犬病专家局的合并,包括以前没有与这两个组织有联系的非洲国家。通过泛非狂犬病控制网络和类似的区域网络举办的研讨会,全球防治狂犬病联盟和国际合作伙伴使用“狂犬病蓝图”和逐步消除狂犬病的方法,支持各国逐步消除犬介导的狂犬病(28)。泛非狂犬病控制网络新版流行病学通报将改进监测和其他监控进展所需数据的收集和可见性(29)。
美洲
在拉丁美洲,预防和控制狂犬病国家计划负责人会议每2年举行一次,审查狂犬病控制策略,向各国提出建议,并协调区域反应。2015年在巴西举行的第15届预防和控制狂犬病国家计划负责人会议推动了对犬介导的狂犬病的最后几个地点的监测(30)。2015年,在泛美卫生组织泛美口蹄疫防控中心、安第斯卫生组织和亚马逊合作条约组织的协调下,为玻利维亚、智利、哥伦比亚、厄瓜多尔、秘鲁和委内瑞拉设立了一个分组。每年组织一次美洲狂犬病问题国际会议(http://www.rabiesintheamericas.org/),审查和讨论该地区的狂犬病研究和控制情况。会议中包含有国际委员会,其成员来自巴西、加拿大、墨西哥和美国。
亚洲
世界卫生组织、粮农组织和世界动物卫生组织在2010年成立的欧洲委员会资助的“高致病性新型疾病”项目(31)的支持下,为亚太地区预防和控制人畜共患病的部门间协作建立了职能协调机制。此后,组织了一次三方研讨会,推动在成员国间实行“同一个健康”的概念。
世界卫生组织、巴斯德研究所和洛桑大学于2015年10月在柬埔寨金边为亚洲国家组织了第一次狂犬病监测和控制国际培训课程,以便在七个国家建立地方推行网络。该课程于2013年首次在塞内加尔进行,2015年在柬埔寨进行,2016年在喀麦隆进行。下一期课程将于2017年10月在伊朗伊斯兰共和国德黑兰进行,面向中东和中亚国家。
欧洲
世界卫生组织欧洲狂犬病通报创建于1977年,由位于德国弗里德里希-勒夫勒研究院的世界卫生组织狂犬病监测和研究合作中心主办。该数据库被40多个欧洲国家使用,每3个月报告一次人类以及野生和家养动物的狂犬病确诊病例。国家、监测数据地图汇总可以在网上免费获得(http://www.eurosurveillance.org/)。欧洲疾控中心(http://www.eurosurveillance.org/)出版的同行评审的科学期刊《欧洲监控》也报道了人类狂犬病病例和狂犬病流行病学。
根除动物疾病工作小组的欧洲联盟狂犬病分组由私人和政府专家组成。其任务是评估欧洲成员国和邻近的非成员国范围内的共同资助的口服狂犬病疫苗接种运动并提出建议。这些报告可在网上获得(http://ec.europa.eu/food/animals/animal-diseases_ en)。
自2008年以来,位于法国南希的欧洲联盟狂犬病参考实验室组织了欧洲国家狂犬病实验室年度会议,以规范诊断技术。
中东和近东
中东和东欧狂犬病专家局为跨区域网络于2010年建立。由中亚、欧洲、中东和北非的狂犬病流行国家代表组成,而代表们致力于加强地方、区域和全球各级狂犬病的控制和预防。成员们于2015年在法国里昂举行了第三次会议,审查网络中狂犬病的现状,并讨论如何使用“同一个健康”的方法来应对狂犬病(32)。
1. Rabies is a tripartite (WHO–FAO–OIE) priority. Paris: World Organisation for Animal Health; 2014.
2. The FAO–OIE–WHO collaboration. A tripartite concept note. Geneva: World Health Organization; 2010.
3. FAO, OIE, WHO. The tripartite’s commitment. Providing multi-sectoral, collaborative leadership in addressing health challenges. Rome: Food and Agriculture Organization of the United Nations; 2017 (I7377EN/1/06.17) (http://www.fao.org/3/b-i7377e.pdf).
4. Global elimination of dog-mediated rabies: report of a global rabies conference, 10–11 December 2015. Geneva: World Health Organization; 2016 (http://apps.who.int/iris/bitstream/10665/204621/1/WHO_HTM_ NTD_NZD_2016.02_eng.pdf).
5. Fahrion AS, Taylor LH, Torres G, Müller T, Dürr S, Knopf L et al. the road to dog rabies control and elimination – What keeps us from moving faster? Front Public Health. 2017; 5: 103.
6. Fahrion AS, Mikhailov A, Abela-Ridder B, Giacinti J, Harriesa J. Human rabies transmitted by dogs: current status of global data, 2015. Wkly Epidemiol Rec. 2016; 91 (2):13–20.
7. From concept to completion (website). Geneva: World Health Organization (http://www.who.int/neglected_diseases/news/from- concept-to-completion-elimination-of-canine-rabies/en/).
8. Stimulus package for eliminating dog-mediated human rabies: a concept. Geneva: World Health Organization; 2016 (http://apps.who.int/iris/ bitstream/10665/254044/1/WHO-HTM-NTD-NZD-2016.6-eng.pdf).
9. Gongal G, Wright AE. Human rabies in the WHO Southeast Asia Region: forward steps for elimination. Adv Prev Med. 2011; 2011: 383970.
10. Strategic framework for elimination of human rabies transmitted by dogs in the South-East Asia region. Geneva: World Health Organization; 2012.
11. Prevention and control of Rabies in SAARC countries. New Delhi: WHO Regional Office for South East Asia; 2016 (http://www.searo.who.int/ entity/emerging_diseases/documents/sea_cd_316.pdf).
12. Resolution CD55R9. Plan of action for the elimination of neglected infectious diseases and post-elimination actions 2016–2022. 55th Directing Council. 68th Session of the Regional Committee of WHO for the Americas; Wahington DC: Pan American Health Organization; 2016 (http://www.paho.org/hq/index.php?option=com_docman&task=doc_ download&gid=36408&Itemid=270&lang=en).
13. AGA in action (website). Rome: Food and Agriculture Organization of the United Nations; 2012 (http://www.fao.org/ag/againfo/home/en/ news_archive/aga_in_action/2010_Animal_Health_Clubs_3.html).
14. An introduction to FAO’s rabies stakeholder consultations (RASC) (website). Rome: Food and Agriculture Organization of the United Nations; undated (http://aphca.org/publications/Tool_I_Introduction_ FAO_Rabies_stakeholder_consultations1_final.pdf).
15. The rabies A-teams inaction on Bali!(video). Rome: Food and Agriculture Organization of the United Nations; 2014; (https://www.youtube.com/ watch?v=ZFZxfnQsPyw).
16. Dog population management. FAO/WSPA/IZSAM expert meeting, Banna, 2011. Rome: Food and Agriculture Organization of the United Nations; 2014.
17. Sixth meeting of the GF-TADs Global Steering Committee. Rome: Food and Agriculture Organization of the United Nations; 2013 (http://www. fao.org/3/a-bl340e.pdf).
18. Rabies (infection with rabies virus). In: Manual of diagnostic tests and vaccines for terrestrial animals, Vol. 2. Paris: World Organisation for Animal Health; 2016 (http://www.oie.int/fileadmin/Home/eng/Health_ standards/tahm/2.01.17_RABIES.pdf).
19. Terrestrial animal health code. Paris: World Organisation for Animal Health; 2011 (https://www.oie.int/doc/ged/D10905.PDF).
20. Resolutions adopted by the World Assemby of Delegates of the OIE during its 84th General Session. Paris: World Organisation for Animal Health; 2017 (http://www.oie.int/fileadmin/Home/eng/About_us/docs/ pdf/Session/2016/A_RESO_2016_public.pdf).
21. Lembo T, Attlan M, Bourhy H, Cleaveland S, Costa P, De Balogh K et al. Renewed global partnerships and redesigned roadmaps for rabies prevention and control. Vet Med Int. 2011; 2011: 923149.
22. Hampson K, Coudeville L, Lembo T, Sambo M, Kieffer A, Attlan M et al. Estimating the global burden of endemic canine rabies. PLoS Negl Trop Dis. 2015; 9 (4): e0003709.
23. Taylor LH, Knopf L. Surveillance of human rabies by national authorities – a global survey. Zoonoses Public Health. 2015; 62 (7): 543–52.
24. Lembo T, Partners for Rabies Prevention. The blueprint for rabies prevention and control: a novel operational toolkit for rabies elimination. PLoS Negl Trop Dis. 2012; 6 (2): e1388.
25. Coetzer A, Kidane AH, Bekele M, Hundera AD, Pieracci EG, Shiferaw ML et al. The SARE tool for rabies control: current experience in Ethiopia. Antiviral Res. 2016; 135: 74–80.
26. Balaram D, Taylor LH, Doyle KA, Davidson E, Nel LH. World rabies day – a decade of raising awareness. Trop Dis Travel Med Vacc. 2016; 2 (1): 19.
27. Humane dog management (website). London: World Animal Protection (https://www.worldanimalprotection.org/sites/default/files/int_files/ humane-dog-management.pdf).
28. Scott TP, Coetzer A, De Balogh K, Wright N, Nel LH. The Pan-African rabies control network (PARACON): a unified approach to eliminating canine rabies in Africa. Antiviral Res. 2015; 124: 93–100.
29. Scott TP, Coetzer A, Fahrion AS, Nel LH. Addressing the disconnect between the estimated, reported, and true rabies data: the development of a regional African rabies bulletin. Front Vet Sci. 2017; 4: 18.
30. EU funded Highly Pathogenic and Emerging Diseases 3rd Steering Committee Meeting 2012. Paris: World Organisation for Animal Health; 2012 (https://www.oie.int/doc/ged/D11881.PDF).
31. 15th REDIPRA, 16–17 September 2015, Brasilia (http://www.panaftosa. org/redipra15/index.php?option=com_content&view=article&id=81&I temid=78&lang=en).
32. Picot V, Rasuli A, Abella-Rider A, Saadatian-Elahi M, Aikimbayev A, Barkia A et al. The Middle East and eastern Europe rabies expert bureau (MEEREB) third meeting: Lyon, France (7–8 April, 2015). J Infect Public Health. 2017; 10 (6): 695–701.
限制狂犬病对个人和人群影响的方法以及改进预防和管理策略的依据和新方法是未来研究的方向,包括改进对人类和动物的干预方式。确定未来研究重点的领域如下。
在目前针对人类狂犬病和动物狂犬病的方案中,需要更好的干预方法。在操作性研究中,精心设计的方案、严格的统计标准和公正取样是必不可少的。在评价干预措施时,应尽可能纳入适当的对照组。研究应包括:
■ 与制造商合作创新、开发新疫苗,以优化成本效益、社区接种实施、易储存性、热稳定性和保质期,同时保持疫苗的安全性和有效性。
■ 创新的、成本效益高的方法,为偏远人群(获得医疗保健的渠道有限或无渠道获得)提供狂犬病生物制品。目前所考虑的方法包括对医疗保健人员进行狂犬病疫苗的行业内管理培训、创新温度控制链、促进狂犬病疫苗管理的研究(例如皮下接种)、协调使用现有冷藏链以及分散动物咬伤治疗诊所。
■ 关于预防咬伤教育对减少犬咬伤次数和人们可能接触狂犬病的影响的概念验证研究。
■ 完善目前的规范,70%的犬只接种疫苗以阻断狂犬病传播。应指出在高传染地区有针对性地对危险性犬只进行疫苗接种是否应该作为重点。
■ 将犬狂犬病控制纳入其他人类和动物健康计划的应用研究。
疾病负担和风险的准确数据对于确定预防和控制狂犬病的区域、国家和地方各级优先事项至关重要。需要进行研究以提高诊断和监测能力,特别需要对资源少、有地方病的环境进行研究。优先事项包括:
■ 评估改进地方病环境中监测的新方法,如综合咬伤病例管理作用的概念验证研究(1)口头尸检、脑炎患者检测(2)以及改进狂犬病病例检测和报告的新技术。
■ 创新战略,提高分散、基于现场的狂犬病诊断的接受程度,并评估其对监测效果(即敏感性、代表性和及时性)的影响,例如优化现场或病床旁收集、准备诊断样本的方法,或开发和验证适合现场或护理点使用的敏感、具体的生前测试。
■ 强大、可持续的数据采集平台,以促进数据从现场流向中央卫生服务以及地区性和全球性储存库。这将提高对全球、地区和国家狂犬病负担估计的准确度。如果现有数据有缺口,可通过建模获取估值。
■ 狂犬病诊断的国际标准,包括分子技术以及诊断检测狂犬病的质量控制方法,可确保结果可靠。
■ 量化狂犬病监测系统强度的方法,该系统可与验证人类狂犬病零死亡的方法结合使用(见第12节)。其中可能包括更多地了解某些地理范围内用于维持和消除狂犬病的方法、了解病毒特征以推断感染关系并确定传播来源。
新方法可简化方案实施,提高诊断能力,使暴露后预防和狂犬病免疫球蛋白更经济实惠。应研究狂犬病生物制品,以获得关于加速暴露后预防和暴露前预防的免疫结果以及狂犬病免疫球蛋白替代品(如单克隆抗体)的可靠临床数据。优先事项包括:
■ 进一步研究新型疫苗输送工具的成本效益、可行性和潜力,如无针注射、微针注射法和局部贴片。
■ 使用新型免疫避孕产品来增强对动物数量的管理,并将外科或非外科绝育与肠胃外或口服狂犬病疫苗接种相结合(3)。应在犬类身上进行此类测试,并对其密切监控,从数量、可行性和成本效益方面确定其人道性和长期影响。
■ 提供数据和样本量,以证明新的暴露后预防和暴露前预防方案的非劣效性,对于建立狂犬病生物制品和其他新产品(如单克隆抗体)的监管也很重要。
■ 建议对反复接触的个体进行免疫接种,建议暴露后预防的最佳间隔和一生应使用的辅助药剂数量。更多地了解免疫低下个体中决定血清血清转化和临床结果的因素将会有所帮助。
■ 可将预防其他丽沙病毒株(即第II和第III谱系丽沙病毒属)疫苗作为多价疫苗研究,并应进一步研究新疫苗载体和佐剂在用于暴露后预防时诱导的激活和保护作用。新丽沙病毒属种的特征描述应说明商业上可获得的狂犬病生物制品是否可能受到保护。
■ 研究静脉内给药狂犬病免疫球蛋白(特别是非咬伤接触)和被动免疫所需的抗体水平及其持续时间(特别是单克隆抗体)。
■ 开发和验证治疗临床狂犬病患者的有效暴露后预防疗法和/或抗病毒疗法(见第6节)。在与家人讨论并做出合议决定以及排除了其他威胁生命但可治愈的疾病(狂犬病脑炎的鉴别诊断)后,新疗法应该仅在资源充足的参考中心得到验证,参考中心须有训练有素的团队(或在专家指导下),在管理狂犬病患者方面有经验并有道德上可接受的方案。
磋商会强调了以方案为导向的研究对克服狂犬病控制方面当前挑战的重要性,这将推动世界范围内实现到2030年人类狂犬病零死亡的全球目标。除了这个目标之外,还应对狂犬病传播阻断、无狂犬病状态的监测以及扩大研究议程(扩大至除狂犬病之外的丽沙病毒属)进行研究。此类研究重点可能只偏重于某一方面,因为这项调查只对与会者开放。总的来说,研究应改善狂犬病高危人群的公共健康状况。
1. Undurraga EA, Meltzer MI, Tran CH, Atkins CY, Etheart MD, Millien MF et al. Cost–effectiveness evaluation of a novel integrated bite case management program for the control of human rabies, Haiti 2014–2015. Am J Trop Med Hyg. 2017; 96 (6): 1307–17.
2. Mallewa M, Fooks AR, Banda D, Chikungwa P, Mankhambo L, Molyneux E et al. Rabies encephalitis in malaria-endemic area, Malawi, Africa. Emerg Infect Dis. 2007; 13 (1): 136.
3. Carroll MJ, Singer A, Smith GC, Cowan DP, Massei G. The use of immunocontraception to improve rabies eradication in urban dog populations. Wildl Res. 2011; 37 (8): 676–87.
Rungrueng Kitphati博士(泰国疾病控制司主任)在会议结束时代表泰国公共卫生部感谢与会者、组织者、媒体和朱拉隆功大学。Bernadette Abela-Ridder博士感谢朱拉隆功大学以及组织者、工作组和与会者的贡献、投入和支持。
抗击狂犬病组织的Gowri Yale博士分享了一个果阿的成功故事。果阿是印度的一个州,面积小,人口约240万,而犬只预计有15万只。自2013年以来,该项目每年为5万犬只接种疫苗,提供教育团队提高学校和社区对狂犬病的认识,还提供热线说明需清除的患狂犬病的犬只。果阿每年死于狂犬病的人数从24人减少到5人,2017年到目前为止还没有病例报告。这个例子提供了确凿证据,令人信服,证明了用现有方法消灭狂犬病是可行的。持续承诺、合作和支持实施控制措施,仍然是到2030年在全世界实现人类狂犬病零死亡的关键。
专家磋商会和世界卫生组织秘书处感谢起草背景文件和更新章节的A. Be-Nazir博士、J. Blanton博士、H. Bourhy博士、D. Briggs博士、S. Cleaveland博士、F. Cliquet博士、V. Del Rio Vilas博士、H. Ertl博士、C. Fehlner-Gardiner博士、T. Fooks博士、C. Freuling博士、G. Gongal博士、K. Hampson博士、A. Jackson博士、J. Kotze博士、M. Lechenne博士、R. Mani博士、F.X. Meslin博士、S. Moore博士、T. Mülle博士、S. Recuenco博士、C.E. Rupprecht博士、S. Shwiff博士、R. Steffen博士、A. Tarantola博士、L. Taylor博士、G. Torres博士、A. Vos博士、M. Vigilato博士和R. Wallace博士。
非常感谢朱拉隆功大学(世界卫生组织病毒性人畜共患病研究和培训合作中心)为主办这次磋商会议所做的工作,特别感谢Thiravat Hemachudha博士、Supaporn Wacharapleusadee博士和Siriporn Ghai女士。
世界卫生组织合作中心
世界卫生组织美国狂犬病参考和研究合作中心(地址:Centers for Disease Control and Prevention, Atlanta (GA), USA)Jesse D. Blanton博士
法国世界卫生组织狂犬病参考和研究合作中心(地址:Institut Pasteur, Paris, France)Hervé Bourhy博士
法国世界卫生组织人畜共患病控制研究和管理合作中心(地址:Laboratory of Rabies and Wild Animals of Nancy, French Agency for Food Environmental and Occupational Health and Safety, Malzeville, France)Florence Cliquet博士
加拿大世界卫生组织食肉动物狂犬病控制和流行病学合作中心(地址:Centre of Expertise for Rabies, Ottawa Laboratory Fallowfield, Canadian Food Inspection Agency, Ottawa, Canada)Christine Fehlner-Gardiner博士(联合主席)
英国世界卫生组织狂犬病和狂犬病相关病毒特征鉴定合作中心(地址:Department of Virology, Animal and Plant Health Agency, Weybridge, United Kingdom)Anthony R. Fooks博士
泰国世界卫生组织病毒性人畜共患病研究和培训合作中心(地址:Faculty of Medicine, Chulalongkorn University, King Chulalongkorn Memorial Hospital, Bangkok, Thailand)Thiravat Hemachudha博士(联合主席)
泰国世界卫生组织狂犬病发病机制和预防研究合作中心(地址:Queen Saovabha Memorial Institute, Thai Red Cross Society, Bangkok, Thailand)Boonlert Lumlertdacha博士
印度世界卫生组织狂犬病参考和研究合作中心(地址:Department of Neurovirology, National Institute of Mental Health and Neurosciences, Bengaluru, India)Reeta S. Mani博士
德国世界卫生组织狂犬病监测和研究合作中心(地址:Institute of Molecular Virology and Cell Biology, Friedrich-Loeffler-Institut, Federal Research Institute for Animal Health, Greifswald-Insel Riems, Germany)Thomas Müller博士
印度世界卫生组织狂犬病流行病学合作中心,(地址:Division of Zoonosis, National Centre for Disease Control, New Delhi, India)IndiaDr Simmi博士
印度世界卫生组织狂犬病参考和研究合作中心(地址:Department of Neurovirology, National Institute of Mental Health and Neurosciences, Bengaluru, India)Ravi Vasanthapuram博士
世界卫生组织狂犬病咨询专家组成员
瑞士日内瓦顾问François-Xavier Meslin博士
全球防治狂犬病联盟和南非比勒陀利亚大学的Louis Hendrik Nel博士
菲律宾马尼拉热带医学研究所的Beatriz Quiambao博士美国费城(宾夕法尼亚州)Wistar Institute的Charles E. Rupprecht博士
巴基斯坦卡拉奇Indus Hospital Karachi的Naseem Salahuddin博士
印度孟加拉鲁拉吉夫·甘地公共卫生研究所和疾病控制中心的Mysore kalapa sudarsan博士
其他专家
伊朗传染病和热带疾病研究中心(地址:Tabriz University of Medical Science,Tabriz, Islamic Republic of Iran)Hossein Bannazadeh Baghi博士
美国曼哈顿(堪萨斯州)堪萨斯州立大学兽医学院的Deborah Briggs博士
澳大利亚墨尔本(维多利亚州)兽医无国界组织Andrea Britton博士
坦桑尼亚联合共和国莫罗戈罗Ifakara Health Centre的Joel Jackson Changalucha博士
英国格拉斯哥大学Sarah Cleaveland博士
英国吉尔福德萨里大学兽医学院Victor J. Del Rio Vilas博士
印度塞康德拉巴德的Sampath Gade博士
英国斯里兰卡国家医院(地址:Mattegoda, Sri Lanka Dr Katie Hampson, Glasgow University, Glasgow, United Kingdom)Amila Gunesekera博士
泰国曼谷公共卫生部Soawapak Hinjoy博士
加拿大温尼伯曼尼托巴大学神经科Alan C. Jackson博士
孟加拉国达卡卫生服务总局-传染病控制-新发传染病与再发传染病的Golam Kaisar博士
柬埔寨金边卫生部Sim Kheng博士
泰国曼谷公共卫生部疾病控制司Rungrueng Kitphati博士
南非马莱兰顾问Johann Kotzé博士
摩洛哥拉巴特卫生部Mohammed Lakranbi博士
瑞士巴塞尔瑞士热带和公共卫生研究所Monique Léchenne博士
柬埔寨金边巴斯德研究所Sowath Ly博士
菲律宾圣费尔南多第三区域办事处卫生部Gina R Manlapig博士
堪萨斯州曼哈顿堪萨斯州立大学兽医学院Susan Moore博士(联合报告人)
肯尼亚医学研究所和基苏木华盛顿州立大学Thumbi Mwangi博士
肯尼亚内罗比卫生部人兽共患病-预防和促进健康服务司-Athman Mwatondo博士
印度班加罗尔医学院的Ashwath Narayana博士
越南河内国家卫生和流行病学研究所Thi Thanh Huong Nguyen博士
秘鲁利马圣马科斯国立大学预防医学和公共卫生部Sergio Recuenco Cabrera博士
塞内加尔达喀尔巴斯德研究所Amadou Sall博士
瑞士世界卫生组织旅行者健康合作中心(地址:Epidemiology, Biostatistics and Prevention Institute, University of Zurich, Zurich, Switzerland)Robert Steffen博士
加纳林业委员会(阿克拉)的Forestry Commission博士
新喀里多尼亚巴斯德研究所(地址:New Caledonia Dr Tenzin Tenzin, National Centre for Animal Health, Timphu, Bhutan)Arnaud Tarantola博士
泰国曼谷公共卫生部Pornchai Thurin博士
英国剑桥大学兽医系Caroline Trotter博士
美国佐治亚州亚特兰大疾病控制和预防中心的Eduardo Undurraga博士
美国佐治亚州亚特兰大疾病控制和预防中心的Ryan Wallace博士
泰国世界卫生组织病毒性人畜共患病研究和培训合作中心(地址:Faculty of Medicine, Chulalongkorn University, King Chulalongkorn Memorial Hospital, Bangkok, Thailand)Henry Wilde博士
中国疾病控制和预防中心(北京)殷文武博士
其他组织的代表
泰国曼谷联合国粮食及农业组织的Katinka de Balogh博士
观察员
中国沈阳辽宁成大股份有限公司国际监管事务-车兴华(音译)博士
印度古吉拉特CPL Biologicals Pvt有限公司Nirav Desai博士
泰国世界卫生组织病毒性人畜共患病研究和培训合作中心(地址:Faculty of Medicine, Chulalongkorn University, King Chulalongkorn Memorial Hospital, Bangkok, Thailand)Siriporn Ghai女士
瑞士日内瓦顾问Saleh Khan先生
印度古吉拉特Zydus Cadila公司的Sanjeev Kumar博士
肯尼亚内罗比世界动物保护协会Emily Mudoga博士
法国里昂梅里埃基金会的Valentina Picot博士
比利时瓦夫尔葛兰素史克股份有限公司的Scott Preiss博士
瑞士日内瓦顾问Gill Sivyer女士
泰国世界卫生组织病毒性人畜共患病研究和培训合作中心(地址:Faculty of Medicine, Chulalongkorn University, King Chulalongkorn Memorial Hospital, Bangkok, Thailand)Supaporn Wacharapluesadee博士
印度班加罗尔抗击狂犬病组织的Gowri Yale博士
世界卫生组织秘书处
被忽视的热带疾病控制部-被忽视的人兽共患病小组组长Bernadette Abela-Ridder博士
丹麦哥本哈根欧洲地区办公室-疟疾和其他媒传疾病司-Elkhan Gasimov博士
印度新德里东南亚地区办公室-食品安全和人畜共患疾病司-Gyanendra Gongal博士
被忽视的热带疾病控制部-被忽视的人兽共患疾病司-Joss Kessels女士(联合报告人)
被忽视的热带疾病控制部-被忽视的人兽共患疾病司-Lea Knopf博士
美国人畜共患疾病司(地址:Pan American Health Organization/Regional Office for the Americas, Washington DC, USA)Marco Vigilato博士
被忽视的热带疾病控制部-被忽视的人兽共患疾病司-Naoko Obara女士
埃及开罗东地中海地区办公室技术主任Nhu NguyenTran Minh博士
病例编号: 日期: 时间:
患者详情
姓名: 年龄: 性别:
地址:
电话(家庭和移动电话):
工作电话:
医生及其联系电话:
暴露细节
国家和城镇: 暴露日期:
传播日期:
暴露性质:咬/舔/唾液/抓痕/其他(具体说明):
暴露地点:
皮肤是否破损?是/否 伤口是否出血?是/否
伤口数量:
咬伤深度:浅表/深 世界卫生组织暴露类别:I/II/III:
动物细节
动物类型:野生/家养 物种:
咬伤:被激怒/ 无端地:(细节):
动物的主人/家是否知晓?是/否
是否尝试追踪该动物?是/否
最后一次看到这只动物存活状态(死前)是什么时候?
动物的疫苗接种状况(如果知晓,请填写):
治疗细节
患者狂犬病疫苗接种史:
患者以前是否接受过至少两次肌肉/皮内狂犬病疫苗接种,作为暴露前或暴露后预防措施?是/否
详细信息(天/日期/疫苗名称/批号):
患者以前是否使用过狂犬病免疫球蛋白?是/否
详细信息(日期/类型(eRIG/hRIG/单克隆抗体)/地点/数量):
其他信息:
联系随叫随到的病毒学家/医生,说明上述信息可获得建议。
如果联系不上,请联系:
之前是否进行过抗狂犬病暴露后预防?是/否
接种了哪种狂犬病疫苗?
详细信息(天/日期等):
是否使用狂犬病免疫球蛋白?是/否
局部/全身: 其他信息
联系随叫随到的病毒学家/医生,说明上述信息可获得建议
如果联系不上,请联系:
推荐处置程序
用水/肥皂/抗病毒剂彻底清洗伤口。
狂犬病免疫球蛋白:
人狂犬病免疫球蛋白,最大剂量20IU/kg体重
马狂犬病免疫球蛋白,最大剂量40IU/kg体重
注射部位:
患者体重(kg): 推荐体积(单位:IU和mL):
是否安排了暴露后预防?是/否
■ 狂犬病疫苗接种(建议世界卫生组织第II和第III类暴露类型):
– 两天,两部位皮内注射:第0天和第3天(2个部位)
– 两天,单部位肌肉内注射:第0天和第3天(1个部位)
– 一天,四部位皮内注射:第0天(4个部位)
■ 以前未免疫的人的标准暴露后预防* :
– 一周两部位皮内注射:第0天、第3天和第7天(2个部位)
– 两周单部位肌内注射:第0天、第3天和第7天,然后第14天~第28之间(1个部位)
– 三周肌内注射: 第0天(2个部位)、第7天(单部位)和第21天(单部位)
– 其他(具体说明)
* 患者以前接受过至少两次肌肉/皮内狂犬病疫苗接种(无论作为暴露前还是暴露后预防措施),则认为其接种过狂犬病疫苗。
是否通过信件/电子邮件/电话/短信通知全科医生?是/否
治疗医生的姓名、电话和签名:
附录3 截至2017年8月,世界各地的人类狂犬病疫苗及其生产者
| 疫苗 | 品牌 | 生产者 | 国家 | 细胞系 | 世界卫生组织预审合格与否 | 类型 |
| PVRV | N/A | 布坦坦研究所 | 巴西 | Vero细胞 | 否 | 液体 |
| HDCV | 成都康华 | 成都康华 | 中国 | 人二倍体细胞 | 否 | 冻干型 |
| PVRV | SPEEDA | 辽宁成大股份有限公司 | 中国 | Vero细胞 | 否 | 冻干型 |
| PVRV | N/A | 长春长生生物科技股份有限公司 | 中国 | Vero细胞 | 否 | 冻干型 |
| PVRV | N/A | 广州诺诚生物制品股份有限公司 | 中国 | Vero细胞 | 否 | 冻干型 |
| PVRV | N/A | 宁波荣安生物药业有限公司 | 中国 | Vero细胞 | 否 | 冻干型 |
| PVRV | N/A | 吉林迈丰生物药业有限公司 | 中国 | 仓鼠肾细胞 | 否 | 液体 |
| PPHKCV | N/A | 中科生物制药股份有限公司 | 中国 | 仓鼠肾细胞 | 否 | 液体 |
| PPHKCV | N/A | 河南远大生物制药有限公司 | 中国 | Vero细胞 | 否 | 液体 |
| 灭活PIKA,
采用TLR3佐剂 |
依生生物制药有限公司 | 中国 | Vero细胞 | 否 | ? | |
| PVRV | Vero细胞狂犬病疫苗 | 赛诺菲巴斯德 | 法国 | Vero细胞 | 是 | 冻干型 |
| HDCV | Imovax | 赛诺菲巴斯德 | 法国 | 人二倍体细胞 | 否 | 冻干型 |
| PCECV | Rabavert | 葛兰素史克 | 德国 | 鸡胚细胞 | 是 | 冻干型 |
| PCECV | Rabipur | 葛兰素史克 | 印度 | 鸡胚细胞 | 是 | 冻干型 |
| HDCV | Rabivax | 印度血清研究所 | 法国 | 人二倍体细胞 | 否 | 液体 |
| PDEV | 纯化鸭胚疫苗
/Vaxirab |
Zydus-Cadila(印度制药公司) | 印度 | 鸭胚细胞 | 停产 | 冻干型 |
| PCECV | Vaxirab-N | Zydus-Cadila(印度制药公司) | 印度 | 鸡胚细胞 | 不合格,Vaxirab接替产品 | 冻干型 |
| PVRV | Indirab | 巴拉特生物技术有限公司 | 印度 | Vero细胞 | 否 | 冻干型 |
| PVRV | Abhayrab | Indian Immunologicals公司 | 印度 | Vero细胞 | 否 | 冻干型 |
| BHKV | Kokav接种疫苗 | Tarasevich研究所 | 俄罗斯联邦 | 仓鼠肾细胞 | 否 | ? |
| NTV | ? | 巴斯德研究院(阿尔及尔) | 阿尔及利亚 | 小鼠大脑 | 否 | 液体? |
| NTV | ? | Instituto Biológico “Tomás Perón” | 阿根廷 | 小鼠大脑 | 否 | 液体 |
| NTV | ? | Instituto Nacional de Laboratorios de Salud INLASA | 玻利维亚 | 小鼠大脑 | 否 | 液体 |
| NTV | ? | 埃塞俄比亚公共卫生研究院 | 埃塞俄比亚 | 羊脑? | 否 | 液体? |
BHKV-幼仓鼠肾细胞疫苗;HDCV-人二倍体细胞疫苗;N/A-不可用;NTV-神经组织疫苗;PCECV-纯化鸡胚细胞疫苗;PDEV-纯化鸭胚细胞疫苗;PPHKCV-纯化原代地鼠肾细胞疫苗;PVRV-纯化Vero细胞疫苗
附录4 采用细胞培养或鸡胚细胞生产的现代狂犬病疫苗替代神经组织疫苗的四个步骤
依然生产或使用神经组织疫苗的国家应当遵从如下所推荐的四步策略,用现代疫苗取
代神经组织疫苗。第1步:
由国家卫生主管机构领导的相关国家权威机构必须做出将神经组织疫苗替换为现代疫苗的最终决定。在评价现代疫苗的安全性、免疫原性及有效性之后,相关权威机构应当评估当地状况,分析取代神经组织疫苗的可行性及其费用。应当考虑在狂犬病暴露前和暴露后的预防中使用可节省成本的皮内注射法。
第2步::国家相关指南应该明确说明如何使用现代疫苗进行暴露前和暴露后预防,包括使用适应症和给药途径;;对狂犬病免疫球蛋白和其他产品也应当给出相应的指导。这些指导方针应由具备技术水平的专家根据世界卫生组织狂犬病咨询专家组、世界卫生组织其他咨询小组的报告中的建议、最新科学文献、国际和国家专家的经验以及观察结果来拟定。并应发放给所有提供暴露前和暴露后预防中心。指导方针必须基于明确的政策,例如疫苗补贴(如果有的话)和处理剩余疫苗问题,并应定期更新。
第3步:狂犬病中心应从总部获得安全、有效、世界卫生组织推荐的狂犬病疫苗和免疫球蛋白的持续供给。一旦决定停止神经组织疫苗的生产和使用,就应该开始采购现代疫苗,以避免在神经组织疫苗停止供应后在提供治疗方面出现任何缺口。与监管机构协调注册新的狂犬病生物制品以及对新的狂犬病疫苗和狂犬病免疫球蛋白进行上市后的监测也很重要。
第4步:::应当建立一个咬伤专科的网络,其员工应接受过提供暴露前和暴露后预防及处置不良反应的培训;应确保这些中心有足够量的狂犬病生物制剂。应建立转诊系统来扩大皮内注射法的效益并减少剩余的疫苗量。应设立一个质量保证系统,所有机构都遵从其标准。省级和市级政府应参与新机构的建立,确保狂犬病疫苗、免疫球蛋白和其他物资的可持续供给,确保人狂犬病病例的上报和调查以及监控狂犬病项目。
附录5 截至2017年8月,全世界狂犬病免疫球蛋白(RIG)产品及其生产商
| 类别 | 产品名称或品牌 | 剂型 | 瓶规格 | 公司 | 国家 |
| eRIG | 抗狂犬病血清 | 200 IU/mL | 5mL | 布坦坦研究所 | 巴西 |
| eRIG | Rabix-IG | 200 IU/mL | 5mL | 孟加拉Incepta制药公司 | 印度 |
| eRIG | Abhay-RIG | 300 IU/mL | 5mL | Indian Immunologicals公司 | 印度 |
| eRIG | 抗狂犬病血清 | 300 IU/mL | 5mL | 哈夫金 | 印度 |
| eRIG | EquiRab | 300 IU/mL | 5mL | 印度巴拉特血清和疫苗有限公司 | 印度 |
| eRIG | 抗狂犬病血清 | 300 IU/mL | 5mL | 印度血清研究所 | 印度 |
| eRIG | 抗狂犬病血清 | 300 IU/mL | 5mL | 卡绍利(HP)中央研究院 | 印度 |
| eRIG | Plasmarab | 300 IU/mL | 5mL | 优级血清 | 印度 |
| eRIG | PremiRab(狂犬病抗血清免疫沉淀反应) | 300 IU/mL | 5mL | Kings Global Biotech印度制药公司 | 印度 |
| eRIG | TRCS eRIG | 200 IU/mL | 5mL | 泰国皇家毒蛇研究中心 | 泰国 |
| hRIG | 人狂犬病免疫球蛋白 | 100 IU/mL | 2mL或5mL | 华兰生物疫苗有限公司 | 中国 |
| hRIG | 人狂犬病免疫球蛋白人狂犬病免疫球蛋白 | 100 IU/mL | 1mL、2mL或5mL | 四川远大蜀阳药业股份有限公司Ltd | 中国 |
| hRIG | 人狂犬病免疫球蛋白 | 100, 200
或500IU/瓶 |
N/A | 中国生物技术集团公司(国药控股子公司) | 中国 |
| hRIG | 人狂犬病免疫球蛋白 | 200IU/
瓶 |
2mL | 泰邦生物制品有限公司 | 中国 |
| hRIG | 卫光 | 100IU/
瓶 |
2mL | 深圳市卫光生物制品股份有限公司 | 中国 |
| hRIG | Imogram Rabies- HT | 150 IU/mL | 2mL或10mL | 赛诺菲巴斯德 | 法国 |
| hRIG | Berirab-P | 150 IU/mL | 2mL或5mL | CSL Behring AG | USA |
| hRIG | KamRAB/ KedRAB | 150 IU/mL | 2mL或10mL | Kamada有限公司 | 以色列 |
| hRIG | 人狂犬病免疫球蛋白 | 150 IU/mL | 500IU | 生物产品实验室有限公司 | 英国 |
| hRIG | HyperRAB S/D | 150 IU/mL | 2mL或10mL | 美国基立福 | USA |
| hRIG | Rabigam | 150 IU/mL | 2mL | 国家生物制品 | 南非 |
| RmAb | Rabishield | 40IU/mL或100
IU/mL |
2.5mL | 印度血清研究所 | 印度 |
皮内注射比标准肌内注射安全,免疫原性更强、更具成本效益,因此建议使用,尤其是在疫苗和财力有限的情况下。标识为肌内注射使用的狂犬病疫苗可以通过皮内注射安全使用,尽管这意味着疫苗为标识外使用。
皮内给药可用于免疫低下的个体或接受氯喹、羟基氯喹药物或长期皮质类固醇或其他免疫抑制治疗的个体。
由于皮内注射疫苗剂量的体积小于肌注剂量体积,皮内给药特别适合在同一中心治疗许多患者,即建议在疫苗溶解后的6小时内给药。目前可用的狂犬病疫苗不含防腐剂,必须在溶解后冷藏,溶解后6小时如未使用必须丢弃。
皮内注射狂犬病疫苗前的准备:
皮内注射狂犬病疫苗前:
■ 所有员工必须接受皮内注射技术的充分培训。
■ 若疫苗作为暴露后预防的一部分,还应采取其他处置步骤,即清洗伤口,根据情况注射适当剂量的狂犬病免疫球蛋白。
■ 应当使用一个适当的1.0ml 注射器(胰岛素或结核菌素注射器)和一个短小完好的注射针头。使用固定针头的注射器可节省大部分花费,因为减少了空隙容量。
■ 应该对皮内注射程序有所选择。WHO推荐一周两部位皮内方案(2-2-2-0-0)用于暴露后预防(见第8.3.3节)。
皮内注射狂犬病疫苗
第1步
| 给药前,在无菌条件下取用制造商提供的适当剂量的稀释剂稀释疫苗。不可使用别的稀释剂。不能使用不同剂量的稀释剂。采用恰当的无菌措施,吸取足够的疫苗到注射器中用来给一位患者注射。小心排出所有气泡。 |  |
| 用抗菌剂消毒注射部位,然后绷紧皮肤表面并插入针头尖端(尖端斜面朝上)到皮肤上层(真皮层),确保针头和注射器与皮肤表面几乎平行。 | |
第2步开始注射疫苗。若针头处于正确部位,会感受到一定阻力。一个橘皮样皮丘会马上出现,直径在6到8毫米。若疫苗很容易注射进去,或是没有出现皮丘,说明误为皮下给药,即打得过深。遇到这种情况,应当重复上述正确的注射方法。 |
 |
第3步当给同一患者的所有0.1ml 剂量的疫苗注射完毕时,丢弃针头和注射器。稀释过后的疫苗可用于不止一位患者;但是,针对每一位患者都必须使用一套无菌的注射器和针头来吸取疫苗。稀释后的疫苗必须保存在2℃到8℃的冰箱中,并在6小时内使用。 |
 |
| 暴露类型 | 暴露类型(暴露于疑似或确认患有狂犬病的家畜或野生动物或无法检测是否有狂犬病的动物) | 推荐采用的暴露后预防 |
| I | 触摸或喂养动物,完好的皮肤被舔(无暴露) | 无,如果有可靠病历记录a |
| II | 裸露的皮肤被轻咬
无出血的轻微抓伤或擦伤(有暴露) |
立即接种疫苗
如果动物在10天的观察期间b保持健康,或者由可靠的实验室使用适当的诊断技术证明狂犬病病毒抗原阴性,则停止治疗。 如果涉及蝙蝠暴露,则按第III类暴露处理。 |
| III | 单处或多处贯贯穿c皮肤咬伤或者抓伤、粘膜遭唾液污染或破损皮肤被舔、以及由于直接接触蝙蝠而导致的暴露(严重暴露)。 | 应立即注射狂犬病疫苗和狂犬病免疫球蛋白,最好暴露后马上注射。
狂犬病免疫球蛋白可以在第一剂疫苗接种后的7天内注射。 如果动物在10 天的观察期内保持健康 或由可靠的实验室经恰当诊断技术证 明该动物未患狂犬病,则停止治疗。 |
a 如果观察过程中明显健康的犬或猫,并且是在低风险地区或来自低风险地区,则治疗
可以延迟。
b 此观察期仅适用于犬和猫。除濒临灭绝的物种之外,其他怀疑患有狂犬病的家养和野生动物均应当实施安乐死并使用恰当的实验室技术对其组织进行狂犬病抗原检查。
c 发生在头部、颈部、面部、手部和生殖器的咬伤归于暴露类型Ⅲ,原因是这些部位有丰富的神经分布。
以下是一份典型的疫苗接种证明。疫苗接种患者应该妥善保存该证明及其个人健康记录。空白证书应该由疫苗制造商提供。
暴露前或暴露后狂犬病疫苗接种证明
姓名:
出生日期: 性别:
地址:
电话:
关于暴露前预防,参见2.1。
暴露后预防
暴露日期: WHO狂犬病暴露类型:I/II/III
咬人动物:健康/患病 该动物是否接种过狂犬病疫苗:是/否
狂犬病病毒中和抗体滴度/方法:
10天观察结果(如相关):
治疗细节
1. 是否用水/肥皂/抗病毒剂清洗伤口:是/否
狂犬病免疫球蛋白
治疗日期: 诊所/医院名称:
地点:
狂犬病免疫球蛋白类型:人免疫球蛋白/马免疫球蛋白/单克隆抗体
免疫球蛋白名称:
制造商(批号/有效期):
患者体重: 剂量(IU):
伤口内及周围浸润的总体积(mL):
2. 暴露前或暴露后预防用狂犬病疫苗接种
2.1 暴露前接种方案:
■ 一周双部位皮内注射:第0天和第7天
■ 一周单部位肌内注射:第0天和第7天
2.2 改进的暴露后接种方案(针对之前曾接种过的患者*):
■ 三天双部位皮内注射:第0天和第3天
■ 三天单部位肌内注射:第0天和第3天
■ 单日四部位皮内注射:第0天
2.3 暴露后接种方案(针对之前未曾接种过的患者*):
■ 一周双部位皮内注射:第0天、第3天和第7天
■ 两周单部位肌内注射:第0天、第3天和第7天,然后第14天~第28天之间
■ 三周肌内注射:第0天(双部位)、第7天(单部位)和第21天(单部位)
■ 其他(具体说明)
* 接受过至少两次肌肉内或皮内狂犬病疫苗接种的人,无论属于暴露前还是暴露后预防,都可视为曾经接种了狂犬病疫苗。
暴露前或暴露后预防接种记录
| 接种后天数 | 第0天 | 第3天 | 第7天 | 第14天 | 第21天 | 第28天 |
| 接种后天数 | ||||||
| 疫苗接种中心/地点 | ||||||
| 疫苗类型/名称 | ||||||
| 制造商(批号)/有效期 | ||||||
| 剂量(mL) | ||||||
| 注射途径(皮内或肌内) | ||||||
| 接种部位 | ||||||
| 不良事件(如有) | ||||||
| 狂犬病病毒中和抗体滴度/方法 | ||||||
| 医师签名 |
备注(如有):
| 疫苗株 | 产品名称(商品名) | 公式计算 | 疫苗瓶尺寸 | 公司 | 国家 |
| SPBN- GASGAS | IDT
Biologika |
RABV | 3号 | 反向遗传与定点诱变株 | 批准用于野生动物 |
| ERA G333 | Prokov | RABV | 3号 | 反向遗传与定点诱变株 | 批准用于野生动物 |
| SAG2* | Virbac | RABV | 2号 | 单克隆选择突变体 | 批准用于野生动物 |
| SAD B19 | IDT
Biologika |
RABV | 1号 | 系列株(体内/体外传代) | 批准用于野生动物 |
| SAD Bern | Bioveta | RABV | 1号 | 系列株(体内/体外传代) | 批准用于野生动物 |
| RB-97 | FGBI “ARRAIH” | RABV | 1号 | 系列株(体内/体外传代) | 批准用于野生动物 |
| VRC-RZ2 | 无信息 | RABV | 1号 | 系列株(体内/体外传代) | 无信息 |
| KMIEV-94 | 无信息 | RABV | 1号 | 系列株(体内/体外传代) | 无信息 |
| V-RG* | Merial | 痘苗病毒 | 重组体,表达狂犬病病毒糖蛋白 | 批准用于野生动物 | |
| AdRG1.3 | Artemis Technologies | 腺病毒 | 重组体,表达狂犬病病毒糖蛋白 | 批准用于野生动物 |
疑似狂犬病
采访人姓名: 采访日期:– –/– –/– – – –
死者姓名:
州/省: 城市/地点:
街道:
GPS坐标: /
I. 受访人信息
1.1 主受访人姓名
1.2 联系方式
州/省: 城市/地点:
街道:
GPS坐标:/ /
1.3 主受访人年龄 (岁)
1.4 向主受访人询问的问题:
你和XXX(死者姓名)的关系?
■ 父母
■ 配偶
■ 兄弟姐妹
■ 儿女
■ 女婿或儿媳
■ 岳父或岳母
■ 朋友或邻居
■ 社区领导
■ 医护工作者(如是,请说出机构名称):
■ 其他(具体说明)
II. 患者信息
2.个人资料
2.1 死者原籍:
2.2 民族(选填)
2.3 国籍(选填)
2.4 性别
2.5 年龄(岁) 未知
2.5.1 如为婴儿,则年龄按实际填写:月 周 天
2.6 职业
2.7 教育水平
■ 文盲
■ 小学以下
■ 小学或初中
■ 高中
■ 大学毕业
■ 研究生
■ 博士
■ 其他(请具体说明)
■ 未知
III.暴露情况(患病前12个月内)
3.1 在病人患病前的12个月内,是否有任何家庭宠物或牲畜死亡?
■ 是(动物死亡日期:– –/– –/– – – –)
■ 否
■ 未知
3.2 在致死疾病发生前的12个月内,XXX[死者的名字]是否与动物有任何接触(咬、抓挠、舔)?
■ 否
■ 是
■ 未知
3.3 如是,请描述动物接触事件
| 动物1 | 动物2 | 动物3 | |
|---|---|---|---|
| 3.3.1 死者于哪一天与这种动物有接触? | – –/– –/– – – – | – –/– –/– – – – | – –/– –/– – – – |
| 3.3.2 接触的是哪种类型的动物? | – 犬
– 猫 – 蝙蝠 – 牲畜 – 其他: |
–犬
–猫 –蝙蝠 –牲畜 –其他: |
–犬
–猫 –蝙蝠 –牲畜 –其他: |
| 3.3.3 该动物属于谁? | – 死者
– 社区 – 流浪动物 – 野生动物 – 未知 |
–死者
–社区 –流浪动物 –野生动物 –未知 |
–死者
–社区 –流浪动物 –野生动物 –未知 |
| 3.3.4 该动物是否有任何疾病的迹象(如有请描述)? | □是 □否 □未知 | □是□否□未知 | □是□否□未知 |
| – 攻击性
– 瘫痪 – 咬人 – 唾液分泌过多 – 嗜睡 – 其他: |
–攻击性
–瘫痪 –咬人 –唾液分泌过多 –嗜睡 –其他: |
–攻击性
–瘫痪 –咬人 –唾液分泌过多 –嗜睡 –其他: |
|
| 3.3.5该动物至今是否存活?(如否,大概的死亡日期是哪天?) | □是□否□未知 | □是□否□未知 | □是□否□未知 |
| – –/– –/– – – – | – –/– –/– – – – | – –/– –/– – – – | |
| 3.3.6 暴露后,是否至少对动物观察10天? | – 是,动物10天后仍存活
– 是,动物在观察期间死亡 – 否 – 未知 |
–是,动物10天后仍存活
–是,动物在观察期间死亡 –否 –未知 |
–是,动物10天后仍存活
–是,动物在观察期间死亡 –否 –未知 |
| 3.3.7 是否对动物进行了狂犬病测试? | – 是,结果为阳性
– 是,结果为阴性 – 否 – 未知 |
–是,结果为阳性
–是,结果为阴性 –否 –未知 |
–是,结果为阳性
–是,结果为阴性 –否 –未知 |
| 3.3.8 死者被这种动物咬伤了吗? | □是 □否 □未知
咬伤部位: – 头 – 躯干 – 上肢 – 手 – 下肢 – 生殖器 – 其他: |
□是 □否 □未知
咬伤部位: –头 –躯干 –上肢 –手 –下肢 –生殖器 –其他: |
□是 □否 □未知
咬伤部位: –头 –躯干 –上肢 –手 –下肢 –生殖器 –其他: |
| 3.3.9 死者是否与动物有其他接触(如舔、抓)? | – 有抓伤
– 唾液与开放性伤口或粘膜接触 – 神经组织与开放性伤口或粘膜接触 – 其他: |
–有抓伤
–唾液与开放性伤口或粘膜接触 –神经组织与开放性伤口或粘膜接触 –其他: |
–有抓伤
–唾液与开放性伤口或粘膜接触 –神经组织与开放性伤口或粘膜接触 –其他: |
| 3.3.10 患者因这种接触接受了什么治疗? | – 清洗伤口
– 就医 – 接种狂犬病疫苗 |
–清洗伤口
–就医 –接种狂犬病疫苗 |
–清洗伤口
–就医 –接种狂犬病疫苗 |
注:
4.狂犬病治疗
4.1 XXX[死者的姓名]有否因上述任何暴露而接受治疗?
■ 是
■ 否
■ 不清楚
4.2 暴露后在家接受过以下处理吗?
■ 清洗伤口
■ 服用非处方药
■ 服用传统药物
■ 其他:
■ 无
■ 未知
4.3 XXX[死者的姓名]因上述任何暴露曾前往何处治疗?
| 传统医师 | 执业医师 | 其他: | |
| 设施名称 | |||
| 设施位置 | |||
| 就医日期 | 1:– –/– –/– – – –
2:– –/– –/– – – – 3:– –/– –/– – – – |
1:– –/– –/– – – –
2:– –/– –/– – – – 3:– –/– –/– – – – |
1:– –/– –/– – – –
2:– –/– –/– – – – 3:– –/– –/– – – – |
| – 抗生素
– 破伤风 – 清洗伤口 – 狂犬病暴露后预防或治疗 – 传统药物 – 其他(具体说明): |
–抗生素
–破伤风 –清洗伤口 –狂犬病暴露后预防或治疗 –传统药物 –其他(具体说明): |
–抗生素
–破伤风 –清洗伤口 –狂犬病暴露后预防或治疗 –传统药物 –其他(具体说明): |
4.4 如果患者曾接受过狂犬病疫苗接种,请写出疫苗类型和接种日期:
■ 神经组织疫苗
■ 注射次数
■ 开始日期:– –/– –/– – – –
■ 系列接种是否完成? 是 否 不清楚
■ 如是,请写出接种结束日期:– –/– –/– – – –
■ 神经组织疫苗
■ 细胞培养疫苗
■ 注射次数
■ 开始日期:– –/– –/– – – –
| CCV | RIG | 疫苗1 | 疫苗2 | 疫苗3 | 疫苗4 | 疫苗5 |
| 接种剂量? | –是
–否 –未知 |
–是
–否 –未知 |
–是
–否 –未知 |
–是
–否 –未知 |
–是
–否 –未知 |
–是
–否 –未知 |
| 接种日期? |
4.5 在暴露之前,患者是否接种过狂犬病疫苗?
■ 是:接种年:– –/– –/– – – –
■ 否
■ 未知
5. 体征和症状
5.1 狂犬病发作和死亡的时间
采访者:我想问你一些关于XXX[死者姓名]的问题,有关其在患病前3个月和发病期间的活动。
5.1.1 死者从何时开始患上该致死疾病?
日 – – 月 – – 年 – – – – 未知
5.1.2 如果你不记得确切的日期,大约是多久前开始患病的?
日 – – 月 – – 年 – – – – 未知
5.1.3 XXX[死者姓名]患病多少天后死亡?
天数(大约天数):
5.2 患病期间,XXX[死者姓名]有否寻求医疗救助?
■ 是:(日期):– –/– –/– – – –
■ 否
■ 未知
5.3 患病期间,XXX[死者姓名]可曾住院?
■ 是:(日期):– –/– –/– – – –
■ 否
■ 未知
5.4 该致死疾病的特征
—
5.5 是否进行了相关的诊断测试?
| 疾病 | 测试 | 日期 | 结果 | 备注 |
| 脑炎 | 腰椎穿刺血细胞计数 | 白细胞计数: | ||
| 狂犬病 | 直接荧光抗体试验(DFA)或直接快速免疫组化试验(DRIT) | |||
| 蚊媒脑炎 | ||||
| 单纯疱疹病毒 | ||||
| 带状疱疹脑炎 | ||||
| 肠道病毒 | ||||
| 麻疹病毒 | ||||
| 细菌性脑膜炎 | ||||
| 疟疾 | ||||
| 弓形虫病 |
5.6 死亡日期
5.6.1 XXX[死者姓名]的死亡日期是哪天? 日– – /月 – – /年 – – – –
5.6.2 死亡地点?
■ 家
■ 医院(请说明)
■ 其他医疗设施(请说明)
■ 其他(具体说明)
5.6.3 在过去12个月内,社区中是否有其他人患上了类似XXX[死者姓名]的疾病?(如答案为“是”,采访人应收集其他疑似病例的联系信息,并对其他病例进行口头尸检。)
■ 是
■ 否
■ 未知
若有,请详细说明:
6. 验尸信息
6.1 能否提供验尸报告(如有):
■ 是
■ 否
■ 未知
6.2 能否提供死亡证明?
■ 是
■ 否
■ 未知
6.3 XXX[死者姓名]身上有任何近期受伤的迹象吗?
■ 是
■ 否
■ 未知
6.4 XXX[死者姓名]身上有任何伤口愈合的迹象吗?
■ 是
■ 否
■ 未知
接触调查
收集疑似狂犬病人症状发作前14天直至死亡这一期间接触的任何家庭成员、社区成员或医院工作人员的姓名和联系信息。
收集与疑似传播狂犬病的动物有接触者的姓名和联系信息。
应同时对这些人进行风险评估,以排除潜在的风险。
指导调查员确定人类狂犬病可能性的信息
人类狂犬病暴露
可能暴露:在狂犬病易感区与狂犬病易感动物有过密切接触(通常被咬伤或抓伤)的人(问题3.2)。
极可能暴露:在狂犬病易感区与动物有过密切接触(通常被咬伤或抓伤)的人,且在暴露时或暴露后10天内,该动物显示出符合狂犬病的临床症状(问题3.3.4、3.3.5、3.3.6)。
确定暴露:与实验室确认的狂犬病动物有密切接触(通常被咬伤或抓伤)的人(问题3.3.7)。
| 人类临床病例定义:
患者出现发热(问题5.4.3);以及两种或多种符合狂犬病的临床症状(问题5.4.5、5.4.6、5.4.7、5.4.8、5.4.9、5.4.10、5.4.11、5.4.12、5.4.14、5.4.15、5.4.16、5.4.17);之前没有接种过狂犬病疫苗(问题4.4和4.5);症状出现后21天内患者死亡(问题5.1.3);没有符合其他疾病诊断的实验室发现(问题5.5)。 或 患者医疗记录中包含狂犬病诊断(问题5.5)。 或 患者的死亡证明将狂犬病列为死亡原因或导致死亡的重要因素(问题6.1和6.2)。 |
人类狂犬病的分类
非病例:不符合临床定义
疑似病例:符合人类临床病例定义的病例
极可能病例:疑似或确认暴露于狂犬病的疑似病例
确定病例:实验室确认为狂犬病的疑似或极可能病例
病例类型确定
调查员姓名、当地信息提供者签名和描述
1.
2.
3.
4.
作为狂犬病证据的附加页(描述)
1. (页数 )
2. (页数 )
3. (页数 )
4. (页数 )
咬伤告知日期:_ _/ _ _/_ _ _ _ 姓名:
动物证件号:| || || || || || |
| 告知 | ||
| 1. 报告人:□ 监督单位 | ||
| 医护联系人姓名:
电话号码: 患者姓名: 年龄: 电话号码: |
||
| □ 卫生部:
□ 医院: □ 兽医代理: □ 兽医 □ 公众 2. 报告原因: □ 人体暴露(咬伤或抓伤) □ 带病动物 □ 车祸 □ 其他 3. 动物类型:□ 犬 □ 猫 □ 山羊 □ 猪 □ 猫鼬 □其他 4. 该动物的归属:□ 家养 □流浪 □ 未知 5. 暴露地点:地区 社区 街道 注: |
171 | |
调查 |
| 6. 调查日期:_ _/ _ _/_ _ _ _
7.调查类型? 电话咨询 亲自调查 8.有多少人被该动物咬了? ______________ 有多少人被该动物抓伤了? ______________ 9.有多少人开始接种狂犬病疫苗? _________多少人接受了医生治疗? __________ 10.有没有其他动物被该动物咬了?数量? 犬_____ 猫_____ 山羊 _____ 其他_____ 11.找到该动物了吗? 是 仍存活 未捕获 被主人杀死 被公众杀死 被车撞死 自然死亡 未知原因死亡 否 未找到 被主人杀死 被公众杀死 被车撞死 自然死亡 未知原因死亡 12.找到该动物的地点?部门/社区__________________ GPS坐标:____________/___________ 13.该动物年龄? 幼崽 小崽 成年 老年 未知 14.该动物的性别? 公 母 15.该动物可曾接种过狂犬病疫苗? 是,接种年份:_________ 否 未知 注: |
| 动物评估 | |
| 16. 疾病体征: □ 攻击性 □ 好撕咬 □ 唾液分泌过多 □ 瘫痪
□ 嗜睡 □ 未知□ 其他(请说明) 17.狂犬病评估: □ 健康 □ 患病,出现狂犬病体征 □ 患病,非狂犬病 □ 死亡 □ 其他(请说明) 18. 评估决策: □ 隔离 □ 安乐死 □ 死亡 □ 其他_____________________ |
|
| □ 安乐死□ 其他原因死亡□ 其他 __________
□ 被主人杀死 □ 被社区杀死 |
|
| 19. 隔离观察结果: □ 14天后健康
20. 有否将该动物送去检测? □ 是,日期: □ 否 注: 第5天随访: 第10天随访: |
|
| 实验室 |
| 21. 实验室收到标本的日期:______________
22.实验室注册号:______________ 23. 试验日期:______________ 24. 试验结果: 阳性 阴性 无定论 |
已通知医院,日期:_ _/ _ _/_ _ _ _
已通知卫生部,日期:_ _/ _ _/_ _ _ _
| 年 | 人类狂犬病 | 动物狂犬病 | ||||||||||
| 人类狂犬病 | 咬伤病例 | 暴露后预防 | 狂犬病病例 | 犬只数量 | 备注 | |||||||
| 案例数a | 犬咬伤案例数 | 其他动物咬伤案例数b | 接受PEP人数 | 除PEP还接受了RIG的人数 | 犬中病例数量 | 其他动物中病例数量b | 国家犬总数 | 已接种疫苗的犬数量 | ||||
| II类 | III类 | 未知类 | ||||||||||
| 2016 | ||||||||||||
| 2015 | ||||||||||||
| 2014 | ||||||||||||
| 2013 | ||||||||||||
| 2012 | ||||||||||||
| 来源c | ||||||||||||
PEP,暴露后预防;RIG,狂犬病免疫球蛋白
a 应包括实验室确认和临床诊断
b 仅限哺乳动物;请在备注栏中注明物种。
c 指出每项指标的数据源(例如卫生部、国家统计局、国家健康报告或估计数)
这一档案模板旨在帮助国家狂犬病项目管理人员准备一份提交至WHO的档案及相关证据,以提请WHO确认该国是否已消灭狂犬病这一公共健康问题,和/或提请WHO确认该国是否已消灭由犬传播的狂犬病。该档案中提供的信息包括流行病学证据和更广泛的背景,以帮助审查人员了解消灭疾病的方案。
(国家)
提交日期:
审核日期:
1. 背景
在某一狂犬病曾经肆虐的国家,已至少2年(24个月)没有人死于犬传播的狂犬病,且正在运行并维护一个适当的狂犬病监测和报告系统,并证明了人类和动物群体狂犬病防控计划的有效实施,则可以申请认证为已经消灭了狂犬病这一公共健康问题(确认)。
如果该国除满足上述确认标准外,还运行并维护一个增强版的狂犬病监测和报告系统,并证明了犬介导的狂犬病防控战略的有效实施,则该国可以申请认证为已经消灭了犬介导的狂犬病(验证)。
1.1 一般文件(可选)
应提供充分的文件,为确认和验证提供必要的数据。这些数据和后续文件最好在同一区域内的国家之间标准化。
为便于确认和验证,应提供以下概述:
a. 该国的人口和经济特点
b. 该国医疗系统概况
c. 该国动物卫生系统概述
d. 该国过去狂犬病流行病学的信息,包括当前国家狂犬病防控计划实施之前的干预措施
为便于验证,还应提供以下概述:
a. 暴露后预防程序
b. 人类和动物病例的临床和实验室诊断程序
c. 如验证完成,可提供人类狂犬病零死亡的证据(例如用于确认的提交文件)
2. 狂犬病防控计划概述(必须提交)
为便于确认,应以叙述形式描述:
a. 国家狂犬病防控计划的证据,包括:
i. 与狂犬病相关的监管框架,包括狂犬病通告
ii. 国家狂犬病控制战略,包括执行情况、按部门划分的责任、战略结构和制定时间
iii. 数据收集和管理系统
b. 防控活动到位的证据,包括:
i. PEP在该国的提供情况和可获得性
ii. 狂犬病普及和预防犬咬伤iii. 犬类疫苗接种活动概况
iv. 关于现有犬只数量管理措施的信息,包括关于犬只流动的规定
v. 世界动物卫生组织为犬介导的狂犬病官方控制计划开立的证明[1](如有)
为便于验证,应以叙述形式描述:
a. 对于之前曾流行狂犬病的国家,有证据表明大规模犬只疫苗接种计划控制了狂犬病,即:
i. 过去5年犬只疫苗接种计划的概述,包括在高危地区实施大规模犬只疫苗接种计划,或者其他成功控制犬只狂犬病的证据
ii. 犬只的估计总数量、覆盖范围和数量的估计方法
b. 现行犬只数量管理措施的信息;表明国家控制计划已成功控制狂犬病的证据
iii. 对于近年有狂犬病流行史的国家来说,狂犬病发生率至少在5年内有所下降
iv. 世界动物卫生组织对该国成功消灭狂犬病的自行宣告(如有)(http://www.oie.int/index.php?id=169&L=0&htmfile=chapitre_selfdeclaration.htm)(可选)
3. 国家狂犬病防控战略的实施
3.1 控制活动的证据(必须提供)
为便于确认和验证,应以叙述形式描述:
■ 暴露后预防在该国的提供情况和可获得性,包括:
– 可用疫苗和狂犬病免疫球蛋白类型及地方分布机制
– 具有暴露后预防能力(仅提供疫苗和既提供疫苗也提供狂犬病免疫球蛋白)的动物咬伤治疗或初级医疗中心的数量和比例
– 暴露后预防管理的标准操作程序
– 每年使用的疫苗和狂犬病免疫球蛋白剂量数
– 暴露后肌肉内或皮内给药的预防途径比例
– 暴露后预防支付系统
■ 狂犬病普及和犬咬伤预防运动的数量和地理覆盖程度
■ 过去5年内的犬只疫苗接种计划,包括:
– 每年接种疫苗的犬的数量,按适当的行政区划划分
– 每年疫苗接种计划覆盖程度,按适当的行政区划划分
– 该国估计犬只总数
– 疫苗接种目标动物种群
- 使用的疫苗类型
– 疫苗来源
– 当前疫苗储量
■ 犬只数量管理,包括关于犬只流动的规定。
为便于验证,还应描述:
■ 至少在5年内评估犬只疫苗接种覆盖率和种群规模的方法。
■ 引入或再次出现犬介导的狂犬病时,可实施的应急准备和反应计划。
3.2 狂犬病监测系统信息(必须提交)
为便于确认和验证,应描述:
a. 证明有充分的狂犬病监测系统来检测狂犬病死亡情况,包括:
i. 人类和动物狂犬病病例全国通告体系
ii. 用WHO/OIE推荐的标准诊断测试诊断狂犬病病例的能力
iii. 该国地方病和邻近地区(无狂犬病地区)提交样本的证据,包括显示阳性和阴性检测结果的地图,以评估监测系统的覆盖面和可能的监测间隙
iv. 每年发现的疑似或可能的人类狂犬病病例、或可能的狂犬病暴露数量、以及调查的性质(包括临床和实验室诊断、口头尸检调查、社区调查、追溯调查)
v. 每年每100000人中急性脑炎症候群(AES)[2]发生率,并描述用于检测、报告和调查全国各地人类急性脑炎病例的监测系统;或者
vi. 如果无法获得AES数据,或者数据有很多遗漏,则提供能证明监测系统能够检测、报告和调查来自全国所有地区的疑似人类狂犬病病例的证据
vii. 根据世界动物卫生组织陆生动物卫生法典对动物进行的狂犬病监测(第1.4章:http://www.oie.int/index.php?id=169&L=0&htmfile=chapitre_surveillance_general.htm),包括:
– 犬和其他动物的狂犬病病例数(经临床和实验室确认)
– 每年在人类和动物中发生的犬和其他疑似狂犬病动物咬伤事件的数量
– 对疑似或极可能的狂犬病病例进行常规流行病学调查的次数,包括从疑似病例中快速收集样本并运送到实验室进行诊断的程序
– 所用抽样方法
– 监测犬只疫苗接种覆盖率的方法
为便于验证,还应描述:
b. 任何能证明在最近一次检测到狂犬病病例后,增强版狂犬病犬只监测系统已经实施了至少24个月的证据,包括:
i. 卫生设施对极可能暴露案例作出的风险评估
– 已报道的极可能暴露案例的数量(以及启动的暴露后预防程序数)
– 任何输入病例的警告数量和早期检测数量
ii. 对极可能暴露案例迅速开展的流行病学调查(临床症状出现后的14天内)和调查结果,包括:
– 已报道的极可能患有狂犬病的动物数量
– 对所有已死亡或被杀的疑似狂犬病动物的采样和试验
预计可以从大约50%的疑似狂犬病动物中采集样本。所有在10天观察期内未能存活的动物均应接受测试
– 如为确定的人或动物狂犬病病例,则说明病毒分离株的分子特征(如可获得)(可通过该分子特征确定该病例属于野生动物变异株感染、蝙蝠丽沙病毒属感染还是外来感染)。
3.3维持确认和/或验证的程序(必须提交)
为便于确认和验证,应以叙述形式描述:
a. 确认后和/或验证后狂犬病监测计划,包括:
i. 持续监测的程序和证据;进行持续监测以确保尽早发现任何输入病例,并对暴露于非犬类狂犬病变异体或丽莎病毒属的人或旅行中被咬的人进行适当治疗
b. 持续提供人类暴露后预防的计划
c. 防止狂犬病从邻国再次传入的跨境计划
为便于验证,还应描述:
a. 世界动物卫生组织对该国已消灭犬介导的狂犬病病毒感染的自行宣告(参见世界动物卫生组织陆生动物卫生法典第1.6章:http://www.oie.int/index.php?id=169&L=0&htmfile=chapitre_selfdeclaration.htm)。
b. 证明有能有效应对狂犬病境外引入的应急计划的证据
i. 动物流动规定
ii. 定期风险评估
– 对来自其他国家/地区病毒入侵的风险评估
– 对其他野生动物狂犬病变异体/丽莎病毒属传播的风险评估
iii. 疫情应对策略,包括在疫情爆发时持续获得犬只疫苗和暴露后预防措施的证据
4. 资源和伙伴关系(可选)
为便于确认和验证,请提供:
a. 简要描述执行该方案所用的人力资源
b. 随着时间的推移,估计用于该方案的内部和外部财政资源
c. 确认/验证后阶段的可持续资源调动战略
5. 特殊事项(可选)
为便于确认和验证,请提供以下内容:
a. 对影响该方案的任何特殊情况的描述。这些特殊情况包括但不限于:
i. 该国的国家稳定或安全问题;和/或
ii. 狂犬病从其他狂犬病流行国家的重新引入。
b. 描述狂犬病病例调查的具体工作和/或对偏远人群(例如游牧民族、境内流离失所者或难民)的干预覆盖面。
6. 参考文献目录(必须提交)
编写档案时所有数据源的参考书目,包括:
■ 卫生部记录
■ 兽医机构记录
■ 相关出版物(包括科研、政策方面的出版物等)
■ 学术报告和论文
WHO可能要求提供未出版文献的副本。
7. 缩略语(必须提交)
该档案中使用的所有缩略语及其定义列表。
附录15 狂犬病、神经病毒学、病毒性人畜共患病和人畜共患病控制WHO合作中心
WHO狂犬病参考和研究合作中心(法国);地址:Institut Pasteur, 28 rue du Docteur Roux, 75724 Paris, France
负责人:Hervé Bourhy博士;电邮:herve.bourhy@pasteur.fr
WHO人畜共患病控制研究和管理合作中心(法国)地址:Laboratory of Rabies and Wild Animals of Nancy, Agricultural and Veterinary Technopole, PO 40009, 54220 Malzéville, France
负责人:Florence Cliquet博士;电邮:florence.cliquet@anses.fr
WHO狂犬病和狂犬病相关病毒特征鉴定合作中心(英国),地址:Animal Health and Veterinary Laboratories Agency, Weybridge, Surrey KT15 3NB, United Kingdom
负责人:Anthony Fooks博士;电邮:tony.fooks@apha.gsi.gov.uk
WHO狂犬病监测和研究合作中心(德国),地址:Friedrich-Loeffler Institut, Federal Research Institute for Animal Health, Sudufer 10, 17493 Greifswald- Insel Reims, Germany
负责人:Thomas Müller博士;电邮:thomas.mueller@fli.bund.de
WHO旅行者健康合作中心(瑞士),地址:University of Zurich, Hirschengraben 84, 8001 Zurich, Switzerland
负责人:Christoph Hatz博士,电邮:christoph.hatz@unibas.ch
WHO食肉动物狂犬病控制和流行病学合作中心(加拿大),地址:Canadian Food Inspection Agency, 3851 Fallowfield Road, ON, Canada
负责人:Christine Fehlner-Gardiner博士;电邮:Christine.Fehlner-Gardiner@inspection. gc.ca
WHO神经病毒学合作中心(美国),地址:Thomas Jefferson University, 233 South 10th Street, Philadelphia, PA 19107, USA
负责人:Matthias Schnell博士;电邮:matthias.schnell@jefferson.edu
WHO狂犬病参考和研究合作中心(美国分部1),地址:Wistar Institute, 3601 Spruce Street, Philadelphia, PA 19104, USA
负责人:Hildegund Ertl博士;电邮:ertl@wistar.upenn.edu
WHO狂犬病参考和研究合作中心(美国分部2),地址:Centers for Disease Control and Prevention, 1600 Clifton Road, Atlanta, GA 30333, USA
负责人:Jesse Blanton博士;电邮:asi5@cdc.gov
WHO狂犬病合作中心(巴西),地址:Institut Pasteur of São Paulo, Av. Paulista, 393, São Paulo, Brazil
负责人:Lucianna Gomes博士/Juliana Galera Castilho博士;电邮:pasteur@pasteur.saude. sp.gov.br/jgcastilho@pasteur.saude.sp.gov.br
WHO狂犬病流行病学合作中心(印度),地址:Division of Zoonosis, National Centre for Disease Control, 22-Sham Nath, Delhi 110054, India
负责人:Mala Chabra博士;电邮:malachhabra@yahoo.co.in
WHO狂犬病参考和研究合作中心(印度),地址:Department of Neurovirology, National Institute of Mental Health and Neurosciences, PO Box 2900, 560029 Bangalore, India
负责人:V. Ravi 教授/ Reeta Mani博士;电邮:virusravi@gmail.com/ drreeta@gmail. com
WHO狂犬病发病机制和预防研究合作中心(泰国),地址:Queen Saovabha Memorial Institute, Thai Red Cross Society, 1871 Rama IV Road, 10330 Bangkok, Thailand
负责人:Visith Sitprija教授;电邮:sitprija@yahoo.com;和Pakmanee Narumol博士; 电邮:npakmanee@yahoo.com
WHO狂犬病参考和研究合作中心(伊朗),地址:Pasteur Institute of Iran, Pasteur No. 69, 1316943551, Tehran, Islamic Republic of Iran
负责人:Alireza Gholami博士;电邮:a.gholami@pasteur.ac.ir
世界卫生组织(WHO)成立于1948年,作为联合国的一个专门机构,是指导和协调国际卫生事务和公共健康的权威机构。WHO的宪章职能之一是在人类健康领域提供客观可靠的信息和建议,并通过广泛的出版计划履行其部分职责。
本组织通过其出版物支持各国的卫生战略、解决全球人口最紧迫的公共卫生问题。根据各发展阶段不同的各成员国的需求,WHO出版了实用手册、指南和针对特殊领域卫生工作者的培训材料、国际适用的准则和标准;卫生政策、卫生方案和研究项目的综述和分析;以及为决策者提供技术咨询和建议的最新共识报告。这些出版物与WHO的首要任务密切相关,这些任务包括疾病预防和控制、建立以初级卫生设施为基础的公平卫生体系以及提高个人和社区的健康水平。为实现人人享有更好的健康,还需要利用WHO所有成员国的知识和经验,以及世界领导人在公共卫生和生物医学科学方面的合作,在全球范围内传播和交流相关信息。
为确保尽可能广泛地提供关于卫生问题的权威信息和指导,WHO在全球范围内广泛发行其出版物,并鼓励各国对这些出版物进行翻译和改编。通过在全球范围内促进和保护卫生、预防和控制疾病,WHO出版物致力于实现本机构的主要目标——人人拥有尽可能高水平的健康。
WHO技术报告系列提供了各种国际专家组的调查结果,这些专家组就广泛的医疗和公共卫生主题向WHO提供了最新的科学和技术建议。上述专家组的成员并非以政府或其他机构代表的身份,而是以个人名义无偿加入专家组;他们的观点不一定反映WHO的决定或主张政策。
更多信息,请联系WHO出版社;地址:1211 Geneva 27, Switzerland;网站:www.who.int/bookorders;电话:+41 22 791 3264;传真:+41 22 791 4857;电邮:bookorders@who.int.
| 自2015年发布《到2030年消除经犬传播的人类狂犬病全球框架》以来,WHO与联合国粮食及农业组织、世界动物卫生组织、全球狂犬病控制联盟以及其他利益相关方和伙伴合作,制定了一项全球战略计划,该计划包括以国家为核心支持、增强和促进国家实体控制和消除狂犬病。
在这一背景下,WHO召集了其狂犬病合作中心成员、专门机构、WHO狂犬病咨询专家组成员、狂犬病专家及相关合作伙伴审查狂犬病防控战略和技术指导,以支持国家和区域方案的实施。 本报告基于狂犬病预防、控制和消除等多方面的证据和方案实施经验,为狂犬病防控提供了最新指导。相比上一版,主要更新内容有:(i)狂犬病监测战略,包括监测系统的跨部门联系和适当的诊断法;(ii)对人和动物免疫的最新建议;(iii)低资源环境中的姑息治疗;(iv)用于指导咬伤者治疗的风险评估;以及(v)用于确认和验证某国是否达到狂犬病零死亡率的建议程序。 该磋商会支持WHO免疫接种战略咨询专家组于2017年10月认可的建议,以使所有人、尤其是医疗条件匮乏地区的人群能获得负担得起的狂犬病生物制剂,并根据全民健康覆盖的目标增加狂犬病消除计划的可行性。 预防狂犬病所需的合作机制是利益相关方在所有层面为实现“唯一健康”而采用的合作模式,也是成功的秘诀。 狂犬病是一种可通过疫苗预防的疾病。向各国提供支持将结束狂犬病给人们特别是儿童带来的痛苦。在狂犬病控制和消除方面的投资将增强卫生体系的职能、提高公平性、增加公众获得医疗卫生条件的机会,并有助于可持续发展。对狂犬病消除的投资不仅仅是为了消灭这种致命但可预防的疾病,也是为了在全球很少受到关注的地区建立起狂犬病防控能力。 应各国的要求,本报告提供了实践指导,以推动狂犬病的消除。 |
- 世界动物卫生组织正在制定犬介导的狂犬病控制计划的批准程序,预计将于2019年生效。 ↑
- 急性脑炎症候群(AES)的临床定义是:任何年龄段人群在一年中的任何时候出现的一种综合征,包括急性发热和以下症状中的至少一种:(a)精神状态的改变(包括思绪混乱、失去方向感、昏迷或不能说话等症状);(b)癫痫新发(不包括单纯的高热惊厥)。其他早期的临床表现可能包括易怒、嗜睡或其他比一般发热性疾病更为严重的异常表现。将参考预期水平评估急性脑炎症候群的发病率。 ↑



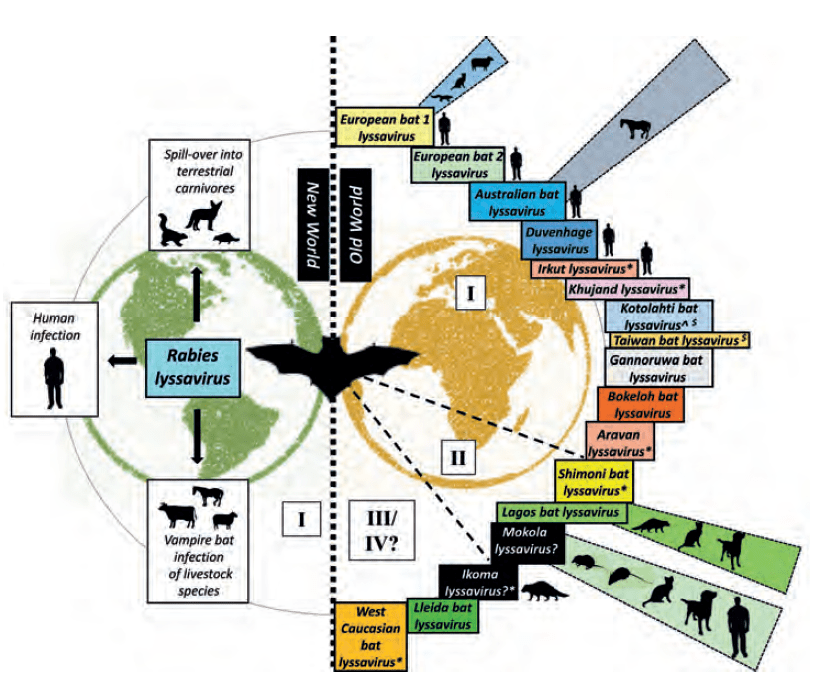
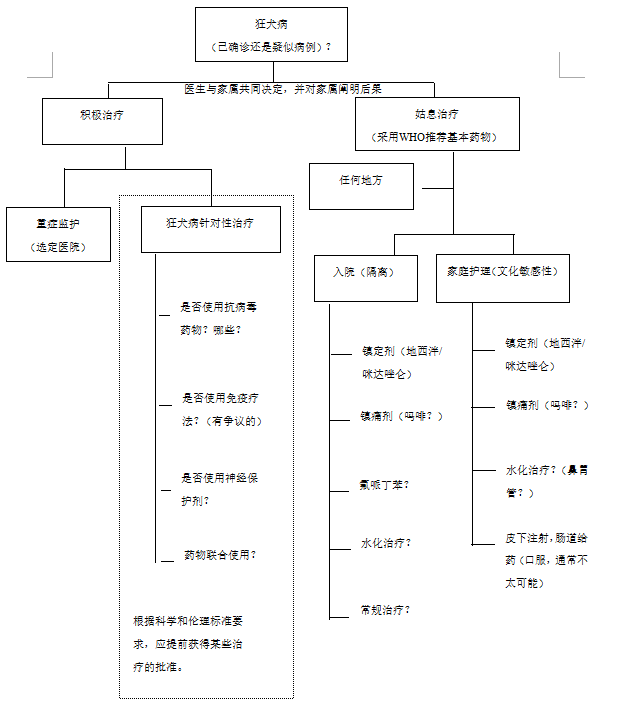
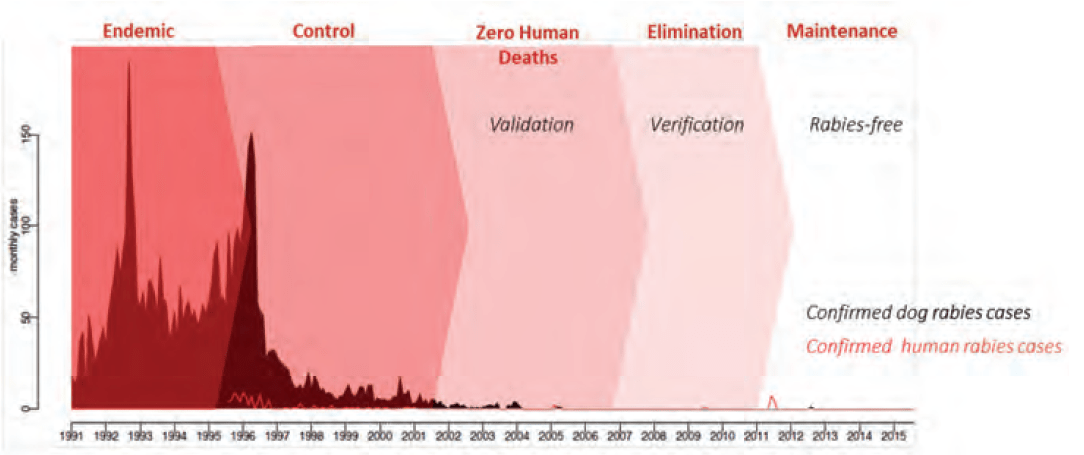




This is the right weblog for wishes to be made aware of this topic. You realize so much its practically hard to argue along with you (not that I actually would want…HaHa). You actually put the latest spin with a topic thats been discussing for years. Excellent stuff, just fantastic!
I came across your own weblog internet site on the internet and appearance a couple of of your earlier posts. Still keep in the really very good operate. I just additional up your Feed to my MSN Information Reader. Seeking toward reading through much more of your stuff afterwards!?–
There are some fascinating points in time in this write-up but I do not know if I see all of them center to heart. There is some validity but I will take hold opinion until I look into it further. Excellent write-up , thanks and we want a lot more! Added to FeedBurner too
I visited a lot of website but I conceive this one holds something extra in it in it
I am also commenting to let you understand of the useful experience our princess encountered viewing your web page. She came to understand a wide variety of details, most notably what it’s like to possess a marvelous teaching nature to have the mediocre ones with ease learn about specific impossible issues. You undoubtedly surpassed her desires. Thank you for providing those warm and friendly, trusted, informative and even unique tips on the topic to Tanya.
*very nice post, i certainly love this website, keep on it
french translation is kind of hard at first but if you get used to it, then it is easy’
I’ve read a few excellent stuff here. Certainly value bookmarking for revisiting. I wonder how a lot attempt you place to make one of these great informative web site.
ok
Thanks – Enjoyed this post, can you make it so I receive an email when you make a fresh post? From Online Shopping Greek
hello!,I love your writing very much! percentage we keep in touch more about your article on AOL? I need a specialist on this space to resolve my problem. May be that’s you! Looking forward to see you.
Cool blog. Maybe i can help you in writing fresh content, are you interested ?
Very superb information can be found on website .
I am not afraid to find this but this is just insane.
I have been reading out some of your articles and i must say nice stuff. I will definitely bookmark your blog.
Thanks
Attractive portion of content. I simply stumbled upon your weblog and in accession capital to assert that I get in fact loved account your weblog posts. Anyway I will be subscribing to your augment and even I success you get admission to constantly quickly.
Thnaks
Just wish to say your article is as surprising. The clearness in your post is just cool and i can assume you are an expert on this subject. Fine with your permission let me to grab your RSS feed to keep updated with forthcoming post. Thanks a million and please keep up the rewarding work.
Thanks
I wanted to thank you a lot more for this amazing web-site you have created here. It truly is full of useful tips for those who are genuinely interested in this subject, specifically this very post. Your all actually sweet plus thoughtful of others as well as reading your site posts is a wonderful delight in my experience. And what a generous reward! Mary and I will certainly have fun making use of your guidelines in what we must do in a few weeks. Our checklist is a mile long which means that your tips might be put to great use.
Thanks
What would be your next topic next week on your blog.”\”–,
There are extremely lots of details that adheres to that to consider. That is the wonderful point to raise up. I provde the thoughts above as general inspiration but clearly you will find questions like the one you raise up where most important factor is going to be in the honest good faith. I don?t determine if best practices have emerged around things like that, but More than likely your job is clearly defined as an affordable game. Both kids feel the impact of merely a moment’s pleasure, through out their lives.
I conceive this site has very fantastic pent subject material blog posts.
Hey! Great post! Please inform us when I will see a follow up!
Youre so cool! I dont suppose Ive read anything like this before. So nice to find somebody with original thoughts on this subject. realy i appreciate you for beginning this up. this site is one area that is required on the internet, an individual after some originality. useful job for bringing new stuff to your net!
It’s perfect time to make some plans for the future and it is time to be happy. I’ve read this post and if I could I desire to suggest you few interesting things or suggestions. Perhaps you could write next articles referring to this article. I wish to read even more things about it!
Thanks
You have observed very interesting details! ps nice web site.
Preferably, when you gain knowledge, are you able to mind updating your website with an increase of information? It is very ideal for me.
i would like to buy wireless speakers but what is the best brand?;
Hello there, I adore your blog. Is there some thing I can do to obtain updates like a subscription or some thing? I am sorry I am not acquainted with RSS?
Yes
omg! can’t imagine how fast time pass, after August, ber months time already and Setempber is the first Christmas season in my place, I really love it!
I precisely wanted to thank you very much yet again. I’m not certain the things I would’ve implemented in the absence of the entire creative ideas revealed by you about such subject matter. This has been a real intimidating scenario in my view, however , understanding this specialized strategy you handled that took me to cry over joy. I’m just grateful for the assistance as well as hope that you realize what an amazing job you have been putting in educating men and women using your website. I know that you have never come across all of us.
孟博士您好,已转发疫苗网文章,想请教您,我2023年10月1日和5日打过狂犬疫苗加强针,昨天被流浪猫抓破了手,有出血,离上次加强针刚过了半年,今年2月25日在河南中抗测过抗体,20.95,这次需要再次打加强针吗?因为在手上,又有出血,所以比较担心,盼望您的回复,祝您工作顺利!万事如意!
安全,可以不用再打。
you can also give your baby some antibacterial baby socks to ensure that your baby is always clean`
I like this weblog so much, saved to fav.
This can be a well written article, if only all bloggers offered the same value of content as you, the internet would be a far better place. Please keep it up!
Thanks
When I originally commented I clicked the -Notify me when new surveys are added- checkbox and from now on whenever a comment is added I am four emails sticking with the same comment. Perhaps there is any way you can get rid of me from that service? Thanks!
您好,孟博士。我4月4日在外面喝酒,被人咬到手,破皮有出血。第二天有用肥皂冲洗伤口,酒精也有喷。咬我的这个人也是在喝酒,应该是正常的,没恐水表现。我2024年3月份有打过狂犬疫苗加强针2针。
问题1.被人咬出血有没有传染狂犬病的风险,需要打疫苗吗?
问题2. 2024年3月份打的加强针,保护期有多久?
问题3.这次被人咬不打疫苗是否安全?多久才能确定安全?
最后祝孟博士,身体健康,万事顺心。
1.不打;
2.最后1针延长1年;
3.你已经安全
非常感谢,孟博士,百忙中抽空回复。祝孟博士身体安康,步步高升,财运亨通。
Keep up the wonderful piece of work, I read few posts on this web site and I believe that your blog is very interesting and has sets of fantastic info .
Thanks
You have a few helpful ideas! Perhaps I should think of trying to do this myself. Respectfully
Simply wanna remark that you have a very decent website , I enjoy the layout it really stands out.
Thanks
Spot on with this write-up, I truly think this web site needs far more consideration. I’ll in all probability be once more to learn way more, thanks for that info.
Currently it seems like Drupal is the top blogging platform available right now. (from what I’ve read) Is that what you’re using on your blog?
I’m not sure where you’re getting your info, but great topic. I needs to spend some time learning much more or understanding more.
OK
Regards for all your efforts that you have put in this. very interesting information.
This will be the proper blog if you hopes to discover this topic. You already know a lot its practically difficult to argue on hand (not that I actually would want…HaHa). You certainly put a whole new spin over a topic thats been written about for a long time. Wonderful stuff, just wonderful!
I like this info shown and it has given me some sort of commitment to succeed for some reason, so thank you.
Youre so cool! I dont suppose Ive read anything like this before. So nice to locate somebody with original applying for grants this subject. realy appreciation for beginning this up. this amazing site is one thing that is needed on the web, an individual if we do originality. helpful work for bringing something totally new towards web!
Thanks
eye glasses are not only stylish but they can also protect your eyes from contaminants”
Hey, your site is very interesting.. Plus it was something I’m able to definitely relate with Ill constantly stop by for your blog therefore i hope you continue making fun and interesting posts like this one…
An interesting discussion is worth comment. I believe that you must write extra on this topic, it may not be a taboo subject but generally people are not sufficient to talk on such topics. To the next. Cheers
It’s perfect time to make some plans for the longer term and it is time to be happy. I’ve learn this post and if I could I desire to counsel you some fascinating issues or tips. Perhaps you can write next articles regarding this article. I want to read more issues about it!
You ought to experience a contest for just one of the most effective blogs on the net. I am going to suggest this blog!
Thanks for helping out, superb information.
Poker-online is usually an excellent Match but it is important to educate yourself on the Suggestions.
Spot on with this write-up, I honestly believe this excellent website wants considerably more consideration. I’ll likely to end up once more to study a great deal more, thank you for that information.
Thank you for your attention.
老师,第八章呢?我没有找到
已经更新
I really like when you discuss this type of stuff inside your posts. Perhaps could you continue this?
Thank you for your attention.
I found this blog site a couple of days ago and look through a lot of of the articles, nevertheless i did not bear in mind to bookmark the web site so I’ve been seeking Couple of weeks seeking for it. Right now I finally found it once more, and this time I ensured to include a bookmark!
Thank you for your attention.
writers and follow slightly something from their store. I’d prefer to use some with the content material on my weblog whether or not you don’t mind.
When I originally commented I clicked the -Notify me when new comments are added- checkbox and already whenever a comment is added I buy four emails with similar comment. Could there be in whatever way it is possible to remove me from that service? Thanks!
Thank you for your attention.
You ought to be a part of a contest for one of the most effective blogs on the net. I’ll suggest this blog!
Thank you for your attention.
I’ve been absent for a while, but now I remember why I used to love this site. Thanks, I’ll try and check back more often. How frequently you update your website?
Thank you for your attention.
I can’t really help but admire your blog. your blog is so adorable and nice ,
Thank you for your attention.
as soon as I noticed this internet site I went on reddit to share some of the love with them.
Thank you for your attention.
You are in reality a just right webmaster. The website loading pace is incredible. It sort of feels that you know what you’re doing. Moreover the content is masterwork. You are done a magnificent process in this subject!
Thank you for your attention.
I’m really enjoying the design and layout of your site. It’s a very easy on the eyes which makes it much more pleasant for me to come here and visit more often. Did you hire out a designer to create your theme? Great work!
Thank you. I don’t have the money to hire people at present. I use my spare time to add content to the website.
孟博士好!报告的第8节是缺失的,7.6节提到第8章有关于免疫持续时间和加强针的内容,但第7章过了直接是第9章了,没有找到第8章。
谢谢提醒,我安排时间补充。
谢谢孟博士!感谢您在传染病和疫苗科普上的无私付出!提前祝您新年快乐,平安健康~
Thanks for your type info.. I realy appreciate it.. keep it up.
Poker-online is usually an excellent Match but it is important to educate yourself on the Suggestions.
Great post buddy! Enjoyed reading, is there a subscribe button so I Can subscribe and get notified of new posts?
Thank you. Let me see how to create a subscription button.
marketing online is of course a good business and also a great way to earn money online“
Thank you.
I seemed to be aware about this kind of currently, nevertheless there was clearly numerous helpful pieces that completed the image personally, thank you so much!
Thanks
Somebody Sometimes along with appointments your website on a regular basis as well as advised it if you ask me to see as well. The way of writing is fantastic and also the content is top-notch. Thanks for your insight an individual supply the visitors!
I am impressed with this site, real I am a big fan.
excellent issues altogether, you simply received brand new reader. What could you recommend about your put up that you simply made a few days in the past? Any sure?
Well, I don’t know if that is going to work for me, but definitely worked for you! Excellent post!
Thanks
It¡¦s in reality a great and useful piece of information. I¡¦m glad that you simply shared this useful info with us. Please stay us up to date like this. Thank you for sharing. rent a car pristina
Hi folks! I simply would want to provide a huge thumbs up for that terrific info you have got here with this write-up. I will be coming back again to your blog page for much more shortly.
Thanks
Oh my goodness! a wonderful article dude. Thanks a ton Nonetheless I am experiencing trouble with ur rss . Don’t know why Unable to join it. Can there be anybody obtaining identical rss issue? Anybody who knows kindly respond. Thnkx
When I originally commented I clicked the -Notify me when new surveys are added- checkbox and already when a comment is added I get four emails with the exact same comment. Will there be in any manner you can remove me from that service? Thanks!
Thanks
Howdy, i read your blog occasionally and i own a similar one and i was just curious if you get a lot of spam comments? If so how do you protect against it, any plugin or anything you can recommend? I get so much lately it’s driving me insane so any support is very much appreciated.
I got what you intend, appreciate it for posting .Woh I am delighted to find this website through google.
Thanks
After study several of the websites on your internet site now, i genuinely as if your method of blogging. I bookmarked it to my bookmark web site list and will be checking back soon. Pls have a look at my site too and tell me what you think.
Thanks
Hello! I simply would wish to supply a huge thumbs up for the wonderful info you might have here for this post. I am returning to your blog post for additional soon.
i love to collect different models of cellphones that is why i have lots of cellphones at home.,
Thanks
After study some of the websites with your web site now, and i also genuinely much like your strategy for blogging. I bookmarked it to my bookmark website list and will also be checking back soon. Pls consider my site at the same time and tell me what you think.
Thanks
Youre so cool! I dont suppose Ive read anything like that just before. So nice to discover somebody by original ideas on this subject. realy appreciation for starting this up. this web site is one thing that is needed on the web, someone with a little originality. helpful task for bringing interesting things on the web!
Thanks
I discovered your website web site on the search engines and appearance a couple of your early posts. Always keep the excellent operate. I merely extra increase Rss to my MSN News Reader. Seeking forward to reading more from you down the road!…
Thanks
I like this post, enjoyed this one thanks for putting up.
Thanks
尊敬的博士您好,我爱人打狂犬疫苗暴露前预防,本来应该0.7 .21三针,她记错了,由于当时医院也忙,就打成了0.3.21三针。
1.请问她这属于暴露前预防吗?再暴露重新打全程还是只打加强就可以?
2.我母亲被食品包装袋划出血了,她从来没有打过疫苗,但是买东西那家有流浪猫狗,经常在那堆食品那打闹玩。如果这个包装袋被它们舔过,过了五分钟把我母亲划伤了,她有感染狂犬病的风险吗。需要打狂犬疫苗吗?
谢谢您,等您的回复。
1.属于;
2.无风险,恐狂去打个暴露前也可以。
尊敬的孟博士
1,之前疾控的医生给我用狂犬蛋白+氯化钠溶液配了一小瓶,给我涂在了伤口处,后来没用完,我拿走了,当时是夏天我直接装包里了,6个小时之后我又滴在了眼睛里,我上网查蛋白必须直接用完不能分两次,我这样做会不会造成危害啊?会不会造成瓶子里的灭活狂犬病毒复活和眼睛失明?
2,昨天问您的,忘了加上有狂犬病的狗了,只说了狗,一直心神不宁。您再看一下谢谢!
要是被有狂犬病的狗咬伤了眼球,昨天打了加强针,半个月后要是测到了大于0.5的抗体,是不是眼球内和中枢神经被就没有狂犬病毒了,就绝对安全了?
1.这个应该在医院,在医生指导下使用;危害就是你一直恐狂;不会复活;
2.安全;建议看精神科医生。
“You really know your stuff… Keep up the good work!”