第27b章:轮状病毒
2015年8月
轮状病毒是包含在蛋白质胶囊内的核糖核酸(RNA)病毒。轮状病毒株根据外层蛋白VP7 (G型)和VP4 (P型)进行分类。虽然至少有15种G型和28种P型,但在人类中仅鉴定出10种G型和11种P型(Desselberger等人,2001年)。
轮状病毒传染性很强。通过粪便-口腔途径传播最为常见,尽管也可能发生呼吸传播(Glass等人,2006年)。虽然良好的卫生措施有助于防止疾病的传播,但轮状病毒的强大耐受性和感染剂量低(10-100个病毒颗粒)使得阻止病毒传播的标准卫生措施相对无效(Gray,2011)。
人类轮状病毒感染导致胃肠炎,通常持续三到八天(Glass等人,2006)。轮状病毒胃肠炎的特征是轻度发热,伴有严重腹泻、呕吐、胃痉挛,并可导致脱水。几乎所有的儿童在五岁之前都会至少有一次轮状病毒肠胃炎发作。在英格兰和威尔士,估计每年将有130,000名儿童去看他们的全科医生,并且将有大约12,700名患有轮状病毒胃肠炎的儿童住院治疗(Djuretic等人,1999;Jit & Edmunds,2007)。虽然在英国由轮状病毒引起的死亡很少,但这些数字很难准确量化:据估计,在英格兰和威尔士,每年可能有多达3到4例轮状病毒相关的死亡(Jit等人,2007)。在发展中国家,轮状病毒感染导致的死亡远比肠胃炎导致的严重腹泻和脱水更常见,肠胃炎是轮状病毒相关死亡的主要原因。
疾病的历史和流行病学
在英国,轮状病毒感染是季节性的(见图1),主要发生在冬季和早春(1月至3月)。任何年龄的人都可能感染轮状病毒,但大多数感染发生在1个月至4个月的儿童中
轮状病毒
报告总数
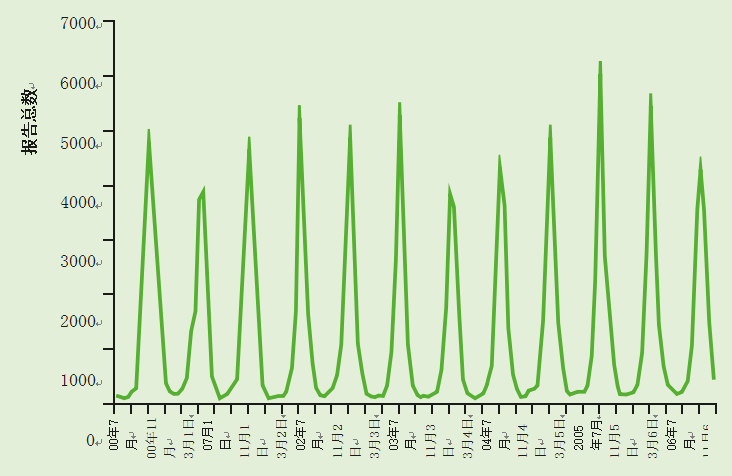
图1 2000-2012年英格兰和威尔士轮状病毒感染的季节性分布-按月份列出的所有鉴定的实验室报告。
年龄(见图2)。新生儿感染是常见的,但往往是轻微的或无症状的,可能是因为循环母源抗体的保护(Grillner等人,1985;毕晓普,1994)。感染通常是复发性的,到3岁时,许多儿童将经历不止一次感染(Brussow等人,1988)。一旦有人感染了轮状病毒,他们通常会产生免疫力,尽管这可能是短暂的(Bishop,1994)。先前遇到的毒株的第二次和随后的感染通常是无症状的;有症状的继发感染通常与不同的基因型有关。
成人感染很少报道,尽管在照顾或接触轮状病毒胃肠炎儿童的个体中并不少见。年龄较大的儿童和成人也可能发生无症状感染,这可能对维持社区轮状病毒感染很重要(Hardy,1987)。轮状病毒血清型G1P[8]、G2P[4]、G3P[8]、G4P[8]和G9P[8]约占在英国流行的所有轮状病毒血清型的82%(伊图里扎-戈马拉等人,2008a),其中G1P[8]是2010年至2012年间最常见的流行毒株。
报告数量
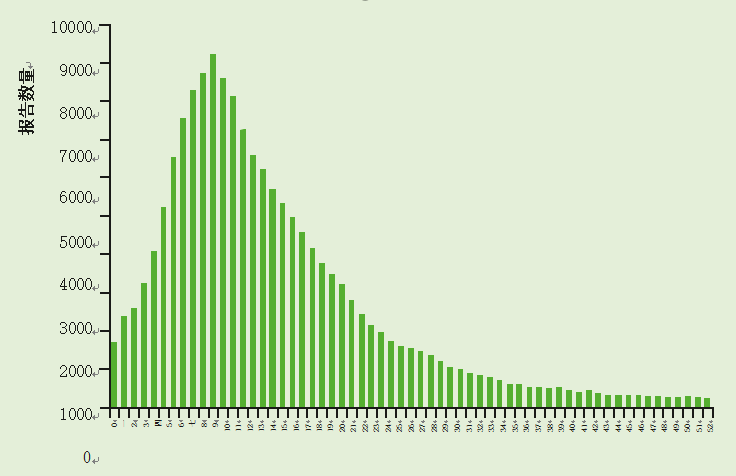
图2 2000年7月至2012年6月英格兰和威尔士5岁以下儿童中确诊的轮状病毒感染(n = 178,880)
资料来源:健康保护局轮状病毒实验室。
计算轮状病毒疾病负担的主要障碍是感染的症状与许多其他病毒和细菌的症状相似。此外,提交给卫生服务部门的大多数肠胃炎病例不包括病原微生物的实验室确认。
使用各种监测和诊断方法和技术,估计轮状病毒感染引起约一半的五岁以下儿童肠胃炎。此外,尽管在过去十年中,由细菌和寄生虫引起的幼儿肠胃炎病例数量呈下降趋势,但由病毒,尤其是轮状病毒引起的肠胃炎病例比例保持稳定(Iturriza-Gomara等人,2008a)。
轮状病毒感染也可能在医院获得。在美国住院患者中,发现三分之一的轮状病毒感染是在医院获得的(Fischer等人,2004)。其他几篇论文也记载了轮状病毒感染在医院获得性胃肠炎中的重要性(Chandran等人,2006;Gleizes等人,2006年)。
轮状病毒疫苗
有两种轮状病毒疫苗被欧洲药品管理局授权使用,Rotarix(由GSK生产)和RotaTeq(由赛诺菲巴斯德MSD公司生产)。两者对预防婴儿轮状病毒感染都非常有效。然而,还不知道这些疫苗是否可以互换,从一种产品开始的一个疫苗疗程应该用同一种疫苗完成,以实现完全保护。这两种疫苗都不含硫柳汞和任何佐剂。
Rotarix是作为英国国家儿童免疫计划的一部分提供的疫苗。它是一种减毒活疫苗,来源于最初从15个月大的儿童中分离的病毒,然后通过连续细胞培养传代进行减毒(De Vos等人,2004)。
在临床试验中,Rotarix已被证明可预防轮状病毒血清型G1P[8]、G2P[4]、G3P[8]、G4P[8]和G9P[8]引起的胃肠炎;对罕见的轮状病毒基因型G8P[4]和G12P[6]也有一定疗效。在出生后的头两年,该疫苗对预防严重轮状病毒胃肠炎的有效性超过85%(Salinas等人,2005;Ruiz-Palacios等人,2006年;Vesikari等人,2006年;Vesikari等人,2007年;苏亚雷斯-魏泽等人,2012年)。疫苗预防任何轮状病毒感染的效力因所列血清型而异。
存储(参见第3章)
疫苗应储存在原包装中,温度为+2℃至+8℃,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非疫苗储存在正确的温度下,否则其有效性会降低。
冷冻可能导致轮状病毒的反应原性增加和效力丧失。
剂型
Rotarix疫苗是以透明无色液体的口服混悬液的形式提供的,在口服涂药器中含有混悬液溶液(1.5 ml),带有柱塞、塞子和保护性顶端盖帽。
剂量和时间表
Rotarix日程表
●两个月大(大约八周)时接种第一剂1.5毫升Rotarix疫苗。
●第一剂后至少四周,第二剂1.5毫升。
两剂Rotarix疫苗的整个疗程最好在16周龄前完成,第一剂和第二剂之间至少间隔4周。这是为了提供早期保护并避免疫苗接种和肠套叠之间的暂时关联。
根据世卫组织的建议,如果婴儿年龄小于15周,只应接种第一剂Rotarix疫苗。在第15周前接种第一剂疫苗的婴儿应在24周大时接种第二剂疫苗。如果疗程中断,应恢复但不重复,前提是可以在24周截止日期前注射第二剂。
在15周或更大时无意中接种了第一剂轮状病毒疫苗的儿童仍应在至少4周后接种第二剂疫苗,前提是他们当时仍未满24周。15周年龄限制的原因是为了最小化肠套叠的潜在风险(见下面的不良反应)
如果第一剂疫苗是在15周零日龄后意外注射的,或者第二剂疫苗是在24周龄后注射的,则不需要采取特定的临床措施。对于这两种情况,应提醒免疫接种者Rotarix疫苗的年龄限制,即使婴儿由于这些限制而无法开始或完成两剂方案。
管理
Rotarix疫苗是口服的。
轮状病毒疫苗一定不能注射。
要接种疫苗,请小心地从口腔涂药器上取下保护性顶端盖帽。让儿童坐在一个斜躺的位置,并口服(即,进入儿童的口中,朝向内脸颊)口腔涂药器的全部内容物。
疫苗使用说明:
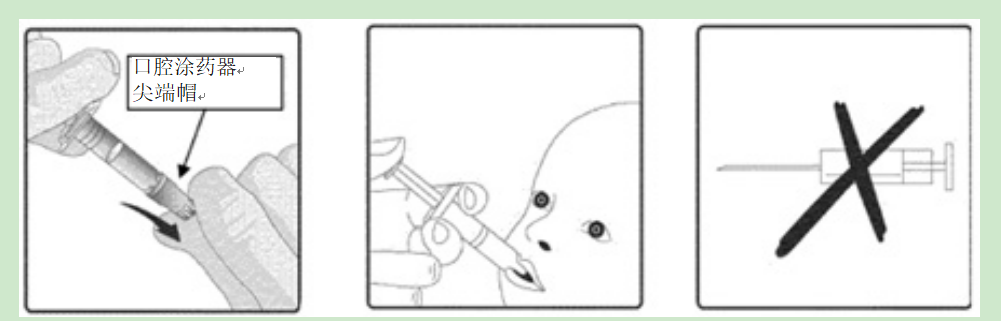
1.拆下保护装置2。这种疫苗是3人份的。不要注射。口服给药的尖盖涂抹器。只有。孩子应该以斜躺的姿势坐着。管理口服(即放入儿童口中,朝向内颊)口腔施用装置的全部内容物。
Rotarix的产品特性总结提供了进一步的给药指南。(http://www.medicines.org.uk/emc/medicine/17840/SPC/rotarix/)
轮状病毒疫苗可与作为常规儿童免疫接种计划一部分的其他疫苗(包括卡介苗)同时接种,因此理想情况下应在预定的两个月和三个月接种访视时接种(见上文)。然而,轮状病毒疫苗可以在常规婴儿免疫接种之前或之后的任何时间接种,也可以在卡介苗接种之前或之后的任何时间接种。关于同时或间隔四周后接种活疫苗的建议仅适用于注射用活疫苗,因此不适用于卡介苗或口服轮状病毒疫苗。
如果婴儿吐出或反流了大部分疫苗,可在同一次接种访视中给予单次替代剂量。在接种疫苗前后,对婴儿的食物或饮料消费没有限制。
处置(见第3章)
根据地方当局法规和技术备忘录07-01(卫生部,2006年)中的指南,用于疫苗接种的设备,包括用过的小瓶、安瓿或部分排出的疫苗(口服涂药器),应在疗程结束时通过密封在适当的、防刺穿的“锐器”盒中进行处置。
疫苗使用建议
轮状病毒免疫接种计划的目的是为6周至24周大的婴儿提供两剂Rotarix疫苗,以预防轮状病毒引起的严重肠胃炎。
六周以下的婴儿
Rotarix疫苗不应用于6周以下的婴儿。
6周至15周以下的婴儿
Rotarix疫苗首剂的最小年龄为6周零天,首剂的最大年龄为14周零6天。
15周至24周以下的婴儿
15周零天或以上的婴儿不应开始接种Rotarix疫苗。在15周零0天内接种了第一剂疫苗的婴儿,应在至少间隔4周后至23周零6天接种第二剂Rotarix疫苗。
24周或以上的婴儿
Rotarix疫苗不应用于24周零0天或以上的婴儿。
禁忌症
尽管疫苗是减毒活病毒,但除了严重的联合免疫缺陷(SCID)外,接种疫苗的益处可能超过其他形式免疫抑制的任何风险。因此,极少数婴儿不能接种轮状病毒疫苗。母乳喂养和胃食管反流药物不是轮状病毒疫苗接种的禁忌症。轮状病毒疫苗也可以在施用任何血液制品(包括含有抗体/免疫球蛋白的血液制品)之前、同时或之后施用。如有疑问,应向免疫协调员或健康保护顾问寻求适当的建议,而不是停止接种疫苗。
Rotarix不应用于:
●对先前剂量的轮状病毒疫苗有过敏反应的婴儿,
●对疫苗的任何成分有过敏反应的婴儿,
●有肠套叠病史的婴儿,
●24周零天或以上的婴儿,
●患有严重联合免疫缺陷(SCID)疾病的婴儿,
●胃肠道畸形的婴儿,这可能使他们更容易发生肠套叠
●患有果糖不耐受、葡萄糖-半乳糖吸收不良或蔗糖酶-异麦芽糖酶不足的罕见遗传问题的婴儿。
预防措施
Rotarix疫苗不应用于6周以下的婴儿。15周零天或以上的婴儿不应开始接种Rotarix疫苗。在15周零0天内接种了第一剂疫苗的婴儿,应在至少间隔4周后至23周零6天接种第二剂Rotarix疫苗。Rotarix疫苗不应用于24周零0天或以上的婴儿。
患有以下疾病的婴儿应推迟接种轮状病毒疫苗:
●急性严重发热疾病,
●急性腹泻或呕吐。这是为了确保疫苗不会回流或通过肠道太快,这可能会降低疫苗的有效性。
没有发烧或全身不适的其他小病不是推迟免疫接种的正当理由。如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
该疫苗含有减毒活病毒,对免疫抑制婴儿的安全性和有效性数据证据有限;除了严重的联合免疫缺陷(不应接种疫苗)外,可以考虑接种疫苗。
早产儿
根据时间表,早产儿在适当的年龄接种疫苗是很重要的。如果婴儿临床表现稳定,则早产儿接种Rotarix疫苗的年龄至少为6周(未校正早产)。由于接种疫苗对早产儿和极早产儿的益处很大,因此不应停止或延迟接种疫苗。
住院婴儿
如果保持标准的感染控制预防措施,对住院婴儿(包括新生儿病房中的早产儿)施用轮状病毒疫苗可能具有较低的疫苗病毒传播风险。此外,轮状病毒疫苗是高度减毒的,不会回复为高毒力毒株。因此,如果婴儿在临床上是稳定的,就不应该延迟接种疫苗,特别是如果延迟接种疫苗的风险太大,或者在接近15周的年龄上限时接种第一剂疫苗。同样,如果最近接种疫苗的儿童因任何原因住院,除了常规的标准感染控制预防措施外,不需要采取任何预防措施来防止疫苗病毒在医院环境中传播。
免疫抑制和艾滋病毒感染
轮状病毒疫苗不应用于已知患有严重联合免疫缺陷(SCID)的婴儿。对患有其他免疫抑制性疾病的婴儿使用轮状病毒疫苗缺乏安全性和有效性数据。然而,考虑到暴露于天然轮状病毒的高风险,给药的益处可能超过任何理论上的风险,因此应积极考虑,必要时与治疗儿童基础疾病的临床医生合作。
然而,在一项临床研究中,100名感染艾滋病毒的婴儿服用了Rotarix冻干制剂或安慰剂。Rotarix疫苗和安慰剂的安全性相似(Steele等人,2011)。因此,建议感染艾滋病毒的婴儿接种疫苗。此外,艾滋病毒状况不明但由艾滋病毒阳性母亲所生的婴儿应接种疫苗。
轮状病毒中的减毒活疫苗有可能通过粪便从婴儿传播给免疫功能严重受损的接触者,至少持续14天(Anderson,2008)。然而,婴儿接种疫苗将为家庭接触者提供保护,使其免受野生型轮状病毒疾病的感染,并超过疫苗病毒传播给任何免疫低下的密切接触者的任何风险。与最近接种疫苗的婴儿密切接触的人应保持良好的个人卫生。
不良反应
任何人都可以使用黄卡报告计划向人类药物委员会(CHM)报告可疑的不良反应(www.mhra.gov.uk/yellowcard)。
施用Rotarix疫苗后观察到的最常见不良反应是腹泻和过敏。其他常见的反应有呕吐、腹痛、胀气、皮肤炎症、食物反流、发烧和食欲不振。与Rotarix疫苗相关的不良反应的详细列表可在该疫苗的产品特性概述中找到,该概述可从欧洲药品管理局网站上获得。
肠套叠是一种自然发生的情况,其中肠的一部分脱垂或收缩到另一部分中,导致梗阻。一岁以下儿童肠套叠的背景年发病率约为120例/100,000(世卫组织,2002)。在英国,肠套叠的背景风险在5个月左右达到高峰(Gay N,Lancet 1999)。来自一些国家的研究表明,Rotarix疫苗可能与接种疫苗后7天内肠套叠风险极小的增加有关,可能是每100,000个首次剂量中有两个病例,Rotarix处方信息包括这一可能的副作用。接种疫苗在预防轮状病毒感染后果方面的益处超过了幼儿的这一微小潜在风险。由于潜在的风险,并为了减少与轮状病毒疫苗暂时相关的可能性,第一剂疫苗不应在15周龄后接种。
没有证据表明Rotarix与川崎病的发展有因果关系(苏亚雷斯-魏泽K等人,2012)。
报告过敏反应和其他过敏反应
过敏反应是大多数疫苗非常罕见的公认副作用,应通过黄卡计划(www.mhra. gov.uk/yellowcard)报告疑似病例。第八章详细介绍了过敏反应的症状和体征。如果疑似过敏反应病例符合临床第8章中描述的特征,这应通过黄卡方案作为“过敏反应”(或适当的“过敏样反应”)的病例报告。不太严重的过敏反应病例(即不包括上述过敏反应的临床特征)不应报告为过敏反应,而应报告为“过敏反应”。
供应品(见第3章)
●Rotarix–由葛兰素史克公司生产(电话。08081 009997).
在英国,Rotarix只能通过ImmForm网站在线订购(https://www。政府。英国/政府/税收/移民署)它由英国Movianto公司(电话:01234 248631)作为国家儿童免疫计划的一部分进行分发。
只能通过ImmForm订购为国民保健制度的国家免疫方案集中购买的疫苗。用于国家儿童免疫方案的疫苗是免费提供的。用于私人处方、疾病爆发、职业健康用途或旅行的疫苗不是免费提供的,应从制造商处订购。有关ImmForm的更多信息,请访问http://immunisation.dh.gov.uk/immform-helpsheets/或从ImmForm帮助台获得helpdesk@immform.org.uk或电话:0844 376 0040。
在威尔士,应通过上述ImmForm订购供应品。南威尔士和北威尔士有不同的存储安排。在南威尔士,疫苗由卫生局药房储存和分发;在北威尔士,疫苗直接分发给全科医生。
在苏格兰,应该从当地的儿童疫苗储备中心获得供应。详情可从苏格兰保健用品公司(电话:0131 275 6154)获得。
在北爱尔兰,用于国家免疫计划的Rotarix疫苗由指定的信托药房部门提供。这些信托药房部门的详细情况可从地区药品采购处获得(电话:028 94 424346;电子邮件rphps。admin@northerntrust.hscni.net)
参考
Amar CF,East CL,Gray J等人(2007年)通过PCR检测4,627份粪便样本中的八组肠道病原体:重新检查英国病例对照传染性肠道疾病研究(1993-1996年)。欧洲临床微生物感染杂志26(5): 311-23。
安德森·EJ。轮状病毒疫苗:病毒脱落和传播风险。柳叶刀感染疾病。
2008年10月;8(10):642-9.
Bishop RF (1994)人类轮状病毒感染的自然史。In: Kapikian AZ(编辑。)胃肠道的病毒感染。纽约:马塞尔·德克尔,第131-67页。
Brussow H,Werchau H,Liedtke W等(1988)西德波鸿不同年龄组婴儿中轮状病毒抗体的流行率。j传染疾病157(5): 1014-22。
Buttery JP,Danchin MH,Lee KJ等,轮状病毒疫苗接种后的肠套叠:澳大利亚国家免疫计划的上市后监测。疫苗。2011年4月5日;29(16):3061-6.
Chandran A,Heinzen RR,Santosham M等人(2006)医院内轮状病毒感染:一项系统综述。《儿科杂志》第149卷第4期第441-7页。
De Vos B,Vesikari T,Linhares AC等(2004)一种用于预防婴儿轮状病毒胃肠炎的轮状病毒疫苗。儿科传染病杂志23(10增刊):S179-82。
卫生部(2006)卫生技术备忘录07-01:医疗废物的安全管理。http://www.dh.gov.uk/en/Publicationsandstatistics/Publications/publications policy and guidance/DH _ 063274。访问时间:2008年7月。
德塞尔伯格U,伊图里扎-戈马拉M和格雷JJ (2001)轮状病毒流行病学和监测。诺华发现Symp 238 125-47;讨论147-52。
Djuretic T,Ramsay M,Gay N等(1999)英格兰和威尔士5岁以下儿童中,全科医生发现的轮状病毒腹泻发病率的估计。《儿科学报补编第88卷第426期》:第38-41页。
Fischer TK,Bresee JS和Glass RI (2004)轮状病毒疫苗和预防儿童医院获得性腹泻。疫苗22补充品1 S49-54。
Gay N,Ramsay M和Waight P (1999)轮状病毒疫苗接种和肠套叠。柳叶刀,354,[9182]:956。格拉斯·里、帕拉沙尔·UD、布雷西·JS等人(2006)轮状病毒疫苗:当前前景和未来挑战。柳叶刀368(9532): 323-32。
Gleizes O,Desselberger U,Tatochenko V等(2006)欧洲国家的医院内轮状病毒感染:医院获得性轮状病毒疾病的流行病学、严重性和经济负担的回顾。儿科传染病杂志25(1增刊):S12-21。
轮状病毒疫苗:安全性、有效性和公共卫生影响。2011年《实习医生医学》;270: 206–214 (2011).
Grillner L,Broberger U,Chrystie I等(1985)新生儿轮状病毒感染:流行病学和临床研究。Scand J Infect Dis 17(4): 349-55。
希顿总理、戈维娅·MG、米勒·JM等人(2005)针对轮状病毒胃肠炎流行血清型的五价轮状病毒疫苗的开发。j感染疾病分类192补编1 S17- 21。
Hardy DB (1987)成人轮状病毒感染的流行病学。Rev Infect Dis 9(3): 461-9。
伊图里扎-戈马拉M、Elliot AJ、Dockery C等人(2008年a)对社区学龄前儿童传染性肠道疾病的结构化监测:“尿布研究”。流行病传染1-10。
Iturriza Gomara M,Simpson R,Perault AM等人(2008年b)对英国东安格利亚婴儿胃肠炎的结构性监测:常见病毒性胃肠病原体感染的发病率。流行病传染136(1): 23-33。
itur iza-góMara M,Dallman T,Bányai K,Bö ttiger B,等(2011)欧洲轮状病毒网络确定的2006年至2009年间在欧洲共同传播的轮状病毒基因型
欧洲合作毒株监测网络。流行性传染病。君;139(6):895-909.
Jit,M;WJ埃德蒙兹;(2007)评估英格兰和威尔士的轮状病毒疫苗接种。第二部分。疫苗接种的潜在成本效益。疫苗,25 (20)。第3971-9页。
Jit M,Pebody R,Chen M等(2007)估计英格兰和威尔士轮状病毒引起的死亡人数。Hum Vaccin 3(1): 23-6。
Omenaca F,Sarlangue J,Szenborn L等。(2012)欧洲早产儿人类轮状病毒疫苗的安全性、反应原性和免疫原性:一项随机IIIb期研究。儿科传染病,五月;31(5):487-93.
Patel MM,López-Collada VR,Bulhõ es MM等.在墨西哥和巴西接种轮状病毒疫苗的肠套叠风险和健康益处英国医学博士。2011年6月16日;364(24):2283-92.
Ruiz-Palacios GM,Perez-Schael I,贝拉斯克斯FR等人(2006)针对严重轮状病毒胃肠炎的减毒疫苗的安全性和有效性。英国医学杂志354(1): 11-22。
Salinas B,Perez Schael I,Linhares AC等人(2005)对减毒轮状病毒疫苗的安全性、免疫原性和有效性的评估,RIX4414:拉丁美洲婴儿的随机安慰剂对照试验。儿科传染病杂志24(9): 807-16。
赛诺菲巴斯德MSD有限公司(2008) RotaTeq:产品特性概述。http://www.medicines.org.uk/emc/medicine/17840/SPC/rotarix/访问时间:2013年1月。
美国婴儿接种五价轮状病毒疫苗后发生肠套叠的风险。贾马。2012年2月8日;307(6):598-604.
预防轮状病毒腹泻的疫苗:使用中的疫苗。Cochrane数据库系统,2012年11月14日修订版;11:CD008521
人类轮状病毒疫苗RIX4414在南非人类免疫缺陷病毒阳性婴儿中的安全性、反应原性和免疫原性。儿科传染病杂志2011年2月;30(2):125-30.
Tompkins DS、Hudson MJ、Smith HR等人(1999)英格兰传染性肠道疾病研究:病例和对照中的微生物发现。《公共卫生共同体》2(2): 108-13。
在墨西哥大规模引入减毒人类轮状病毒疫苗后对肠套叠的上市后监测。儿科传染病杂志2012;31: 736-744
韦斯卡里·T、卡尔沃宁·A、普雷穆拉·R等人(2007)欧洲婴儿出生后两年内人类轮状病毒疫苗对轮状病毒胃肠炎的疗效:随机双盲对照研究。柳叶刀370(9601): 1757-63。
Vesikari T,Matson DO,Dennehy P等(2006)五价人-牛(WC3)重组轮状病毒疫苗的安全性和有效性。英国医学杂志354(1): 23-33。
世卫组织(2002)婴幼儿急性肠套叠。发病率、临床表现和管理:全球视角。疫苗和生物制品世卫组织/V&B/02.19。http://whqlibdoc.who.int/hq/2002/WHO_V&B_02.19.pdf[2013年4月访问]。




