ACIP日本脑炎疫苗的建议
日本脑炎疫苗:免疫接种谘询委员会的建议
Japanese Encephalitis Vaccine: Recommendations of the Advisory Committee on Immunization Practices
Recommendations and Reports / July 19, 2019 / 68(2);1–33
Susan L. Hills, MBBS1; Emmanuel B. Walter, MD2; Robert L. Atmar, MD3; Marc Fischer, MD1 (查看作者单位)
本页内容
- 总结
- 介绍
- 方法
- 背景
- JE-VC型
- 预防美国旅行者发生日本脑炎的建议
- 预防实验室工作人员乙型脑炎的建议
- 接种乙型脑炎疫苗
- 使用日本脑炎疫苗的禁忌症和注意事项
- 特殊人群
- 疫苗不良事件报告
- JE-VC的未来研究
- 其他信息
总结
本报告更新了CDC免疫实践咨询委员会(ACIP)2010年关于预防美国旅行者和实验室工作人员日本脑炎(JE)的建议(FischerM、LindseyN、StaplesJE、HillsS.日本脑炎疫苗:免疫实践咨询委员会(ACIP)的建议)。MMWRRecommRep2010;59[不。RR-1])。该报告总结了日本脑炎的流行病学,描述了在美国获得许可和上市的日本脑炎疫苗,并提供了旅行者和实验室工作人员使用乙型脑炎疫苗的建议。
日本脑炎病毒是一种蚊媒黄病毒,是亚洲最常见的疫苗可预防的脑炎病因。日本脑炎在亚洲大部分地区和西太平洋部分地区均有发生。大约20%-30%的患者死亡,30%-50%的幸存者有神经系统、认知或行为后遗症。目前尚无抗病毒治疗。
灭活的Vero细胞培养衍生的JE疫苗(Ixiaro[JE-VC])是唯一在美国获得许可和上市的JE疫苗。2009年,美国食品和药物管理局(FDA)批准JE-VC用于≥17岁的人群;2013年,执照扩大到包括≥2个月大的儿童。
大多数前往该疾病流行国家的旅行者患日本脑炎的风险非常低。然而,根据他们的旅行计划,一些旅行者的感染风险增加。增加日本脑炎病毒暴露风险的因素包括:1)旅行时间较长;2)在日本脑炎病毒传播季节旅行;3)在农村地区度过时光;4)参加广泛的户外活动;5)住在没有空调、屏风或蚊帐的住宿中。应建议所有前往日本脑炎流行国家的旅行者采取预防措施,避免蚊虫叮咬,以降低感染日本脑炎和其他媒介传播疾病的风险。对于一些可能增加乙型脑炎风险的人,疫苗可以进一步降低感染风险。关于是否接种疫苗的决定应因人而异,并考虑1)与特定旅行行程相关的风险,2)未来前往日本脑炎流行国家的可能性,3)日本脑炎的高发病率和死亡率,4)有效疫苗的可用性,5)接种疫苗后发生严重不良事件的可能性(但概率较低),以及6)旅行者的个人感知和对风险的容忍度。
建议移居日本脑流行国家居住的人、前往日本脑炎流行地区的长期(例如≥1个月)旅行者以及经常前往日本脑炎流行地区的旅行者接种乙型脑炎疫苗。对于根据计划旅行持续时间、季节、地点、活动和住宿而增加JE风险的短期(例如<1个月)旅行者,以及前往JED流行地区但不确定其具体旅行持续时间、目的地或活动的旅行者,也应考虑接种JE疫苗。不建议旅行风险极低的旅行者接种日本脑炎疫苗,例如仅限于城市地区或明确定义的日本脑炎病毒传播季节之外的短期旅行。
介绍
日本脑炎(JE)病毒是一种蚊媒黄病毒,是亚洲最常见的疫苗可预防的脑炎病因(1,2)。日本脑炎在亚洲大部分地区和西太平洋部分地区均有发生(3,4)。大约20%-30%的患者死亡,30%-50%的幸存者有神经系统、认知或行为后遗症(5-7)。在该病流行的国家,日本脑炎主要影响儿童。虽然罕见,但旅行相关性日本脑炎可发生于任何年龄的人群中(8-10)。对于大多数前往亚洲的旅行者来说,发生日本脑炎的风险非常低,但因旅行时间、季节、地点、活动和住宿而异[9,11]。
日本脑炎病毒在蚊子和扩增的脊椎动物宿主(主要是猪和涉禽)之间维持地方性循环(12,13)。日本脑炎病毒通过受感染的蚊子传播给人类(1)。日本脑炎病毒主要发生在农村农业地区。在亚洲大多数温带地区,日本脑炎病毒的传播是季节性的,可能会发生大规模暴发。在亚热带和热带地区,传播可能全年发生,往往在雨季加剧。
灭活的Vero细胞培养衍生的JE疫苗(Ixiaro[JE-VC])是唯一在美国获得许可和上市的JE疫苗。自1992年以来,一种灭活的小鼠脑源性疫苗(JE-VAX[JE-MB])已在美国获得许可,但已不再生产,所有剩余剂量均于2011年到期。2009年,美国食品和药物管理局(FDA)许可JE-VC用于≥17岁的人群(14)。2013年,执照扩大到包括≥2个月大的儿童。本报告更新了2010年免疫实践咨询委员会(ACIP)关于在美国旅行者和实验室工作人员中使用JE疫苗的建议(15)。
方法
ACIP日本脑炎疫苗工作组最初成立于2006年,旨在审查和更新美国可用的日本脑炎疫苗信息。FDA于2009年批准了≥17岁成人的JE-VC。2010年发布了关于在美国旅行者和实验室工作人员中使用JE疫苗的最新ACIP建议(15)。ACIP随后于2011年批准了在成人中使用加强剂量的JE-VC的建议,并在FDA将JE-VC许可扩展到包括≥2个月的儿童后,于2013年批准了在儿童中使用JE-VC的建议(16,17)。2015年,ACIP日本脑炎疫苗工作组解散并进行了改革,成员进行了修订。工作组的目标是1)审查JE-VC的新可用安全性和免疫原性数据,2)审查有关旅行者JE流行病学和风险的最新信息,以及3)考虑到这些数据,审查使用日本脑炎疫苗的建议。工作组成员包括在日本脑炎、传染病、儿科、旅行医学、公共卫生、疫苗接种安全和疫苗政策方面具有专业知识的人员。2015年3月至2019年1月期间,工作组通过电话会议召开了大约34次会议。制造商或工作组成员向ACIP介绍了疫苗免疫原性和安全性以及与制定乙脑疫苗建议有关的其他主题。
建议分级、评估、发展和评价(GRADE)方法用于审查和评估新获得的数据(18,19)。在制定日本脑炎疫苗建议时,还评估了“从证据到建议”框架中概述的其他因素,包括目标人群价值、利益相关者的可接受性和实施的可行性(19,20)。日本脑炎疫苗证据推荐书中提供了有关GRADE方法的详细信息,包括检索方案、检索的数据库和纳入标准、证据摘要、证据分级以及有关所考虑的其他因素的信息(19)。工作组在2018年10月的会议上向ACIP提出了初步建议。拟议的建议已提交给ACIP,并在2019年2月的会议上获得批准。ACIP将在获得其他数据时对其进行审查,并根据需要更新建议。
背景
日本脑炎病毒说明
日本脑炎病毒是一种节肢动物传播病毒(虫媒病毒),是一种单链RNA病毒,属于黄病毒属,与西尼罗河病毒、圣路易斯脑炎、黄热病和登革热病毒密切相关(21,22)。已鉴定出5种基因型的JE病毒(23)。直到1990年代,亚洲主要的JE病毒基因型是基因型III,但现在是基因型I(23)。
日本脑炎病毒传播
日本脑炎病毒在蚊子和扩增的脊椎动物宿主(主要是猪和涉水鸟类(如苍鹭和白鹭)之间通过地方性循环传播(图1)(13,24–28)。由于种群快速更替,有许多易感后代和高滴度病毒血症的发展,家猪是将乙脑病毒传播给人类的蚊子的主要感染源(12,28–32)。
库蚊,尤其是三带喙库蚊,是亚洲大部分地区乙脑病毒传播的主要媒介(12,13,24,27,33–40)。三带喙库蚊是一种夜间和夜间叮咬的蚊子,优先以大型家畜和鸟类为食,但很少以人类为食(41)。三带喙库蚊最常在户外觅食,日落后出现觅食高峰(41)。幼虫存在于被淹没的稻田、沼泽和其他积水的积水中(38,39)。在温带地区,蚊子在6月至11月期间密度最大,在冬季不活跃(12,26,42)。在亚洲和西太平洋的某些地区,其他蚊子种类也是乙脑型脑炎病毒的重要媒介(13,37,39,43)。
受感染的蚊子将乙脑病毒传播给人类。人类被认为是日本脑炎病毒传播周期中的死胡同宿主,因为他们没有发展出足以感染蚊子的病毒血症水平或持续时间(13,44)。因此,感染日本脑炎病毒的旅行者返回非流行地区后,对随后传播病毒的风险很小或没有风险。
日本脑炎病毒不会通过直接接触在人与人之间传播。已有少量经胎盘传播乙脑病毒病例的报道。在印度暴发期间,9名受感染的孕妇中有4例流产(3,45,46)。所有流产的妇女都处于妊娠早期或中期,从四个流产胎儿中的一个中分离出乙脑病毒。乙型脑炎病毒通过输血传播在日本脑炎流行地区已有记录,根据类似黄病毒的经验,器官移植被认为是一种潜在的传播方式(47,48)。在实验室环境中,乙型脑炎病毒可能通过意外经皮暴露传播,或者理论上通过黏膜或吸入暴露传播。至少报告了22例实验室获得性JE病毒感染(49)。
日本脑炎的流行病学
地理分布和传播
日本脑炎在亚洲大部分地区和西太平洋部分地区均有发生(图2)。在20世纪上半叶,该病主要在亚洲温带地区被发现,包括日本、韩国、和中国(50-54)。该病毒随后向南和向西传播,据报道,东南亚、印度、孟加拉国、斯里兰卡和尼泊尔的传播有所增加(36,54-68)。在1990年代,日本脑炎病毒向东传播,并首次在塞班岛和澳大利亚被发现,最初是在外托雷斯海峡群岛,随后在北部大陆(43,69,70)。最近,在新的地区也发现了传播,包括在西藏和尼泊尔的山区(71,72)。地理分布增加的原因尚不确定,但可能包括种群变化或气候、生态、农业实践、畜牧业或候鸟模式的变化(39,56,70)。这些因素可能导致进一步传播,包括亚洲和西太平洋以外的地区。
发生
在1970年代初期,每年报告约100,000例日本脑炎病例,其中绝大多数来自中国(54)。由于疫苗的使用、城市化进程的加快、农业实践的改变和蚊虫控制,每年的日本脑炎病例数大幅下降。每年向世界卫生组织(WHO)报告多达5,000例日本脑炎病例(73例)。然而,这一数字可能低估了实际病例数,因为在许多流行型日本脑炎国家,诊断检测和监测能力有限(5,7)。2011年,考虑到当时疫苗接种计划的状况,一项系统评价估计,每年通常发生67,900例乙型脑炎病例,总体发病率为每100,000人1.8例。在<15岁儿童中,发病率估计为5.4/100,000(5)。然而,发病率可能因年份和地区而异。在引入疫苗接种计划之前,亚洲最高风险地区的实验室确诊日本脑炎发病率高达每年每10万名儿童20例(5.74-76)。在疫苗接种计划覆盖率高的国家,日本脑炎发病率现在每年不到每10万名儿童1例(577例)。
生态和季节模式
日本脑炎的风险因当地生态和季节而异。日本脑炎病毒的传播主要发生在农村农业地区,通常与水稻生产和洪水灌溉有关,大量病媒蚊子在动物水库附近繁殖(24,27)。在亚洲的一些地区,这些生态条件可能发生在城市中心附近或城市中心内(尽管很少见)(78-80)。
在亚洲温带地区(如中国、日本、尼泊尔、越南北部、印度北部、韩国和),日本脑炎病毒的传播是季节性的,人类疾病通常在夏季和秋季达到高峰(50,52,53,57,66,68,81)。传播高峰期和季节长度因地区而异,可能会发生大规模的爆炸性疫情。在亚热带和热带地区,传播可全年发生,通常在雨季达到高峰(56,58,62,76,82)。
特定年龄模式
在日本脑炎流行地区,该病主要影响儿童,绝大多数病例发生在<15岁的儿童中;大多数成年人在自然暴露于病毒后具有保护性免疫力(52,53,57–59,66,68,76,83,84)。然而,在有儿童JE疫苗接种计划的地区,JE的总体发病率下降,成人病例比例更高(50,51,85,86)。日本、中国和印度报告了主要影响老年人的暴发(87-89)。由于来自非流行国家的未接种疫苗的旅行者通常免疫学上是幼稚的,因此旅行相关的日本脑炎可发生在任何年龄的人群中。
临床表现和诊断
体征和症状
人类大多数乙脑炎病毒感染是无症状的,<1%的乙脑病毒感染者会发展为脑炎(83,90-94)。急性脑炎是日本脑炎病毒感染者中最常见的临床综合征,但也可能发生较轻的疾病形式(例如无菌性脑膜炎或未分化发热性疾病)[6,13,95-97]。在出现临床症状的患者中,潜伏期为5-15天。初始症状通常是非特异性的,可能包括发热、寒战、头痛、呕吐和腹泻(6,61,98,99)。在接下来的几天内可能会出现精神状态改变、全身无力、局灶性神经功能缺损(例如偏瘫、四肢瘫痪或颅神经麻痹)和运动障碍(61,98–103)。癫痫发作很常见,尤其是在儿童中(61,98-100,103-105)。日本脑炎的一个独特临床表现是锥体外系受累导致的帕金森综合征,表现为面具样面容、震颤、齿轮强直和舞蹈手足徐动样运动(6,99)。急性弛缓性麻痹的临床和病理特征与脊髓灰质炎相似,也与日本脑炎病毒感染有关(6,106,107)。癫痫持续状态、脑缺氧、颅内压增高、脑干突出和吸入性肺炎是与不良结局和死亡相关的最常见并发症(6,98,104,108)。
临床实验室检查结果和神经影像学检查
乙脑型脑炎的临床实验室检查结果是非特异性的,可能包括白细胞计数中度升高、轻度贫血和低钠血症(6,95,98,99,103)。血小板减少症和肝酶升高已有报道(99)。脑脊液(CSF)通常显示淋巴细胞细胞增多,伴有中度升高的蛋白水平(6,59,61,95,98,100,103,109)。
磁共振成像(MRI)是检测脑部JE相关异常(包括丘脑、基底神经节、中脑、脑桥和髓质变化)的最佳方法(110–112)。丘脑病变是最常见的异常(110,112)。
实验室诊断
乙型脑炎病毒感染通常通过检测脑脊液或血清中的病毒特异性抗体来确诊(13,113–117)。由于人类在临床疾病发生时病毒血症水平较低或检测不到,因此病毒分离和核酸扩增试验(NAAT)不敏感,不应用于排除JE诊断(118,119)。在泰国的一项研究中,无法从血浆和脑脊液样本的30例非致死性JE病例中分离出JE病毒(120)。相比之下,从15例死亡患者中的5例(33%)和11例死亡患者中的8例(73%)的脑组织中分离出乙型脑炎病毒。最近的研究表明,NAAT可用于诊断某些脑炎或无菌性脑膜炎患者的JE,并且在一名死亡患者的尿液中检测到JE病毒RNA(97,121,122)。然而,NAAT的检测缺乏常规诊断所需的敏感性。
应使用IgM抗体捕获酶联免疫吸附测定(MAC ELISA)检测急性期标本的JE病毒免疫球蛋白M(IgM)抗体(13,113–117)。大多数患者的脑脊液中可在症状出现后4天内测定乙型脑炎病毒IgM抗体,并在症状发作后7-8天在血清中测定(76,115,116,123,124)。脑脊液中存在JE病毒IgM抗体,这为日本脑炎病毒感染是神经系统疾病的病因提供了证据(114,119)。由于临床和流行病学相关性,IgM检测呈阳性具有良好的诊断预测价值,但可能与其他黄病毒发生交叉反应。
斑块减少中和试验(PRNT)可用于根据急性期和恢复期血清标本之间病毒特异性中和抗体升高4倍或更高来确认近期感染,或区分归因于另一种原发性黄病毒感染的交叉反应抗体。对于既往感染过另一种黄病毒或接种过黄病毒疫苗(例如黄热病)的患者,ELISA和中和试验中的交叉反应性抗体使得识别特定病原体变得困难。
在解释结果时,应考虑疫苗接种史、症状发作日期以及已知在地理区域传播的可能在血清学检测中发生交叉反应的其他虫媒病毒的信息。一些州公共卫生实验室和疾病预防控制中心提供乙脑诊断检测。
治疗和管理
日本脑炎治疗包括支持性治疗和并发症管理。没有抗病毒药物或特异性药物可用于减轻乙脑病毒感染的影响(125)。在对照临床试验中,皮质类固醇、干扰素α-2a、利巴韦林、米诺环素或静脉注射免疫球蛋白并未改善临床结局(126-130)。一种乙型脑炎病毒基因型的感染被认为可产生针对所有基因型的终生免疫力。
结局和后遗症
日本脑炎的病死率为20%-30%(6,52,53,62,68,84,98-100,109,120,127,131,132)。一些死亡发生在短暂的暴发性病程后,而另一些则发生在长时间昏迷之后。尽管一些运动缺陷和运动障碍在急性疾病后有所改善,但30%-50%的JE幸存者甚至在数年后仍有神经系统或其他后遗症(6,100,106,127,131-138)。这些包括癫痫发作、上下运动神经元无力、小脑和锥体外系体征、手臂屈曲畸形、腿部过度伸展、认知缺陷、语言障碍、精神问题、学习困难和行为问题(6)。
旅行者中的JE
对于大多数前往亚洲的旅行者来说,发生日本脑炎的风险非常低,但因旅行目的地、持续时间、季节、活动和住宿而异(4,8,11,139)。据估计,在前往亚洲的非流行国家旅行者中,日本脑炎的总体发病率低于每100万旅行者1例。然而,在日本脑炎病毒传播活跃的农村地区长期逗留的人,其风险水平可能与易感居民相似。如果短途旅行的旅行者在活跃传播期间在农村地区有广泛的户外或夜间暴露,则风险可能会增加(140-142)。短期(例如,<1个月)旅行者的访问仅限于主要城市地区,其患JED的风险最小。
旅行者的感染风险不能从日本脑炎流行国家居民的发病率中推断出来。由于接种疫苗或对既往感染具有自然免疫力,当地人口中可能报告的病例很少。然而,由于日本脑炎病毒在动物和蚊子之间维持在地方性循环中,易感游客可能仍面临感染风险。对于有神经系统感染证据(例如脑炎、脑膜炎或急性弛缓性麻痹)且最近从日本脑炎流行的亚洲或西太平洋国家返回的患者,应怀疑日本脑炎。
来自非流行国家的所有旅行者中的乙型脑炎
在1973-2017年期间,共有85例来自非流行国家的旅行者或外籍人士的日本脑炎病例被公布或报告给CDC(8-10,122,140-174)。与前三个10年期间相比,最近10年报告的病例数大约是前三个10年期间的两倍:2008-2017年(n=34)、1998-2007年(n=18)、1988-1997年(n=17)和1978-1987年(n=13)。这一变化可能与旅行者人数的增加以及疾病病例的检测和报告增加有关。总体而言,53例(62%)发生在游客中,16例(19%)发生在外籍人士中,6例(7%)发生在士兵中,1例(1%)发生在研究人员中;在9例(11%)病例中,旅行类型未知。旅游类别包括七名探亲访友和两名出国留学的学生。这些患者是20个不同国家的公民。最常感染的国家是泰国(n=26)、印度尼西亚(n=13)、菲律宾(n=11)、中国(n=9)、越南(n=4)和日本(n=4)。病例数最多的国家(即泰国和印度尼西亚)有高风险地区,但也是游客人数众多的目的地。在这两个国家,旅游海滩度假区可以靠近稻田或蚊子密度高的农村地区(例如,泰国普吉岛和印度尼西亚巴厘岛)。在记录年龄的76例病例中,中位年龄为36岁(范围:5周至91岁)。总体而言,50例(59%)发生在男性中,31例(36%)发生在女性中;4例(5%)的性别不明。19例(22%)患者完全康复,39例(46%)存活但有后遗症,14例(16%)死亡,13例(15%)结局未知。据悉,所有患者均未接种过乙型脑炎疫苗。在仅访问城市地区的商务旅行者或其他短期旅行者中没有发生病例。
美国旅行者中的JE
在1973年之前,美国军事人员或其家庭成员中至少报告了300例日本脑炎病例(92,93,95,175-179)。在1973年至1992年期间,美国旅行者和军事人员中共报告了11例日本脑炎病例。在1993-2017年期间,自1992年美国首次获得乙脑型脑炎疫苗许可以来,美国旅行者中共报告了12例病例,每年病例中位数为零(范围:0-22)(10,143,144,165,173,174)。根据这25年期间报告的12例病例,以及每年约4-500万美国公民前往亚洲的旅行,美国旅行者中JE的总体发病率估计为每百万次亚洲旅行中<1例(180)。在12例病例中,3例(25%)为≤11岁儿童,其余为≥17岁成人。8例(67%)为男性。6例(50%)患者康复,3例(25%)存活但有后遗症,2例(17%)死亡,1例(8%)结局未知。总体而言,4例(33%)病例发生在居住在亚洲的美国侨民中,8例(67%)发生在游客中。旅行时间从10天到大约3年不等,8名旅行者(67%)为≥1个月。根据2007年的一项研究,大约20%的美国游客前往亚洲旅行>30天;因此,大约三分之二的美国旅行者病例发生在较小的20%的高风险长期旅行者中(181)。在四名短期旅行者中,三人旅行了3至<4周,一人旅行了10天。一名短期旅行者大部分时间都在农村地区度过,两名在城市地区逗留,但至少在农村地区过夜一次,一名没有与接触相关的信息。
接种日本脑炎疫苗的美国旅行者比例未知。然而,研究表明,即使在高风险旅行者中,乙脑疫苗接种率也很低。2007年对从美国直飞亚洲的成年旅行者进行的一项调查确定,在1,691名参与者中,有415人(25%)描述了应该考虑接种日本脑炎疫苗的行程,其中包括330名(20%)计划在日本脑炎流行国家停留≥30天,另有85名(5%)短期旅行者计划在日本脑炎流行农村地区度过至少50%的时间(181)。在这些高风险旅行者中,47人(11%)报告至少接种了一剂日本脑炎疫苗。在164名未接种疫苗的高风险旅行者中,有113人(69%)表示他们的医疗保健提供者没有提供或推荐乙脑疫苗。在一组提供旅行前医疗保健的美国临床实践中进行的另一项调查结果显示,在8,289名成年人中,有711名(9%)的人患JE的风险增加,原因是计划在JE病毒传播季节前往一个或多个JED流行国家≥30天,并访问行程中包含的农村地区(182)。在这711人中,188人(26%)在旅行前访问期间接种了疫苗,11人(2%)在过去两年内接种了日本脑炎疫苗;512例(72%)未接种乙型脑炎疫苗。未接种乙型脑炎疫苗的主要原因包括未指征乙型脑炎疫苗(n=282;55%)、患者拒绝接种(n=116;23%)或完成疫苗接种系列的时间不足(n=85;17%)(182)。在这两项美国研究中,2%-4%的低风险旅行者接种了疫苗(181,182)。
旅行者中的亚临床乙型脑炎病毒感染
两项研究调查了亚临床乙型脑炎病毒感染的频率。在2008年至2011年期间部署到韩国至少330天的1,000名未接种疫苗的美国步兵中,部署前和部署后的血清学检测表明一种可能的亚临床感染(183)。在一项针对387名在旅行前访问时未接种疫苗的澳大利亚成年旅行者的研究中,他们前往亚洲的中位时间为21天(范围:7-326天),并在旅行前和旅行后进行了血清学检测,没有发生JE病毒感染;因此,亚临床感染的风险为每10,000个旅行者日为零(95%置信区间[CI]=0-3.9)(184)。
日本脑炎疫苗
不同国家/地区生产和提供四种类型的乙型脑炎疫苗,包括减毒活疫苗、重组(嵌合)活疫苗、灭活小鼠脑源性疫苗和灭活Vero细胞培养衍生疫苗(3,7,185,186)。JE-VC以Ixiaro的名义生产,是唯一在美国获得许可和上市的日本脑炎疫苗。JE-MB,作为JE-VAX制造,以前在美国上市;生产已经停止,所有剂量已于2011年5月到期(16)。
保护的关联性
由于亚洲有几种有效的日本脑炎疫苗,因此评估新型日本脑炎疫苗的随机对照有效性试验在逻辑上是困难的,而且可能不道德。JE-VC因其诱导JE病毒中和抗体的能力而获得许可,这被认为是疗效的可靠替代物(187,188)。1930年代的观察表明,意外接触JE病毒的实验室工作人员在具有可测量的中和抗体时可以免受疾病侵害(187)。这些观察结果得到了使用许可和实验性乙型脑炎疫苗的动物被动抗体转移和主动疫苗接种研究的进一步支持。小鼠研究表明,中和抗体的被动转移可保护动物免受日本脑炎病毒攻击,并在抗体滴度和保护水平之间建立剂量-反应关系(189–192)。这些研究还表明,主动启动但没有检测到的针对JE病毒的中和抗体的动物免受致命攻击,显示出有效的记忆删除免疫应答(192)。最近的一项研究表明,针对源自基因III型乙型脑炎病毒株(即源自Nakayama株的JE-MB和源自SA14-14-2株的嵌合疫苗)的两种JE疫苗的超免疫腹水可保护小鼠免受四种基因型的JE病毒株的脑内攻击。这些数据表明,中和抗体可针对异源JE病毒基因型提供保护(193)。在另一项研究中,小鼠被动接种了来自接种JE-VC的人类的针对JE病毒的中和抗体滴度不同的混合血清。18小时后,用致死剂量的基因型I(KE-093)或基因型III(SA14)JE病毒株(194)攻击小鼠。体外中和抗体滴度为≥10的小鼠在感染基因型I和III型JE病毒株后存活率分别为100%(10个中的10个)和90%(10个中的9个)。在接受较低滴度血清的小鼠中,存活率与免疫血清的中和抗体滴度相关。积极接种不同剂量的JE-VC和JE-MB的小鼠对JE病毒SA14菌株的腹膜内攻击也具有剂量依赖性保护(194)。最后,在一项旨在开发非人灵长类动物JE动物模型的研究中,16只恒河猴接受了90%有效剂量的JE病毒鼻内攻击(即,当通过鼻内攻击注射时,预计会导致90%的动物发生脑炎),包括四只猴子,它们被给予了四剂灭活的小鼠脑源性JE疫苗,8只猴子接种了两种发育性痘病毒JE疫苗中的一种,以及4只未感染JE病毒的对照猴(195,196)。保护猴子免受致命攻击所需的最低中和抗体滴度在30到46之间。本研究中保护所需的较高滴度可能是由用于开发模型的高激发剂量引起的。
PRNT用于测量灭活或中和病毒的功能性抗体。APRNT50滴度是终点血清稀释度的倒数,可将攻击病毒斑块计数减少50%。世卫组织专家小组接受了PRNT50滴度为≥10作为人类抗JE保护的免疫学相关性(188)。尽管已经确定了保护的相关性,但由于持续的免疫记忆,中和抗体滴度已减弱至<10水平的接种疫苗者仍可能受到保护。几项研究表明,没有可测量的中和抗体的接种疫苗的人可以对感染产生快速的记忆删除反应(197-199)。T细胞也可能在清除乙型脑炎病毒中发挥关键作用。
PRNT可以使用各种方案进行,PRNT结果的有效性和可比性取决于所选检测的详细组分(例如,终点中和、孵育条件、细胞底物和靶病毒)(188,200)。虽然JE病毒PRNT仅在选定的参考实验室进行,但必须特别注意用于测量JE病毒中和抗体滴度的PRNT检测的特征和验证,作为疗效的替代物。
JE-VC型
制造和许可
2009年3月,FDA批准JE-VC用于≥17岁人群;2013年5月,执照扩大到包括≥2个月(17)岁的儿童。加强剂量于2010年10月被批准用于≥17岁的人,并于2018年4月被批准用于儿童。
JE-VC是一种灭活疫苗,来源于在Vero细胞中繁殖的减毒SA14-14-2日本脑炎病毒株(Box1)(14,201,202)。每0.5mL剂量含有6个抗原单位的纯化灭活JE病毒和约250μg氢氧化铝作为佐剂。
JE-VC在成人中的免疫原性
0天和28天时的初级系列
目前尚无针对JE-VC的疗效数据。该疫苗因其诱导日本脑炎病毒中和抗体作为保护替代物的能力而获得许可。在美国、奥地利和德国,关键的非劣效性免疫原性研究比较了第0天和第28天给予2剂JE-VC与第0、7和28天给予3剂JE-MB,与≥18岁的成年人(203)。接种前PRNT50所有受试者的滴度均为<10。在按方案分析中,365名JE-VC接受者中有352名(96%)出现了PRNT50滴度≥10,而最后一次注射后28天,370例JE-MB受者中有347例(94%)(14)。PRNT公司50在有数据可查的361名JE-VC接受者中,91%的滴度为>80。血清转化率的差异为2.6%(95%CI=−0.5%–6%),并且确定JE-VC与JE-MB相比具有非劣效性(14,203)。PRNT公司50JE-VC受者的几何平均滴度(GMT)为244(95%CI=216–274),而JE-MB受者的几何平均滴度(95%CI=90–115)。然而,中和抗体测定中的靶JE病毒株是SA14-14-2(即JE-VC中使用的JE病毒株),而JE-MB是由中山JE病毒株产生的。GMT比值为2.3(95%CI=2.0-2.8),再次确定非劣效性。
获得许可的疫苗时间表部分来自一项研究,该研究将间隔28天接种的26-μg疫苗与单剂6μg或12μg疫苗进行了比较(204)。在接受1剂标准6-μg方案28天后,230名JE-VC接受者中只有95名(41%)发生了PRNT血清转化50滴度≥10。在接种第一剂疫苗56天后,接种了2剂疫苗的113名参与者中有110名(97%)患有PRNT50滴度≥10,而接受单次6-μg或12-μg剂量的患者中,117例为30例(26%),114例为47例(41%);三组的GMT分别为218、8和11。所有血清转化的2剂接种者在接种第二剂疫苗后7天内均具有保护性抗体。在所有其他许可前和许可后随机对照试验和观察性研究中,≥95%的成年人在接受间隔28天的2剂JE-VC后获得血清保护,但一项研究显示≥64岁成年人的血清保护率较低(表1)(201,203–209)。
≥65岁的成年人
许可前临床试验没有纳入足够数量的≥65岁人群,无法充分评估该年龄组的免疫原性。一项关于JE-VC的免疫原性研究纳入了24名年龄≥65岁的患者,他们按照方案接受了2剂初级系列治疗。在接种第二剂后28天,23例(96%)患者的血清保护滴度为255(14,203)。
进行了一项许可后IV期观察性研究,以调查JE-VC在老年人中的免疫原性(206)。中位年龄为69岁(范围:64-83岁)。在接种2剂初级系列疫苗的第二剂后42天,197人中有128人(65%)接受了血清保护,GMT为37。与JE-VC关键免疫原性研究的结果相比,血清保护率和GMT都显着降低,该研究参与者的中位年龄为41岁(203岁)。在研究中,老年人在42天时测量了第二剂后的血清保护,而关键免疫原性研究中为28天;然而,这种差异不太可能解释结果。在对173名65-74岁人群与23名75-83岁人群的子分析中,两组的血清保护率和GMT相似。没有收集到关于第二剂后>42天的血清保护率的数据,也没有收集到对额外剂量或早期加强剂量的JE-VC的免疫反应的数据。
延迟注射初级系列的第二剂
在一项研究中,既往接受过单次6-μg剂量的JE-VC且PRNT50第6个月的滴度<10在第11个月接受第二次6-μg剂量(14,210)。在接种第二剂后28天,100人中有99人(99%)获得血清保护,GMT为504(95%CI=367-692)。与间隔28天接种的2剂相比,间隔11个月接种的2剂疫苗具有相似的血清保护率和更高的GMT。在0个月和11个月方案的第2剂后13个月,96名参与者中有85名(89%)仍受到血清保护,GMT为121(95%CI=87-168)。除了少数研究参与者在间隔23个月接种2剂时发生血清转化的轶事报告外,没有关于间隔>11个月注射的初级系列疫苗的免疫原性的数据。
18-65岁成人的加速初级系列
一项针对奥地利、德国和瑞士18-65岁成人的随机对照试验研究了在第0天和第7天加速初次接种JE-VC后免疫原性,同时给予纯化的鸡胚细胞狂犬病疫苗(14,205)。在两个对照组中,JE-VC在第0天和第28天按照常规的2剂初级系列接种,有或没有狂犬病疫苗。狂犬病疫苗在第0、3和7天(美国是一种未经许可的方案)在加速计划组中接种,在第0、7和28天在常规组中接种。在接种第二剂JE-VC疫苗后28天,加速接种狂犬病疫苗组206例患者中有203例(99%)接种狂犬病疫苗组,157例接种狂犬病疫苗组157例(100%),单独接种JE-VC常规接种方案组49例(100%)接受血清保护(表2)。PRNT公司50加速方案组的GMT为690,而使用狂犬病疫苗的常规JE-VC方案为299,单独使用常规JE-VC方案为337。在第二剂后10-12个月,加速计划组的血清保护率为94%,其他两组分别为86%和88%(14,211)。加速赛程组的GMT为117,是其他两组39的GMT的三倍。加速计划组中GMT较高的原因尚不清楚;在研究期间,没有研究参与者报告接种了其他黄病毒疫苗(211)。
JE-VC的II期研究也提供了较短注射方案的数据,该研究调查了18-49岁成年人的替代注射方案(201)。一个研究组包括以0、14和28天的时间表接受JE-VC的人,并在第28天接种疫苗前收集血样。在接种0天和14天剂量后14天,23人中有22人(96%)受到血清保护,GMT为328(95%CI=189-570)。
预先存在黄病毒抗体的成人
一项研究评估了针对另一种黄病毒蜱传脑炎(TBE)病毒的预先存在的抗体的影响,确定TBE病毒抗体在第一次注射后增强了对JE-VC的反应,但在2剂初级系列后没有效果(212)。在接种1剂JE-VC后,81名既往存在TBE病毒IgG抗体的人中有62名(77%)产生了针对JE病毒的保护性抗体,而339名既往没有TBE病毒抗体的JE-VC受者中有166名(49%)产生了针对JE病毒的保护性抗体。然而,在第二剂JE-VC后,有和没有TBE病毒抗体的人对JE病毒的血清保护率同样高,分别有78人(96%)和310人(91%)(339人中有81人)有保护性抗体;这种差异没有统计学意义(p=0.17)。日本脑炎病毒PRNT50接种2剂JE-VC后,两组之间的GMT也相似(分别为207和187;p=0.56)。
JE-VC初级系列后中和抗体的持续时间
三项临床试验提供了间隔28天接种2剂初级JE-VC系列后保护性中和抗体持续存在的数据。在中欧(奥地利、德国和罗马尼亚)进行的一项研究中,血清保护率从接种2剂系列的第一剂后6个月的95%到60个月时的82%不等(表3)(14,213,214)。一项使用类似方法但在西欧和北欧(德国和北爱尔兰)进行的研究发现,在接受2剂JE-VC的成年人中,6个月时血清保护率为83%(116人中有96人),12个月时为58%(116人中有67人),首次接种疫苗后24个月时为48%(116人中有56人)(165人)。在奥地利和德国进行的第三项临床试验中,在接种2剂JE-VC疫苗系列的第一剂后15个月,69%(198人中的137人)的参与者具有保护性中和抗体滴度(215)。
为了调查三项研究中相似时间点血清保护率存在显著差异的可能原因,使用在中欧(奥地利、德国和罗马尼亚)进行的研究的受试者数据进行了后续分析,并按TBE疫苗接种状态对受试者进行分层(表4)(214,216)。在分层分析中,与在研究之前或期间接种过TBE疫苗的组相比,未接种TBE疫苗的组在接种2剂初级系列疫苗后6至60个月的所有时间点的血清保护率均较低。在美国,TBE疫苗不可用,其他黄病毒疫苗不常规与JE-VC一起接种;因此,JE-VC之后的免疫反应可能与未接种TBE疫苗的参与者最相似。
加强剂量后的免疫反应
两项临床试验提供了对加强剂量JE-VC的反应数据。在奥地利和德国进行的一项研究中,198名≥18岁的成年人接受了2剂JE-VC初级系列接种,在首次接种后15个月接种了加强剂(215)。在加强剂量后28天,具有保护性中和抗体滴度的参与者百分比从加强剂量前的69%(198人中的137人)增加到100%(198人中的198人),并且在加强剂量后6个月和12个月时,98%的人发现了保护性滴度(表5)。加强针前的GMT为23,在加强针后28天增加了40倍,达到900。在加强剂量后约76个月,67名参与者中有64名(96%)仍然患有PRNT50滴度≥10,GMT为148,表明加强剂量后至少6年内具有良好的血清保护率(217)。在第76个月时,有和没有TBE或黄热病疫苗接种史的人的GMT没有显著差异。这项研究的数据被用于数学模型,以估计加强剂量后的保护平均持续14年(范围:2-25年)。
在第二项研究中,对40名接受过2剂初级系列治疗但不再具有保护性中和抗体滴度的人进行了加强剂量(210)。加强剂在首次注射后11个月(n=16)或23个月(n=24)注射,导致所有人的保护滴度。在接种加强针后1个月的GMT增加到676(95%CI=365-253),在11个月时接种的组中,接种加强针的组增加到2,496(95%CI=1,408-427),在初级系列接种后23个月接种的组中增加到2,496(95%CI=1,408-427)。在11个月时接受加强剂量的16人中,所有患者在13个月后仍具有血清保护滴度。
初次接种JE-MB后使用JE-VC
在一项针对至少接种过3剂JE-MB或未接种JE疫苗的美国军事人员的研究中,人们在第0天和第28天接种了2剂JE-VC,在先前接种过JE-MB疫苗的人接种1剂后28天评估了免疫原性,在未接种疫苗的人中接种了2剂后2天(207)。先前接种过日本脑炎疫苗的人在2.9年前接种了最后一剂日本脑炎疫苗(范围:1.8-10.2岁)。在符合方案的分析中,在接种1剂JE-VC后第28天接种过疫苗的参与者的血清保护率为100%(44人中有44人),在接种2剂后28天,既往未接种疫苗的参与者的血清保护率为93%(57人中有53人)。与接种2剂疫苗的既往未接种疫苗的受试者相比,接种1剂疫苗的受试者的GMT显著高于接种2剂疫苗的受试者(GMT79;95%CI=54-114)。在既往接种过乙型脑炎疫苗的人士中,自接种最后一剂乙型乙型脑炎疫苗后所达到的中和抗体滴度无显著影响;然而,只有12名(27%)参与者在入组前≥5年接受了最后一剂JE-MB。
在另一项美国研究中,使用来自军事人员的存档血清,评估了先前接种至少3剂JE-MB的成人接种单剂JE-VC后12-23个月的免疫原性,与接种2剂JE-VC系列疫苗的未接种JE疫苗的成人相比(218)。有JE-MB疫苗接种史的人在JE-VC剂量前2.9年(范围:1天至19岁)接种了最后一剂JE-MB,中位数接种了3剂JE-MB。在12-23个月时,既往接种过JE-MB疫苗的人员血清保护率为94%(250人中有235人),以前未接种疫苗的人员为54%(250人中有135人)。既往接种过JE-MB疫苗的人员的GMT为75(95%CI=63-90),显著高于既往未接种疫苗的人员的GMT为12(95%CI=11-14)。
在斯堪的纳维亚半岛的旅行诊所对计划前往日本脑炎流行地区的成年人进行了一项观察性研究(208)。一项研究队列包括接种过2剂或3剂JE-MB并接种过1剂JE-VC疫苗的受试者;对照组包括在第0天和第28天接种2剂JE-VC的未接种JE疫苗的人。在先前接种过1剂JE-VC的人群中,他们最后一次接种JE-MB的中位数为5.2年前(范围:1-21岁)。在JE-VC剂量后4-8周,98%(42人中有41人)的GMT为504进行血清保护。在未接种疫苗的人中,在接种两剂JE-VC疫苗后4-8周,97%(31人中有30人)的GMT为499。在一项调查保护持续时间的后续研究中,原始研究队列中只有47%的人可用(219)。在最后一剂JE-VC疫苗后平均2.1年,既往接种JE-MB疫苗且已接种1剂JE-VC的人士的血清保护率为100%(18人中有18人),而既往未接种疫苗但已接种2剂JE-VC的人的血清保护率为93%(14/15)。
这些研究的结果表明,在既往接种过JE-MB疫苗的人群中,单剂JE-VC在大约4周时的血清保护率和GMT并不劣于接受标准2剂JE-VC系列的未接种疫苗人群。在12-23个月时,既往接种至少3剂JE-MB的成人接种1剂JE-VC后的免疫反应仍然不劣于接种2剂JE-VC初级系列疫苗的未接种JE疫苗的成人的反应。
JE-VC与其他疫苗同时注射
JE-VC与甲型肝炎疫苗
在一项临床试验中,第一剂JE-VC与甲型肝炎疫苗同时注射,表明不会干扰对JE-VC或甲型肝炎疫苗的免疫反应(209)。在按照方案分析同时接种JE-VC和甲型肝炎疫苗的58人中,所有人都具有保护性中和抗体,而单独接受JE-VC的人中有98%(58人中有57人)。GMT也相似,分别为203(95%CI=154–261)和192(95%CI=148–250)。此外,与单独接种甲型肝炎疫苗的人(96%,50/52)和HAV抗体GMT相似(分别为150和124)。然而,男性和女性在达到的抗HAV抗体水平方面存在一些差异,血清转化率和抗体滴度因使用的抗HAV测定而有所不同;这些观察结果是否具有任何临床意义尚不清楚。
JE-VC与狂犬病疫苗
一项随机试验评估了单独或同时对18-65岁的成年人接种疫苗时对JE-VC和纯化的鸡胚细胞培养狂犬病疫苗的免疫反应(14,205,220)。JE-VC在第0天和第28天以2剂方案接种,狂犬病疫苗在第0、7和28天以3剂方案接种。在第二次JE-VC剂量后28天,同时注射组(157/157)和单独注射JE-VC组(49人中的49人)的所有患者均具有针对JE病毒的血清保护性中和抗体滴度,GMT相似,分别为299和337(表2)。在首次接种JE-VC后12个月,乙脑血清保护率相似,分别为86%(154人中有132人)和88%(48人中有42人),两组的GMT均为39(211)。在第三剂狂犬病疫苗后28天,伴随接种狂犬病疫苗组的狂犬病病毒保护性中和抗体浓度(即≥0.5IU/mL)的百分比为100%(157人中的157人),单独接种狂犬病疫苗的组为99%(204人中的203人)(220人)。与单独接种任何一种疫苗相比,同时接种JE-VC和狂犬病疫苗的免疫反应具有非劣效性。
JE-VC和狂犬病疫苗与脑膜炎球菌疫苗
另一项研究对18-60岁的成年人同时接种JE-VC和纯化的鸡胚细胞狂犬病疫苗,联合或不联合四价脑膜炎球菌结合疫苗(221)。另外两组单独接种狂犬病疫苗或单独接种脑膜炎球菌疫苗。JE-VC按0天和28天的时间表注射,狂犬病疫苗按0、7和28天的时间表注射,脑膜炎球菌疫苗在第0天单剂注射。在按方案分析中,在最后一剂JE-VC和狂犬病疫苗后28天,接种所有三种疫苗的97名成年人中有95名(98%)具有针对JE病毒的血清保护滴度,而接受JE-VC和狂犬病疫苗的96人中有95名(99%)接种了JE-VC和狂犬病疫苗。GMT也相似,分别为165(95%CI=136-199)和183(95%CI=151-151-21)。在接种狂犬病疫苗的三组中,所有受试者的狂犬病病毒保护性抗体浓度均为≥0.5IU/mL。同时接种三种疫苗的人对脑膜炎球菌疫苗的反应测量时间为56天,单独接种脑膜炎球菌疫苗组为28天。针对脑膜炎球菌血清群A、C、W或Y达到人血清杀菌测定抗体滴度≥1:8的受试者百分比未发现显着差异;然而,当单独接种脑膜炎球菌疫苗时,针对每个血清组的GMT更高。由于两组抽血的时间点不同,这些结果的解释变得复杂。
JE-VC对不同日本脑炎病毒基因型的免疫原性
JE-VC来源于基因型IIISA14-14-2日本脑炎病毒。为了评估针对不同JE病毒基因型提供的交叉保护,对接受2剂初级JE-VC系列的欧洲旅行者进行了一项研究,并评估了针对代表基因型I、II、III和IV的JE病毒株的中和抗体的存在(222)。在初级系列接种后4-8周,在接种JE-VC的29人中,≥93%的人对每种病毒株的PRNT滴度为≥10。GMT范围从基因型I菌株的55到基因型II菌株的811。
JE-VC在儿童中的免疫原性
初级系列
JE-VC的关键性儿科临床试验在菲律宾2个月-17岁的儿童中进行(14,223)。在随机分配接受2种适龄剂量JE-VC的儿童中,385例中有384例(99.7%)在第二次注射后28天受到血清保护(95%CI=96%–100%)(表6)。接受0.25mL和0.5mL剂量的儿童的血清保护率相似。
在印度对1-2岁儿童进行的一项随机对照试验中,23名儿童中有22名(96%)(95%CI=87%–100%)在接受2剂0.25mL剂量的JE-VC后28天接受血清保护,而11名儿童中有10名(91%)(95%CI=74%–100%)接种了3剂灭活小鼠脑源性JE疫苗(14,224).GMT分别为201(95%CI=106-380)和230(95%CI=68-784)。在一项针对来自无流行JED的国家的62名儿童的观察性研究中,所有儿童在接种第二剂JE-VC后28天均具有保护性中和抗体(14,225)。
JE-VC初级系列后中和抗体的持续时间
在菲律宾进行的JE-VC儿科临床试验中,在完成初级系列研究6个月后,152名2个月-2岁儿童中有134名(88%)(95%CI=82%-92%),237名3-17岁儿童中有224名(95%)(95%)有保护性中和抗体(14,223)。300名儿童参加了一项后续研究,并被随机分配到接受或未接受加强剂量的组(226)。在未接种加强剂的150名儿童中,90%(149人中有134人)在接种2剂初级系列疫苗的第二剂后11个月获得血清保护,23个月时为89%(146人中有130人),35个月时为90%(142人中有128人)(14,226人)。
在对来自无流行日本脑炎的国家的儿童进行的观察性研究中,91%(34人中有31人)儿童在接种2剂初级系列疫苗的第二剂后6个月具有保护性中和抗体(14,225)。在参加随访研究的一个子集中,11个月时血清保护率为89%(19人中有17人),23个月时为91%(23人中有21人),35个月时为89%(19人中有17人)(14人)。
加强剂量后的免疫反应
在菲律宾进行的儿科免疫原性研究随访的300名儿童中,150名被随机分配在初级系列疫苗第二剂后11个月接受适合年龄的加强剂量。在这些儿童中,94%(148人中有139人)在加强剂量前具有保护性中和抗体滴度,100%在加强剂量后1个月、12个月和24个月具有血清保护作用(表7)(14,226)。加强剂量前的GMT为53,在加强剂量后1个月增加约40倍,达到2,067。加强剂量后12个月的GMT保持在428的高位,在24个月时为350。数据还用于数学模型,以估计加强剂量后的保护持续时间,并建议中位持续时间为9年(范围:<5年至≥30年)(227)。
JE-VC的局部和全身不良事件
在许可前临床试验中,对大约5,000名成人进行了JE-VC研究(15)。JE-VC引起的局部和全身不良事件与单独使用JE-MB或安慰剂辅助治疗报告的不良事件相似(228,229)。随后的执照后研究包括儿童和老年人,未发现安全问题(206,230)。自疫苗获得许可以来,已分发了大约100万剂疫苗,并且没有发现与疫苗相关的严重超敏反应、神经系统或其他严重不良事件的模式(231,232)。
在成人中,服用JE-VC后最常见的局部反应是疼痛和压痛,最常见的全身反应是头痛和肌痛(14,228)。在儿童中,最常报告的局部反应是2个月至<3岁儿童的发红和3-17岁儿童的疼痛和压痛,最常报告的全身反应是发热(14,230)。
与安慰剂辅助相比,JE-VC的不良事件
这项关键安全性研究比较了1,993名≥18岁的成年人,这些成年人被随机分配接受2剂JE-VC和657名被分配接受2剂安慰剂佐剂(磷酸盐缓冲盐水和0.1%氢氧化铝)的人,结果显示类似的反应原性和不良事件,包括就医和严重不良事件(228)。给予第1剂或第2剂JE-VC后最常见的局部反应是疼痛(第1剂和第2剂后分别为28%和18%)和压痛(29%和23%),最常见的全身反应是头痛(22%和13%)和肌痛(13%和6%)(14,228)。2例患者有荨麻疹(228例)。第一位患者在大腿上有皮疹,这发生在第二次安慰剂疫苗接种后6天。第2例患者出现面部、胸部、手臂和腹部全身性荨麻疹,发生在第二剂JE-VC后8天,被描述为中度;未观察到血管性水肿。患者接受盐酸西替利嗪治疗,3天后皮疹消退(228)。共有17人,其中JE-VC组12人(0.6%)和安慰剂组5人(0.8%)因不良事件而提前终止研究(228)。在JE-VC组中,其中2起事件(胃肠炎和皮疹)被认为是严重的,其中8起(头痛[2起事件]、流感样疾病、过敏性皮炎、注射部位疼痛、恶心、疲劳和皮疹)被认为至少可能与研究治疗有关。未发现严重的神经系统事件。
与JE-MB相比,JE-VC的不良事件
在针对≥18岁成年人的非劣效性免疫原性试验中,接种JE-VC疫苗后报告的不良事件的总体发生率(n=428人)与接受JE-MB的人报告的不良事件发生率(n=435人)相似(203)。≤1%的JE-VC受者报告了注射部位的严重发红、肿胀、压痛或疼痛(表8)。接种JE-VC疫苗后报告的全身不良事件通常较轻;每次注射后7天内最常报告的不良事件是头痛(26%)、肌痛(21%)、流感样疾病(13%)和疲劳(13%)。JE-VC组报告了1例严重不良事件;一名50岁的男性在第二次接种疫苗3周后发生非致死性心肌梗死。研究者认为该事件不太可能与研究疫苗有关。
汇总安全数据
对≥18岁成年人的7项许可前研究的6个月安全性数据进行了汇总分析,包括3,558名至少接种1剂JE-VC的人、435名接种至少1剂JE-MB的人和657名安慰剂辅助接受者(229)。48%的JE-VC患者、46%的JE-MB接受者和48%的安慰剂辅助接受者报告了第1剂后7天内的局部注射部位反应。然而,与JE-VC(3%)和安慰剂辅助接受者(2%)(p<0.01)相比,JE-MB(6%)后第1剂后的严重局部反应更为频繁。在接受JE-VC(64%)、JE-MB(64%)或安慰剂(61%)的患者中报告的全身不良事件频率相似。JE-VC组中有1%的人报告了严重不良事件。任何研究组均未发生严重过敏反应。与第一剂相比,第二剂后受试者报告的全身不良事件百分比较低。
在加速初级系列中注射的JE-VC的不良事件
在成人加速接种JE-VC与纯化的鸡胚细胞狂犬病疫苗(n=217)、标准方案中同时接种狂犬病疫苗(n=167)或仅按标准方案接种JE-VC(n=56)的研究中,分别报告了74%、75%和63%的局部不良事件(205)。三组患者分别有66%、60%和54%的人报告了全身不良事件。总体而言,当JE-VC以加速或标准方案注射时,局部和全身不良事件发生率相似。
≥65岁成人JE-VC的不良事件
在接种2剂JE-VC初级系列疫苗的≥65岁成人中,在每次接种后7天内,最常见的局部反应是压痛(26%),最常见的全身反应是头痛(18%)(206)。到第二剂后第42天,200人中有38人(19%)报告了严重或有医学参与的不良事件,但研究调查人员认为没有一起不良事件与疫苗接种有因果关系。
儿童不良事件
在菲律宾的一项开放标签试验中,195名2-11个月大的婴儿被随机分配接受JE-VC(n=131)或7价肺炎球菌结合疫苗(n=64)。另外1,674名1-17岁的儿童被随机分配接受JE-VC(n=1,280)或甲型肝炎疫苗(n=394)(14,230)。接受JE-VC或对照疫苗的儿童的局部、全身、就医和严重不良事件的发生率相似。不良事件在2-11个月的儿童中最常见。最常报告的局部反应是2个月至<3岁儿童的发红和3-17岁儿童的疼痛和压痛。总体而言,9%(1,411人中有122人)的JE-VC受者在首次注射后7天内出现发热(≥100.4℉[38.0℃]),6%(1,405人中有84人)在第二次注射后7天内发热(17)。与年龄较大的儿童相比,<3岁儿童的发热率更高。在任一注射后1个月内,4例(<1%)接受者出现荨麻疹或超敏反应,5例(<1%)出现神经系统不良事件,包括热性惊厥(n=3)、流涎(n=1)和头晕(n=1);所有接种率均与对照疫苗接种者的接种率相似。第1剂后引发的局部和全身不良事件比第2剂更常见。在2-11个月的儿童中,46%报告了第1剂后的事件,28%报告了第2剂后的事件,在1-17岁的儿童中,分别有32%和18%报告了第1剂和第2剂后的事件。在接受JE-VC的1,411名儿童中,23名(2%)报告了首次注射后7个月内的严重不良事件。最常见的严重不良事件是肺炎(n=6)和热性惊厥(n=5)。在服用JE-VC后2周内仅报告了3例严重不良事件,包括热性惊厥、蜂窝织炎和胃肠炎各1例。据报道,一名12岁男孩在接受第二剂JE-VC后4个月时因疑似细菌性脑膜炎后弥散性血管内凝血而死亡,研究者和试验的数据安全监测委员会认为与疫苗接种无关。没有其他神经系统或超敏反应事件被报告为严重不良事件。
在印度的一项试验中,在随机分配接受JE-VC的48名1-2岁儿童中,报告了5例(10%)注射部位压痛和1例(2%)发热病例(224)。唯一不请自来的不良事件是皮肤病变和皮疹各报告一次。没有严重不良事件或死亡的报告。
在一项针对来自无流行JED的国家的2个月-17岁儿童的观察性研究中,评估了12名接受0.25mL剂量的儿童和88名接受0.5mL剂量的儿童的不良事件(14,225)。在接受0.25mL剂量的儿童中,JE-VC剂量后7天内最常见的不良反应是注射部位发红(n=3,25%)和腹泻(n=2,17%)。在接受0.5mL剂量的儿童中,最常见的不良反应是注射部位压痛(n=44,50%)和肌肉疼痛(n=27,31%)。报告了三起严重不良事件。在任一剂量的JE-VC后28天内均未发生。各有一名患儿患有糖尿病(第2剂后3个月)、头晕(第2剂后4个月)和故意自残。
成人和儿童JE-VC加强剂量后的不良事件
在≥18岁的成年人中,在2剂初级系列疫苗的首次注射后15个月接受JE-VC加强剂量,在加强剂量后的7天内,最常见的局部反应是19%(193例中的37例)和13%的疼痛(195例中的25例),最常报告的全身反应是11%(194例中的21例)和10%(188例中的18例)的疲劳(16,215,233)。在加强剂量后的28天内没有报告严重不良事件。
在一项针对儿童进行的类似试验中,在加强剂量后7天内,148名儿童中有12名(8%)发生局部不良事件,21名(14%)发生全身不良事件(226)。两名儿童在加强剂量后1个月内发生严重不良事件。1名儿童在接种疫苗后1天腰部出现脓肿,1名儿童在接种加强剂约4周后出现登革热。
同时接种JE-VC和甲型肝炎或狂犬病疫苗的不良事件
在一项临床试验中,与单独接种任何一种疫苗的人相比,接受第一剂JE-VC与甲型肝炎疫苗同时接种的人更有可能报告疼痛,发红和肿胀[209]。与单独接种每种疫苗相比,同时接种JE-VC和甲型肝炎疫苗在安全性或反应原性方面没有其他差异。
与单独接种相比,接受JE-VC和狂犬病疫苗的成人在联合接种疫苗时报告了更多的局部和全身不良事件(205,220)。在同时接种疫苗的166人中,有125人(75%)报告了局部反应,100人(60%)报告了全身反应。在56例单独接受JE-VC治疗的患者中,35例(63%)报告了局部反应,30例(54%)报告了全身反应。
获得许可后JE-VC监控
自获得疫苗许可以来,美国疫苗不良事件报告系统(VAERS)对疫苗安全性数据进行了两次审查,涵盖2009年5月至2016年4月期间共7年,当时分发了>100万剂JE-VC(231,232剂)。VAERS是国家被动监测系统,用于监测疫苗接种后的不良事件,由医疗保健提供者、疫苗接受者和疫苗制造商提交报告。两项分析的总体不良事件发生率相似,第一次分析的不良事件发生率为每10万剂15.2例,第二阶段为每10万剂14.8例不良事件。这些比率与之前向VAERS报告的JE-MB每100,000剂15.0和23.7例不良事件相似或更低(234,235)。在向VAERS报告的JE-VC数据的两项分析中,根据FDA定义定义的严重不良事件发生率为每100,000剂1.8例和1.1例;在14份严重事件报告中,11份(79%)是将JE-VC与一种或多种其他疫苗一起接种的报告(236)。据报道,超敏反应事件的发生率为每100,000剂3.0和4.4例,56%(36剂中的20例)发生在JE-VC与其他疫苗同时注射后。神经系统事件报告的发生率为每100,000剂2.2和1.2起事件。神经系统不良事件报告包括4例疫苗接种后癫痫发作的报告,均发生在JE-VC与其他疫苗一起接种后。VAERS数据通常不能用于确定因果关系,特别是在接种多种疫苗的人中。然而,这两项分析中的大多数报告并不严重,也没有发现特定事件的意外高报告率。
在美国军事人员中进行的上市后不良事件监测研究中,超敏反应和神经系统反应的发生率要高得多,这反映了不同的研究方法(237)。采用主动监测方法,使用国际疾病分类第九次修订版、代码确定事件,并对医疗记录进行回顾性审查。然而,往往缺乏对事件的完整描述,无法澄清某些事件的性质。此外,评估是在军事人员中进行的,这些人员有时接种了多种其他JE-VC疫苗,包括反应原疫苗。
孕妇或哺乳期妇女的疫苗接种
尚无对照研究评估JE-VC在孕妇中的安全性、免疫原性或有效性。JE-VC在怀孕大鼠中的临床前研究未显示对胎儿有害的证据(14)。没有研究调查JE-VC在母乳喂养妇女中的安全性或免疫原性,也没有关于JE-VC是否在母乳中排泄的数据。ACIP最佳疫苗接种实践的一般指南表明,对母乳喂养妇女接种的灭活疫苗不会影响妇女或其婴儿的母乳喂养安全(238)。
日本脑炎疫苗的成本效益
几项研究表明,在乙型脑炎流行国家,与不接种疫苗相比,在日本脑炎流行国家的儿童中接种日本脑炎疫苗具有成本效益或节省成本(239-241)。由于美国旅行者的疾病风险大大降低,而且使用的疫苗成本比亚洲常规疫苗接种计划高得多,因此旅行者接种乙脑型脑炎疫苗预计不会具有成本效益。然而,成本效益与旅行疫苗不太相关,因为旅行疫苗通常由旅行者自己支付,并且大多数保险计划或儿童疫苗计划不涵盖。
一项比较分析比较了三组美国旅行者前往亚洲的日本脑炎疫苗接种策略(242)。第l组包括计划在日本脑炎流行地区停留≥1个月的高风险旅行者,第2组包括将在日本脑炎流行地区停留<1个月且至少有20%的时间在农村地区参加户外活动的旅行者,第3组包括其余前往亚洲的短期和低风险美国旅行者。使用了6年的分析范围,尽管生产力损失是在平均预期寿命上评估的。为了预防一例日本脑炎病例,第1、2和3组需要接种疫苗的旅行者人数分别为70万、160万和980万。从社会角度来看,预防一个乙型脑炎病例的成本约为6亿美元、13亿美元和79亿美元。对疫苗接种成本效益影响最大的变量是旅行者的疾病发病率,并且进行了敏感性分析,使基线发病率增加了100倍。利用这一较高的发病率,在第1、2和3组中,预防病例所需的疫苗接种人数分别为7,000、16,000和98,000,每个避免病例的成本分别为500万美元、1200万美元和7800万美元。尽管所有旅行者群体避免的每例病例的成本都很高,但这项比较分析支持将重点放在与风险较低的旅行者相比,对疾病风险增加的旅行者进行疫苗接种。
预防美国旅行者发生日本脑炎的建议
对于大多数前往日本脑炎流行国家的美国旅行者来说,日本脑炎是一种风险非常低的疾病。然而,根据他们计划的行程,一些旅行者的感染风险增加。增加日本脑炎病毒暴露风险的因素包括:1)旅行时间延长;2)在日本脑炎病毒传播季节旅行;3)在农村地区度过时光;4)参加广泛的户外活动;5)住在没有空调、屏风或蚊帐的住宿中(插文2)。
医务人员应根据其计划行程评估每位旅行者的蚊虫暴露和乙脑病毒感染风险,并讨论降低风险的方法(图3)。应建议所有前往日本脑炎流行国家的旅行者采取预防措施,避免蚊虫叮咬,以降低感染日本脑炎和其他媒介传播疾病的风险。这些预防措施包括使用驱虫剂、浸渍氯菊酯的衣服和蚊帐,以及入住带纱窗或空调房的住宿。
对于一些可能因旅行时间、季节、地点、活动和住宿而增加日本脑炎风险的人,日本脑炎疫苗可以进一步降低感染风险。是否接种疫苗的决定应因人而异,并考虑1)与特定旅行行程相关的风险,2)未来前往日本脑炎流行国家的可能性,3)日本脑炎的高发病率和死亡率,4)有效疫苗的可用性,5)接种疫苗后发生严重不良事件的可能性但可能性较低,以及6)旅行者的个人感知和对风险的容忍度。
建议移居日本脑流行国家居住的人、前往日本脑炎流行地区的长期(例如≥1个月)旅行者以及经常前往日本脑炎流行地区的旅行者接种乙型脑炎疫苗。对于根据计划旅行时间、季节、地点、活动和住宿条件,日本脑炎风险增加的短期(例如<1个月)旅行者也应考虑接种乙型脑炎疫苗(插文2)。对于前往日本脑炎流行地区的旅行者,如果不确定具体的旅行时间、目的地或活动,也应考虑接种疫苗。不建议旅行风险极低的旅行者接种日本脑炎疫苗,例如仅限于城市地区的短期旅行或在明确的日本脑炎病毒传播季节之外进行的旅行。
预防实验室工作人员乙型脑炎的建议
日本脑炎病毒的工作主要局限于生物安全3级(BSL-3)设施和实践;然而,减毒的SA14-14-2日本脑炎疫苗病毒可以在BSL-2(243)下处理。在实验室环境中,日本脑炎病毒可能通过意外经皮传播,或者理论上通过黏膜或吸入暴露传播。据推测,疫苗诱导的免疫力可以防止通过经皮途径暴露。暴露于雾化乙型脑炎病毒,尤其是病毒纯化过程中可能出现的高浓度乙型脑炎病毒,可能导致通过粘膜或嗅上皮直接感染中枢神经系统。在这种暴露后,疫苗接种是否能提供保护尚不清楚。
建议所有可能接触SA14-14-2日本脑炎疫苗病毒以外的JE病毒的实验室工作人员接种疫苗。仅使用SA14-14-2日本脑炎病毒的人通常不需要接种疫苗;然而,对于那些使用高浓度或高体积的SA14-14-2病毒或传代病毒的人,应由当地生物安全委员会进行个体风险评估,并考虑生物安全水平和疫苗接种情况。处理常规临床样本的工作人员不需要接种疫苗。
接种乙型脑炎疫苗
疫苗的组成、剂型和储存
每0.5mL剂量的JE-VC含有250μg氢氧化铝作为佐剂。成品不包括明胶稳定剂、抗生素或硫柳汞。JE-VC以0.5mL预充式玻璃注射器形式提供,带有柱塞(氯化丁基弹性体,不含天然乳胶橡胶)。疫苗应储存在35℉–46℉(2℃–8℃)下,不应冷冻。疫苗应避光保存。
剂量、注射方案和注射
初级疫苗接种系列
JE-VC的疫苗接种剂量和主要接种时间表因年龄而异(插文1)。
- 2-35个月:在第0天和第28天肌内(IM)注射2剂(每剂0.25mL)。
- 3-17岁:第0天和第28天肌肌注射2剂(每剂0.5mL)。
- 18-65岁:第0天和第7-28天肌内注射2剂(每剂0.5mL);这是唯一一个批准加速时间表的年龄组。
- >65岁:在第0天和第28天肌内注射2剂(每剂0.5mL)。
对于所有年龄组,应在可能暴露于日本脑炎病毒前至少1周完成2剂系列接种。
加强剂量
对于成人和儿童,如果预计持续暴露或再次暴露于日本脑炎病毒,则应在完成初级JE-VC系列接种后≥1年接种加强剂(即第三剂)。<3岁儿童的加强剂量为0.25mL,成人和≥3岁儿童的加强剂量为0.5mL。没有关于在初级系列接种后>2年接种加强剂量的反应的数据。临床试验数据显示,在加强剂量后至少6年内血清保护率很高(217);没有长期研究数据。美国没有关于是否需要后续加强剂量的建议。
疫苗制备
在储存过程中,疫苗可能呈透明液体,带有白色沉淀。注射前,充分摇动注射器以获得白色,不透明,均匀的悬浮液。要施用0.25mL剂量,请在注射前将柱塞向上推至注射器针筒上红线的边缘,从0.5mL预充式注射器中排出并丢弃一半体积。有关制备0.25mL剂量的更多信息,请参阅处方信息(14)。
同时接种其他疫苗或药物
在一项临床试验中,第一剂JE-VC与甲型肝炎疫苗同时注射,表明不会干扰对JE-VC或甲型肝炎疫苗的免疫反应(209)。同样,与单独接种任何一种疫苗相比,同时接种两种疫苗的免疫反应不劣于JE-VC和纯化的鸡胚细胞培养狂犬病疫苗(205,220)。如果同时接种JE-VC和其他疫苗,则应使用单独的注射器在不同的解剖部位(即尽可能相距>1英寸)注射。
使用日本脑炎疫苗的禁忌症和注意事项
对疫苗成分过敏
在先前剂量的JE-VC、任何其他JE疫苗或JE-VC的任何成分后出现严重过敏反应(例如过敏反应)是后续剂量的禁忌证。JE-VC含有硫酸鱼精蛋白,一种已知会引起某些人超敏反应的化合物(14)。
怀孕
怀孕是使用JE-VC的预防措施。乙型脑炎疫苗的接种通常应推迟,因为理论上对发育中的胎儿有风险。然而,如果孕妇必须前往日本脑炎高风险地区,如果接种疫苗对母亲和发育中的胎儿的益处大于风险,则应接种疫苗。
特殊人群
- <2个月的婴儿:JE-VC对<2个月婴儿的安全性和有效性尚未确定。
- ≥65岁的成年人:在一项针对老年人进行的许可后观察研究中,与年轻人相比,初级JE-VC系列检查后的血清保护率和GMT均显著降低。然而,尚无关于≥65岁成人额外剂量或早期加强剂量JE-VC的安全性或免疫原性的数据。
- 哺乳期妇女:母乳喂养不是接种乙型脑炎疫苗的禁忌症或预防措施。
- 免疫状态改变的人:没有关于在免疫功能低下者或接受免疫抑制治疗的患者中使用JE-VC的数据;然而,这些人对JE-VC的反应可能减弱。
疫苗不良事件报告
监测与日本脑炎疫苗接种相关的不良事件很重要。即使不确定与疫苗接种的因果关系,也应向VAERS报告所有具有临床意义的不良事件(https://vaers.hhs.gov 或800-822-7967)。
JE-VC的未来研究
对JE-VC的其他研究将有助于评估加强剂量后6年后保护性免疫的持续性、初次JE-VC系列接种后>2年对加强剂量的反应以及>65岁成年人对加强剂量的反应。
其他信息
有关日本脑炎的更多信息,请访问CDChttps://www.cdc.gov/japaneseencephalitis和CDC黄皮书(4)。有关JE-VC的其他许可信息可从美国食品和药物管理局(https://www.fda.gov/vaccines-blood-biologics/vaccines/ixiaro )。
通讯作者:SusanL.Hills,CDC国家新兴和人畜共患传染病中心。电话:970-221-6400;电子邮件:shills@cdc.gov.
1科罗拉多州柯林斯堡疾病预防控制中心国家新兴和人畜共患传染病中心病媒传播疾病司;2杜克大学医学院,北卡罗来纳州达勒姆;3德克萨斯州休斯顿贝勒医学院
CDC采用ACIP建议,用于MMWR建议和报告,MMWR政策说明和免疫计划(儿童/青少年,成人):儿童、青少年和成人常规使用疫苗的建议由免疫实践咨询委员会(ACIP)制定。ACIP被特许为联邦咨询委员会,就使用疫苗和相关制剂控制美国平民的疫苗可预防疾病向CDC主任提供专家外部建议和指导。儿童和青少年常规使用疫苗的建议与美国儿科学会(AAP)、美国家庭医师学会(AAFP)和美国妇产科医师学会(ACOG)的建议在最大程度上保持一致。成人常规使用疫苗的建议与AAFP、ACOG和美国内科医师学会(ACP)的建议一致。CDC主任批准的ACIP建议在发病率和死亡率周报(MMWR)中公布的日期成为机构指南。有关更多信息,请访问https://www.cdc.gov/vaccines/acip。
引用
- FischerM,HillsS,StaplesE,JohnsonB,YaichM,SolomonT.日本脑炎预防和控制:进展、挑战和新举措。在:ScheldWM,HammerSM,HughesJM,编辑。新发感染8.华盛顿特区:ASMPress;2008:93–124.
- HeffelfingerJD、LiX、BatmunkhN等。日本脑炎监测和免疫接种——亚洲和西太平洋地区,2016年。MMWRMorbMortalWklyRep2017年;66:579–83.交叉参考 PubMed
- HalsteadSB、HillsSL、DubischarK.日本脑炎疫苗。在:PlotkinSA,OrensteinWA,OffitPA,EdwardsKM,编辑。普洛特金的疫苗,第7版。宾夕法尼亚州费城:爱思唯尔;2017:511–48.
- HillsSL、LindseyNP、FischerM.日本脑炎。在:疾病预防控制中心。CDC2020年黄皮书:国际旅行健康信息。纽约,纽约:牛津大学出版社;2019:248–57.
- CampbellGL、HillsSL、FischerM等人。日本脑炎全球发病率估计:系统评价。公牛世界卫生机构2011;89:766–74.交叉参考 PubMed
- SolomonT、DungNM、KneenR、GainsboroughM、VaughnDW、KhanhVT。日本脑炎。JNeurolNeurosurg精神病学2000;68:405–15.交叉参考 PubMed
- 世界卫生组织。乙型脑炎疫苗:世卫组织立场文件—2015年2月。Wkly流行病学记录2015;90:69–87. PubMed
- 美国疾病预防控制中心灭活日本脑炎病毒疫苗。免疫实践咨询委员会(ACIP)的建议。MMWRRecommRep1993年;42(编号。RR-1)。 PubMed
- HillsSL,GriggsAC,FischerM.1973-2008年来自非流行国家旅行者的日本脑炎。AmJTropMedHyg2010年;82:930–6.交叉参考 PubMed
- HillsSL、StolteyJ、MartínezD等人。2010-2012年三名美国成人患有日本脑炎的病例系列。JTravelMed2014年;21:310–3.交叉参考 PubMed
- ShlimDR,SolomonT.旅行者日本脑炎疫苗:探索风险极限。临床感染Dis2002;35:183–8.交叉参考 PubMed
- EndyTP,NisalakA.日本脑炎病毒:生态学和流行病学。CurrTopMicrobiolImmunol2002年;267:11–48.交叉参考 PubMed
- 沃恩DW,小霍克CH日本脑炎的流行病学:预防前景。流行病学修订版1992;14:197–221.交叉参考 PubMed
- 美国食品和药物管理局。Ixiaro:乙型脑炎疫苗,灭活,吸附[包装说明书]。奥地利维也纳:ValnevaAustriaGmbH;2018.https://www.fda.gov/media/75777/download
- FischerM,LindseyN,StaplesJE,HillsS.日本脑炎疫苗:免疫实践咨询委员会(ACIP)的建议。MMWRRecommRep2010;59(否。RR-1)。 PubMed
- CDC.使用灭活Vero细胞培养衍生的日本脑炎疫苗加强剂量的建议:免疫实践咨询委员会,2011年。MMWRMorbMortalWklyRep2011年;60:661–3. PubMed
- 儿童使用乙型脑炎疫苗:免疫实践咨询委员会的建议,2013年。MMWRMorbMortalWklyRep2013年;62:898–900. PubMed
- AhmedF.免疫实践咨询委员会制定循证建议手册。版本1.2。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2013.https://www.cdc.gov/vaccines/acip/recs/grade/downloads/handbook.pdfpdf图标
- 美国疾病预防控制中心(CDC)的乙型脑炎疫苗证据推荐。佐治亚州亚特兰大:美国卫生与公众服务部,疾病预防控制中心。https://www.cdc.gov/vaccines/acip/recs/grade/table-refs.html
- 李G,卡尔W;ACIP循证建议工作组。免疫实践咨询委员会制定循证建议的最新框架。MMWRMorbMortalWklyRep2018;67:1271–2.交叉参考 PubMed
- KunoG,ChangGJ,土屋KR,KarabatsosN,CroppCB.黄病毒属的系统发育。JVirol1998年;72:73–83. PubMed
- 麦肯齐JS、巴雷特AD、杜贝尔诉日本脑炎血清学组的黄病毒:该组的简要介绍。CurrTopMicrobiolImmunol2002年;267:1–10.交叉参考 PubMed
- SchuhAJ,WardMJ,LeighBrownAJ,BarrettAD.整个亚洲新显性基因型日本脑炎病毒的出现和建立的动态。JVirol2014年;88:4522–32.交叉参考 PubMed
- BuescherEL,SchererWF.日本乙型脑炎病毒的生态学研究。九、流行病学相关性和结论。AmJTropMedHyg1959年;8:719–22.交叉参考 PubMed
- BuescherEL、SchererWF、McCLUREHE等人。日本乙型脑炎病毒的生态学研究。四、禽感染。AmJTropMedHyg1959年;8:678–88.交叉参考 PubMed
- BuescherEL,SchererWF,RosenbergMZ,GresserI,HardyJL,BullockHR.日本脑炎病毒的生态学研究.二、蚊虫感染。AmJTropMedHyg1959年;8:651–64.交叉参考 PubMed
- 罗森L.日本脑炎病毒的自然病程。AnnuRevMicrobiol1986年;40:395–414.交叉参考 PubMed
- SchererWF,MoyerJT,IzumiT,GresserI,McCownJ.日本脑炎病毒的生态学研究。六、猪感染。AmJTropMedHyg1959年;8:698–706.交叉参考 PubMed
- KonnoJ,EndoK,AgatsumaH,IshidaN.猪和人类中日本脑炎的周期性爆发。AmJ流行病学1966;84:292–300.交叉参考 PubMed
- 儿玉K、佐佐木N、井上YK。猪减毒活乙型脑炎疫苗的研究。J免疫学1968;100:194–200. PubMed
- UebaN,MaedaA,OtsuK,MitsudaB,KimotoT.日本脑炎病毒对猪的自然感染及其通过疫苗接种的修饰。比肯J1972;15:67–79. PubMed
- 辛普森DIH、史密斯CEG、马歇尔TF等。砂拉越的虫媒病毒感染:家猪的作用。TransRSocTropMedHyg1976年;70:66–72.交叉参考 PubMed
- 格雷瑟I,哈迪JL,胡SM,舍勒WF.影响日本乙型脑炎病毒通过库蚊菌株从受感染的猪和雏鸡传播到易感猪和禽的因素。AmJTropMedHyg1958年;7:365–73.交叉参考 PubMed
- 明尼苏达州希尔。砂拉越的日本脑炎:成年蚊子种群研究。TransRSocTropMedHyg1970年;64:489–96.交叉参考 PubMed
- SimpsonDI、BowenET、WayHJ等。1968年10月至1970年2月砂拉越的虫媒病毒感染:从蚊子中分离出日本脑炎病毒。AnnTropMedParasitol1974年;68:393–404.交叉参考 PubMed
- PeirisJS,AmerasingheFP,AmerasinghePH,RatnayakeCB,KarunaratneSH,TsaiTF.斯里兰卡的日本脑炎——流行病研究:病媒入罪、猪感染和人类疾病。TransRSocTropMedHyg1992年;86:307–13.交叉参考 PubMed
- GajananaA、RajendranR、SamuelPP等人。印度泰米尔纳德邦阿科特区南部的日本脑炎:一项为期三年的病媒丰度和感染频率纵向研究。JMedEntomol1997年;34:651–9.CrossRef PubMed
- KanojiaPC,ShettyPS,GeevargheseG.Along-termstudyonvectorabundance&seasonalprevalenceinrelationtotheoccurrenceofJapaneseencephalitisinGorakhpurdistrict,UttarPradesh.IndianJMedRes2003;117:104–10.PubMed
- KeiserJ,MalteseMF,ErlangerTE,etal.EffectofirrigatedriceagricultureonJapaneseencephalitis,includingchallengesandopportunitiesforintegratedvectormanagement.ActaTrop2005;95:40–57.CrossRef PubMed
- OlsonJG,KsiazekTG,TanR,AtmosoedjonoS,LeeVH,ConverseJD.CorrelationofpopulationindicesoffemaleCulextritaeniorhynchuswithJapaneseencephalitisviralactivityinKapuk,Indonesia.SoutheastAsianJTropMedPublicHealth1985;16:337–42.PubMed
- 古尔德DJ、爱德曼R、格罗斯曼RA、尼萨拉克A、沙利文MF。泰国清迈谷的日本脑炎病毒研究。四、病媒研究。AmJ流行病学1974;100:49–56.交叉参考 PubMed
- ReisenWK、AslamkhanM、BasioRG。气候模式和农业实践对亚洲三带喙库蚊种群动态的影响东南亚JTropMed公共卫生1976:61–71。 PubMed
- HannaJN、RitchieSA、PhillipsDA等。1995年在澳大利亚托雷斯海峡爆发的日本脑炎。MedJAust1996年;165:256–60.交叉参考 PubMed
- SchererWF,KitaokaM,OkunoT,OgataT.日本脑炎病毒的生态学研究.七、人为感染。AmJTropMedHyg1959年;8:707–15.交叉参考 PubMed
- ChaturvediUC、MathurA、ChandraA、DasSK、TandonHO、SinghUK。经胎盘感染日本脑炎病毒。J感染Dis1980;141:712–5.交叉参考 PubMed
- MathurA、TandonHO、MathurKR、SarkariNB、SinghUK、ChaturvediUC。妊娠期间感染乙型脑炎病毒。印度医学杂志1985年;81:9–12. PubMed
- ChengVCC,SridharS,WongSC,等.通过输血传播的日本脑炎病毒,中国香港。EmergInfectDis2018年;24:49–57.交叉参考 PubMed
- IwamotoM,JerniganDB,GuaschA,etal.岩本M,JerniganDB,GuaschA,etal.移植受者调查小组中的西尼罗河病毒。西尼罗河病毒从器官捐献者传播给四名移植受者。NEnglJMed2003年;348:2196–203.交叉参考 PubMed
- 美国节肢动物传播病毒委员会虫媒病毒实验室安全小组委员会。虫媒病毒和某些其他脊椎动物病毒的实验室安全性。AmJTropMedHyg1980年;29:1359–81.交叉参考 PubMed
- 吴玉聪,黄永生,钱林杰,等.1966-1997年日本脑炎的流行病学。AmJTropMedHyg1999年;61:78–84.交叉参考 PubMed
- SohnYM.韩国的日本脑炎免疫接种:过去、现在和未来。EmergInfectDis2000年;6:17–24. PubMed
- GraystonJT,WangSP,YenCH.脑炎.一、引言和流行病学。AmJTropMedHyg1962年;11:126–30.交叉参考 PubMed
- 河野R,金KH.大韩民国、中国和日本脑炎的比较流行病学特征。公牛世界卫生机构,1969年;40:263–77. PubMed
- 五十岚A.日本脑炎的流行病学和控制。《1992年世界卫生统计》;45:299–305. PubMed
- 奥野T.日本脑炎的流行病学综述。1978年世界卫生统计Q;31:120–33. PubMed
- UmenaiT,KrzyskoR,BektimirovTA,AssaadFA.日本脑炎:目前全球状况。公牛世界卫生机构,1985年;63:625–31. PubMed
- 中国的日本脑炎。东南亚JTropMed公共卫生1995;26(增刊3):17-21。
- CareyDE、MyersRM、WebbJK、ReubenR.南印度的日本脑炎。最新知识的总结。J印度医学会1969年;52:10–5. PubMed
- 1969年和1970年泰国北部地区日本脑炎流行的研究。比肯J1971;14:267–96. PubMed
- 汗AM、汗AQ、多布津斯基L、乔希GP、米亚特A.孟加拉国的日本脑炎焦点。JTropMedHyg1981年;84:41–4. PubMed
- PoneprasertB.泰国北部儿童的日本脑炎。东南亚JTropMed公共卫生1989;20:599–603. PubMed
- HaD,HuongV,LoanH,ThongD,DeubelV.1976-1992年越南南部日本脑炎的现状。TropMed1994年;36:202–14.
- CardosaMJ,HooiTP,KaurP.日本脑炎病毒是槟城儿童脑炎的重要病因。东南亚JTropMed公共卫生1995;26:272–5. PubMed
- ChunsuttiwatS,WarachitP.泰国的日本脑炎。东南亚JTropMed公共卫生1995;26(增刊3):43-6。 PubMed
- JoshiD.尼泊尔日本脑炎的现状。东南亚JTropMed公共卫生1995;26(增刊3):34-40。
- TamN,YenN.越南的日本脑炎1985-93.东南亚JTropMed公共卫生1995;26(增刊3):47-50。
- VitaranaT.斯里兰卡的日本脑炎。东南亚JTropMed公共卫生1995;26(增刊3):41-2。
- 比斯塔MB,什雷斯塔JM。尼泊尔日本脑炎的流行病学情况。JNMAJ尼泊尔医学会2005;44:51–6.交叉参考 PubMed
- PaulWS、MoorePS、KarabatsosN等人。1990年在塞班岛爆发日本脑炎。J感染Dis1993;167:1053–8.交叉参考 PubMed
- HannaJN、RitchieSA、PhillipsDA等。1998年,澳大利亚昆士兰州北部的日本脑炎。MedJAust1999年;170:533–6.交叉参考 PubMed
- LiYX,LiMH,FuSH,等.日本脑炎,西藏,中国。EmergInfectDis2011年;17:934–6.交叉参考 PubMed
- BhattachanA,AmatyaS,SedaiTR,UpretiSR,PartridgeJ.尼泊尔丘陵和山区的日本脑炎。EmergInfectDis2009年;15:1691–2.交叉参考 PubMed
- 世界卫生组织。日本脑炎报告了病例。瑞士日内瓦:世界卫生组织。http://apps.who.int/immunization_monitoring/globalsummary/timeseries/tsincidencejapenc.html
- WierzbaTF,GhimireP,MallaS,etal.尼泊尔基于实验室的日本脑炎监测及其对国家免疫战略的影响。AmJTropMedHyg2008年;78:1002–6.交叉参考 PubMed
- TouchS、HillsS、SokhalB等人。柬埔寨日本脑炎的流行病学和疾病负担:两年哨点监测的结果。TropMedIntHealth2009年;14:1365–73.交叉参考 PubMed
- KariK、LiuW、GautamaK等。在印度尼西亚巴厘岛进行的日本脑炎医院监测。BMC医学2006;4:8。交叉参考 PubMed
- AraiS,MatsunagaY,TakasakiT,etal.日本疫苗可预防疾病监测计划。日本脑炎:1982年至2004年日本的监测和消除工作。JPNJ感染Dis2008;61:333–8. PubMed
- GingrichJB、NisalakA、LatendresseJR等。曼谷的日本脑炎病毒:影响三个郊区社区病媒感染的因素。JMedEntomol1992年;29:436–44.交叉参考 PubMed
- LindahlJ,ChiricoJ,BoqvistS,ThuHTV,MagnussonU.日本脑炎病毒蚊子媒介与城市养猪场的关系。AmJTropMedHyg2012年;87:1076–82.交叉参考 PubMed
- DiFrancescoJ,ChoeungR,PengB,etal.柬埔寨农村和城郊哨兵猪乙型脑炎病毒传播动态比较。PLoSNeglTropDis2018;12:e0006644。交叉参考 PubMed
- KanagasabaiK、JoshuaV、RaviM等人。印度日本脑炎流行病学:实验室监测数据分析,2014-2017年。J感染2018;76:317–20.交叉参考 PubMed
- TouchS、HillsS、SokhalB等人。柬埔寨日本脑炎的流行病学和疾病负担:两年哨点监测的结果。TropMedIntHealth2009年;14:1365–73.交叉参考 PubMed
- GrossmanRA,EdelmanR,WillhightM,PantuwatanaS,UdomsakdiS.泰国清迈谷日本脑炎病毒研究。3.人类血清流行病学和不明显的感染。AmJ流行病学1973;98:133–49.交叉参考 PubMed
- PotulaR,BadrinathS,SrinivasanS.印度南部本地治里及其周边地区的日本脑炎:结果的临床评估和预后指标。JTropPediatr2003年;49:48–53.交叉参考 PubMed
- YinZ,WangH,YangJ,etal.急性脑膜炎和脑炎综合征(AMES)研究组。中华人民共和国四个城市的日本脑炎疾病负担和日本脑炎的临床特征。AmJTropMedHyg2010年;83:766–73.交叉参考 PubMed
- SunwooJS,JungKH,LeeST,LeeSK,ChuK.2010-2015年韩国日本脑炎的重新出现。EmergInfectDis2016年;22:1841–3.交叉参考 PubMed
- AyukawaR、FujimotoH、AyabeM等。2002年,日本中国地区意外爆发了日本脑炎。JPNJ感染Dis2004;57:63–6. PubMed
- 王炳辉,傅晖,王海,等.2006年,中国运城爆发了日本脑炎疫情。EmergInfectDis2007年;13:1123–5.交叉参考 PubMed
- GuravYK,TandaleBVBondre副总裁等。日本脑炎的大规模暴发,主要发生在印度西孟加拉邦北部地区的成年人中。JMedVirol2016年;88:2004–11.交叉参考 PubMed
- GajananaA,ThenmozhiV,SamuelPP,ReubenR.一项基于社区的社区研究,研究印度泰米尔纳德邦地区儿童的亚临床黄病毒感染,该地区是日本脑炎的地方病。Bull世界卫生组织1995年;73:237–44. PubMed
- HalsteadSB,GroszCR.亚临床日本脑炎。I.在韩国有限居住的美国人的感染。AmJHyg1962年;75:190–201. PubMed
- BenensonMW、TopFHJr、GressoW、AmesCW、AltstattLB。泰国日本脑炎病毒对人类的毒力。AmJTropMedHyg1975年;24:974–80.交叉参考 PubMed
- HsiehWC,WallaceCK,WangSP,RasmussenAFJr.1960年冲绳美国军人感染日本脑炎的不明显情况。AmJTropMedHyg1963年;12:413–6.交叉参考 PubMed
- SouthamCM.日本脑炎的血清学研究。II.乙型脑炎病毒的不明显感染。J感染Dis1956;99:163–9.交叉参考 PubMed
- LincolnAF,SivertsonSE.日本乙型脑炎急性期;1950年,韩国美国士兵的201例病例。JAmMedAssoc1952年;150:268–73.交叉参考 PubMed
- WattG,JongsakulK.由日本脑炎病毒感染引起的急性未分化发热。AmJTropMedHyg2003年;68:704–6.交叉参考 PubMed
- KuwayamaM,ItoM,TakaoS,etal.日本脑膜炎患者中的日本脑炎病毒。EmergInfectDis2005年;11:471–3. PubMed
- 库马尔R、马图尔A、库马尔A、夏尔马S、查克拉博蒂S、查图尔韦迪UC。勒克瑙(印度)儿童日本脑炎的临床特征和预后指标。印度医学杂志1990年;91:321–7. PubMed
- KumarR,TripathiP,SinghS,BannerjiG.2005年印度北方邦日本脑炎流行期间住院儿童的临床特征。临床感染Dis2006;43:123–31.交叉参考 PubMed
- SchneiderRJ,FirestoneMH,EdelmanR,ChieowanichP,PornpibulR.日本脑炎后的临床后遗症:泰国的一项为期一年的随访研究。东南亚JTropMed公共卫生1974年;5:560–8. PubMed
- MisraUK,KalitaJ.与仅具有帕金森病特征的患者相比,伴有肌张力障碍的日本脑炎患者的预后。研究生医学杂志2002;78:238–41.交叉参考 PubMed
- KalitaJ,英国米斯拉。日本脑炎患者明显严重的肌张力障碍。MovDisord2000年;15:1168–72.交叉参考 PubMed
- RayamajhiA,SinghR,PrasadR,KhanalB,SinghiS.尼泊尔儿童日本脑炎的临床实验室概况和结果。AnnTrop儿科2006;26:293–301.交叉参考 PubMed
- SolomonT、DungNM、KneenR等人。越南日本脑炎患者的癫痫发作和颅内压升高。大脑2002;125:1084–93.交叉参考 PubMed
- MisraUK,KalitaJ.日本脑炎的癫痫发作。J神经科学2001;190:57–60.交叉参考 PubMed
- MisraUK,KalitaJ.前角细胞也参与日本脑炎。ActaNeurolScand1997年;96:114–7.交叉参考 PubMed
- SolomonT、KneenR、DungNM等。由日本脑炎病毒引起的脊髓灰质炎样疾病。柳叶刀1998;351:1094–7.交叉参考 PubMed
- HalsteadSB,JacobsonJ.日本脑炎。高级病毒研究2003;61:103–38.交叉参考 PubMed
- LibratyDH,NisalakA,EndyTP,SuntayakornS,VaughnDW,InnisBL.日本脑炎严重疾病的临床和免疫危险因素。TransRSocTropMedHyg2002年;96:173–8.交叉参考 PubMed
- 马施克M、卡斯特鲁普O、福斯廷M、迪纳HC。感染性中枢神经系统疾病的神经影像学研究进展。CurrOpinNeurol2004年;17:475–80.交叉参考 PubMed
- 王海.日本脑炎磁共振成像异常与儿童急性坏死性脑病的比较。ArchNeurol2004年;61:1149-50,作者回复1150。交叉参考 PubMed
- DungNM、TurtleL、ChongWK等。神经影像学诊断日本脑炎的有用性评估。JNeurol2009年;256:2052–60.交叉参考 PubMed
- BurkeDS,NisalakA,HokeCHJr.日本脑炎诊断试剂盒的现场试验。JMedVirol1986年;18:41–9.交叉参考 PubMed
- BurkeDS,NisalakA,UsseryMA,LaorakpongseT,ChantavibulS.人血清和脑脊液中IgM和IgG对日本脑炎病毒反应的动力学。J感染Dis1985;151:1093–9.交叉参考 PubMed
- ChanamaS、SukprasertW、Sa-ngasangA等人。在乙型脑炎患者的脑脊液和血清样本中检测日本脑炎(JE)病毒特异性IgM。JPNJ感染Dis2005;58:294–6. PubMed
- MartinDA,BiggerstaffBJ,AllenB,JohnsonAJ,LanciottiRS,RoehrigJT.免疫球蛋白m交叉反应在美国人类黄病毒性脑炎感染鉴别诊断中的应用。临床诊断实验室免疫学2002;9:544–9. PubMed
- MartinDA,MuthDA,BrownT,JohnsonAJ,KarabatsosN,RoehrigJT.用于虫媒病毒感染常规诊断的免疫球蛋白M捕获酶联免疫吸附测定的标准化。临床微生物学杂志2000;38:1823–6. PubMed
- SreyVH、SadonesH、OngS等人。1999-2000年柬埔寨茶胶住院儿童和成人脑炎综合征的病因。AmJTropMedHyg2002年;66:200–7.交叉参考 PubMed
- HillsS、DabbaghA、JacobsonJ等人,日本脑炎核心工作组。世界卫生组织推荐的日本脑炎监测标准的证据和理由。BMC感染Dis2009;9:214。交叉参考 PubMed
- BurkeDS、LorsomrudeeW、LeakeCJ等人。日本脑炎的致命后果。AmJTropMedHyg1985年;34:1203–10.交叉参考 PubMed
- 斯瓦米R、拉索RK、米什拉B、辛格议员。RT-PCR在临床样本中诊断日本脑炎的有用性。ScandJ感染Dis2008;40:815–20.交叉参考 PubMed
- HuangGKL,TioSY,CalyL,等.在返回的短期旅行者的尿液和全血中长期检测日本脑炎病毒。2017年InfectDis公开论坛;4:ofx203。交叉参考 PubMed
- 韩晓英,任QW,徐志,蔡特.日本脑炎的血清和脑脊液免疫球蛋白M、A和G。临床微生物学杂志1988;26:976–8. PubMed
- SolomonT、ThaoLT、DungNM等。使用免疫球蛋白M点酶免疫测定法快速诊断日本脑炎。临床微生物学杂志1998;36:2030–4. PubMed
- TurtleL,SolomonT.日本脑炎——新疗法的前景。NatRevNeurol2018年;14:298–313.交叉参考 PubMed
- KumarR,TripathiP,BaranwalM,SinghS,TripathiS,BanerjeeG.口服利巴韦林治疗印度北方邦儿童日本脑炎的随机对照试验。临床感染Dis2009;48:400–6.交叉参考 PubMed
- HokeCHJr、VaughnDW、NisalakA等人。大剂量地塞米松对日本脑炎病毒所致急性脑炎结局的影响。J感染Dis1992;165:631–7.交叉参考 PubMed
- SolomonT、DungNM、WillsB等人。日本脑炎中的干扰素α-2a:一项随机双盲安慰剂对照试验。柳叶刀2003;361:821–6.交叉参考 PubMed
- RayamajhiA、NightingaleS、BhattaNK等人。尼泊尔静脉注射免疫球蛋白治疗日本脑炎的初步随机双盲安慰剂对照试验。PLoSOne2015年;10:e0122608。交叉参考 PubMed
- KumarR、BasuA、SinhaS等人。口服米诺环素在印度急性脑炎综合征中的作用——一项随机对照试验。BMC感染2016;16:67。交叉参考 PubMed
- KumarR、MathurA、SinghKB等人。儿童日本脑炎的临床后遗症。印度医学杂志1993年;97:9–13. PubMed
- MahaMS、MoniagaVA、HillsSL等。印度尼西亚儿童日本脑炎后残疾的结果和程度。IntJInfectDis2009年;13:e389-93。交叉参考 PubMed
- 日本乙型脑炎和流行性腮腺炎的后遗症:最近对1947-1948年关岛流行患者进行随访。AmJTropMedHyg1958年;7:481–90.交叉参考 PubMed
- RichterRW,ShimojyoS.日本B脑炎的神经系统后遗症。神经病学1961;11:553–9.交叉参考 PubMed
- HuyBV,TuHC,LuanTV,LindqvistR.日本乙型脑炎后的早期精神和神经系统后遗症。东南亚JTropMed公共卫生1994;25:549–53. PubMed
- MurgodUA,MuthaneUB,RaviV,RadheshS,DesaiA.日本脑炎后的持续性运动障碍。神经病学2001;57:2313–5.交叉参考 PubMed
- 丁D,洪志,赵世杰,等.中国上海急性儿童日本脑炎的长期残疾。AmJTropMedHyg2007年;77:528–33.交叉参考 PubMed
- HillsSL、VanCuongN、TouchS等人。柬埔寨和越南因日本脑炎致残。JTropPediatr2011年;57:241–4.交叉参考 PubMed
- 哈茨C、韦莱恩J、穆奇M、赫夫纳格尔M、贝伦斯RH。日本脑炎:确定前往流行国家和英国和瑞士的旅行者的风险发生率以及疫苗处方。JTravelMed2009年;16:200–3.交叉参考 PubMed
- MacdonaldWB、TinkAR、OuvrierRA等。在巴厘岛度过两周假期后的日本脑炎。MedJAust1989年;150:334–6,9.
- 维特斯约B,艾特雷姆R,尼克拉森B,维内S,曼贾菲科JA.在巴厘岛度过10天假期后的日本脑炎。柳叶刀1995;345:856–7.交叉参考 PubMed
- CaramelloP、CantaF、BalbianoR等人。一例在越南短途旅行期间感染的进口乙型脑炎病例。目前关于疫苗接种的建议是否更广泛?JTravelMed2007年;14:346–8.交叉参考 PubMed
- 2003-2008年从亚洲返回的三名美国旅行者中患有日本脑炎。MMWRMorbMortalWklyRep2009年;58:737–40. PubMed
- 2004年,一名从泰国返回的美国旅行者患上日本脑炎。MMWRMorbMortalWklyRep2005年;54:123–5. PubMed
- 罗斯MR、休斯SM、加图斯BJ。一宗输入英国的乙型乙型脑炎病例。J感染1983;6:261–5.交叉参考 PubMed
- TrillenC.美国编年史。Zei-da-man。《纽约客》1985;61–93.
- 伯登JT、斯坦利PJ、劳埃德G、北卡罗来纳州琼斯。一例日本脑炎。J感染1994;28:175–9.交叉参考 PubMed
- BuhlMR,LindquistL.旅行者中的日本脑炎:病例和季节性风险回顾。JTravelMed2009年;16:217–9.交叉参考 PubMed
- BuhlMR,BlackFT,AndersenPL,LaursenA.致命的日本脑炎在丹麦游客访问巴厘岛12天。ScandJ感染1996;28:189。交叉参考 PubMed
- 波戈迪娜VV、博奇科娃NG、列辛斯卡亚EV、列维娜LS。[出国旅行的俄罗斯公民患有日本脑炎]。VoprVirusol1996年;41:8–11. PubMed
- BernardP,JambaudE,BerbineauA,BrunotJ,FlechaireA.[日本脑炎:一种特殊的输入虫媒病毒]。PresseMed1998;27:1327。 PubMed
- SaitoM、SunagawaT、MakinoY等。1991年日本冲绳的三例日本脑炎病例。东南亚JTropMed公共卫生1999;30:277–9. PubMed
- 日本乙型脑炎后的行为障碍。欧洲精神病学2003;18:269–73.交叉参考 PubMed
- GeraghtyCM,麦卡锡JS。乙型脑炎疫苗:是否在旅行者中得到充分使用?MedJAust2004年;181:269–70. PubMed
- HansonJP,TaylorCT,RichardsAR,SmithIL,BoutlisCS.在莫尔兹比港附近获得的日本脑炎:对巴布亚新几内亚居民和旅行者的影响。MedJAust2004年;181:282–3. PubMed
- OstlundMR,KanB,KarlssonM,VeneS.日本脑炎在前往爪哇和巴厘岛旅行后在瑞典游客中。ScandJ感染Dis2004;36:512–3.交叉参考 PubMed
- 新泽西州卡特菲尔德、安德森NE、布里克尔K、休斯顿L、皮克霍尔茨C、罗克斯堡RH。在中国旅行时感染的日本脑炎。实习医学杂志2005;35:497–8.交叉参考 PubMed
- DelsingCE,ArdeschJ,NihomJ,MulderL,KootstraGJ,HylkemaBS.[脑膜脑炎的不寻常病因:日本脑炎]。NedTijdschrGeneeskd,2005年;149:2423–7. PubMed
- LehtinenVA,HuhtamoE,SiikamäkiH,VapalahtiO.日本脑炎在泰国度假两周的芬兰旅行者。临床维罗尔杂志2008;43:93–5.交叉参考 PubMed
- 波兰JD,CroppCB,CravenRB,MonathTP.美国居民灭活日本脑炎疫苗的效力和安全性评估。J感染Dis1990;161:878–82.交叉参考 PubMed
- ArtsobH,SpenceL.1974-89年加拿大输入虫媒病毒感染。CanJInfectDis1991年;2:95–100.交叉参考 PubMed
- JeurissenA,StrauvenT.一例从菲律宾返回的旅行者因日本脑炎病毒引起的无菌性脑膜炎病例。ActaNeurolBelg2011年;111:143–5. PubMed
- TappeD、NemecekA、ZippF等人。两例由从东南亚返回的旅行者输入德国的日本脑炎实验室确诊病例。临床维罗尔杂志2012;54:282–5.交叉参考 PubMed
- WerlinrudAM,ChristiansenCB,KochA.丹麦短期旅行者柬埔寨的日本脑炎。JTravelMed2011年;18:411–3.交叉参考 PubMed
- 美国疾病预防控制中心(CDC)2010年。MMWRMorbMortalWklyRep2011年;60:276–8. PubMed
- LangevinS,LibmanM,DrebotMA,LaverdièreM.一例在泰国旅行期间感染的日本脑炎病毒病例。JTravelMed2012年;19:127–9.交叉参考 PubMed
- LeeDW、ChoeYJ、KimJH等。2007-2010年韩国日本脑炎流行病学。IntJInfectDis2012年;16:E448-52。交叉参考 PubMed
- 澳大利亚政府卫生部。国家法定传染病监测系统。澳大利亚堪培拉:澳大利亚政府卫生部。http://www9.health.gov.au/cda/source/cda-index.cfm
- DotiP、CastroP、MartínezMJ等。2013年2月,一名20岁的西班牙运动员患上日本脑炎。欧洲监督2013;18:20573。交叉参考 PubMed
- LagardeS、LagierJC、CharrelR等人。一名前往尼泊尔的法国旅行者患有日本脑炎。J神经病毒2014;20:99–102.交叉参考 PubMed
- KnopeKE、DoggettSL、KuruczN等人,国家虫媒病毒和疟疾咨询委员会。2011-12年澳大利亚虫媒病毒病和疟疾:国家虫媒病毒和疟疾咨询委员会年度报告。2014年CommunDisIntellQRep;38:E122-42。 PubMed
- SchwermerB,EschleD,Bloch-InfangerC.在泰国度假后发烧和头痛。DtschMedWochenschr2017年;142:1063–6. PubMed
- ShinES,ParkO,KongIS.2007-2016年居住在大韩民国的外国出生者和韩国国民的日本脑炎发病率综述。2018年五松公共卫生研究;9:126–9.交叉参考 PubMed
- HuangMZ,NovaraSC,Hough-TelfordC,OliverSE,WuCL,PinnintiS.美国青少年前往亚洲后患上日本脑炎。医学研究杂志2015;63:395。
- 凯特尔WB,奥格尼贝内AJ。越南的日本乙型脑炎。美国医学杂志1971;261:271–9.交叉参考 PubMed
- 艾德姆惠普,加拉古西VF。日本乙型脑炎:来自纽约的病例报告和文献简要回顾。AnnInternMed1961年;55:324–7.交叉参考 PubMed
- 免疫程序的现状;破伤风和具有军事重要性的外来疾病。AmJ公共卫生国家卫生1948年;38:485–9.交叉参考 PubMed
- 佩雷斯-皮纳F,梅里坎加斯UR。一名从韩国归来的美国士兵患有日本B脑炎。NEnglJMed1953年;249:531–2.交叉参考 PubMed
- TigerttWD,HammonWM,BergeTO,etal.日本乙型脑炎;对1945-1949年冲绳经验的完整回顾。AmJTropMedHyg1950年;30:689–722.交叉参考 PubMed
- 国家旅行和旅游局。美国公民前往国际地区旅行。华盛顿特区:美国商务部国家旅行和旅游局。https://travel.trade.gov
- DuffyMR、ReedC、EdelsonPJ等。一项针对前往亚洲的美国旅行者的调查,旨在评估对使用日本脑炎疫苗建议的遵守情况。JTravelMed2013年;20:165–70.交叉参考 PubMed
- DeshpandeBR、RaoSR、JentesES等。全球TravEpiNet联盟。日本脑炎疫苗在全球TravEpiNet的美国旅行医学实践中的使用。AmJTropMedHyg2014年;91:694–8.交叉参考 PubMed
- Eick-CostAA,胡Z,KleinTA,PutnakRJ,JarmanRG.驻韩美军步兵血清转化为日本脑炎病毒。AmJTropMedHyg2015年;93:1052–4.交叉参考 PubMed
- RatnamI、LederK、BlackJ等人。短期前往亚洲的澳大利亚旅行者患日本脑炎的风险较低。JTravelMed2013年;20:206–8.交叉参考 PubMed
- HillsS,MartinR,MarfinA,FischerM.亚洲日本脑炎的控制:现在是时候了。2014年专家修订版抗感染;12:901–4.交叉参考 PubMed
- BatchelorP,PetersenK.日本脑炎:亚洲临床指南和疫苗可用性综述。TropDisTravelMed疫苗2015;1:11。交叉参考 PubMed
- MarkoffL.指出,在开发新型日本脑炎病毒疫苗的功效替代物时要考虑。疫苗2000;18(增刊2):26–32。交叉参考 PubMed
- HombachJ,SolomonT,KuraneI,JacobsonJ,WoodD.关于世卫组织关于评估新型日本脑炎疫苗的免疫学终点的磋商报告,世卫组织,日内瓦,2004年9月2日至3日。疫苗2005;23:5205–11.交叉参考 PubMed
- OyaA.日本脑炎疫苗。ActaPaediatrJpn1988年;30:175–84.交叉参考 PubMed
- 哈蒙WM,萨瑟GE。虫媒病毒感染的被动免疫。I.人与小鼠人工诱导的日本(B)脑炎预防。AmJTropMedHyg1973年;22:524–34.交叉参考 PubMed
- LubinieckiAS,CypessRH,HammonWM.虫媒病毒感染的被动免疫。II.小鼠自然和人工获得的对日本(B)脑炎病毒保护的定量方面。AmJTropMedHyg1973年;22:535–42.交叉参考 PubMed
- 小西E、山冈M、Khin-Sane-Win、仓根I、高田K、梅森PW。记忆删除中和抗体反应对于使用编码日本脑炎病毒前膜和包膜基因的质粒接种疫苗后保护小鼠免受攻击至关重要。JVirol1999年;73:5527–34. PubMed
- BeasleyDW、LiL、SudermanMT等。通过被动转移针对ChimeriVax-JE实验疫苗产生的血清,对代表四种基因型的日本脑炎病毒株的保护。疫苗2004;22:3722–6.交叉参考 PubMed
- VanGesselY、KladeCS、PutnakR等人。对日本脑炎病毒和日本脑炎疫苗(IXIARO)的保护相关性诱导的中和抗体滴度。疫苗2011;29:5925–31.交叉参考 PubMed
- RaengsakulrachB、NisalakA、GettayacaminM等人。用于在恒河猴中测试日本脑炎疫苗的鼻内激发模型。AmJTropMedHyg1999年;60:329–37.交叉参考 PubMed
- RaengsakulrachB、NisalakA、GettayacaminM等人。NYVAC-JEV和ALVAC-JEV重组日本脑炎疫苗在恒河猴中的安全性、免疫原性和保护效力。AmJTropMedHyg1999年;60:343–9.交叉参考 PubMed
- FeroldiE,CapedingMR,BoazM,GailhardouS,MericC,BouckenoogheA.日本脑炎嵌合病毒疫苗(JE-CV)加强剂量在JE-CV引发的儿童中的记忆免疫反应和安全性。嗡嗡声VaccinImmunother2013;9:889–97.交叉参考 PubMed
- SohnYM,TandanJB,YoksanS,JiM,OhrrH.接种单剂SA14-14-2减毒活疫苗的儿童抗体反应的5年随访:免疫原性和记忆删除反应。疫苗2008;26:1638–43.交叉参考 PubMed
- MonathTP、GuirakhooF、NicholsR等人。日本脑炎嵌合减毒活疫苗(ChimeriVax-JE):安全性和免疫原性、疫苗剂量和时间表的影响以及对灭活日本脑炎抗原攻击的记忆反应的2期临床试验。J感染Dis2003;188:1213–30.交叉参考 PubMed
- FergusonM,JohnesS,LiL,HeathA,BarrettA.攻击病毒基因组变异对灭活JE疫苗接受者中和滴度的影响——关于日本脑炎病毒(JE)抗体的PRNT50测定的合作研究报告。生物制品2008;36:111–6.交叉参考 PubMed
- LyonsA、Kanesa-thasanN、KuschnerRA等人。纯化灭活病毒疫苗预防日本脑炎的2期研究。疫苗2007;25:3445–53.交叉参考 PubMed
- SrivastavaAK、PutnakJR、LeeSH等。一种在Vero细胞中制备的纯化灭活日本脑炎病毒疫苗。疫苗2001;19:4557–65.交叉参考 PubMed
- TauberE、KollaritschH、KorinekM等人。Vero细胞衍生的灭活日本脑炎疫苗的安全性和免疫原性:一项非劣效性、III期、随机对照试验。柳叶刀2007;370:1847–53.交叉参考 PubMed
- SchullerE,KladeCS,WölflG,KaltenböckA,DewasthalyS,TauberE.研究性日本脑炎疫苗的单一高剂量疫苗接种方案与标准方案的比较,IC51:一项随机、观察者盲法、对照的3期研究。疫苗2009;27:2188–93.交叉参考 PubMed
- JelinekT、BurchardGD、DieckmannS等人。日本脑炎疫苗联合狂犬病疫苗加速暴露前预防方案的短期免疫原性和安全性:一项III期、多中心、观察者盲法研究。JTravelMed2015年;22:225–31.交叉参考 PubMed
- CramerJP、DubischarK、EderS等人。灭活日本脑炎疫苗IXIARO®在老年受试者中的免疫原性和安全性:开放标签、非对照、多中心、4期研究。疫苗2016;34:4579–85.交叉参考 PubMed
- WoolpertT、StaplesJE、FaixDJ等。一剂Vero细胞培养衍生的日本脑炎(JE)疫苗在先前接种过小鼠脑源性JE疫苗的成人中的免疫原性。疫苗2012;30:3090–6.交叉参考 PubMed
- ErraEO、AsklingHH、RomboL等人。单剂Vero细胞源性日本脑炎(JE)疫苗(Ixiaro)可有效增强接种小鼠脑源性乙型脑炎疫苗的旅行者的免疫力。临床感染Dis2012;55:825–34.交叉参考 PubMed
- KaltenböckA、Dubischar-KastnerK、EderG等人。在健康受试者中同时接种基于细胞培养的日本脑炎疫苗IC51和甲型肝炎疫苗HAVRIX1440的安全性和免疫原性:一项单盲、随机、对照的3期研究。疫苗2009;27:4483–9.交叉参考 PubMed
- Dubischar-KastnerK、EderS、BuergerV等人。接种灭活日本脑炎疫苗IXIARO后对加强剂量的长期免疫和免疫反应,IC51。疫苗2010;28:5197–202.交叉参考 PubMed
- CramerJP、JelinekT、Paulke-KorinekM等人。纯化的鸡胚细胞狂犬病疫苗和灭活的Vero细胞衍生日本脑炎疫苗的一年免疫原性动力学和安全性,根据新的、为期1周的加速初级系列同时注射。JTravelMed2016年;23:1–8. PubMed
- SchullerE、KladeCS、HeinzFX等。预先存在的抗蜱传脑炎病毒免疫对Vero细胞衍生的灭活日本脑炎病毒候选疫苗IC51的中和抗体反应的影响。疫苗2008;26:6151–6.交叉参考 PubMed
- SchullerE、JilmaB、VoicuV等人。新型Vero细胞衍生灭活日本脑炎病毒疫苗IC51的长期免疫原性多中心随访3期研究的6个月和12个月结果。疫苗2008;26:4382–6.交叉参考 PubMed
- 杜比沙尔-卡斯特纳K.IXIARO日本脑炎疫苗的新临床数据,灭活,吸附。2016年2月24日向免疫实践咨询委员会(ACIP)提交的演讲。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2016.https://stacks.cdc.gov/view/cdc/60592
- EderS、Dubischar-KastnerK、FirbasC等人。灭活日本脑炎疫苗IXIARO®加强剂量后的长期免疫力,IC51。疫苗2011;29:2607–12.交叉参考 PubMed
- TaucherC,KollaritschH,DubischarKL.健康成人接种日本脑炎疫苗IXIARO®后免疫反应的持续性:一项为期五年的随访研究。疫苗2019;37:2529–31.交叉参考 PubMed
- Paulke-KorinekM,KollaritschH,KundiM,ZwazlI,Seidl-FriedrichC,JelinekT.使用针对日本脑炎的灭活疫苗加强疫苗接种六年后抗体的持续存在。疫苗2015;33:3600–4.交叉参考 PubMed
- Krow-LucalE、FischerM、LavenJ等人。在先前接种过小鼠脑源性乙型脑炎疫苗的成人中,单剂Vero细胞培养衍生的日本脑炎(JE)疫苗后12-23个月的血清保护。第15届国际旅行医学学会会议;2017年5月14日至18日;巴塞罗那,西班牙。
- ErraEO、AsklingHH、YoksanS等人。针对日本脑炎的初次和加强疫苗接种引起的交叉保护:一项为期两年的随访研究。疫苗2013;32:119–23.交叉参考 PubMed
- JelinekT、CramerJP、DieckmannS等人。纯化的鸡胚细胞狂犬病疫苗与日本脑炎疫苗同时接种后狂犬病免疫原性和耐受性的评估。2015年旅行医学感染迪斯;13:241–50.交叉参考 PubMed
- AlbererM、BurchardG、JelinekT等人。脑膜炎球菌糖结合ACWY疫苗与旅行疫苗的联合注射:一项随机、开放标签、多中心研究。2014年旅行医学感染疾病;12:485–93.交叉参考 PubMed
- ErraEO、AsklingHH、YoksanS等人。日本脑炎(JE)疫苗对流行的异源JE病毒基因型的交叉保护能力。临床感染Dis2013;56:267–70.交叉参考 PubMed
- DubischarKL、KadlecekV、SablanJB等。灭活日本脑炎病毒疫苗IXIARO在日本脑炎病毒流行地区儿童中的免疫原性。儿科感染杂志2017;36:898–904.交叉参考 PubMed
- 卡尔滕伯克A、杜比沙尔-卡斯特纳K、舒勒E、达特拉M、克莱德CS、基肖尔TS。IXIARO(IC51)在1至3岁健康印度儿童的II期研究中的免疫原性和安全性。疫苗2010;28:834–9.交叉参考 PubMed
- JelinekT、CromerMA、CramerJP等。灭活的Vero细胞源性日本脑炎疫苗(IXIARO、®JESPECT®)在JE非流行国家儿科人群中的安全性和免疫原性:一项不受控制的开放标签3期研究。2018年TravelMedInfectDis;22:18–24.交叉参考 PubMed
- KadlecekV、Borja-TaboraCF、Eder-LingelbachS等人。菲律宾儿童使用灭活日本脑炎疫苗IXIARO进行初次免疫后抗体持续长达3年,以及加强剂量的效果。儿科感染杂志2018;37:E233-40。交叉参考 PubMed
- TaucherC,KundiM.估计儿童灭活日本脑炎疫苗IXIARO®加强剂量后的保护持续时间,IC51。美国热带医学与卫生学会。第67届年会;路易斯安那州新奥尔良;2018年10月28日至11月1日。
- TauberE、KollaritschH、vonSonnenburgF等人。随机、双盲、安慰剂对照的3期试验,研究灭活日本脑炎疫苗IC51的安全性和耐受性。J感染Dis2008;198:493–9.交叉参考 PubMed
- Dubischar-KastnerK,KaltenboeckA,KlinglerA,JilmaB,SchullerE.Vero细胞培养衍生的日本脑炎疫苗IXIARO(IC51)的安全性分析,在6个月的随访中。疫苗2010;28:6463–9.交叉参考 PubMed
- DubischarKL、KadlecekV、SablanBJr等人。灭活日本脑炎病毒疫苗IXIARO在儿童中的安全性。儿科感染杂志2017;36:889–97.交叉参考 PubMed
- 2009-2012年在美国接种灭活的Vero细胞培养衍生日本脑炎疫苗后的不良事件。疫苗2015;33:708–12.交叉参考 PubMed
- WalkerWL,HillsSL,MillerER,FischerM,RabeIB.2012-2016年在美国接种灭活的Vero细胞培养衍生日本脑炎疫苗后的不良事件。疫苗2018;36:4369–74.交叉参考 PubMed
- Dubischar-KastnerK.支持使用加强剂量Ixiaro的数据。向免疫实践咨询委员会(ACIP)介绍;2011年2月23日;佐治亚州亚特兰大https://www.cdc.gov/vaccines/acip/meetings/index.html
- LindseyNP、StaplesJE、JonesJF等。1999-2009年美国接种日本脑炎疫苗后的不良事件报告。疫苗2010;29:58–64.交叉参考 PubMed
- 高桥H,PoolV,TsaiTF,ChenRT;VAERS工作组。日本脑炎疫苗接种后的不良事件:回顾来自日本和美国的上市后监测数据。疫苗2000;18:2963–9.交叉参考 PubMed
- 美国食品和药物管理局。不良经历的上市后报告。21C.F.R.Sect.600.80(2018)。https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?fr=600.80
- TaucherC.VLA-401:美国军事人员的JE-VC上市后不良事件监测。十月26,2017.2017年10月26日向免疫实践咨询委员会(ACIP)提交的报告;佐治亚州亚特兰大。
- 疾病预防控制中心。特殊情况。一般免疫最佳实践指南:免疫实践咨询委员会(ACIP)最佳实践指南。https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/special-situations.html
- SiraprapasiriT,SawaddiwudhipongW,RojanasuphotS.泰国日本脑炎疫苗接种计划的成本效益分析。东南亚JTropMed公共卫生1997;28:143–8. PubMed
- 尹志,BeelerAsayGR,ZhangL,等.贵州省乙型脑炎研究组.日本脑炎疫苗在中国贵州省扩大免疫计划中使用的经济评价。疫苗2012;30:5569–77.交叉参考 PubMed
- TouchS、SuraratdechaC、SamnangC等。柬埔寨乙型脑炎疫苗的成本效益分析。疫苗2010;28:4593–9.交叉参考 PubMed
- MeltzerM.美国前往亚洲的旅行者接种日本脑炎疫苗策略的比较分析。2018年6月21日向免疫实践咨询委员会(ACIP)提交的报告;佐治亚州亚特兰大。https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2018-06/JE-03-Hills-Fischer-508.pdfpdf图标
- 美国卫生与公众服务部。微生物和生物医学实验室的生物安全。第5版,HHS出版物编号(疾病预防控制中心)21-1112。华盛顿特区:美国卫生与公众服务部;2018.https://www.cdc.gov/biosafety/publications/bmbl5
图1.日本脑炎病毒的传播周期*
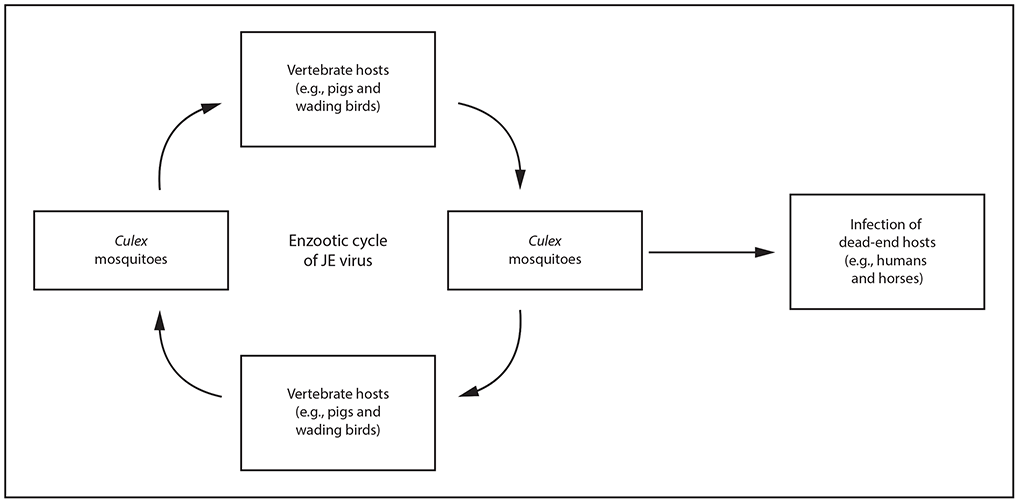
缩写:JE=日本脑炎。
*日本脑炎病毒在库蚊和扩增的脊椎动物宿主(主要是猪和涉水鸟)之间通过地方性循环传播。人类是日本脑炎病毒传播周期中的死胡同宿主,病毒血症水平短暂且水平较低。人类在乙脑病毒的维持或扩增中不起任何作用,病毒不会直接在人与人之间传播。
图2.日本脑炎的大致地理范围
源:HillsSL、LindseyNP、FischerM.日本脑炎。在:CDC2020年黄皮书:国际旅行健康信息。纽约,纽约:牛津大学出版社;2019:248–57.
方框1.灭活Vero细胞培养衍生的日本脑炎疫苗的组成、储存、剂量和注射
商品名:Ixiaro
日本脑炎病毒株:SA14-14-2
日本脑炎病毒种子:减毒
基质:Vero细胞
佐剂:氢氧化铝
稳定器:无
防腐剂:无
最终准备:*液体
储存:35℉–46℉(2℃–8℃)
介绍:预充式注射器
途径:肌肉注射
按年龄组划分的剂量和时间表:
- 2-35个月:第0天和第28天接种2剂(每剂0.25mL)†
- 3-17岁:第0天和第28天接种2剂(每剂0.5mL)
- 18-65岁:第0天和第7-28天接种2剂(每剂0.5mL)§
- >65岁:第0天和第28天接种2剂(每剂0.5mL)
按年龄组划分的加强剂量(如果预计持续暴露或再次暴露):
- <3年:第二次注射后≥1年 接种1剂(0.25mL)†,¶
- ≥3年:第2剂后1年≥1年接种1剂(0.5mL)¶
*最终制剂含有硫酸鱼精蛋白的残留物。
†要施用0.25mL剂量,请从0.5mL预充式注射器中排出并丢弃一半体积。
研究表明,第二剂最早可以在第一剂后7天注射,仅包括18-65岁的成年人。
没有关于第二剂后>2年加强剂量的反应数据。§¶
*比例与50%噬斑减少中和试验滴度≥10。
†在第2剂后4-8周测量血清保护。
表 1.根据美国食品和药物管理局批准的剂量和时间表,按年龄组接种 2 剂灭活 Vero 细胞培养衍生的日本脑炎疫苗初级系列后 1 个月的血清保护率
| 年龄组别(岁) | 地点 | 血清保护率* | 参考 | ||
|---|---|---|---|---|---|
| 总人数 | 血清阳转人数 | 阳转率(%) | |||
| ≥18 | 美国、欧洲 | 361 | 352 | 98 | 203 |
| ≥18 | 欧洲 | 127 | 126 | 99 | 209 |
| ≥18 | 欧洲 | 113 | 110 | 97 | 204 |
| ≥18 | 欧洲 | 31 | 30 | 97† | 208 |
| ≥18 | 美国 | 92 | 88 | 96 | 207 |
| 18–49 | 美国 | 22 | 21 | 95 | 201 |
| 18–65 | 欧洲 | 206 | 206 | 100 | 205 |
| ≥64 | 欧洲 | 197 | 128 | 65 | 206 |
* 比例与50%噬斑减少中和试验滴度≥10。
†在第 2 剂后 4-8 周测量血清保护。
|
第二次JE-VC剂量后的测量和时间 |
主要系列时间表 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| JE-VC,0天和7天,狂犬病疫苗† | JE-VC,0天和28天,接种狂犬病疫苗§ | JE-VC,单独0天和28天 | |||||||
| 血清保护率¶ | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) |
| 28天 | 206 | 203 | 99 | 157 | 157 | 100 | 49 | 49 | 100 |
| >300天** | 199 | 188 | 94 | 154 | 132 | 86 | 48 | 42 | 88 |
| GMT†† | GMT(95%CI) | GMT(95%CI) | GMT(95%CI) | ||||||
| 28天 | 690(595-801) | 299(254-352) | 337(252-451) | ||||||
| >300天** | 117(100-137) | 39(33-47) | 39(28-54) | ||||||
表 2.灭活的 Vero 细胞培养衍生的日本脑炎疫苗的血清保护率和几何平均滴度对 18-65 岁的成年人按接种狂犬病疫苗或标准接种方案(有和没有狂犬病疫苗)加速接种*
来源:美国食品和药物管理局。Ixiaro:乙型脑炎疫苗,灭活,吸附[包装说明书]。奥地利维也纳:ValnevaAustriaGmbH;2018.https://www.fda.gov/media/75777/download ;JelinekT、BurchardGD、DieckmannS等人。日本脑炎疫苗联合狂犬病疫苗加速暴露前预防方案的短期免疫原性和安全性:一项III期、多中心、观察者盲法研究。JTravelMed2015年;22:225–31;CramerJP、JelinekT、Paulke-KorinekM等人。纯化的鸡胚细胞狂犬病疫苗和灭活的Vero细胞衍生日本脑炎疫苗的一年免疫原性动力学和安全性,根据新的、为期1周的加速初级系列同时注射。JTravelMed2016年;23:1–8.
缩写:CI=置信区间;GMT=几何平均滴度;JE-VC=Vero细胞培养衍生的日本脑炎疫苗;PCEC=纯化的鸡胚细胞。
*按协议分析。
†PCEC狂犬病疫苗以0、3、7天的时间表接种。
PCEC狂犬病疫苗以0、7、28天的时间表接种。
与50%斑块减少的比例中和试验滴度≥10。
**研究在第365天结束。§¶
††PRNT滴度<10被归化为5。
表3.成人血清保护率和几何平均滴度在2剂灭活Vero细胞培养衍生的日本脑炎疫苗初级系列首次接种后间隔
| 测量和研究地点 | 6个月 | 12-15个月 | 24个月 | 60个月 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 血清保护率* | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) |
| 奥地利、德国、罗马尼亚 | 181 | 172 | (95) | 181 | 151 | (83) | 181 | 148 | (82) | 151 | 124 | (82) |
| 德国、北爱尔兰 | 116 | 96 | (83) | 116 | 67 | (58) | 116 | 56 | (48) | — | — | — |
| 奥地利、德国 | — | — | — | 198 | 137 | (69) | — | — | — | — | — | — |
| GMT | GMT(95%CI) | GMT(95%CI) | GMT(95%CI) | GMT(95%CI) | ||||||||
| 奥地利、德国、罗马尼亚 | 84(71-98) | 41(34-49) | 44(37-53) | 43(36-53) | ||||||||
| 德国、北爱尔兰 | 47(37-59) | 18(14-23) | 16(13-21) | — | ||||||||
| 奥地利、德国 | — | 23(19-27) | — | — | ||||||||
来源:美国食品和药物管理局。Ixiaro:乙型脑炎疫苗,灭活,吸附[包装说明书]。奥地利维也纳:ValnevaAustriaGmbH;2018.https://www.fda.gov/media/75777/download ;Dubischar-KastnerK、EderS、BuergerV等人。接种灭活日本脑炎疫苗IXIARO后对加强剂量的长期免疫和免疫反应,IC51。疫苗2010;28:5197–202.SchullerE、JilmaB、VoicuV等人。新型Vero细胞衍生灭活日本脑炎病毒疫苗IC51的长期免疫原性多中心随访3期研究的6个月和12个月结果。疫苗2008;26:4382–6.杜比沙尔-卡斯特纳K.IXIARO日本脑炎疫苗的新临床数据,灭活,吸附。2016年2月24日向免疫实践咨询委员会(ACIP)提交的演讲。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2016.https://stacks.cdc.gov/view/cdc/60592;EderS、Dubischar-KastnerK、FirbasC等人。灭活日本脑炎疫苗IXIARO®加强剂量后的长期免疫力,IC51。疫苗2011;29:2607–12.
缩写:CI=置信区间;GMT=几何平均滴度。
*与50%噬斑减少中和试验滴度≥10的比例。
表4.按蜱传脑炎疫苗接种状态划分的2剂灭活Vero细胞培养衍生日本脑炎疫苗初级系列接种后,成人血清保护率和几何平均滴度
| 测量 | 6个月 | 12个月 | 24个月 | 60个月 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 血清保护率* | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) |
| TBE疫苗† | 89 | 86 | (97) | 89 | 82 | (92)§ | 86 | 78 | (91)§ | 78 | 67 | (86)§ |
| 没有TBE疫苗 | 92 | 86 | (93) | 92 | 69 | (75) | 78 | 53 | (68) | 47 | 30 | (64) |
| GMT | GMT | GMT | GMT | GMT | ||||||||
| TBE疫苗† | 96 | 48 | 56 | 45 | ||||||||
| 没有TBE疫苗 | 73 | 35 | 33 | 29 | ||||||||
来源:杜比沙尔-卡斯特纳K.IXIARO日本脑炎疫苗的新临床数据,灭活,吸附。2016年2月24日向免疫实践咨询委员会(ACIP)提交的演讲。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2016.https://stacks.cdc.gov/view/cdc/60592;TaucherC,KollaritschH,DubischarKL.健康成人接种日本脑炎疫苗IXIARO®后免疫反应的持续性:一项为期五年的随访研究。疫苗2019;37:2529–31.
缩写:GMT=几何平均滴度;TBE=蜱传脑炎。
*与50%噬斑减少中和试验滴度≥10的比例。
†在Vero细胞培养衍生的日本脑炎疫苗之前或之后接种TBE疫苗。
非重叠的95%置信区间(根据Wilson开发的Altman推荐的方法计算)用于TBE和无TBE疫苗组的血清保护率。§
表5.在2剂初级系列疫苗第一剂后15个月接种灭活Vero细胞培养衍生的日本脑炎疫苗加强剂量前后的血清保护率和几何平均滴度
| 测量 | 0天 | 1个月 | 6个月 | 12个月 | 76个月 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 血清保护率* | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) |
| 198 | 137 | (69) | 198 | 198 | (100) | 197 | 194 | (98) | 194 | 39秒 | (98) | 67 | 64 | (96) | |
| GMT | GMT(95%CI) | GMT(95%CI) | GMT(95%CI) | GMT(95%CI) | GMT(95%CI) | ||||||||||
| 23(19–27) | 900(742–1,091) | 487(391–608) | 361(295–444) | 148(107–207) | |||||||||||
来源:EderS、Dubischar-KastnerK、FirbasC等人。灭活日本脑炎疫苗IXIARO®加强剂量后的长期免疫力,IC51。疫苗2011;29:2607–12;Paulke-KorinekM,KollaritschH,KundiM,ZwazlI,Seidl-FriedrichC,JelinekT.使用针对日本脑炎的灭活疫苗加强疫苗接种六年后抗体的持续存在。疫苗2015;33:3600–4.
缩写:CI=置信区间;GMT=几何平均滴度。
*与50%噬斑减少中和试验滴度≥10的比例。
表6.根据美国食品和药物管理局批准的剂量和时间表接种2剂灭活Vero细胞培养衍生的日本脑炎疫苗初级系列后1个月儿童的血清保护率*
| 研究地点 | 年龄组 | 血清保护率† | |||||
|---|---|---|---|---|---|---|---|
| 0.25mL JE-VC剂量 | 0.5mL JE-VC剂量 | ||||||
| 总人数 | 血清阳转人数 | 阳转率(%) | 总人数 | 血清阳转人数 | 阳转率(%) | ||
| 菲律宾 | 2个月至17岁 | 148 | 147 | (99)§ | 237 | 237 | (100) |
| 印度 | 1-2岁 | 23 | 22 | (96) | — | — | —¶ |
| 美国、欧洲、澳大利亚 | 2个月至17岁 | 5 | 5 | (100) | 57 | 57 | (100) |
来源:美国食品和药物管理局。Ixiaro:乙型脑炎疫苗,灭活,吸附[包装说明书]。奥地利维也纳:ValnevaAustriaGmbH;2018.https://www.fda.gov/media/75777/download ;DubischarKL、KadlecekV、SablanJB等。灭活日本脑炎病毒疫苗IXIARO在日本脑炎病毒流行地区儿童中的免疫原性。儿科感染杂志2017;36:898–904;卡尔滕伯克A、杜比沙尔-卡斯特纳K、舒勒E、达特拉M、克莱德CS、基肖尔TS。IXIARO(IC51)在1至3岁健康印度儿童的II期研究中的免疫原性和安全性。疫苗2010;28:834–9;JelinekT、CromerMA、CramerJP等。灭活的Vero细胞衍生日本脑炎疫苗(IXIARO、®JESPECT®)在JE非流行国家儿科人群中的安全性和免疫原性:一项不受控制的开放标签3期研究。2018年TravelMedInfectDis;22:18–24.
缩写:FDA=食品和药物管理局;JE-VC=Vero细胞培养衍生的日本脑炎疫苗。
*对于2个月至2岁的儿童,间隔28天接种2剂(每剂0.25mL);对于3-17岁的儿童,间隔28天接种2剂(每剂0.5mL)。
†与50%斑块减少中和试验滴度≥10.
在另外98名3-11岁儿童中,他们接受了2剂0.25mL疫苗,其中94名(96%)在接种第二剂后1个月接受了血清保护。
在21名接受2剂0.5mL疫苗的1-2岁儿童中,20名(95%)在接种第二剂后1个月受到血清保护;FDA批准的1-2岁儿童剂量为0.25mL。§¶
表7.菲律宾14个月至17岁儿童在2剂初级系列疫苗第二剂后11个月接种灭活Vero细胞培养衍生的日本脑炎疫苗加强剂前后的血清保护率和几何平均滴度
| 测量 | 0天 | 1个月 | 12个月 | 24个月 | ||||
|---|---|---|---|---|---|---|---|---|
| 血清保护率* | 血清阳转人数 (n=148) |
阳转率(%) | 血清阳转人数 (n=148) |
阳转率(%) | 血清阳转人数 (n=147) |
阳转率(%) | 血清阳转人数 (n=143) |
(阳转率(%) |
| 139 | (94) | 148 | (100) | 147 | (100) | 143 | (100) | |
| GMT | GMT | (95%置信区间) | GMT | (95%置信区间) | GMT | (95%置信区间) | GMT | (95%置信区间) |
| 53 | (45–64) | 2,067 | (1,671–2,556) | 428 | (335–546) | 350 | (279–440) | |
源:KadlecekV、Borja-TaboraCF、Eder-LingelbachS等人。菲律宾儿童使用灭活日本脑炎疫苗IXIARO进行初次免疫后抗体持续长达3年,以及加强剂量的效果。儿科感染杂志2018;37:E233-40。
缩写:CI=置信区间;GMT=几何平均滴度。
*与50%噬斑减少中和试验滴度≥10的比例。
表8.接种灭活Vero细胞培养衍生的日本脑炎疫苗或灭活小鼠脑源性日本脑炎疫苗后7天内发生的成人局部和全身不良事件*
| 不良事件 | JE-VC型† | JE-MB系列§ |
|---|---|---|
| 严重的局部不良事件 | 人数(%)(n=421) | 人数(%)(n=427) |
| 红色 | 4(1) | 46(11) |
| 肿胀 | 3(1) | 23(5) |
| 硬度 | 4(1) | 25(5) |
| 任何¶ | 9(2) | 59(14) |
| 全身不良事件 | 不。(%)(n=428) | 不。(%)(n=435) |
| 头痛 | 113(26) | 125(29) |
| 肌痛 | 88(21) | 69(16) |
| 流感样疾病 | 54(13) | 55(13) |
| 疲劳 | 54(13) | 48(11) |
源:TauberE、KollaritschH、KorinekM等人。Vero细胞衍生的灭活日本脑炎疫苗的安全性和免疫原性:一项非劣效性、III期、随机对照试验。柳叶刀2007;370:1847–53.
缩写:JE-MB=小鼠脑源性日本脑炎疫苗;JE-VC=Vero细胞培养衍生的日本脑炎疫苗。
*分析包括所有进入研究并接受≥1剂疫苗的参与者。
†在第0天和第28天接种两剂,在7天接种一剂安慰剂。
在第0、7和28天接种3剂。
p<0.01使用Fisher精确检验两种疫苗之间的差异计算得出。§¶
方框2.增加旅行者患日本脑炎风险的因素
期间
- 据报道,长期旅行者的发病率最高。
- 虽然没有特定的旅行时间使旅行者面临感染日本脑炎的风险,但长期旅行会增加旅行者接触受感染蚊子的可能性。
- 长期旅行包括在日本脑炎流行地区的累积时间;这包括经常旅行的人和居住在城市地区的人,他们可能会访问风险较高的农村地区。
季节
- 日本脑炎病毒在某些地区季节性传播,在另一些地区全年传播。
- 有关按国家/地区划分的预期乙型脑炎病毒传播的信息,可从CDC网站(https://wwwnc.cdc.gov/travel/yellowbook/2018/infectious-diseases-related-to-travel/japanese-encephalitis)的黄皮书中获得。应谨慎解释这些数据,因为日本脑炎病毒的传播在各国内部和每年都有所不同。
位置
- 在农村或农业地区接触蚊子的风险最高。
- 传播乙脑病毒的蚊子通常在被淹没的稻田、沼泽和其他积水区繁殖。
- 据报道,前往位于农村或水稻种植区或邻近的沿海地区或度假胜地的旅行者中出现了一些病例。
- 日本脑炎可发生于大规模、局灶性暴发,表明这些地区存在广泛的活动性日本脑炎病毒传播。
活动
- 传播日本脑炎病毒的蚊子最常在户外觅食,特别是从日落到黎明;因此,增加风险的活动示例包括:
- —户外休闲活动,如露营、远足、徒步旅行、骑自行车、漂流、钓鱼、狩猎或耕种。
- —在户外度过大量时间,尤其是在傍晚或夜间。
住宿
- 没有空调、纱窗或蚊帐的住宿会增加蚊子暴露的风险。
图3.针对前往日本脑炎流行地区的美国旅行者的疫苗建议
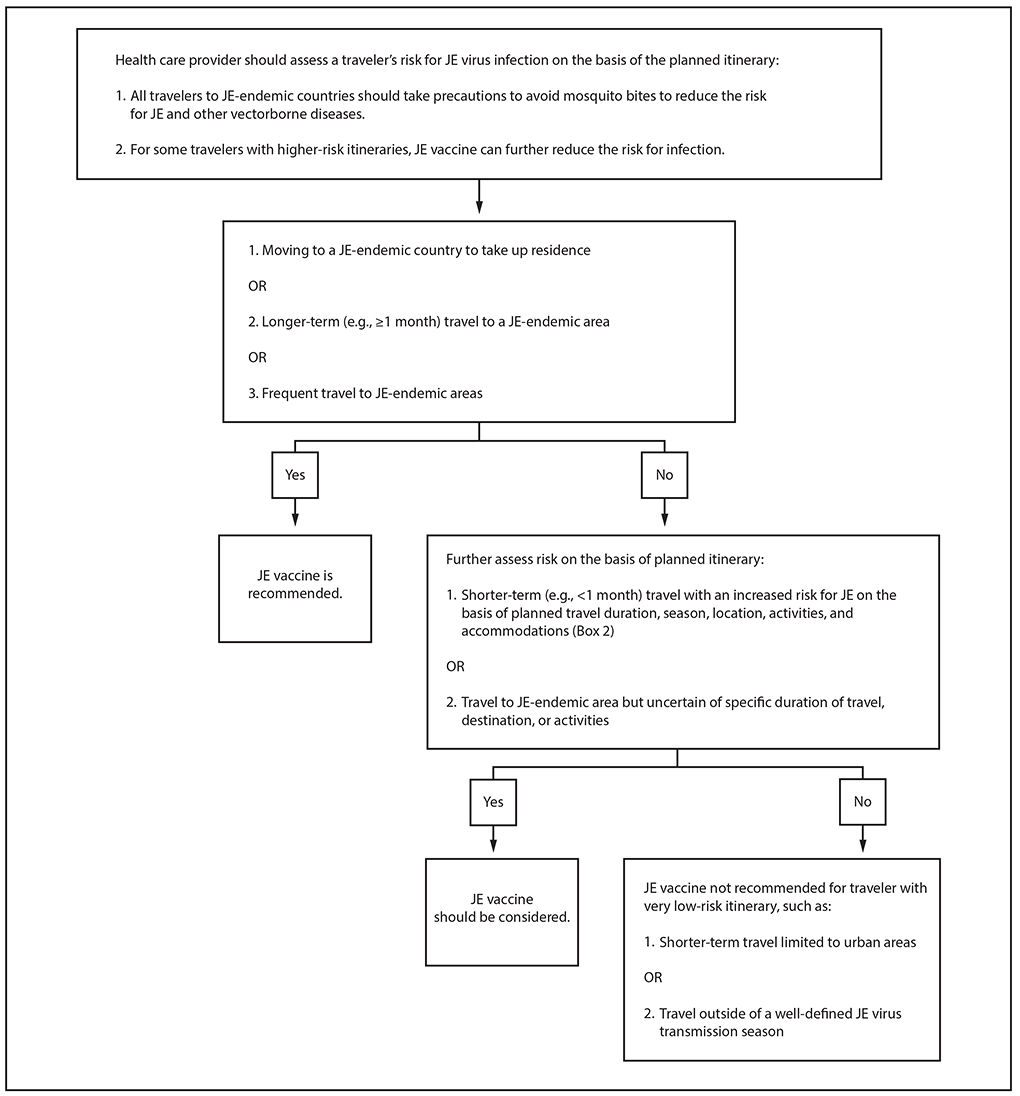
缩写:JE=日本脑炎。
建议引用本文:HillsSL、WalterEB、AtmarRL、FischerM.日本脑炎疫苗:免疫实践咨询委员会的建议。MMWRRecommRep2019;68(编号。RR-2):1-33。DOI:http://dx.doi.org/10.15585/mmwr.rr6802a1 .
页面上次审核日期:2019年7月18日
内容来源:美国疾病控制与预防中心
https://www.cdc.gov/mmwr/volumes/68/rr/rr6802a1.htm
日本脑炎疫苗:免疫接种实践咨询委员会的建议 |MMWR系列 (cdc.gov)




