Prevention of Hepatitis A Virus Infection in the United States: Recommendations of the Advisory Committee on Immunization Practices, 2020
Noele P. Nelson,医学博士,博士1;Mark K. Weng,医学博士1;Megan G. Hofmeister,医学博士1;凯利·摩尔(Kelly L.Moore),医学博士2;莫娜·多沙尼,医学博士1;萨利姆·卡米利(Saleem Kamili)博士1;Alaya Koneru,公共卫生硕士1;佩尼娜·哈伯(Penina Haber),公共卫生硕士3;Liesl Hagan,公共卫生硕士1;何塞·罗梅罗,医学博士4;莎拉·席利,医学博士1;亚伦·哈里斯(Aaron M. Harris),医学博士1 (查看作者单位)
介绍
方法
未来方向
摘要
甲型肝炎是由甲型肝炎病毒(HAV)引起的一种疫苗可预防的肝脏传染病。感染通过粪口途径传播,通常通过人与人之间的直接接触或食用受污染的食物或水传播。甲型肝炎是一种急性自限性疾病,不会导致慢性感染。针对甲型肝炎病毒感染而产生的甲型肝炎病毒抗体(免疫球蛋白G[IgG]抗甲型肝炎病毒)终生持续存在,并防止再次感染;接种疫苗后产生的抗甲型肝炎病毒IgG具有长期免疫力。本报告取代并总结了免疫实践咨询委员会 (ACIP) 先前发表的关于预防美国 HAV 感染的建议。ACIP建议对12-23个月的儿童进行常规疫苗接种,并为2-18岁的儿童和青少年进行补种疫苗接种,这些儿童和青少年以前未在任何年龄接种过甲型肝炎(HepA)疫苗。ACIP建议有甲型肝炎病毒感染风险或甲型肝炎病毒感染重症的成人,以及在不承认危险因素的情况下要求预防甲型肝炎病毒的成人接种甲型肝炎疫苗。这些建议还为旅行前的疫苗接种、暴露后预防、为成人提供服务的环境中以及疫情暴发期间提供了指导。
介绍
甲型肝炎病毒 (HAV) 通过粪口途径传播,通常通过人与人之间的直接接触或食用受污染的食物或水传播 (1,2)。甲型肝炎病毒感染在临床上与其他类型的急性病毒性肝炎难以鉴别,当健康人感染时,病情通常较轻且自限性(1,2)。老年人或免疫功能低下者、慢性肝病患者或有其他基础疾病者疾病严重程度增加(2-4)。尚未发现甲型肝炎病毒感染会导致慢性感染,但已有长期或复发甲型肝炎的报道(5)。
甲型肝炎 (HepA) 疫苗的建议在美国逐步引入。1996年,免疫实践咨询委员会(ACIP)建议对生活在甲型肝炎感染率高的社区、甲型肝炎感染风险增加或感染不良后果增加的人群以及暴发环境中的≥2岁儿童进行常规疫苗接种(6)。1999 年,ACIP 扩大了建议范围,包括对以下群体的常规疫苗接种:1) 11 个州(阿拉斯加、亚利桑那州、加利福尼亚州、爱达荷州、内华达州、新墨西哥州、俄克拉荷马州、俄勒冈州、南达科他州、犹他州和华盛顿州)的 ≥2 岁儿童,其平均发病率至少是 1987-1997 年全国平均水平的两倍(即每 100,000 人 ≥20 例)和 2) ≥考虑在六个州(阿肯色州、 科罗拉多州、密苏里州、蒙大拿州、德克萨斯州和怀俄明州的平均发病率高于全国平均水平,但不到全国平均水平的两倍(即每10万人≥10<20例)(7)。2006年,ACIP建议所有12-23个月大的儿童常规接种甲肝疫苗(8)。这些建议使1996-2011年期间报告的甲型肝炎病例减少了95.5%(9)。2013年和2016年病例略有增加,归因于与受污染食品相关的食源性暴发(10,11)。从2016年开始,美国各地报告的病例数量增加幅度更大,主要是由于人际传播引起的甲型肝炎广泛爆发(12)。成人甲肝疫苗接种覆盖率低和人群对甲型肝炎病毒感染的易感性高,使疫情继续发生(13,14)。本报告取代并总结了ACIP先前发表的关于在美国预防HAV感染的建议。卫生保健提供者可以使用这些建议来更新目前为暴露前和暴露后预防提供 HepA 疫苗的做法。
新的或更新的建议
以下 ACIP 建议是新的、更新的或不再推荐的:
为所有以前未接种过 HepA 疫苗的 2-18 岁儿童和青少年接种疫苗(即建议儿童和青少年进行补种疫苗接种)
为所有感染人类免疫机能丧失病毒(HIV)的≥1岁人士接种疫苗
为慢性肝病患者接种疫苗,包括但不限于乙型肝炎病毒(HBV)感染、丙型肝炎病毒(HCV)感染、肝硬化、脂肪肝、酒精性肝病、自身免疫性肝炎或丙氨酸转氨酶(ALT)或天冬氨酸转氨酶(AST)水平持续高于正常上限两倍的人士
为被确定在怀孕期间有 HAV 感染风险的孕妇(例如,国际旅行者、使用注射或非注射药物的人 [即所有使用非法药物的人]、有感染职业风险的人、预计与国际收养者密切接触的人或无家可归的人)或因 HAV 感染而产生严重后果(例如 慢性肝病患者或HIV感染者)
在甲型肝炎暴发期间接种疫苗 ≥1 岁有 HAV 感染风险的人(例如,使用注射或非注射药物的人 [即所有使用非法药物的人]、无家可归者或 MSM)或有 HAV 重症风险的人(例如,慢性肝病患者或感染 HIV 的人)
在为成人提供服务的环境中接种疫苗,在这些环境中,高比例的人有甲型肝炎病毒感染的危险因素(例如,以注射或非注射药物使用者为重点的卫生保健机构[即所有使用非法药物的人]、集体之家和发育障碍者的非住宿日托设施)
不再建议接受血液制品治疗凝血障碍(例如血友病)的人接种疫苗。
CDC为以下人群提供了新的临床指南:在美国境外旅行的6-11个月大的婴儿、>40岁的人、免疫功能低下的人、计划旅行的慢性肝病患者、HIV感染者、孕妇、暴露后预防和疫情期间的疫苗接种。
方法
ACIP的肝炎疫苗工作组由来自学术医学(儿科、家庭医学、内科、传染病、职业健康和预防医学)、联邦和州公共卫生机构以及医学会的专业人员组成。工作组审议了先前发表的ACIP甲型肝炎疫苗建议,审查了甲型肝炎的流行病学和文献,进行了经济分析,并审议了这些建议。
本报告取代并总结了先前发表的ACIP关于儿童和成人HepA疫苗接种的建议(8,15-17)。根据2019年3月19日完成的文献检索结果,对用于对建议进行一般性澄清的数据进行了总结,并在发表前进行了更新。文献检索包括自2005年以来在世界范围内进行的临床试验和比较研究,并以英文发表。对流行病学和疫苗接种覆盖率数据进行了评价。所有产生相关信息的研究都被认为与纳入相关。工作组组织、评估和讨论了使用证据到建议 (EtR) 框架 (https://www.cdc.gov/vaccines/acip/recs/grade/etr.html) 和建议分级评估、开发和评估 (GRADE) (https://www.cdc.gov/vaccines/acip/recs/grade/table-refs.html) 创建建议的信息。
EtR 框架用于审查和评估 2-18 岁儿童和青少年的 HepA 补种疫苗接种数据。由于以下几个原因,GRADE未用于评估HepA疫苗追赶的证据:1)自1996年以来,HepA疫苗一直被推荐用于儿童接种,2)自2006年以来,基于共同的临床决策,HepA疫苗已被推荐用于追赶疫苗接种,3)自1996年以来,HepA疫苗的有效性和安全性已经得到评估和充分记录(见疫苗安全性)。HepA 补种疫苗接种的 EtR 框架表可在 ACIP 网站 (https://www.cdc.gov/vaccines/acip/recs/grade/hep-a-catchup-etr.html) 上找到。
进行了 GRADE,并使用 EtR 框架来审查和评估 HIV 感染者作为 HepA 疫苗接种风险人群的数据,并将研究结果提交给 ACIP,并在 2019 年 2 月和 6 月的会议上提交给 ACIP。ACIP网站(https://www.cdc.gov/vaccines/acip/recs/grade/hep-a-hiv.html)和EtR框架表(https://www.cdc.gov/vaccines/acip/recs/grade/hep-a-hiv-etr.html)提供了用于GRADE的方法的详细信息,包括检索方案、检索的数据库、纳入标准、证据摘要、证据分级以及所考虑的其他因素的信息。
为了评估疫苗安全性,在2005-2018年期间检索了两个许可后监测系统,以查找不良事件。疫苗不良事件报告系统(VAERS)(https://www.vaers.hhs.govexternal icon)是一个国家被动监测系统,而疫苗安全数据链(https://www.cdc.gov/vaccinesafety/ensuringsafety/monitoring/vsd)包含基于人群的疫苗安全性研究。疫苗安全性假设可以通过VAERS生成,但不能进行评估,并且受到限制,包括报告偏倚和数据质量不一致(18,19)。疫苗安全数据链可用于评估因医学文献综述、向VAERS报告、疫苗接种计划的变化或新疫苗的引入而产生的假设(20)(见疫苗安全性)。
在2014年5月至2019年6月期间,工作组举行了31次电话会议,重点关注HepA疫苗主题。在ACIP2019年6月的会议之前,工作组和ACIP成员还对声明草案进行了全面审查和评论。工作组讨论摘要已于2019年6月27日提交给ACIP。当时,ACIP成员投票批准了HepA疫苗建议草案,包括建议所有以前未接种过HepA疫苗的2-18岁儿童和青少年接种疫苗(即建议儿童和青少年进行补种疫苗接种),以及所有≥1岁的HIV感染者接种HepA疫苗。在CDC随后的审查过程中,对ACIP声明进行了修改,以更新和澄清报告中的措辞;然而,根据 ACIP 委员会在 2019 年 6 月会议期间的审议,仅对 HIV 感染者再接种疫苗的临床指南进行了实质性修改。
HAV背景
甲型肝炎疫苗覆盖率
在2015-2016年出生的儿童中,到35月龄接种≥2剂HepA疫苗的覆盖率为76.6%,到24月龄接种≥1剂的覆盖率为84.7%(21)。2017年,13-17岁青少年接种≥2剂的覆盖率为68.4%,接种1剂的覆盖率为77.2%(CDC,未公布的数据,2019年)。2017年,≥19岁成年人接种≥2剂疫苗的总体覆盖率为10.9%,旅行者的覆盖率为17.7%,慢性肝病患者的覆盖率为20.8%(14)。
流行病学
初步数据表明,2018 年,来自 50 个州和哥伦比亚特区的 CDC 报告了大约 12,500 例甲型肝炎病例(CDC,未公布的数据,2020 年),由于人际传播的甲型肝炎广泛爆发,比 2017 年大幅增加 (12)。2017年,美国疾病预防控制中心共报告了3,366例甲型肝炎病例(图1)(9)。2017年报告病例的总体发病率为每10万人1例(9)。在对确定不足和报告不足进行调整后,2017年估计发生了6,700例甲型肝炎病例(95%置信区间[CI]:4,700-7,400例)(9)。
2014年,除10-19岁年龄组外,所有年龄组报告的甲型肝炎发病率均达到最低点,最低点发生在2015年。2016年和2017年,由于大规模社区甲型肝炎暴发,在吸毒者和无家可归者之间发生人际传播,成人发病率上升(9,12,22)。2016-2017年期间,男男性行为者(MSM)的甲型肝炎病毒感染也有所增加(23),在较小程度上与食用进口甲型肝炎污染食品有关(11)。
2017年,30-39岁的成年人甲型肝炎发病率在所有年龄组中最高(每10万人2.1例),≤9岁儿童的发病率最低(每10万人0.1例)(9)。由于常规儿童期HepA疫苗接种,儿童和青少年的HAV感染率仍然很低(9)。然而,与儿童和青少年相比,成人的甲型肝炎病毒感染率更高,因为成人疫苗覆盖率低(14)和甲型肝炎易感性较高(13)。2007-2016 年,在美国出生的 ≥20 岁成年人中,HAV 易感患病率(HAV 阴性总抗体)为 74.1%(95% CI:72.9%-75.3%)(13)。
自2003年以来,男性和女性报告的甲型肝炎病毒感染率相似,当时男性为每10万人2.82例,女性为2.43例(9)。随着时间推移,比率下降,与全国趋势一致,并保持相似;然而,从 2016 年到 2017 年,男性的发病率(2016 年为每 100,000 人 0.7 例,2017 年为 1.38 例)比女性(2016 年为每 100,000 人 0.55 例,2017 年为 0.7 例)增幅更大,这与男性吸毒率高于女性(9,24)一致。2017年,所有种族/族裔人群报告的甲型肝炎病例率相似。白人、非西班牙裔人(每10万人中有0.98人)的比率最高,最低的是美洲印第安人/阿拉斯加原住民(每10万人中有0.48人)(9)。
病毒描述
HAV 具有单链正链 RNA 基因组,长度约为 7.5 kb。该病毒是肝病毒属小核糖核酸病毒科家族的成员 (25–28)。存在两种形式的传染性病毒粒子 (29)。在感染者的粪便中脱落直径为 27 nm 的裸露无包膜病毒粒子,在感染者的血液中发现准包膜病毒粒子,并从感染细胞中以非裂解方式分泌 (29)。
甲型肝炎病毒分为六种基因型。基因型 I、II 和 III 在人间传播,而基因型 IV、V 和 VI 感染猿猴 (30,31)。不同基因型对 HepA 疫苗的抗体反应相似 (32)。全球仅发现一种人 HAV 血清型 (30)。
传播
甲型肝炎病毒通过粪-口途径传播,通常通过人与人之间的直接接触或食用受污染的食物或水传播(33)。在甲肝疫苗接种可用之前,儿童是甲型肝炎病毒传播的主要来源,并建议常规用于儿童,因为大多数感染甲型肝炎病毒的儿童无症状或未被发现的感染,并且可以在粪便中排出病毒数月(34,35)。目前主要发生在易感成人中。
常见来源暴发和散发病例也因接触有粪便污染的食物或水而发生。未煮熟的食物已被公认为疫情的来源(36)。如果准备过程中使用的热量水平不足以灭活病毒,或者如果食物在烹饪后受到污染,熟食也可能传播甲型肝炎病毒,这可能发生在与受感染的食品处理人员相关的爆发期间(36)。在卫生设施和供水维护良好的发达国家,水源性甲型肝炎暴发并不常见(37)。根据条件,HAV可以在环境中稳定数月(33,38)。HAV 在冷冻时也很稳定 (10,39–41)。在>185°F(>85°C)的温度下加热食物1分钟,或用自来水中1:100稀释的次氯酸钠(即家用漂白剂)对表面进行消毒,使甲型肝炎病毒失活(42)。
在极少数情况下,甲型肝炎病毒通过输注从献血者感染的病毒血症期采集的血液或血液制品传播(43,44)。自 2002 年以来,用于检测 HAV RNA 的核酸扩增试验 (NAAT) 已应用于筛选用于制造血浆衍生产物的源血浆,从而大大降低了血浆衍生产物的传播风险 (45)。
在实验感染的非人灵长类动物中,在潜伏期的唾液中检测到 HAV (46),以及在血清和粪便样本中。在人类唾液中也检测到甲型肝炎病毒 (47,48);然而,尚无评估唾液传播甲型肝炎病毒感染的研究。
临床特征和自然病程
人类感染发生在平均潜伏期为 28 天(范围:15-50 天)后 (49,50)。有症状的甲型肝炎病毒感染在临床上与其他类型的急性病毒性肝炎难以区分,但通常是轻度和自限性的,突然发作,可包括发热、不适、厌食、恶心和腹部不适,随后在几天至一周内出现尿色深、大便苍白和黄疸(1)。甲型肝炎病毒感染出现症状的可能性与年龄有关。在<6岁的儿童中,70%的感染是无症状的;确实发生的疾病通常不伴有黄疸(1,51)。在年龄较大的儿童和成人中,感染通常有症状,>70%的患者会出现黄疸(1,52)。体征和症状通常在2-3个月内消退,6个月内完全恢复(53)。然而,10%-15%的有症状的人患有持续长达6个月的甲型肝炎长期或复发,应被视为传染性(5)。尽管复发包括肝酶水平升高和粪便中检测到病毒,但复发恢复是普遍的 (52-54),并且尚未发现 HAV 感染会导致慢性感染。暴发性肝衰竭很少见,发生率为<1%的病例(2),尽管在2016年开始的广泛暴发中观察到肝衰竭的病例比例较高(12,55)。
在感染者中,甲型肝炎病毒在肝脏中复制,在胆汁中排泄,并在粪便中排出。感染者的传播高峰发生在黄疸发作或肝酶升高前的2周内,此时粪便中病毒浓度最高(33)。黄疸出现后粪便中病毒浓度降低,大多数人在黄疸发作后 1 周不再具有传染性 (33)。与成人相比,儿童可以排出甲型肝炎病毒的时间更长,在临床疾病发作后长达 10 周 (56)。在一次院内暴发中,新生儿感染的婴儿排出甲型肝炎病毒长达6个月(57)。粪便中甲型肝炎病毒的慢性脱落通常不会发生;然而,复发性疾病患者在复发期间会发生复发性脱落(54)。病毒血症在感染后不久发生,并持续到肝酶升高期间,但浓度比粪便低几个数量级 (43,56-58)。几项研究报道了免疫功能正常者中甲型肝炎病毒血症的长期病毒血症和粪便脱落超过一个月,免疫功能低下患者超过一年(59,60)。器官移植后病毒血症延长也有报道[61]。
血清学标志物的解释和甲型肝炎病毒感染的诊断
甲型肝炎不能仅根据临床或流行病学特征与其他类型的病毒性肝炎相鉴别。HAV 感染的诊断需要检测血清中的免疫球蛋白 M (IgM) 抗 HAV 或血清或粪便中的 HAV RNA。抗HAV的IgM是急性疾病的标志物,在大多数人(58,62)症状出现后5-10天内可检测到,通常在发病后1个月内达到峰值,并在感染后6个月内降至检测不到的水平(58,62-64)(图2)。然而,已有报道称,感染后 >1 年人群的 IgM 抗 HAV 检测呈阳性,而没有近期 HAV 感染证据的人群也可能出现假阳性检测 (65-67)。因此,为了减少假阳性检测,只有在有症状并怀疑感染HAV时,才应对患者进行IgM抗HAV检测(66-68)。总抗 HAV 或免疫球蛋白 G (IgG) 抗 HAV 检测用于流行病学研究,以测量既往感染的患病率,或在临床上确定具有暴露前预防指征的人是否已经免疫。抗 HAV IgG 抗体是在自然感染后或接种 HepA 疫苗后产生的,在感染过程的早期出现,在人的一生中保持可检测到,并提供针对该疾病的终生保护 (69–71)。总抗 HAV 抗体检测可测量抗 HAV 的 IgG 和抗 HAV 的 IgM。尽管有用于检测 IgG 抗 HAV 的检测方法,但在未进行 IgG 抗 HAV 检测的情况下,应随后对有症状患者的抗 HAV 总样本进行 IgM 抗 HAV 检测,以确定 HAV 感染的急性期 (72)。总抗 HAV 检测呈阳性和 IgM 抗 HAV 检测呈阴性的人被认为具有免疫力,无论是过去的感染还是疫苗接种。
肝炎的生化证据包括血清胆红素和血清肝酶水平升高,包括 ALT、AST、碱性磷酸酶和 γ-谷氨酰转肽酶。AST 和 ALT 水平升高通常发生在症状发作前 5-10 天。血清胆红素和转氨酶水平通常在发病后 2-3 个月恢复正常 (53)。
分子流行病学技术与传统流行病学方法相结合,有助于调查疫情和确定传播联系(32)。从感染者的水、食物、血液或粪便中检测和测序HAV RNA为追踪和表征HAV毒株以及确定水源和食源性甲型肝炎暴发的来源提供了重要信息。在感染急性期,使用NAAT技术可以在大多数人的血液和粪便中使用NAAT技术检测HAV RNA (73–75)。肝活检、细胞培养物或环境样品中的 HAV RNA 也可以使用各种基于 NAAT 的研究方法进行检测 (76)。HAV 在细胞培养中的生长需要较长的适应期,并且与病毒基因组中各种适应性突变的获得有关 (77,78)。然而,血清学标志物的检测足以进行常规监测。
有甲型肝炎病毒感染或甲型肝炎病毒重症风险的成人
国际旅客
来自发达国家的未接种疫苗者前往甲型肝炎高危或中度流行国家,感染甲型肝炎的风险很大(9,79)。流行与群体免疫中点年龄(AMPI)有关(图3);随着AMPI的增加,甲型肝炎的流行水平通常会降低(80)。然而,确定全球HAV流行情况很复杂,关于区域内抗HAV血清阳性率亚群变异的数据有限(80,81)。面临风险的旅行者包括游客、非免疫移民及其返回原籍国探亲访友的子女、军事人员、传教士和其他在国外工作或学习的人。甲型肝炎仍然是旅行期间最常见的疫苗可预防疾病之一(82)。那些在农村地区居住或访问、在偏远地区跋涉或经常在卫生条件差的环境中进食或饮水的人风险最高。然而,与旅行相关的甲型肝炎病例可能发生在旅游行程、住宿和饮食行为被认为是低风险的旅行者身上。在旅途中感染甲型肝炎的旅行者可能会在返回时将甲型肝炎病毒传播给他人。
男男性行为者
男男性行为者中甲型肝炎暴发的报道屡见不鲜(83,84)。自2016年以来,在男男性行为者中报告了多起甲型肝炎疫情,这些疫情与在男男性行为者中持续传播甲型肝炎病毒的地区(例如,在>20个欧盟国家)的旅行有关(23,85-91)。分子流行病学显示,在感染甲型肝炎的男男性行为者中传播类似的甲型肝炎病毒株,表明该人群存在传播链(74)。自 1996 年以来,ACIP 一直建议对 MSM 进行常规 HepA 疫苗接种 (6)。尽管有这一长期建议,但男男性行为者的疫苗接种覆盖率仍然不理想,总体疫苗接种覆盖率估计为25%-45%(13,92-94),尽管在有针对性的高风险环境中,疫苗接种覆盖率可能更高(95)。
使用注射或非注射毒品的人
在注射或非注射药物使用者(即所有使用非法药物的人)中经常暴发(12,55,96-98)。注射或非注射毒品使用者之间通过粪口途径传播(由于卫生习惯不良或缺乏适当的卫生设施),也可能通过经皮途径在注射吸毒者中传播(96,98);然而,HAV RNA水平为几个对数10血清单位低于粪便单位。自1996年以来,ACIP建议使用注射或非注射药物的人接种HepA疫苗(6)。尽管有这一长期建议,但该人群的 HAV 血清阳性率仍然很低 (20%-40%) (13,99,100)。
有职业暴露风险的人员
据报道,在与非人灵长类动物(包括旧世界和新世界物种)打交道的人中暴发了甲型肝炎(101,102)。被感染的灵长类动物出生在野外(103)。在研究实验室环境中使用含有 HAV 的临床或非临床材料的人员被认为有感染 HAV 的风险。
卫生保健人员因职业暴露而感染甲型肝炎病毒的风险不会显著增加,与卫生保健相关的甲型肝炎病毒传播很少见( 甲型肝炎低风险人群和环境)(104)。食品处理人员也未被视为甲型肝炎病毒感染风险增加( 甲型肝炎低风险人群和环境)(36)。
预计与国际收养人有密切个人接触的人
甲型肝炎病毒感染可发生在国际收养者的家庭成员中(例如,有密切的个人接触)(16,105)。美国家庭从国外收养的大多数儿童来自甲型肝炎高度或中度流行的国家,这与AMPI有关;随着AMPI的增加,甲型肝炎的流行水平通常会降低(图3)(80)。在接触国际收养者后,报告了大约50例甲型肝炎病毒感染病例(16,106-110例),这可能是低估的,因为与国际收养者接触的数据不是作为国家甲型肝炎监测的一部分常规收集的。据估计,国际收养者在抵达美国后的前60天内,每100,000名家庭接触者中有106人感染甲型肝炎病毒(CDC,未公布的数据,2009年)。相比之下,根据监测数据,2009年美国普通人群中症状性甲型肝炎的估计发病率为每10万人0.6例(111)。
无家可归者
无家可归者被定义为 1) 缺乏住房的人(无论该人是否是家庭成员),包括夜间主要住所是提供临时居住住宿的受监督的公共或私人设施(例如庇护所)的人,以及居住在过渡性住房的人, 2)可能流落街头的无固定住房者;或留在避难所、传教所、单间入住设施、废弃的建筑物、车辆或任何其他不稳定或非永久性的情况,或 3) “加倍”,该术语是指人们无法维持其住房状况并被迫与一系列朋友或大家庭成员住在一起的情况。此外,从监狱或医院释放的以前无家可归的人,如果没有可以返回的稳定住房条件,就可能被视为无家可归者。认识到一个人生活安排的不稳定性对于无家可归的定义至关重要(112-114)。
2017年,无家可归者中人与人之间的甲型肝炎病毒传播引起的疫情标志着美国甲型肝炎流行病学的转变(12)。无家可归者可能难以实施推荐的非疫苗策略来保护自己免受暴露(例如,使用干净的厕所设施、定期洗手和避免拥挤的生活条件)。因此,接种疫苗是无家可归者预防甲型肝炎病毒感染的最可靠保护措施。为无家可归者接种甲型肝炎疫苗可提供个人保护并提高群体免疫力,从而降低该人群中人际传播大规模暴发的风险(15)。此外,无家可归与HAV感染的其他已知危险行为(例如吸毒)有关(115)。
爱滋病病毒感染者
数据表明,高达87%的HIV感染者易感染HAV感染(即,总检测结果或IgG抗HAV检测结果为阴性),因为既往没有感染过HAV病毒,没有接种过HepA疫苗,或对HepA疫苗接种反应不佳(116-122)。患有基础肝病的HIV感染者因HAV感染而患重症的风险增加(123,124)。HIV感染者的HAV感染时间延长,可能会增加HIV复制,从而可能增加HIV传播,并可能延长HAV传播期(124-132)。HIV感染者中可能发生长期甲型肝炎暴发(133,134),因为与未感染HIV的人相比,这些人的HAV病毒血症往往升高,并且甲型肝炎的临床病程往往更长(131),导致HAV传播的风险更高(131,133)。
HIV感染者的HepA疫苗血清转化率(即接种疫苗后达到的IgG抗HAV水平高于研究确定的保护相关性)范围为50%至94%(135,136)(见保护相关性)。HepA 疫苗不会增加 HIV 病毒载量、影响 CD4 细胞计数或加速进展为获得性免疫缺陷综合征 (AIDS) (137–142)。尽管与HIV阴性者相比,血清转化率较低,但HIV感染者仍可预防HAV(见疫苗诱导的血清保护)(136,143,144)。在一项针对 130 名 HIV 感染者的研究中,85% 的人在接种 2 剂疫苗系列后 6-10 年保持血清阳性 (145)。CD4计数较高的疫苗接种与更好的疫苗诱导的免疫应答相关(135,136,141,145–147)。
慢性肝病患者
慢性肝病患者感染甲型肝炎病毒的风险不会增加。然而,当发生 HAV 感染时,并发的潜在慢性肝病(例如 HBV 感染、HCV 感染、肝硬化、脂肪肝、酒精性肝病和自身免疫性肝炎)与暴发性肝炎风险增加相关 (3,148-152)。在 2010-2011 年美国因 HAV 感染住院的患者中,因任何肝病(例如其他病毒性肝炎、非酒精相关性肝硬化性肝病、酒精相关性肝病、未另行说明的肝病和胆道疾病)住院的百分比很高(38.3%;每 100,000 人中有 2.7 例)(153)。
生活在发育障碍人士群体环境中的人
从历史上看,甲型肝炎病毒感染在发育障碍者机构中高度流行(154)。由于被收容的发育障碍儿童越来越少,而且随着收容条件的改善,这些环境中甲型肝炎病毒感染的发病率和患病率有所下降(8)。在日常生活活动方面需要帮助的发育障碍人士通常住在集体住宅或小型住宅设施中。在这些地区暴发了疫情,与手部卫生不良、穿尿布和近距离生活有关(155,156)。
被监禁者
有吸毒史或无家可归的人在惩教设施中的比例过高,并且经常在惩教设施和社区之间频繁循环(157,158)。在被监禁人群中持续吸毒、聚集且有时过度拥挤的生活条件以及共用卫生设施可能会增加监狱和监狱内的甲型肝炎病毒传播(157)。
在监狱和监狱中提供甲型肝炎疫苗是一种有效的策略,可以覆盖社区中难以接触到的甲型肝炎病毒感染高危人群。在美国、英国和澳大利亚,基于矫正的疫苗接种计划在缓解社区范围内的甲型肝炎疫情方面发挥了作用(96,159,160)。这些计划也已成功实施,以限制甲型肝炎病毒在监狱和监狱内的传播(159,160)。观察数据表明,与惩教人员的伙伴关系和强化教育工作可以使惩教机构内第一剂Twinrix(甲型肝炎和乙型肝炎联合疫苗)系列的接种率达到>90%(161,162)。加速接种方案也被用于增加在从短期监禁中释放之前接种多剂 Twinrix 疫苗系列的可能性 (163)。
老年人 (年龄>40岁)
甲型肝炎病毒感染通常在成人中出现症状。甲型肝炎疾病的严重程度随着年龄的增长而增加(1)。>40岁的成年人在HAV感染后更有可能住院[153]。
甲型肝炎低风险人群和环境
患有凝血障碍的人
不再特别建议接受凝血障碍(例如血友病)血液制品的人接种 HepA 疫苗。这些人于1996年首次被建议接种甲肝疫苗(6)。以前,一些病毒灭活过程仅侧重于用溶剂和洗涤剂处理血液制品,这些溶剂和洗涤剂可灭活脂质包膜病毒(164),但不能灭活甲型肝炎等非包膜病毒,从而导致感染风险(165)。二次病毒减少步骤现在很常见,并缩小了这一差距(166-168)。此外,在美国,>80% 的凝血障碍患者接受重组凝血因子浓缩物,这些浓缩物经过灭菌(例如巴氏杀菌、热灭活和过滤),消除了 HAV 污染的风险 (168)。现在认为凝血障碍患者通过输注血液制品传播甲型肝炎病毒的风险与普通人群相同(168),并且现在对源血浆进行甲型肝炎病毒筛查(167)。
餐饮服务机构及食品处理人员
对于在没有其他风险因素的情况下处理食物的人,不特别建议接种 HepA 疫苗。在美国,食源性甲型肝炎疫情的发生率相对较低;然而,最近暴发的甲型肝炎疫情与从土耳其进口的石榴假种皮(果实包衣种子)、从菲律宾进口的冷冻扇贝和从埃及进口的冷冻草莓有关,表明了与从甲型肝炎流行地区进口的食品有关的暴发风险(10,11,169)。甲型肝炎病毒对食物的污染可能发生在任何时候:生长、收获、加工、处理或烹饪后。食品处理人员患甲型肝炎的风险不会因为他们的职业而增加(36)。甲型肝炎病毒从受感染的食品处理人员传播给易感消费者或工作场所的餐馆顾客是罕见的(36,170,171)。自2006年通过普遍的儿童甲肝疫苗接种建议以来,食品处理人员之间的传播并不常见,尽管对食品处理人员中的甲型肝炎病毒感染进行了昂贵且资源密集型的调查。一项研究发现,在>90%的受感染食品处理人员的病例调查中,只有食品处理人员被感染,没有继发病例(172例)。对2016-2019年期间经历人对人甲型肝炎疫情的州卫生部门的调查显示,在各州报告的近23,000例甲型肝炎疫情病例中,<4%发生在食品处理人员中;顾客的继发感染占疫情病例的0.2%(173例)。在这些人对人甲型肝炎疫情中,从感染甲型肝炎的食品处理人员到食品企业顾客的继发感染风险为<1%(173)。
托儿所
过去,甲型肝炎暴发发生在托儿所的儿童和这些中心的员工中;然而,在广泛采用儿童疫苗接种后,暴发频率有所下降(9,51,174)。儿童保育中心爆发的甲型肝炎现在很少见。从历史上看,穿尿布的儿童以及处理和更换尿布的工作人员的卫生条件差导致了甲型肝炎病毒感染在托儿所的传播;在仅向接受过如厕训练的儿童提供护理的儿童的托儿所很少发生暴发(51,174)。由于幼儿中的甲型肝炎病毒感染通常是轻微的或无症状的,因此通常只有在成人接触者(通常是父母)生病时才发现儿童保育中心的暴发(51,174)。
学校
建议所有儿童接种 HepA 疫苗。在儿童普遍接种疫苗之前,美国小学或中学甲型肝炎病例的发生通常反映了社区中的疾病获得,而甲型肝炎病毒在学校环境中的传播并不常见(并且仍然不常见)。如果学校儿童中出现多例病例,应调查常见的感染源(39,75)。
医疗机构
不常规建议医护人员接种甲肝疫苗。卫生保健人员是指在卫生保健机构中服务的所有有偿和无偿人员,他们有可能直接或间接接触患者或传染性物质,包括身体物质(例如血液、组织和特定体液);受污染的医疗用品、器械和设备;受污染的环境表面;或受污染的空气(175)。这些人员包括但不限于急诊医疗服务人员、护士、护理助理、医生、技术人员、治疗师、抽血师、药剂师、学生和实习生、非受雇于医疗机构的合同工,以及不直接参与患者护理但可能接触可在医疗机构传播的传染性病原体的科室人员(例如 文员、饮食、环境服务、洗衣、保安、工程和设施管理、行政、计费和志愿者) (https://www.cdc.gov/infectioncontrol/pdf/guidelines/infection-control-HCP-H.pdf) (第175页)。
与卫生保健相关的甲型肝炎病毒传播很少见。过去,当婴儿从输血中获得感染并随后将甲型肝炎病毒传播给其他婴儿和工作人员时,在新生儿重症监护病房观察到暴发(57,176,177)。卫生保健人员因职业暴露而感染甲型肝炎病毒的风险不会显著增加(104)。由成年患者传播给卫生保健人员引起的甲型肝炎暴发通常与大便失禁和手部卫生不足有关(61,178)。然而,大多数甲型肝炎住院患者在黄疸发作后入院,此时他们超过了感染高峰点(179,180)。应鼓励卫生保健人员遵守针对失禁患者推荐的感染控制措施、标准预防措施和接触预防措施,包括手部卫生(181)。
接触污水的工人
不建议处理未经处理污水的人员常规接种甲型肝炎疫苗。在美国境外进行的血清学研究数据表明,接触过污水的工人感染甲型肝炎病毒的风险可能升高;然而,这些分析没有控制其他危险因素(例如,年龄或前往流行地区的旅行)(182-184)。已发表的关于在美国废水处理工人和适当对照人群中进行的三项血清学调查的报告没有发现废水处理工人中抗HAV患病率有任何实质性或持续的增加(185-187)。此外,在美国,可以携带原始污水的洪水不太可能引起传染病的爆发,并且尚未报告由洪水引起的HAV爆发(36,188)。
公共供水系统
以前曾报道过使用私人或社区水井、游泳池或公共饮用水的人中爆发甲型肝炎疫情,这些人被附近化粪池系统的污水污染(36,37,189-194)。公共供水系统中的水处理过程和稀释使甲型肝炎病毒不具有传染性(36)。自2009年以来,美国没有报告与饮用水有关的甲型肝炎疫情(37)。经过充分处理且未受到污染(例如,被污水或尿布中的儿童)污染的休闲水上场所(例如,水疗中心和游泳池)不太可能构成甲型肝炎暴发的风险(36,192)。
暴发
在美国,大多数甲型肝炎病例是由社区暴发期间的人际传播引起的(195,196)。自 2016 年以来,社区范围的暴发主要发生在具有特定危险因素的成年人(例如吸毒者、无家可归者和男男性行为者)中 (12)。然而,受污染食品的常见来源暴发也时有发生。与多次甲型肝炎暴发有关的食物(例如,生菜,大葱,草莓,覆盆子和石榴假种皮)通常生吃(10,39,169,197-200)。例如,一家餐馆的大规模疫情(约600人感染)与进口大葱(199,200人)有关。在食用从受污染水域收获的生的或部分煮熟的牡蛎、蛤蜊、扇贝或贻贝后,发生了与贝类相关的暴发(11,201)。受污染的食品暴发继续发生,并且仍然是一种风险(例如,与冷冻草莓有关的多州暴发和与生吃的冷冻扇贝有关的夏威夷暴发,均发生在2016年)(11,169)。
预防甲型肝炎病毒感染
甲型肝炎疫苗
在美国获得许可的含有 HAV 抗原的疫苗是单抗原疫苗 Havrix 和 Vaqta 以及联合疫苗 Twinrix(同时含有 HAV 和 HBV 抗原)。都是灭活疫苗。这三种疫苗已获得美国食品和药物管理局 (FDA) 的许可:1995 年的 Havrix、1996 年的 Vaqta 和 2001 年的 Twinrix (202)。
制备
灭活的HepA疫苗使用与灭活脊髓灰质炎病毒疫苗(203,204)类似的方法制备。HepA疫苗含有铝佐剂。“Havrix、Twinrix 和 Vaqta 不含防腐剂。在美国获得许可的 HepA 疫苗中,没有一种含有硫柳汞作为防腐剂。对于 Havrix 和 Twinrix,最终疫苗效力(每剂)表示为 HAV 抗原的酶联免疫吸附测定 (ELISA) 单位。Vaqta 的抗原含量表示为 HAV 抗原的单位。制造商的包装说明书包括有关HepA疫苗制备的其他信息(202)。
疫苗储存和运输
HepA疫苗应在36°F至46°F(2°C至8°C)的温度范围内储存和运输,不应冷冻(205)。制造商的包装说明书包括附加信息 (202)。
接种路线
疫苗应肌肉注射到大腿的前外侧或上臂的三角肌,具体取决于人的年龄(205)。应使用适合患者年龄和体型的针头长度(205)。当甲肝疫苗与其他疫苗或免疫球蛋白(IG)同时接种时,应在不同的解剖部位(例如,单独的肢体)接种(205)。如果甲型肝炎疫苗是皮下注射的,无意中或出于临床原因,则该剂量被认为是有效的,不需要重复(205-207)。
疫苗接种时间表和剂量
Vaqta
Vaqta有两种配方。12 个月至 18 岁的人应按 2 剂方案每剂接种 25 单位 HAV 抗原;≥19岁的人应按2剂方案每剂50单位(表1)。
Havrix
Havrix 还获得了两种配方的许可。12 个月至 18 岁的人应在 2 剂方案中每剂接受 720 个 ELISA 单位;≥19 岁的人应按 2 剂方案每剂 1,440 个 ELISA 单位接受 2 剂方案(表 1)。
Twinrix
Twinrix已获准用于≥18岁的成年人。Twinrix 含有 720 个 ELISA 单位的 HAV 抗原(Havrix 成人剂量的一半)和 20 μg 重组 HBV 表面抗原蛋白(与 Engerix-B 成人剂量相同)(表 1)。Twinrix 的初级疫苗接种包括 3 剂,按 0、1 和 6 个月的时间表接种,与通常用于单抗原 HepB 疫苗的时间表相同。接种 3 剂 Twinrix 后,对 HAV 抗原和 HBV 表面抗原的抗体反应与按标准时间表单独接种单抗原疫苗后的反应相当 (208,209);更多信息可在 Twinrix 包装说明书 (202) 中找到。Twinrix可以在旅行或任何其他潜在暴露之前以加速的时间表接种,在0、7和21-30天接种3剂,然后在12个月时接种加强剂,以提供长期保护(202)。
加强剂和激发剂
HepA 疫苗剂量可用于通过产生记忆删除反应来确定疫苗诱导的免疫记忆的存在。术语“加强剂量”或“挑战剂量”已用于指在初次疫苗接种系列后接种的一剂甲肝疫苗,以提供针对严重感染(即感染导致 HAV 血清学检测结果呈阳性、具有临床意义的疾病或两者兼而有之)的快速保护性免疫。
疫苗性能
接种后抗甲型肝炎病毒的检测
保护的关联性。保护的相关性定义为免疫应答(即 IgG 抗 HAV 滴度),它负责保护并在统计学上与保护相关 (210)。抗 HAV 水平与世界卫生组织参考 IG 试剂进行比较测量,以毫国际单位/毫升 (mIU/mL) 表示。血清转化(对疫苗接种的反应)定义为通过标准检测达到 ≥10 mIU/mL 的可检测和可量化的疫苗接种后 IgG 抗 HAV 水平 (210,211)。血清保护被认为是临床保护的替代物,当 IgG 抗 HAV 水平仍然高于保护相关性时,血清保护作用持续存在。
预防 HAV 感染所需的抗 HAV 的绝对下限尚未确定,尽管该限值可能相当低,因为 IG 在预防甲型肝炎方面提供了约 90% 的效力,并且在 IG 接受者中检测到的抗 HAV 水平非常低 (212,213)。通过免疫球蛋白被动转移或通过疫苗接种主动诱导后达到的抗HAV浓度比自然感染产生的浓度低10倍至100倍(63)。临床研究得出的最低保护性抗体水平的数据有限,因为疫苗诱导的抗体水平通常很高,而且在接种疫苗的人中很少检测到感染(即疫苗失败)。使用不同检测方法的 10-33 mIU/mL 抗体水平已被提议作为人类预防 HAV 感染的阈值 (214),尽管一项研究表明,任何可检测到的 IgG 抗 HAV 水平都可能表明具有保护作用 (72)。由于没有定义绝对保护水平,因此所使用的特定测定的检测下限通常被认为是保护水平;疫苗接种后研究使用 ≥10 mIU/mL 作为最低保护水平 (210,211,215)。
接种疫苗后 IgM 抗 HAV。甲型肝炎疫苗接种可诱导可检测到的抗甲型肝炎病毒 IgM,尤其是在接种疫苗后几周内进行检测时。在8%-20%的成人中,在接种1剂疫苗后2-3周检测到抗HAV的IgM抗体(216)(CDC,未发表的数据,1995年)。为了减少假阳性检测,只有在有症状并怀疑感染HAV的情况下,才应对患者进行IgM抗HAV检测(66-68)。
免疫球蛋白
免疫球蛋白通过被动转移抗体提供对甲型肝炎的保护。GamaSTAN 是一种无菌、不含防腐剂的 IG 溶液,用于肌内接种,用于预防 HAV、麻疹、水痘和风疹病毒引起的疾病(参见 GamaSTAN 包装说明书)(217)。GamaSTAN是唯一被FDA批准用于预防甲型肝炎的IG产品。2017 年,IG 的剂量发生了变化,以反映 IgG 抗 HAV 效力的降低 (218,219),这可能是由于血浆供体中既往 HAV 感染率降低所致(表 2)。GamaSTAN可以与灭活疫苗或类毒素同时在不同的解剖部位(例如,单独的肢体)或剂量之间的任何时间间隔接种(205)。
然而,IG 制剂对某些活病毒疫苗反应的影响尚不清楚,并且 GamaSTAN 中的抗体可能会干扰活病毒疫苗,例如麻疹、腮腺炎和风疹 (MMR) 疫苗和水痘疫苗 (205)。当推荐接种MMR和水痘疫苗时,应在甲型肝炎免疫球蛋白接种前至少2周(205,218)或接种后至少6个月接种(217);GamaSTAN 软件包说明书包含其他信息 (217)。如果必须在接种MMR或水痘疫苗后<2周内给予IG制剂,则患者应在接受IG制剂后6个月内重新接种疫苗(205,217)。
疫苗诱导的血清保护
婴儿的免疫原性
现有数据表明,灭活的甲肝疫苗对没有被动获得性母体抗体的<2岁儿童具有免疫原性( 免疫原性降低相关因素)。随后,所有接种HepA疫苗的儿童都具有保护性抗体水平,最终几何平均浓度(GMCs)因剂量和时间表而异(220-226)。被动获得性母体抗体的婴儿(<12 个月)接种疫苗后 GMC 降低 (221,222)。
儿童和青少年的免疫原性
根据使用不同配方和疫苗接种计划的研究,甲型肝炎疫苗在儿童和青少年接种时具有高度免疫原性。2-18岁的人群中,97%-100%的人在接受第一剂疫苗后1个月具有保护性抗体水平,100%的人在接种第二剂疫苗后1个月具有保护性水平,GMCs较高(215,225,227-233)。
成人免疫原性
所有获得许可的 HepA 疫苗在 >18 岁成人中都具有高度免疫原性,如果按照推荐的时间表 (215,229,230,234,235) 进行接种。关于产生保护性抗体所需时间的数据有限。一项对四项 2 剂疫苗接种研究的回顾性汇总分析比较了灭活 HepA 疫苗在 ≥40 岁成人和 20-30 岁成人中的免疫原性和安全性。第一剂(91%-99.7%)和第二剂(95.3%-100%)后1个月的免疫反应在各年龄组之间相似。然而,20-30岁成人(92.3%;95%CI:84-97)在15天时的血清转化率高于40岁成人≥(79.7%;95%CI:68.8-88.2)(234)。对于 Twinrix,使用标准 Twinrix 方案,1 剂后甲型肝炎血清转化率为 93.8%,2 剂后为 98.8%,3 剂后 1 个月为 99.9%;Twinrix包装说明书提供了其他信息(202)。
疗效
在泰国进行的一项双盲、随机对照临床试验中评估了 Havrix 的疗效,该试验对大约 40,000 名 1-16 岁的儿童进行了评估。这些儿童生活在1989-1991年期间通过主动监测确定的每10万人中有119例甲型肝炎病毒感染率的村庄(236例)。间隔 1 个月接种 2 剂疫苗(每剂 360 个 ELISA 单位)后,疫苗预防临床甲型肝炎的有效性为 94%(95% CI:79%–99%)。一项使用 Vaqta 的双盲、安慰剂对照、随机临床试验在大约 1,000 名居住在纽约社区的 2-16 岁儿童中进行了,其中 68% 的 >19 岁人群具有可检测到的抗体水平 (237)。接种1剂(25单位)疫苗后,对临床甲型肝炎的保护效力为100%(95%CI下限:87%)。预计Twinrix的功效与每种单价HepA和HepB疫苗成分的功效相似;Twinrix包装说明书提供了其他信息(202)。
长期保护
终生保护发生在自然甲型肝炎病毒感染后,也可能在接种疫苗后发生,但接种疫苗后对甲型肝炎病毒感染的确切保护作用尚不清楚。已对儿童接种疫苗的儿童、儿童接种疫苗的成人和成人接种疫苗的成人进行了长期免疫原性研究。
儿童在 <24 个月大时接种疫苗。在三组阿拉斯加原住民儿童中,抗 HAV 血清阳性至少持续到 15-16 岁,他们在 6-21 个月大时开始接种 2 剂灭活 HepA 疫苗系列(238)。然而,在接种疫苗的婴儿和母亲抗甲烊病毒阳性的儿童中,血清阳性的患病率在 10 岁后下降,这可能是因为被动获得的母体抗体对免疫反应的影响。模型表明,大多数人的血清阳性应持续至少 30 年 (238)。
成人在儿童时期接种疫苗。在儿童(3-6 岁)按 3 剂计划接种灭活疫苗的大多数成年人中,抗 HAV 已被证明在保护水平以上持续至少 22 年(239,240),尽管总体 GMC 降至 90 mIU/mL,12% 的参与者的抗 HAV 水平为 <20 mIU/mL, 表明抗 HAV 减弱 (240)。在接种后约14年,使用先前推荐的3剂HepA Havrix(每剂360个ELISA单位)方案接种疫苗的儿童接种者与接种2剂方案(720个ELISA单位)的接种者具有相似的保护作用(241)。
成年人作为成年人接种疫苗。在1992-1993年接受Havrix 1440 ELISA单位的成人中,每年测量抗体持久性,2次接种方案为0-6个月或0-12个月(242,243)。接种疫苗20年后>97%的成人抗甲型肝炎病毒抗体血清阳性。在最初接种 0-6 个月的 2 剂方案的 36 名参与者中,有 34 名受试者的 GMC 为 312 mIU/ml,在 0-12 个月时接种的 86 名受试者中有 85 名的 GMC 为 317 mIU/ml。在20年的随访中,7名失去循环抗HAV抗体的参与者中有6名在接种HepA疫苗加强剂后产生了强烈的反应。数学模型预测,在30年时,≥95%的疫苗接种者将持续存在血清阳性抗HAV水平,在40岁时将持续≥90%(243)。
继续对保护期限进行定期评估。尽管存在抗 HAV 减弱的证据,但对 HepA 加强剂量的记忆删除反应表明持久的免疫记忆和对 HAV 感染的保护 (144,243)。细胞免疫也可能有助于长期保护。
单剂量甲型肝炎疫苗保护
在评估1剂疫苗接种后长达10.67年的长期保护的研究中,单剂灭活HepA疫苗后的保护性抗HAV抗体水平可以持续近11年,并在加强疫苗接种后增加或重新出现(244)。此外,单剂量的 HepA 疫苗已被证明可诱导与自然感染诱导的 HAV 特异性细胞免疫相似 (245)。单剂量单抗原HepA疫苗也被证明可以控制甲型肝炎的爆发(246)。
一些南美国家已经启动了普遍的单剂儿童疫苗接种计划。2014年,巴西国家免疫计划为15-24个月的儿童采用了单剂普遍疫苗接种(247)。2014-2017年,<5岁儿童的甲型肝炎病例显著下降,从949例降至31例(p = 0.017)(248)。2005年,所有12个月大的阿根廷儿童都接种了单剂HepA疫苗。在单剂甲肝疫苗接种后9岁以下的阿根廷儿童中,超过97%(1,088人中有1,060人)发现了针对HAV的保护性抗体水平(249人),在单剂疫苗接种后11年内接受检测的1,119名儿童中,约有87.6%(250人)。需要更多的数据来评估单次接种后的长期保护作用。
与免疫原性降低相关的因素
存在被动获得的母体抗体
在婴儿(<12 个月)疫苗接种时存在被动获得的母体抗 HAV 会干扰对 HepA 疫苗接种的免疫反应,并显着降低疫苗接种后的抗 HAV 浓度 (220,221,224,251)。在大多数研究中,尽管所有婴儿随后都有保护性抗体水平,但最终的GMCs大约是抗HAV阴性母亲所生婴儿GMC的三分之一到十分之一,并按照单一的、一致的时间表接种疫苗(252)。尽管初级系列研究后抗体水平较低,但大多数被动获得性抗体的婴儿对 1-6 年后给予的加强剂量有记忆删除反应 (221,252,253)。大多数婴儿在1岁时被动获得性抗体下降到检测不到的水平(220,254)。甲肝疫苗对 >1 岁时开始接种疫苗的儿童具有高度免疫原性,无论母亲抗 HAV 状态如何 (220,221)。
甲型肝炎疫苗和免疫球蛋白同时接种
尽管在完成疫苗系列后 1 个月接受 IG 和疫苗的成人的 GMC 低于单独接种 HepA 疫苗的成人的 GMC,但随后具有保护性抗体水平的成人比例没有差异 (255,256)。因此,减少GMCs对长期保护的影响尚不清楚。
免疫功能低下的情况
免疫功能低下的儿童和成人(例如,造血细胞移植 [hematopoietic cell transplant, HCT] 受者、接受化疗的患者和 HIV 感染者)对 HepA 疫苗的体液反应可能会降低(表 3)(4,257–259)。有限的数据表明,改良的接种方案,包括标准抗原剂量加倍或额外剂量接种,可能会提高反应率。此外,ACIP最佳实践指南指出,在HCT之前接种疫苗的HCT受者应在HCT后常规接种疫苗或重新接种疫苗,无论移植干细胞的来源如何;建议在HCT后再接种HepA疫苗(205)。
美国传染病学会(Infectious Disease Society of America)为免疫功能低下的宿主提供了疫苗接种指南。该指南指出,未接种疫苗、疫苗接种不足或甲型肝炎血清反应阴性的实体器官移植候选者,尤其是肝移植候选者,年龄在12-23个月(强烈推荐,中等质量证据)和≥2岁(强烈推荐,中等质量证据)应接种甲型肝炎疫苗系列(4)。
HIV感染者的CD4计数和其他因素较低
使用标准剂量和时间表的HepA疫苗对HIV感染的儿童和成人具有免疫原性(143,144,260,261)。虽然 CD4 计数较高 (>200–300 个细胞/mm)3)的反应几乎与免疫功能低下的人一样,CD4计数较低的成年人不太可能获得保护性抗体水平(139,141,145–147,257,260,262)。这一发现表明,使用抗病毒药物进行免疫重建可能会恢复对疫苗接种的反应能力(263)。大多数HIV感染控制良好的成年人在接种HepA疫苗后长达6-10年内具有持久的血清阳性反应(145)。在一项研究中,32 名 HIV 感染儿童(平均年龄:5.5 岁)中 100% 产生了保护性抗体 (264)。在初始血清转化的HIV感染者中,与血清反转(血清反应丧失)相关的因素包括较高的体重(超重和肥胖),较低的CD4计数或HIV病毒血症在HepA疫苗接种时,或对疫苗接种的血清反应较低或延迟[146]。
慢性肝病
对患有病毒性或非病毒性病因的慢性肝病的儿童或成人进行疫苗接种,产生的血清保护比例与在健康成人中观察到的相似(表3)(265-270)。肝移植受者的血清保护作用差异很大。在一项研究中,肝移植后接种疫苗的 8 名患者均未对 HepA 疫苗接种有反应;在另一项研究中,23 名肝移植受者中有 6 名 (26%) 做出了反应 (265,266)。然而,在另一项研究中,HepA 疫苗对大多数肝移植患者具有免疫原性,其中 38 例 (97%) 对标准剂量和方案有反应 (271,272)( 免疫功能低下的情况)。
年龄较大(>40岁)
有限的数据表明,年龄较大的人对甲肝疫苗的免疫反应可能低于年轻人。在某些研究中,>40 岁时接种疫苗的人的血清保护率低于 ≤40 岁时接种疫苗的人,特别是当在第一次接种后 15 天内测量水平时,但两剂后血清保护率相似,尽管最终抗体水平较低 (229,234,235,273-275)。
其他因素
在超重人群中观察到对甲肝疫苗的抗体反应较慢(146,273),一项针对HIV感染者的研究发现,当超重或肥胖的人时,血清倒转的可能性更大(146)。吸烟是与其他疫苗免疫原性降低相关的一个因素,尚未针对 HepA 疫苗的许可配方进行评估。
疫苗安全性
甲型肝炎单抗原和联合疫苗的接种
在许可前临床试验中,接种 Havrix 和 Vaqta (HepA) 和 Twinrix(HepA 和 HepB 联合疫苗)后最常见的不良事件是注射部位反应(例如疼痛和红斑)和轻度全身反应(例如发热、易激惹、食欲不振、嗜睡和头痛)。Twinrix疫苗接种后的不良事件发生率与单独接种的HepA和HepB疫苗相似。
VAERS是由CDC和FDA管理的自发报告(被动监测)系统,用于对美国疫苗进行许可后的安全性监测(18)。在2006年至2018年期间,VAERS收到了25,079份涉及HepA疫苗的美国报告,其中5.7%被归类为严重(即报告了以下一种或多种情况:死亡,危及生命的疾病,住院或延长现有住院时间,或永久性残疾)(276)。在所有报告中,48.6%为2-18岁人群,29.5%为12-23个月儿童,13.3%为>19岁成人。大多数(80.3%)报告涉及在同一次卫生保健访问期间同时接种HepA疫苗和其他疫苗。最常报告的不良事件是发热(16.2%)、注射部位红斑(14.8%)、注射部位肿胀(9.9%)、皮疹(9.0%)和红斑(8.9%)(CDC,未发表的数据,2006-2018)。
在同一时期(2006-2018年),VAERS收到了2,117份涉及HepA和HepB联合疫苗的美国报告,其中8.6%被归类为严重疫苗。在所有报告中,92.9%为≥18岁(许可疫苗的批准年龄)的人群。大多数(60.3%)报告涉及在同一次卫生保健访问期间同时接种Twinrix疫苗和其他疫苗。最常报告的不良事件是发烧(13.6%)、头痛(11.5%)、疼痛(11.5%)、注射部位疼痛(9.8%)和头晕(9.4%)(CDC,未发表的数据,2006-2018年)。
VAERS通常受到自发报告系统的局限性,并非旨在评估疫苗是否引起不良事件。然而,VAERS中甲肝疫苗和Twinrix联合疫苗的这些发现与这些年龄组常规接种的其他灭活疫苗的发现相似。
怀孕期间接种HepA疫苗的数据有限。1996-2013年期间向VAERS提交的139份关于在怀孕期间接种HepA疫苗或联合Twinrix疫苗的妇女报告的安全性审查没有发现孕妇或其婴儿中任何令人担忧的不良事件模式(277)。
CDC疫苗安全数据链(VSD)是一个基于人群的研究和监测数据系统(20),一项关于孕产妇HepA疫苗接种的多中心研究(278)发现,怀孕期间接种HepA疫苗与妊娠期间检查的一系列不良事件的风险增加无关,导致活产。然而,发现母体 HepA 疫苗接种与小于胎龄的婴儿之间存在关联。研究人员认为,这种关联可能是由于无法测量的混杂因素,但可能需要额外考虑(278)。
在先前接种甲肝疫苗后出现严重过敏反应(例如过敏反应)或对甲肝疫苗成分严重过敏的人不应接种甲肝疫苗(205)。患有中度或重度急性疾病并伴有或不伴有发烧的人可能希望在急性疾病存在时推迟接种疫苗(205)。
与其他疫苗同时接种
现有数据并未表明,在儿童和成人中,当HepA疫苗与其他疫苗一起接种时,反应会降低(221,279-285);更多信息可从制造商封装说明书 (202) 获得。在成人中进行的研究的有限数据表明,同时接种甲肝疫苗与白喉、脊髓灰质炎病毒(口服和灭活)、破伤风、伤寒(口服和肌肉注射)、霍乱、日本脑炎、狂犬病或黄热病疫苗不会降低对任何一种疫苗的免疫反应或增加不良事件的发生率(279-281)。在美国获得 Twinrix 许可之前进行的研究表明,HepB 疫苗可以与 HepA 疫苗同时接种,而不会降低疫苗免疫原性或增加不良事件的频率 (282,283)。
在 <18 个月大的婴幼儿中进行的研究表明,同时接种 HepA 疫苗与白喉-破伤风-无细胞百日咳 (DTaP)、b型流感嗜血杆菌 (Hib)、HepB、MMR 或灭活脊髓灰质炎病毒疫苗不会影响这些疫苗的免疫原性和反应原性 (202,221,283,284).在美国,大约 4,300 名 12-23 个月大的儿童服用 1 剂或 2 剂 Vaqta 耐受性良好且具有高度免疫原性,无论是单独使用还是与其他疫苗(M-M-RII、Varivax、Tripedia、Prevnar、ProQuad、PedvaxHIB 和 Infanrix)同时使用(285)。
成本效益考虑因素
2007年发表的一项分析评估了全国常规HepA疫苗接种的成本效益,该分析使用马尔可夫模型跟踪了从2005年出生到95岁或死亡的大约400万人的美国出生队列(286)。与不接种疫苗相比,1岁时常规接种疫苗可预防172,000例感染,每质量调整生命年(QALY)可节省28,000美元。与根据1996年和1999年ACIP建议(6,7)中先前存在的区域政策维持HepA疫苗接种水平相比,在1岁时普遍常规接种疫苗将防止另外112,000例感染,每节省QALY的成本为45,000美元(286)。另一项经济分析考虑了受感染儿童家庭接触者中继发病例的估计减少,得出了类似的结果(287)。
在实施 2006 年普遍甲型肝炎儿童疫苗接种建议 (8) 后,2015 年对原始马尔可夫模型进行了调整,以评估未接种疫苗和部分接种疫苗的儿童与未接种疫苗的儿童相比补种 HepA 疫苗接种的成本效益,使用 2008-2012 年期间的甲型肝炎发病率 (288).在队列的整个生命周期中,追赶 HepA 疫苗接种将使相对于基线的感染总数减少 741 人,同时增加 556,989 人的疫苗接种剂量。补种疫苗接种将增加净成本1020万美元,即每人2.38美元(288)。该模型的结论对贴现率(3%)、成人疫苗接种率和甲型肝炎病毒感染发生率高度敏感。尽管成人疫苗接种率一直保持在较低水平(289),但甲型肝炎发病率以及儿童和青少年疫苗接种率大大高于该模型开发时(9,14)。因此,现在补种疫苗接种的实际成本效益可能比最初估计的更有利。
甲型肝炎疫苗和免疫球蛋白用于暴露前预防的建议
本节包含儿童、青少年和成人常规 HepA 疫苗接种的 ACIP 建议 (盒子),以及使用 IG 进行暴露前和暴露后预防 HAV 感染的指南。ACIP还建议接种甲型肝炎疫苗,用于暴露后预防和疫情暴发期间的高危人群。免疫球蛋白可提供短期保护,防止甲型肝炎病毒感染,推荐用于某些情况(表 2 和表 4)。
以下关于甲型肝炎疫苗接种的建议旨在进一步降低美国甲型肝炎的发病率和死亡率,并有可能考虑最终消除甲型肝炎病毒的传播。建议儿童、感染风险增加的人、因甲型肝炎病毒感染而患重症风险增加的人以及任何要求接种疫苗的人常规接种乙肝疫苗。
孩子
ACIP建议所有12-23个月的儿童接种甲肝疫苗,
ACIP建议所有以前未接种过甲肝疫苗的2-18岁儿童和青少年接种疫苗(即建议儿童和青少年进行补种疫苗接种)。这是一项新的建议。
感染甲型肝炎病毒的高风险人群
前往甲型肝炎病毒高度或中度流行国家或在该国工作的人
所有前往甲型肝炎高危或中度流行国家或在甲型肝炎高危或中度流行国家工作的易感人群(即未接种疫苗、部分接种疫苗或从未感染)感染甲型肝炎病毒的风险增加。这些人应在出发前接种疫苗,如果年龄太小或禁忌接种疫苗,则应接受IG接种(17,218)。对于已经部分接种疫苗(即未接种完整系列疫苗)的旅行者,如果需要,应根据疫苗接种时间表在旅行前接种一剂疫苗。
婴儿
<6个月大的婴儿。<6 个月大的婴儿应在旅行前接受免疫球蛋白检查,建议预防甲型肝炎病毒。对于长达 1 个月的旅行时间,建议接种 1 剂 0.1 mL/kg 的 IG;对于长达 2 个月的旅行,建议接种 1 剂 0.2 mL/kg 的 IG,对于 ≥2 个月的旅行,应在旅行期间或直到婴儿接种 HepA 疫苗(即 ≥6 月龄)每 2 个月重复一次 0.2 mL/kg 剂量的 IG(表 2 和表 4)。
6-11个月的婴儿。当建议预防甲型肝炎病毒时,应为在美国境外旅行的6-11个月大的婴儿接种甲肝疫苗(表4)。6-11 个月婴儿的旅行相关剂量不计入常规 2 剂系列。因此,应在 1 岁时开始接种 2 剂 HepA 疫苗系列,并采用适当的剂量和时间表。
CDC临床指南。IG (GamaSTAN) 不能与 MMR 疫苗同时接种,因为含抗体的产品(如 IG)可在接种后长达 6 个月内抑制对麻疹和风疹疫苗的免疫反应 (217)。然而,由于建议所有从美国出国旅行的 6-11 个月大的婴儿接种 MMR 疫苗 (290),并且由于婴儿期麻疹比婴儿期 HAV 感染更严重,因此应优先考虑预防麻疹,不应给予免疫球蛋白。甲型肝炎疫苗(超说明书使用适应症)和MMR疫苗可以同时接种给6-11个月大的婴儿(220,221,251),提供对甲型肝炎和麻疹的保护(17,205,284)。
≥12个月大
年龄在 12 个月至 40 岁之间的健康人。年龄在12个月至40岁之间的健康人,如果计划前往甲型肝炎高流行或中度流行地区,但尚未接种甲肝疫苗,应在考虑旅行后立即接种单剂甲肝疫苗,并应以适当的剂量和时间表完成甲肝疫苗系列(表4)。
>40 岁的人、免疫功能低下的人和慢性肝病患者。>40 岁的人、免疫功能低下的人和计划前往甲型肝炎高危或中度流行地区的慢性肝病患者应在考虑旅行后立即接种单剂 HepA 疫苗。<2周内旅行的人应接受初始剂量的HepA疫苗,并可同时在不同的解剖注射部位(例如,单独的肢体)进行IG注射(218,268,269,291)。甲型肝炎疫苗系列应按照常规方案完成(表4)。
CDC临床指南。除甲肝疫苗外,对于有特殊危险因素或甲型肝炎病毒感染导致重症风险增加的人,在旅行前应考虑接种免疫球蛋白(表3)(附录A)。
禁忌接种疫苗的旅行者和选择不接种甲肝疫苗的人。禁忌接种疫苗或选择不接种疫苗的旅行者应在旅行前接种免疫球蛋白疫苗,但建议接种甲型肝炎疫苗。对于长达 1 个月的旅行时间,建议接种 1 剂 0.1 mL/kg 的 IG;对于长达 2 个月的旅行,建议 1 剂 0.2 mL/kg 的 IG,对于 ≥2 个月的旅行,在旅行期间应每 2 个月重复一次 0.2 mL/kg 剂量的 IG(表 2 和表 4)。
男男性行为者
建议男男性行为者接种疫苗。男男性行为者接受治疗的初级保健和专科医疗机构(例如性传播疾病门诊)的卫生保健提供者应向所有男男性行为者提供甲型肝炎疫苗。
使用注射或非注射毒品的人
建议使用注射或非注射药物的人(即所有使用非法药物的人)接种疫苗。医务人员应进行彻底的危险因素评估,以确定使用注射或非注射药物或有使用注射或非注射药物风险的人。在初级保健和专科医疗机构中,吸毒者接受治疗(例如,为阿片类药物使用障碍患者提供药物辅助治疗的阿片类药物治疗计划)的医务人员应向所有使用注射或非注射药物的人提供甲肝疫苗。
有职业暴露风险的人员
在研究实验室环境中与感染甲型肝炎病毒的非人灵长类动物或含有甲型肝炎病毒的临床或非临床材料一起工作的人应接种疫苗。没有其他职业群体(例如,卫生保健提供者或食品处理人员)因职业暴露而增加甲型肝炎病毒感染的风险。
预计与来自高流行或中度流行国家的国际收养者有密切个人接触的人
所有预计在被收养者抵达美国后的前60天内与来自高流行或中度流行的国家的国际被收养者有密切个人接触(例如,家庭接触者、看护人或常规保姆)的人都应接种甲型肝炎疫苗(16)。第一剂 HepA 疫苗系列应在计划收养后立即接种,最好是在被收养者到达前 2 周或更长时间。
无家可归者
所有≥1岁的无家可归者都应常规接种甲型肝炎疫苗,应将甲型肝炎疫苗纳入无家可归者的常规预防服务中(15)。
因感染甲型肝炎病毒而罹患严重疾病的风险增加的人士
慢性肝病患者
慢性肝病患者(包括但不限于乙型肝炎病毒感染者、丙型肝炎病毒感染者、肝硬化者、脂肪肝患者、酒精性肝病患者、自身免疫性肝炎患者,或ALT或AST水平持续高于正常上限两倍者)应常规接种甲型肝炎疫苗。
爱滋病病毒感染者
年龄≥1岁的人。ACIP建议所有≥1岁的HIV感染者定期接种HepA疫苗。这是一项新的建议。
CDC临床指南。由于免疫抑制的HIV感染者对疫苗的反应可能会降低,因此应对所有HIV感染者完成HepA疫苗系列后1个月进行疫苗接种后血清学检测(292)。一些研究表明,HIV感染者在接种疫苗后需要≥6个月才能进行血清转化(即≥10 mIU/mL)(146,257,293,294)。
尽管CD4细胞计数或百分比较低的HIV感染者对疫苗的反应可能较弱,但不应推迟疫苗接种,直到CD4计数超过某个阈值,因为错过接种疫苗的机会会造成长期的HAV暴露风险。对疫苗无反应的HIV感染者应被视为易感染HAV感染,并告知预防感染的预防措施,以及任何已知或可能暴露于HAV的免疫球蛋白暴露后预防(epi-post-exposure prophylaxis, PEP)。对于初次HepA疫苗接种系列接种后未表现出足够免疫应答(即≥10 mIU/mL)的HIV感染者,医务人员应考虑再次接种(重复接种系列疫苗),尤其是后来证明免疫状态改善(例如,CD4计数增加和HIV病毒载量降低)的HIV感染者(292).在重新接种完整疫苗系列后至少 1 个月,应进行疫苗接种后检测。如果对再次接种的反应仍然不充分(即 <10 mIU/mL),则不建议额外接种;然而,应告知患者预防 HAV 感染的方法,包括暴露后是否需要免疫球蛋白( 再接种)。
所有接种甲肝疫苗的HIV感染者,无论接种后的血清学检测结果如何,都应被告知该疫苗可能无法提供针对甲型肝炎病毒感染的长期保护。因此,他们可能需要在高危 HAV 暴露(例如,性接触或家庭接触)后接受 IG (146,295)。
其他建议接种疫苗的人
孕妇
有 HAV 感染风险或因 HAV 感染而产生严重后果的孕妇。ACIP 建议,在怀孕期间被确定有 HAV 感染风险的孕妇(例如,国际旅行者、使用注射或非注射药物的人、有感染职业风险的人、预计与国际收养者密切接触的人或无家可归的人)或因 HAV 感染而产生严重后果的孕妇(例如, 慢性肝病患者或HIV感染者)如果以前没有接种疫苗,则应在怀孕期间接种疫苗。这是一项新的建议。
CDC临床指南。孕妇应接种与非孕妇相同的适应症。未接种疫苗或部分接种疫苗的怀孕青少年应接种甲肝补种疫苗。对于妊娠期有甲型肝炎病毒感染风险的孕妇,应告知其预防甲型肝炎病毒感染的其他预防方法(例如手部卫生)。
任何要求接种疫苗的人
接种甲型肝炎疫苗不需要披露甲型肝炎病毒感染或并发症的危险因素。由于一个人可能不会向提供者透露风险因素,ACIP建议任何以前未完成HepA疫苗系列的人都可以接种HepA疫苗。
为成人提供服务的设置的实施策略
高比例人群具有甲型肝炎病毒感染危险因素的环境包括以注射或非注射药物使用者为重点的卫生保健机构,以及为发育障碍者提供的集体之家和非住宿日托设施。医务人员可能认为,在这些环境中,未接种疫苗的 ≥19 岁成年人有感染甲型肝炎病毒的风险,因此为以前未完成疫苗接种的患者提供 HepA 疫苗接种。
甲肝疫苗接种可以在外展和其他环境中提供,在这些环境中,为有甲型肝炎感染风险的人提供服务(例如,无家可归者收容所和注射器服务计划)。
医务人员应考虑实施常规命令,以确定推荐接种甲肝疫苗的成年人,并将疫苗接种作为常规服务的一部分进行接种。
对于难以保持卫生的设施(例如,发育障碍者集体之家和无家可归者收容所)中的人员(例如居民和工作人员)应考虑接种 HepA 疫苗。
ACIP关于甲型肝炎疫苗和免疫球蛋白暴露后预防的建议
为提供者提供了 HAV PEP 风险评估和临床决策指南(附录 B)。在没有暴露后预防的情况下,据报道,在受感染的幼儿的传播率高于受感染的青少年和成人的家庭中,继发性发作率为20%-50%(34,35,296,297)。在过去 2 周内接触过 HAV 的人(例如,性接触或家庭接触或已知受污染的食物来源)且以前未接种过疫苗的人应尽快接种 1 剂单抗原 HepA 疫苗、IG (0.1 mL/kg) 或两者兼而有之(年龄≥12 个月、免疫功能低下或患有慢性肝病的人)(17,218). 与免疫球蛋白相比,使用HepA疫苗治疗PEP具有优势,包括诱导主动免疫、保护期更长、易于管理以及更高的可接受性和可用性(17)。暴露后 >2 周接种 IG 或疫苗的疗效尚未确定。
接触感染甲型肝炎病毒的食物处理人员的感染率很低(171,173);大多数感染甲型肝炎病毒的食品处理人员不会通过工作场所将甲型肝炎病毒传播给暴露的消费者或餐馆顾客(36,170,171)。
严重免疫功能低下的人,包括那些因免疫功能低下而接受常规免疫球蛋白治疗的人,过去接种过疫苗的人可能受益于暴露后预防,应根据个体情况评估甲型肝炎病毒感染的风险。
甲肝疫苗应在接触后2周内尽快接种给所有最近接触过甲型肝炎病毒的≥12个月大的未接种疫苗者(17)。除HepA疫苗外,在某些情况下,建议联合接种GamaSTAN IG(0.1 mL/kg)(表4),根据提供者的风险评估,对于>40岁的人(17)。
<12个月的婴儿
<12 个月大的婴儿应在暴露后 2 周内尽快接种 IG (0.1 mL/kg) (17,218) 而不是 HepA 疫苗。MMR疫苗不应在IG接种后<6个月接种(217);GamaSTAN 软件包说明书包含其他信息 (217)。
≥12个月大
≥12个月的健康人
年龄≥12个月的人士,如在过去2星期内曾接触过甲型肝炎疫苗,但之前未曾接种过甲型肝炎疫苗系列,应尽快接种1剂单抗原甲型肝炎疫苗(表4)。除甲肝疫苗外,根据提供者的风险评估(附录 B),可对 >40 岁的人进行免疫球蛋白 (0.1 mL/kg)。当暴露后预防接种的甲肝疫苗剂量为暴露者接种的第一剂时,应在第一剂后 6 个月接种第二剂以获得长期免疫力;但是,PEP 不需要第二剂。
≥12个月大的免疫功能低下或患有慢性肝病的人
免疫功能低下或患有慢性肝病的人,以及在过去 2 周内接触过 HAV 且之前未完成 HepA 疫苗接种系列的人应在接触后尽快在不同的解剖部位(例如,单独的肢体)同时接种 IG (0.1 mL/kg) 和 HepA 疫苗(17,268,269,291)(表4)。当暴露后预防接种的甲肝疫苗剂量为暴露者接种的第一剂时,应在第一剂后 6 个月接种第二剂以获得长期免疫力;但是,PEP 不需要第二剂。
禁忌接种疫苗的人
禁忌接种疫苗的人(见疫苗安全性)应在接触后 2 周内尽快接种 IG (0.1 mL/kg) (17,218) 而不是 HepA 疫苗。MMR和水痘疫苗不应在IG接种后6个月<接种(217);GamaSTAN 软件包说明书包含其他信息 (217)。
CDC暴露后预防临床指南
除甲肝疫苗外,对于有甲型肝炎病毒感染或甲型肝炎感染导致的重症的特殊危险因素的人群,应考虑使用免疫球蛋白进行暴露后预防(表 3 和表 4)(附录 B)。甲型肝炎和乙肝联合疫苗 Twinrix 含有 720 个 ELISA 单位的甲型肝炎抗原,是单抗原甲型肝炎疫苗成人剂量的一半。由于没有可用于 PEP 的 Twinrix 数据,因此不建议将 Twinrix 用作 PEP。
疫情期间的疫苗接种
高危人群的暴露前疫苗接种
疫情控制的疫苗接种策略应侧重于对有感染风险的人群进行暴露前疫苗接种和暴露后策略。预防甲型肝炎病毒感染的最佳方法是为高危人群接种疫苗。现有证据表明控制甲型肝炎疫情所需的疫苗覆盖率水平有限(84,246,298)。对于常规疫苗接种,剂量的数量和时间取决于所接种的疫苗类型;然而,单剂HepA疫苗足以控制疫情(246)。提供者应在可行的情况下完成 HepA 疫苗系列;然而,尽管建议完成该系列疫苗以获得长期保护,但对于暴露后预防或疫情应对并不需要。
由于各种因素(例如,行为健康问题、参与卫生保健系统和其他机构的参与有限或没有参与,以及缺乏交通工具),在疫情暴发中,某些有甲型肝炎病毒感染风险的人群(例如,使用注射或非注射药物的人或无家可归者)可能难以通过常规疫苗接种和教育工作覆盖。通常,卫生部门和卫生保健提供者必须用其他方法(例如,流动现场疫苗接种、药房固定点和疫苗接种足队)来补充传统的外展策略,以覆盖这些人群(299)。
ACIP建议在甲型肝炎暴发期间,所有年龄≥1岁且有甲型肝炎感染风险的未接种疫苗者(例如,使用注射或非注射药物的人、无家可归者和男男性行为者)(12,300人)或有甲型肝炎重症风险的人(例如,慢性肝病患者和艾滋病毒感染者)。单剂量暴露前甲型肝炎疫苗已被证明可以成功控制甲型肝炎的爆发(246)。
CDC临床指南
如果发生通过人际传播传播的社区疫情,公共卫生官员应考虑建议在为疫情附近的感染高风险人群提供服务的封闭聚集环境中进行暴露前甲肝疫苗接种(例如,被监禁在惩教设施中的人、使用注射或非注射药物的人的医疗保健机构、无家可归者收容所和注射器服务计划)。在这些环境中,甲型肝炎病毒感染的风险增加,因此暴发的风险增加(12,55,299,301)。聚集环境为在疫情暴发期间有效接种疫苗提供了独特的机会,在疫情暴发期间扩大对有感染风险的人群的疫苗接种有可能比非靶向方法更快地阻止传播(12)。
血清学检测
接种前
不常规建议在接种疫苗前进行甲型肝炎免疫血清学检测,但在特定情况下可以考虑通过不为已经免疫的人接种疫苗来降低成本。疫苗接种前血清学检测不应成为易感人群接种疫苗的障碍,尤其是在难以接触的人群中。如果进行疫苗接种前血清学检测,应使用市售的总抗 HAV 或 IgG 抗 HAV 检测。
接种前检测可能最具成本效益的人群包括出生在甲型肝炎高度或中度流行地理区域或长期居住的成年人(图3)。由于该年龄组的感染率较低,因此不建议对儿童进行疫苗接种前血清学检测(9)。
在预计既往甲型肝炎病毒感染率较高的人群中,在可行的情况下,应在检测或疫苗接种前获取疫苗接种史。如果无法获得疫苗接种史、无法获得记录或疫苗接种前检测不可行,则不应推迟疫苗接种。对自然感染免疫的人接种疫苗没有已知的风险,给予额外剂量的甲肝疫苗也没有已知的风险(302)。
接种疫苗后
婴儿、儿童或成人常规接种疫苗后,无需进行血清学免疫检测。对于后续临床管理取决于其免疫状态的了解以及可能需要再次接种疫苗的人,例如 HIV 感染者和其他免疫功能低下者(例如 HCT 和实体器官移植受者以及接受化疗的人),建议在接种疫苗后检测是否存在抗 HAV 抗体( HIV 感染者;重新接种)。
再接种
对于在婴儿、儿童或成人时期接种完整系列疫苗的健康人,不建议再次接种(即加强剂量、挑战剂量或完整系列疫苗的重新接种)(238,240,243)。对于免疫功能低下者(例如,HIV 感染者、HCT 和实体器官移植受者以及接受化疗的人),可用于确定是否需要加强剂量或重新接种完整系列疫苗的数据有限。
临床医生可以考虑对HIV感染者( HIV感染者)和在化疗免疫抑制期间接种HepA疫苗的人进行重新接种,这些患者在初始HepA疫苗接种系列后未能表现出足够的免疫反应(即≥10 mIU/mL)(146,205)。在这种情况下,应在重新接种完整疫苗系列后至少 1 个月进行疫苗接种后血清学检测。如果对再次接种的反应仍然不充分(即 <10 mIU/mL),则不建议额外接种;然而,应告知患者预防 HAV 感染的方法,包括暴露后是否需要进行免疫球蛋白。如果疫苗接种导致血清转化,关于是否需要重复检测或加强剂量或重新接种疫苗的频率的数据有限。
中断的时间表和最短接种间隔
计划中断。对于所有年龄段,当 HepA 疫苗接种计划中断时,不需要重新开始疫苗系列。有限的数据表明,>2 岁 (Havrix) 和成人延迟 4-8 岁 (Havrix) 对第二剂延迟 20-31 个月和延迟 4-8 岁 (Havrix) 的反应与许可时间表相似。在成人中,对延迟 12-18 个月的第二剂 (Vaqta) 的反应与对 6 个月后给予的加强剂量的反应相似 (303-305)。
接种第一剂和第二剂。如果第一剂和第二剂单抗原 HepA 疫苗间隔 <6 个月接种,则第二剂无效,应在无效的第二剂后 6 个月重复接种。然而,如果在第一次接种后的任何时间≥6个月施用这种重复剂量(第三次接种),并且至少施用了适合年龄的剂量,则可以认为该系列是完整的(205)。
最小间隔或年龄。在最短间隔或年龄前 ≤4 天接种的疫苗剂量被认为是有效的。由于 Twinrix 独特的加速时间表,当以 0 天、7 天、21-30 天和 12 个月的时间表接种时,4 天指南不适用于该疫苗的前 3 剂 (306)。
其他疫苗接种管理问题和注意事项
剂量和时间表。甲型肝炎疫苗只能按照适合年龄的剂量和时间表进行接种。不建议对 ≥19 岁的人同时或顺序接种 2 剂 25 单位的 Vaqta 或 2 剂 720 ELISA 单位的 Havrix,而不是 1 剂成人剂量,并且不作为剂量和接种方法包含在制造商的包装说明书中;Havrix 和 Vaqta 的包装说明书包括附加信息 (202)。
Twinrix 和 PEP。不建议将 Twinrix 用于 PEP。
疫苗的可互换性。ACIP更倾向于系列中的HepA疫苗剂量来自同一制造商;但是,如果这是不可能的,或者如果先前给予的剂量的制造商未知,提供者应管理他们可用的疫苗(205)。剂量应被认为是有效的,不需要重复。当一个制造商生产的 1 剂有效剂量的 HepA 疫苗之后,按照推荐的时间表接种来自另一个制造商的剂量时,未观察到免疫原性差异 (307,308);Vaqta 的包装说明书包括附加信息 (202)。
o单抗原 HepA 和 HepB 疫苗可与 Twinrix 结合使用,形成这些疫苗的完整系列。由于 Twinrix 的乙型肝炎成分相当于标准成人剂量的 HepB 疫苗,因此无论哪种疫苗用于哪种剂量,时间表都是相同的。由于 Twinrix 的甲型肝炎成分相当于儿童剂量的 HepA 疫苗,因此将单抗原 HepA 疫苗和 Twinrix 混合的系列更为复杂。
o接受 1 剂 Twinrix 的 >19 岁人群可以完成 HepA 疫苗系列,接种 2 剂成人配方 HepA 疫苗,间隔至少 5 个月。接种 2 剂 Twinrix 的人可以在接种第二剂后 5 个月接种 1 剂成人制剂 HepA 疫苗或 Twinrix 来完成 HepA 疫苗系列。年龄≥19 岁的人开始接种单抗原 HepA 疫苗的甲型肝炎系列疫苗,可以接种 2 剂 Twinrix 或 1 剂成人制剂 HepA 疫苗完成该系列。18 岁的人应遵循与成人相同的时间表,使用甲肝疫苗的儿科制剂。提供者应仅接受注明日期的记录作为 HepA 疫苗接种的证据。有关乙肝疫苗接种的更多信息(306)。(Twinrix 封装说明书和相关参考资料提供了有关遵循加速的备用 Twinrix 时间表 [202,283,309,310] 的等效保护的更多信息。
易感人群。应在易感人群(即未接种疫苗、部分接种疫苗、对疫苗无反应或从未感染)中接种疫苗。
疫苗记录。虽然如果找不到记录,不应推迟疫苗接种,但应通过联系以前的医护人员、查看州或地方免疫信息系统或搜索个人持有的记录来尝试查找缺失的记录。如果无法在合理时间内找到记录,则应将这些人视为易感者,并按适当的剂量和时间表接种疫苗。
疫苗系列启动。在所有情况下,对在完成甲肝疫苗系列接种之前失去随访的担忧不应成为建议接种乙肝疫苗的人群开始接种系列疫苗的障碍。即使可能无法确保完成该系列,也应开始接种疫苗。一剂HepA疫苗提供个人保护,并有助于群体免疫,尽管长期保护可能不理想(244)。
活疫苗和免疫球蛋白。活疫苗(例如 MMR 和水痘疫苗)应在 IG 接种前至少 2 周 (205) 或后至少 6 个月接种 (217);GamaSTAN 软件包说明书包含其他信息 (205,217)。如果必须在接种 MMR 或水痘疫苗后 <2 周内接种 IG,则患者应在接受 IG 后 6 个月内重新接种疫苗,除非血清学检测可行并表明对该疫苗有反应 (205,217)。
疫苗和免疫球蛋白。同时推荐接种 HepA 疫苗的 IG 患者应在不同的解剖部位(例如,单独的肢体)与 IG 同时接种一剂疫苗。如果只有免疫球蛋白或只有疫苗可用,则应尽快接种任何可用的产品。如果该产品是作为暴露后预防的一部分接种的,则该人可以在接触后 2 周内返回使用其他产品。
常规。应考虑执行常规命令,以克服障碍并扩大覆盖面。
疫苗不良事件。接种任何疫苗后发生的不良事件都应报告给VAERS。报告可以在线、传真或邮寄提交给VAERS。有关VAERS的更多信息,请访问电话(800-822-7967)和在线(https://vaers.hhs.govexternal icon).
未来方向
ACIP和CDC将审查这些建议,作为与甲型肝炎疫苗(包括其他含甲型肝炎疫苗的许可)、甲型肝炎疫苗不良事件相关的新流行病学或其他信息,并在实施这些建议中获得的经验。将根据需要制定经修订的建议。
* 1996 年,建议 2-18 岁的人使用第三种儿科制剂 Havrix,每剂 360 个 ELISA 单位,分 3 剂接种 (6,202);然而,到 1999 年,每剂 360 个 ELISA 单位的儿科制剂不再可用,也不再推荐 (7)。
图 1.报告和估计的甲型肝炎病例数——美国,2013-2017年
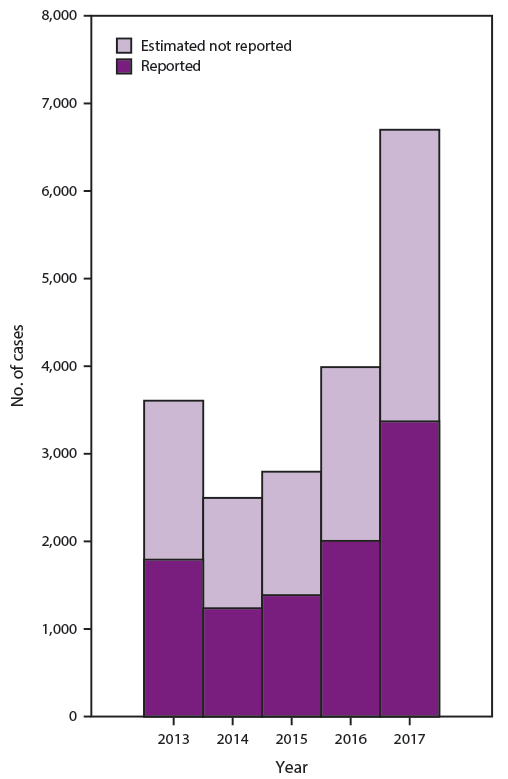
源:CDC,国家法定传染病监测系统。病毒性肝炎监测——美国,2017 年。佐治亚州亚特兰大:CDC,美国卫生与公众服务部。https://www.cdc.gov/hepatitis/statistics/2017surveillance/index.htm
图2.与甲型肝炎病毒感染和恢复相关的免疫学和临床事件
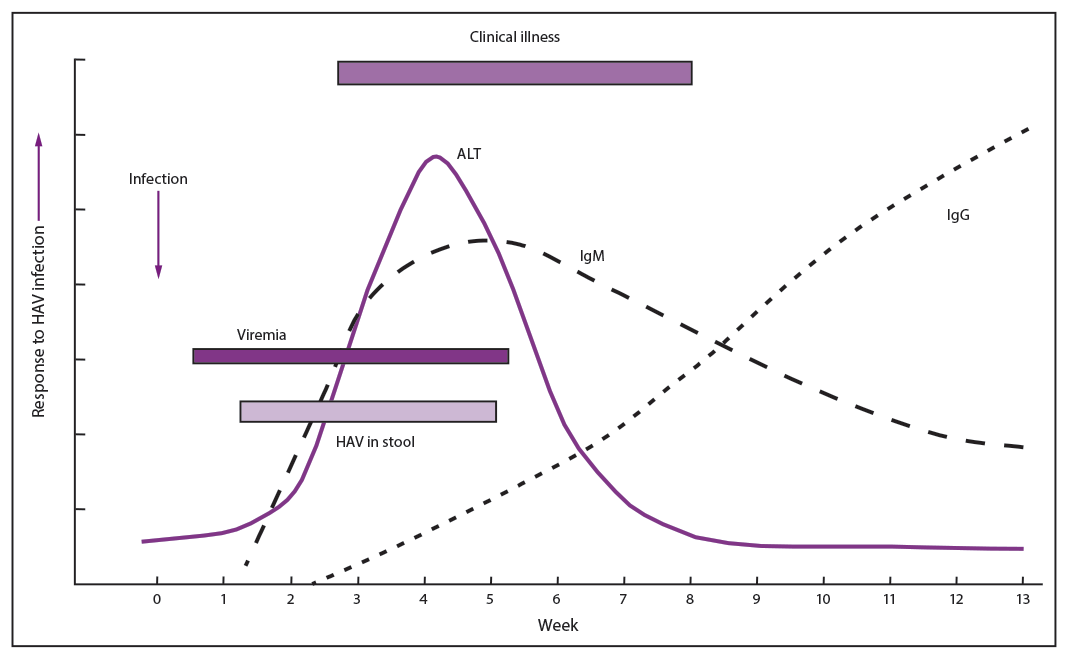
源:疾病预防控制中心。 食源性疾病的诊断和管理。MMWR Recomm Rep 2004;53(否。RR-4)。
缩写:ALT = 丙氨酸氨基转移酶;HAV = 甲型肝炎病毒;IgG = 免疫球蛋白 G;IgM = 免疫球蛋白 M。
图3.2015年按国家分列的甲型肝炎人群免疫力*中点估计年龄
源:雅各布森 KH.全球化和不断变化的甲型肝炎病毒流行病学。冷泉 Harb Perspect Med 2018;8:a031716。
缩写:AMPI = 人群免疫中点的年龄;HAV = 甲型肝炎病毒。
* AMPI 是出生队列中有一半具有先前接触过 HAV 的血清学证据的最年轻年龄。随着AMPI的增加(从浅到暗),甲型肝炎的流行水平通常会降低。
表 1.用于预防甲型肝炎病毒感染的疫苗
| 疫苗 | 商品名称(制造商) | 年龄组别(岁) | 剂量 | 路线 | 附表 | 加强剂 |
|---|---|---|---|---|---|---|
| 灭活的HepA(2剂) | Havrix(葛兰素史克) | 1–18 | 0.5 mL(720 个 ELISA 单位灭活的 HAV) | IM | 0、6-12 个月 | 没有 |
| ≥19 | 1 mL(1,440 个 ELISA 单位灭活的 HAV) | IM | 0、6-12 个月 | 没有 | ||
| 灭活的HepA(2剂) | Vaqta(默克) | 1–18 | 0.5 mL(25 单位 HAV 抗原) | IM | 0、6-18 个月 | 没有 |
| ≥19 | 1 mL(50 单位 HAV 抗原) | IM | 0、6-18 个月 | 没有 | ||
| HepA 和 HepB* 组合(3 剂) | Twinrix(葛兰素史克) | ≥18(主要) | 1 mL(720 个 ELISA 单位灭活 HAV + 20 μg HBsAg) | IM | 0、1、6 个月 | 没有 |
| ≥18(加速) | 1 mL(720 个 ELISA 单位灭活 HAV + 20 μg HBsAg) | IM | 0, 7, 21–30 天 | 12个月 |
缩写:ELISA = 酶联免疫吸附试验;HAV = 甲型肝炎病毒;HBsAg=乙型肝炎表面抗原;甲型肝炎=甲型肝炎;乙肝=乙型肝炎;IM = 肌内注射。
* 甲型肝炎和乙肝联合疫苗(Twinrix)不应用于暴露后预防。
表 2.GamaSTAN人免疫球蛋白用于甲型肝炎感染暴露前和暴露后预防的剂量建议
| 指示 | 时间 | 剂量* | 路线 |
|---|---|---|---|
| 暴露前预防 | 长达 1 个月的旅行时间 | 0.1 mL/kg | IM |
| 暴露前预防 | 长达 2 个月的旅行时间 | 0.2 mL/kg | IM |
| 暴露前预防 | ≥2个月的旅行时间 | 0.2 mL/kg(每 2 个月重复一次) | IM |
| 暴露后预防 | 接触后 2 周内 | 0.1 mL/kg | IM |
缩写:IM = 肌内注射。
*免疫球蛋白的剂量基于所有年龄段的体重,没有预防甲型肝炎的最大剂量(来源:基立福。用 GamaSTAN(免疫球蛋白 [人])治疗。https://www.hypermunes.com/en/hcp/gamastan-hepatitis-aexternal icon).
表 3.甲型肝炎病毒感染或甲型肝炎病毒感染严重疾病风险增加的人群类别*
| 风险类型 | 风险类别 | 例子 |
|---|---|---|
| 甲型肝炎病毒感染风险增加 | 甲型肝炎病毒感染者的密切接触者† | 家庭联系人 |
| 管理员 | ||
| 性接触 | ||
| 预计与国际收养人有密切个人接触的人 | ||
| 职业风险 | 与非人灵长类动物打交道的人 | |
| 在研究实验室中使用含有 HAV 的临床或非临床材料的人员 | ||
| 吸毒者 | 使用注射或非注射药物的人(即所有使用非法药物的人) | |
| 为成人提供服务的环境中的人员 | 发育障碍人士的团体设置 | |
| 无家可归者收容所 | ||
| 注射器服务计划 | ||
| 疫情爆发期间的惩教设施 | ||
| 国际旅客 | 前往甲型肝炎病毒高流行或中度流行国家或在该国工作的人 | |
| 甲型肝炎病毒感染导致重症风险增加 | 免疫功能低下人士 | 先天性或获得性免疫缺陷 |
| HIV感染 | ||
| 慢性肾功能衰竭,正在接受透析 | ||
| 实体器官、骨髓或干细胞移植受者 | ||
| 患有需要使用免疫抑制药物/生物制剂(例如肿瘤坏死 α 抑制剂)、长期全身性皮质类固醇、放射治疗治疗的疾病的人 | ||
| 慢性肝病患者 | 乙型肝炎病毒感染 | |
| 丙型肝炎病毒感染 | ||
| 肝硬化(任何病因) | ||
| 脂肪肝(肝脂肪变性) | ||
| 酒精性肝病 | ||
| 自身免疫性肝炎 | ||
| 丙氨酸转氨酶或天冬氨酸转氨酶水平超过正常上限的两倍或持续升高 6 个月 | ||
| 年龄 | >40 岁的成年人 |
缩写:HAV = 甲型肝炎病毒;HIV = 人类免疫缺陷病毒。
* 并非所有风险类别都包括建议常规接种甲型肝炎疫苗的人(盒装)。医务人员在决定是否提供暴露后预防或再接种时,应评估甲型肝炎病毒感染或甲型肝炎感染引起的严重疾病的风险(表 4)。医务人员应考虑在为有甲型肝炎感染风险的成年人提供服务的环境中接种疫苗( 实施策略和疫情暴发期间的甲型肝炎疫苗接种)。
†不包括使用适当个人防护装备的医护人员。
表 4.按年龄组和风险类别分列的暴露后预防和暴露前保护建议 — 免疫实践咨询委员会,2020 年
| 适应症和年龄组别 | 风险类别和健康状况 | 甲肝疫苗 | IG级* |
|---|---|---|---|
| 暴露后预防 | |||
| <12个月 | 健康 | 不 | 0.1mL/kg |
| 12个月–40岁 | 健康 | 1剂† | 没有 |
| >40 岁 | 健康 | 1剂† | 0.1mL/kg§ |
| ≥12个月 | 免疫功能低下或慢性肝病 | 1剂† | 0.1mL/kg¶ |
| ≥12个月 | 疫苗禁忌证** | 不 | 0.1mL/kg |
| 暴露前保护(例如,旅行)†† | |||
| <6个月 | 健康 | 不 | 0.1–0.2 mL/kg§§ |
| 6-11个月 | 健康 | 1剂¶¶ | 没有 |
| 12个月–40岁 | 健康 | 1剂*** | 没有 |
| >40 岁 | 健康 | 1剂*** | 0.1–0.2 mL/kg§§,††† |
| >6个月 | 免疫功能低下或慢性肝病 | 1剂*** | 0.1–0.2 mL/kg§§,††† |
| >6个月 | 选择不接种疫苗或禁忌接种疫苗的人士** | 不 | 0.1–0.2 mL/kg§§ |
缩写:HAV = 甲型肝炎病毒;甲型肝炎=甲型肝炎;IG = 免疫球蛋白。
* 麻疹、流行性腮腺炎和风疹疫苗在注射免疫球蛋白前至少 2 周和接种后 6 个月内不应接种。
†暴露后预防不需要接种第二剂甲肝疫苗;然而,为了获得长期免疫力,疫苗接种系列应在第一剂后至少 6 个月完成第二剂。
医务人员的风险评估(表 3)应确定是否需要进行免疫球蛋白治疗。如果医务人员的风险评估确定疫苗和免疫球蛋白均有必要,则应在不同的解剖部位(例如,不同的肢体)同时接种 HepA 疫苗和免疫球蛋白。
疫苗和免疫球蛋白应在不同的解剖部位(例如,单独的肢体)同时接种。
** 对先前剂量的 HepA 疫苗有危及生命的过敏反应或对任何疫苗成分过敏。§¶
††对于有 HAV 感染或 HAV 感染导致的重症特殊危险因素的人,在旅行前应考虑 IG。
0.1 mL/kg,旅行时间不超过 1 个月;0.2 mL/kg(旅行时间不超过 2 个月),0.2 mL/kg(旅行时间≥2 个月)。
该剂量不应计入常规 2 剂系列,该系列应在 12 月龄时开始。
对于以前未接种过甲肝疫苗的人,在考虑旅行后立即接种,如果旅行前需要接种下一剂,则按照常规时间表完成接种。§§¶¶
†††可根据提供者的风险评估进行管理(表 3)。
盒子. 美国甲型肝炎病毒感染的预防:免疫实践咨询委员会的建议,2020 年*
孩子
所有 12-23 个月的儿童
未接种疫苗的 2-18 岁儿童和青少年
甲型肝炎病毒感染风险增加的人群
国际旅客
男男性行为者
使用注射或非注射药物的人(即所有使用非法药物的人)
有职业暴露风险的人员
预计与国际收养人有密切个人接触的人
无家可归者
甲型肝炎病毒感染重症风险增加的人群
慢性肝病患者
人类免疫缺陷病毒感染者
其他建议接种疫苗的人
有 HAV 感染风险或因 HAV 感染而产生严重后果的孕妇
任何要求接种疫苗的人
疫情暴发期间的疫苗接种
在疫情暴发环境中有甲型肝炎感染风险或有甲型肝炎重症风险的未接种疫苗者
为成人提供服务的机构的实施策略
在为成年人提供服务的环境中,这些人中有很大一部分人有甲型肝炎感染的危险因素
ACIP不再推荐接种甲型肝炎疫苗
因凝血障碍(例如血友病)接受血液制品治疗的人
__________________________
*有关更多信息,请参阅本报告中的甲型肝炎疫苗和免疫球蛋白暴露前预防建议部分。
引用
1.莱德纳 WM、柠檬 SM、柯克帕特里克 JW、雷德菲尔德 RR、菲尔兹 ML、凯利 PW。成人流行性甲型肝炎病毒感染相关疾病的发生率。Am J 流行病学 1985;122:226–33.交叉参考external icon PubMed的external icon
2.Kemmer NM, Miskovsky EP. 甲型肝炎 Infect Dis Clin North Am 2000;14:605–15.交叉参考external icon PubMed的external icon
3.Keeffe E. 慢性肝病患者的甲型肝炎 – 疾病的严重程度和疫苗接种的预防。J 病毒性肝炎 2000;7(增刊1):15–7。交叉参考external icon PubMed的external icon
4.Rubin LG、Levin MJ、Ljungman P 等人,美国传染病学会。2013 年 IDSA 免疫功能低下宿主疫苗接种临床实践指南。2014 年临床感染病;58:309–18.交叉参考external icon PubMed的external icon
5.Glikson M, Galun E, Oren R, Tur-Kaspa R, Shouval D. 复发性甲型肝炎. 回顾 14 例病例和文献调查。医学(巴尔的摩)1992 年;71:14–23.交叉参考external icon PubMed的external icon
6.通过主动或被动免疫预防甲型肝炎:免疫实践咨询委员会、美国儿科学会、美国家庭医师学会和美国医学会的建议。MMWR Recomm Rep 1996年;45(编号。RR-13)。
7.通过主动或被动免疫预防甲型肝炎:免疫实践咨询委员会(ACIP)的建议。MMWR Recomm Rep 1999年;48(编号。RR-12)。PubMed的external icon
8.菲奥雷 AE、瓦斯利 A、贝尔 BP;免疫实践咨询委员会(ACIP)。通过主动或被动免疫预防甲型肝炎:免疫实践咨询委员会的建议。MMWR Recomm Rep 2006;55(否。RR-7)。PubMed的external icon
9.疾病预防控制中心(CDC)病毒性肝炎监测—美国,2017年。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2019. https://www.cdc.gov/hepatitis/statistics/SurveillanceRpts.htm
10.Collier MG、Khudyakov YE、Selvage D 等人甲型肝炎疫情调查小组。美国爆发的甲型肝炎与从土耳其进口的冷冻石榴假种皮有关:流行病学案例研究。柳叶刀感染 Dis 2014;14:976–81.交叉参考external icon PubMed的external icon
11.Viray MA、Hofmeister MG、Johnston DI 等。对生吃进口扇贝的甲型肝炎疫情的公共卫生调查和应对——夏威夷,2016年。流行病学感染 2018;147:1–8.
12.Foster M、Ramachandran S、Myatt K 等人与吸毒和无家可归相关的甲型肝炎病毒爆发——加利福尼亚州、肯塔基州、密歇根州和犹他州,2017 年。MMWR Morb Mortal Wkly Rep 2018;67:1208–10.交叉参考external icon PubMed的external icon
13.Yin S, Barker L, Ly KN, 等.2007-2016 年美国甲型肝炎病毒感染易感性。2020 年临床感染疾病;CIA298
.交叉参考external icon PubMed的external icon
14.美国成年人的疫苗接种覆盖率,全国健康访谈调查,2017 年。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2018. https://www.cdc.gov/vaccines/imz-managers/coverage/adultvaxview/pubs-resources/NHIS-2017.html#box2
15.Doshani M、Weng M、Moore KL、Romero JR、Nelson NP。免疫实践咨询委员会关于无家可归者使用甲型肝炎疫苗的建议。MMWR Morb Mortal Wkly Rep 2019;68:153–6.交叉参考external icon PubMed的external icon
16.疾病预防控制中心;免疫实践咨询委员会。免疫实践咨询委员会(ACIP)关于在新抵达的国际收养者的密切接触者中使用甲型肝炎疫苗的最新建议。MMWR Morb Mortal Wkly Rep 2009 年;58:1006–7.PubMed的external icon
17.Nelson NP、Link-Gelles R、Hofmeister MG 等。最新情况:免疫实践咨询委员会关于使用甲型肝炎疫苗进行暴露后预防和国际旅行暴露前预防的建议。MMWR Morb Mortal Wkly Rep 2018;67:1216–20.交叉参考external icon PubMed的external icon
18.Shimabukuro TT, Nguyen M, Martin D, DeStefano F. 疫苗不良事件报告系统 (VAERS) 中的安全性监测。疫苗 2015;33:4398–405.交叉参考external icon PubMed的external icon
19.周 W, Pool V, 伊斯坎德尔 JK, 等.免疫接种后安全性监测:疫苗不良事件报告系统(VAERS)——美国,1991-2001年。MMWR Surveill Summ 2003;52(编号。SS-1)。PubMed的external icon
20.McNeil MM、Gee J、Weintraub ES 等人。疫苗安全数据链:监测疫苗安全性的成功与挑战。疫苗 2014;32:5390–8.交叉参考external icon PubMed的external icon
21.Hill HA, Singleton JA, Yankey D, Elam-Evans LD, Pingali SC, Kang Y. 2015 年和 2016 年出生的儿童 24 个月大的疫苗接种覆盖率——全国免疫调查——美国儿童,2016-2018 年。MMWR Morb Mortal Wkly Rep 2019;68:913–8.交叉参考external icon PubMed的external icon
22.佐治亚州亚特兰大:美国卫生与公众服务部。甲型肝炎在人与人之间广泛爆发。https://www.cdc.gov/hepatitis/outbreaks/2017March-HepatitisA.htm
23.Latash J、Dorsinville M、Del Rosso P 等人。现场笔记:男男性行为者中报告的甲型肝炎感染增加——纽约市,2017年1月至8月。MMWR Morb Mortal Wkly Rep 2017 年;66:999–1000.交叉参考external icon PubMed的external icon
24.美国国立卫生研究院,国家药物滥用研究所。女性的物质使用。马里兰州贝塞斯达:美国国立卫生研究院、国家药物滥用研究所;2018.https://www.drugabuse.gov/publications/research-reports/substance-use-in-women/summaryexternal icon
25.梅尔尼克 JL。甲型肝炎病毒的性质和分类。疫苗 1992;10(增刊 1):S24–6。交叉参考external icon PubMed的external icon
26.Martin A, Lemon SM. 甲型肝炎病毒:从发现到疫苗。肝病学 2006;43(增刊1):S164–72。交叉参考external icon PubMed的external icon
27.Zell R、Delwart E、Gorbalenya AE 等人,ICTV 报告联盟。ICTV病毒分类简介:小核糖核酸病毒科。J Gen Virol 2017 年;98:2421–2.交叉参考external icon PubMed的external icon
28.科恩·姬(Cohen JI)。甲型肝炎病毒:来自分子生物学的见解。肝病学 1989;9:889–95.交叉参考external icon PubMed的external icon
29.Lemon SM, Ott JJ, Van Damme P, Shouval D. A 型病毒性肝炎:分子病毒学、流行病学、发病机制和预防的总结和更新。肝病杂志 2017:S0168–8278(17):32278-X。
30.Robertson BH、Jansen RW、Khanna B 等人。从不同地理区域回收的甲型肝炎病毒株的遗传相关性。J Gen Virol 1992 年;73:1365–77.交叉参考external icon PubMed的external icon
31.Costa-Mattioli M, Napoli AD, Ferré V, Billaudel S, Perez-Bercoff R, Cristina J. 甲型肝炎病毒的遗传变异性。J Gen Virol 2003 年;84:3191–201.交叉参考external icon PubMed的external icon
32.Vaughan G, Goncalves Rossi LM, Forbi JC, et al. 甲型肝炎病毒:宿主相互作用、分子流行病学和进化。感染 Genet Evol 2014;21:227–43.交叉参考external icon PubMed的external icon
33.北卡罗来纳州塔索普洛斯、帕帕万杰洛 GJ、蒂斯赫斯特 JR、珀塞尔 RH。甲型肝炎患者和实验感染的黑猩猩中希腊甲型肝炎病毒株的粪便排泄。J Infect Dis 1986 年;154:231–7.交叉参考external icon PubMed的external icon
34.Smith PF、Grabau JC、Werzberger A 等人。幼儿在1997年甲型肝炎流行病爆发中的作用;118:243–52.交叉参考external icon PubMed的external icon
35.Staes CJ、Schlenker TL、Risk I 等人。急性甲型肝炎患者在持续社区暴发期间未确定危险因素的感染源。儿科 2000;106:E54
。交叉参考external icon PubMed的external icon
36.菲奥雷AE。通过食物传播的甲型肝炎。临床感染 Dis 2004;38:705–15.交叉参考external icon PubMed的external icon
37.Barrett CE、Pape BJ、Benedict KM 等。公共卫生干预措施对饮用水相关甲型肝炎暴发的影响——美国,1971-2017 年。MMWR Morb Mortal Wkly Rep 2019;68:766–70.交叉参考external icon PubMed的external icon
38.麦考斯特兰 KA、邦德 WW、布拉德利 DW、艾伯特 JW、梅纳德 JE。甲型肝炎病毒在干燥和储存 1 个月后在粪便中的存活率。临床微生物学杂志 1982;16:957–8.交叉参考external icon PubMed的external icon
39.Niu MT、Polish LB、Robertson BH 等。与冷冻草莓相关的甲型肝炎多州暴发。J 感染 Dis 1992;166:518–24.交叉参考external icon PubMed的external icon
40.北欧疫情调查小组。北欧国家对2012年10月至2013年6月甲型肝炎疫情的联合分析:怀疑冷冻草莓。欧洲监督 2013;18:20520。交叉参考external icon PubMed的external icon
41.里德 TM,罗宾逊 HG。冷冻覆盆子和甲型肝炎。 流行病学感染 1987;98:109–12.交叉参考external icon PubMed的external icon
42.法韦罗 MSBW。消毒和灭菌。在:Zuckerman AJ TH,编辑。病毒性肝炎的科学依据和临床管理。纽约:丘吉尔·利文斯通;1993 年,第 565-75 页。
43.柠檬SM。甲型肝炎的自然病程:通过输血或血液制品传播的可能性。Vox Sang 1994 年;67(增刊4):19-23,讨论24-6。交叉参考external icon PubMed的external icon
44.Soucie JM, Robertson BH, Bell BP, McCaustland KA, Evatt BL. 美国与凝血因子浓缩物相关的甲型肝炎病毒感染。输血 1998;38:573–9.交叉参考external icon PubMed的external icon
45.本杰明RJ。核酸检测:更新和应用。Semin Hematol 2001 年;38(增刊9):11-6。交叉参考external icon PubMed的external icon
46.科恩 JI, Feinstone S, Purcell RH.黑猩猩甲型肝炎病毒感染:病毒血症的持续时间以及唾液和咽拭子中病毒的检测。J 感染 Dis 1989;160:887–90.交叉参考external icon PubMed的external icon
47.Parry JV, Perry KR, Panday S, Mortimer PP. 通过测试唾液诊断甲型肝炎和乙型肝炎。J Med Virol 1989 年;28:255–60.交叉参考external icon PubMed的external icon
48.Mackiewicz V, Dussaix E, Le Petitcorps MF, Roque-Afonso AM.检测唾液中的甲型肝炎病毒RNA。临床微生物学杂志 2004;42:4329–31.交叉参考external icon PubMed的external icon
49.克鲁格曼 S, 贾尔斯 JP.病毒性肝炎。旧病的新曙光。美国医学会杂志 1970;212:1019–29.交叉参考external icon PubMed的external icon
50.柠檬SM.A型病毒性肝炎。旧病的新发展。N Engl J Med 1985 年;313:1059–67.交叉参考external icon PubMed的external icon
51.哈德勒 SC、韦伯斯特 HM、埃尔本 JJ、斯旺森 JE、梅纳德 JE。日托中心的甲型肝炎。全社区范围的评估。N Engl J Med 1980 年;302:1222–7.交叉参考external icon PubMed的external icon
52.Tong MJ, el-Farra NS, Grown MI. 甲型肝炎的临床表现:最近在社区教学医院的经历。J Infect Dis 1995 年;171(增刊1):S15–8。交叉参考external icon PubMed的external icon
53.科夫RS。甲型肝炎病毒感染的临床表现和诊断。疫苗 1992;10(增刊1):S15–7。交叉参考external icon PubMed的external icon
54.Sjogren MH, Tanno H, Fay O, et al. 临床复发期间粪便中的甲型肝炎病毒。Ann Intern Med 1987 年;106:221–6.交叉参考external icon PubMed的external icon
55.Foster MA、Hofmeister MG、Kupronis BA 等。甲型肝炎病毒感染增加——美国,2013-2018 年。MMWR Morb Mortal Wkly Rep 2019;68:413–5.交叉参考external icon PubMed的external icon
56.Robertson BH、Averhoff F、Cromeans TL 等人。在社区范围暴发期间分离出甲型肝炎病毒的遗传相关性。J Med Virol 2000 年;62:144–50.交叉参考external icon PubMed的external icon
57.Rosenblum LS, Villarino ME, Nainan OV, et al. 新生儿重症监护病房中的甲型肝炎暴发:早产儿传播的危险因素和病毒排泄延长的证据。J 感染 Dis 1991;164:476–82.交叉参考external icon PubMed的external icon
58.鲍尔 WA、奈南 OV、韩 X、马戈利斯 HS。甲型肝炎病毒感染中病毒血症的持续时间。J 感染 Dis 2000;182:12–7.交叉参考external icon PubMed的external icon
59.Tjon GM、Coutinho RA、van den Hoek A 等人。免疫功能正常患者的甲型肝炎病毒高且持续排泄。J Med Virol 2006 年;78:1398–405.交叉参考external icon PubMed的external icon
60.Costa-Mattioli M, Allavena C, Poirier AS, Billaudel S, Raffi F, Ferré V. HIV-1 血清阳性患者长期甲型肝炎感染。J Med Virol 2002 年;68:7–11.交叉参考external icon PubMed的external icon
61.Foster MA、Weil LM、Jin S 等。甲型肝炎病毒通过肝-小肠-胰腺联合移植传播。Emerg Infect Dis 2017年;23:590–6.交叉参考external icon PubMed的external icon
62.廖永峰, 杨赛, 楚 CM, 黄 MJ.甲型肝炎 IgM 抗体在急性临床甲型肝炎中的出现和持续存在。感染 1986;14:156–8.交叉参考external icon PubMed的external icon
63.Lemon SM、Murphy PC、教务长 PJ 等。免疫沉淀和病毒中和试验表明,对灭活甲型肝炎疫苗的保护性抗体反应与免疫球蛋白被动免疫之间存在质的差异。J 感染 Dis 1997;176:9–19.交叉参考external icon PubMed的external icon
64.美国医学会;美国护士协会-美国护士基金会;疾病预防控制中心;美国食品药品监督管理局食品安全与应用营养中心;美国农业部食品安全和检验局。食源性疾病的诊断和管理:医生和其他卫生保健专业人员的入门书。MMWR Recomm Rep 2004;53(否。RR-4)。PubMed的external icon
65.花王 HW、阿什卡瓦伊 M、雷德克尔股份公司。急性临床甲型肝炎后甲型肝炎 IgM 抗体的持续存在。 肝病学 1984;4:933–6.交叉参考external icon PubMed的external icon
66.Sikuler E, Keynan A, Hanuka N, Zagron-Bachir G, Sarov I. 晚期恢复期血清中甲型肝炎病毒 IgM 抗体检测呈阳性的持续性。Isr J Med Sci 1987 年;23:193–5.PubMed的external icon
67.美国疾病预防控制中心,近期无急性肝炎病史的急性甲型肝炎病毒感染阳性检测结果——美国。MMWR Morb Mortal Wkly Rep 2005 年;54:453–6.PubMed的external icon
68.Castrodale L, Fiore A, Schmidt T. 在没有其他肝炎证据的情况下检测阿拉斯加居民的甲型肝炎病毒免疫球蛋白 M 抗体。临床感染 Dis 2005;41:E86-8。交叉参考external icon PubMed的external icon
69.Decker RH, Overby LR, Ling CM, Frösner G, Deinhardt F, Boggs J. 甲型肝炎在人类中传播的血清学研究。J Infect Dis 1979 年;139:74–82.交叉参考external icon PubMed的external icon
70.柠檬 SM,宾 LN。对甲型肝炎病毒的血清中和抗体反应。J 感染 Dis 1983;148:1033–9.交叉参考external icon PubMed的external icon
71.Locarnini SA、Ferris AA、Lehmann NI、Gust ID。甲型肝炎感染后的抗体反应。Intervirology 1977 年;8:309–18.交叉参考external icon PubMed的external icon
72.宿主对甲型肝炎病毒的免疫反应。J Infect Dis 1995 年;171(增刊1):S9-14。交叉参考external icon PubMed的external icon
73.Amon JJ、Devasia R、Xia G 等。2003年美国食源性甲型肝炎暴发的分子流行病学。J 感染 Dis 2005;192:1323–30.交叉参考external icon PubMed的external icon
74.Nainan OV、Armstrong GL、Han XH、Williams I、Bell BP、Margolis HS。1996-1997年美国甲型肝炎分子流行病学:感染源和疫苗接种政策的影响。J 感染 Dis 2005;191:957–63.交叉参考external icon PubMed的external icon
75.Hutin YJ、Pool V、Cramer EH 等人国家甲型肝炎调查小组。甲型肝炎的多州食源性暴发。 N Engl J Med 1999;340:595–602.交叉参考external icon PubMed的external icon
76.奈南 OV、夏 G、沃恩 G、马戈利斯 HS。甲型肝炎病毒感染的诊断:分子方法。临床微生物修订版 2006;19:63–79.交叉参考external icon PubMed的external icon
77.Funkhouser AW、Purcell RH、D’Hondt E、Emerson SU。减毒甲型肝炎病毒:适应MRC-5细胞生长的遗传决定因素。J Virol 1994 年;68:148–57.交叉参考external icon PubMed的external icon
78.科恩 JI、罗森布鲁姆 B、费恩斯通 SM、蒂斯赫斯特 J、珀塞尔 RH。甲型肝炎病毒 (HAV) 的衰减和细胞培养适应:使用 HAV cDNA 进行遗传分析。J Virol 1989 年;63:5364–70.交叉参考external icon PubMed的external icon
79.Steffen R, Kane MA, Shapiro CN, Billo N, Schoellhorn KJ, van Damme P. 旅行者甲型肝炎的流行病学和预防。美国医学会杂志 1994;272:885–9.交叉参考external icon PubMed的external icon
80.雅各布森 KH.全球化和不断变化的甲型肝炎病毒流行病学。冷泉 Harb Perspect Med 2018;8:a031716
.交叉参考external icon PubMed的external icon
81.Mohd Hanafiah K, Jacobsen KH, Wiersma ST. 绘制甲型肝炎病毒感染健康风险图的挑战。国际健康地理杂志 2011;10:57。交叉参考external icon PubMed的external icon
82.Nelson N. 甲型肝炎 CDC 黄皮书 2020。纽约,纽约:牛津大学出版社;2020.
83.Cotter SM、Sansom S、Long T 等。男男性行为者中甲型肝炎的暴发:对甲型肝炎疫苗接种策略的影响。J 感染 Dis 2003;187:1235–40.交叉参考external icon PubMed的external icon
84.Regan DG、Wood JG、Benevent C 等人。估计预防男男性行为者甲型肝炎暴发的关键免疫阈值。流行病学感染 2016;144:1528–37.交叉参考external icon PubMed的external icon
85.欧洲疾病预防和控制中心。欧盟/欧洲经济区的甲型肝炎疫情主要影响男男性行为者——第三次更新。瑞典斯德哥尔摩:欧洲疾病预防和控制中心;2017.https://www.ecdc.europa.eu/en/publications-data/rapid-risk-assessment-hepatitis-outbreak-eueea-mostly-affecting-men-who-have-external icon
86.2016 年 6 月至 2017 年 5 月,欧盟和欧洲经济区甲型肝炎疫情对男男性行为者 (MSM) 的影响尤为严重。欧洲监视 2018;23:08.
87.Plunkett J, Mandal S, Balogun K, et al. 2016-2018 年英格兰男男性行为者 (MSM) 中的甲型肝炎疫情:过去和当前的疫苗接种政策和实践的贡献。疫苗 X 2019;1:100014。
88.欧洲疾病预防和控制中心。流行病学最新情况:欧盟/欧洲经济区爆发的甲型肝炎疫情主要影响男男性行为者。瑞典斯德哥尔摩:欧洲疾病预防和控制中心;2017.https://www.ecdc.europa.eu/en/news-events/epidemiological-update-hepatitis-outbreak-eueea-mostly-affecting-men-who-have–men-2external icon
89.Gozlan Y、Bar-Or I、Rakovsky A 等人。2016 年 12 月至 2017 年 6 月,以色列特拉维夫地区与欧洲疫情相关的男男性行为者 (MSM) 中持续发生的甲型肝炎。欧洲监视 2017;22:30575。交叉参考external icon PubMed的external icon
90.Rivas V, Barrera A, Pino K, et al. 自 2016 年 11 月以来影响智利男男性行为者 (MSM) 的甲型肝炎疫情与欧洲目前的男男性行为者疫情有关,情况截至 2017 年 10 月。欧洲监督 2018;23。
91.Tanaka S、Kishi T、Ishihara A 等。2018年3月至7月在日本大阪发生的与欧洲男男性行为者疫情有关的甲型肝炎疫情。Hepatol Res 2019 年;49:705–10.交叉参考external icon PubMed的external icon
92.Srivastav A, O’Halloran A, Lu PJ, Williams WW, Hutchins SS. 美国成年人自我认同的性取向之间的疫苗接种差异,国家健康访谈调查,2013-2015 年。PLoS One 2019 年;14:e0213431
.交叉参考external icon PubMed的external icon
93.Whitehead J、Shaver J、Stephenson R. 农村 LGBT 人群的 Outness、污名化和初级卫生保健利用。PLoS One 2016 年;11:e0146139
.交叉参考external icon PubMed的external icon
94.Bialek SR、Barry V、Bell BP 等;青年男子调查研究小组。HIV阴性美国男男性行为者甲型肝炎的血清阳性率和相关性。性健康 2011;8:343–8.交叉参考external icon PubMed的external icon
95.西康诺菲 DE、哈尔基蒂斯 PN、罗杰斯 ME。在纽约市参加健身房的男同性恋、双性恋和其他与男性发生性关系的男性中接种肝炎疫苗和感染。Am J 男性健康 2009;3:141–9.交叉参考external icon PubMed的external icon
96.Vong S、Fiore AE、Haight DO 等人。在甲基苯丙胺吸毒者中社区爆发甲型肝炎疫情期间,在县监狱接种疫苗作为接触高危成年人的策略。疫苗 2005;23:1021–8.交叉参考external icon PubMed的external icon
97.Lugoboni F, Pajusco B, Albiero A, Quaglio G. 吸毒者中的甲型肝炎病毒和疫苗接种的作用:综述。前精神病学 2012;2:79。交叉参考external icon PubMed的external icon
98.Hutin YJ、Sabin KM、Hutwagner LC 等。甲型肝炎病毒在甲基苯丙胺使用者中的多种传播方式。Am J 流行病学 2000;152:186–92.交叉参考external icon PubMed的external icon
99.科利尔 MG、德罗贝纽克 J、奎瓦斯-莫塔 J、加芬 RS、卡米利 S、特沙勒 EH。注射毒品的年轻人中的甲型肝炎和乙型肝炎——疫苗接种、既往和现在的感染。疫苗 2015;33:2808–12.交叉参考external icon PubMed的external icon
100.Koepke R, Sill DN, Akhtar WZ, et al. 注射毒品并有丙型肝炎感染证据的人的甲型肝炎和乙型肝炎疫苗接种覆盖率。公共卫生代表 2019;134:651–9.交叉参考external icon PubMed的external icon
101.Hinthorn DR、Foster MT Jr、Bruce HL、Aach RD。黑猩猩相关肝炎的爆发。J Occup Med 1974 年;16:388–91.PubMed的external icon
102.Dienstag JL、达文波特 FM、麦科勒姆 RW、轩尼诗 AV、Klatskin G、Purcell RH。非人灵长类动物相关病毒性甲型肝炎。 甲型肝炎病毒感染的血清学证据。美国医学会杂志 1976;236:462–4.交叉参考external icon PubMed的external icon
103.罗伯逊 BH.病毒性肝炎和灵长类动物:人类和非人灵长类动物甲型肝炎、乙型肝炎和GB相关病毒的历史和分子分析。J 病毒性肝炎 2001;8:233–42.交叉参考external icon PubMed的external icon
104.免疫实践咨询委员会;卫生保健人员的免疫接种:免疫实践咨询委员会(ACIP)的建议。MMWR Recomm Rep 2011;60(编号RR-7)。PubMed的external icon
105.Raabe VN, Sautter C, Chesney M, Eckerle JK, Howard CR, John CC. 对来自甲型肝炎流行国家的国际收养儿童进行甲型肝炎筛查。Clin Pediatr (Phila) 2014 年;53:31–7.交叉参考external icon PubMed的external icon
106.Fischer GE, Teshale EH, Miller C, et al. 国际收养者中的甲型肝炎及其接触者。临床感染 Dis 2008;47:812–4.交叉参考external icon PubMed的external icon
107.Pelletier AR、Mehta PJ、Burgess DR 等。在国际收养者的主要和次要接触者中爆发甲型肝炎。公共卫生代表 2010;125:642–6.交叉参考external icon PubMed的external icon
108.Sweet K, Sutherland W, Ehresmann K, Lynfield R. 2007-2009 年明尼苏达州近期国际收养者及其接触者的甲型肝炎感染。儿科 2011;128:E333-8。交叉参考external icon PubMed的external icon
109.Vernon JA, Payette M, Chatterjee A. 美国的社会福利和青少年疫苗接种计划:系统性扩张的经济机会。2009年社会工作公共卫生;24:414–45.交叉参考external icon PubMed的external icon
110.Wilson ME, Kimble J. 旅行后甲型肝炎:可能从无症状收养儿童那里获得。临床感染 Dis 2001;33:1083–5.交叉参考external icon PubMed的external icon
111.美国疾病预防控制中心(CDC)病毒性肝炎监测——美国,2009年。佐治亚州亚特兰大:美国卫生与公众服务部。https://www.cdc.gov/hepatitis/statistics/2009surveillance/index.htm
112.国家无家可归者医疗保健委员会 [互联网]。了解无家可归者:常见问题。田纳西州纳什维尔:无家可归者委员会的国家医疗保健。https://nhchc.org/understanding-homelessness/faq/external icon
113.健康中心,42 U.S.C. Sect. 254b。https://www.law.cornell.edu/uscode/text/42/254b#tab_default_2external icon
114.初级卫生保健局卫生资源和服务管理局。健康中心计划合规手册。词汇表:330(h)无家可归人口。马里兰州罗克维尔:卫生资源和服务管理局。https://bphc.hrsa.gov/programrequirements/compliancemanual/glossary.htmlexternal icon
115.Doran KM、Rahai N、McCormack RP 等。急诊科患者的药物使用和无家可归。药物酒精依赖 2018;188:328–33.交叉参考external icon PubMed的external icon
116.DeGroote NP, Mattson CL, Tie Y, Brooks JT, Garg S, Weiser J. 接受 HIV 医疗护理的高危人群的甲型肝炎病毒免疫和疫苗接种。2018 年上一篇医学代表;11:139–44.交叉参考external icon PubMed的external icon
117.Moon AM, Lowy E, Maier MM, et al. 鉴于最近的疫情,退伍军人健康管理局内外的甲型肝炎病毒预防和疫苗接种。2018年美联储实践;35(增刊2):S32–7。PubMed的external icon
118.Sun HY, Kung HC, Ho YC, 等.台湾HIV感染者甲型肝炎病毒感染的血清阳性率:对甲型肝炎疫苗接种的影响。Int J Infect Dis 2009年;13:E199-205。交叉参考external icon PubMed的external icon
119.奥弗顿 ET、努鲁迪诺娃 D、Sungkanuparph S、塞弗里德 W、格罗格 RK、粉状 WG。HIV感染者接种甲型肝炎疫苗后免疫力的预测因子。J 病毒性肝炎 2007;14:189–93.交叉参考external icon PubMed的external icon
120.Sheth AN、Moore RD、Gebo KA。在城市HIV诊所为中老年患者提供一般和针对HIV的健康维护。2006 年艾滋病患者护理 STDS;20:318–25.交叉参考external icon PubMed的external icon
121.疾病预防控制中心。 医疗监测项目。美国卫生与公众服务部,疾病预防控制中心。https://www.cdc.gov/hiv/statistics/systems/mmp/resources.html
122.阿德朱莫 A、西瓦帕兰 V、曼海默 S.评估市中心 HIV 诊所 HIV 患者甲型肝炎抗体和疫苗接种的血清阳性率。Int J Infect Dis 2010 年;14:e404
.交叉参考external icon
123.Koziel MJ, Peters MG. HIV感染中的病毒性肝炎。N Engl J Med 2007 年;356:1445–54.交叉参考external icon PubMed的external icon
124.Lin KY, Chen GJ, Lee YL, et al. 人类免疫缺陷病毒阳性患者的甲型肝炎病毒感染和甲型肝炎疫苗接种:综述。2017 年世界胃肠病杂志;23:3589–606.交叉参考external icon PubMed的external icon
125.Ciccullo A、Gagliardini R、Baldin G 等人。在年轻成年男性中暴发急性甲型肝炎:意大利罗马一家大型教学医院的临床特征和 HIV 合并感染率。艾滋病毒医学 2018;19:369–75.交叉参考external icon PubMed的external icon
126.Comelli A, Izzo I, Casari S, Spinetti A, Bergamasco A, Castelli F. 2016 年 7 月至 2017 年 7 月在布雷西亚(意大利北部)男男性行为者 (MSM) 中爆发的甲型肝炎疫情。Infez Med 2018 年;26:46–51.PubMed的external icon
127.Fonquernie L, Meynard JL, Charrois A, Delamare C, Meyohas MC, Frottier J. 感染人类免疫缺陷病毒的患者发生急性甲型肝炎。临床感染 Dis 2001;32:297–9.交叉参考external icon PubMed的external icon
128.Gallego M、Robles M、Palacios R 等人。急性甲型肝炎病毒(HAV)感染对HIV感染者HIV病毒载量的影响以及HIV感染对急性HAV感染的影响。J Int Assoc Physicians AIDS Care (Chic) 2011 年;10:40–2.交叉参考external icon PubMed的external icon
129.Ida S、Tachikawa N、Nakajima A 等人。人类免疫缺陷病毒1型感染对急性甲型肝炎病毒感染的影响。临床感染 Dis 2002;34:379–85.交叉参考external icon PubMed的external icon
130.劳伦斯JC。对感染人类免疫缺陷病毒的个体进行甲型和乙型肝炎免疫接种。美国医学杂志 2005;118(增刊 10A):75S–83S。交叉参考external icon PubMed的external icon
131.Lee YL, Chen GJ, Chen NY, 等.台湾HIV研究小组。与未感染 HIV 的患者相比,人类免疫缺陷病毒 (HIV) 感染患者的急性甲型肝炎病程较轻但持续时间延长:一项多中心观察性研究。2018 年临床感染 Dis;67:1595–602.交叉参考external icon PubMed的external icon
132.Lombardi A、Rossotti R、Moioli MC 等人。艾滋病毒感染和男男性行为者身份对甲型肝炎感染的影响:2017年疫情暴发期间和2009-2016年期间意大利北部两个三级中心的经验。J 病毒性肝炎 2019;26:761–5.交叉参考external icon PubMed的external icon
133.普奥蒂 M, 莫伊奥利 MC, 特拉维 G, 罗索蒂 R.人类免疫缺陷病毒感染患者的肝病负担。Semin Liver Dis 2012 年;32:103–13.交叉参考external icon PubMed的external icon
134.Yotsuyanagi H、Koike K、Yasuda K 等。通过聚合酶链反应确定的成年甲型肝炎患者甲型肝炎病毒的粪便排泄延长。肝病学 1996;24:10–3.交叉参考external icon PubMed的external icon
135.Mena G、García-Basteiro AL、Llupià A 等人。在高效抗逆转录病毒治疗时代,与HIV感染者对甲型肝炎疫苗接种的免疫反应相关的因素。疫苗 2013;31:3668–74.交叉参考external icon PubMed的external icon
136.梅纳 G、维拉赫利乌 A、乌尔比斯通多 L、巴亚斯 JM。[西班牙人类免疫缺陷病毒感染成年患者肝炎疫苗接种的区域建议:基于证据的差异?Med Clin (Barc) 2015 年;145:163–70.交叉参考external icon PubMed的external icon
137.André F, Van Damme P, Safary A, Banatvala J. 灭活甲型肝炎疫苗:免疫原性、有效性、安全性和官方使用建议的审查。2002年专家修订疫苗;1:9–23.交叉参考external icon PubMed的external icon
138.Phung BC, Launay O. HIV-1 感染患者的病毒性肝炎疫苗接种。嗡嗡声 Vaccin Immunother 2012;8:554–9.交叉参考external icon PubMed的external icon
139.Wallace MR、Brandt CJ、Earhart KC 等。灭活甲型肝炎疫苗在HIV感染受试者中的安全性和免疫原性。临床感染 Dis 2004;39:1207–13.交叉参考external icon PubMed的external icon
140.Dlamini SK、Madhi SA、Muloiwa R 等人。南非感染艾滋病毒的青少年和成人疫苗接种指南。南非洲艾滋病毒医学杂志 2018;19:8。交叉参考external icon
141.Kemper CA、Haubrich R、Frank I 等人加州协作治疗小组。甲型肝炎疫苗在人类免疫缺陷病毒感染患者中的安全性和免疫原性:一项双盲、随机、安慰剂对照试验。J 感染 Dis 2003;187:1327–31.交叉参考external icon PubMed的external icon
142.新泽西州夏尔,谢尔曼 KE。HIV感染者接种甲型肝炎和乙型肝炎疫苗。Curr Hepat 代表 2006;5:63–7.交叉参考external icon
143.Crum-Cianflone NF, Wallace MR. HIV感染成人的疫苗接种。艾滋病患者护理 STDS 2014;28:397–410.交叉参考external icon PubMed的external icon
144.Van Damme P、Banatvala J、Fay O 等人,甲型肝炎病毒免疫国际共识小组。甲型肝炎加强疫苗接种:有需要吗?柳叶刀 2003;362:1065–71.交叉参考external icon PubMed的external icon
145.Crum-Cianflone NF、Wilkins K、Lee AW 等人传染病临床研究计划 HIV 工作组。HIV感染成人接种甲型肝炎疫苗后免疫反应的长期持久性。J 感染 Dis 2011;203:1815–23.交叉参考external icon PubMed的external icon
146.Huang SH, Huang CH, Wang NC, 等.台湾HIV研究小组。人类免疫缺陷病毒阳性患者接种 2 剂甲型肝炎疫苗后的早期血清反转:发生率和相关因素。肝病学 2019;70:465–75.交叉参考external icon PubMed的external icon
147.Armstrong KE, Bush HM, Collins JD, Feola DJ, Caldwell GC, Thornton AC. CD4计数在HIV感染者接种甲型和乙型肝炎疫苗后免疫发展中的作用:肯塔基州,2002-2007年。J Int Assoc Physicians AIDS Care (Chic) 2010 年;9:179–86.交叉参考external icon PubMed的external icon
148.库克斯利工作组。我们从上海甲肝疫情中学到了什么?J 病毒性肝炎 2000;7(增刊1):1-3。交叉参考external icon PubMed的external icon
149.Lefilliatre P, 维伦纽夫 JP.慢性肝病患者的暴发性甲型肝炎。Can J 公共卫生 2000;91:168–70.交叉参考external icon PubMed的external icon
150.Pramoolsinsap C.在泰国乙型肝炎病毒(HBV)携带者和HBV或丙型肝炎病毒相关慢性肝病中对甲型肝炎病毒的急性甲型肝炎和获得性免疫。J 病毒性肝炎 2000;7(增刊1):11-2。交叉参考external icon PubMed的external icon
151.赖斯 G,基夫 EB。慢性肝病患者的肝炎疫苗接种。Aliment Pharmacol Ther 2004 年;19:715–27.交叉参考external icon PubMed的external icon
152.Vento S. 慢性丙型肝炎患者与甲型肝炎病毒重叠感染相关的暴发性肝炎。 J 病毒性肝炎 2000;7(增刊1):7-8。交叉参考external icon PubMed的external icon
153.Collier MG, Tong X, Xu F. 2002-2011 年美国甲型肝炎住院情况。肝病学 2015;61:481–5.交叉参考external icon PubMed的external icon
154.Szmuness W、Purcell RH、Dienstag JL、Stevens CE。机构化智障患者的甲型肝炎抗原抗体。美国医学会杂志 1977;237:1702–5.交叉参考external icon PubMed的external icon
155.Bohm SR、Berger KW、Hackert PB 等人,集体住宅中发育障碍成年人的甲型肝炎爆发——密歇根州,2013 年。MMWR Morb Mortal Wkly Rep 2015 年;64:148–52.PubMed的external icon
156.Lim HS, Choi K, Lee S. 残疾人住宅设施甲型肝炎爆发的流行病学调查,2011 年。J Prev Med 公共卫生 2013;46:62–73.交叉参考external icon PubMed的external icon
157.Knopf-Amelung S. 监禁和无家可归:风险的旋转门。聚焦:2013 年无家可归者国家医疗保健委员会季度研究回顾;2:5。https://nhchc.org/wp-content/uploads/2019/08/infocus_incarceration_nov2013.pdfexternal icon
158.穆莫拉 CJ,卡伯格 JC。2004年,州和联邦囚犯的吸毒和依赖。华盛顿特区:美国司法部、司法计划办公室、司法统计局;2006.
159.斯基德莫尔 S、帕里合资公司、诺塔奇 P.调查在引入社区暴发病例后监狱人群中爆发甲型肝炎病毒的潜在风险。2001年公共卫生社区;4:133–5.PubMed的external icon
160.Whiteman D, McCall B, Falconer A. 澳大利亚昆士兰州监狱入狱者甲型肝炎病毒暴露的患病率和决定因素:对公共卫生控制的影响。J 病毒性肝病 1998;5:277–83.交叉参考external icon PubMed的external icon
161.Gilbert RL, O’Connor T, Mathew S, Allen K, Piper M, Gill ON. 甲型肝炎疫苗接种——基于监狱的社区爆发解决方案?2004年公共卫生社区;7:289–93.PubMed的external icon
162.Safran R. 华盛顿州立监狱的甲型/乙型肝炎预防。J Investig Med 2010 年;58:242–3.
163.Costumbrado J、Stirland A、Cox G 等人。2007-2010 年,洛杉矶县监狱在高危囚犯中加速实施甲型/乙型肝炎疫苗接种计划。疫苗 2012;30:6878–82.交叉参考external icon PubMed的external icon
164.塔博尔 E.血浆衍生物病毒传播的流行病学:临床研究证实乙型肝炎和丙型肝炎病毒以及 1 型 HIV 没有传播。输血 1999;39:1160–8.交叉参考external icon PubMed的external icon
165.Mannucci PM、Gdovin S、Gringeri A 等人。意大利合作小组。甲型肝炎通过用有机溶剂和洗涤剂处理以灭活病毒的因子VIII浓缩物传播给血友病患者。Ann Intern Med 1994 年;120:1–7.交叉参考external icon PubMed的external icon
166.美国食品和药物管理局。血浆衍生物病毒清除过程检查指南。马里兰州银泉市:美国食品和药物管理局;2008.https://ntrl.ntis.gov/NTRL/dashboard/searchResults/titleDetail/PB98137144.xhtmlexternal icon
167.Gröner A. 血浆衍生产物的病原体安全性 – 血红素 P/腐殖质-P。血友病 2008;14(增刊5):54–71。交叉参考external icon PubMed的external icon
168.Klamroth R、Gröner A、Simon TL。血浆来源的凝血因子浓缩物的病原体灭活和去除方法。输血 2014;54:1406–17.交叉参考external icon PubMed的external icon
169.CDC. 2016 – 与冷冻草莓有关的甲型肝炎多州爆发(最终更新)。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2016. https://www.cdc.gov/hepatitis/outbreaks/2016/hav-strawberries.htm
170.Ridpath A、Reddy V、Layton M 等人,食品处理人员中的甲型肝炎病例:当地卫生部门的回应——纽约市,2013 年。J 公共卫生管理实践 2017;23:571–6.交叉参考external icon PubMed的external icon
171.Sharapov UM, Kentenyants K, Groeger J, Roberts H, Holmberg SD, Collier MG. 1993-2011 年美国食品处理人员的甲型肝炎感染情况。公共卫生代表 2016;131:26–9.交叉参考external icon PubMed的external icon
172.莫雷 RJ、科利尔 MG、尼尔森 NP。2012-2014年食品处理人员对甲型肝炎病例的公共卫生应对的经济负担。公共卫生代表 2017;132:443–7.交叉参考external icon PubMed的external icon
173.Hofmeister MG、Foster MA、Montgomery MP、Gupta N. 现场笔记:评估食品处理人员在甲型肝炎病毒传播中的作用——多个州,2016-2019 年。MMWR Morb Mortal Wkly Rep 2020;69:636–7.交叉参考external icon PubMed的external icon
174.哈德勒 SC、埃尔本 JJ、弗朗西斯 DP、韦伯斯特 HM、梅纳德 JE。日托中心甲型肝炎的危险因素。J 感染 Dis 1982;145:255–61.交叉参考external icon PubMed的external icon
175.Kuhar DT、Carrico RM、Cox K 等人。医护人员感染控制:职业感染预防和控制服务的基础设施和常规做法。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2019.https://www.cdc.gov/infectioncontrol/pdf/guidelines/infection-control-HCP-H.pdf
176.克莱因 BS、迈克尔斯 JA、Rytel MW、伯格 KG、戴维斯 JP。院内甲型肝炎。威斯康星州的多苗圃疫情。美国医学会杂志 1984;252:2716–21.交叉参考external icon PubMed的external icon
177.Noble RC,Kane MA,Reeves SA,Roeckel I.新生儿重症监护病房输血后甲型肝炎。美国医学会杂志 1984;252:2711–5.交叉参考external icon PubMed的external icon
178.Doebbeling BN, Li N, Wenzel RP.卫生保健工作者中甲型肝炎暴发:传播的危险因素。Am J 公共卫生 1993;83:1679–84.交叉参考external icon PubMed的external icon
179.古德曼RA。院内甲型肝炎,Ann Intern Med,1985 年;103:452–4.交叉参考external icon PubMed的external icon
180.Papaevangelou GJ, Roumeliotou-Karayannis AJ, Contoyannis PC.在没有隔离预防措施的情况下接受治疗的患者感染医院甲型肝炎和乙型肝炎病毒的风险。J Med Virol 1981 年;7:143–8.交叉参考external icon PubMed的external icon
181.西格尔 JD、莱茵哈特 E、杰克逊 M、基亚雷洛 L;卫生保健感染控制实践咨询委员会。2007 年隔离预防措施指南:在医疗环境中防止传染性病原体传播。2007 年 Am J 感染控制;35(增刊2):S65–164。交叉参考external icon PubMed的external icon
182.Glas C, Hotz P, Steffen R. 暴露于污水的工人的甲型肝炎:系统评价。占领环境,地中海,2001 年;58:762–8.交叉参考external icon PubMed的external icon
183.Lerman Y, Chodik G, Aloni H, Ribak J, Ashkenazi S. 甲型肝炎风险增加的职业:一项为期 2 年的全国性历史前瞻性研究。Am J 流行病学 1999;150:312–20.交叉参考external icon PubMed的external icon
184.普尔 CJ,莎士比亚 AT。污水处理工人和学习障碍人士的护理人员是否应该接种甲型肝炎疫苗?英国医学杂志 1993;306:1102。交叉参考external icon PubMed的external icon
185.Trout D, Mueller C, Venczel L, Krake A. 废水处理工人中甲型肝炎病毒职业传播的评估。J 占领环境医学 2000;42:83–7.交叉参考external icon PubMed的external icon
186.Venczel L, Brown S, Frumkin H, Simmonds-Diaz J, Deitchman S, Bell BP. 佐治亚州污水处理工人中甲型肝炎病毒感染的患病率。美国医学杂志 2003;43:172–8.交叉参考external icon PubMed的external icon
187.韦尔登 M、范埃格多姆 MJ、亨德里克斯 KA、雷格纳 G、贝尔 BP、塞胡斯特 LM。1996 年至 1997 年德克萨斯州饮用水工人和废水处理工人中甲型肝炎病毒抗体的流行情况。J 占领环境医学 2000;42:821–6.交叉参考external icon PubMed的external icon
188.疾病预防控制中心(CDC)针对因灾害而流离失所的个人的临时免疫建议。佐治亚州亚特兰大:美国卫生与公众服务部,疾病预防控制中心。https://www.cdc.gov/disasters/disease/vaccrecdisplaced.html
189.Bloch AB、Stramer SL、Smith JD 等。从导致甲型肝炎共同来源暴发的供水中回收甲型肝炎病毒。 Am J 公共卫生杂志 1990;80:428–30.交叉参考external icon PubMed的external icon
190.Bowen GS,麦卡锡马萨诸塞州。1980年,宾夕法尼亚州兰开斯特县的五金店饮水机和一口受污染的水井引起的甲型肝炎。Am J 流行病学 1983;117:695–705.PubMed的external icon
191.Bergeisen GH、Hinds MW、Skaggs JW。肯塔基州米德县的甲型肝炎水源性疫情。美国公共卫生杂志 1985;75:161–410.2105/ajph.75.2.161external icon
.PubMed的external icon
192.马奥尼 FJ、法利 TA、凯尔索 KY、威尔逊 SA、霍兰 JM、麦克法兰 LM。与在公共游泳池游泳有关的甲型肝炎暴发。J 感染 Dis 1992;165:613–8.交叉参考external icon PubMed的external icon
193.De Serres G、Cromeans TL、Levesque B 等人。井水中甲型肝炎病毒的分子确认:流行病学和公共卫生影响。J Infect Dis 1999 年;179:37–43.交叉参考external icon PubMed的external icon
194.Friedman LS、O’Brien TF、Morse LJ 等人。通过血清学分析重新审视圣十字足球队肝炎爆发(1969 年)。美国医学会杂志 1985;254:774–6.交叉参考external icon PubMed的external icon
195.Bell BP、Shapiro CN、Alter MJ 等。美国甲型肝炎流行病学的多样化模式——对疫苗接种策略的影响。J 感染 Dis 1998;178:1579–84.交叉参考external icon PubMed的external icon
196.Shaw FE Jr、Sudman JH、Smith SM 等人。俄亥俄州甲型肝炎的社区流行。Am J 流行病学 1986;123:1057–65.交叉参考external icon PubMed的external icon
197.Dentinger CM、Bower WA、Nainan OV 等。与大葱有关的甲型肝炎爆发。J 感染 Dis 2001;183:1273–6.交叉参考external icon PubMed的external icon
198.罗森布鲁姆 LS、米尔金 IR、艾伦 DT、萨福德 S、哈德勒 SC。甲型肝炎的多灶性暴发可追溯到商业分销的生菜。美国公共卫生杂志 1990;80:1075–9.交叉参考external icon PubMed的external icon
199.2003年,宾夕法尼亚州莫纳卡市一家餐馆的甲型肝炎疫情与大葱有关。MMWR Morb Mortal Wkly Rep 2003 年;52:1155–7.PubMed的external icon
200.Wheeler C、Vogt TM、Armstrong GL 等。与大葱有关的甲型肝炎爆发。N Engl J Med 2005;353:890–7.交叉参考external icon PubMed的external icon
201.德森克洛斯 JC、克朗茨 KC、怀尔德 MH、奈南 OV、马戈利斯 HS、冈恩 RA。由食用生牡蛎引起的多州甲型肝炎疫情。美国公共卫生杂志 1991;81:1268–72.交叉参考external icon PubMed的external icon
202.美国食品和药物管理局。获准在美国使用的疫苗。马里兰州银泉市:美国食品和药物管理局。https://www.fda.gov/vaccines-blood-biologics/vaccines/vaccines-licensed-use-united-statesexternal icon
203.Armstrong ME、Giesa PA、Davide JP 等。从减毒活病毒株CR326F中开发福尔马林灭活甲型肝炎疫苗VAQTA。J Hepatol 1993 年;18(增刊2):S20–6。交叉参考external icon PubMedexternal icon
204.Peetermans J. Production, quality control and characterization of an inactivated hepatitis A vaccine. Vaccine 1992;10(Suppl 1):S99–101. CrossRefexternal icon PubMedexternal icon
205.Ezeanolue E, Harriman K, Hunter P, Kroger A, Pellegrini C. 免疫的一般最佳实践指南:免疫实践咨询委员会(ACIP)的最佳做法指南。佐治亚州亚特兰大:美国卫生与公众服务部,CDC;2018. https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/index.html
206.拉格尼 MV、卢舍尔 JM、科珀 MA、曼科-约翰逊 M、克劳斯 DS。皮下注射甲型肝炎疫苗在儿童血友病中的安全性和免疫原性。血友病 2000;6:98–103.交叉参考external icon PubMed的external icon
207.Linglöf T、van Hattum J、Kaplan KM 等。成人皮下注射甲型灭活疫苗 (VAQTA) 的开放研究:安全性、耐受性和免疫原性。疫苗 2001;19:3968–71.交叉参考external icon PubMed的external icon
208.Czeschinski PA, Binding N, Witting U. 甲型肝炎和乙型肝炎疫苗接种:联合疫苗和同时或单独应用的单一疫苗的免疫原性。疫苗 2000;18:1074–80.交叉参考external icon PubMed的external icon
209.Knöll A, Hottenträger B, Kainz J, Bretschneider B, Jilg W. 甲型肝炎和乙型肝炎联合疫苗在健康年轻人中的免疫原性。疫苗 2000;18:2029–32.交叉参考external icon PubMed的external icon
210.普洛特金SA。疫苗接种诱导的保护相关性。临床疫苗免疫 2010;17:1055–65.交叉参考external icon PubMed的external icon
211.Nalin D、Brown L、Kuter B 等人。儿童灭活甲型肝炎疫苗:对疾病控制的影响。疫苗 1993;11(增刊1):S15–7。交叉参考external icon PubMed的external icon
212.免疫血清球蛋白和免疫血清球蛋白人类受体血清中的甲型肝炎病毒中和抗体。胃肠病学 1985;89:637–42.交叉参考external icon PubMed的external icon
213.Winokur PL, Stapleton JT. 甲型肝炎的免疫球蛋白预防 Clin Infect Dis 1992;14:580–6.交叉参考external icon PubMed的external icon
214.评估对灭活甲型肝炎疫苗反应的免疫学方法。J Hepatol 1993 年;18(增刊2):S15–9。交叉参考external icon PubMed的external icon
215.克莱门斯 R、萨法里 A、赫本 A、罗氏 C、斯坦伯里 WJ、安德烈 FE。灭活甲型肝炎疫苗的临床经验。J Infect Dis 1995 年;171(增刊1):S44–9。交叉参考external icon PubMed的external icon
216.Shouval D、Ashur Y、Adler R 等人。对灭活甲型肝炎病毒疫苗的单剂量和加强剂量反应:与免疫血清球蛋白预防的比较。疫苗 1993;11(增刊1):S9–14。交叉参考external icon PubMed的external icon
217.基立福。用 GamaSTAN(免疫球蛋白 [人])治疗。加利福尼亚州洛杉矶:基立福,2019 年。https://www.hypermunes.com/en/hcp/gamastan-hepatitis-aexternal icon
218.尼尔森NP。更新了用于预防甲型肝炎病毒的免疫球蛋白(人)GamaSTAN S/D 的接种说明。MMWR Morb Mortal Wkly Rep 2017 年;66:959–60.交叉参考external icon PubMed的external icon
219.特哈达-斯特罗普 A、科斯塔弗雷达 MI、迪米特洛娃 Z、卡普兰 GG、特奥 CG。免疫球蛋白产品对甲型肝炎的效力评估。 JAMA Intern Med 2017;177:430–2.交叉参考external icon PubMed的external icon
220.Bell BP、Negus S、Fiore AE 等。灭活甲型肝炎疫苗在婴幼儿中的免疫原性。儿科感染杂志 2007;26:116–22.交叉参考external icon PubMed的external icon
221.Dagan R、Amir J、Mijalovsky A 等人。在出生后第一年接种甲型肝炎疫苗:尽管存在母体抗体,但仍启动。儿科感染杂志 2000;19:1045–52.交叉参考external icon PubMed的external icon
222.莱特森 GW,马戈利斯 HS。婴儿接种甲型肝炎疫苗:解决长期存在的公共卫生问题的最终解决方案。Curr Pediatr 修订版 2007;3:11–9.交叉参考external icon
223.Lieberman J、Marcy S、Partridge S、Ward J,编辑。婴儿甲型肝炎疫苗:母体抗体对抗体反应的影响[程序和摘要]。在第 36 届美国传染病学会年会上发表。弗吉尼亚州亚历山大市:美国传染病学会;1998.
224.Piazza M、Safary A、Vegnente A 等人。婴儿甲型肝炎疫苗的安全性和免疫原性:纳入儿童疫苗接种计划的候选者。疫苗 1999;17:585–8.交叉参考external icon PubMed的external icon
225.Sharapov UM、Bulkow LR、Negus SE 等。甲型肝炎疫苗诱导的婴幼儿血清阳性的持续性(按母体抗体状态划分):10 年随访。肝病学 2012;56:516–22.交叉参考external icon PubMed的external icon
226.Troisi CL、Hollinger FB、Krause DS、Pickering LK。血清阴性婴儿接种甲型肝炎疫苗(HAVRIX;SKB):两种接种方案的比较研究。疫苗 1997;15:1613–7.交叉参考external icon PubMed的external icon
227.巴尔卡雷克 KB、巴格利 MR、帕斯 RF、希夫 ER、克劳斯 DS。灭活甲型肝炎疫苗在学龄前儿童中的安全性和免疫原性。J Infect Dis 1995 年;171(增刊1):S70–2。交叉参考external icon PubMed的external icon
228.Horng YC, Chang MH, Lee CY, Safary A, Andre FE, Chen DS.甲型肝炎疫苗在健康儿童中的安全性和免疫原性。Pediatr Infect Dis J 1993 年;12:359–62.交叉参考external icon PubMed的external icon
229.McMahon BJ、Williams J、Bulkow L 等人。灭活甲型肝炎疫苗在阿拉斯加原住民儿童以及原住民和非原住民成年人中的免疫原性。J Infect Dis 1995 年;171:676–9.交叉参考external icon PubMed的external icon
230.Nalin D. VAQTA:™甲型肝炎疫苗,纯化灭活。1995年《药物未来》;20:24–9.交叉参考external icon
231.Van Herck K, Van Damme P. Havrix 预防甲型肝炎:综述。2005 年专家修订疫苗;4:459–71.交叉参考external icon PubMed的external icon
232.Ashur Y, Adler R, Rowe M, Shouval D. 两种甲型肝炎疫苗(VAQTA 和 HAVRIX)在年轻人中的免疫原性比较。疫苗 1999;17:2290–6.交叉参考external icon PubMed的external icon
233.Findor JA, Cañero Velasco MC, Mutti J, Safary A. 6 个月后单剂加强接种后儿童对甲型肝炎疫苗的反应。J Travel Med 1996 年;3:156–9.交叉参考external icon PubMed的external icon
234.Van Der Meeren O, Crasta P, de Ridder M.一项回顾性汇总分析,评估年龄对健康成人 Havrix™ 免疫原性的影响。嗡嗡声 Vaccin Immunother 2015;11:1729–34.交叉参考external icon PubMed的external icon
235.Briem H, Safary A. 甲型肝炎病毒疫苗成人的免疫原性和安全性,在 6 个月后作为单剂量和加强剂接种。J Med Virol 1994 年;44:443–5.交叉参考external icon PubMed的external icon
236.Innis BL、Snitbhan R、Kunasol P 等人。灭活疫苗预防甲型肝炎。美国医学会杂志 1994;271:1328–34.交叉参考external icon PubMed的external icon
237.Werzberger A、Mensch B、Kuter B 等人。福尔马林灭活甲型肝炎疫苗在健康儿童中的对照试验。N Engl J Med 1992 年;327:453–7.交叉参考external icon PubMed的external icon
238.Spradling PR、Bulkow LR、Negus SE、Homan C、Bruce MG、McMahon BJ。婴儿期接种甲型肝炎疫苗的人血清阳性的持续性(按母体抗体状态划分):15 年随访。肝病学 2016;63:703–11.交叉参考external icon PubMed的external icon
239.Plumb ID、Bulkow LR、Bruce MG 等。在阿拉斯加接种甲型肝炎疫苗 20 年后甲型肝炎病毒抗体的持续存在。J 病毒性肝炎 2017;24:608–12.交叉参考external icon PubMed的external icon
240.Mosites E, Gounder P, Snowball M, et al. 甲型肝炎疫苗免疫反应 接种疫苗 22 年后。J Med Virol 2018 年;90:1418–22.交叉参考external icon PubMed的external icon
241.Raczniak GA、Thomas TK、Bulkow LR 等人。与儿童三剂疫苗计划相比,当前两剂疫苗对甲型肝炎的保护持续时间。疫苗 2013;31:2152–5.交叉参考external icon PubMed的external icon
242.Hens N, Habteab Ghebretinsae A, Hardt K, Van Damme P, Van Herck K. 基于模型的成人灭活甲型肝炎疫苗诱导抗体长期持续存在的估计。疫苗 2014;32:1507–13.交叉参考external icon PubMed的external icon
243.Theeten H, Van Herck K, Van Der Meeren O, Crasta P, Van Damme P, Hens N. 接种 2 剂 Havrix(灭活甲型肝炎疫苗)后的长期抗体持久性:20 年的观察数据和基于模型的长期预测。疫苗 2015;33:5723–7.交叉参考external icon PubMed的external icon
244.在甲型肝炎疫苗建议的背景下单剂量接种灭活甲型肝炎疫苗。Int J Infect Dis 2013年;17:e939-44。交叉参考external icon PubMed的external icon
245.Melgaço JG、Morgado LN、Santiago MA 等。单剂灭活甲型肝炎疫苗可促进甲型肝炎特异性记忆细胞反应,类似于自然感染诱导的记忆细胞反应。疫苗 2015;33:3813–20.交叉参考external icon PubMed的external icon
246.麦克马洪 BJ、贝勒 M、威廉姆斯 J、施洛斯 M、坦蒂拉 H、布尔科夫 L.一项通过使用灭活甲型肝炎疫苗来控制阿拉斯加甲型肝炎爆发的计划。Arch Pediatr Adolesc Med 1996 年;150:733–9.交叉参考external icon PubMed的external icon
247.Brito WI、Alves-Junior ER、Oliveira RM、Souto FJD。巴西中部单剂甲型肝炎病毒普遍免疫接种的初步评估。Braz J 感染 Dis 2018;22:166–70.交叉参考external icon PubMed的external icon
248.Souto FJD, de Brito WI, Fontes CJF.巴西甲型肝炎单剂普遍大规模疫苗接种策略的影响。疫苗 2019;37:771–5.交叉参考external icon PubMed的external icon
249.Urueña A、González JE、Rearte A 等人。阿根廷一岁儿童单剂通用甲型肝炎免疫接种:接种疫苗后 9 年内保护性抗体的患病率很高。儿科感染杂志 2016;35:1339–42.交叉参考external icon PubMed的external icon
250.Urueña A、González J、Carrega MEP 等人。阿根廷 1 岁婴儿单剂通用甲型肝炎免疫接种:接种疫苗后 11 年内保护性抗体的患病率很高。2017 年 Infect Dis 公开论坛;4(增刊1):S320。交叉参考external icon
251.Letson GW、Shapiro CN、Kuehn D 等人。母体抗体对婴儿甲型肝炎疫苗免疫原性的影响。J Pediatr 2004 年;144:327–32.交叉参考external icon PubMed的external icon
252.Fiore AE, Shapiro CN, Sabin K, et al. 婴儿甲型肝炎疫苗接种:母体抗体状态对抗体持久性和对加强剂量反应的影响。儿科感染杂志 2003;22:354–9.交叉参考external icon PubMed的external icon
253.Kanra G, Yalcin SS, Kara A, Ozmert E, Yurdakök K. 婴儿免疫接种后儿童甲型肝炎加强疫苗。Pediatr Infect Dis J 2002 年;21:727–30.交叉参考external icon PubMed的external icon
254.Lieberman JM、Chang SJ、Partridge S 等。婴儿母体甲型肝炎抗体衰变的动力学:对疫苗使用的影响。Pediatr Infect Dis J 2002 年;21:347–8.交叉参考external icon PubMed的external icon
255.Wagner G、Lavanchy D、Darioli R 等人。在旅行者人群中同时进行针对甲型肝炎的主动和被动免疫接种。疫苗 1993;11:1027–32.交叉参考external icon PubMed的external icon
256.Walter EB、Hornick RB、波兰 GA 等。在健康成人中同时接种带有免疫球蛋白的灭活甲型肝炎疫苗。疫苗 1999;17:1468–73.交叉参考external icon PubMed的external icon
257.Fritzsche C, Bergmann L, Loebermann M, Glass A, Reisinger EC. HIV患者对甲型肝炎疫苗的免疫反应。疫苗 2019;37:2278–83.交叉参考external icon PubMed的external icon
258.Garcia Garrido HM, Wieten RW, Grobusch MP, Goorhuis A. 免疫功能低下旅行者对甲型肝炎疫苗接种的反应。J 感染 Dis 2015;212:378–85.交叉参考external icon PubMed的external icon
259.加西亚·加里多 HM、Veurink AM、Leeflang M、Spijker R、Goorhuis A、Grobusch MP。使用免疫抑制药物的患者的甲型肝炎疫苗免疫原性:系统评价和荟萃分析。2019 年 Travel Med 感染 Dis;32:101479
。交叉参考external icon PubMed的external icon
260.梅纳 G、加西亚-巴斯泰罗 AL、巴亚斯 JM。HIV感染成人的乙型肝炎和甲型肝炎疫苗接种综述。嗡嗡声 Vaccin Immunother 2015;11:2582–98.交叉参考external icon PubMed的external icon
261.Weinberg A、Gona P、Nachman SA 等人。儿科艾滋病临床试验组 1008 团队。HIV 感染儿童在接受高效抗逆转录病毒治疗时具有免疫重建证据的 HIV 感染儿童对甲型肝炎病毒疫苗的抗体反应。J 感染 Dis 2006;193:302–11.交叉参考external icon PubMed的external icon
262.Neilsen GA, Bodsworth NJ, Watts N. 对人类免疫缺陷病毒感染和未感染的同性恋男性接种甲型肝炎疫苗的反应。J 感染 Dis 1997;176:1064–7.交叉参考external icon PubMed的external icon
263.Rimland D,嘉宾 JL。HAART时代HIV患者对甲型肝炎疫苗的反应。艾滋病 2005;19:1702–4.交叉参考external icon PubMed的external icon
264.Gouvea AF、De Moraes-Pinto MI、Ono E 等人。甲型肝炎疫苗在HIV感染儿童中的免疫原性和耐受性。临床感染 Dis 2005;41:544–8.交叉参考external icon PubMed的external icon
265.Arslan M, Wiesner RH, Poterucha JJ, Zein NN. 肝移植受者接种甲型肝炎疫苗的安全性和有效性。移植 2001;72:272–6.交叉参考external icon PubMed的external icon
266.Dumot JA、Barnes DS、Younossi Z 等人。甲型肝炎疫苗在失代偿性肝病中的免疫原性。Am J 胃肠病学 1999;94:1601–4.交叉参考external icon PubMed的external icon
267.Ferreira CT, da Silveira TR, Vieira SM, Taniguchi A, Pereira-Lima J. 甲型肝炎疫苗在慢性肝病儿童中的免疫原性和安全性。J Pediatr 胃肠素营养学 2003;37:258–61.交叉参考external icon PubMed的external icon
268.Keeffe EB、Iwarson S、McMahon BJ 等。甲型肝炎疫苗在慢性肝病患者中的安全性和免疫原性。肝病学 1998;27:881–6.交叉参考external icon PubMed的external icon
269.Lee SD, Chan CY, Yu MI, et al.灭活甲型肝炎疫苗在慢性肝病患者中的安全性和免疫原性。J Med Virol 1997 年;52:215–8.交叉参考external icon PubMed的external icon
270.Majda-Stanislawska E, Bednarek M, Kuydowicz J. 灭活甲型肝炎疫苗在慢性肝病儿童中的免疫原性。儿科感染杂志 2004;23:571–4.交叉参考external icon PubMed的external icon
271.Stark K、Günther M、Neuhaus R 等人。甲型肝炎疫苗在肝和肾移植受者的免疫原性和安全性。J Infect Dis 1999 年;180:2014–7.交叉参考external icon PubMed的external icon
272.Günther M, Stark K, Neuhaus R, Reinke P, Schröder K, Bienzle U. 肝炎和肾移植受者甲型肝炎免疫接种后抗体的快速下降。移植 2001;71:477–9.交叉参考external icon PubMed的external icon
273.Reuman PD、Kubilis P、Hurni W、Brown L、Nalin D.年龄和体重对健康成人对福尔马林灭活、明矾佐剂甲型肝炎疫苗反应的影响。疫苗 1997;15:1157–61.交叉参考external icon PubMed的external icon
274.Tong MJ, Co RL, Bellak C. 甲型肝炎疫苗接种。西医学杂志 1993;158:602–5.PubMed的external icon
275.Link-Gelles R、Hofmeister MG、Nelson NP。使用甲型肝炎疫苗预防 40 岁以上人群暴露后预防:对已发表研究和疫苗使用建议的系统评价。疫苗 2018;36:2745–50.交叉参考external icon PubMed的external icon
276.不良经历的上市后报告。21 CFR 第 600.80 节 (2010)。https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=600.80external icon
277.Moro PL, Museru OI, Niu M, Lewis P, Broder K. 孕妇接种甲型肝炎和乙型肝炎疫苗后向疫苗不良事件报告系统报告。Am J Obstet Gynecol 2014 年;210:561:E1-6。
278.Groom HC、Smith N、Irving SA 等。怀孕期间甲型肝炎疫苗接种的吸收和安全性:疫苗安全数据链研究。疫苗 2019;37:6648–55.交叉参考external icon PubMed的external icon
279.Bienzle U, Bock HL, Kruppenbacher JP, Hofmann F, Vogel GE, Clemens R. 根据两种不同的时间表接种的灭活甲型肝炎疫苗的免疫原性以及其他“旅行者”疫苗对免疫反应的干扰。疫苗 1996;14:501–5.交叉参考external icon PubMed的external icon
280.Gil A, González A, Dal-Ré R, Calero JR. 黄热病疫苗对单剂灭活甲型肝炎疫苗免疫反应的干扰评估 (1440 EL.U.)。一项针对成人的对照研究。疫苗 1996;14:1028–30.交叉参考external icon PubMed的external icon
281.Jong EC、Kaplan KM、Eves KA、Taddeo CA、Lakkis HD、Kuter BJ。一项与伤寒和黄热病疫苗同时接种的灭活甲型肝炎疫苗的开放随机研究。J Travel Med 2002 年;9:66–70.交叉参考external icon PubMed的external icon
282.Ambrosch F、André FE、Delem A 等人。同时接种甲型和乙型肝炎疫苗:对照研究的结果。疫苗 1992;10(增刊 1):S142–5。交叉参考external icon PubMed的external icon
283.Joines RW、Blatter M、Abraham B 等人。甲型和乙型肝炎联合疫苗 (Twinrix) 与相应的单价疫苗(Havrix 和 Engerix-B)在成人中的前瞻性、随机、比较美国试验。疫苗 2001;19:4710–9.交叉参考external icon PubMed的external icon
284.Usonis V、Meriste S、Bakasenas V 等人。甲型肝炎和乙型肝炎联合疫苗与麻疹-腮腺炎-风疹或白喉-破伤风-脱细胞百日咳灭活脊髓灰质炎疫苗混合b型流感嗜血杆菌结合疫苗在 12-18 个月婴儿中的免疫原性和安全性。疫苗 2005;23:2602–6.交叉参考external icon PubMed的external icon
285.Petrecz M、Acosta CJ、Klopfer SO 等人。VAQTA® 在 12 至 23 个月大的儿童中的安全性和免疫原性,无论是否接种其他美国儿科疫苗。嗡嗡声 Vaccin Immunother 2019;15:426–32.交叉参考external icon PubMed的external icon
286.Rein DB、Hicks KA、Wirth KE 等。美国常规儿童甲型肝炎疫苗接种的成本效益。儿科 2007;119:E12-21。交叉参考external icon PubMed的external icon
287.雅各布斯 RJ,迈耶霍夫 AS。水痘、甲型肝炎和肺炎球菌结合疫苗的成本效益比较。Prev Med 2001年;33:639–45.交叉参考external icon PubMed的external icon
288.Hankin-Wei A、Rein DB、Hernandez-Romieu A 等。未接种疫苗/部分接种疫苗的儿童补种甲型肝炎疫苗接种的成本效益分析。疫苗 2016;34:4243–9.交叉参考external icon PubMed的external icon
289.Williams WW、Lu PJ、O’Halloran A 等人。成年人群疫苗接种覆盖率监测——美国,2015 年。MMWR 监视总结 2017;66。交叉参考external icon PubMed的external icon
290.麦克莱恩总部、Fiebelkorn AP、Temte JL、Wallace GS。2013年麻疹、风疹、先天性风疹综合征和流行性腮腺炎的预防:免疫实践咨询委员会(ACIP)的摘要建议。MMWR Recomm Rep 2013;62(否。RR-4)。PubMed的external icon
291.巴克斯顿 JA,金 JH。慢性丙型肝炎感染者的甲型肝炎和乙型肝炎疫苗接种反应:证据和当前建议的综述。J 可以感染 Dis Med Microbiol 2008 吗;19:197–202.交叉参考external icon PubMed的external icon
292.艾滋病毒成人和青少年机会性感染小组。成人和青少年HIV感染者机会性感染的预防和治疗指南:美国疾病控制与预防中心、美国国立卫生研究院和美国传染病学会HIV医学协会的建议。华盛顿特区:美国卫生与公众服务部。https://aidsinfo.nih.gov/contentfiles/lvguidelines/adult_oi.pdfexternal icon
293.Tseng YT, Chang SY, Liu WC, 等.两剂与三剂甲型肝炎疫苗对人类免疫缺陷病毒感染和未感染男男性行为者的比较有效性。肝病学 2013;57:1734–41.交叉参考external icon PubMed的external icon
294.Weissman S、Feucht C、Moore BA。HIV阳性患者对甲型肝炎疫苗的反应。J 病毒性肝炎 2006;13:81–6.交叉参考external icon PubMed的external icon
295.Brennan J、Moore K、Sizemore L 等人。现场笔记:先前接种过艾滋病毒感染者的急性甲型肝炎病毒感染——田纳西州,2018 年。MMWR Morb Mortal Wkly Rep 2019;68:328–9.交叉参考external icon PubMed的external icon
296.科夫RS。甲型肝炎,柳叶刀 1998;351:1643–9.交叉参考external icon PubMed的external icon
297.Victor JC、Surdina TY、Suleimeova SZ、Favorov MO、Bell BP、Monto AS。甲型肝炎家庭传播在流行趋势发生变化的地区日益突出。流行病学感染 2006;134:492–7.交叉参考external icon PubMed的external icon
298.Smith D、Huynh C、Moore AJ 等人。群体免疫可能在加利福尼亚州圣地亚哥最近爆发的甲型肝炎疫情中保护了男男性行为者。 临床感染 Dis 2018;25:25。
299.Peak CM、Stous SS、Healy JM 等人。无家可归和甲型肝炎——圣地亚哥县,2016-2018 年。临床感染 Dis 2019;CIZ788。
300.伍顿 DA。被遗忘但未消失:从圣地亚哥的甲型肝炎疫情和公共卫生应对中吸取教训。2019 年顶级 Antivir Med;26:117–21.PubMed的external icon
301.James TL, Aschkenasy M, Eliseo LJ, Olshaker J, Mehta SD. 应对甲型肝炎流行病:急诊科与公共卫生委员会合作。J Emerg Med 2009 年;36:412–6.交叉参考external icon PubMed的external icon
302.Moro PL、Arana J、Marquez PL 等。给一个人接种额外剂量的疫苗有什么害处吗?2007-2017 年向疫苗不良事件报告系统 (VAERS) 报告的过量疫苗剂量。疫苗 2019;37:3730–4.交叉参考external icon PubMed的external icon
303.Iwarson S, Lindh M, Widerström L. 单剂甲型灭活肝炎疫苗后 4 至 8 年具有出色的加强反应。J Travel Med 2004 年;11:120–1.交叉参考external icon PubMed的external icon
304.Williams JL, Bruden DA, Cagle HH, et al. 甲型肝炎疫苗:婴儿、儿童和成人延迟免疫计划后的免疫原性。疫苗 2003;21:3208–11.交叉参考external icon PubMed的external icon
305.Hornick R、Tucker R、Kaplan KM 等人。成人 VAQTA 灵活加强接种方案的随机研究:安全性、耐受性和免疫原性。疫苗 2001;19:4727–31.交叉参考external icon PubMed的external icon
306.Schillie S、Vellozzi C、Reingold A 等人。美国乙型肝炎病毒感染的预防:免疫实践咨询委员会的建议。MMWR Recomm Rep 2018;67(编号。RR-1)。交叉参考external icon PubMed的external icon
307.Bryan JP、Henry CH、Hoffman AG 等。两种灭活甲型肝炎疫苗的随机、交叉、对照比较。疫苗 2000;19:743–50.交叉参考external icon PubMed的external icon
308.Connor BA、Phair J、Sack D 等人。在健康成年人中进行的随机、双盲研究,以评估单剂量 Havrix 后 Vaqta 或 Havrix 的增强效果。临床感染 Dis 2001;32:396–401.交叉参考external icon PubMed的external icon
309.美国食品和药物管理局(FDA)批准了甲型和乙型肝炎联合疫苗(Twinrix®)的替代接种方案。MMWR Morb Mortal Wkly Rep 2007;56:1057。
310.Nothdurft HD、Dietrich M、Zuckerman JN 等。2002年疫苗:新的加速疫苗接种计划,以快速预防甲型肝炎和乙型肝炎;20:1157–62.交叉参考external icon PubMed的external icon
通讯作者:Noele P. Nelson,美国国家艾滋病毒/艾滋病中心病毒性肝炎科,病毒性肝炎,性病和结核病预防,疾病预防控制中心。电话:404-718-8576;电子邮件: nnelson@cdc.gov.
1疾病预防控制中心国家艾滋病毒/艾滋病、病毒性肝炎、性病和结核病预防中心病毒性肝炎科;2田纳西州纳什维尔范德比尔特医学院卫生政策系;3美国疾病预防控制中心国家新发和人畜共患传染病中心医疗质量促进司;4阿肯色州小石城阿肯色大学医科儿科儿科科
关系披露:所有2019年免疫实践咨询委员会肝炎疫苗工作组成员均已填写并提交了国际医学期刊编辑委员会表格,以披露潜在的利益冲突。Kelly L. Moore 博士报告了 Prime, Inc. 和辉瑞公司的个人费用,超出了提交的工作。其余成员与甲型肝炎(HepA)疫苗相关商业产品的制造商或商业服务供应商没有经济或竞争利益。内容将不包括任何关于产品或研究性产品的无标签使用的讨论,但以下情况除外:当建议对 HAV 防护时,对在美国境外旅行的 6-11 个月大的婴儿接种 HepA 疫苗。
建议引用本文:Nelson NP、Weng MK、Hofmeister MG 等。美国甲型肝炎病毒感染的预防:免疫实践咨询委员会的建议,2020 年。MMWR Recomm Rep 2020;69(编号。RR-5):1-38。DOI:http://dx.doi.org/10.15585/mmwr.rr6905a1external icon.
MMWR 和 Morbidity and Mortality Weekly Report 是美国卫生与公众服务部的服务标志。
使用商品名称和商业来源仅用于识别,并不意味着美国国务院的认可 卫生与公众服务。
互联网上对非CDC网站的引用如下 作为一项服务提供给MMWR读者,并不构成或暗示 CDC或美国对这些组织或其计划的认可 卫生与公众服务部。CDC不对内容负责 在这些网站上找到的页面。MMWR 中列出的 URL 地址是截至 出版日期。
MMWR 文章的所有 HTML 版本都是通过自动化过程从最终校样生成的。 此转换可能会导致 HTML 版本中的字符转换或格式错误。 用户可参考电子PDF版本(https://www.cdc.gov/mmwr) 和/或官方文本、数字和表格的可打印版本的原始 MMWR 纸质副本。
有关格式错误的问题或消息应发送给 mmwrq@cdc.gov。
查看页面:PDF格式 [710K]
页面上次审核: 2021年2月25日
内容来源:美国疾病控制与预防中心




