第22章:脑膜炎球菌
2022年5月
脑膜炎球菌性脑膜炎和败血症 须呈报
疾病
脑膜炎球菌病是由脑膜炎奈瑟球菌引起的全身性细菌感染引起的。
脑膜炎球菌是革兰氏阴性双球菌,根据其多糖荚膜分为抗原性不同的荚膜组。目前有12个已确定的荚膜组,A、B、C、E、H、I、K、L、W、X、Y和Z,其中B、C、W和Y组是英国侵袭性疾病的最常见原因。在过去二十年中,脑膜炎球菌疫苗显著降低了脑膜炎球菌病的发病率。
脑膜炎球菌寄居在人类的鼻咽,尤其是青少年和年轻成年人,并且通常是无害的共生体。在婴幼儿中,携带率较低(Christensen et al., 2010)。还不完全清楚为什么疾病在一些个体中发展而在另一些个体中不发展。年龄、季节、吸烟、既往病毒感染和生活在“封闭”或“半封闭”的社区,如大学宿舍或军营,已被确定为疾病的危险因素(Cartwright, 1995; Mandal et al.,2017)。
传播途径是通过气溶胶、飞沫或直接接触带菌者的呼吸道分泌物。传播通常需要频繁或长时间的密切接触。脑膜炎球菌病有明显的季节性变化,冬季月份的高峰水平下降到夏末的低水平。
脑膜炎球菌疾病最常见的表现为脑膜炎和/或败血症。少数情况下,个体可能出现肺炎、心肌炎、心内膜炎、心包炎、关节炎、结膜炎、尿道炎、咽炎和宫颈炎(Rosenstein et al., 2001)。潜伏期为2至7天,发病从轻度前驱症状到具有急性和压倒性特征的暴发性疾病不等。
脑膜炎球菌病在五岁以下儿童中发病率最高,一岁以下儿童的发病率最高。在15-19岁的人群中有一个较小的发病率第二高峰。这种感染在5%-10%的病例中是致命的,幸存者可能会出现严重的长期并发症,包括听力损失、严重的视觉障碍、沟通问题、截肢、癫痫发作和脑损伤。
自1999年以来,脑膜炎球菌疫苗在英国国家免疫规划中的实施已导致所有年龄组的脑膜炎球菌病大幅下降。2020/21年期间的大幅下降是由于与新冠肺炎疫情相关的全国封锁、限制和物理距离措施(图1和图2) (Subbarao 2021)。
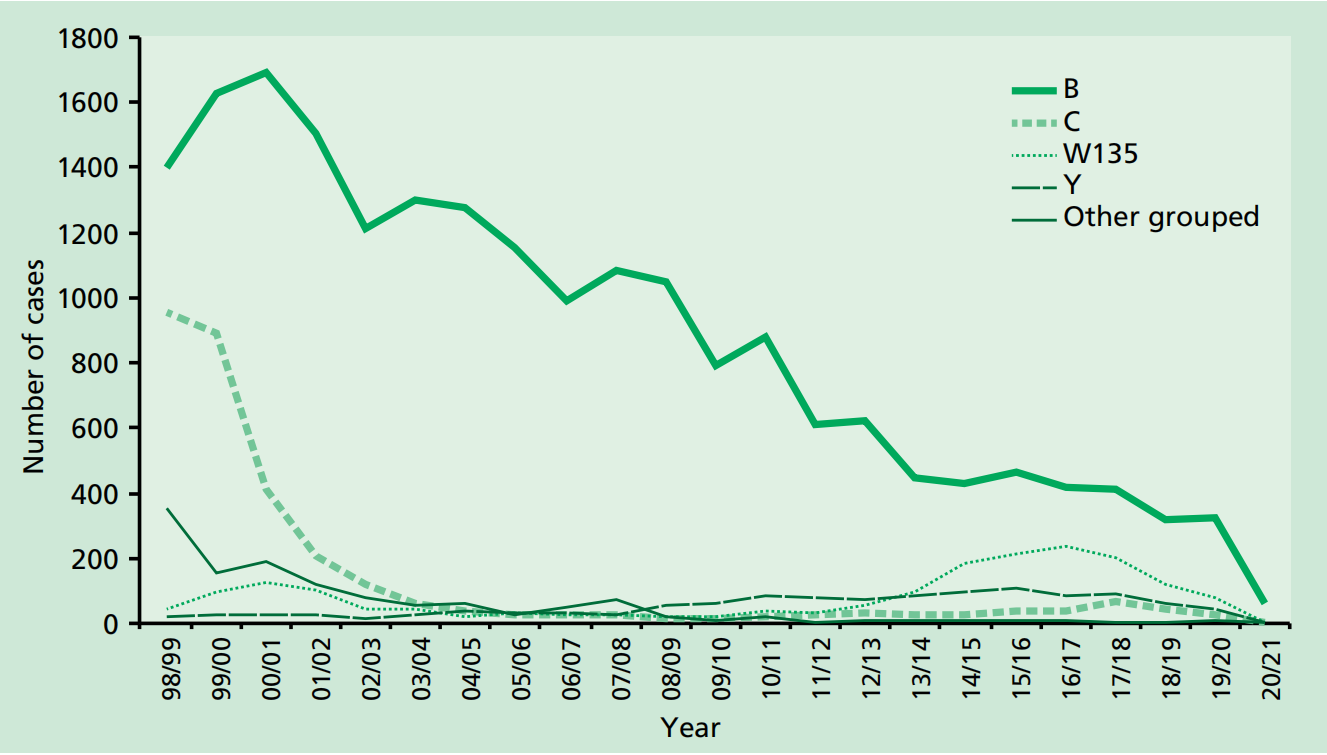
图1.1998-2021年英格兰和威尔士按流行病学年份划分的侵袭性脑膜炎球菌病病例。资料来源:曼彻斯特UKHSA脑膜炎球菌参考单位。
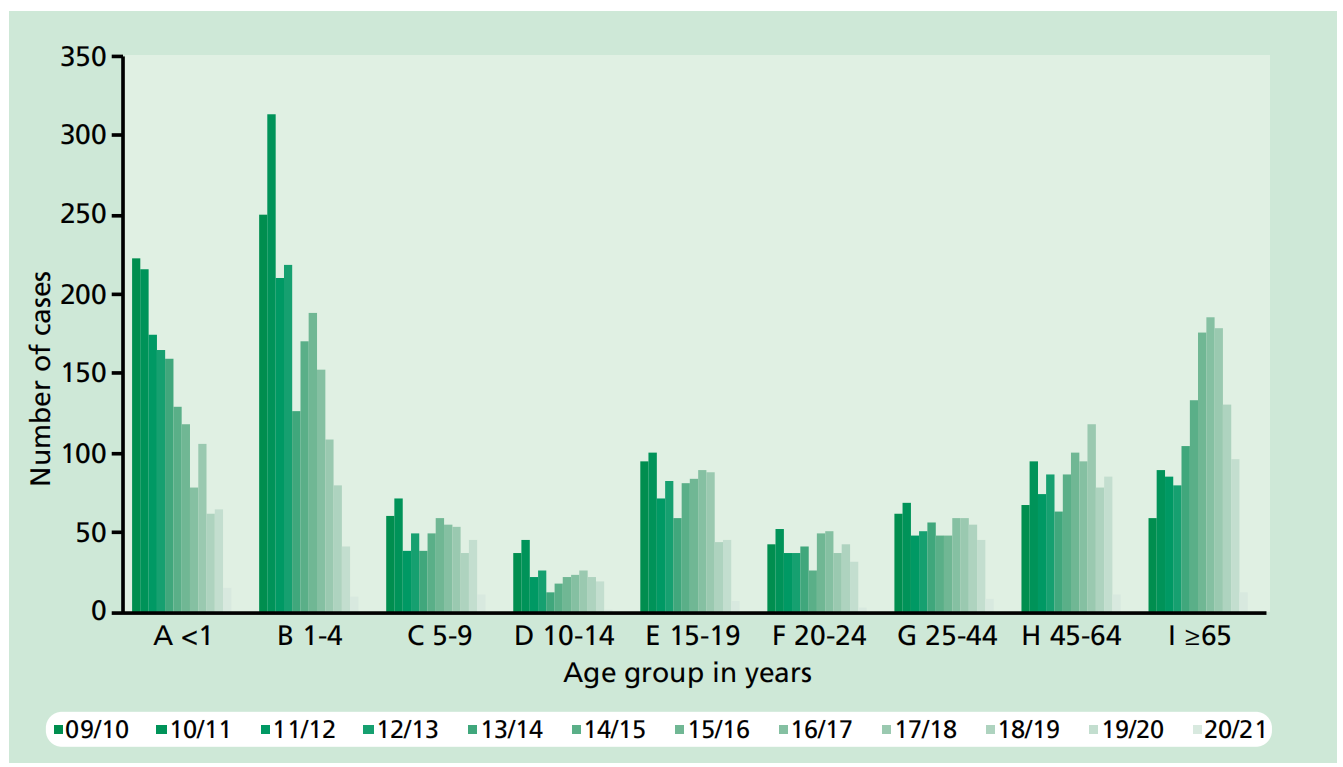
图2. 2010/11年至2020/21年英格兰和威尔士按年龄组和流行病学年份分列的所有侵袭性脑膜炎球菌病病例。资料来源:曼彻斯特UKHSA脑膜炎球菌参考单位
脑膜炎球菌疫苗
表1总结了目前可用的疫苗。所有已获许可的脑膜炎球菌疫苗都不含活生物体,因此不会引起它们所保护的疾病。
表1 脑膜炎球菌疫苗
| 疫苗类型 | 防止 | 许可疫苗 |
| MenC结合疫苗 | C群脑膜炎球菌 | NeisVac-C®和 Menjugate Kit® |
| Hib/MenC结合疫苗 | b型流感嗜血杆菌/C群脑膜炎球菌 | Menitorix® |
| MenACWY四价结合疫苗 | A、C、W和Y群脑膜炎球菌 | Menveo®, Nimenrix® 和MenQuadfi® |
| 多组分蛋白疫苗 (MenB) | B群脑膜炎球菌(可抵御其他荚膜群) | Bexsero® 和 Trumenba® |
脑膜炎球菌结合疫苗
仅基于荚膜多糖的脑膜炎球菌疫苗(通常称为“普通”多糖疫苗)仅向较大的儿童和成人提供短期保护,而不保护婴儿。然而,多糖结合脑膜炎球菌疫苗对所有年龄的人都具有免疫原性,并且还防止获得携带,从而阻断脑膜炎球菌向他人的传播并诱导群体(群体或间接)保护。在婴儿和幼儿中,与仅含多糖的疫苗相比,结合增加了疫苗的免疫原性,并导致随后的疫苗剂量增强了抗体和细胞反应。脑膜炎球菌多糖结合疫苗是血清群特异性的,不提供针对其他脑膜炎球菌血清群的任何交叉保护。
MenC结合疫苗
根据制造商的方法,MenC结合疫苗由C群脑膜炎奈瑟球菌的荚膜多糖制成,其与载体蛋白连接(结合)。在英国,已经使用了与CRM197(白喉毒素的无毒变体)或破伤风类毒素结合的MenC疫苗。1999年C群脑膜炎球菌(MenC)结合疫苗的引入与已接种疫苗的儿童和青少年以及未接种疫苗的成人MenC疾病的大量减少相关,这是由于携带率降低(Maiden et al., 2002)和暴露风险降低(Trotter et al., 2003)。
Hib/MenC结合疫苗
Hib/MenC结合疫苗由b型流感嗜血杆菌和C型脑膜炎奈瑟球菌的荚膜多糖制成,这两种荚膜多糖都与破伤风类毒素结合。常规婴儿计划目前包括1岁时接种Hib/MenC联合疫苗。
四价 (ACWY)结合疫苗
MenACWY结合疫苗由A、C、W和Y群脑膜炎奈瑟球菌的荚膜多糖制成。在英国,MenACWY疫苗与CRM197或破伤风类毒素结合。自2009年以来,在英国注意到MenW疾病的增加,这导致英国JCVI首次为14-18岁和25岁以下上大学的年轻人引入MenACWY疫苗接种(Campbellet al., 2021)。
Nimenrix®从6周大开始许可,MenQuadfi从12个月大开始许可,Menveo® 从2岁开始许可。
4CMenB蛋白疫苗(Bexsero®,GSK)
2013年,一种基于四种成分蛋白的B群脑膜炎球菌(4CMenB)蛋白疫苗(Bexsero®)获得许可,在欧洲用于儿童和成人。据估计,该疫苗可预防英格兰和威尔士66-88%的MenB菌株(Parikh et al., 2017)。该疫苗由重组DNA技术生产的三种主要脑膜炎奈瑟氏球菌蛋白(奈瑟氏球菌肝素结合抗原(NHBA)、奈瑟氏球菌粘附A (NadA)、H因子结合蛋白(fHbp))和脑膜炎奈瑟氏球菌B组外膜囊泡制剂(OMV)制成。4CMenB在幼儿(Findlow et al., 2010)和青少年(Findlow et al., 2010)中具有免疫原性,并被许可在两个月大时使用。4CMenB自2015年9月在英国国家婴儿免疫计划中实施以来,在预防婴幼儿MenB疾病方面非常有效(Ladhani et al, 2020)。4CMenB还可以防止MenB以外的血清群感染(Ladhani et al, 2021)。
MenB-fHbp蛋白疫苗((Trumenba®,辉瑞公司)
2017年,MenB-fHbp被批准用于≥10岁的个人,作为预防MenB疾病的2剂或3剂方案(欧洲药品管理局,2018年)。MenB- fHbp蛋白疫苗((Trumenba®)由两种重组脑膜炎球菌脂质化fHbp组成,分别属于A和B亚家族,可广泛覆盖循环脑膜炎球菌菌株(Findlow et al, 2019)。实验室研究表明,MenB-fHbp可以防止除MenB以外的血清群(Harris et al, 2018)。
储存
疫苗应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。如果不在正确的温度下储存,疫苗的有效性可能会受到损害。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会导致容器出现细微裂缝,从而导致污染。有关存储的更多信息,请参见Chapter 3。
剂型
MenC结合疫苗
MenC结合疫苗可作为用稀释剂复溶的冻干粉末或作为注射器中的悬浮液获得。冻干悬浮液重建后,疫苗必须在一小时内使用。
复溶后一小时,丢弃任何未使用的疫苗。注意:稀释剂不得冷冻。
Hib/MenC结合疫苗
Hib/MenC以一小瓶白色粉末和0.5毫升溶剂的形式提供,装在一个预装的注射器中。疫苗必须通过将预填充注射器的全部内容物添加到含有粉末的小瓶中来复溶。加入溶剂后,应充分摇动混合物,直到粉末完全溶解。重新配制后,应立即接种疫苗,或让疫苗在+2℃和+8℃之间静置,并在24小时内使用。
四价 (ACWY)结合疫苗
Menveo以粉末形式装在小瓶中,0.5毫升溶液装在预装注射器中。疫苗必须通过将预装注射器的全部内容物(包含MenCWY溶液)添加到包含粉末(MenA)的小瓶中来重新配制。Nimenrix以粉末形式装在小瓶中(MenACWY ), 0.5毫升溶剂装在预装注射器中。疫苗必须通过将预填充注射器的全部内容物添加到含有粉末的小瓶中来复溶。任一疫苗复溶后,应将0.5毫升全部吸入注射器并立即使用,但Menveo在25℃或低于25℃的温度下可稳定长达8小时, Nimenrix®在30℃的温度下可稳定8小时。MenQuadfi®作为注射液提供。稳定性数据表明MenQuadfi®在高达25℃的温度下稳定72小时。
4CMenB蛋白疫苗
4CMenB疫苗以白色乳白色液体悬浮液(0.5毫升)的形式提供,装在预装注射器(单包装尺寸)中,用于注射。一剂(0.5毫升)含有50微克NHBA、NadA和fHbp以及25微克OMV。
MenB-FHbp,(二价 rLP2086) MenB蛋白疫苗
注射用Trumenba混悬剂采用预装注射器。一剂(0.5毫升)含有重组fHbp亚家族A (60微克)和fHbp亚家族B (60微克),吸附在磷酸铝上(每剂0.25毫克铝)
接种
所有含脑膜炎球菌的疫苗都通过上臂或大腿前外侧肌肉注射。这是为了降低局部反应的风险,局部反应在皮下注射中更常见(Mark et al., 1999; Zuckerman, 2000; Diggle et al., 2000)。然而,对于患有出血性疾病的个体,应通过深层皮下注射来接种疫苗,以降低出血的风险。服用4CMenB时,务必注意发热和扑热息痛的服用信息(参见下文“不良反应”一节)。
脑膜炎球菌疫苗可与其他疫苗同时接种,如肺炎球菌、麻疹、腮腺炎和风疹(MMR)、白喉、破伤风、百日咳、脊髓灰质炎和Hib。疫苗应该在单独的部位注射,最好是在单独的肢体上。如果接种在同一个肢体,它们应该至少分开2.5厘米(美国儿科学会,2006)。应该在儿童的临床记录中注明每种疫苗的注射部位。
处理
有关用于疫苗接种的设备的处置,包括用过的小瓶、安瓿、注射器或部分排出的疫苗,请参见Chapter 3。
脑膜炎球菌疫苗常规使用建议常规免疫接种计划的目的是直接或间接保护那些最有可能患脑膜炎球菌疾病的人。
免疫时间表
表2 一岁生日时脑膜炎球菌常规疫苗接种时间表*
| 年龄 | 初免/加强 | 剂量 |
| 8周龄 | 初免 | 一剂– 4CMenB疫苗 |
| 16周龄 | 初免 | 一剂– 4CMenB疫苗 |
| 1岁 | 初免(MenC)和加强(Hib)
加强 |
一剂Hib/MenC结合疫苗
一剂– 4CMenB疫苗 |
| 大约14岁 | 初免(中东地区),加强(中东地区) | 一剂MenACWY结合疫苗 |
当4CMenB与其他常规疫苗一起在第8周龄和第4周龄给婴儿使用时,建议使用预防性扑热息痛-参见下文的“不良反应”一节
有未知或不完整疫苗接种史的个人
当在英国出生的儿童有不充分的免疫史时,应尽一切努力澄清他们可能接种过哪些疫苗(参见 Chapter 11)。来到英国的儿童,如果在其原籍国有过免疫史,可能没有得到目前在英国使用的所有抗原的保护,他们可能没有接受过任何脑膜炎球菌疫苗。
http://apps.who.int/immunization_monitoring/globalsummary/schedules
来自发展中国家、冲突地区或难以接触到的人群的儿童可能没有完全免疫。如果没有可靠的既往免疫史,则应假设他们未进行过免疫,并应遵循完整的英国建议(参见 Chapter 11).
小于12个月的婴儿应接受第一剂4CMenB,两个月后接受第二剂4CMenB。他们还应该接受Hib/MenC剂量和4CMenB加强剂,确保4CMenB剂量之间至少有两个月的间隔。
一岁至两岁以下的儿童,如果在出生后第一年内接受的4CMenB剂量少于2剂,则应至少间隔两个月再接受两剂4CMenB。
1岁至10岁以下的儿童应接种单剂含MenC的疫苗:如果儿童在第一个生日当天或之后没有接种过Hib加强剂,应使用Hib/MenC联合疫苗。
更多信息请访问https://www.gov.uk/government/出版物/免疫状态不确定或不完全的个体的疫苗接种
10岁至25岁以下的儿童和年轻人(包括25岁以下首次上大学的学生)也有资格接种MenACWY结合疫苗。这个年龄组中从未接受过MenC的人应提供一剂MenACWY结合疫苗。无需进一步接种疫苗。
患有无脾症、脾功能障碍或补体紊乱的儿童和成人(包括正在接受补体抑制剂治疗的儿童和成人)
患有无脾症或脾功能障碍的儿童和成人可能会增加侵袭性脑膜炎球菌感染的风险。这些个体,无论年龄或脾切除术间隔时间,对疫苗的反应可能不是最佳的(Balmer et al., 2004)。
患有补体障碍的儿童和成人(Figueroa et al., 1991),或正在接受Eculizumab治疗(一种抑制末端补体途径的人源化单克隆抗体)的儿童和成人,患侵袭性脑膜炎球菌感染的风险增加(Ladhani et al., 2019)。
鉴于风险增加,建议患有无脾症或脾功能障碍的个人或根据年龄和疫苗接种史诊断为补体紊乱的个人额外接种脑膜炎球菌病疫苗(第7章)。接受Eculizumab治疗的患者应在治疗开始前至少两周接种疫苗(Soliris®的产品特性总结,Alexion Europe,2012)。这个建议适用于所有新诊断的病人。
如果有机会,根据患者的具体情况,应该为从未接种过4CMenB或MenACWY结合疫苗的符合条件的儿童和成人提供这些疫苗。
高危人群的加强免疫接种
脑膜炎球菌ACWY结合疫苗。
目前不推荐在高危个体中加强剂量的MenACWY结合疫苗,因为加强剂的需要和时机尚未确定。由于青少年MenACWY免疫计划提供的人群保护,目前这4种血清群导致的感染非常少。
脑膜炎球菌B疫苗。
高危个体加强剂量4CMenB疫苗的需要和时机尚未确定。
正在国外旅行或打算在国外居住的个人
所有旅行者都应接受仔细的风险评估,考虑他们的行程、停留时间和计划的活动。在世界上的一些地区,获得脑膜炎球菌感染的风险,特别是发展为A组荚膜疾病的风险,比英国高得多。特别危险的个人是那些生活或旅行“艰苦”的游客,如背包客,以及那些与当地人一起生活或工作的人。朝觐期间发生了A和W群脑膜炎球菌感染的大规模流行,A、C、W和Y群脑膜炎球菌疫苗接种证明现在是前往沙特阿拉伯王国的朝觐者和季节工人的入境签证要求。
流行病,主要是荚膜A组和最近的荚膜W组感染,在整个热带非洲不可预测地发生,但在旱季(12月至6月)特别是在大草原。建议在撒哈拉以南非洲长期逗留或高风险的游客进行免疫接种,例如,那些将与当地人一起生活或工作的人,或那些背包旅行的人。
世界其他地区可能不时报告脑膜炎球菌感染的爆发。如果此类疫情显示是由疫苗可预防的荚膜群引起的,可能会建议前往受影响地区的某些旅行者接种疫苗。
有关脑膜炎球菌疾病全球流行病学的国别建议和信息可在以下网站上找到:www.nathnac.orgwww.travax.nhs.uk
注:MenC结合疫苗仅预防C组荚膜疾病。出国旅行的个人(见上文)应接种适当的四价(ACWY)疫苗,即使他们以前接种过MenC结合疫苗。目前还没有建议正在旅行或将要在国外居住的个人接种4CMenB疫苗。
表3旅行使用四价脑膜炎球菌ACWY疫苗的建议
| 年龄 | ACWY计划 |
| 出生不到一年* | 首剂0.5毫升
第一剂后一个月,第二剂0.5毫升。 |
| 从一岁开始(包括成人) | 单剂量0.5毫升 |
*如果婴儿已经接种了两次MenC结合疫苗,则还应在最后一次脑膜炎球菌结合疫苗接种后至少1个月接种两次MenACWY结合疫苗。
面临职业风险的个人
处理脑膜炎奈瑟菌菌株或含有脑膜炎奈瑟菌的临床样本的任何实验室工作人员必须接受脑膜炎球菌ACWY结合疫苗和4CMenB疫苗的初级疗程,并每五年接受两种疫苗的加强剂量。
禁忌症
极少数人不能接种脑膜炎球菌疫苗。如有疑问,应向儿科顾问医生、免疫协调员或传染病控制顾问寻求适当建议,而不是停止免疫接种。疫苗不应注射给患有以下疾病的人:
- 确认对先前剂量的疫苗有过敏反应,或
- 对疫苗的任何成分或赋形剂的确认过敏反应
预防措施
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。如果个人急性不适,免疫接种可能会推迟,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
怀孕和母乳喂养
当有临床指征时,可以给孕妇接种脑膜炎球菌疫苗。没有证据表明孕妇或哺乳期妇女接种疫苗有风险
灭活病毒或细菌疫苗或类毒素(Granoff et al., 2008)。在怀孕期间意外接种脑膜炎球菌疫苗的情况下,没有证据表明会对胎儿造成伤害。
早产儿
根据时间表,早产儿在适当的年龄接种疫苗是很重要的。接种疫苗后窒息的发生率在早产婴儿中特别高。
住院的极早产儿(出生时≤ 28周)在接受第一次免疫接种时,应进行48-72小时的呼吸监测,尤其是那些先前有呼吸不成熟病史的婴儿。如果儿童在第一次免疫接种后出现呼吸暂停、心动过缓或不饱和,第二次免疫接种也应在医院进行,并进行48-72小时的呼吸监测(Ohlsson et al., 2004; Pfister et al.,2004; Schulzke et al., 2005; Pourcyrous et al., 2007; Klein et al., 2008)。
由于这一组婴儿的免疫接种益处很大,因此不应停止或推迟免疫接种。
免疫抑制和艾滋病毒感染
患有免疫抑制和人类免疫缺陷病毒(HIV)感染的个体(无论CD4计数如何)应根据常规计划接种脑膜炎球菌疫苗。这些人可能不会产生完全的抗体反应。
在治疗结束并痊愈后,应考虑重新免疫。可能需要专家的建议。
皇家儿科和儿童健康学院(RCPCHhttp://www.rcpch.ac.uk/),英国艾滋病协会(BHIVAhttp://www.bhiva.org/vaccination-guidelines.aspx)和儿童艾滋病毒协会(CHIVAhttp://www . chiva . org . uk/guidelines/immunization/)。
不良反应
MenC结合疫苗
注射部位的疼痛、压痛、肿胀或发红以及轻度发烧在所有年龄组中都很常见。在婴幼儿中,哭闹、易怒、困倦、睡眠障碍、进食减少、腹泻和呕吐是常见的。在年龄较大的儿童和成人中,可能会出现头痛、肌痛和嗜睡。
MenC结合疫苗接种后出现头晕、发热/无热性癫痫发作、昏厥、麻木和张力减退等神经系统反应的情况非常罕见。
Hib/MenC结合疫苗
通常会出现轻微的副作用,如过敏、食欲不振、疼痛、注射部位肿胀或发红以及轻微的体温升高。曾报告过不太常见的哭闹、腹泻、呕吐、特应性皮炎、不适和超过39.5℃的发烧。
四价结合疫苗
对于Menveo®,非常常见或常见的报告反应包括注射部位反应,包括疼痛、红斑、硬结和瘙痒。其他非常普通或常见的反应包括头痛、恶心、皮疹和不适。所有不良反应的报告可在Menveo®的产品特性总结(GSK,2022年5月1日查阅)中找到。
对于Nimenrix®,非常常见或常见的报告反应包括注射部位反应,包括疼痛、红斑和肿胀。其他非常常见或常见的反应包括易怒、嗜睡、头痛、恶心和食欲不振。所有不良反应的报告可在Nimenrix®的产品特性总结中找到(辉瑞,2022年5月1日查阅)。(https://www.medicines.org.uk/emc/medicine/26514#gref)
对于MenQuadfi®,所有不良反应的报告可在MenQuadfi®的产品特性总结中找到(赛诺菲巴斯德,2022年5月1日查阅)。
4CMenB疫苗
对于4CMenB (Bexsero®),在青少年和成人中观察到的最常见的局部和全身不良反应是注射部位疼痛、不适和头痛。在婴儿和10岁以下的儿童中,注射部位反应、发烧(≥38℃)和过敏非常常见。腹泻和呕吐、饮食紊乱、嗜睡、异常哭闹和出现皮疹在该年龄组中常见或非常常见。所有不良反应的报告可在Bexsero®的产品特性总结(GSK,2022年5月1日查阅)中找到。
在婴儿和两岁以下的儿童中,当4CMenB与常规疫苗同时接种时,发热≥38℃(偶尔≥39℃)更常见(参见破产重组保护)比单独给予4CMenB时更有效。发烧在6小时左右达到高峰,通常在接种疫苗后48小时消失。在引入4CMenB之前,通常不建议在接种疫苗期间使用预防性扑热息痛来预防接种后发热(参见Chapter 8)因为担心它可能会降低对某些疫苗的抗体反应(Prymula et al., 2009);尽管这种减少不太可能具有临床意义(Das et al., 2014)。当Bexsero®和其他常规疫苗与4CMenB共同接种时,扑热息痛不会影响这些疫苗在婴儿中的免疫原性。(Prymula等人,2011年),扑热息痛已被证明可减少发烧和其他与疫苗接种相关的症状(Prymula et al., 2011)。因此,JCVI建议,当一岁以下婴儿在接种常规疫苗的同时接种4CMenB时,应预防性使用扑热息痛。接种疫苗后应尽快口服2.5毫升的扑热息痛液体(婴儿扑热息痛120毫克/5毫升),然后在4-6小时后服用第二剂2.5毫升,在第二剂4-6小时后服用第三剂2.5毫升。如果在第三次接种后仍持续发热,并且如果儿童在其他方面表现良好,则可每隔4至6小时再接种一次扑热息痛,最长可达48小时。如果孩子明显不适并伴有发烧,或者发烧发生在其他时间,应建议父母寻求医疗建议。在疫苗接种后控制发烧方面,布洛芬似乎不如扑热息痛有效,因此不推荐使用(Prymula et al., 2011)。
MenB-fHbp疫苗
对于MenB-fHbp (Trumenba®),10岁以上人群中最常见的不良反应是头痛、腹泻、恶心、肌肉疼痛、关节痛、疲劳、寒战以及注射部位疼痛、肿胀和发红。(辉瑞公司,于2022年5月1日获得)。
报告不良事件
儿童或任何年龄的个体在接种标有黑三角(▼)的疫苗后出现的所有疑似疫苗不良反应,应使用黄卡计划报告给MHRA。成人对疫苗的严重疑似不良反应应通过黄卡计划进行报告。
使用4CMenB和MenB-fHbp后的监测未发现任何与使用疫苗相关的严重或意外健康问题。
任何人都可以使用黄卡报告计划(www.yellowcard.gov.uk).
疑似病例和接触者的管理
NICE目前的建议是,没有非热烫性皮疹的疑似细菌性脑膜炎的儿童和年轻人应该直接转移到二级护理,而不用注射抗生素。如果无法紧急转移到医院(例如,在偏远地区或由于恶劣的天气条件),应对疑似细菌性脑膜炎的儿童和年轻人使用抗生素。
对于疑似脑膜炎球菌疾病(发热伴非热烫性皮疹或脑膜炎球菌败血症),应在初级或二级护理中尽早给予胃肠外抗生素(肌肉注射或静脉注射苄青霉素),但不应延迟紧急转院以给予胃肠外抗生素。
http://guidance.nice.org.uk/CG102/NICEGuidance/pdf/English
https://www . gov . uk/government/collections/脑膜炎球菌-疾病-指南-数据-和-analysis
联系人管理
对于病例和疫情接触者的公共卫生管理,必须征求当地健康保护团队的意见。脑膜炎球菌感染病例的家庭接触者患该病的风险增加。这种风险在指数病例发病后的前七天最高,但至少持续四周。通过对整个接触组进行抗生素预防,可以降低直接风险。
作为预防,建议成人单剂量服用500毫克环丙沙星(5-12岁儿童服用250毫克,1个月至4岁儿童服用125毫克)。替代选项在中讨论https://www.gov.uk/government/collections/meningococcal-disease-制导数据和分析。
对于确诊或可能的MenC感染,应向所有密切接触者(所有年龄)提供含有MenC的结合疫苗,这些人以前没有免疫、部分免疫或一年多以前接种过含有MenC的结合疫苗。
对于确诊的A、W或Y类荚膜感染,应给任何年龄的所有密切接触者接种MenACWY结合疫苗(如果年龄小于1岁,则间隔一个月接种两次;老年个体中的一剂),这些个体先前没有用MenACWY结合疫苗进行免疫接种或接种超过一年。
Hib/MenC、MenACWY和/或4CMenB疫苗也应根据推荐的国家计划提供给任何符合条件的未免疫指标病例。这项政策确保这一年龄组的人得到与其年龄相匹配的免疫同龄人同等的保护。
4CMenB疫苗目前不被常规推荐用于指示病例的家庭接触者或教育环境中的接触者。提供任何脑膜炎球菌疫苗的决定不应推迟抗生素化学预防的实施,这是预防脑膜炎球菌病进一步病例的最重要的干预措施。
任何病例都提供了检查指示病例和接触者的疫苗状态的机会,并确保符合条件的个人已经根据英国的计划进行了完全免疫。
脑膜炎球菌聚集和暴发的管理
除了零星病例外,脑膜炎球菌感染的暴发尤其可能发生在封闭或半封闭的社区,如学校、军事机构和大学。应该从当地健康保护小组获得关于管理这种疾病爆发的建议(HPT)。
在脑膜炎球菌聚集或暴发中,应考虑为接受抗生素化学预防的同一人群接种适当的脑膜炎球菌疫苗。对于脑膜炎球菌B群,4CMenB (Bexsero®)是首选疫苗,除非在可能考虑MenB-fHbp (Trumenba®)时,预测该疫苗无法预防暴发菌株(例如,使用脑膜炎球菌抗原分型系统[MATS])。然而,MATS的结果并不及时,也不应该推迟公共卫生决策。有关在这种情况下使用4CMenB (Bexsero®)的其他建议,请参见英国脑膜炎球菌疾病公共卫生管理指南:
https://www . gov . uk/government/collections/脑膜炎球菌疾病指南数据和分析
可从以下机构获得脑膜炎球菌疫苗使用建议:UKHSA、Colindale(电话:020 8200 6868)、苏格兰健康保护局(电话:0141 300 1100)和苏格兰嗜血杆菌、军团菌、脑膜炎球菌和肺炎球菌参考实验室(电话:0141 201 8659)。
如果您在为家庭接触者获得脑膜炎球菌疫苗方面遇到任何延迟或在爆发疫情的情况下,请联系位于科林代尔的UKHSA的免疫部门。
供应
作为国家免疫计划的一部分,为国民保健系统集中购买的疫苗只能通过ImmForm订购。作为国家儿童免疫方案一部分的疫苗是免费提供的。有关ImmForm的更多信息,请访问https://www.gov.uk/government/collections/immform,从ImmForm帮助台获取,网址为helpdesk@immform.org.uk或电话:0844 376 0040。有关可通过ImmForm获得的疫苗的更多信息,请参见ImmForm帮助表13。用于私人处方、职业健康用途或旅行的疫苗不是免费提供的,应从制造商处订购。
在北爱尔兰,应通过正常的儿童疫苗分发安排获得供应,详情请致电028 9442 4089与地区药品采购处联系。
在苏格兰,应该从当地的儿童疫苗储备中心获得供应。详情可从苏格兰国民保健服务系统的采购、调试和设施处获得(电话:0131 275 6725)。
4CMenB、MenC/Hib和以下列表中的至少一种MenACWY疫苗将随时可用:
- 葛兰素史克公司生产的Bexsero® – (4CMenB)
- 葛兰素史克公司生产的Menitorix® – (Hib/MenC)
- MenQuadfi® – (MenACWY)由赛诺菲巴斯德公司生产
- Menveo® – (MenACWY)由葛兰素史克公司生产
- Nimenrix® – (MenACWY)由辉瑞公司生产
用于国家规划之外的疫苗应直接向制造商订购:
- Bexsero® (4CMenB))–由葛兰素史克公司生产(电话:0808 100 9997)
- Menitorix® (Hib/MenC conjugate vaccine)-葛兰素史克公司生产(电话:0808 100 9997)
- Menjugate® (MenC conjugate vaccine)-葛兰素史克公司生产(电话:0808 100 9997)
- Menveo® (Quadrivalent conjugate ACWY vaccine)-葛兰素史克公司生产(电话:0808 100 9997)
- NeisVac-C® (Men C conjugate vaccine)-由辉瑞公司生产(0800 0327907)
- Nimenrix® (Quadrivalent conjugate ACWY vaccine)-由辉瑞公司生产(0800 0327907)
- 由赛诺菲巴斯德公司生产的MenQuadfi® – (Quadrivalent conjugate ACWY vaccine)
- Trumenba® – (MenB-fHbp)由辉瑞公司生产。访问smarthub.pfizerpro.co.uk了解股票信息,致电Alliance healthcare订购0344 8547749,免费电话
0800 0327907
国家免疫规划的疫苗不应用于确诊病例接触者的疫苗接种和威胁性感染的爆发。疫苗应该从制造商那里订购。
参考
American Academy of Pediatrics (2006) Active Immunization. In: Pickering LK (ed.) Red Book: 2006. Report
of the Committee on Infectious Diseases. 27th edition. Elk Grove Village, IL: American Academy of Pediatrics,
p 9-54.
Balmer P, Falconer M, McDonald P et al. (2004) Immune response to meningococcal serogroup C conjugate
vaccine in asplenic individuals. Infect Immun 72(1): 332-7.
Campbell H, Andrews N, Parikh SR, White J, Edelstein M, Bai X, Lucidarme J, Borrow R, Ramsay ME, Ladhani
SN. Impact of an adolescent meningococcal ACWY immunisation programme to control a national outbreak
of group W meningococcal disease in England: a national surveillance and modelling study. Lancet Child
Adolesc Health. 2021 Dec 6:S2352-4642(21)00335-7. doi: 10.1016/S2352-4642(21)00335-7 https://www.
thelancet.com/pdfs/journals/lanchi/PIIS2352-4642(21)00335-7.pdf
Cartwright K (1995) The Clinical Spectrum of Meningococcal Disease. In: Cartwright K (ed.) Meningococcal
disease. Chichester, UK: John Wiley & Sons, pp 115-46.
Christensen H, May M, Bowen L et al. (2010) Meningococcal carriage by age: a systematic review and meta
analysis. Lancet Infect Dis 10(12): 853-61.
Das RR, Panigrahi I, Naik SS (2014) The effect of prophylactic antipyretic administration on post-vaccination
adverse reactions and antibody response in children: a systematic review. PLoS One 9(9):e106629
Diggle L and Deeks J (2000) Effect of needle length on incidence of local reactions to routine immunisation
in infants aged 4 months: randomised controlled trial. BMJ 321(7266): 931-3.
European Medicines Agency. Annex I: Summary of product characteristics (Trumenba), https://www.ema.
europa.eu/documents/product-information/trumenba-epar-product-information_en.pdf; [accessed November
7, 2018].
Figueroa JE and Densen P (1991) Infectious diseases associated with complement deficiencies. Clin Microbiol
Rev 4(3): 359-95.
Findlow J, Borrow R, Snape MD et al. (2010) Multicenter, open-label, randomized phase II controlled trial of
an investigational recombinant Meningococcal serogroup B vaccine with and without outer membrane
vesicles, administered in infancy. Clin Infect Dis 51(10): 1127-37.
Findlow J, Nuttens C, Kriz P.Introduction of a second MenB vaccine into Europe – needs and opportunities for
public health. Expert Rev Vaccines 2019;18(3):225-39.
Granoff DM, Harrison LH and Borrow R (2008) Section 2: Licensed Vaccines Meningococcal Vaccines. In:
Plotkin S, Orenstein W and Offit P (ed.) Vaccines. 5th edition. Elsevier Inc., p 399-434.
GSK Summary of Product Characteristics for Menveo® https://www.medicines.org.uk/emc/
medicine/27347#gref
GSK Summary of Product Characteristics for Bexsero® https://www.medicines.org.uk/emc/medicine/28407/
SPC/Bexsero+Meningococcal+Group+B+vaccine+for+injection+in+pre-filled+syringe/#gref
Harris SL, Tan C, Andrew L, Hao L, Liberator PA, Absalon J, et al. The bivalent factor H binding protein
meningococcal serogroup B vaccine elicits bactericidal antibodies against representative non-serogroup B
meningococci. Vaccine 2018;36:6867–74.
Klein NP, Massolo ML, Greene J et al. (2008) Risk factors for developing apnea after immunization in the
neonatal intensive care unit. Pediatrics 121(3): 463-9.
Ladhani SN, Campbell H, Lucidarme J, Gray S, Parikh S, Willerton L, Clark SA, Lekshmi A, Walker A, Patel S,
Bai X, Ramsay M, Borrow R. Invasive meningococcal disease in patients with complement deficiencies: a case
series (2008-2017).BMC Infect Dis. 2019 Jun 14;19(1):522. doi: 10.1186/s12879-019-4146-5. https://www.
ncbi.nlm.nih.gov/pmc/articles/PMC6567562/pdf/12879_2019_Article_4146.pdf
Ladhani SN, Andrews N, Parikh SR, Campbell H, White J, Edelstein M, Bai X, Lucidarme J, Borrow R, Ramsay
ME. Vaccination of Infants with Meningococcal Group B Vaccine (4CMenB) in England. N Engl J Med
2020;382:309-17.
Ladhani SN, Campbell H, Andrews N, Parikh SR, White J, Edelstein M, Clark SA, Lucidarme J, Borrow R,
Ramsay ME. First Real-world Evidence of Meningococcal Group B Vaccine, 4CMenB, Protection Against
Meningococcal Group W Disease: Prospective Enhanced National Surveillance, England. Clin Infect Dis. 2021
Oct 5;73(7):e1661-e1668.
Maiden MC, Stuart JM and UK Meningococcal Carriage Group (2002) Carriage of serogroup C meningococci
1 year after meningococcal C conjugate polysaccharide vaccination. Lancet 359(9320): 1829-31.
Maiden MC, Ibarz-Pavon AB, Urwin R et al. (2008) Impact of meningococcal serogroup C conjugate vaccines
on carriage and herd immunity. J Infect Dis 197(5): 737-43.
Mandal S, Campbell H, Ribeiro S, Gray S, Carr T, White J, Ladhani SN, Ramsay ME. Risk of invasive
meningococcal disease in university students in England and optimal strategies for protection using
MenACWY vaccine. Vaccine. 2017 Oct 13;35(43):5814-5818. doi: 10.1016/j.vaccine.2017.09.024. Epub
2017 Sep 18. PubMed PMID: 28928076.
Mark A, Carlsson RM and Granstrom M (1999) Subcutaneous versus intramuscular injection for booster DT
vaccination of adolescents. Vaccine 17(15-16): 2067-72.
Ohlsson A and Lacy JB (2004) Intravenous immunoglobulin for preventing infection in preterm and/or low
birth-weight infants. Cochrane Database Syst Rev (1): CD000361.
Parikh SR, Newbold L, Slater S, Stella M, Moschioni M, Lucidarme J, De Paola R, Giuliani M, Serino L, Gray SJ,
Clark SA, Findlow J, Pizza M, Ramsay ME, Ladhani SN, Borrow R. Meningococcal serogroup B strain coverage
of the multicomponent 4CMenB vaccine with corresponding regional distribution and clinical characteristics
in England, Wales, and Northern Ireland, 2007-08 and 2014-15: a qualitative and quantitative assessment.
Lancet Infect Dis. 2017 Jul;17(7):754-762. doi: 10.1016/S1473-3099(17)30170-6. Epub 2017 Mar 30. PMID:
28366725. https://www.sciencedirect.com/science/article/pii/S1473309917301706?via%3Dihub
Pfister RE, Aeschbach V, Niksic-Stuber V et al. (2004) Safety of DTaP-based combined immunization in very
low-birth-weight premature infants: frequent but mostly benign cardiorespiratory events. J Pediatr 145(1):
58-66.
Pfizer Summary of Product Characteristics for Nimenrix® https://www.medicines.org.uk/emc/
medicine/26514#gref
Pfizer Summary of Product Characteristics for Trumenba® https://www.medicines.org.uk/emc/product/2670/
smpc#gref
Pourcyrous M, Korones SB, Arheart KL et al. (2007) Primary immunization of premature infants with
gestational age <35 weeks: cardiorespiratory complications and C-reactive protein responses associated with
administration of single and multiple separate vaccines simultaneously. J Pediatr 151(2): 167-72.
Prymula R, Siegrist CA, Chlibek R et al. (2009) Effect of prophylactic paracetamol administration at time of
vaccination on febrile reactions and antibody responses in children: two open-label, randomised controlled
trials. Lancet 374(9698): 1339-50.
Prymula R, Esposito S, Kittel C et al. (2011) Prophylactic paracetamol in infants decreases fever following
concomitant administration of an investigational meningococcal serogroup B vaccine with routine
immunizations. Poster presented at: 29th Annual Meeting of the European Society for Paediatric Infectious
Diseases (ESPID); June 7-11, 2011; The Hague, The Netherlands. Poster 631.
Rosenstein NE, Perkins BA, Stephens DS et al. (2001) Meningococcal disease. N Engl J Med 344(18): 1378-
88.
Sanofi Pasteur Summary of Product Characteristics for MenQuadfi® https://www.medicines.org.uk/emc/
product/12818/smpc#gref
Santolaya ME, O’Ryan ML, Valenzuela MT et al. (2012) Immunogenicity and tolerability of a multicomponent
meningococcal serogroup B (4CMenB) vaccine in healthy adolescents in Chile: a phase 2b/3 randomised,
observer-blind, placebo-controlled study. Lancet 379(9816): 617-24.
Schulzke S, Heininger U, Lucking-Famira M et al. (2005) Apnoea and bradycardia in preterm infants following
immunisation with pentavalent or hexavalent vaccines. Eur J Pediatr 164(7): 432-5.
Subbarao S, Campbell H, Ribeiro S, Clark SA, Lucidarme J, Ramsay M, Borrow R, Ladhani S. Invasive
Meningococcal Disease, 2011-2020, and Impact of the COVID-19 Pandemic, England. Emerg Infect Dis. 2021
Sep;27(9):2495-2497. doi: 10.3201/eid2709.204866. Epub 2021 Jun 30. PMID: 34193335.
Trotter CL and Gay NJ (2003) Analysis of longitudinal bacterial carriage studies accounting for sensitivity of
swabbing: an application to Neisseria meningitidis. Epidemiol Infect 130(2): 201-5.
Zuckerman JN (2000) The importance of injecting vaccines into muscle. Different patients need different
needle sizes. BMJ 321(7271): 1237-8.




