第22章:对疫苗可预防疾病监测的实验室支持
疫苗可预防疾病监测手册
作者:桑德拉·劳什,山,英里;伯纳德·比尔博士;莱斯利·麦基博士;迈克尔·博文博士;史蒂文·奥伯斯特博士;丹尼尔·佩恩博士,MSPH;保罗·罗塔博士;卡罗尔·希克曼博士;玛丽亚·露西亚·通德拉博士;Annemarie Wasley,ScD王欣博士
疫苗可预防疾病的监测
疫苗可预防疾病的监测需要与临床医生、公共卫生专业人员和实验室人员密切合作。公共卫生监测依赖于VPDs的临床和实验室报告;因此,适当的标本收集、运输和实验室检测至关重要。本章提供了每个VPD的样本采集和实验室结果解释指南。
每个处理疫苗可预防疾病的公共卫生专业人员都应该为他或她的临床和公共卫生实践确定实验室支持的来源。表1列出实验室适用于VPD的测试,并提供实验室和实验室人员的姓名和联系信息。除了本章介绍的指南外,州卫生部门人员可以提供关于标本采集、运输和其他相关信息的额外指南。
表1.VPD监测实验室支持的联系人
| 疾病 | 测试名称 | 实验室名称 | 实验室联系人/电话 |
| 白喉 | 培养
产毒性测试 聚合酶链式反应 |
疾控中心百日咳和白喉实验室 | 联系脑膜炎和疫苗可预防疾病处,以获得相关人员的指导
404-639-3158 |
| 流感嗜血杆菌 | 培养
实时PCR 血清分型玻片凝集 分子分型(WGS) |
疾病控制中心细菌性脑膜炎实验室 | 亨朱·马尔朱基博士 vsd1@cdc.gov 404-639-2803 |
| 甲型肝炎 | 实验室分部 | 萨利姆·卡米里博士 sek6@cdc.gov 404-639-4431 |
|
| 乙型肝炎 | 实验室分部 | 萨利姆·卡米里博士 sek6@cdc.gov 404-639-4431 |
|
| 流行性感冒 | 培养/病毒分离
抗原检测 RT-PCR/ 逆转录聚合酶链反应 |
流感科,病毒学,监测和诊断处 | 约翰·巴恩斯 基因组学和诊断团队负责人 fzq9@cdc.gov 电子邮件:flusupport@cdc.gov 404-639-1587 |
| 麻疹 | IgM抗体
IgG抗体 病毒分离法 逆转录聚合酶链反应 病毒基因分型 |
病毒疫苗可预防疾病处 | 保罗·罗塔博士 par1@cdc.gov 404-639-4181 |
| 脑膜炎球菌病 | 培养
实时PCR 血清分组玻片凝集 |
疾病控制中心细菌性脑膜炎实验室 | 亨朱·马尔朱基博士 vsd1@cdc.gov 404-639-2803 |
| 腮腺炎 | IgM抗体 IgG抗体 -病毒分离 逆转录聚合酶链反应 病毒基因分型 |
疫苗病毒可预防疾病处 | 斯蒂芬·克鲁克博士 SCrooke@cdc.gov 404-718-4003Dr。贝蒂娜银行 BBankamp@cdc.gov 404-639-1242 |
| 百日咳 | 培养
聚合酶链式反应 血清学 |
疾控中心百日咳和白喉实验室 | 露西娅·唐德拉博士 mlt5@cdc.gov 404-639-1239 |
| 肺炎球菌疾病 | 培养
聚合酶链式反应 敏感性测试 血清分型(常规或基于PCR) 基因分型 耐药性 |
疾控中心链球菌实验室 | 莱斯利·麦基博士 LMcGee@cdc.gov 404-639-0455或 Sopio Chochua博士 |
| 脊髓灰质炎 | 培养
逆转录聚合酶链反应 |
CDC脊髓灰质炎/小核糖核酸病毒实验室 | 卡拉·伯恩斯 zqd1@cdc.gov 404-639-5499 |
| 轮状病毒 | 抗原EIA
逆转录聚合酶链反应 基因分型 定序 |
疾病控制中心轮状病毒实验室 | 拉希·高塔姆 hsr7@cdc.gov 404-639-1628 |
| 风疹 | IgM抗体
IgG抗体 IgG亲和力 培养 逆转录聚合酶链反应 |
疫苗病毒可预防疾病处 | 柳德米拉·佩雷吉娜博士 LPerelygina@cdc.gov 404-639-4812 |
| 先天性风疹综合征 | IgM抗体
IgG抗体 培养 逆转录聚合酶链反应 血清学 |
疫苗病毒可预防疾病处 | |
| 水痘 | 聚合酶链式反应
血清学 美术博士(Doctor of Fine Arts的缩写) 培养 病毒分型/毒株鉴定 |
国家VZV实验室 | 希拉·多拉德博士 SDollard@cdc.gov 404-639-2178 |
标本采集和实验室测试的一般指南
标本采集和运送是获得VPD实验室诊断或确认的重要步骤。已经发布了以下指南标本收集和处理为病毒的和微生物剂。还可以获得关于使用疾病控制和预防中心(CDC)实验室作为支持的信息参考和疾病监测,其中包括
一个中央网站申请实验室测试;
向疾病控制中心提交标本所需的表格(附录23,CDC表格#50.34[2.74兆字节,2页];
病原体运输的一般要求信息(附录24[4页])—虽然该信息旨在指导向CDC提交标本,但也适用于向其他实验室提交标本;和
这CDC传染病实验室测试目录它不仅包含该机构可用测试的列表,还包含关于适当标本类型、采集方法、标本量和联系点的详细信息。
此外,还有4名VPD参考中心[2页]—使用CDC开发的标准化方法对7种VPD进行检测的公共卫生实验室。
针对疾病的标本采集和实验室检测指南
本章提供了本手册第1-17章实验室信息的快速参考摘要。用于监测疫苗可预防疾病的确证试验和其他有用试验列于下文表2。
表2.用于监测疫苗可预防疾病的确证试验和其他有用试验
| 疾病 | 确认测试 | 其他有用的测试 |
| 白喉 | 培养 产毒性测试 |
聚合酶链式反应
马尔迪飞行时间 |
| 流感嗜血杆菌 | 培养
实时PCR |
血清分型玻片凝集或PCR (胶囊化菌株的胶囊类型的鉴定) 抗原检测 分子分型 |
| 甲型肝炎 | IgM抗HAV抗体(阳性) | 全面反HAV;
IgG抗HAV(免疫标记) |
| 乙型肝炎 | IgM抗HBc(急性感染) 乙型肝炎表面抗原(急性或慢性感染)* |
抗-HBs(免疫标记) 总抗HBc(过去或现在感染的标志) HBV DNA(当前感染的标记)的PCR |
| 流行性感冒 | 培养 抗原检测(环境影响评估,IFA,EM) 逆转录聚合酶链反应 |
|
| 麻疹 | 免疫球蛋白M 逆转录聚合酶链反应 病毒分离法 |
免疫球蛋白G(同immunoglobulin G) 血清转化或4倍滴度升高的IgG 亲和力(案例分类) |
| 脑膜炎球菌病 | 培养 | 血清分组
玻片凝集或PCR 抗原检测 分子分型 |
| 腮腺炎 | 病毒分离法
逆转录聚合酶链反应 |
血清转化或4倍滴度升高的IgG (不推荐) |
| 百日咳 | 培养 聚合酶链式反应 |
血清学 |
| 肺炎球菌疾病 | 培养 聚合酶链式反应 |
基于WGS的所有菌株特征推断(血清型、抗微生物剂抗性、MLST基因型
|
| 脊髓灰质炎 | 培养——来自粪便,
咽, |
类型内分化(野生型与疫苗型)
配对血清学 脑脊液分析 |
| 轮状病毒 | RT-PCR/qRT-PCR | |
| 风疹 | IgG配对血清 免疫球蛋白M |
培养 |
| 破伤风 | 没有破伤风的实验室特征 | 血清学(用于免疫测试) |
| 水痘 | 聚合酶链式反应 | DFA
培养 血清学 基因分型 |
缩写:EIA,酶联免疫吸附试验;IFA,间接荧光抗体;EM,电子显微镜; PCR, 聚合酶链反应;MLST,多位点序列分型;PFGE,脉冲场凝胶电泳;CSF, 脑脊液;IgG,免疫球蛋白G;IgM,免疫球蛋白M;HAV,甲型肝炎病毒;HBV,乙肝病毒;anti-HBc;乙肝核心抗体;HBsAg, 乙肝表面抗原;qRT-PCR, 定量逆转录聚合酶链反应
*应按照测试包装说明书中的规定,通过HBsAg中和试验确认HBsAg阳性结果。
表3总结了实验室检测的标本采集程序。因为一些标本需要不同的处理程序,所以在运输前与诊断实验室核对是非常重要的。当对采集什么标本、标本采集的时间、标本运送的地点或方式有疑问时,请致电州卫生部门和州实验室。
表3.为疫苗可以预防疾病实验室检测样本采集
| 疾病 | 测试名称 | 要取的标本 | 标本采集的时间安排 | 运输要求 | 收集要求 |
|---|---|---|---|---|---|
| 白喉 | 培养
注意:提醒实验室怀疑白喉,以便使用含亚碲酸盐的培养基。 |
鼻、喉、膜拭子 | 当怀疑有白喉时,尽快 | <24 hrs: Amies 或者相似媒介
≥24小时:硅胶袋 |
州卫生部门可拨打404-639-1231或404-639-1239联系CDC白喉实验室。 |
| 白喉 | 聚合酶链式反应
注意:提醒实验室怀疑白喉,以便使用特定的PCR检测。 |
拭子(如上)、膜片、活检组织 | 在采集培养标本的同时采集这些标本 | 棉签,硅胶袋,
或4℃的无菌干燥容器 |
州卫生部门可致电CDC白喉实验室
404-639-1231 或者 404-639-1239. |
| 白喉 | 产毒性测试(埃莱克测试) | 从培养物中分离(如上) | 在白喉杆菌已经被分离 | 运输介质,如Amies介质或硅胶袋 | 州卫生部门可拨打404-639-1231或404-639-1239联系CDC白喉实验室。 |
| 白喉 | 血清学(白喉毒素抗体) 注意:收集成对的血清,间隔2-3周。疾控中心目前还没有这项测试。 |
血清 | 注射抗毒素前 | 冷冻(-20℃) | 如果使用白喉抗毒素,则无效。 |
| b型流感嗜血杆菌 | 培养 注意:要求实验室对任何你好与任何正常无菌场所分离。 |
血 | 尽快 | 带肉汤的血培养瓶
或者 裂解离心管 |
在24小时内收集3个单独的样本。 |
| 流感嗜血杆菌b型 | 培养
其他通常无菌位置 |
脑脊髓液(Cerebrospinal Fluid) | 尽快 | 无菌螺旋盖试管 | |
| b型流感嗜血杆菌 | 血清分型玻片凝集 | 培养分离物 | 巧克力斜面,冷冻,冻干
或者 硅胶包装 |
最高优先级是从小于15岁的人群中分离出。 | |
| b型流感嗜血杆菌 | 抗原检测 | 脑脊髓液 | 尽快 | 用蓝色冰袋冷冻 | |
| b型流感嗜血杆菌 | 用于鉴定和血清分型的PCR | 任何通常无菌的地方 | 尽快 | 用蓝色冰袋冷冻 | |
| 甲型肝炎 | IgM抗HAV | 血清 | 症状出现后尽快(可在6个月内检测到) | 用于检测HAV和HBV感染血清学标记的所有血清可以短期保存在室温、冷藏(< 48小时)下。对于超过48小时的储存,血清应冷冻。 | 遵循血清分离的标准程序。 |
| 甲型肝炎 | 全面反HAV
注:测量IgM和IgG。 IgG抗HAV |
血清 | 没有时间限制 | 样品可以在环境温度下短期冷藏(< 48小时)。对于超过48小时的储存,血清应冷冻。 | 遵循血清分离的标准程序。 |
| 甲型肝炎 | PCR检测HAV RNA | 血清 | 症状出现后尽快(最多2周可检测到) | 储存和运输冷冻样品 | 遵循血清分离的标准程序。 |
| 乙型肝炎 | IgM抗HBc | 血清 | 症状出现后尽快(可在6个月内检测到) | 样品可以在环境温度下短期冷藏(< 48小时)。对于超过48小时的储存,血清应冷冻。 | 遵循血清分离的标准程序。 |
| 乙型肝炎 | 乙型肝炎表面抗原
注意:HBsAg阳性结果应按照每项检测的包装说明书中的规定通过HBsAg中和检测进行确认。 |
血清 | 症状出现后尽快 | 样品可以在环境温度下短期冷藏(< 48小时)。对于超过48小时的储存,血清应冷冻。 | 遵循血清分离的标准程序。 |
| 乙型肝炎 | 抗HBs | 血清 | 接种疫苗后1-2个月 | 样品可以在环境温度下短期冷藏(< 48小时)。对于超过48小时的储存,血清应冷冻。 | 遵循血清分离的标准程序。 |
| 流行性感冒 | 培养/病毒分离 | 鼻洗液、鼻咽抽吸物、鼻/咽拭子、经气管抽吸物、支气管肺泡灌洗 | 发病72小时内 | 如果要在72小时内进行测试,则在4℃下运输样本;否则,冻结在-70℃,直到可以进行测试。 | |
| 流行性感冒 | 抗原检测和RT-PCR | 鼻洗液、鼻咽抽吸物、鼻/咽拭子、含漱液、经气管抽吸物、支气管肺泡灌洗 | 发病72小时内 | 如果要在72小时内进行测试,则在4℃下运输样本;否则,冻结在-70℃,直到可以进行测试。 | 注意:保存一份临床样本用于确认和分离。病毒分离株可进一步以世卫组织/CDC为特征。 |
| 麻疹 | 病毒分离法
逆转录聚合酶链反应 |
鼻咽抽吸物、咽拭子、尿液、肝素化血液 | 与血清学样本同时收集(最好在出疹3天内) | 如果要在72小时内进行测试,则在4℃下运输样本;否则,冻结在-70℃,直到可以进行测试。 | 注:PCR用于基因分型。从出疹开始最多收集10天。 |
| 麻疹 | IgM抗体 | 血清 | 出疹后尽快,如果第一次呈阴性,则在出疹后72小时重复 | 冷藏运输 | 注意:IgM在皮疹出现后至少30天内是可检测的。 |
| 麻疹 | IgG抗体 | 配对血清 | 急性:皮疹出现后尽快(最迟7天) 康复期:急性后14-30天 |
||
| 脑膜炎球菌病 | 培养**
注:要求实验室对脑膜炎球菌分离 |
血 | 尽快 | 带肉汤的血培养瓶
或者 裂解离心管 |
|
| 脑膜炎球菌病 | 培养**
注:要求实验室对脑膜炎球菌分离 |
脑脊髓液
或其他通常无菌位置 |
尽快 | 无菌螺旋盖试管 | |
| 脑膜炎球菌病 | 血清分组玻片凝集 | 从培养物中分离(如上) | 斜面、冷冻、冻干
或者 硅胶包。 |
||
| 脑膜炎球菌病 | PCR用于检测和血清分型 | 任何通常无菌的地方 | 尽快 | 用蓝色冰袋冷冻 | |
| 脑膜炎球菌病 | 抗原检测 | 任何通常无菌的地方 | 尽快 | 用蓝色冰袋冷冻 | |
| 腮腺炎 | 病毒分离法
逆转录聚合酶链反应 |
口腔/腮腺拭子;脑脊液仅用于无菌性脑膜炎;睾丸炎病例的尿液 | 理想的是腮腺炎发作后0-3天,但最多10天 | 如果要在72小时内进行测试,则在4℃下运输样本;否则,冻结在-70℃,直到可以进行测试。 | 在采集拭子前,按摩唾液/腮腺区30秒。 |
| 腮腺炎 | IgM抗体 | 血清 | 理想情况是腮腺炎发作后3天 | 在干冰上冻结的船 | |
| 腮腺炎 | IgG抗体 | 成对血清用于血清转化
或者 效价上升4倍 |
急性:理想情况下,腮腺炎发作后0-3天康复期:急性后2周 | 在干冰上冻结的船 | 不建议以前接种过疫苗的人将效价提高四倍。 |
| 百日咳 | 培养
注意:尽快接种选择性初级分离培养基,如木炭马血琼脂或博代-根沟培养基。 阴性培养不排除百日咳。 |
后部鼻咽拭子或抽吸物 | 在咳嗽发作的前两周内 | 拭子:4℃下半强度木炭马血琼脂
里根-洛运输公司的拭子 吸出物:在4℃的带盖注射器中的盐水中 |
使用聚酯(如涤纶)、人造丝或尼龙鼻咽拭子。首选植绒棉签。轴可以是柔性塑料、铝或绞合线。通过将少量盐水引入鼻咽腔并将其收集在注射器中,可以用注射器和导管收集吸出物。 |
| 百日咳 | 聚合酶链式反应
注意:如果可能的话,PCR应该通过培养来验证。 |
鼻咽拭子或抽吸物 | 在咳嗽发作的前两周内 | 里根-洛运输公司的拭子在4◦C
在4时,吸出带盖注射器中的盐水◦C 仅用于PCR检测时,可将拭子放在无菌试管中,并在4℃(短期储存)或-20℃或更低温度(长期储存)下运送 |
使用聚酯(如涤纶)人造丝,或尼龙咽拭子。首选植绒棉签。轴可以是柔性塑料、铝或绞合线。通过将少量盐水引入鼻咽腔并将其收集在注射器中,可以用注射器和导管收集吸出物。 |
| 百日咳 | 血清学 | 血清 | 咳嗽发作2至8周 | 4℃下的短期;长期处于-20℃或以下 | 出于国家监测的目的,目前不接受血清学结果作为实验室确认。 |
| 肺炎球菌疾病 | 培养 | 正常无菌区 | 在临床疾病发作后但在使用抗生素前尽快进行 | 带肉汤或裂解离心管的血液培养瓶,或者,如果来自另一个无菌场所,则为无菌的带螺旋盖的试管 | 在24小时内收集2份单独的血液样本。大多数其他无菌标本(如脑脊液)仅收集一次。 |
| 肺炎球菌疾病 | 聚合酶链式反应 | 正常无菌区 | 尽快,给药后不久抗生素是一个可行的选择 | 发送冷冻在蓝色冰袋上的标本 | 聚合酶链式反应 |
| 肺炎球菌疾病 | 血清型PCR推断 | 培养阴性无菌部位标本 | 标本立即冷冻 | 血清型PCR推断 | |
| 肺炎球菌疾病 | 敏感性测试 | 纯培养物 | 倾斜、冷冻或二氧化硅包装 | 敏感性测试 | |
| 肺炎球菌疾病 | 血清型 | 纯培养物 | 倾斜、冷冻或二氧化硅包装 | 血清型 | |
| 脊髓灰质炎 | 培养 | 粪便、咽拭子、脑脊液 | 严重的 | 无菌螺旋盖容器 | 大便无载体;拭子用盐水缓冲液
注意:保持冷冻或迅速运送到实验室;避免拭子样本干燥。 |
| 脊髓灰质炎 | 类型内分化 | 从培养物中分离(如上) | 注意:保持冷冻或迅速运送到实验室;避免拭子样本干燥。 | ||
| 脊髓灰质炎 | 血清学 | 配对血清 | 急性:尽快
恢复期:急性发作后3周 |
||
| 轮状病毒胃肠炎 | EIA,RT-PCR,qRT-PCR,基因分型,测序 | 凳子 | 患病第一至第四天最佳 | 无菌螺旋盖容器 | 散装大便
保持冷冻或用冰袋迅速运送到实验室;避免多次冻融循环。 |
| 轮状病毒相关癫痫发作 | 逆转录聚合酶链反应 | 脑脊髓液 | 症状开始后尽快 | 无菌螺旋盖容器 | 没有运营商。
保持冷冻;避免多次冻融循环。 |
| 风疹 | IgM抗体 | 血清 | 尽快,如果第一次阴性,在发病后96小时重复 | 保持在4摄氏度 和冰上的船 |
|
| 风疹 | IgG抗体 | 血清
配对血清 |
严重的:皮疹发作后尽快(最迟7天)
康复期:急性后14-30天 |
保持在4℃并在冰上运输 | 配对血清必须平行运行 |
| 风疹 | 培养/聚合酶链反应 | 鼻咽拭子/洗液、咽拭子、尿液。 | 与血清学样本同时收集(最好在皮疹发病3天内,且不迟于发病后10天) | 病毒运输介质;船舶冻结或在冰上 | 注意:保持冻结 (尿液除外)或迅速运送到实验室;避免拭子样本干燥。 |
| 先天性风疹综合征 | IgM抗体 | 血清 | 出生后6个月内尽快 | 保持在4℃并在冰上运输 | |
| 先天性风疹综合征 | IgG抗体 | 血清 | 9月龄后,接种MMR疫苗前 | 保持在4℃并在冰上运输 | 注:确认是通过记录血清IgG滴度的持续时间超过母体IgG抗体被动转移的预期时间。 |
| 先天性风疹综合征 | 培养/聚合酶链反应 | 鼻咽拭子/洗液、尿液、血液、白内障 | 尽快进行确认;监测阳性病例的脱落情况;3个月后,每月一次,直到培养结果反复为阴性 | 病毒运输介质;船舶冻结或在冰上 | 注意:保持冷冻(尿液除外)或迅速运送到实验室;避免拭子样本干燥。 |
| 水痘 | 血清学 | 血清 | 免疫状态:除了在急性疾病期间,随时收集
配对血清学诊断:发病7-10天内为急性 |
单个IgG测定可用于评估免疫状态。
配对血清区分近期原发感染和既往感染。 |
|
| 水痘 | VZV IgG亲和力 | 血清应在干冰上冷冻运输或在冷包装中冷藏 | |||
| 水痘 | VZV PCR | 来自囊泡、鼻腔或咽喉拭子、血清、脊髓液、尿液、支气管树冲洗液或发炎关节的液体 | 出现皮疹和新水疱后2-3天出现急性疾病 | 明确诊断;高度灵敏、特异和快速 | |
| 水痘 | 疫苗野生型鉴别 | 来自水疱、痂、唾液的物质 | 从皮疹出现的第一天直到结痂的损害消退 | 水泡拭子和痂可以在环境温度下干燥运输;唾液在干冰上冷冻运输或在冷包装上冷藏。 | 利用实时PCR方法策略分析疫苗相关SNP:可用性仅限于专业实验室,如CDC、哥伦比亚大学和疫苗可预防疾病参考中心 |
** 脑膜炎奈瑟菌不能对送到CDC的标本进行培养,但CDC可以提供建议并回答关于培养方法的问题。
A.白喉(参见第1章)
用于确认感染的诊断测试包括通过培养分离白喉棒状杆菌和埃莱克试验分离出白喉毒素(1-3)。CDC百日咳和白喉实验室定期进行培养以确认白喉棒状杆菌也是目前美国唯一测试毒素产生的实验室。尽管目前还没有其他确认白喉的测试方法,但CDC可以对临床标本进行聚合酶链式反应(PCR)测试,以确认潜在产毒菌株的感染(4) 。PCR可以检测非活菌白喉棒状杆菌抗生素治疗开始后采集的标本中的微生物。
CDC百日咳和白喉实验室进行的用于白喉毒素基因的种属鉴定和检测的PCR和MALDI-TOF为诊断提供了支持性证据,但不能证实毒素的产生。当这些试验用于分离物时,应始终与确认毒素产生的试验结合,如埃莱克试验。
如果基于现有的实验室检测诊断或病例分类不直接,CDC建议咨询其白喉主题专家进行进一步讨论。
通过培养分离白喉棒状杆菌
通过细菌培养分离白喉棒状杆菌对确认白喉是必要的。应考虑以下几点:
当怀疑白喉(涉及任何部位)时,即使已经开始用抗生素治疗,也应尽快获取临床标本进行培养。
标本应取自白喉感染部位、鼻、喉,如果有的话,还应取自白喉膜。如果可能的话,也应该从膜下提取拭子。
其他病原体可在喉咙和扁桃体上形成一层膜,包括下列病原体。应鼓励患者的医疗保健提供者在适当的时候进行实验室检测,以排除这些情况和微生物,包括
o链球菌,
o爱泼斯坦-巴尔病毒和巨细胞病毒(两者都引起传染性单核细胞增多综合征),
o溶血阿卡诺杆菌,
o白色念珠菌,以及
o梭形细菌(可导致文森特心绞痛)。
实验室应警惕白喉的嫌疑,因为白喉棒状杆菌借助于含有亚碲酸盐的特殊培养基。
应从所有疑似白喉患者及其密切接触者处获取鼻和喉标本(即鼻和口咽拭子)进行培养。
的分离白喉棒状杆菌来自密切接触者的可能确诊病例,即使患者的培养呈阴性。
生物型测试
在白喉棒状杆菌已经被分离出来后,生物型(亚系)应该被确定。这4种生物型是重症型、轻症型、中间型和贝凡提型。
产毒性测试
除了确定生物型外,还应使用埃莱克试验进行产毒性试验,以确定白喉棒状杆菌分离会产生毒素。这些测试在许多临床微生物实验室中不容易获得;分离株应送至精通检测的参考实验室。
聚合酶链式反应测试
如果需要,为培养检测收集的临床标本也可用于CDC的PCR检测。因为分离白喉棒状杆菌并不总是可能的(许多患者在考虑白喉诊断时已经接受了几天的抗生素),PCR可以为白喉的诊断提供额外的支持证据。PCR试验允许检测白喉毒素基因(毒药),通过检测RNA聚合酶基因(rpoB识别白喉棒状杆菌),以及检测白喉溃疡和白喉假结核病,还以rpoB为目标。然而,白喉溃疡和白喉假结核病在该分析中彼此没有区别。
质谱分析MALDI-TOF
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)是一项附加技术(5 ),可用于快速鉴定细菌种类,例如白喉棒状杆菌。这项技术需要一种分离物来鉴定微生物细胞的蛋白质组成。然而,这种形式的检测仅确认细菌种类,不确认白喉毒素的产生,并且CDC百日咳和白喉实验室不提供这种检测。
血清学测试
在使用抗毒素之前,测量患者的白喉毒素血清抗体可能有助于评估诊断白喉的可能性。高抗体水平可能表明对白喉的保护,和白喉棒状杆菌感染不太可能导致严重疾病。然而,如果抗体水平低,就不能准确地排除白喉。州卫生部门或疾病预防控制中心可以提供提供这种测试的实验室的信息;很少有实验室有能力准确检测抗体水平。
提交白喉棒状杆菌分离株和临床标本
所有分离的白喉棒状杆菌应送至CDC百日咳和白喉实验室进行参考检测。疑似白喉患者的临床标本,如已释放白喉抗毒素进行治疗,也应送至CDC百日咳和白喉实验室进行培养、PCR和产毒性试验。虽然不可报告,但如果白喉溃疡或者白喉假结核病要求管辖区向CDC百日咳和白喉实验室提交可用的标本或分离物以进一步鉴定。
临床标本(拭子、膜片、心脏活检组织)可以按照中的当前指导运送到CDC疾病控制中心测试订单目录。有关标本收集和运输的详细信息以及安排PCR检测,州卫生部可致电404-639-3158联系脑膜炎和疫苗可预防疾病处,以便联系适当的工作人员。
B.流感嗜血杆菌b型(Hib)侵袭性疾病(参见第2章)
通过革兰氏染色或抗原检测进行推定鉴定
革兰氏染色是一种根据细菌细胞壁的化学和物理特性将细菌物种分成两大类的经验方法。革兰氏阳性菌保留主要染色,而革兰氏阴性菌呈现复染的颜色。革兰氏染色也可以用来评估临床标本的质量。革兰氏染色有助于初步鉴定可能,流感嗜血杆菌虽然不是验证性测试,但无法区分b型流感嗜血杆菌(Hib)血清型。
因为b型荚膜抗原可以在体液中检测到,包括患者的尿液、血液和脑脊液(CSF ),所以临床医生经常要求进行快速抗原检测试验来诊断Hib疾病。抗原检测可作为培养或PCR的辅助手段,特别是在获取标本进行培养前对接受抗微生物药物治疗的患者进行诊断时。抗原检测的方法是乳胶凝集,这是一种用于检测脑脊液中Hib荚膜多糖抗原的快速而敏感的方法;但是,可能会出现假阴性和假阳性反应。
如果在脑膜炎患者的CSF中检测到Hib抗原,但未从无菌部位的培养中获得阳性结果,则该患者应被视为可能患有Hib疾病,并据实报告。因为抗原检测试验可以在没有侵袭性Hib疾病的人的尿液和血清中呈阳性,所以仅通过尿液或血清中的阳性抗原试验确定的人不应被报告为病例。
通过培养和PCR确认
确诊Hib病例需要分离流感嗜血杆菌或者检测来自正常无菌身体部位的流感嗜血杆菌DNA。通常,用于分离侵入性的无菌场所流感嗜血杆菌通常包括CSF、血液、关节液、胸腔积液、心包积液、腹膜液、皮下组织液、胎盘和羊水。大多数医院和商业微生物实验室都有能力分离流感嗜血杆菌。分离的流感嗜血杆菌建议检测对氨苄西林、第三代头孢菌素之一、氯霉素和美罗培南的药物敏感性。对于从怀疑治疗或化学预防失败的病例或疫情中获得的分离株,应考虑进行进一步的抗生素敏感性试验。
虽然培养是确认流感嗜血杆菌的黄金标准,实时PCR是一种可接受的替代方法。近年来,流感嗜血杆菌PCR检测的灵敏度和特异性都有了很大的提高。实时PCR分析可用于检测以下血液、脑脊液或其他临床标本中的所有6种血清型流感嗜血杆菌的DNA。PCR的一个主要优点是它允许检测通过培养方法无法检测到临床样本中的流感嗜血杆菌,如在获取临床样本进行培养之前,患者已经接受了抗生素治疗。即使当微生物在抗菌处理后不能存活时,PCR仍然可以检测流感嗜血杆菌DNA。需要分离细菌来测试抗生素敏感性。
现在可以获得几种商业多重PCR测定法,其能够同时检测单个样本中引起血液感染或脑膜炎/脑炎的一系列病原体,主要用于临床设置(例如,来自BioFire Diagnostics的FilmArray血液培养鉴定小组和FilmArray脑膜炎/脑炎小组,以及来自ARUP实验室的PCR脑膜炎/脑炎小组)[6–10]。尽管这种分析可以快速鉴定 流感嗜血杆菌(嗨)还有脑膜炎奈瑟菌(Nm)种,大多数不确定血清型或血清群。因此,如果鉴定出Hi或Nm,使用不确定血清型/血清群的检测的实验室进行同时培养或反射培养是很重要的。最低限度,实验室应收集并保存足够的临床样本,以便在实验室用可检测血清型/血清群的PCR检测进行进一步检测。
血清型测试
血清分型将包括Hib在内的有包膜菌株与无法进行血清分型的无包膜菌株区分开来。6种被囊化的类型(命名为a-f)具有不同的荚膜多糖,可以通过与类型特异性抗血清的玻片凝集进行区分。
为了做出有关化学预防的公共卫生决策,微生物实验室应及时对流感嗜血杆菌分离株和流感嗜血杆菌阳性的临床标本进行血清型检测[11,12]。即使Hib疾病已经减少,实验室仍应继续常规血清分型。如果实验室无法进行血清分型,实验室人员应联系州卫生部门。州卫生部门如对血清分型有疑问,应联系CDC脑膜炎和疫苗可预防疾病分支实验室,电话404-639-3158。
分子分型
虽然没有广泛应用,全基因组测序(WGS)已被用于分型 流感嗜血杆菌分离以评估它们的遗传相似性。通过脉冲场凝胶电泳(PFGE)对Hib细菌进行分型[13-15]或多位点序列分型(MLST)也可用于流行病学目的,在没有WGS的地方。一些分型方法,如外膜蛋白、脂多糖或酶电泳,不再被推荐或实施,因为它们不可靠或过于耗费人力。州卫生部门可能会将有关分型的问题提交给CDC脑膜炎和疫苗可预防疾病分支实验室,电话:404-639-3158。
C.甲型肝炎(参见第3章)
用于确认甲型肝炎病毒(HAV)感染的诊断试验包括血清学试验,偶尔也包括基于PCR的病毒基因组扩增和测序试验。
血清学测试
由于临床或流行病学特征重叠,需要进行血清学试验来区分甲型肝炎和其他类型的病毒性肝炎。几乎所有甲型肝炎患者都有可检测到的免疫球蛋白M (IgM)抗HAV抗体。急性HAV感染在感染的急性或恢复期早期通过血清中存在IgM抗HAV而得到证实。用于IgM抗HAV检测的血清应在症状出现后尽快获得,因为IgM抗HAV一般在症状出现后6个月内消失。
免疫球蛋白G (IgG)抗HAV抗体出现在感染的急性期或恢复期,在人的一生中都存在,并赋予对疾病的持久保护。总抗HAV抗体测试测量IgG抗HAV和IgM抗HAV。抗HAV抗体完全阳性且IgM抗HAV抗体阴性的人被认为是免疫的,无论是来自过去的感染还是疫苗接种史。IgG抗HAV测试也是可用的。
疾病控制中心实验室特别研究
偶尔,分子病毒学方法,如基于PCR的分析,被用于扩增和测序病毒基因组。分子流行病学方法有助于理解HAV在具有相似危险因素的人群网络中的传播。当与常规流行病学方法结合使用时,HAV测序在调查疫情和确定传播联系方面也很有用[16]。然而,出于常规监测目的,检测血清学标记物——完全抗HAV,或IgG抗HAV,和IgM抗HAV——是足够的可操作信息。
对2007年至2013年在美国作为甲型肝炎强化监测的一部分收集的标本进行测序;聚合酶链反应检测753例标本中,472例(62.7%)为HAV RNA阳性。对2013年至2016年食品安全项目A13FBM的其他标本进行了测序:373份可用标本中有98份(26.3%)为HAV RNA阳性。这570例标本中的HAV基因型为:IA (83.2%)、IB (16.0%)和IIIA (0.9%) (CDC病毒性肝炎实验室分部,未公布数据)。
对分子病毒学方法有疑问的提供者应咨询他们的州卫生部门或CDC病毒性肝炎分部,实验室分部(仅限CDC内部访问。)
D.乙型肝炎(参见第4章)
用于确认乙型肝炎病毒(HBV)感染的诊断检测包括各种血清学标记,可区分感染的不同阶段和分子检测,可提供HBV感染个体的滴度、基因型和逃逸突变信息。
血清学标记试验
可用于评估HBV感染的实验室检测包括乙型肝炎表面抗原(HBsAg)、HBsAg总抗体(总抗-HBs)的检测;抗HBV核心抗原的总抗体和IgM抗体(总抗体和IgM抗HBc抗体)和抗乙肝e抗原的总抗体(总抗HBe抗体)。所有这些测试在临床实验室使用的自动化平台上都可以买到。HBV实验室检测算法是复杂的,它通常以逐步的方式进行,从HBsAg检测开始。
HBsAg的存在表明正在进行的HBV感染和潜在的传染性。在新感染者中,HBsAg在接触以下物质后30-60天出现在血清中乙型肝炎病毒。抗-HBc抗体在所有HBV感染中出现,在急性HBV感染的症状或肝脏检查异常开始时出现,迅速上升到高水平,并持续终生。急性或新近获得的感染可通过存在IgM类抗-HBc来区分,这种感染可持续约6个月。
从HBV病毒感染中康复的人,通常在2-3个月内,血液中的HBsAg被清除,并产生乙肝表面抗原抗体(抗-HBs)。水平等于或高于10 mIU/ml的抗-HBs抗体的存在表明对HBV感染的免疫性。接种乙肝疫苗的人也会产生抗乙肝病毒抗体。免疫个体和先前感染个体之间的差异可以基于乙型肝炎核心的总抗体(总抗-HBc)来确定。从自然感染中恢复后,大多数人抗-HBs和抗-HBc抗体都呈阳性,而在成功接种乙肝疫苗的人中仅出现抗-HBs抗体。未从HBV感染中恢复并成为慢性感染的人仍保持HBsAg(和抗-HBc)阳性,尽管这些人中有一小部分(每年0.3%)可能最终清除HBsAg并出现抗-HBs抗体[17]。
在某些情况下,抗HBc是唯一检测到的血清学标志。在HBV感染后,已康复但抗-HBs水平下降的人或抗-HBs未发展的人可出现孤立的抗-HBc。某些慢性感染者可能单独抗-HBc呈阳性,其HBsAg水平低于可通过商业途径检测到的水平,或由于S基因突变而无法通过这些检测到。HBsAg阳性母亲所生且未被感染的婴儿也可能在出生后长达24个月内从被动转移的母体抗体中检测到抗-HBc[18]。
乙型肝炎病毒感染引起的急性肝炎的诊断通过乙型肝炎核心抗原IgM抗体(IgM抗-HBc)阳性试验在血清学上得到证实。应根据需要通过HBsAg中和试验确认HBsAg阳性结果。除了急性HBV感染,围产期HBV感染和慢性HBV感染都是可报告的疫苗可预防的疾病。HBV慢性感染通过HBsAg阳性检测伴有IgM抗HBc阴性检测或间隔至少6个月的2次HBsAg阳性检测结果来确认。围产期HBV感染的诊断是通过在美国或美国领土上出生的、母亲HBsAg阳性的1-24个月大的婴儿的HBsAg阳性检测来确诊的。表4总结了乙型肝炎血清学检测结果的解释。
表4.乙型肝炎血清学试验的解释。
| 解读乙型肝炎血清学试验 | ||||
| 血清学标记 | 解释 | |||
| 乙型肝炎表面抗原* | 总抗HBc† | IgM抗HBc§ | 抗HBs¶ | |
| – | – | – | – | 易感,从未感染,也未免疫 |
| + | – | – | – | 急性感染,早期潜伏期** |
| + | + | + | – | 急性传染 |
| – | + | + | – | 急性溶解感染 |
| – | + | – | + | 既往感染、痊愈和免疫 |
| + | + | – | – | 慢性感染 |
| – | + | – | – | 假阳性(即易感)、既往感染或“低水平”慢性感染 |
| – | – | – | + | 如果效价≥10 mIU/ml,则免疫 |
*乙型肝炎表面抗原。
†乙型肝炎核心抗原抗体。
§免疫球蛋白M。
¶乙型肝炎表面抗原抗体。
**在接种疫苗期间,某些患者可能会检测到短暂的HBsAg阳性(持续时间少于18天)。
血清中乙肝e抗原(HBeAg)阳性表明病毒复制活跃[19]。HBeAg是前核心开放阅读框(ORF)的分泌产物,在急性和慢性感染患者中均有发现。从HBeAg自发转化为抗乙肝e抗原的抗体(抗-HBe)可能表明HBV水平较低。HBeAg阳性的母亲将HBV病毒传染给未出生婴儿的风险增加,需要在出生后立即进行及时的预防性干预[20]。
分子分析
基于聚合酶链反应(PCR)的方法用于确定HBV病毒载量(定量测试)和HBV DNA存在(定性测试):它们既可作为商业美国食品药品监督管理局(FDA)批准的测试,也可作为实验室开发的测试(laboratory developed tests ,LDTs)。HBV DNA检测最常用于评估被诊断为HBV病毒感染、正在接受或正在考虑接受治疗的患者;这些测试通常不用于感染的初步诊断。也可以通过基于PCR的技术来确定基因型,并且可以作为LDTs获得,最常见的是基于S基因序列[21]。
基于PCR的HBV基因组特定区域的扩增或深度测序方法,结合流行病学研究,可用于调查乙型肝炎感染的共同来源爆发,如丙型肝炎病毒感染[22]。此外,HBV准种多样性可用于评估疾病进展。HBV基因组的前S区与肝细胞癌的疾病进展相关[23]。此外,分子分析对于检测疫苗逃避突变体、诊断失败突变体和治疗抗性突变体的出现是必不可少的[24,25]。这些类型的突变在不同的HBV基因型中以不同的比率出现,因此了解基因型信息对于患者的诊断和治疗至关重要。在HBsAg阳性妇女的接种过疫苗的婴儿中检测HBV疫苗逃逸突变体对于确定它们在疫苗失败中的潜在作用是重要的[26]。对分子病毒学方法有疑问的卫生保健专业人员或在接种疫苗的人群中发现HBsAg阳性事件的人员应咨询他们所在州的卫生部或疾病预防控制中心病毒性肝炎部流行病学分部。
E.流感(参见第6章)
可用于诊断流感的方法包括病毒分离(标准方法和快速培养测定)、分子检测(逆转录酶-聚合酶链反应[RT-PCR])、病毒抗原检测(酶免疫测定[EIA]、免疫荧光抗体[IFA]和市售快速诊断试剂盒),以及较少使用的免疫组织化学[IHC]、电子显微镜和使用血凝抑制或微中和的血清学试验[27,28]。
病毒分离和快速培养试验
病毒分离是流感诊断的金标准。应考虑以下准则。
合适的样本包括鼻洗液、鼻咽抽吸物、鼻腔和咽喉拭子、经气管抽吸物和支气管肺泡灌洗。
应在发病72小时内采集样本,以最大限度地提高分离病毒的可能性。
使用免疫学方法检测细胞培养物中的病毒抗原的快速培养试验是可行的。这些检测可以在18-40小时内提供结果,而从标准培养中获得阳性结果平均需要4-5天。
分子测试方法
RT-PCR,包括实时RT-PCR,可用于检测临床标本中流感病毒的存在,或用于表征在组织培养物或含胚卵中生长的流感病毒。这种检测可以在生物安全等级2的条件下进行,即使是对于像禽流感A(H5N1)这样的病毒,也需要生物安全等级3并加强病毒培养。
抗原检测分析
存在几种直接从临床材料中诊断流感感染的方法:
1.可以使用免疫荧光抗体对来自临床样品的细胞进行染色,以寻找病毒抗原的存在。鼻洗液、鼻咽吸出物、鼻腔和咽喉拭子、含漱液、经气管吸出物和支气管肺泡灌洗液是合适的临床标本。
2.检测病毒抗原存在的市售试剂盒分为三组:第一组仅检测甲型流感病毒;而第二种检测甲型和乙型流感病毒,但不区分病毒类型;第三种检测甲型和乙型流感病毒并区分两者。这些快速抗原检测测试的结果可在不到1小时内获得,尽管这些测试通常不如RT-PCR测试灵敏(通常约50%-70%)[29-32]。
3.其他不常用的方法包括免疫染色和通过电子显微镜观察病毒抗原。该方法和RT-PCR方法也可分别用于检测死后呼吸组织样品中的流感抗原和核酸。
当直接抗原检测方法用于诊断流感时,收集并保留一份临床样本用于可能的进一步检测是很重要的。某些快速检测方法中用于保存标本的培养基不适用于病毒培养;在这种情况下,有必要收集两个单独的样本。这些额外或保留的样本可用于确认培养的直接检测结果,并对甲型流感病毒分离株进行分型。
血清学测试
流感感染的血清学诊断需要成对的血清标本。急性期样本应在发病1周内收集,恢复期样本应在大约2-3周后收集。
血凝抑制(HI)试验是血清学诊断的首选方法。当同时检测时,阳性结果是急性期和恢复期样品之间的滴度升高4倍或更多。血清学测试结果通常在24小时内可以得到。
血清学测试在特殊研究中最有用;由于缺乏标准化的检测方法和解释,流感血清学诊断不用于国家监测。
F.麻疹(参见第7章)
血清学测试
麻疹抗体的血清学检测可以广泛获得。一般来说,在暴露于野生型麻疹病毒的易感人群中,IgM反应在皮疹发作时开始,并可在1-2个月内检测到。IgG反应开始较慢,大约在皮疹发作后5-10天,但通常持续一生。急性麻疹感染的诊断可通过检测单一血清标本中的麻疹IgM抗体或通过检测血清转化来进行——在大约相隔2周获得的2份血清标本中IgG抗体滴度升高4倍。未受感染的人是IgM阴性,但根据他们以前的疾病或疫苗接种史,将是IgG阴性或IgG阳性。
在与疑似麻疹病例患者首次接触时获得的单一血清标本中进行麻疹IgM抗体的EIA试验是诊断急性麻疹的推荐方法之一。
单个样本的IgG测试是最常用的麻疹免疫测试,因为IgG抗体是持久的。
对于疑似麻疹病例,建议同时检测IgG和IgM。
配对血清(急性和恢复期)可检测血清转化或麻疹IgG抗体升高4倍,以确认急性麻疹感染。
当疑似麻疹患者最近接种过疫苗(皮疹发作前6-45天)时,IgM和IgG抗体反应都不能区分接种疫苗后的麻疹疾病和皮疹。在这种情况下,应获得病毒咽喉或鼻咽拭子标本,以便CDC可以尝试区分疫苗病毒和野生型病毒(表5)。
表5.麻疹酶免疫分析结果解读*
| IgM结果 | IgG结果 | 既往感染史 | 当前感染 | 评论 |
| + | –或+ | 未接种疫苗,无麻疹病史 | 最近接种了第一剂麻疹疫苗 | 血清转化。IgG反应取决于标本收集的时间。 |
| + | –或+ | 未接种疫苗,无麻疹病史 | 野生型麻疹 | 血清转化。典型的临床麻疹。IgG反应取决于标本收集的时间。 |
| + | –或+ | 以前接种过疫苗,初次接种失败 | 最近接种了第二剂麻疹疫苗 | 血清转化。IgG反应取决于标本收集的时间。 |
| – | + | 以前接种过,IgG+ | 最近接种了第二剂麻疹疫苗 | IgG水平可能保持不变,也可能升高。 |
| + | + | 以前接种过,IgG+ | 野生型麻疹 | 可能很少或没有症状(例如,没有发烧或皮疹)。 |
| + | + | 最近接种过疫苗 | 暴露于野生型麻疹 | 无法区分疫苗或野生型病毒;根据流行病学进行评估。† |
| – | + | 自然麻疹的遥远历史 | 疫苗 | IgG水平可能保持不变,也可能升高。 |
| + (至少在部分患者中) |
+ | 自然麻疹的遥远历史 | 野生型麻疹 | 可能很少或没有症状。 |
*这些结果是使用捕获IgM和间接IgG酶免疫测定时的预期结果,由于技术和灵敏度/特异性不同,可能不适用于不同的测定。
但是,在这种情况下,IgM测试将会有所帮助。如果呈阴性,就可以排除野生型麻疹感染。
IgM抗体测试。尽管存在多种可能的IgM抗体检测方法,EIA是最稳定准确的检测方法,因此是推荐的方法。IgM测试有两种形式。第一种也是最广泛使用的是间接方式,它需要一个特定的步骤来去除IgG抗体。清除IgG抗体的问题会导致假阳性[33]或者不太常见的假阴性结果。
第二种形式,IgM捕获,不需要去除IgG抗体。这是麻疹的首选参考测试。
麻疹的EIA测试通常在出疹当天呈阳性。然而,在皮疹出现后的最初72小时内,高达30%的IgM检测可能会给出假阴性结果。出疹后72小时内呈阴性的测试应重复进行;应在皮疹发作72小时后采集血清进行重复检测。IgM可在皮疹发作后至少28天内检测到,通常时间更长[34]。
当怀疑实验室IgM检测结果为假阳性时,可进行额外的检测。麻疹IgM结果假阳性可能是由于血清标本中存在类风湿因子。从患有其他皮疹疾病(如细小病毒B19、风疹和玫瑰疹)的患者中采集的血清标本在某些麻疹IgM检测中被观察到会产生假阳性反应。当全面监测显示无病例来源或传播时,当病例不符合临床病例定义时,或当IgG结果在皮疹发作3天内呈阳性时,可能怀疑假阳性试验。在这些情况下,确认测试可以在国家公共卫生实验室或疾病控制中心进行。通过EIA以外的测试获得的IgM结果可以通过EIA进行验证。间接EIA测试可通过捕获EIA进行验证。
IgG抗体测试。因为IgG测试需要2份血清标本,并且在获得第二份标本之前无法做出确诊,所以IgM测试通常是首选。然而,如果IgM试验仍然没有结果,在第一份(急性期)标本后14-30天收集的第二份(恢复期)血清标本可用于检测IgG滴度的增加。这些测试可以在国家实验室或疾病预防控制中心进行。有多种检测麻疹IgG抗体的方法;这些包括EIA、间接荧光抗体测试和蚀斑减少中和。补体结合虽然在过去被广泛使用,但不再被推荐。近期麻疹病毒感染血清学证据的“金标准”试验是急性期和恢复期配对血清中IgG的蚀斑减少中和试验。
实验室确认麻疹的成对IgG检测需要证明麻疹抗体滴度上升了4倍。IgG抗体检测应同时在急性期和恢复期标本上进行。两个样本应进行相同类型的测试。记录滴度增加的具体标准取决于测试。EIA值不是滴度,EIA值的增加并不直接对应于滴度的增加。
RT-PCR和病毒分离
在培养物中分离麻疹病毒或在临床标本中通过RT-PCR检测麻疹病毒可确诊麻疹。由于病毒分离可能需要数周时间,因此RT-PCR是确诊病例的首选方法。值得注意的是,阴性培养或RT-PCR结果并不能排除麻疹,因为检测结果受临床标本的时间、质量和处理的影响很大。如果通过RT-PCR分离或检测到麻疹病毒,该病毒基因型可用于分子流行病学,并区分由野生型麻疹病毒引起的麻疹疾病和麻疹疫苗反应。
病毒分离和RT-PCR对于分子流行病学监测非常重要,有助于确定:
病毒的起源,
哪些病毒株在美国传播,以及
这些病毒株是否已经成为美国的地方病。
一旦麻疹得到确认,从临床疑似麻疹病例中获得的用于病毒分离的标本(尿液、鼻咽抽吸物、肝素化血液或咽拭子)应立即运送至州公共卫生实验室或州卫生部门指示的CDC。在等待病例确认期间,标本应妥善储存(参见附录7[2页])。用于病毒分离的临床标本应与血清学检测的样本同时采集。由于在出疹3天内采集标本时更有可能分离出病毒,因此在获得实验室确认之前,不应延迟采集用于病毒分离的标本。理想情况下,临床标本应在出疹后7天内采集,如果出疹后超过10天,则不应采集。
G.脑膜炎球菌疾病, 脑膜炎奈瑟菌(参见第8章)
脑膜炎球菌鉴定
革兰氏染色推定鉴定:革兰氏染色是一种根据细菌细胞壁的化学和物理特性将细菌物种分成两大类的经验方法。革兰氏阳性菌保留主要染色,而革兰氏阴性菌呈现复染的颜色。革兰氏染色也可以用来评估临床标本的质量。脑膜炎球菌革兰氏染色是常用的,并且仍然是推定识别的可靠和快速的方法。脑脊液中的细胞内革兰氏阴性双球菌可被认为是脑膜炎球菌,除非有其他证据。
通过抗原检测的推定识别:乳胶凝集可用于脑脊液中脑膜炎球菌荚膜多糖的快速检测;但是,可能会出现假阴性或假阳性结果。血清或尿液样本的抗原凝集试验对脑膜炎球菌病的诊断是不可靠的[35]。免疫组织化学可用于福尔马林固定组织中脑膜炎球菌的检测。
通过培养和PCR证实:确诊脑膜炎球菌病的病例定义要求分离脑膜炎球菌或脑膜炎球菌DNA的检测。来自正常无菌区的DNA。通常情况下,无菌部位包括血液或脑脊液,但也可能包括关节液、胸膜液或心包液。在脑膜炎球菌血症病例中,紫癜或瘀点的抽吸物或皮肤活检可产生脑膜炎球菌。用于生物生长的典型培养基是巧克力琼脂或Mueller-Hinton培养基,在含有5%二氧化碳的气氛中[36]。
实时PCR检测血液、脑脊液或其他临床标本中脑膜炎球菌的DNA,是确认脑膜炎球菌病例的一种可接受的替代方法。实时PCR分析可用于检测血液、脑脊液或其他临床标本中的所有6种血清群脑膜炎球菌DNA[6-10]。PCR的一个主要优点是它允许检测脑膜炎球菌通过培养方法无法检测到微生物的临床样本,如在获取临床样本进行培养之前,患者已经接受了抗生素治疗。即使当微生物在抗菌处理后不能存活时,PCR仍然可以检测脑膜炎球菌DNA[37]。由于脑膜炎球菌病的严重性,一旦怀疑感染,立即对患者进行治疗至关重要,不要拖延获取培养或实验室结果。
现在可以获得几种商业多重PCR测定法,其能够同时检测单个样本中引起血液感染或脑膜炎/脑炎的一系列病原体,主要用于临床设置(例如,来自BioFire Diagnostics的FilmArray血液培养鉴定小组和FilmArray脑膜炎/脑炎小组,以及来自ARUP实验室的PCR脑膜炎/脑炎小组)[9,38,39]。虽然这种试验可以快速鉴定Hi和Nm种,但大多数不能确定血清型或血清群。因此,如果鉴定出Hi或Nm,使用不确定血清型/血清群的检测的实验室进行同时培养或反射培养是很重要的。至少,实验室应收集并保存足够的临床样本,以便在实验室用PCR检测进行进一步检测,从而检测血清型/血清群结果。
血清群测试
血清分型将有包膜的脑膜炎球菌菌株与无包膜的菌株区分开来,后者在细胞表面不表达任何包膜,不能进行血清分型。12个封装的基团(A、B、C、W、X、Y等。)具有不同的荚膜多糖,其可以通过用特异性抗血清或PCR进行玻片凝集来区分。
微生物实验室应对脑膜炎球菌分离株和临床标本进行血清群检测,其阳性脑膜炎球菌及时地。如果实验室无法进行血清分型,实验室人员应联系州卫生部门。州卫生部门如对血清分型有疑问,应致电404-639-3158联系CDC脑膜炎和疫苗可预防疾病分支实验室。
敏感性测试
不建议对脑膜炎球菌分离株进行常规抗菌药物敏感性试验。脑膜炎球菌在美国、欧洲和非洲的一些地区已经零星地发现了对青霉素G敏感性降低的菌株[40]。这些对青霉素敏感性降低的分离株中,大多数仍为中度敏感(最低青霉素抑制浓度在0.12 g/mL至1.0 g/mL之间)。高剂量青霉素G仍然是治疗中度易感脑膜炎球菌的有效方法。应对人群的易感性模式进行监测,以监控以下趋势脑膜炎球菌易感性。
暴发期间的分子分型
表型和基因型方法用于调查脑膜炎球菌的多样性。荚膜多糖(血清群)、孔蛋白PorB(血清型)和孔蛋白PorA(血清亚型)都是可用于区分脑膜炎球菌的表型特征[41]。脑膜炎球菌疾病的爆发通常由相同或密切相关的菌株引起[42]。分子基因分型技术,如PFGE、16S rRNA基因测序或多位点序列分型(MLST)用于暴发克隆的亚型表征[43,44]。这种分型有助于更好地确定疫情的范围。在确定暴发中的脑膜炎球菌血清群时,获得快速可靠的结果至关重要,因为公共卫生应对措施会因疫苗可预防或疫苗不可预防的疾病而异。分子基因分型为了解脑膜炎球菌疾病的总体流行病学提供了重要工具,但不同的方法在某些情况下可能更有用。PFGE或16S rRNA基因分型似乎对暴发和短期流行病学最有用,而MLST已成为长期全球追踪脑膜炎球菌种群变化的“金标准”。
H.腮腺炎(参见第9章)
尽管接种疫苗的人患腮腺炎和腮腺炎并发症的风险低得多,但完全接种疫苗的人也可能发生腮腺炎。最近的疫情最常发生在完全接种疫苗的人群中,这些人群长期密切接触,如共用水瓶或水杯、接吻、一起运动或与腮腺炎患者生活在一起。在接种疫苗的人群中,腮腺炎的实验室确认可能更具挑战性,因为与未接种疫苗的人群相比,病毒载量可能更低,更不容易检测到,并且IgM反应可能不存在、延迟或短暂。
通过逆转录聚合酶链反应(RT-PCR)或腮腺炎IgM反应成功检测腮腺炎病毒依赖于正确的收集(腮腺按摩)标本的采集时间、运输和储存。RT-PCR检测不到腮腺炎病毒RNA或在临床相容的腮腺炎患者血清中检测不到IgM不能排除腮腺炎的诊断。培训提供者正确收集、储存和运输标本的努力提高了腮腺炎的检测水平[45,46]。
急性腮腺炎感染可通过检测腮腺炎病毒RNA、RT-PCR或从临床标本中分离出腮腺炎病毒来确诊。临床上兼容的腮腺炎RT-PCR结果阳性或病毒分离阳性的病例被归类为确诊病例。最大的病毒脱落发生在腮腺炎发病前1-3天和发病后第5天。口腔拭子的早期采集(腮腺炎发病后0至3天)提供了实验室确认的最佳方法,特别是在有疫苗接种史的人群中,因为病毒滴度较低,并且病毒可能比未接种疫苗的人群清除得更快[47–49]。
如果在口腔/口腔拭子样本中检测到腮腺炎RNA,可将样本提交进行序列分析,以确定病毒基因型。序列数据的分析有助于监测病毒传播。此外,在疑似疫苗反应的情况下(即,疑似腮腺炎患者最近接种了疫苗),有必要收集口腔/口腔拭子样本进行病毒检测和基因分型。由于血清学试验无法区分疫苗暴露和野生型腮腺炎病毒暴露,因此必须使用基因分型来确认疫苗株或野生型病毒的检测。
口腔或口腔拭子样本应通过按摩腮腺擦拭斯滕森周围区域之前,先擦拭30秒导管。可以使用设计用于收集咽喉样本的商业产品或植绒聚酯纤维拭子。合成棉签优于棉签,棉签可能含有抑制RT-PCR中使用的酶的物质。植绒合成棉签似乎更具吸收性,洗脱样本的效率更高。有关病毒传播媒介、标本储存和运输的信息,请参见CDC腮腺炎实验室网站推荐。
血清腮腺炎IgM的存在也可用于辅助诊断腮腺炎感染,但不能确诊。如果在腮腺炎发病后3天以上收集血清标本,可提高腮腺炎IgM的检测[45,50,51]。具有阳性血清抗腮腺炎免疫球蛋白M (IgM)抗体结果的临床相容病例被分类为很可能的事。
标本收集
适当的时间选择和标本收集对于提高实验室检测的灵敏度非常重要。提供者工作援助是此处提供。
采集口腔拭子前,应按摩腮腺30秒钟。关于如何正确采集口腔拭子进行流行性腮腺炎检测的指导,这里提供了。
如果腮腺炎发病后≤3天,收集口腔拭子标本进行RT-PCR。
如果腮腺炎发病已超过3天,收集口腔拭子标本用于RT-qPCR,并收集血清标本用于IgM检测。
如果患者患有睾丸炎/卵巢炎、乳腺炎、胰腺炎、听力丧失、脑膜炎或脑炎,并且没有腮腺炎,则收集口腔拭子样本用于RT-qPCR,收集尿液样本用于RT-qPCR,并收集血清样本用于IgM检测,无论症状出现的天数。
对于腮腺炎实验室结果呈阴性的散发病例,考虑检测其他病因,如
流感病毒(甲型流感病毒亚型H3N2)、
副流感病毒1-3型,
爱泼斯坦-巴尔病毒,
人类疱疹病毒6A和6B,
单纯疱疹病毒1和2,
柯萨奇病毒A,
腺病毒,
细小病毒B19,
埃可病毒,
淋巴细胞性脉络丛脑膜炎病毒,
艾滋病毒,
或细菌,包括金黄色葡萄球菌和甲型溶血性链球菌。
病毒分离和RT-PCR
为州和地方管辖区提供7种VPD的增强监测检测能力,包括腮腺炎、麻疹、风疹、水痘带状疱疹病毒、百日咳博德特氏菌, 流感嗜血杆菌,以及脑膜炎奈瑟菌,疾病预防控制中心与公共卫生实验室协会(APHL)以及州和地区流行病学家委员会(CSTE)合作,于2013年建立了4个疫苗可预防疾病参考中心(VPD-RCs)。这些VPD通常通过实验室检测来检测,例如临床样本的定量逆转录聚合酶链反应(RT-PCR)测定。VPD-RCs为州和地方卫生部门提供了应对大规模疫情的快速反应能力,为没有RT-PCR能力的管辖区提供检测,以及基因分型。自成立以来,VPD-RCs已经接收并检测了大多数腮腺炎临床标本。
腮腺炎通过(RT-PCR)、实时RT-PCR (RT-qPCR)或口腔或尿液标本的病毒培养进行实验室确认。一旦怀疑有流行性腮腺炎,立即收集口腔或口腔拭子样本。当收集样本时,RT-PCR具有最大的诊断灵敏度≤腮腺炎发病3天。
尿液不是RT-PCR的最佳标本,也不是腮腺炎患者的优选标本,即使是症状发作3天以上的患者[46,52-57]。在疾病爆发期间检测尿液不会显著提高诊断率,并且会对检测资源产生负面影响。然而,对于出现腮腺炎并发症(睾丸炎、卵巢炎、肾炎、脑炎、脑膜炎)但无腮腺炎或其他唾液腺肿胀的患者,除了口腔标本外,收集尿液标本可能有助于确认腮腺炎感染。
在疑似腮腺炎暴发开始时,应通过RT-PCR对疑似腮腺炎的患者进行检测,以确认腮腺炎并排除其他可能的病因。然而,一旦流行性腮腺炎爆发得到确认,管辖区应考虑减少检测的替代策略,以节约公共卫生资源。
分子分型
分子流行病学监测使建立序列数据库成为可能,这将有助于监测基因型流行率随时间的任何变化,并有助于跟踪在美国流行的腮腺炎毒株的传播。收集和提交标本进行测序对于分子监测和通知公共卫生非常重要。用于分子分型的标本应在腮腺炎发病后尽快获取,理想的是发病当天至3天后(不超过腮腺炎后10天)。
分子分型是唯一可以区分疫苗反应和野生型感染的测试。通过咨询CDC腮腺炎实验室,可从CDC获得标本收集和运送的具体说明网站。
CDC和VPD RCs可以对RT-PCR阳性标本进行腮腺炎基因分型。整个腮腺炎短疏水(SH)基因的核苷酸序列被用于将腮腺炎病毒归属于12种公认的基因型之一[58]。在某些情况下,一种基因型与一个国家流行性腮腺炎病毒的流行有关;然而,流行性腮腺炎的常规基因型监测仅限于少数国家。来自流行性腮腺炎病毒的遗传信息被用于追踪病毒的传播途径,并可用于提示病例和暴发之间的流行病学联系或缺乏联系[59]。
自从我们在2006年开始常规的流行性腮腺炎基因型监测以来,CDC在美国的流行性腮腺炎患者中主要检测到G基因型[60]。流行性腮腺炎爆发通常只与一种基因型有关。在美国,接种疫苗和未接种疫苗的流行性腮腺炎患者中检测到的基因型没有差异。
鼓励公共卫生实验室发送RT-PCR阳性的散发性腮腺炎病例的患者样本,以及从一个爆发,(有关哪些标本的更多信息,请参见优化流行性腮腺炎检测指南)到疾病控制中心或VPD研究中心。如果疫情蔓延到另一个社区,应努力从新疫情的初始阳性标本中获得基因型。
为了监测正在发生的已确定的疫情,每周最多应从这些疫情中抽取5份标本送至VPD-RC或CDC进行测序
在暴发开始时、在暴发的每个流行病学周期间以及如果/当暴发扩散到新的地区或社区时,获取病例的SH序列
在疫情中,没有必要获取每个样本的序列,特别是当病例之间的联系得到很好理解时
从散发病例中获取序列非常重要,因为它们有助于我们监测腮腺炎病毒的传播模式
识别旅行和/或腮腺炎病例的潜在来源将有助于我们了解腮腺炎基因型的全球分布
在州或地方公共卫生实验室进行腮腺炎RT-PCR检测的管辖区也应发送RT-PCR阳性标本,以监测新的或正在发生的疫情
流行性腮腺炎的全球病毒学监测不像麻疹或风疹那样强有力,因此基因型的真正多样性尚不清楚
患有腮腺炎、唾液腺肿胀、卵巢炎或睾丸炎的患者,他们在流行病学上与确诊或可能的腮腺炎病例-患者无关(散发病例)
患有无菌性脑膜炎、脑炎、听力丧失、乳腺炎或胰腺炎的患者,无腮腺炎、唾液腺肿胀、卵巢炎或睾丸炎(严重腮腺炎并发症)
在可能的潜伏期(发病前12-25天)进行国际旅行的患者
复发性腮腺炎患者(尽可能提交两次发病的样本)
在症状出现前28天以上接受≥3剂MMR的患者
IgM抗体血清学检测
疫苗接种状态和标本采集时间影响腮腺炎感染者检测IgM的能力。一般来说,IgM阳性标本的百分比在未接种者中最高,在单剂疫苗接种者中居中,在2剂疫苗接种者中最低。腮腺炎发病后3天以上收集的标本更有可能出现IgM阳性结果。
IgM检测方法和试剂盒在灵敏度和特异性方面有很大差异,一些间接EIA和免疫荧光检测法仅检测到12%-15%的确诊腮腺炎病例[45]。IgM捕获ELISA是最敏感的血清学方法,可检测46%–71%的RT- PCR确诊病例[45]。当地或州卫生部门可以就现有的实验室服务和首选测试提供指导。
在以前接种过疫苗但感染了腮腺炎的人群中未能检测出腮腺炎IgM已有充分的文献记载。无论标本采集时间如何,有腮腺炎疫苗接种史的人可能检测不到腮腺炎IgM抗体。
酶免疫测定。EIA是诊断急性腮腺炎感染的高度特异性试验。商业免疫荧光(IFA)和间接EIA检测不如捕获IgM检测灵敏[45]。在州卫生部门的指导下,医疗服务提供者和州及地方卫生部门可将疑似腮腺炎病例的血清标本送至CDC病毒疫苗可预防疾病处,通过其内部采集EIA进行IgM检测。
免疫荧光分析。IFA的优点是相对便宜和简单。IFA IgM试验的读数需要相当的技能和经验,因为非特异性染色可能导致假阳性读数。IFA和间接EIA可能易受高水平IgG的干扰。为了避免假阳性结果,可能需要处理血清以去除IgM。
注意:用于检测流行性腮腺炎IgM的市售IFA抗体测定法和EIA试剂盒目前尚未得到美国美国食品药品监督管理局的批准。每个实验室必须独立验证这些测试。
未接种疫苗的人:IgM抗体在症状发作后5天内可检测到,在发作后约一周达到最高水平,并在几周或几个月内保持升高[61,62]。大多数IgM检测分析在未接种疫苗的人群中效果良好,尽管如果过早收集可能会出现假阴性结果[45]。如果腮腺炎发病后≤3天采集的急性期血清样本IgM阴性,且RT-PCR结果为阴性,则建议在症状发病后第5天或更晚时间采集第二份血清样本进行检测,因为IgM反应可能需要更多时间才能达到可检测水平。
接种疫苗的人:对流行性腮腺炎产生二次免疫反应的患者,如大多数先前接种过疫苗的人,可能没有IgM反应,或者根据标本收集的时间,可能没有、延迟或短暂出现IgM反应[61]。因此,如果采集标本,先前接种过疫苗的个体可能会出现大量假阴性结果≤3天。假阳性IgM结果也可能发生,并且似乎在某些IgM检测形式中更为普遍,如IFA。腮腺炎发病后> 3天收集标本可提高检测IgM的能力。在疫情期间,从症状出现后不到3天的患者中收集的血清样本中有13–46%呈阳性,而从3天以上的患者中收集的血清样本中有71%呈阳性[45]。然而,有腮腺炎疫苗接种史的人可能不具有可检测的腮腺炎IgM抗体,无论标本采集的时间,并且在来自临床相容的腮腺炎患者的血清样本中未检测到腮腺炎IgM也不能排除腮腺炎作为一种诊断。
IgG抗体的血清学检测
有多种检测腮腺炎IgG抗体的方法,包括EIA、IFA和蚀斑减少中和试验。记录腮腺炎IgG抗体存在或滴度增加的具体标准取决于检测。
1957年或以后出生的成年人或没有腮腺炎病史或疫苗接种史的人可能由于先前的无症状感染而具有可检测的腮腺炎IgG。
用IgG诊断腮腺炎:通过EIA记录从IgG阴性到IgG阳性的血清转化,或使用噬斑减少中和试验或类似定量试验中测量的配对标本记录IgG滴度升高4倍,可用于辅助诊断腮腺炎。应同时对急性期和恢复期标本进行IgG抗体检测,并且应对这两种标本进行相同类型的检测。EIA值不是滴度,EIA值的增加并不直接对应于滴度结果的增加。
未接种疫苗的人:在未接种疫苗的人群中,IgG抗体在症状出现后迅速增加,并且通常持续很长时间。根据样本采集的时间,急性期样本中可能存在IgG。
接种疫苗的人:在接种过疫苗的人中,急性期血样中的IgG可能已经升高,这经常阻止检测恢复期血清样本中IgG滴度的4倍升高。出于这个原因,不建议在以前接种过疫苗的人群中检测4倍升高的IgG。
免疫的假定实验室证据
使用血清学试验(EIA或IFA)检测到的腮腺炎特异性IgG的存在被认为是先前暴露于腮腺炎疫苗或腮腺炎病毒的证据,但不一定预示中和抗体的存在或对腮腺炎疾病的保护。
I.百日咳(见第10章)
培养
分离百日咳细菌培养仍然是诊断百日咳的金标准。它也是抗生素敏感性测试和分子分型所必需的。虽然细菌培养对诊断有特异性,但相对不敏感。在最佳条件下,暴发调查中80%的疑似病例可通过培养确诊;在大多数临床情况下,分离率低得多[63]。标本采集的时间会影响分离率,标本采集不充分和同时使用有效的抗菌药物也会影响分离率。因为患者即使服用了有效的抗生素(例如,当菌株对抗生素有耐药性时)仍可保持培养阳性,所以无论是否同时使用抗生素,都应采集鼻咽拭子进行培养。
苛刻的增长要求使得百日咳很难分离。在卡他阶段(即咳嗽的第一个1-2周),使用直接平板分离微生物是最成功的。所有怀疑患有百日咳疾病的人都应该从鼻咽后部获得鼻咽抽吸物或拭子进行培养。百日咳鼻咽抽吸物的回收率类似于或高于鼻咽拭子的回收率[63-66];咽喉和前鼻拭子的回收率低得令人无法接受。因此,标本应通过使用聚酯(如Dacron)或尼龙植绒鼻咽拭子从鼻咽后部而不是咽喉(图1)获得。棉签是不可接受的,因为这些材料中的残留物会抑制百日咳。标本应直接铺在选择性培养基上或放在运输培养基中。里根-洛韦琼脂或博代-根沟琼脂通常用于培养;应该使用半强度的Regan-Lowe作为输送介质。如果病人以前接受过有效的抗生素治疗,分离细菌的成功率就会下降百日咳(红霉素或甲氧苄啶-磺胺甲恶唑),如果样本采集延迟超过患病前2周,或者如果患者已接种疫苗。积极的培养百日咳确认了百日咳的诊断。出于这个原因,进入准备免费或以有限费用向患者提供这项服务的微生物实验室是百日咳监测的一个关键组成部分。
聚合酶链反应
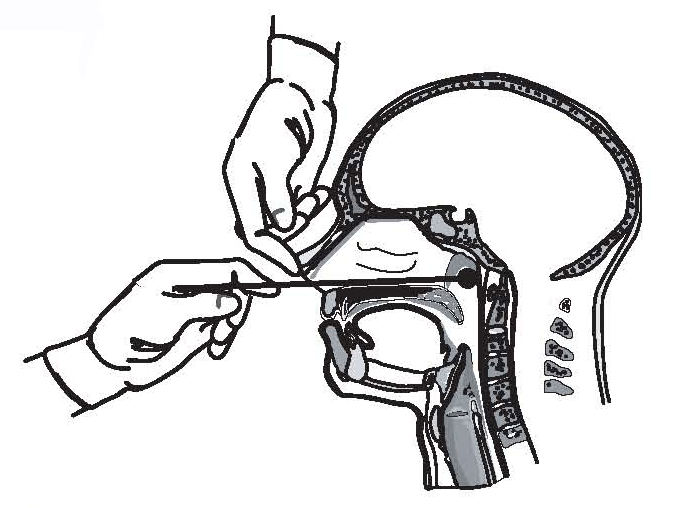
PCR是及时诊断百日咳的重要工具,临床医生可广泛使用。PCR是一种用于检测DNA序列的分子技术百日咳博德特氏菌与培养不同,细菌不需要样本中存在活的细菌[67,68]。鼻咽拭子或吸出物的PCR检测可以是诊断百日咳的快速、敏感和特异的方法[68,69];但是,由于实验室或标本采集过程中的污染,可能会获得假阳性结果[69,70]。尽管百日咳的早期体征和症状通常是非特异性的,但只有体征和症状与百日咳一致的患者才应接受检测。不应检测确诊病例的无症状接触者,接触者检测不应用于接触后预防决策。
自从1997年将其纳入病例定义以来,通过PCR确诊的病例比例大幅增加,许多实验室现在仅使用PCR来确诊百日咳[71]。然而,不同实验室之间的检测方法各不相同,而且没有标准化[69],不同实验室之间的检测程序以及灵敏度和特异性可能会有很大差异。因此,诊断的解释标准各不相同。PCR结果的解释,尤其是那些具有高周期阈值(Ct)值的结果,应结合体征和症状的评估以及可用的流行病学信息进行。有关PCR Ct值解释的更多信息,请参见卫生保健专业人员使用聚合酶链反应(PCR)的最佳实践诊断百日咳[72]。
虽然PCR越来越多地被用作百日咳的唯一诊断试验,但CDC建议在可行时将PCR与培养结合使用,而不是作为替代试验。验证时需要与培养物直接比较,建议使用多个目标来区分百日咳来自其他人博德特氏菌物种[73]。即使实验室已经验证了其PCR方法,分离百日咳在可能的情况下,应尝试通过培养。百日咳然后可以通过分子分型方法评估分离株对阿奇霉素和红霉素的敏感性,这有助于确定在美国流行的菌株的分子流行病学。
百日咳PCR检测的时间会显著影响其准确诊断该疾病的能力。在咳嗽的前3周,当鼻咽中仍然存在细菌DNA时,PCR具有最佳的灵敏度。咳嗽四周后,细菌DNA的数量迅速减少,这增加了获得假阴性结果的风险。
PCR的采集方法与培养的采集方法相似,通常两种检测可以使用相同的样本。但是,藻酸钙拭子不能用于采集鼻咽标本进行PCR。仅用于PCR(而非培养)检测的拭子可以放在干燥、无菌的试管中,以便运送到实验室。由于样本污染的风险,不鼓励使用液体运输介质。
血清学测试
虽然血清学检测已被证明在临床研究和疫情调查中有用,但它尚未标准化。此外,抗体水平和对百日咳的免疫力之间缺乏联系,使得血清学试验的结果难以解释。即使血清学不是临床病例定义的一部分,商业诊所和制造商仍然提供用于百日咳诊断的血清学测定和血清学试剂盒。没有一种血清学试验是FDA批准的,并且对这些市售血清学试验的临床准确性知之甚少。
免疫球蛋白(Ig)G抗体对百日咳毒素(PT)诊断价值的分界点尚未确定,目前的IgA和IgM测定缺乏足够的敏感性和特异性。在没有近期免疫接种的情况下,咳嗽发作2周后血清抗IgG抗体升高提示近期百日咳感染。增加的滴度或大约100 IU/mL或更高的单个IgG抗PT值(使用标准参考血清作为对照)可用于诊断。
只有在马萨诸塞州,该州利用自己的临床验证试验,血清学用于11岁及以上患者的临床诊断和报告[74]。CDC与FDA一起验证了一种IgG抗PT ELISA,该ELISA已被证明可用于青少年和成人疾病晚期的诊断[75–77]。该检测目前在明尼苏达州卫生部实验室进行,以支持其他州卫生部门,作为疫苗可预防疾病参考中心计划[74]。
在其他地方,除了少数例外,还不知道血清学检测是否已经过适当的验证或标准化。因此,为了国家报告的目的,不应依赖血清学检测来确认病例。符合临床病例定义的血清学阳性但培养或PCR阳性的病例应报告为可能病例。
直接荧光抗体测试
鼻咽分泌物的DFA试验有时用于筛查百日咳,但不推荐作为诊断百日咳的试验。阳性DFA结果可能会增加患者患百日咳的可能性,但它的特异性有限(经常出现假阳性结果),并且不是一项确证试验。单克隆DFA试验是可行的,但敏感性和特异性是可变的。
白细胞计数升高
百日咳病例中通常出现白细胞计数升高并伴有淋巴细胞增多(即淋巴细胞计数增加)。淋巴细胞绝对计数可达20,000个/mm3或者更高。然而,非常小的婴儿、接种疫苗的儿童或患有轻度百日咳的成人可能没有淋巴细胞增多。白血球计数不是确认的测试。
脉冲场凝胶电泳
PFGE是一种DNA指纹技术。这种技术是区分流行病学相关菌株(例如,来自同一家庭或小社区的菌株)的有用工具,同时在更大的地理区域如城市、县和州内显示多样性[78,79]。
多位点可变数目串联重复分析
多位点可变数目串联重复分析(MLVA)是一种分子分型方法,它比较菌株之间直接重复(可变数目串联重复,或VNTRs)的基因组区域(80);它显示出比PFGE更少的菌株多样性。MLVA具有适用于两种培养物并直接适用于从临床样本中提取的核酸的优点(81)。
多位点序列分型
多基因座序列分型(MLST)是另一种分型方法,其分析一组预定基因或基因片段中的核苷酸变异(82)。MLST方法因细菌种类而异。虽然MLST方法百日咳还没有标准化,许多实验室分析了几种无细胞百日咳疫苗中包含的编码毒力因子的3个基因和启动子区域的片段。(83,84)
州卫生部门对分离、PCR检测、血清学或其他检测方法有疑问百日咳应联系CDC百日咳和白喉实验室,电话404-639-1231。
J.肺炎球菌感染(参见第11章)
培养
肺炎链球菌是一种革兰氏阳性、柳叶刀形双球菌,通常作为正常菌群栖息于咽喉。肺炎链球菌引起的肺炎通常引起下呼吸道和上呼吸道疾病,包括肺炎、脑膜炎和急性中耳炎。侵袭性肺炎球菌感染的诊断通过培养和分离以下细菌来确定肺炎链球菌来自通常无菌的身体部位(例如,血液、CSF、胸膜液、腹膜液)。或者,可以使用实时PCR从来自正常无菌场所的培养阴性标本中确认诊断。
耐药性
临床实验室标准协会(CLSI)建议临床实验室检测所有的肺炎链球菌对青霉素、头孢噻肟或头孢曲松、美罗培南和万古霉素耐药的脑脊液[85]。对于其他来源的微生物,实验室应考虑检测对红霉素、青霉素、甲氧苄啶-磺胺甲恶唑、克林霉素、头孢吡肟、头孢噻肟或头孢曲松、氟喹诺酮、美罗培南、四环素和万古霉素的耐药性。对万古霉素耐药的肺炎球菌从未被描述过。利奈唑胺耐药极其罕见,并且与rplD-编码的核糖体蛋白L4[86]。对于万古霉素,如果菌株的最小抑制浓度大于或等于1 μg/ml或区域直径小于< 17 mm,则认为该菌株不敏感。对于利奈唑胺,不敏感菌株是指最小抑制浓度(MIC)大于2 μg/ml或区域直径小于21 mm的菌株。发现对万古霉素或利奈唑胺不敏感的菌株应提交给参考实验室进行确认检测,如果耐药,则报告给州卫生部门。因为肺炎球菌是苛求的生物,一些用于其他生物的药敏试验方法不适用于肺炎球菌;有关测试建议,请参见CLSI文档[85]。CDC的抗生素耐药性实验室网络(ARLN)可用于协助州公共卫生实验室进行IPD分离株的敏感性测试。各州可以要求对特定的IPD分离株进行检测。接触ARLN@cdc.gov获取有关该计划的信息。此外,具有不寻常耐药性特征的分离株可被送往CDC链球菌实验室进行表型验证和基因组分析,利用其专门的生物信息学渠道检测耐药性决定因素[87]。联系人pneumococcus@cdc.gov了解更多信息。获得青霉素结合蛋白基因测序信息的州卫生部门实验室可以考虑使用疾控中心链球菌实验室数据库用于推导β-内酰胺类抗生素[88]。
血清型
目前的肺炎球菌疫苗基于荚膜多糖。目前已知的荚膜血清型超过91种。由于肺炎球菌疫苗中仅包括荚膜血清型的子集,因此血清型可以测量疫苗效力,并可以为扩展血清型疫苗的开发提供数据[89]。CDC及其合作伙伴在代表美国约3000万人的特定地区对侵袭性肺炎球菌血清型进行积极的、基于人群的监测。血清分型目前仅在有限数量的州公共卫生实验室、学术中心或CDC进行。州公共卫生实验室可以考虑采用基于PCR的技术来确定荚膜血清型[90-93]。 CDC链球菌实验室为州卫生部门和临床实验室提供了大量的方案和参考,以使用以下方法鉴定肺炎球菌血清型聚合酶链式反应。如果各州不能进行PCR血清分型,CDC的ARLN和VPD项目可以为选择的IPD分离株或标本提供血清分型帮助。联系ARLN@cdc.gov用于血清分型辅助。CDC链球菌实验室将对来自爆发环境中的血液、脑脊液或其他无菌场所的肺炎球菌分离株进行血清分型,并在适当时进行全基因组序列分析,以确定菌株特征和疾病群分离株之间的相关性。联系pneumococcus@cdc.gov爆发援助。血清型通过用于确定MLST类型和抗性特征的相同生物信息学途径来推断[87]。
K.脊髓灰质炎(参见第12章)
病毒分离法
从粪便标本中分离出脊髓灰质炎病毒的可能性最高,从咽拭子中居中,从血液或脊髓液中分离出的可能性极低。脊髓灰质炎病毒在粪便中存在的浓度最高,时间最长,因此仍然是诊断的最关键样本。因为细胞培养对检测脊髓灰质炎病毒极其敏感,所以它与大多数分子检测一样敏感,甚至更敏感。泛肠道病毒PCR结果阴性不能排除脊髓灰质炎病毒感染。从粪便标本中分离出脊髓灰质炎病毒有助于诊断评估,但不能证明分离出的病毒与麻痹性脊髓灰质炎之间存在因果关系[94]。从脑脊液中分离病毒是诊断性的,但很少实现。为了增加脊髓灰质炎病毒分离的可能性,应在病程的早期(即,在脊髓灰质炎被认为是一种可能的鉴别诊断后立即)从疑似脊髓灰质炎患者处至少获得24小时的粪便标本和2份咽拭子,但理想情况下在麻痹性疾病发病后的前14天内。标本应送往州或其他参考实验室进行初步分离。实验室应将分离株转交给CDC进行型内鉴别,以确定脊髓灰质炎病毒分离株是野生的还是疫苗衍生的。如果不容易获得培养物,疾控中心可以提供帮助。
野生脊髓灰质炎病毒的分离构成了公共卫生突发事件,必须立即采取适当的控制措施(与医疗服务提供者、州和地方卫生部门以及CDC协商)。2型脊髓灰质炎病毒已被宣布根除;2型传染性和潜在传染性材料只能在适当的控制设施[282页].
血清学测试
血清学可能有助于支持或排除麻痹性脊髓灰质炎的诊断。急性期血清标本应尽可能在病程早期采集,恢复期标本应至少在3周后采集。急性期和恢复期标本之间滴度的4倍上升提示脊髓灰质炎病毒感染。两种标本中不可检测的抗体滴度可能有助于排除脊髓灰质炎,但在免疫功能低下者中可能为假阴性,这些人也是麻痹性脊髓灰质炎的高危人群。此外,中和抗体出现得早,在患者住院时可能处于高水平,因此可能不会出现4倍的升高。接种疫苗的人也应该有可测量的滴度;因此,疫苗接种史对于解释血清学试验很重要。血清学的局限性之一是无法区分疫苗相关脊髓灰质炎病毒诱导的抗体和野生病毒诱导的抗体。大多数商业和州立公共卫生实验室都有检测抗脊髓灰质炎病毒抗体的血清学试验。
L.轮状病毒(参见第13章)
实验室检测对于确认A组轮状病毒感染和确保可靠的监测和临床治疗是必要的。因为轮状病毒在粪便中以如此高的浓度脱落,所以粪便标本是诊断轮状病毒的优选方法。可用于诊断轮状病毒感染的方法包括检测病毒抗原(EIA、免疫层析、电子显微镜和免疫染色)以及通过RT-PCR/qRT-PCR和基因组测序进行的分子检测[95-97]。
病毒抗原的检测
粪便中最常用的抗原检测方法是EIA,它检测所有A组轮状病毒共有的抗原[95]。有几种廉价的商业EIA试剂盒可以提供快速和高灵敏度的结果(90%-100%)。因为EIA快速、廉价且高度敏感,所以它是临床诊断和监测的最合适的方法。
另一种不常用但更适合研究环境的方法是通过电子显微镜观察病毒颗粒。
分子检测
分子方法可用于检测临床标本中的轮状病毒感染并表征病毒。检测病毒RNA的分子方法包括RT-PCR、qRT-PCR和基因组测序[96,97]。
多重、半巢式RT-PCR基因分型和基因组测序被广泛用于鉴定最常见和几种不常见的轮状病毒G和P基因型[96,97]。
基因组测序已被广泛用于鉴定不能通过RT-PCR基因分型鉴定的罕见菌株和遗传变异体,并用于确认基因分型方法的结果[96,97]。
病毒分离法
轮状病毒可以通过在含有胰蛋白酶的生长培养基中接种细胞培养物直接从粪便标本中分离出来,但这种方法劳动强度大,更适合于研究实验室。
M. 风疹(参见第14章)
风疹的临床诊断不可靠,因此,病例必须得到实验室确认。病毒检测和血清学检测可用于确认急性或近期风疹感染。血清学试验也可用于筛查风疹免疫力。
病毒检测(实时RT-PCR,RT-PCR)
风疹病毒可从风疹患者的鼻腔、咽喉、尿液、血液和脑脊液标本中检测到(参见附录15[2页]。最好的结果来自咽拭子。脑脊液标本应留给疑似风疹脑炎的人。在最初调查时,应努力从所有病例中获取临床标本进行病毒检测。出疹前1周至出疹后2周可检测到病毒。然而,最大的病毒脱落发生在皮疹发作后的第4天。
实时RT-PCR和RT-PCR可用于检测风疹病毒,并已被广泛用于检测临床标本中的风疹病毒[84,85]。通过这些技术对为病毒检测而获得的临床标本进行常规筛查,并将其送至CDC。
推荐分子分型,因为它提供了重要的流行病学信息来追踪美国风疹的流行病学,因为风疹病毒不再在这个国家持续传播。通过将从新病例患者身上获得的病毒序列与其他病毒序列进行比较,可以追踪该国特定病毒类型的来源[100]。此外,这一信息可能有助于记录消除地方病传播的维持情况。此外,基因分型方法可用于区分野生型风疹病毒和疫苗病毒。
血清学测试
实验室确认风疹感染和免疫力可用的血清学检测因实验室而异。州卫生部门可以就可用的实验室服务和首选测试提供指导。
EIAs是风疹IgG和IgM抗体的最常用和最广泛可用的诊断测试,并且是灵敏的和相对容易进行的。EIA是IgM的首选检测方法,使用捕获技术,尽管间接检测也是可以接受的。
当由有经验的实验室人员执行时,乳胶凝集试验对于筛选似乎是敏感的和特异的。其他有限使用的检测风疹特异性IgM的试验包括HI和IFA。
IgM抗体检测
风疹特异性IgM通常可以在发病后4-30天检测到,通常需要更长时间。应在发病后尽早收集血清。然而,IgM抗体可能在出疹后第5天之前检测不到。如果在第5天之前采集的标本中出现风疹IgM阴性结果,应在第5天之后采集的标本中重复进行血清学检测。
因为风疹发病率低,高比例的IgM阳性检测很可能是假阳性。由于存在类风湿因子(表明有风湿病)或交叉反应IgM,或其他病毒感染,可能会出现假阳性血清风疹IgM试验[101,102]。亲和力测试(见下文)和野生型风疹病毒检测可用于解决疑似病例血清学评估中的不确定性。
当在没有疾病史或风疹样疾病接触史的孕妇中检测到风疹IgM时,应特别小心。虽然不建议这样做,但许多已知未接触过风疹的孕妇会接受风疹IgM检测,作为产前护理的一部分。如果对于没有风疹暴露风险或暴露风险低的人,风疹检测结果为IgM阳性,应进行额外的实验室评估。实验室评估与图2中IgM阳性部分描述的相似。

用于诊断测试的IgG抗体检测(显著上升或亲和力)
为了检测风疹特异性IgG浓度的显著升高,应在发病后尽快采集第一份血清标本,并在第一份标本采集后约7-21天采集第二份血清标本。在大多数风疹病例中,风疹IgG在皮疹发作后8天可检测到[103]。IgG抗体试验应在同一试验中同时对急性期和恢复期标本进行。
IgG亲和力的测定有助于区分近期和既往风疹感染的差异。低亲和力与近期初次风疹感染有关,而高亲和力与既往感染或再次感染有关。亲和力测试不是常规测试,应在参考实验室进行。已经描述了许多亲和力测定法[104,105]。
检测IgG抗体筛查风疹免疫
单一血清学IgG测试可用于确定风疹疾病史或疫苗接种史未知的人的风疹免疫状态。血清IgG风疹特异性抗体的存在表明对风疹有免疫力。
N. 先天性风疹综合症(参见第15章)
用于确认CRS的诊断试验包括血清学试验和病毒检测。
病毒检测(实时RT PCR和RT-PCR)
风疹病毒可以从患有CRS的婴儿的鼻、喉、尿和血液标本中检测到。在初始调查时,应努力从婴儿身上获取用于病毒分离的临床标本(参见附录15[2页]).然而,由于患有CRS的婴儿可能会长期(一年或更长时间)从喉咙和尿液中流出病毒,因此后来获得的标本也可能产生风疹病毒。与风疹感染一样,推荐使用分子分型,因为它提供了重要的流行病学信息来追踪美国风疹的流行病学,因为风疹病毒不再在该国持续传播。通过将新病例患者的病毒序列与其他病例的病毒序列进行比较,可以追踪该国特定病毒类型的来源[106]。此外,这些信息可能有助于记录维持消除地方性风疹病毒传播的情况。用于分子分型的标本应在确诊后尽快从CRS患者身上获取。合适的标本包括咽拭子、尿液和手术后的白内障。用于病毒检测和分子分型的标本应按照州卫生部门的指示送到CDC。
血清学测试
实验室确认CRS感染可用的血清学检测因实验室而异。EIAs是风疹IgG和IgM抗体最常用和最广泛可用的诊断试验。环境影响评价很敏感,也相对容易进行。EIA是IgM的首选检测方法,使用捕获技术,尽管间接检测也是可以接受的。在患有CRS的婴儿中,IgM抗体可在婴儿的脐带血或血清中检测到,并持续约6-12个月。出生时IgM阴性的疑似CRS病例应在一个月大时确认该结果。
O.水痘(参见第17章)
水痘的实验室确认变得更加重要,因为这种疾病的常见疫苗修饰表现,以及患有未修饰疾病的医生的经验更加有限。此外,疫苗野生型鉴别试验对于确认疫苗相关疾病也很重要。由于水痘是与天花相混淆的最常见疾病,根据CDC算法,属于天花“中度风险”类别的水疱/脓疱性皮疹病例需要进行水痘带状疱疹病毒(VZV)诊断的快速实验室确认。用于确认近期水痘感染的诊断试验包括病毒DNA的检测和表征。血清学试验在确认VZV病原学方面的价值有限,但IgG亲和力除外,它可以区分原发性和既往感染。
水痘带状疱疹病毒的快速鉴定
实时PCR技术是确认VZV感染的金标准。在与VZV病毒感染相关的神经系统疾病和血管病变的病例中,也可在脑脊液中检测到病毒DNA。如果CSF的PCR结果为阴性,VZV IgG鞘内抗体试验可能会产生阳性结果,因为该方法可用于在疾病发作后一个月内显示VZV。如果在症状发作后超过10天,病毒DNA被检测到的频率较低。适用于PCR检测的样本包括水泡拭子、结痂病变的痂、唾液、脑脊液以及疑似播散性VZV病病例的活检或尸检样本。由于灵敏度和特异性的限制,一般不推荐其他直接检测方法,如DFA。
PCR是一种强大的技术,它允许快速扩增病毒DNA的特定序列,否则这些序列会以远低于可检测极限的浓度存在于临床样本中。精心设计的靶向选定的小片段病毒DNA的引物可用于复制从临床样品中提取的少量病毒DNA。如果产生预期大小的PCR产物,则证明病变中存在病毒。这种技术已经扩展到VZV,通过扩增水痘DNA片段,该片段在碱基序列中包括一个突变,该突变将疫苗株与野生型水痘株区分开。已经开发出可以实时区分疫苗标记和野生型的技术,使得在一天内完成测试成为可能。
接种疫苗后应检测标本的情况包括:1)接种疫苗后7天或更长时间出现50处以上的皮疹,2)怀疑疫苗病毒的二次传播,3)接种疫苗者出现带状疱疹,或4)任何严重的不良事件。CDC的国家VZV实验室有能力使用常规和实时PCR方法区分野生型VZV和Oka毒株。拨打国家VZV实验室电话404-639-0066,404-639-2192,或发送电子邮件至dds1@cdc.gov或者vzvlab@cdc.gov有关收集和提交样本进行测试的详细信息。位于加利福尼亚州、威斯康星州、纽约州和明尼苏达州的州立实验室的疫苗可预防疾病参考中心也能够区分水痘疫苗和野生型VZV。
病毒培养
不再推荐VZV病毒培养,因为获得结果需要时间,而且与PCR相比,这种方法相对不敏感。
血清学测试
对VZV的IgG(急性和恢复期)和IgM抗体可进行血清学试验,以确诊疾病。不推荐使用商业试剂盒检测IgM抗体,因为现有方法缺乏敏感性和特异性;假阳性IgM结果在高IgG水平的情况下是常见的。VZV IgM可以确认最近的活动性VZV感染,但不一定能确认原发感染。此外,IgM方法可能容易产生假阳性结果。虽然不能广泛获得,但VZV IgG亲和力可以区分原发性VZV感染和既往感染(VZV的再激活将驱动IgM的瞬时表达,正如在初次反应中一样。疾控中心的国家VZV实验室已经开发了一种可靠的IgM捕获测定法。致电404-639-0066、404-639-2192或发送电子邮件至dds1@cdc.gov或者kjr7@cdc.gov有关收集和提交样本进行测试的详细信息。
参考
A.白喉
1.世界卫生组织。(2021).世卫组织白喉和其他相关感染诊断实验室手册。世界卫生组织。https://apps.who.int/iris/handle/10665/352275。许可证:CC BY-NC-SA 3.0 IGO
2.当前实验室诊断白喉的方法。j传染疾病2000年;181(补1):S138-45。doi: 10.1086/315552
3.Engler KH,Glushkevich T,Mazurova IK等。一种用于在诊断实验室中检测棒状杆菌的改良埃莱克试验。临床微生物学杂志1997;35:495-98.1997年2月35日
4.威廉姆斯MM,沃勒JL,阿内克JS,等。携带白喉毒素基因的检测和鉴定棒状杆菌通过一种新的实时PCR检测。临床微生物学杂志2020;58: doi: 10.1128/JCM.00639-20。打印2020年9月22日
5.丁乐TC,管家-吴SM。Maldi-tof质谱在微生物鉴定中的应用。临床医学实验室2013;33(3):589-609.doi:10.1016/2013 . 03 . 001
B.Hib
6.王X,麦尔R,哈彻C,等。用一种新的实时PCR方法检测蒙古流脑监测中的病原菌流感嗜血杆菌. IJMM2010;301(4): 303–9.doi:10.1016/j.ijmm.2010.11.004
7.Vuong J,科拉德·JM,Whaley MJ,等开发无需提取DNA的实时PCR方法检测细菌性脑膜炎病原体。公共科学图书馆一号2016;11(2):e0147765。doi:10.1371
8.多重实时PCR检测细菌性脑膜炎病原体的临床验证。临床微生物学杂志2012;50(3):702–8.doi:10.1128/ JCM.06087-11
9.Leber等,Everhart K,Balada-Llasat J-M,等。BioFire FilmArray脑膜炎/脑炎检测板用于检测脑脊液标本中的细菌、病毒和酵母菌的多中心评估。临床微生物学杂志2016;54(9):2251–61.doi:10.1128/JCM.00730-16
10.Altun O,Almuhayawi M,Ullberg M,zenci V .使用薄膜阵列快速鉴定无菌体液中的微生物。临床微生物学杂志2015;53(2):710–2.doi:10.1128/ JCM.03434-14
11.CSTE。疫苗可预防疾病的监测和报告。CSTE立场声明09-ID-99。佐治亚州亚特兰大市:CSTE;2000.
12.疾病控制中心。血清分型差异流感嗜血杆菌b型疾病——美国,1998-1999年。MMWR2002;51(32):706–7.
13.疾病控制中心。使用PCR诊断流感嗜血杆菌和脑膜炎奈瑟菌的最佳实践以及确定血清型/血清群的公共卫生重要性.
14.Fry AM,Lurie P,Gidley M,等。流感嗜血杆菌宾夕法尼亚州阿米什儿童中的b型疾病:疾病持续的原因。小儿科2001;108(4):E60。doi:10.1542/peds
15.吕彻拉,里维斯M,轩尼诗T,等。重现,在西南阿拉斯加,入侵流感嗜血杆菌由于菌株与从接种疫苗的儿童中分离的菌株难以区分而导致的b型疾病。感染疾病2002;186:958–65.doi:10.1086/342595
C.HAV
16.HAV。沃恩G,冈萨尔维斯罗西LM,福尔比JC,等。甲型肝炎病毒:宿主相互作用,分子流行病学和进化。感染遗传进化 2014;21:227–43.
D.乙型肝炎病毒
17.疾病控制中心。美国乙型肝炎病毒感染的预防:免疫实践咨询委员会的建议。MMWR建议和代表2018;67(RR-1):1–31。
18.免疫实践咨询委员会(ACIP)。消除美国乙型肝炎病毒感染传播的综合免疫策略:免疫实践咨询委员会的建议(ACIP)。第1部分:婴儿、儿童和青少年的免疫接种。MMWR代表2005;54(RR-16):1–31。
19.杨喜,陆锡南,廖,等。乙型肝炎e抗原与肝细胞癌的风险。英国医学杂志2002;347:168–74.
20.奥特·JJ,史蒂文斯·加,威斯玛·圣。围产期乙型肝炎病毒传播的风险:世界所有地区乙型肝炎e抗原(HBeAg)患病率的估计。BMC感染Dis2012;12:131.doi: 10.1186/1471-2334-12-131
21.福尔比J,沃恩G,波弟M,等。尼日利亚农村两个偏远社区乙型肝炎病毒感染的流行史和进化动力学。公共科学图书馆一号2010;5: e1615。doi: 10.1371/journal.pone
22.抗药性和疫苗逃逸HBV突变体的分子发生。红伞疗法2010;14(3点b):451–61。
23.张爱,赖春林,黄凤英,等。前S区准种基因的深度测序分析及其与肝细胞癌的相关性。胃肠病学杂志2017;52:1064–74.
24.Longmire AG,Sims S,Rytsareva I,等,《幽灵:全球肝炎爆发和监测技术》。BMC基因组学2017;18(补编第10号):916。doi: 10.1186/s12864-017-4268-3
25.迪勒洛法,里德鲁埃霍E,马丁内斯AP,佩雷斯PS,坎波斯RH,弗里奇曼DM。与疫苗逃逸、耐药性和诊断失败相关的乙型肝炎病毒突变体的分子流行病学。病毒性肝炎2019;26:552–60.
26.托马斯HC,卡门WF。乙型肝炎病毒包膜和前核心/核心变异体。北美胃肠临床1994;23:499–514. https://pubmed.ncbi.nlm.nih.gov/7989091/
E.流行性感冒
27.新泽西州考克斯贝里尼·WJ。麻疹、流感和其他呼吸道病毒感染的实验室诊断。课程手册。DC华盛顿州:HHS,公共卫生服务;1995.
28.新泽西州考克斯齐格勒T。流感病毒。在:默里公关,巴伦EJ,法勒马,特诺夫足球俱乐部,约肯RH,编辑。临床微生物学手册。DC华盛顿:ASM出版社;1999.
29.疾病控制中心。快速流感诊断测试。佐治亚州亚特兰大[2016年10月25日审核;更新2017年1月18日;引用2017年9月7日】。
30.疾病控制中心。对用于检测新型甲型H1N1流感的快速流感诊断试验的评估——美国,2009年. Morb莫尔布凡人周代表2009;58(30):826–9.
31.疾病控制中心。对11种市售快速流感诊断测试的评估—美国,2011–2012. Morb莫尔布凡人周代表2012;61(43):873–6.
32.莫斯克FM,范坎彭JJA,阿伦G,等。在三级护理中儿童流感病毒和RSV快速抗原检测试验的诊断性能。临床病毒2016;79:12–7.doi: 10.1016/j. jcv.2016.03.022
F.麻疹
33.詹克森有限公司,贝勒M,Middaugh JP,埃德曼DD。假阳性风疹IgM试验。英国医学杂志1995;332:1103–4.doi:10.1056/nejm 1995 . 158658666667
34.赫尔方德RF,希斯JL,安德森LJ,梅斯EF,古里斯D,贝利尼WJ。用IgM捕获EIA诊断麻疹:出疹后标本采集的最佳时机. 感染疾病1997;175:195–9.doi:10.1093/INF dis/175.195
G.脑膜炎球菌病
35.Rosenstein NE,Perkins BA,Stephens DS等。脑膜炎球菌病. 英国医学杂志2001;344:1378–88.doi:10.1056/nejm 2001 . 546536565656
36.斯蒂芬斯·鲁法尔·NG脑膜炎奈瑟菌:生物学、微生物学和流行病学。方法分子生物学2012;799:1–20.doi:10.1007/978-1-61779-346-2 _ 1
37.使用实时PCR解决血清群鉴定中玻片凝集的差异脑膜炎奈瑟菌. 临床微生物学杂志2004;42:320–8.doi:2004年1月42日至328日
38.Biofire薄膜阵列面板。
39.ARUP脑膜炎/脑炎PCR检测小组.
40.儿科学会。脑膜炎球菌感染。在:皮克林LK,贝克CJ,龙SS,麦克米兰JA,编辑。红皮书:传染病委员会2006年报告。27泰国(Thailand)由…编辑伊利诺伊州埃尔克格罗夫村:美国儿科学会;2006.452–60.
41.拉古纳坦PL,伯恩哈特有限公司,罗森斯坦NE。美国控制脑膜炎球菌病的机会。Annu Rev Med 2004;55:333–53.
doi:10.1146/annu rev . med . 55 . 555556565656
42.疾病控制中心。脑膜炎球菌病的预防和控制。MMWR代表2005;54(编号RR-7):1至17。
43.Sacchi,CT,Whitney AM,Reeves MW,Mayer LW,Popovic T脑膜炎奈瑟菌16S rRNA基因和16S rRNA基因测序作为分子分型工具的用途。临床微生物学杂志2002;40(12):4520–7.2002年12月40日
44.少女,MC,Bygraves JA,Feil E,等。多位点序列分型:一种鉴定病原微生物群体中克隆的简便方法. 美国国家科学院院刊 1998;95:3140–5.
H.腮腺炎
45.Rota JS,Rosen JB,Doll MK等。2009年纽约市流行性腮腺炎爆发的实验室诊断方法敏感性比较. 临床疫苗免疫2013;20(3):391–6.doi:10.1128/CVI.00660-12
46.加拿大不列颠哥伦比亚省部分疫苗接种人群流行性腮腺炎爆发期间实验室方法的诊断结果和病毒基因分型的价值。临床微生物学杂志2018;56(5):e01954-17。doi:10.1128/JCM.01954-17
47.接种过流行性腮腺炎疫苗的个体向密切接触者传播流行性腮腺炎病毒。疫苗2011;29 (51):9551–6.doi:10.1016/日本疫苗
48.罗塔JS,特纳JC,约斯特-达尔杰夫MK,等。2006年9月-12月在弗吉尼亚州接受两次麻疹-腮腺炎-风疹(MMR)疫苗接种的大学生中流行性腮腺炎爆发的调查。医学病毒学杂志2009;81(10):1819–25.doi:10.1002/jmv.21557
49.在麻疹、流行性腮腺炎和风疹疫苗高覆盖率人群中检测流行性腮腺炎病毒的RNA。临床微生物学杂志2008;46(3):1101–3.doi:10.1128/JCM.01803-07
50.放大图片作者:James C .社区流行性腮腺炎爆发时临床特征在诊断中的重要性。医学杂志 2006;99(6):171–3.
51.克劳斯奇,莫利纽克斯PJ,何燕多,等。流行性腮腺炎-IgM ELISA在急性感染中的比较。临床病毒学杂志2007;38(2):153–6.doi:2006年10月10日
52.实时荧光PCR技术及其在流行性腮腺炎快速诊断中的应用。医学病毒学杂志2007;79(11):1761–7.doi:10.1002/jmv.20880
53.谭可,安德森M,克拉登M,等。不列颠哥伦比亚省高度未接种疫苗人群中流行性腮腺炎病毒检测。公共卫生2011;102(1):47–50.doi:10.1007/BF03404876
54.流行性腮腺炎爆发与实验室诊断。临床病毒学杂志2015;62:14–9.doi:10.1016/2014 . 11 . 004
55.加拿大安大略省流行性腮腺炎爆发期间的实验室检测和系统发育分析。病毒学J2018;15(1):98.doi:10.1186/s12985-018-0996-5
56.Krause CH,伊斯蒂克K,Ogilvie MM .实时聚合酶链反应用于腮腺炎临床标本的诊断——与常规病毒检测方法和巢式聚合酶链反应结果的比较。临床病毒学杂志2006;37(3):184–9.2006年7月10日
57.在部分免疫人群中流行性腮腺炎的实验室诊断:新斯科舍省的经验。日本能感染疾病微生物吗2009;20(4):e157–62。doi:10.1155/2009/493275
58.流行性腮腺炎病毒的基因组多样性及其12种基因型的全球分布。医学病毒学修订版2015;25(2):85–101.多元指数:10.1002/1819
59.结合基因组学和流行病学追踪美国流行性腮腺炎病毒的传播。公共科学图书馆生物学2020;18(2):e3000611。doi:10.1371/journal.pbio
60.McNall R,Wharton A,Anderson R,等。与美国流行性腮腺炎复发相关的流行性腮腺炎病毒的基因特征:2015—2017。病毒研究2020;16:197935.doi:10.1016/j . virus RES . 1366586363616
61.Ukkonen P,granstrm ML,Penttinen K .通过酶联免疫吸附试验测定自然腮腺炎感染中的腮腺炎特异性免疫球蛋白M和G抗体医学病毒学杂志1981;8:131–42.doi:10.1002/jmv . 18001 . 181008382025
62.贝尼托·RJ,拉拉德·L,拉谢拉·MP,等。自然流行性腮腺炎感染后特异性IgM抗体的持久性。感染疾病1987;155:156–7.doi:10.1093/infdis/155
I.百日咳
63.Bejuk D,Begovac J,Bace A,等百日咳博德特氏菌三份上呼吸道样本。儿科传染病杂志 1995;14:64–5.
64.Halperin SA,Bortolussi R,麦芽汁AJ. 百日咳诊断的培养、免疫荧光和血清学评估。临床微生物学杂志 1989;27:752–7.
65.Hallander HO,Reizenstein E,Renemar B,等.鼻咽抽吸物与拭子培养的比较百日咳博德特氏菌. 临床微生物学杂志 1993;31:50–2.
66.韦斯·霍普·JE百日咳博德特氏菌来自四种棉签。欧洲临床微生物学杂志 1987;6:203–5.
67.柯伊迪尔·C,博济奇·M,布尔迈斯特·A,等博德特氏菌物种通过实时PCR。临床微生物学杂志2007;45(2):347–50.doi:10.1128/JCM.01303-06
68.秦,加兰akis E,马丁等,英文JA。多靶点聚合酶链反应诊断百日咳及其临床意义。临床微生物学杂志2007;45(2):506–11.doi:10.1128/JCM.02042-06
69.Meade BD,Bollen A.《聚合酶链式反应在乳腺癌诊断中的应用推荐》百日咳博德特菌。 医学微生物学杂志 1994;41:51–5.
70.Mandal S,Tatti KM,Woods-Stout D,等.百日咳假暴发与被百日咳博德特氏菌诊所表面的DNA。小儿科 2012;129:e424–30。doi:10.1542/2011-1710年
71.福克纳,斯科夫,唐德拉,等。1990-2012年美国百日咳诊断检测的趋势. 儿科传染病杂志2016;35(1)39–44.doi:10.1097/INF . 00000000000021
72.疾病控制中心。卫生保健专业人员使用聚合酶链反应(PCR)诊断百日咳的最佳实践。2011.佐治亚州亚特兰大市:美国疾病预防控制中心,2011年。
73.塔蒂公里,火花千牛,博尼高,汤德拉毫升。新型多靶实时PCR快速检测博德特氏菌临床标本中的物种。临床微生物学杂志 2011;49:4059–66.doi:10.1128/JCM.00601-11
74.马尔尚CD,拉夫林AM,列特SM等。1981—1991年马萨诸塞州的百日咳:发病率、血清学诊断和疫苗有效性。感染疾病 1994;169:1297–1305.
75.门泽斯SL,卡德瓦德V,Pawloski LC,等。定量血清抗百日咳毒素抗体的免疫测定法的开发和分析验证百日咳博德特菌。 临床疫苗免疫2009;16(12):1781–8.doi:10.1128/CVI.00248-09
76.美国青少年和成人百日咳毒素、丝状血凝素和菌毛血清抗体水平诊断临界值的建立。临床诊断实验室免疫2004;11(6):1045–53.doi:2004年6月11日
77.Burgos-Rivera B,Lee AD,Bowden KE,等,《2005年协议水平评估》。博德特氏菌百日咳增加期间美国三个实验室的菌种鉴定。临床微生物学杂志 2015;53:1842–4.doi:10.1128/JCM.03567
78.Schmidtke AJ,Boney KO,Martin SW,等.种群多样性百日咳博德特氏菌分离物,美国,1935-2009。急诊传染病 2012;18:1248–55.doi:10.3201/开斋节
79.脉冲场凝胶电泳在流行病学研究中的应用百日咳博德特氏菌百日咳爆发时。临床微生物学杂志1994;32:398–402.1994年2月32日
80.Bisgard K,Christie C,Reising S,等。恶性肿瘤的分子流行病学百日咳博德特氏菌通过脉冲场凝胶电泳图谱:辛辛那提,1989-1996。感染疾病2001;183:1360–7.doi:10.1086/319858
81.Schouls LM,van der Heide HG,Vauterin L,等.荷兰人的多位点可变数目串联重复分析百日咳博德特氏菌菌株揭示了在20世纪90年代后期克隆扩张的快速遗传变化。j细菌醇2004;186:5496–505.doi:10.1128/JB . 186 . 16 . 5496-5505.2004
82.2012年华盛顿州百日咳流行的分子流行病学。临床微生物学杂志2014;52:3549–57.doi:10.1128/JCM.01189-14
83.李德杰,姚恩凯,齐佩娃,等。肿瘤的直接分子分型百日咳博德特氏菌来自提交用于诊断定量(实时)PCR的临床标本。医学微生物学杂志2012;61:1662–8.doi:10.1099/jmm 0.049585-0
84.处女MC。细菌的多位点序列分型。微生物学年鉴2006;60:561–88.doi:10.1146/annu rev . micro . 59 . 515855565656
J.肺炎球菌(IPD)
85.临床和实验室标准协会。抗菌敏感性测试的M100-S22性能标准;第二十二条信息补充。认可的标准。宾夕法尼亚州韦恩:临床和实验室标准研究所,2012年。
86.董W,蔡卓妍S,麦吉L,杰克森D,克鲁格曼KP,维达尔JE。利奈唑胺不敏感的rplD基因突变肺炎链球菌在美国分离出的菌株。抗菌剂化学试剂2014;58(4):2459–62.doi:10.1128/AAC.02630-13
87.梅特卡夫·BJ、乔楚亚·S、格茨·雷、Jr、李·Z、沃克·H、特兰·T等,利用全基因组测序确定美国2015年侵袭性肺炎球菌疾病分离株的耐药决定因素并预测其耐药表型。临床微生物感染2016;22(12):1002 E1–E8。doi:10.1016/j.cmi.2016.08.001
88.李燕,梅特卡夫BJ,乔楚亚S,李Z,Gertz RE,Jr .,沃克H,等.追踪和预测β-内酰胺类抗生素耐药水平的青霉素结合蛋白转肽酶特征肺炎链球菌. MBio2016;7(3)e 00756–16。10.1128/mBio.00756-16
89.Beall B,McEllistrem MC,Gertz RE Jr,等。1999、2001和2002年在美国收集的分离株的侵袭性肺炎球菌血清型的接种前和接种后克隆组成。活跃的细菌核心监视小组。临床微生物学杂志2006;44(3):999–1017.doi:10.1128/JCM.44.3.999-1017.2006
90.Pai R,Gertz RE,Beall B,等。序贯多重PCR方法检测猪链球菌荚膜血清型肺炎链球菌. 临床微生物学杂志2006;44(1):124–31.2006年1月44日至131日
91.Carvalho MG,Tondella ML,McCaustland K,等。实时PCR检测方法的评估和改进lytA,ply,和psaA用于检测肺炎球菌DNA的基因. 临床微生物学杂志2007:45(8);2460–66.doi:1128/JCM.02498-06
92.Dias CA,Teixeira LM,Carvalho MG,Beall B。序贯多重PCR检测巴西儿童肺炎球菌荚膜血清型. 医学微生物学杂志2007;56(9):1185–8.doi:1099/jmm.0.47347-0
93.莫莱斯,卡瓦略,罗卡,A,等。序贯多重PCR鉴定撒哈拉以南非洲临床分离肺炎球菌荚膜血清型. 医学微生物学杂志2007;56:1181–4.doi:1099/jmm.0.47346-0
K.脊髓灰质炎
94.Strebel PM、Sutter RW、Cochi SL等。最后一例本土野生病毒相关疾病报道十年后美国脊髓灰质炎的流行病学. 临床感染疾病1992;14:568–79.doi:10.1093/clinids/14.2.568
L.轮状病毒
95.格雷法学博士,德塞尔伯格大学,编辑。2000.轮状病毒,方法和方案。(分子医学方法)。纽约:Humana出版社,2000年。
96.小费希尔·TK·根茨。轮状病毒分型方法和算法. 医学病毒学修订版2004;14:71–82.货币指数:10.1002/411
97.轮状病毒。肠道病原体的诊断测试。(实验室医学诊所)。费城:爱思唯尔,2015。
M.风疹
98.Namuwulya P,Abernathy E,Bukenya H,等。乌干达风疹病毒的系统发育分析, 2003-2012. 医学病毒学杂志2014;86(12):2107–13.doi:10.1002/jmv.23935
99.阿伯纳西E,C,孙H,等出疹4天内确诊风疹:口腔液中风疹病毒RNA检测与血清或口腔液中免疫球蛋白M检测的比较. 临床微生物学杂志2009;47(1):182–8.doi:10.1128/JCM.01231-08
100.2011-2012年罗马尼亚一起风疹暴发的流行病学和分子调查。欧洲监察2016;21(38):303–45.doi:10.2807/1560-7917
101.库尔茨JB,安德森MJ。风疹和细小病毒特异性IgM试验中的交叉反应。柳叶刀 1985;2:1356.
102.风疹特异性IgM的假阳性检测。儿科传染病杂志 1991;10:415–6.
103.贝利尼WJ,冰酒JP。麻疹和风疹病毒。在:乔根森JH,法勒马,卡罗尔KC,方克G,兰德里ML,里希特SS,和沃诺克DW,编辑。临床微生物学手册,第11版。DC华盛顿:美国微生物学会;2015:1519–35.
104.哈姆卡尔R,贾里万德S,莫赫塔里-阿扎德T,等。IgM酶免疫测定法和IgG亲和力测定法用于区分风疹疫苗的初次和二次免疫反应的评估。病毒学方法2005;130(1–2):59–65.doi:2005年6月10日
105.Hofmann J,Liebert UG .孕妇风疹IgM阳性血清标本亲和力和免疫印迹分析的意义。病毒学方法2005;130(1–2):66–71.doi:016/j.jviromet.2005.06.004
N.CRS
106.Bosma TJ,Corbett KM,Eckstein MB,等。临床样本中风疹病毒RNA的PCR检测。临床微生物学杂志1995;33:1075–9.1995年5月33日
上次审阅时间:2023年1月11日
来源:国家免疫和呼吸疾病中心





尊敬的孟博士:
您好!如果以前只打过一针,还是十多年前大概07.08年打的,会产生抗体吗?这次只打了两针能否激活以前的抗体呢?大概需要多久?如果不能激活以前的抗体,这样的打法大概首针之后多久能安全呢?
感谢解答!
如果暴露,需要全程接种,只打1针,不太确定是否能产生抗体。