19岁以上成人肺炎球菌疫苗:美国免疫实践咨询委员会的建议,2023年
Miwako Kobayashi, MD1; Tamara Pilishvili, PhD1; Jennifer L. Farrar, MPH1; Andrew J. Leidner, PhD1; Ryan Gierke, MPH1; Namrata Prasad, PhD1; Pedro Moro, MD2; Doug Campos-Outcalt, MD3; Rebecca L. Morgan, PhD4; Sarah S. Long, MD5; Katherine A. Poehling, MD6; Adam L. Cohen, MD1
摘要
本报告汇编并总结了美国疾病预防控制中心免疫实践咨询委员会(ACIP)发布的所有关于美国19岁以上成人使用肺炎球菌疫苗的建议。该报告还包括CDC更新的和新的临床指南。
在2021年之前,ACIP建议根据年龄和肺炎球菌疾病的潜在风险,在美国成人中单独使用23价肺炎球菌多糖疫苗(PPSV23)(最多2剂),或同时使用单剂13价肺炎球菌结合疫苗(PCV13)和1-3剂PPSV23串联疫苗(PCV13后接PPSV23)。2021年,食品药品监督管理局批准了两种新的肺炎球菌结合疫苗(PCV),一种15价和一种20价PCV (PCV15和PCV20),用于美国18岁以上的成年人。
ACIP的建议规定,对于年龄≥65岁的所有成年人,以及年龄在19-64岁、具有某些潜在疾病或其他危险因素、未接种过PCV或疫苗接种史未知的成年人,单独使用PCV20或PCV15与PPSV23串联使用。此外,ACIP建议使用单剂量的PCV20或≥1剂量的PPSV23用于已经开始使用PCV13的肺炎球菌疫苗系列但没有接种所有推荐剂量的PPSV23的成人。对于年龄≥65岁且已完成PCV13和PPSV23疫苗推荐系列的成年人,建议共享关于使用补充PCV20剂量的临床决策。
CDC更新和新的临床实施指南包括对已接种PPSV23但未接种任何PCV剂量的成人使用PCV15或PCV20的建议。该报告还包括对仅接种7价PCV (PCV7)的成人和接种造血干细胞移植的成人的临床指导。
介绍
肺炎球菌感染由以下原因引起肺炎链球菌(肺炎球菌),一种革兰氏阳性兼性厌氧菌。肺炎球菌可寄居在上呼吸道,最常见于幼儿,并通过接触上呼吸道肺炎球菌寄居者的呼吸飞沫传播给他人(1)。某些肺炎球菌定植者可能会患上侵袭性肺炎球菌疾病(IPD)(2)。IPD是正常无菌部位的感染,包括肺炎伴菌血症、脑膜炎、骨髓炎、脓毒性关节炎和无感染病灶的菌血症;非侵袭性疾病的例子包括无菌血症的肺炎、鼻窦炎或中耳炎。在成人中,肺炎球菌性肺炎是最常见的肺炎球菌疾病类型,并且肺炎球菌是导致住院疫苗的肺炎的最常见细菌原因(3)。
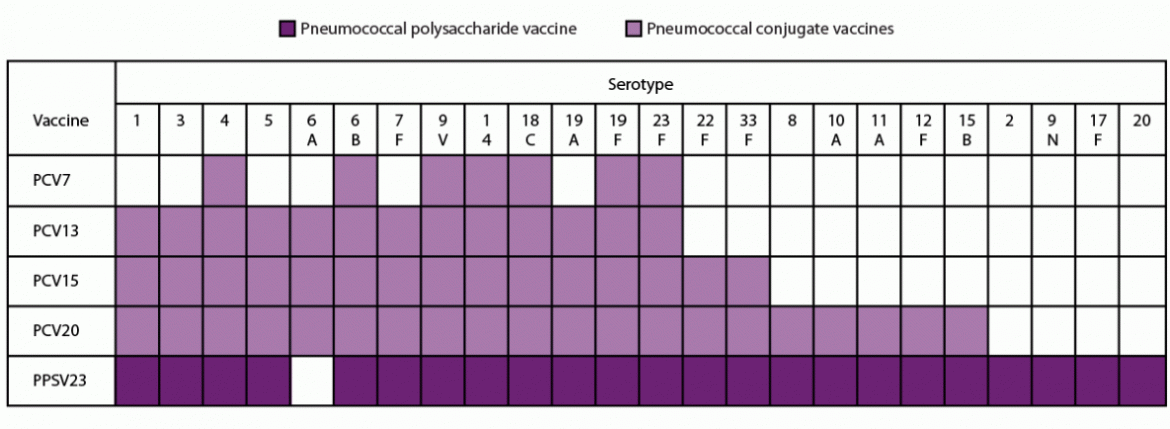
肺炎球菌根据其荚膜多糖分为血清型,荚膜多糖是肺炎球菌的主要毒力因子(4)。截至2020年,至少记录了100种肺炎球菌血清型(5–7)。在2018-2019年期间,约60%-75%的成人IPD是由24种肺炎球菌血清型引起的,这些血清型包括在市售多糖结合疫苗(PCV)或肺炎球菌多糖疫苗(PPSV)疫苗(即,PCV13、PCV15、PCV20和PPSV23)的配方中(图)。目前的肺炎球菌疫苗使用肺炎球菌荚膜多糖作为抗原来产生血清型特异性抗体,其通过调理吞噬作用促进肺炎球菌的血清型特异性清除(4)。PPSV23(23价肺炎多糖疫苗)是一种23价疫苗,自20世纪80年代以来一直被推荐用于年龄≥2岁且患有某些基础疾病的人和年龄≥65岁的成人(表1)(图)。在2000年,免疫实践咨询委员会(ACIP)建议在所有小于2岁的儿童中使用PCV7 (佩儿),这是第一种7价肺炎多糖蛋白结合疫苗(8)。在儿童中使用PCV7不仅降低了那些直接建议接种疫苗的人的肺炎球菌疾病的发病率,而且通过间接作用降低了那些不建议接种疫苗的较大儿童和成人的发病率(9)。在2010年,一种13价的PCV13 (佩儿13)取代了PCV7(不再生产),并被推荐用于所有2-59个月大的儿童(10)。在2012年,ACIP建议除了PPSV23之外,PCV13还用于年龄≥19岁的患有免疫低下疾病、功能性或解剖性无脾症、脑脊液(CSF)漏或耳蜗植入的成年人(11)。2014年,ACIP建议所有年龄≥65岁的成年人常规使用PCV13和PPSV23(12)。这一建议得到了一项大型随机对照试验(RCT)的支持,该试验在荷兰年龄≥65岁的社区居住成人中进行,证明了PCV13对非侵袭性肺炎球菌肺炎(13)。2019年6月,ACIP投票决定不再向所有年龄≥65岁的成年人常规推荐PCV13,而是在共享临床决策的基础上,向年龄≥65岁的成年人推荐PCV13,这些成年人没有免疫妥协状况、脑脊液漏或耳蜗植入(14)。这一决定的基本原理是基于更多年的数据,这些数据发现,在对所有年龄≥65岁的成年人实施PCV13建议后,成人中可通过PCV13预防的肺炎球菌疾病的发病率变化极小,以及归因于儿科使用PCV13的间接影响的PCV13型疾病的历史低水平。虽然解剖或功能性无脾症、慢性肾衰竭和肾病综合征可能不被认为是免疫妥协(15),由于疫苗建议中的相似性,这些条件被包括在肺炎球菌疫苗建议的免疫妥协条件下。
新ACIP建议
年龄≥19岁、患有免疫功能低下疾病、脑脊液漏或人工耳蜗植入、接种过PCV13和PPSV23但疫苗接种不完全的成年人,建议在最后一剂肺炎球菌疫苗后至少间隔5年接种一剂PCV20或接种≥1剂PPSV23(表2, 3,以及4)。
—当使用第二种PPSV23代替PCV20时,应在接种PCV13≥8周后,并在接种第一种PPSV23后≥5年,适用于19-64岁患有免疫功能低下疾病的成人,但不适用于有脑脊液漏或耳蜗植入的成人(表3)。此外,患有免疫功能低下、脑脊液漏或耳蜗植入的成年人,如果同时接种了PCV13和PPSV23(无PCV20)疫苗,但在年龄≥65岁时未接种PPSV23疫苗,则建议在年龄≥65岁时接种PCV20疫苗,或在距离上次PPSV23疫苗≥5年后接种单次最终剂量的PPSV23疫苗(11)(表2、表3和表4)。
对于年龄≥65岁的成年人,如果他们已经完成了PCV13(在任何年龄)和PPSV23(在年龄≥65岁时接种)的推荐疫苗系列,则建议共享关于使用PCV20的临床决策(表2)。与常规、追赶和基于风险的建议不同,共享临床决策疫苗并不推荐给特定年龄组的每个人或可识别风险组的每个人。相反,共享的临床决策建议是基于个人的,并由卫生保健提供者和患者或监护人之间的决策过程来指导。
建议年龄≥19岁且仅接种过PCV13的成人在接种PCV13剂量后间隔≥1年接种单剂PCV20,或接种≥1剂PPSV23以完成其肺炎球菌疫苗系列。
—当使用PPSV23代替PCV20时,对于患有免疫功能低下、脑脊液漏或耳蜗植入的成人,PCV13和PPSV23接种之间的最小建议间隔为≥8周,对于无这些情况的成人,建议间隔为≥1年(11)(表2、表3和表4)。对于19-64岁患有特定免疫缺陷疾病的成年人,建议在第一次PPSV23剂量≥5年后接种PCV20或第二次PPSV23剂量,但对于有脑脊液漏或耳蜗植入的成年人则不建议(表3)。此外,那些同时接种了PCV13(在任何年龄)和PPSV23(没有接种PCV20)但在年龄≥65岁时没有接种PPSV23剂量的患者,建议在年龄≥65岁时接种PCV20或单次和最终剂量的PPSV23,并且距离上次PPSV23剂量≥5年(11)(表2)。
更新的CDC实施指南
建议年龄≥19岁且仅接种过PPSV23的成人在接种最后一剂PPSV23后间隔≥1年接种一剂PCV20或PCV15(表2、3、4和5)。这份疾病预防控制中心的指导方针被提交给了ACIP,但是没有进行全票表决。
CDC新的实施指南
任何年龄仅接种过PCV7的成人应遵循针对未接种肺炎球菌疫苗或疫苗接种史未知的成人的建议(表2、3、4和5)。
接种造血干细胞移植(HSCT)的19岁以上成年人,建议在HSCT后3-6个月开始接种4剂PCV20。从HSCT后3-6个月开始,间隔4周接种3剂PCV20。第三剂PCV20后≥6个月或HSCT后≥12个月,以较晚者为准,给予第四剂PCV20。如果PCV20不可用,可给予间隔4周的3剂PCV15,然后在HSCT后≥1年给予单剂PPSV23。对于正在接种PCV15疫苗的慢性移植物抗宿主病(GVHD)患者,可以使用第四剂PCV15代替PPSV23,因为这些成人对PPSV23的反应较低。最好通知患者的临床团队来确定接种疫苗的适当时机(表6)。
这些疾病预防控制中心的指导方针被提交给ACIP,但没有进行全票表决。
方法
ACIP的肺炎球菌疫苗工作组包括ACIP的投票成员;ACIP当然组织和联络组织的代表;以及在公共卫生、疫苗学、医学专业(例如,家庭实践、老年病学、传染病、内科和儿科)、疫苗研究和疫苗有效性和安全性评估方面具有专业知识的科学顾问。工作组审查并讨论了以下主题:肺炎球菌疾病流行病学、肺炎球菌疫苗安全性、新许可疫苗的免疫原性、现有肺炎球菌疫苗的功效和有效性、肺炎球菌疫苗覆盖率、计划可行性、健康公平性和成本效益。该报告更新并取代了之前发布的ACIP成人肺炎球菌疫苗使用建议(11,12,14,16–18)。工作组使用“从证据到建议(EtR)”框架和“建议评估、制定和评估(等级)分级”来组织、评估和讨论信息,以创建建议(19)。根据肺炎球菌疫苗工作组的专家意见和2022年10月17日完成的文献搜索结果,总结了用于对建议进行一般性澄清的数据,并在出版前进行了更新。所有产生相关信息的研究都被认为与纳入相关。
2010年,ACIP在对文献进行系统综述后,采用等级法评估证据的确定性(20)。随后使用分级方法提出的ACIP建议包括:免疫缺陷成年人常规使用PCV13和PPSV23(11);年龄≥65岁的成人常规使用PCV13(12);对于年龄≥65岁且无免疫缺陷、脑脊液漏或人工耳蜗植入的成年人,共享关于使用PCV13的临床决策(14);年龄在19-64岁、患有某些潜在疾病或其他风险因素的成年人以及所有年龄≥65岁、之前未接种肺炎球菌结合疫苗或疫苗接种史未知的成年人使用PCV15或PCV20(16);以及在以前接种过PCV13的成人中使用PCV20。这些建议的等级证据表可在(https://www . CDC . gov/vaccines/acip/RECs/grade/table-refs . html)。
对于本报告中的新ACIP建议,更新了2021年2月进行的系统文献搜索,以审查关于成人中PCV15和PCV20的免疫原性和安全性的现有证据(21–24)。等级仅用于证明之前接种过PCV13的成人使用PCV20。为了确定2021年3月至2022年3月期间发表的其他文献,使用之前的搜索词搜索了PubMed Medline、Embase、CINAHL、Scopus、Epistemonikos和Cochrane图书馆数据库。使用术语“20价肺炎球菌疫苗,成人”搜索ClinicalTrials.gov,使用术语“PCV20”或“20价肺炎球菌疫苗”搜索PubMed Medline(https://stacks.cdc.gov/view/cdc/131260)。疫苗制造商提供了通过ClinicalTrials.gov鉴定但尚未公开的试验的未发表数据。使用分级(19)。
2018年,ACIP通过了EtR框架,以促进评估并确保在制定疫苗建议时考虑的其他因素的透明度,包括目标人群的价值观和偏好、资源使用、公平性、可接种性和实施的可行性(25)。使用EtR框架进一步评估了2019年≥65岁成人使用PCV13、19-64岁具有某些潜在疾病或其他风险因素的成人或所有≥65岁成人使用PCV15或PCV20以及先前接种PCV13的成人使用PCV20的更新建议(26)。当数据不可用时,会征求肺炎球菌疫苗工作组成员的专家意见(https://www.cdc.gov/vaccines/acip/recs/grade/etr.html)。
为了评估PCV13和PPSV23的安全性,对总结了两个上市后监测系统数据的已发表文献进行了搜索:疫苗不良事件报告系统(VAERS)(https://www . CDC . gov/vaccine safety/ensuring safety/monitoring/vaers/index . html)和疫苗安全数据链(VSD)(https://www . CDC . gov/vaccine safety/ensuring safety/monitoring/VSD/index . html)。VAERS是由CDC和食品药品监督管理局(FDA)运营的国家被动公共卫生监测系统,接种来自任何人的报告,包括卫生保健专业人员、疫苗制造商、患者和护理人员(27)。鼓励卫生保健专业人员和患者报告临床上重要的或意外的不良事件,即使他们不确定事件是否与疫苗相关。对于严重不良事件(SAE)(例如,死亡、危及生命的事件、住院、接种疫苗后永久残疾或出生缺陷)的报告,VAERS的工作人员会定期要求提供医疗记录(27)。VAERS可以识别罕见的不良事件,并快速检测可能的安全问题,产生疫苗安全假设,供其他来源评估;然而,VAERS数据通常不能用于确定疫苗是否引起不良事件。
VSD是美国疾病预防控制中心、参与站点和网络之间的合作项目,使用来自参与站点的电子健康数据来监控和评估疫苗的安全性。VSD包含人群安全性研究,可用于评估来自医学文献综述、VAERS报告、疫苗接种计划变更或新疫苗引进的假设(28)。对于所有肺炎球菌疫苗,对VAERS进行了额外审查,以评估截至2022年8月31日报告的安全性数据。
ACIP肺炎球菌疫苗工作组定期召开电话会议(通常每月一至两次)。邀请工作组以外的专家介绍当前的研究并讨论已发表和未发表的数据。工作组总结并向ACIP提交了证据,以帮助制定建议。当考虑新的肺炎球菌疫苗建议(例如,新的年龄适应症或疫苗接种方案)时,或当其他群体被确定有患肺炎球菌疾病的风险时,进行ACIP投票。2022年10月19日的ACIP会议讨论了该报告中的新ACIP建议。当时,ACIP成员投票批准了以下成人肺炎球菌疫苗建议草案:对于患有免疫功能低下、脑脊液漏或耳蜗植入的成人,使用单一剂量的PCV20或PPSV23,这些成人已经开始使用PCV13的肺炎球菌疫苗系列,但尚未接种所有建议的PPSV23剂量;对于年龄≥65岁且已完成PCV13和PPSV23疫苗系列推荐的成年人,共享关于使用PCV20的临床决策;和使用单一剂量的PCV20或PPSV23,如先前推荐的仅接种PCV13的成人。这些建议基于新冠肺炎疫情之前的肺炎球菌疾病负担数据,因为自疫情疫情爆发以来,肺炎球菌疾病的发病率一直呈动态变化(即,疫情早期侵袭性肺炎球菌疾病减少,有报告称在国家放松非药物干预后增加) (29,30)。此外,工作组和ACIP成员审查并评论了CDC最新指南草案,该草案适用于仅接种PPSV23的成人、仅接种PCV7的成人和接种HSCT的成人。实施指南在10月19日的会议上提出,并附有支持数据,但没有经过表决,因为其目的只是为如何将新ACIP建议应用于特定人群提供指导。
肺炎球菌的传播
肺炎球菌可以在人类的上呼吸道定居,并且肺炎球菌定居的流行通常在出生后的前2年增加,之后减少(2,31)。肺炎球菌主要通过肺炎球菌携带者的呼吸飞沫传播,由于肺炎球菌定植的频率较高,幼儿是社区中常见的肺炎球菌宿主(2)。在老年人中,那些住在养老院、吸烟或经常与< 6岁儿童接触的人比没有这些危险因素的人肺炎球菌携带率更高(32)。肺炎球菌定植是疾病的先兆,并且肺炎球菌可以扩散到上呼吸道之外,并导致从通过从上呼吸道局部扩散的急性中耳炎,到通过吸入的肺炎,或通过菌血症的IPD如菌血症或脑膜炎(1)。上呼吸道中的炎症状况,尤其包括呼吸道病毒的共感染,可增加上呼吸道中肺炎球菌的密度,并促进向肺部的传播和微呼吸(1)。在全球范围内,新冠肺炎疫情(33,34)。然而,对儿童的某些研究表明,肺炎球菌携带在此期间没有变化,肺炎球菌疾病的减少归因于呼吸道病毒(如流感病毒和呼吸道合胞病毒)流通的减少,因为实施了非药物干预(34–36)。
美国成人肺炎球菌疾病的流行病学
在成人中,肺炎球菌疾病的风险随着年龄的增长而增加。肺炎球菌肺炎是成人中最常见的肺炎球菌疾病,估计约占住院社区获得性肺炎(CAP)病例的10%(37)。根据商业索赔和遭遇数据,在2014年,每100,000人年中估计有680(18-49岁的成人)到9,570(85岁以上的成人)的全因肺炎病例导致医疗保健使用;在2008年至2014年期间,导致住院疫苗的全因肺炎病例比例在较大年龄组中较高,从18岁至49岁成人的8.5%到≥85岁成人的38.6%(38)。当仅限于收集2010-2016年期间数据的研究时,对美国全因CAP住院文献的系统综述表明,估计发病率范围为每100,000名年龄< 65岁的成年人126-422例,每100,000名年龄≥65岁的成年人847-3,365例(39)。在一项对住院非细菌性肺炎球菌肺炎(NBPP)患者的多州监测研究中,2017年肺炎球菌肺炎的估计发病率为每100,000名18-49岁成年人12例,每100,000名≥65岁成年人105例(40)。对田纳西州纳什维尔和佐治亚州亚特兰大因肺炎的临床和影像学证据而住院的成人进行的一项评估报告称,肺炎球菌性肺炎的住院发病率为每100,000人中43-53人(41)。
关于非侵袭性肺炎球菌肺炎病例中肺炎球菌血清型分布的数据有限;呼吸道培养很少进行,可用数据主要依赖于血清型特异性尿抗原检测(SSUAD)试验,该试验仅可用于研究(37)。在一项对2013年10月至2016年9月期间因CAP住院的美国成年人进行的前瞻性多点研究中,该研究使用培养或SSUAD分离的肺炎球菌来确定肺炎球菌血清型,由PCV13血清型引起的住院全因肺炎病例的比例为4.6%(12,055例中的559例),由PCV15和PCV13 (22F和33F)中包含的两种血清型引起的比例为1.4%(12,055例中的166例)37)。IPD发病率和血清型分布数据可从CDC的主动细菌核心监测(ABCs)获得,这是一个基于实验室和人群的主动系统,覆盖美国10个站点,IPD监测的集水区人口约为3400万人(42)。2019年,IPD发病率从18-34岁成年人的每10万人中2.3人到85岁以上成年人的37.8人不等。在2018-2019年期间,在≥65岁的成年人中,由PCV13、PCV15、PCV20和PPSV23血清型引起的IPD的比例分别为27%、42%、54%和62%。
在PCV被推荐用于儿童后,PCV型肺炎球菌疾病在未被推荐接种该疫苗的成人中的发病率下降,包括那些有潜在疾病的人,他们患肺炎球菌疾病的风险增加(43)。然而,IPD发病率在2014-2019年期间保持稳定,最常见的剩余PCV13型血清型是血清型3(2018年期间年龄≥65岁的成人中62%的PCV13血清型) (44,45)。在因CAP住院的年龄≥65岁的美国成年人中,通过使用SSUAD或培养的肺炎球菌分离株评估的PCV13型血清型的比例从2013-2014年期间的5.3%下降到2015-2016年期间的3.4%。相比之下,在18-64岁的成人中,没有推荐接种PCV13疫苗的,具有PCV13型血清型的全因性CAP病例的比例没有变化。值得注意的是,与年龄≥65岁的成年人相比,后一组的参与者人数较少(6347名年龄≥65岁,2976名年龄在18-64岁的风险增加,868名年龄在18-64岁的低风险状况);因此,血清型分布可能不太稳定(46)。
在2020年,全球观察到IPD发病率下降,这种下降被认为是由于引入了非药物干预措施来控制新冠肺炎疫情(例如,戴口罩,呆在家里,限制室内聚集),这也可能减少了南肺炎 (33)。在美国,与基于2014年1月至2020年2月数据的预期IPD率相比,2020年3月至12月观察到的IPD率在所有年龄组中低58%,在≥65岁的成年人中低68%47)。然而,来自欧洲和美国的最新数据表明,在各国放松非药物干预后,IPD病例有所增加(29,30,45)(主动细菌核心监测,CDC,未公布数据,2022年11月8日)。
肺炎球菌疫苗覆盖率
在2014年ACIP建议对年龄≥65岁的成年人常规使用PCV13后,该人群的PCV13疫苗接种覆盖率增加(12)。在年龄≥65岁的医疗保险A/B部分受益人中,接种至少1剂PCV13的比例从2014年的3%增加到2019年的49%,同时接种PCV13和PPSV23的比例从2014年的2%增加到2019年的32%(48)。由于肺炎球菌疾病的风险因素,建议接种肺炎球菌疫苗的19-64岁成年人的肺炎球菌疫苗覆盖率一直较低(见肺炎球菌疾病风险增加的群体)。2018年,国家健康访谈调查的结果表明,23%的19-64岁肺炎球菌疾病风险增加的成年人曾接种过肺炎球菌疫苗(49)。年龄在19-64岁的成人中新诊断的被认为是肺炎球菌疾病风险因素的医疗条件的行政索赔数据表明,在随访期间(自诊断后1-7年)肺炎球菌疫苗的总覆盖率为14%,并且因条件而异;诊断患有艾滋病毒/艾滋病的人的肺炎球菌疫苗接种覆盖率最高(48%),相比之下,诊断患有酒精依赖的人的疫苗接种覆盖率最高(6%)(50)。疫苗覆盖率因社会人口特征而异,西班牙人的肺炎球菌疫苗覆盖率始终低于其他种族或族裔群体,无论是年龄≥65岁的成年人还是具有风险因素的年轻成年人(48,49,51)。
肺炎球菌疾病高危人群
在成人中,肺炎球菌感染的风险随着年龄的增长而增加。此外,与没有这些疾病的成年人相比,患有某些潜在疾病或风险因素的成年人患肺炎球菌疾病的风险更高,因此无论年龄如何,都有基于风险的肺炎球菌疫苗建议(表7)。
患有慢性心脏病的人
据报道,与没有慢性心脏病的人相比,患有慢性心脏病(包括充血性心力衰竭和心血管和瓣膜疾病)的人患CAP的几率高达3.3倍,患IPD的几率高达9.9倍(52)。在患有慢性心脏病的成年人中,CAP的风险更高,尤其是在那些患有严重充血性心力衰竭(52)。肺炎球菌疫苗接种与患有心血管疾病或心血管风险极高的成年人的全因死亡率降低22%相关(53)。
吸烟的人
目前的吸烟状况与老年人携带肺炎球菌的风险增加有关(32),封顶的风险随着包装年数的增加而增加(52)。在已发表的文献中,吸烟者的IPD风险报告的变化更大(52),尽管一项使用美国基于实验室和人群的IPD监测数据进行的分析表明,与没有增加肺炎球菌疾病风险的基础疾病的成年人相比,吸烟(定义为过去一年内的任何吸烟)的IPD风险为2.8-4.1倍(43)。对这种风险增加的潜在解释包括肺炎球菌携带风险增加和对呼吸道病毒感染的易感性增加(32)。
患有慢性肺病的人
患有慢性阻塞性肺病(COPD)的人比患有其他慢性肺病(52,54–56)。在因慢性阻塞性肺病住院的40岁以上的成人中,慢性阻塞性肺病患者患慢性阻塞性肺病的风险是非慢性阻塞性肺病患者的18倍(57)。慢性阻塞性肺疾病患者的风险增加可能是因为吸入性皮质类固醇使用增加、气道防御机制减弱以及与吸烟(52,54)。以前,哮喘不被认为会增加肺炎球菌疾病的风险,除非它伴有慢性支气管炎、肺气肿或长期全身使用皮质类固醇(58)。然而,在2010年,ACIP更新了建议,增加了哮喘作为肺炎球菌疫苗接种的指征,其依据是数据表明哮喘病史与IPD风险增加相关,即使在调整了潜在条件后(59,60)。
糖尿病患者
据报道,糖尿病患者(1型或2型)患CAP的风险是非糖尿病患者的1.4倍(52)和1.4-5.9倍的IPD风险43,52)。较年轻的糖尿病患者患肺炎球菌疾病的相对风险较高(52)。例如,在丹麦进行的一项基于人群的病例对照研究发现,年龄< 40岁的糖尿病患者与非糖尿病患者相比,肺炎相关住院的相对危险度为3.2,而年龄≥80岁的成人随着年龄的增长,相对危险度下降至1.1(61)。除了与糖尿病相关的可增加肺炎球菌疾病风险的共病之外,由持续高血糖症导致的免疫系统受损也被认为是感染风险增加的原因(52,62,63)。
过度饮酒的人
过量饮酒与针对细菌性肺炎的宿主免疫反应受损有关(64–66)并且已经与具有剂量反应关系的CAP风险增加相关联(67,68)。在一项系统综述中,患有临床定义的酒精使用障碍的成年人患CAP的风险比没有酒精使用障碍的成年人高8.2倍(68)。据报道,与没有潜在疾病的成年人相比,IPD风险高2.3-7.7倍(43,69)。
慢性肝病患者
在患有慢性肝病的成人中,尤其是患有肝硬化的成人中,细菌感染的发病率和死亡率的风险很高(70,71)。在一项医疗保健索赔库的回顾性队列研究中,与无潜在健康状况的成年人相比,患有慢性肝病的成年人全因肺炎的发病率高4.1-5.6倍,肺炎球菌肺炎的风险高4.3-6.4倍,IPD的发病率高6.4-10.2倍(69)。在另一项使用IPD监测数据的研究中,IPD发病率比没有潜在疾病的成年人高3.8-15.4倍(43)。
人工耳蜗植入者
在2002年,接种人工耳蜗植入的人患细菌性脑膜炎的风险增加,肺炎球菌是最常见的病原体(72)。因此,CDC更新了肺炎球菌疫苗建议,将人工耳蜗植入者纳入肺炎球菌疾病高危人群(73)。在实施人工耳蜗植入后2年以上,观察到脑膜炎风险增加(72,74)。医疗保健索赔数据表明,与没有任何潜在疾病的人相比,年龄≥65岁的人工耳蜗植入成年人患IPD的风险为10.5倍(69)。这项研究发现,与没有潜在疾病的成年人相比,植入人工耳蜗的成年人患全因肺炎和肺炎球菌肺炎的风险也增加了(69)。
脑脊液漏的人
因各种原因(如先天性损伤、颅骨骨折或神经外科手术)导致脑脊液漏的患者,由于大脑天然屏障的解剖缺陷(75,76)。在患有社区获得性细菌性脑膜炎的成人队列中,59%的脑脊液漏成人之前曾患过脑膜炎(75)。对北加州凯泽医疗机构(KPNC)成员的一项研究表明,脑脊液漏的成年人患IPD的风险是所有成员的6.4倍(77)。
患有功能性或解剖性无脾症的人
脾脏在从血流中清除被包裹的细菌(例如肺炎球菌)中起着重要作用,因为被包裹的细菌逃避调理作用,从而被巨噬细胞直接识别(78)。因此,患有功能性或解剖性无脾症(如镰状细胞病或脾切除术)的成人感染肺炎球菌的风险更高。卫生保健声称数据表明,与没有任何潜在疾病的成人相比,患有功能性或解剖性无脾症的成人患全因性肺炎的风险增加8.5-18.2倍,患IPD的风险增加14.0-32.6倍(69)。
患有慢性肾病的人
患有慢性肾病(CKD)的人,特别是患有肾病综合征和终末期肾病(ESRD)的人,具有改变的免疫系统(79,80)并增加患肺炎球菌疾病的风险。一项针对KPNC成员的研究表明,与KPNC成员整体相比,患有3或4期CKD(肾小球滤过率[GFR]为15–59mL/min)的成人患IPD的风险是1.2倍,患有ESRD(GFR < 15mL/min或正在透析)的成人患IPD的风险是3.7倍(77)。2012年肾病:改善全球结果临床实践指南建议4和5期CKD成人接种肺炎球菌疫苗(81)。一项比较患有CKD的成人和健康成人中PPSV23的免疫原性的研究发现,患有CKD的成人对PPSV23的免疫反应显著较低(82)。另一项研究报道了在患有CKD的儿童和年轻人中接种PPSV23后抗体水平的快速下降(83)。已知接种透析的人抗体浓度快速下降,这可能与适应性免疫系统受损以及通过透析逐渐去除一部分血清抗体有关(83,84)。
患有原发性或继发性免疫缺陷疾病的人
患有原发性(先天性)免疫缺陷(即导致B细胞或T细胞缺乏、补体缺乏或吞噬细胞功能障碍的疾病)或继发性(获得性)免疫缺陷(如艾滋病毒感染、造血系统恶性肿瘤以及放射疫苗或免疫抑制药物疫苗)的人感染或出现疫苗可预防疾病(包括肺炎球菌疾病)的严重症状的风险增加(43,69,77,85,86)。在这些成人中,对肺炎球菌疫苗的免疫应答,尤其是对PPSV23的应答被认为是减弱的和短暂的(87–90)。有关与不同医疗条件和疫苗相关的免疫抑制程度的更多信息,可通过ACIP免疫能力改变者疫苗接种的一般最佳实践获得(15),CDC的黄皮书(91),以及2013年IDSA免疫缺陷宿主疫苗接种临床实践指南(92)。获得HSCT奖的成年人将被单独处理。
患有其他疾病、职业或环境暴露或生活条件的人员
在某些报告中,其他医疗条件、职业或环境暴露或生活条件与肺炎球菌疾病风险增加相关,但不属于基于风险的肺炎球菌疫苗建议的一部分。这些群体中的人包括患有肥胖症的成年人(93,94),经历无家可归的成年人(95–97),以及从事电焊工工作的成年人(98–100)。
肺炎球菌疾病爆发环境中的管理
据报道,在聚集场所,如医院病房(101)、军事训练设施(102,103)、惩教设施(102,103),以及长期护理设施(104–106)。CDC没有对肺炎球菌疾病患者的密切接触者使用暴露后抗菌化学预防或在爆发期间使用肺炎球菌疫苗的建议。然而,除了感染预防和控制措施,如加强手和呼吸卫生、患者隔离或患者同组、限制患者活动或关闭受影响的病房或单元(107–109)。
使用抗菌化学预防可以消除肺炎球菌携带,并在疫情爆发期间中断易感人群之间的持续传播(107)。最近的一项系统综述发现,在封闭环境中用于控制疫情的抗生素选择和用药方案是可变的,这可能取决于抗生素的敏感性模式(108)。据报道,在最近的疫情中,使用阿奇霉素、苄星青霉素G、阿莫西林或左氧氟沙星可预防更多病例(102,107)。如果暴露者接种了含有循环肺炎球菌血清型的疫苗,预计他们会比接种抗菌化学预防疫苗的人获得更长期的肺炎球菌疾病保护(107)。具体而言,PCV比PPSV23具有优势,因为这些疫苗可以诱导高水平的血清型特异性免疫球蛋白G (IgG ),以帮助保护接种疫苗的人免受疫苗型肺炎球菌携带(110,111)。据报告,在肺炎球菌疫苗覆盖率低的环境中,爆发了疫苗血清型肺炎球菌疾病(105,106,112)。因此,疫情提供了一个评估疫苗接种史的机会,并确保肺炎球菌疾病患者和暴露者都及时接种了推荐的疫苗。
肺炎球菌疫苗和接种
一个PPSV和三个PCV已获得许可,可在美国使用(表1)。这些疫苗是23价肺炎球菌多糖疫苗PPS v23(pneumovax 23);PCV13 (佩儿13),一种13价肺炎球菌结合疫苗;PCV15 (Vaxneuvance),15价肺炎球菌结合疫苗;以及20价肺炎球菌结合疫苗PCV20 (佩儿20)。PPSV和PCV疫苗以不同的方式诱导免疫反应。在小鼠中的研究发现,多糖疫苗诱导不依赖于T细胞的免疫反应,并刺激直接的B细胞反应(113)。结果,B细胞分化成产生抗体的浆细胞。然而,不依赖于T细胞的免疫反应不会产生血清型特异性记忆B细胞(114)。另一方面,结合疫苗诱导T细胞依赖性反应。多糖抗原与B细胞结合,来自载体蛋白的肽被呈递到载体肽特异性辅助T细胞。这些辅助性T细胞增强了B细胞的免疫反应,并且也产生了记忆性B细胞(114,115)。所有PCV都使用CRM197(基因解毒白喉毒素)作为载体蛋白(116–118)。
PCV15和PCV20以0.5 mL的剂量肌内接种。如果在PCV15或PCV20不易获得的情况下使用PCV13,则以0.5 mL的剂量进行肌肉注射。PPSV23以0.5毫升的剂量通过肌内或皮下接种。在一个年龄≥55岁的成人小RCT中,通过接种途径(119)。局部不良事件在皮下注射PPSV23的患者中更常见(18.9%[127例中的9例]对7.1%[127例中的24例]),而全身不良事件的频率在两组中相同(6.3%[127例中的8例])119)。所有三种肺炎球菌疫苗(即PCV15、PCV20和PPSV23)均可在单剂量预灌装注射器中获得。PPSV23也有单剂量小瓶。关于肺炎球菌疫苗接种的更多信息可在包装插页(116,117,120)。
疫苗效力和有效性
疫苗效力是指在安慰剂对照随机试验中,与未接种疫苗者相比,接种疫苗者目标疾病发生率降低的百分比。疫苗有效性(VE)通过观察性研究,在疫苗的常规、真实世界使用的背景下,测量与有效性相同的发病率降低百分比。目前没有关于PCV15或PCV20的疫苗功效和有效性数据。
23价肺炎球菌多糖疫苗(PPSV23)
PPSV23含有肺炎球菌多糖血清型1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19F、19A、20、22F、23F和33F(图)。在含有0.25%苯酚作为防腐剂的等渗盐水溶液中,每0.5毫升的剂量含有每种类型的多糖各25μg(120)。
成人的临床疗效和有效性
多个随机对照试验和观察性研究已经报道PPSV23对IPD有保护作用。一项随机对照试验的荟萃分析报告,针对任何血清型引起的IPD病毒,混合疫苗的功效为63%(95% CI = 10%–92%)121);纳入该荟萃分析的RCT未报告PPSV23对疫苗型(VT) IPD (VT-IPD)的疗效(122–125)。最近一项对观察性研究的荟萃分析报告,针对室性心动过速-IPD的综合VE估计值为45%(95% CI = 37%–51%),低于随机对照试验针对全因IPD的估计值,即使将VE估计值限制在PPSV23疫苗接种后≤5年(126)。较低的合并VE估计值可能是因为存在免疫功能低下的成年人,他们在登记时被排除在大多数RCT之外。在无免疫妥协情况的成人中,针对室性心动过速-IPD的综合VE估计值为60%(95% CI = 47%–69%)(126)。
对PPSV23抗肺炎球菌性肺炎的功效和有效性的估计在不同的研究中差异较大。评估PPSV23对肺炎球菌肺炎疗效的RCT的合并估计值为35%(95% CI = 62%至65%),但当结果仅限于两个被认为仅具有低偏倚风险的RCT时,合并估计值为64%(95% CI = 35%–80%)(121)。这些随机对照试验未报告对VT肺炎球菌肺炎的疗效。观察性研究报告了从无或不显著(127,128)到中度(40%–50%)(129,130)对抗肺炎球菌肺炎。这些观察性研究中报告的估计值的异质性可能是因为研究设计的差异,包括肺炎球菌肺炎病例的确定方式、研究环境(基于社区与基于医院)、患有基础疾病的成人比例或年龄分布。来自五项观察性研究的VT肺炎球菌性肺炎的合并VE估计值并不显著(VE = 18%;95%置信区间= 4%至35%)(126)。
免疫功能低下成年患者的临床疗效和有效性
在1995-1998年期间,在感染HIV的乌干达成年人中进行的一项RCT观察到,由于所有血清型(VE = 48%;95%置信区间= 232%至35%)或VT-IPD(VE = 114%;95%置信区间= 431%至14%)。值得注意的是,这项研究是在高效抗逆转录病毒疫苗广泛可用之前进行的,接种疫苗组和安慰剂组中有超过10%的人失访,每组中有28%的剩余参与者在研究期末死亡(131)。观察性研究表明,在感染艾滋病毒的成年人中,PPSV23 VE对IPD的疗效参差不齐(132–136)。三项间接队列研究报告了同一研究中不同风险组的室性心动过速-IPD效应(137–139)。通常情况下,患有免疫功能低下疾病的成年人的VE低于无基础疾病的成年人,并且在接种PPSV23疫苗后≥2年的老年人(年龄≥65岁)中,VE通常不显著(137,138)。
保护期限
PPSV23疫苗接种后保护持续时间的数据只能通过观察性研究获得。在一项来自英格兰和威尔士的大型间接队列研究中,自接种疫苗以来,PPSV23对VT-IPD的VE显著下降,从≤2年前接种疫苗者的48%(95% CI = 32%–60%)降至≥5年前接种疫苗者的15%(95% CI = 3%-30%)(p < 0.001)(137)。在英格兰和威尔士的另一项研究中,PPSV23对VT-IPD的VE从≤2年前接种疫苗者的41%(95% CI = 23%–54%)下降到2-4年前接种疫苗者的34%(95% CI = 16%–48%),以及≥5年前接种疫苗者的23%(95% CI = 12%–32%)(138)。尽管这种疫苗接种后VE随时间的差异没有统计学意义(p = 0.13),但样条模型显示VE在5年后从约50%下降到20%-25%的稳定水平。这两项研究都发现,无论接种疫苗的年龄如何,VE对抗VT-IPD的趋势都在下降。在这三项PPSV23预防肺炎持续时间的研究中,确定肺炎球菌肺炎的诊断标准各不相同(129,140,141)。然而,在所有确定的研究中,自接种疫苗以来,随着时间的增加,VE相对于CAP呈下降趋势。
重复PPSV23接种
细菌多糖疫苗的重复接种可能诱导对疫苗抗原的免疫耐受或低反应性(142)。在感染HIV的乌干达成年人中PPSV23的RCT中,研究人员假设,与接种安慰剂的人相比,接种PPSV23的人患肺炎球菌疾病的风险增加是由于多糖反应性B细胞克隆的破坏(131)。
一项调查重复接种PPSV23的免疫原性研究的系统综述发现,在短期内(即每次接种后≤2个月测量),再次接种PPSV23可能会诱导比初次接种更低的免疫应答;然而,这些差异在统计学上并不显著。当比较接种后> 2年测量的免疫反应时,与初始接种相比,用PPSV23再接种后针对某些血清型的抗体水平更高(143)。在一项更近期的免疫原性研究的系统综述中,当PPSV23剂量间隔< 5年时,某些血清型的重复PPSV23免疫反应低于初始接种,而在间隔≥5年的研究中没有发现低反应性的证据,间隔≥5年是推荐用于有≥2次PPSV23剂量指征的成人的间隔(144)。因为没有临床试验研究多剂量PPSV23方案,所以低反应性对肺炎球菌疾病的临床相关性尚不清楚。
安全
在1990年至2013年期间,使用VAERS的数据进行了PPSV23安全性的许可后审查,其中包括25,168份PPSV23接收后不良事件的报告。本研究中未发现安全信号或新的或意外的不良事件(145)。
对2014年1月1日至2022年8月31日期间VAERS数据的更新搜索发现了24,926份报告;23,763例(95.3%)为非严重,20,737例(83.2%)为年龄≥19岁的成年人,15,550例(62.4%)为女性(P Moro,MD,CDC,personal communication,2022年9月7日)。当单独接种PPSV23时,注射部位红斑(21.1%)、注射部位肿胀(19.3%)和注射部位疼痛(19.3%)是总体上最常报告的不良事件(基于MedDRA首选术语)。这些比率与成人接种的所有疫苗中普遍报告的不良事件相似:注射部位红斑(27.1%)、红斑(24.7%)、注射部位肿胀(23.6%)和注射部位疼痛(23.3%)。在报告的35例死亡中,30例为成人,2例为儿童,3例年龄不详。对这些死亡报告的临床审查未发现任何提示与PPSV23有因果关系的模式。在接种PPSV23后的26份过敏反应报告中,有一半是在单独接种PPSV23后发生的。在审查期间(2014年1月1日-2022年8月31日),26例过敏反应报告的VAERS报告率为美国分发的每百万剂PPSV23中1例,类似于所有疫苗中疫苗引发的过敏反应的发生率(每百万剂0.8例)146)。数据挖掘分析显示,在收到PPSV23后,未出现任何新的或意外的不良事件的不相称报告。
13价肺炎球菌结合疫苗(PCV13)
PCV13包含肺炎球菌多糖血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F,与无毒形式的白喉毒素CRM197结合(图)。每0.5毫升的剂量的疫苗含有大约2.2µg的所有血清糖,除了6B是4.4µg糖、34µg CRM197载的蛋白质,100µg聚山梨醇酯80,295 µg琥珀酸盐缓冲液,并125微克铝作为磷酸铝佐剂(118)。2021年,ACIP更新了PCV13建议,针对未接种肺炎球菌结合疫苗的成人,用PCV15或PCV20替代PCV13(16)。
在患有和未患有免疫妥协疾病的成人中的临床疗效和有效性
评估成人PCV13功效或有效性的研究有限。在84,496名年龄≥65岁的荷兰社区居住成人(未接种肺炎球菌疫苗)中的RCT(CAPiTA试验)报告了75%(95% CI = 41%–91%)的疫苗对VT-IPD的有效性,以及45%(95% CI = 14%–65%)的疫苗对首次VT-NBPP和非侵袭性肺炎球菌肺炎的有效性(3)。该试验在招募时排除了免疫功能低下的成年人。在年龄≥65岁的成人中,三项观察性研究对室性心动过速-IPD的VE估计值在47%至68%之间(147–149)。
三项测试阴性的病例对照观察性研究评估了PCV13对室性心动过速-NBPP的疗效,估计范围为38%至68%。每项研究都指出,大多数参与者都有≥1种潜在或高风险状况(128,150,151)。一项对西班牙约 200 万年龄≥50 岁的成年人进行的基于人群的队列研究并未证明 PCV13 对肺炎球菌肺炎或全因肺炎有保护作用,但接种 PCV13 的人与未接种 PCV13 的人的特征有显著差异,包括接种 PCV13 的人与未接种 PCV13 的人相比,年龄更大,免疫力低下的成年人比例更高 (152)。其他观察性研究也证明 PCV13 对全因肺炎(范围 = 5%-12%)的疗效153–156)。
在无免疫力低下慢性疾病(即患有慢性心、肺或肝脏疾病、哮喘或糖尿病)的成人中,CAPiTA 试验的事后分析观察到,针对 VT-IPD 的疫苗有效率为 77%(95% CI = 44%-91%)(157),针对首次 VT 肺炎球菌肺炎的疫苗有效率为 40%(95% CI = 11%-60%)(158)。PCV13 对免疫力低下的成人的效力和有效性数据有限。一项针对年龄≥65 岁、免疫力低下或患有慢性疾病的意大利成人的试验阴性研究观察到,PCV13 对 VT-CAP 的有效率为 40%(95% CI = -128% 至 89%)(151)。
保护期限
对 CAPiTA 试验进行的事后时间到事件分析发现,在整个试验期间(平均随访时间约为 4 年),PCV13 接种者与安慰剂接种者在所有结果上的无病存活率都有显著差异。疫苗对 VT-NBPP 和非侵入性肺炎球菌肺炎的有效率为接种 1 年后 44%,接种 5 年后 45%;疫苗对 VT-IPD 的有效率为接种 1 年后 67%,接种 5 年后 75%(159)。对 CAPiTA 试验中慢性病成人(不包括免疫力低下者)的数据进行的另一项事后分析也显示,PCV13 对 VT-CAP 的免疫效果显著且持久,平均持续时间为 4 年(158)。
安全
2012 年 6 月至 2015 年 12 月期间,我们利用 VAERS 的数据对 PCV13 的安全性进行了一次许可后审查,受试者为年龄≥19 岁的成年人 (160)。VAERS 共收到 2,976 份 PCV13 报告,其中 2,800 份(94.1%)为非严重报告,2,511 份(86%)为年龄≥65 岁者报告,465 份(14%)为年龄 19-64 岁者报告。注射部位红斑(28%)、注射部位疼痛(24%)和发热(22%)是 19-64 岁人群中最常见的不良反应(根据 MedDRA 首选术语)。在年龄≥65 岁的人群中,最常见的不良反应是注射部位红斑(30%)、红斑(20%)和注射部位肿胀(18%)。这项研究的结果与 PCV13 许可前研究的安全性数据一致。
一群研究在六个地点从VSD群在一月1日至2011年八月15,到2015年,评估了安全PCV13在成人年龄≥65岁,相比PPSV23增加的风险对于某些事先规定的不良事件(即,心血管的事件,贝尔麻痹、格林-巴利综合症,晕厥,多形性红斑、血小板减少、蜂窝组织炎和感染、过敏反应和过敏反应)。 总的313,136剂量的PCV13和232,591剂量的PPSV23都包括在内。 没有比率增加的不良事件之后PCV13行政当局岁的人≥65岁,相比PPSV23观察(161)。。
15价肺炎球菌结合疫苗(PCV15)
PCV15 除 PCV13 血清型外,还含有与 CRM197 连接的肺炎球菌多糖血清型 22F 和 33F(图)。每支 0.5 毫升的疫苗含有肺炎球菌多糖血清型 1、3、4、5、6A、7F、9V、14、18C、19A、19F、22F、23F 和 33F 各 2.0 μg 以及 4. 0 微克 6B、30 微克 CRM197 载体蛋白、1.55 毫克 L-组氨酸、1 毫克聚山梨醇酯 20、4.5 毫克氯化钠和 125 微克铝作为磷酸铝佐剂(116)。
未接种过肺炎球菌疫苗的成人的免疫原性
II期和III期RCT评估了1剂PCV15与PCV13在多个人群中的免疫原性和安全性:年龄≥50岁的健康成人(162,163),年龄在18-49岁的美国印第安人或阿拉斯加土著成年人(这些人口的IPD比率高于美国一般人口) (164)、肺炎球菌疾病风险条件≥1的成人(165),以及年龄≥18岁的HIV感染成人(CD4细胞计数≥50个细胞/μl和血浆HIV RNA < 50,000拷贝/mL)(166)。接种后1个月,使用调理吞噬活性(OPA)测定法测量血清型特异性IgG GMCs和功能性抗体应答。对于成年人来说,预防肺炎球菌疾病的相关性尚未确定。在一项II期RCT研究中,年龄≥50岁的成年人随机接种PCV13、PCV15或PPSV23治疗。主要和次要终点是非劣效性评估†PCV15与PPSV23相比,所有14种共有血清型均符合;14种血清型中有13种的IgG GMC和OPA几何平均抗体滴度(GMT)数值较高(血清型19F除外)。与PCV13相比,对于13种共有血清型中的8种和13种共有血清型中的7种,PCV15分别诱导了数值更高的IgG GMCs和OPA GMTs这些比较没有评估非劣效性(162)。在一个年龄≥50岁的成年人的III期RCT中,非劣效性标准§与13种共有血清型的PCV13相比,PCV15符合,并且OPA反应在统计学上更高¶对于共有血清型3和pcv 15-独特血清型22F和33F(163)。在评估2-12个月后PCV15或PCV13和PPSV23的免疫原性的研究中(165–167),与接种PCV13的人相比,接种PCV15的人在9-13 * *共有PCV13血清型方面具有数字上相似或更高的OPA GMT,并且在接种PPSV23后1个月测量时,对于5-11种共有血清型,具有更高百分比的血清应答者(定义为接种后OPA GMT滴度比接种前增加4倍以上的受试者)。因此,PCV13随后是PPSV23的免疫原性被认为通常与PCV15随后是PPV23的免疫原性相当。
既往接种过肺炎球菌疫苗的成人的免疫原性
一项II期试验评估了年龄≥65岁且在接种PCV前≥1年接种过PPSV23的成人中,PCV15与PCV13相比的安全性和免疫原性(168)。与基线相比,在PCV接种后1个月测量时,观察到所有PCV血清型的IgG GMCs和OPA GMTs增加。与接种PCV13的患者相比,接种PCV15的患者在PCV13中包含的13种血清型的IgG GMCs和OPA GMTs在数值上相似或更高,并且在PCV接种后1个月测量时,对PCV15独特血清型22F和33F的免疫应答更高。
安全
在7项随机对照试验中评估了PCV15的安全性,共有5630名年龄≥18岁的参与者接种了单一剂量的PCV15。大多数参与者都有免疫能力;然而,一项研究包括了302名感染艾滋病病毒的成年人(166)。这七项随机对照试验的参与者包括在接种PCV15前接种PPSV23 ≥1年的人,接种PCV15后接种PPSV23的人,以及接种PCV15同时接种季节性灭活四价流感疫苗(IIV4)的人。最常报告的不良反应是注射部位疼痛、疲劳和肌痛。在一组研究中,接种疫苗后6个月内的SAE发生率(PCV15的n = 4,751;PCV13的n = 1,532)在PCV15受体中为2.5%,在PCV13受体中为2.4%。没有SAE或死亡被认为与研究疫苗有关(116,169)。正在收集和审查许可后安全性数据;然而,可用的数据有限。
20价肺炎球菌结合疫苗(PCV20)
PCV20 除 PCV13 血清型外,还含有与 CRM197 结合的肺炎球菌多糖血清型 8、10A、11A、12F、15B、22F 和 33F(图)。除了 4.4 微克的 6B 糖、51 微克的 CRM197 载体蛋白、100 微克的聚山梨醇酯 80、295 微克的琥珀酸缓冲液、4.4 毫克的氯化钠和 125 微克的铝作为磷酸铝佐剂外,每剂疫苗含有约 2.2 微克的所有血清型(117)。
未接种过肺炎球菌疫苗的成人的免疫原性
一项针对60-64岁成年人的II期研究和两项针对≥18岁成年人的III期RCT评估了PCV20与PCV13相比的免疫原性和安全性(170–172)。将包括在PCV20中但不包括在PCV13中的另外七种血清型的PCV20的免疫原性与PPSV23(在PCV13后1个月接种) (170,172)。这些研究包括病情稳定的成年人(即,在接种疫苗前几周内,病情恶化的疾病不需要显著改变治疗或住院治疗),但不包括免疫功能低下的成年人。与PCV13受体相比,PCV20受体在年龄≥60岁的成年人的III期试验中引发了符合所有13种血清型的非劣效性标准(定义为OPA GMT比值[PC v20/PC V13]> 0.5的双侧95% CI的下限)的应答(170);然而,PCV20受体似乎具有较低的GMT,并且包括对13种PCV13共有血清型中的12-13种血清型的较低百分比的血清应答者(170,172)。这些发现的临床相关性尚不清楚。与PPSV23受体相比,PCV20受体在数量上具有更高的GMT,并且对七个(不包括血清型8)共有的非PCV13血清型中的六个具有更高百分比的血清应答者(170,172);这六种血清型符合非劣效性标准(170)。
既往接种过肺炎球菌疫苗的成人的免疫原性
两项III期研究评估了年龄≥65岁且之前接种过肺炎球菌疫苗(仅接种PCV13、仅接种PPSV23或同时接种PCV13和PPSV23)的成人中PCV20的免疫原性(173,174)。这些研究包括病情稳定的成人,但不包括免疫力低下的成人。PCV20 的免疫原性在接种 PCV20 1 个月后进行评估。在一项研究中,参与者要么在≥6 个月前接种 PCV13;要么在 1-5 年前接种 PPSV23;要么先接种 PCV13 后接种 PPSV23,其中 PPSV23 在≥1 年前接种(173)。另一项研究是对6个月前在与季节性灭活流感疫苗(174,175)。两项研究都没有直接比较接种PCV13和PPSV23后PCV20和PPSV23的免疫原性。在一项研究中,与之前仅接种PPSV23的人相比,之前接种PCV13和PPSV23的人在20种PCV20血清型中的19种中具有数量上更高的PCV20血清型的OPA GMTs(173)和另一项研究中20种PCV20血清型中的15种(174)。此外,与之前接种过PPSV23的成人相比,接种过PCV13的成人仅在数值上具有较高的PCV20血清型的OPA GMTs。与以前接种过PPSV23的成人相比,以前接种过PCV13的成人中20个血清型中的13-18个血清型的血清应答百分比(定义为OPA滴度从接种PCV20前到接种pcv 20后1个月上升4倍以上)在数字上更高。在一项研究中,与以前只接种PPSV23的成人相比,接种PCV13和PPSV23的成人的20种血清型中的4种血清型的血清应答者百分比在数字上更高(173)和另一项研究中20种血清型中的6种(174,175)。这些研究中的血清应答者百分比通常低于在肺炎球菌疫苗接种-未接种的成人中观察到的百分比(170)。无论如何,这些数据表明PCV20在年龄≥65岁且以前接种过肺炎球菌疫苗的人群中具有免疫原性。
安全
临床试验
在7项试验中对年龄≥18岁的具有免疫能力的成人进行了安全性评估;这些试验包括总共6,343名接种PCV20(117)。参与者包括未接种肺炎球菌疫苗的人和以前接种过肺炎球菌疫苗的人。在肺炎球菌疫苗接种初期成人的关键III期试验中,最常报告的不良反应是注射部位疼痛、肌肉疼痛、疲劳、头痛和关节痛(在年龄≥60岁的成人中分别为55%、39%、30%、22%和13%;在18-59岁的成年人中,分别为50%-61%、50%-67%、40%-43%、32%-39%和13%-15%)(117)。在七项试验中的六项试验的参与者中,1.5%的PCV20受体(n = 4,552)和1.8%的对照组(n = 2,496)在接种疫苗后6个月内报告了SAE(117)。在所有七项试验中,未发现与研究疫苗相关的严重不良事件或死亡(117,176)。
许可后安全监控
在2021年10月21日至2022年8月31日期间,使用VAERS的数据对PCV20的安全性进行了许可后审查。共向VAERS提交了412份与PCV20相关的报告;399例(96.8%)为非严重,389例(94.4%)为年龄≥19岁的成年人,313例(75.9%)为女性。报告了十三例严重不良事件,包括两例死亡。在一份报告中,一名51岁女性的死因是继发于急性左侧颞叶出血的急性脑疝;第二份报告中的死因没有具体说明。在报告的其余11例严重不良事件中,最常见的不良事件是乏力、恶心、发热和步态不稳。当单独接种PCV20时(n = 274),最常见的不良事件是注射部位红斑(26.6%)、注射部位肿胀(22.6%)和注射部位疼痛(22.3%)。这些比例与批准用于成人的所有疫苗中普遍报告的不良事件相似:注射部位红斑(22.6%)、注射部位疼痛(19.3%)和红斑(19%)。数据挖掘分析显示,接种PCV20后,未出现任何新的或意外的不良事件的不相称报告。
PCV重复接种后的免疫反应
无免疫妥协状况的成年人
回顾了六项免疫原性研究的结果,这些研究评估了PCV重复接种后的反应。在两项针对年龄≥60岁的肺炎球菌疫苗接种初免成人的研究中,第一次注射PCV13后1年,第二次注射PCV13后的免疫反应在统计上显著低于第一次注射PCV13后的免疫反应(177,178)。相比之下,在两项针对年龄≥50岁的肺炎球菌疫苗初免成年人的研究中,在第一次注射PCV13后3.5-5年,第二次注射PCV13后的免疫反应与第一次注射PCV13后的免疫反应相当,或在统计上显著高于第一次注射的免疫反应(179,180)。这些发现表明,较长的PCV13接种间隔可能会优化对后续剂量的免疫反应。在另一项针对年龄≥70岁且在登记前≥5年接种过1剂PPSV23的成人的研究中,间隔1年两次接种PCV13,导致反应恢复到与初始PCV13剂量后相似的水平,表明初始剂量的PCV13对先前接种过PPSV23的成人对后续PCV13剂量的免疫反应没有负面影响(181)。最后,在对6个月前接种过PCV13的成人进行的事后分析中,与基线(即PCV20疫苗接种日)相比,接种PCV20后1个月的免疫应答在数字上高于PCV13和PCV20共有的13种血清型以及PCV20中包含的7种额外血清型(182)。在本研究中,OPA滴度升高四倍以上的受试者的百分比通常低于在肺炎球菌疫苗接种-初治成人(170)。
免疫功能低下的成年人
在一项对年龄≥18岁且感染HIV的成年人的研究中,这些人在第一剂PCV13前≥6个月接种过PPSV23,在间隔6个月接种第二剂和第三剂PCV13后1个月测量了针对PCV13血清型的IgG GMCs。第二剂和第三剂PCV13后的IgG GMCs与第一剂PCV13后的相当(183)。在另一项针对肺炎球菌疫苗的研究中,年龄≥6岁且感染HIV的初治患者间隔1个月接种3剂PCV13疫苗注射后再接种1剂PPSV23疫苗注射,第一剂注射后PCV13血清型的IgG GMCs或OPA GMTs增加最大,第二剂和第三剂注射后仅出现轻微增加(184)。
接种HSCT的成年人
与普通人群相比,HSCT患者感染IPD的风险高达80倍(86)。HCST受体在移植的第一年或以后对PPSV23的反应较差,尤其是那些患有慢性移植物抗宿主病(GVHD)的患者(185,186)。由于HSCT病毒感染后淋巴细胞恢复的过程较长,因此建议接种HSCT病毒感染的儿童和成人在HSCT病毒感染后3-6个月开始接种3剂PCV13(15,92)。PPSV23作为肺炎球菌疫苗的第四剂,在HSCT被发现诱导对疫苗血清型的免疫反应后12个月开始(187)并已被建议提供对PCV中不包括的其它血清型的免疫力,但患有慢性GVHD的患者除外,这些患者已被建议接种第四剂PCV,因为他们不太可能对PPSV23产生反应(92)。
在III期RCT中,接种同种异体HSCT的儿童和成人在HSCT病毒感染后3-6个月开始随机接种3剂PCV13或PCV15,然后在12个月时接种单剂PPSV23(或对于发生GVHD的患者接种单剂PCV13或PCV15)(188)。在第三次PCV接种后1个月测量的免疫原性表明,对于13种共有的PCV13血清型,IgG GMC和OPA GMT通常是可比的,并且对于PCV13中不包括的另外两种血清型,PCV15具有显著更高的免疫原性。在两个干预组中,从接种前(第12个月)到接种PPV23后30天(第13个月),对于PCV13中的13种共有血清型和PCV15特有的另外两种血清型,PPV23也是免疫原性的(通过IgG GMC和OPA GMT中的几何平均倍数上升[GMFR]来评估)189,190)。对于包含在PCV13中的13个共有血清型,在第13个月中测量的血清型特异性IgG GMCs和OPA GMTs在两组之间通常具有可比性;与PCV13受体相比,PCV15受体对PCV15特有的两种血清型具有更高的IgG GMC和OPA GMT数值。慢性GVHD患者中的第四剂PCV15从接种前(第12个月)到接种后30天对疫苗中包含的所有15种血清型(通过GMFRs评估)也是免疫原性的。在接种3剂PCV后,年龄≥18岁接种PCV15的HSCT受试者与接种PCV13的受试者相比,疫苗相关不良事件的发生率更高(注射部位不良事件:93.1%比75.2%;全身性不良事件:55%对43.4%),尽管大多数不良事件为轻度至中度。接种PPSV23后12个月的不良事件频率(注射部位不良事件:71.4%对64.8%;系统不良事件:31.0%对29.6%)在PCV15和PCV13组之间具有可比性。尚未有在HSCT受体中进行PCV20临床试验的报道。
全球都在讨论HSCT接种者接种疫苗的最佳时机。荷兰免疫规划建议在HSCT后1年开始接种疫苗,以便在同种异体HSCT(191)。或者,更早开始接种疫苗使HSCT接种者有机会更早获得针对肺炎球菌疾病的保护(186)。一项试验比较了造血干细胞移植后 3 个月或 9 个月接种 3 剂 PCV7,然后在造血干细胞移植后 12 个月或 18 个月接种一剂 PPSV23,结果显示,两组的应答率(定义为第三剂 PCV7 接种后 1 个月所有 PCV7 血清型抗体滴度≥0.15 μg/mL 的患者百分比)在统计学上无显著差异,但在 24 个月时,早期接种组的 GMC 和应答率较低(192)。对于PPSV23特有的血清型,早期接种组在24个月时具有较低的GMCs和应答者百分比,尽管两组之间的差异没有统计学意义(187)。
为了在HSCT之后提供更早和更长时间的抗IPD保护,已经研究了使用4剂PCV13(间隔1个月接种3剂,然后在第三剂PCV后6个月接种加强剂量)然后使用单剂PPSV23(193,194)。一项研究评估了前3-6个月接种HSCT的儿童和成人在1个月后接种4剂PCV13和单剂PPSV23的免疫原性和安全性。结果表明,从基线到第三次接种后1个月以及从第三次接种后到第四次接种后1个月,在儿童和成人的所有PCV13血清型中,IgG浓度的GMFR显著增加;然而,当比较第四次接种后1个月和PPSV23接种后1个月时,GMFR几乎没有变化(194)。在一项独立的研究中报道了类似的发现,该研究采用了类似的5剂疫苗方案(4剂PCV13,然后在第4剂PCV13后2个月注射1剂PPSV23),研究对象为3-6个月前接种同种异体HSCT的成人(193)。值得注意的是,这些试验中使用的PCV和PPSV23剂量之间的间隔比目前推荐的时间表短。虽然这些研究没有提供由4剂PCV组成的方案与在12个月时使用3剂PCV13和1剂PPSV23的方案的直接比较,但这些研究的发现表明,使用4剂PCV是免疫原性的,加强剂量可能提供针对疫苗中包含的血清型的额外保护。关于在HSCT接种者中使用4剂PCV的安全性,与第一剂、第二剂和第三剂PCV13相比,第四剂PCV13后更频繁地发生局部和全身反应(194)。在一项研究中,疫苗相关的SAE发生在不同剂量的疫苗中,包括面部双瘫、注射部位红斑和发热、自身免疫性溶血性贫血、格林-巴利综合征和蜂窝组织炎(194)。
PCV和PPSV23之间的间隔
回顾了七项免疫原性研究,这些研究评估了在间隔2、6或12个月或3-4年接种PCV13或PCV15然后接种PPSV23后的免疫反应(165–167,177,179,195,196)。4例为年龄≥50岁的成年人,无免疫妥协情况(167,177,179,195)。三个包括被认为肺炎球菌疾病风险增加的年轻成人(年龄≥18岁):一个是患有慢性疾病的美国印第安人和非美国印第安人成人(165),其中一名感染爱滋病病毒的成年人(166),以及一名接种生物缓解疾病抗风湿药物(196)。除了这七项研究之外,还包括一项PCV7研究,该研究比较了55-70岁阿拉斯加土著成年人之间PCV7和PPSV23的不同间隔(197)。在八项研究中,三项比较了PCV和PPSV23接种间隔2至6个月的研究发现,接种PPSV23后测量的免疫原性没有显著差异,尽管间隔越短,反应原性往往越高(195–197)。在一项针对60-64岁的肺炎球菌疫苗接种者的研究中,比较了对1剂PCV13的抗体反应和间隔1年后对PCV13和PPSV23的反应,PPSV23后的免疫反应明显低于12种常见血清型中8种的1剂PCV13后的反应(177)。在另一项针对肺炎球菌疫苗的研究中——年龄≥50岁的未接种过PCV13或PCV15的成年人,间隔1年后接种PPSV23,对PPSV23的免疫应答(以IgG浓度的GMFR和接种后1个月OPA滴度比接种前增加4倍以上来衡量)通常与接种1剂PCV后1个月对PCV中所含血清型的免疫应答相当(167)。在另一项作为先前肺炎球菌疫苗研究的延伸而进行的研究中——年龄为50-64岁的初治成人,比较了对1剂PCV13的抗体应答与对PCV13后接PPSV23的应答,间隔约3.5年(179)。对于12种常见血清型中的7种,PPSV23后的免疫反应显著更高(179)。这些发现表明,PCV和PPSV23之间较长的接种间隔可能改善免疫活性成年人的免疫原性,尽管1年间隔和4年间隔之间没有直接的比较。
与其他疫苗共同接种
PCV15、PCV20或PPSV23与季节性灭活四价流感疫苗(具体而言,PCV15或PPSV23和IIV4 [Fluarix]以及PCV20和佐剂IIV4 [Fluad])同时接种已被证明在成人中具有免疫原性且安全(174,198,199)。然而,与单独接种肺炎球菌疫苗相比,当肺炎球菌疫苗与IIV4联合接种时,某些血清型的肺炎球菌血清型特异性OPA GMTs或GMCs在数字上较低。
在年龄≥65岁的成人中,接种了2剂BNT162b2新冠肺炎疫苗,且在≥6个月前接种了第2剂BNT162b2疫苗,与单独使用PCV20相比,PCV20与BNT162b2联合使用时,报告的肺炎球菌血清型特异性OPA GMTs略低;然而,这种差异在统计学上并不显著。与单独接种PCV20的组相比,在接种PCV20和BNT162b2的组中,接种后10天内注射部位疼痛和接种后7天内全身事件的报告频率更高。接种疫苗后1个月内报告任何不良事件的参与者百分比在各组中相似(PCV20和BNT162b2联合用药:5.3%[95% CI = 2.6%–9.6%];仅PC v20:4.3%[95% CI = 1.9%–8.3%];仅bnt 162 b 2:6.5%[95%可信区间= 3.4%–11.1%])(200)。尚无PCV20与其他新冠肺炎疫苗合用的数据。正在对年龄≥50岁的成年人同时接种PCV15或PPSV23与新冠肺炎疫苗进行评估(201)。在接种2剂含佐剂重组带状疱疹疫苗(RZV)的≥50岁成人中,对RZV和PPSV23联合接种的免疫应答不劣于该年龄组中依次接种这些疫苗的人。当第一剂RZV和PPSV23同时接种时,报告的恳求不良反应更频繁(202)。尚无成人与其他疫苗(如破伤风、白喉、无细胞百日咳疫苗或乙型肝炎疫苗)合用的数据。
PCV使用的经济评估
关于在美国使用肺炎球菌结合疫苗的可用经济证据主要来自杜兰疾病预防控制中心、默克公司和辉瑞公司的三个成本效益模型。这些模型总结了肺炎球菌结合疫苗的经济价值,根据每质量调整生命年的成本(QALY)计算成本效益比。QALY是对与健康相关的生活质量的一种度量,它使用数值来表示疾病发作如何影响有患病风险的人群的发病率和死亡率。在使用QALYs的经济模型中,在给定年份,一个人的QALY范围可以从0.0到1.0,其中值1.0表示完全健康的一年,值< 1.0但> 0.0表示不完全健康的一年,值0.0表示死亡。本报告中包含的所有成本效益比率已使用消费者价格指数调整为2022美元。因此,此报告中的数值可能与之前报告的值不完全匹配。
在以前未接种过疫苗的成人中使用PCV15或PCV20
当对以前没有接种过疫苗的成年人推荐PCV15和PCV20时,审查了三个经济模型,分别来自杜兰疾病预防控制中心、默克公司和辉瑞公司(16,203) (表8)。这些经济模型评估了使用PCV15或PCV20的政策选择的成本效益,并与之前的建议进行了比较(PPSV23仅适用于19-64岁患有慢性疾病的成年人;PPSV23,根据年龄≥65岁且无免疫缺陷、脑脊液漏或耳蜗植入的成人的共同临床决策,可选择接种PCV13PCV13和PPSV23适用于患有免疫缺陷疾病、脑脊液漏或耳蜗植入的成人) (14)。Tulane-CDC、Merck和Pfizer经济模型评估了所有年龄≥65岁的成年人单独使用PCV20的成本效益估计值,范围从成本节约(即与以前的建议相比,成本更低,健康结果更好)到每QALY增加42,000美元(16,203)。两个经济模型(Tulane-CDC和Merck)评估了PCV15与PPSV23串联使用对所有年龄≥65岁的成年人的影响,估计从每QALY获得成本节约到309,000美元不等。Tulane-CDC模型发现,对于所有年龄≥65岁的成年人,单独使用PCV20或PCV15与PPSV23串联使用,在所有情况下都可以节省成本。对于年龄在19-64岁、有某些潜在疾病或其他风险因素的成年人,单独使用PCV20获得的每QALY成本效益估计值为13,000-320,000美元,与PPSV23联合使用PCV15获得的成本效益估计值为274,000-718,000美元(表8)。
评估PCV20和PCV15用途的其他成本效益评估已经公布(204,205)。在一项研究中,将所有年龄≥65岁的成年人使用的高价疫苗与2021年初实施的建议(即,在共同临床决策的基础上常规使用PPSV23和PCV13)进行了比较,单独使用PCV20获得的每QALY成本效益估计值为209,000美元至544,000美元,为531,000美元至676,000美元††由于将PCV15与PPSV23串联使用而获得的per QALY,其范围包括间接效应(205)。同一研究小组的后续分析基本上证实了最初的发现;特别是,与单独使用PCV20相比,将PCV15与PPSV23串联使用可获得更高的每QALY成本估算值(204)。
先前接种过PCV13的成人使用PCV20
仅接种PCV13的成人
当PCV20被推荐给以前只接种PCV13的成人时,Tulane-CDC、Merck和Pfizer模型被审查(175)。在Tulane-CDC模型中,在年龄≥65岁的成年人队列中,与未接种疫苗相比,接种PCV13后1或5年使用PCV20获得的每QALY成本为540,000美元,在概率敏感性分析中,第5和第95百分位范围为438,000-812,000美元。在一组年龄为42岁的免疫功能低下的成年人(年龄选择为19-64岁)中,与未接种疫苗相比,接种PCV13后1年或5年使用PCV20获得的每QALY成本为279,000美元,在概率敏感性分析中,第5和第95百分位范围为197,000-540,000美元。Tulane-CDC模型包括多种情况,这些情况改变了接种PCV20疫苗的年龄、自上次接种以来的时间、间接效应和针对血清型3疾病的PCV VE。在杜兰-CDC模型的这些场景中,每QALY获得的成本从209,000美元到403,000美元不等。
由于估计年龄在19-64岁的免疫功能低下的成年人仅接种了PCV13(206,207),这三个模型的比较集中在年龄≥65岁的成年人,他们只接种了PCV13疫苗,而没有接种疫苗(表9)。在这三种模型中,使用PCV20获得的每QALY成本从87,000美元(辉瑞模型:PCV20在PCV13接种7年后接种)到611,000美元(Tulane-CDC模型:PCV20在PCV13接种1年后接种于66岁免疫功能低下的成年人)不等。
默克模型没有报告这一比较的数值。然而,根据疾病预防控制中心审查小组的计算,默克模型的估计值将介于辉瑞和杜兰-疾病预防控制中心模型的估计值之间。
接种PCV13和PPSV23疫苗的19-64岁免疫功能低下的成年人
在Tulane-CDC模型中,在接种PCV13和PPSV23后1年或5年使用PCV20与PPSV23进行比较,如之前在42岁(年龄选择为代表19-64岁的成年人)的免疫妥协条件的单年龄队列中推荐的。该队列被随访至64岁。从使用PCV20中获得的每QALY成本从209,000美元到403,000美元不等。
在辉瑞模型中,对一个年龄在19-64岁的免疫功能低下的成年人的多年龄组进行了终生随访。每QALY获益的成本从40,000美元(PCV20在PCV13接种后7年接种,假设儿科PCV20疫苗接种无间接影响)到每QALY获益的107,000美元(PCV20在PCV13接种后7年接种,假设儿科PCV20疫苗接种有间接影响)。
在默克模型中,对42岁免疫功能低下的成年人进行了单年龄队列研究,与目前推荐的使用PPSV23完成肺炎球菌疫苗接种系列的策略相比,在使用PCV13和PPSV23后5年使用PCV20导致了更高的费用和更差的健康结果。值得注意的是,该模型假设对照组在52岁和65岁时接种PPSV23剂量,这是当前推荐的剂量,但由于时间跨度较长,其他模型没有考虑这一点。此外,QALY的增量变化很小。
接种PCV13和PPSV23的年龄≥65岁的成人
在Tulane-CDC模型中,在接种PCV13和PPSV23后5年,与65岁成年人的单年龄队列中没有额外接种相比,使用PCV20获得的每QALY成本为454,000美元,在概率敏感性分析中,第五和第95百分位范围为308,000-956,000美元。在不同年龄、接种PCV13和PPSV23后的年数、间接效应和PCV对血清型3疾病的VE(即,对血清型3疾病无保护或中度保护)的情景分析中,在无免疫妥协状况的成人中,使用PCV20获得的每QALY成本为168,000美元至970,000美元,在有免疫妥协状况的成人中为421,000美元至925,000美元(表9)。免疫功能低下的成年人每QALY增加的成本较高,可能是因为该人群的预期寿命较短,VE较低。在辉瑞模型中,假设在65岁时接种PCV13和PPSV23后7年使用PCV20,与没有额外接种疫苗相比,使用PCV20获得的每QALY成本范围从93,000美元(无间接影响假设)到182,000美元(有间接影响假设)。在Merck模型中,假设在68岁接种PCV13和PPSV23后使用PCV20 5年,与没有额外接种相比,使用PCV20获得的每QALY成本为217,000美元。
如果自最后一次接种肺炎球菌疫苗后间隔时间较短,每QALY增加的成本通常会更高。在Tulane-CDC模型中,对从65岁或75岁开始接种PCV13和PPSV23的成人的1年、5年和10年间隔的建模范围为每QALY获益168,000美元(从75岁开始接种PCV13和PPSV23起5年后接种PCV20)到每QALY获益970,000美元(从65岁开始接种PCV13和PPSV23起1年后接种PCV20)。
65岁以上成人使用肺炎球菌疫苗的建议
以前未接种过任何肺炎球菌疫苗的成年人
年龄≥65岁、以前未接种过肺炎球菌疫苗或以前的疫苗接种史未知的成人应接种单剂PCV20或PCV15。当使用PCV15时,应至少间隔1年接种一剂PPSV23(表2和表7)。患有免疫功能低下、脑脊液漏或耳蜗植入的成人接种PPSV23剂量的最小建议间隔为自PCV15剂量起≥8周。
基本原理
II期和III期临床试验表明,在以前没有接种过肺炎球菌疫苗的老年人中,PCV15或PCV20的免疫原性不劣于PCV13、PPSV23或两者。PCV15和PCV20的安全性与PCV13相当(22,24)。建议将PCV15与PPSV23串联使用,以提供针对更广泛血清型的保护。尚无免疫功能低下成年人使用PCV20的临床试验数据。观察性研究中有限的PCV13有效性数据表明,PCV13可预防室性心动过速-IPD(147–149)或VT-肺炎球菌肺炎(151)。
经济模型表明,与以前的建议相比,年龄≥65岁的成年人单独使用PCV20的成本效益估计值范围为每QALY收益节省成本至42,000美元(16,203)。两个经济模型(Tulane-CDC和Merck)评估了PCV15与PPSV23串联使用对所有年龄≥65岁的成年人的影响,并与之前的建议进行了比较,估计从每QALY获得的成本节约到309,000美元不等。
之前仅接种过PCV13的成人
建议年龄≥65岁且之前仅接种过PCV13的成年人在接种PCV13疫苗后间隔≥1年接种一剂PCV20或PPSV23疫苗,以完成其肺炎球菌疫苗系列。当PPSV23用于患有免疫功能低下、脑脊液漏或耳蜗植入的成人时,PCV13和PPSV23之间的最小推荐间隔为8周(11,14)(表2)。
基本原理
在年龄≥65岁的成人中进行的III期临床研究数据证明,在无免疫妥协症状的成人中使用PCV20是安全的且具有免疫原性(https://www . CDC . gov/vaccines/acip/RECs/grade/PC v20-prev-VAX-adults-ETR . html)。三个经济模型评估了年龄≥65岁且之前接种过PCV13的成年人使用PCV20的情况,仅表明使用PCV20获得的每QALY成本在87,000美元(辉瑞模型:PCV13接种7年后使用PCV20)至611,000美元(Tulane-CDC模型:PCV20接种1年后免疫功能低下的66岁成年人)(表9)。之前,PCV13被推荐用于所有患有免疫功能低下、脑脊液漏或人工耳蜗植入的成年人,或基于年龄≥65岁且无免疫功能低下、脑脊液漏或人工耳蜗植入的成年人的共同临床决策(14)。如果接种了PCV13,则建议这些成年人使用PPSV23完成该系列。尽管PPSV23在可用的肺炎球菌疫苗中提供了最广泛的血清型覆盖,但考虑到PCVs与PPSV23相比的免疫学优势(113–115),使用单剂量PCV20是PPSV23的一个选项,以完成已接种PCV13的成人的肺炎球菌疫苗系列,为这些肺炎球菌疾病风险增加的成人提供更广泛的肺炎球菌血清型覆盖。
之前接种过PCV13和PPSV23但尚未接种最终剂量PPSV23的成人
根据以前的肺炎球菌疫苗建议,年龄≥65岁的成年人已接种PCV13和PPSV23疫苗(14)但在年龄≥65岁时尚未接种最终剂量的PPSV23,建议通过接种单一剂量的PCV20或PPSV23来完成其肺炎球菌疫苗系列。如果选择PCV20,则可在最后一剂肺炎球菌疫苗后≥5年进行接种。如果选择PPSV23,则可在注射PCV13后间隔≥1年(或对于患有免疫功能低下、脑脊液漏或耳蜗植入的成人,在注射PCV13后间隔至少≥8周)和上次注射PPSV23后间隔≥5年(11)(表2)。
基本原理
在1-5年前接种过PCV13和PPSV23的年龄≥65岁且无免疫妥协状况的成人中进行的III期临床试验数据表明,使用PCV20是安全的且具有免疫原性(https://www . CDC . gov/vaccines/acip/RECs/grade/PC v20-prev-VAX-成人-19-64-基于风险-etr.html)。由于模型假设的差异,评估年龄< 65岁、免疫功能低下且之前接种过PCV13和PPSV23的成年人使用PCV20的经济模型具有不同的结果,从每QALY获得40,000美元(辉瑞模型:PCV20自PCV13接种后7年接种,假设儿科PCV20疫苗接种无间接影响)到更高的成本和更差的健康结果(默克模型:在接种PCV13和PPSV23后5年使用PCV20)。尽管PPSV23在可用的肺炎球菌疫苗中提供了最广泛的血清型覆盖,但考虑到PCVs与PPSV23相比的免疫学优势(113–115),对于接种过PCV13的成人,使用单剂量PCV20是PPSV23的一种选择,为这些肺炎球菌疾病风险增加的成人提供更广泛的肺炎球菌血清型覆盖。
已完成PCV13和PPSV23疫苗推荐系列的成人
对于任何年龄≥65岁的成年人,如果已经完成了推荐的PCV13和PPSV23疫苗系列(即,PPSV23是在年龄≥65岁时接种的),但尚未接种PCV15或PCV20疫苗,则建议共享临床决策。如果决定使用PCV20,建议在最后一次接种肺炎球菌疫苗后≥5年时使用单剂PCV20。共享临床决策的考虑因素可能包括患者因基础医疗条件导致的肺炎球菌疾病风险、自上次接种肺炎球菌疫苗以来的时间或暴露于PCV20中所含肺炎球菌血清型的风险(盒子)。
基本原理
在1-5年前接种过PCV13和PPSV23的年龄≥65岁且无免疫妥协状况的成人中进行的III期临床试验数据表明,使用PCV20是安全的且具有免疫原性(https://www . CDC . gov/vaccines/acip/RECs/grade/PC v20-prev-VAX-older-adults-ETR . html)。经济模型表明,为同时接种PCV13和PPSV23的≥65岁成年人推荐PCV20的每QALY获益成本范围为每QALY获益93,000美元(辉瑞模型:65岁时同时接种PCV13和PPSV23后7年)至每QALY获益970,000美元(杜兰-CDC模型:65岁时同时接种PCV13和PPSV23后1年)。尽管某些成年人在完成之前推荐的肺炎球菌疫苗系列(同时使用PCV13和PPSV23)后,可能会受益于针对肺炎球菌肺炎的额外保护,但根据经济分析的结果,建议对该人群共享临床决策,而不是常规使用PCV20。
19-64岁患有某些潜在疾病或其他风险因素的成人使用肺炎球菌疫苗的建议
以前未接种过任何肺炎球菌疫苗的成年人
19-64岁的成年人,患有某些潜在疾病或其他风险因素(如酗酒;慢性心脏、肝脏或肺部疾病;慢性肾衰竭;吸烟;人工耳蜗;先天性或获得性无脾症;脑脊液漏;糖尿病;全身恶性肿瘤;艾滋病毒感染;霍奇金病;免疫缺陷;医源性免疫抑制;白血病、淋巴瘤或多发性骨髓瘤;肾病综合征;实体器官移植;或镰状细胞病或其他血红蛋白病)的患者,或其先前的疫苗接种史未知的患者,应接种单剂量的PCV20或PCV15。当使用PCV15时,应至少间隔1年接种一剂PPSV23(表3、4、5和7)。患有免疫功能低下、脑脊液漏或耳蜗植入的成人接种PPSV23剂量的最小建议间隔为自PCV15剂量起≥8周。
基本原理
II期和III期临床试验表明,PCV15与PPSV23在患有肺炎球菌疾病的基础疾病或其他风险因素的成人中的安全性和免疫原性与PCV13与PPSV23的安全性和免疫原性相当(23)。PCV20临床试验包括患有稳定慢性疾病的成年人,但不包括患有免疫妥协疾病的成年人(21)。对年龄≥65岁的成年人进行的PCV13 RCT事后分析发现,PCV13可有效预防室性心动过速-IPD(157)或VT-肺炎球菌肺炎(158)在慢性病情稳定的成年人中。来自观察性研究的有限的PCV13有效性数据表明,PCV13具有抗室性心动过速-IPD(147–149)或VT-肺炎球菌肺炎(151)。评估单独使用PCV20或PCV15与PPSV23串联使用的经济模型表明,与之前的建议相比,新的干预措施将预防更多疾病,同时相关的成本增加(208,209)。
患有免疫缺陷疾病、脑脊液漏或耳蜗植入的成人,之前仅接种过PCV13
年龄在19-64岁、患有免疫缺陷疾病(即慢性肾衰竭、肾病综合征、免疫缺陷、医源性免疫抑制、全身性恶性肿瘤、HIV感染、霍奇金病、白血病、淋巴瘤、多发性骨髓瘤、实体器官移植、先天性或获得性无脾症、镰状细胞病或其他血红蛋白病)、脑脊液漏或耳蜗植入的成年人,如果之前仅接种过PCV13,建议在PCV13剂量后≥1年接种单剂量PCV20或单剂量PPSV2311,14)(表3和表4)。当这些成人使用PPSV23代替PCV20时,对于患有免疫功能低下疾病的成人,建议在第一次PPSV23剂量≥5年后使用PCV20或第二次PPSV23剂量,但对于患有脑脊液漏或耳蜗植入的成人则不建议使用(表3)。当该人年满65岁时,再次回顾肺炎球菌疫苗建议(表3和表4)。如果用PCV20代替任何剂量的PPSV23,则该系列疫苗是完整的,无需再接种其他肺炎球菌疫苗。对于年龄在19-64岁之间的成年人,如果他们没有免疫缺陷、脑脊液漏或耳蜗植入,并且以前只接种过PCV13,请参考新的CDC指南进行实施(见新的CDC指南)。
基本原理
年龄≥65岁且无免疫妥协状况的成人的III期临床研究数据表明,在6个月前接种过PCV13的成人中使用PCV20是安全且具有免疫原性的(https://www . CDC . gov/vaccines/acip/RECs/grade/PC v20-prev-VAX-adults-ETR . html)。虽然没有关于免疫功能低下的成年人使用PCV20的数据,但已经证明重复使用PCV13对免疫功能低下的成年人有一定的免疫原性(183,184)。在一组年龄为42岁的免疫功能低下的成年人(年龄选择为19-64岁)中,与未接种疫苗相比,接种PCV13后1年或5年使用PCV20获得的每QALY成本为279,000美元,在概率敏感性分析中,第5和第95百分位范围为197,000-540,000美元。尽管PPSV23在可用的肺炎球菌疫苗中提供了最广泛的血清型覆盖,但考虑到PCVs与PPSV23相比的免疫学优势(113–115),使用单一剂量的PCV20是PPSV23的一种选择,使用先前为接种PCV13的成人推荐的剂量和间隔,以提供更广泛的肺炎球菌血清型覆盖。
患有免疫缺陷疾病、脑脊液漏或耳蜗植入的成年人,之前接种过PCV13和PPSV23
免疫功能低下的 19-64 岁成人(即 慢性肾功能衰竭、肾病综合征、免疫缺陷、先天性免疫抑制、全身恶性肿瘤、艾滋病病毒感染、霍奇金病、白血病、淋巴瘤、多发性骨髓瘤、实体器官移植、先天性或后天性胰岛细胞减少症、镰状细胞病或其他血红蛋白病)、脑脊液渗漏、 已接种 PCV13 和 PPSV23 但未接种完整推荐疫苗系列的患者或植入人工耳蜗的患者,建议在接种最后一剂肺炎球菌疫苗≥5 年后接种一剂 PCV20 或接种≥1剂 PPSV23,以完成肺炎球菌疫苗接种系列。如果使用第二剂 PPSV23 代替 PCV20,则应在接种 PCV13 ≥ 8 周后接种,并在接种第一剂 PPSV23 ≥ 5 年后接种(表 3)。年满 65 岁时再次复查肺炎球菌疫苗接种建议(表 3 和表 4)。如果用 PCV20 代替任何剂量的 PPSV23,则该系列疫苗接种完成,无需再接种其他肺炎球菌疫苗。
基本原理
在1-5年前接种过PCV13和PPSV23的年龄≥65岁且无免疫妥协状况的成人中进行的III期临床试验数据表明,使用PCV20是安全的且具有免疫原性 (https://www.cdc.gov/vaccines/acip/recs/grade/PCV20-prev-vax-adults-19-64-risk-based.html)。由于模型假设的差异,评估年龄< 65岁且之前接种过PCV13和PPSV23的免疫低下成年人使用PCV20的经济模型具有不同的结果,从每QALY获益40,000美元(辉瑞模型:PCV20自PCV13接种后7年接种,假设儿科PCV20疫苗接种无间接影响)到更高的成本和更差的健康结果(默克模型:在接种PCV13和PPSV23后5年使用PCV20)。尽管PPSV23在可用的肺炎球菌疫苗中提供了最广泛的血清型覆盖,但考虑到PCVs与PPSV23相比的免疫学优势(113–115),使用单一剂量的PCV20是PPSV23的一种选择,使用之前为接种PCV13的成人推荐的剂量和间隔,为这些肺炎球菌疾病风险增加的成人提供更广泛的肺炎球菌血清型覆盖。不建议年龄< 65岁且无免疫缺陷、脑脊液漏或耳蜗植入的成人接种PCV13与PPSV23串联(14)。
疾控中心实施指南
更新和新的CDC实施指南被提交给ACIP,但没有进行全票表决。这些指南的目的是就如何对特定人群应用新建议提供指导。
更新的CDC指南
之前仅接种过PPSV23的成人
仅接种过PPSV23的成人,包括仅根据先前肺炎球菌疫苗建议接种PPSV23的成人,或在接种PCV15-PPSV23系列中的一剂PCV15之前接种PPSV23的成人,应在最后一剂PPSV23后≥1年接种单剂PCV20或PCV15。当PCV15或PCV20用于之前接种过PPSV23的成人时,无需再接种另一剂PPSV23(表2、3、4和5)。
基本原理
2019年,ACIP停止了对年龄≥65岁且无免疫妥协状况、脑脊液漏或人工耳蜗植入的成人常规使用PCV13的建议,因为该建议的人口水平影响有限(14)。PCV15和PCV20包含PCV13中不包含的其他血清型,考虑到PCV与PPSV23相比的免疫学优势(113–115)以及PPSV23的有限保护持续时间(129,137,138,140,141),现在建议所有以前只接种过PPSV23的成年人接种单剂量的PCV15或PCV20。
新的疾病预防控制中心指南
PCV15和PPSV23系列的接种方案
当使用PCV15时,建议PCV15和PPSV23的接种间隔≥1年。对于患有免疫功能低下、脑脊液漏或人工耳蜗植入的成年人,可考虑至少间隔8周,以最大限度地减少这些肺炎球菌疾病风险增加的人群中由PPSV23特有血清型引起的IPD风险时间(17)。PCV15和PPSV23不应在同一就诊期间接种。如果在接种一剂PCV15之前不慎接种了一剂PPSV23,则应在接种PPSV23后≥1年再接种一剂PCV15或PCV20。
仅接种过PCV7的成人
仅接种过PCV7疫苗的成年人,无论是作为儿童还是作为成年人无意中接种的,都应按照ACIP针对年龄≥19岁且之前未接种过任何肺炎球菌疫苗的成年人的建议接种疫苗。这是因为PCV7提供了针对小部分当前肺炎球菌疾病的保护。
仅接种过PCV13的19-64岁患有慢性疾病的成年人
19-64岁患有慢性疾病(即酒精中毒;慢性心脏病,包括充血性心力衰竭和心肌病;慢性肝病;慢性肺病,包括慢性阻塞性肺病、肺气肿和哮喘;吸烟;或糖尿病)不被推荐接种PCV(1314)。这些成年人以前被建议只接种一剂PPSV23。然而,如果成人接种了一定剂量的PCV13,则应在PCV13剂量≥1年后给予单剂量的PCV20或PPSV23,以提供肺炎球菌血清型覆盖率(表5)。当患者年满65岁时,应再次审查肺炎球菌疫苗建议(表2)。
19-64岁患有慢性疾病的成年人,接种过PCV13和PPSV23
根据以前的建议(14)、19-64岁患有慢性疾病(即酒精中毒;慢性心脏病,包括充血性心力衰竭和心肌病;慢性肝病;慢性肺病,包括慢性阻塞性肺病、肺气肿和哮喘;吸烟;或糖尿病)不推荐接种与PPSV23串联的PCV13。相反,这些成年人以前被建议只接种单一剂量的PPSV23。如果此类成人同时接种了PCV13和PPSV23,则不需要额外的肺炎球菌疫苗剂量(表5)。当患者年满65岁时,应再次审查肺炎球菌疫苗建议(表2)。
接种HSCT的成年人
建议接种HSCT的成人在HSCT后3-6个月开始,间隔4周接种3剂PCV20。建议在第三剂PCV20后≥6个月或HSCT后≥12个月进行第四剂PCV20,以较晚者为准。已开始接种PCV13或PCV15肺炎球菌疫苗系列的HSCT接种者,可在不接种额外剂量的情况下完成其接种PCV20的4剂肺炎球菌疫苗系列。如果PCV20不可用,可在HSCT后≥12个月接种3剂PCV15,然后接种1剂PPSV23。对于正在接种PCV15治疗的慢性GVHD患者,可以使用第四剂PCV15替代PPSV23,因为这些成人对PPSV23的反应较弱。最好告知患者的临床团队,以确定接种疫苗的适当时机(表6)。
基本原理
HCST受体在移植后第一年或以后对PPSV23的反应较差,尤其是那些患有慢性GVHD的患者。虽然没有关于在HSCT受体中使用PCV20的临床试验数据,但评估使用4剂PCV13 (3剂和1剂加强剂量)后使用1剂PPSV23的研究表明,使用4剂PCV13具有免疫原性(193,194),并且PCV20在可用的PCV中提供了最广泛的血清型覆盖。III期临床试验数据表明,当与一定剂量的PPSV23(在没有GVHD的患者中)或PCV(在有GVHD的患者中)一起作为第四剂量使用时,PCV15的免疫原性与PCV13相当(188)。使用3剂PCV15后,疫苗相关不良事件的频率较高,尽管大多数不良事件为轻度至中度。
与其他疫苗共同接种
根据ACIP免疫接种一般最佳实践指南,对于在健康护理就诊时没有特定禁忌症的成人,建议在同一就诊时常规接种肺炎球菌疫苗和其他适龄剂量的疫苗(210)。例如,在同一次就诊中,可以在不同的解剖部位同时注射新冠肺炎疫苗。有关新冠肺炎疫苗联合用药的更多信息,请参见目前在美国批准或授权的新冠肺炎疫苗使用的临时临床注意事项(211)。
注意事项和禁忌症
在接种肺炎球菌疫苗之前,疫苗接种提供者应查阅包装说明书,了解注意事项、警告和禁忌症(116–118,120)。对于已知对疫苗的任何成分有严重过敏反应(例如过敏反应)的人,禁用PCV或PPSV23疫苗接种。此外,PCV禁用于已知对任何含白喉类毒素疫苗有严重过敏反应的人。在接种肺炎球菌疫苗之前,应采取所有预防措施,以防止过敏或任何其他不良反应。这些预防措施应包括审查患者的疫苗接种史,以确定对疫苗或类似疫苗的可能敏感性,以及先前的疫苗接种相关不良反应,以确定是否存在任何肺炎球菌疫苗接种禁忌症,并允许评估风险和益处,如ACIP一般最佳免疫实践指南(212)。
怀孕
ACIP没有对孕妇使用肺炎球菌疫苗提出任何建议。妊娠与CD4 T细胞计数减少和轻度免疫抑制相关,表明疫苗可能无法实现最佳免疫原性(213)。大多数关于怀孕期间使用肺炎球菌疫苗的可用信息都与PPSV23有关(214–227)。
安全
在孕妇中进行的多项随机对照试验发现,接种PPSV23疫苗的女性中很少出现疫苗相关的SAE(214,220–227),接种了PPSV23疫苗的母亲所生婴儿的妊娠相关不良结局(如死产或低出生体重)或死亡的频率与对照组中观察到的结果相当(215,216,220–225,227)。相比之下,孕妇使用PCV的数据有限。一项在巴西进行的临床试验将接种抗逆转录病毒治疗的HIV感染孕妇(孕龄13周到< 34周)随机分为10价肺炎球菌结合疫苗(PCV10)、PPSV23或安慰剂组(219)。在接种疫苗后4周内发生治疗相关的≥3级事件(即严重事件)的孕妇百分比(每组1%)和接种疫苗后> 4周发生≥4级事件(即潜在威胁生命的事件)的百分比(PCV10组为2%,PPSV23组为1%,安慰剂组为3%)在三个组之间具有可比性(217,228)。除了PCV10组早产比例较低(2%,其他各组不良妊娠结局的百分比也相似;98个中的两个)与PPSV23(13%;98个中的13个)和安慰剂(12%;103个中的12个)组(217)。
免疫原性
研究发现,在孕妇接种疫苗后,PPSV23增加了血清中血清型特异性抗肺炎球菌抗体的浓度(214,215,221,225,227)。与未接种PPSV23的妇女相比,接种PPSV23的妇女脐带血中的抗肺炎球菌抗体浓度也较高(214,215,221,225,227)以及与未接种PPSV23的母亲所生婴儿相比,接种PPSV23的母亲所生婴儿的血清中(215,218,225,227)。然而,婴儿增加的抗体浓度在生命的最初几个月下降。
在巴西感染HIV的孕妇的RCT中,接种PCV10 (65%)和PPSV23 (65%)的妇女对五种或更多血清型的血清反应(定义为从基线到接种后28天抗体增加两倍以上) (217)。出生时,具有血清保护(定义为抗流行性感冒抗体浓度≥0.35μ在接种PCV10的母亲所生的婴儿中,针对五种或更多种血清型的耐药率为67%,在接种PPSV23的母亲所生的婴儿中为57%,在安慰剂组的婴儿中为17%。在8周龄时,PCV10、PPSV23和安慰剂组的血清保护百分比分别降至19%、23%和1%(217)。当比较产前和产后接种的PCV10和PPSV23的免疫原性时,结果表明在产后接种的妇女中抗体浓度更高(213)。该试验进一步评估了怀孕期间接种PCV10或PPSV23的母亲所生婴儿对PCV10的免疫原性(219)。当在婴儿第二剂PCV10后1-3个月评估免疫原性时,与接种PPSV23的母亲所生的婴儿相比,接种PCV10的母亲所生的婴儿对7种常见血清型中的5种的抗体水平显著降低,对7种常见血清型的血清保护率在统计学上有显著差异,在母体PCV10组中为50%,而在母体PPSV23组中为71%。
疫苗不良事件的报告
在接种PCV15、PCV20或PPSV23之前,医疗保健提供者应查阅相关的包装说明书(116,117,120)关于注意事项和禁忌症。接种疫苗后发生的不良事件应报告给疫苗不良事件报告系统(VAERS)。有关VAERS和如何报告不良事件的更多信息,请访问https://vaers.hhs.gov.
国家疫苗伤害赔偿计划
根据经修订的1986年《国家儿童疫苗伤害法》制定的国家疫苗伤害赔偿方案(VICP)是一种机制,通过这种机制可以向可能因接种VICP承保的疫苗而受伤的人提供赔偿。疫苗伤害表(https://www . hrsa . gov/sites/default/files/hrsa/vicp/vaccine-injury-table-01-03-2022 . pdf)列出了VICP承保的疫苗以及可能获得法律因果关系推定的相关伤害和情况。如果伤害或状况不在表中或不符合表中的要求,个人必须证明疫苗导致了伤害或状况。索赔必须在指定的时间范围内提交。接种VICP疫苗的所有年龄的成年人都有资格提出索赔。更多信息请访问https://www.hrsa.gov/vaccine-compensation或致电1-800-338-2382。
未来方向
CDC和ACIP将继续评估成人使用PCV15和PCV20的安全性,监测实施这些新建议的影响,并评估实施后肺炎球菌疾病的趋势。这些疫苗是在安全性和免疫原性数据的基础上获得许可的,对成人的保护相关性尚未确定。
多种因素可能影响未来成人肺炎球菌疫苗接种策略。与PCV13不同,新的PCV(PCV15和PCV20)首先由FDA批准用于成人。2022年6月,FDA批准儿童使用PCV15,ACIP也提出了建议(229),PCV20的使用于2023年4月获得FDA批准,并于2023年6月获得ACIP的推荐(230)。与对PCV13的观察结果相似,在儿童中使用这些新PCV的间接影响可能会降低未来成人接种PCV15或PCV20疫苗的额外益处(14)。此外,针对成年人的新型高价肺炎球菌疫苗已经完成了第二阶段临床试验,这些疫苗可能在未来几年投入使用(231–233)。此外,新冠肺炎对美国肺炎球菌疾病负担的长期影响尚不清楚。
随着越来越多的肺炎球菌疫苗可供使用,成人肺炎球菌疫苗的推荐变得更加复杂。肺炎球菌疫苗的覆盖范围,尤其是年龄< 65岁且有增加肺炎球菌疾病风险的基础疾病的成年人,仍然不是最理想的(50,207,234)。涵盖更广泛血清型的疫苗的未来可用性可能提供简化成人肺炎球菌疫苗建议和增加疫苗覆盖面或扩大基于风险的建议的机会,以最大限度地预防肺炎球菌疾病。随着新数据的出现,ACIP将审查和更新建议。
免疫实践咨询委员会(ACIP)
2010年至2022年的ACIP会员名单可在以下网址获得https://www . CDC . gov/vaccines/acip/members/members-archive . html和https://www.cdc.gov/vaccines/acip/members/bios.html.
ACIP肺炎球菌疫苗工作组
椅子:凯瑟琳·a·珀林,维克森林医学院。
成员:弗吉尼亚·凯恩,国家医学协会;亚利桑那大学Doug Campos-out calt;Uzo Chukwuma,印度卫生局;埃默里大学亚特兰大退伍军人事务医疗中心Monica M. FarleyLynn Fisher,美国家庭医师学会;詹森·高德曼,美国内科医师学会;Jeffrey Kelman,医疗保险和医疗补助服务中心;基思·克鲁格曼,比尔和梅林达·盖茨基金会;露西亚·李,蒂娜·蒙高,美国食品药品监督管理局;德雷克塞尔大学医学院萨拉·s·朗;Kristina Lu,Mamodikoe Makhene,国立卫生研究院;詹姆斯·麦考利,美国传染病学会;Emily Messerli,免疫管理者协会;麦克马斯特大学丽贝卡·摩根;David Nace,美国老年医学会,急性和长期护理医学学会;亚瑟·莱因戈尔德,加州大学伯克利分校;纽约科恩儿童医疗中心的劳里·鲁宾;马克·索耶,美国儿科学会,传染病委员会;William Schaffner,国家传染病基金会;辛西娅·惠特尼,埃默里大学;Aleksandra Wierzbowski,加拿大国家免疫咨询委员会;匹兹堡大学理查德·k·齐默曼。
CDC贡献者:艾玛·阿科尔西、艾莉森·艾伯特、克里斯汀·安德列科、施莱亚·巴特纳加尔、亚当·l·科恩、詹妮弗·l·法勒、马克·费舍尔、瑞安·吉尔克、雷切尔·戈维兹、安吉拉·吉利斯、安德鲁·雷德纳、杰西卡·麦克尼尔、谢尔比·米勒、佩德罗·莫罗、诺埃尔·纳尔逊、塔玛拉·皮里什维利、纳姆拉塔·普拉萨德、杰奎琳·里萨尔瓦托、艾玛·格雷斯·特纳、伊丽莎白·贝拉斯克斯。
通讯作者:小林美和子,美国疾病预防控制中心国家免疫和呼吸道疾病中心。电话:404-639-2912;电子邮件:ydk3@cdc.gov.
1佐治亚州亚特兰大市疾病预防控制中心国家免疫和呼吸疾病中心;2佐治亚州亚特兰大市疾病预防控制中心国家新发和人畜共患传染病中心;3亚利桑那州凤凰城亚利桑那大学医学院;4加拿大安大略省汉密尔顿市麦克马斯特大学卫生研究方法、证据和影响系;5宾夕法尼亚州费城德雷克塞尔大学医学院;6北卡罗来纳州温斯顿塞勒姆维克森林大学维克森林医学院
利益冲突
所有作者都已完成并提交了国际医学期刊编辑委员会表格,用于披露潜在的利益冲突。Katherine A. Poehling报告了来自所有新生儿安全睡眠、大声爱幼儿伙伴、亲密伴侣暴力合作项目的机构支持,因为你很重要:关于新冠肺炎的对话、为错过儿童健康探视的患者提供的短信随访,以及重新想象母亲对我们的婴儿、家庭和社区的健康和福祉。没有披露其他潜在的利益冲突。
*在本研究中使用的SSUAD试验中,血清型15B和15C一起被鉴定为15B/15C。
†主要非劣效性假设是14种共有血清型的IgG GMC比率(PCV15/PPSV23)的双侧95% CI的下限> 0.5;次要非劣效性假设是14种共有血清型的OPA GMT比值(PCV15/PPSV23)的双侧95% CI的下限大于0.33。
§OPA GMT比率(PCV15/PCV13)的双侧95% CI的下限大于0.5。
¶对于PCV15独特血清型22F和33F,OPA GMT比率(PCV15/PCV13)的双侧95% CI的下限> 2.0,且参与者之间的百分比差异(PC v15-PC V13)的双侧95% CI的下限至少升高4倍,且> 0.1。对于血清型3,OPA GMT比率(PCV15/PCV13)的双侧95% CI的下限> 1.2,且至少增加四倍的参与者百分比之间的差异(pcv 15-pcv 13)的双侧95% CI的下限> 0。
**范围反映了不同研究结果的差异。例如,在一项研究中,与接种PCV13的组相比,接种PCV15的组在13种共有血清型中的9种中可能具有数字上相似或更高的OPA几何平均抗体滴度。在另一项研究中,接种PCV15的组可能在13种共有血清型中的13种中具有数值相似或更高的OPA GMT。具有数值相似或更高OPA GMT的特定血清型可能不同。
††这些增量成本效益比(PCV15 + PPSV23与2021年初建议)没有在研究中直接报告,而是根据Smith KJ,Wateska AR,Nowalk MP等人在《高价肺炎球菌结合疫苗:美国老年人的探索性成本效益分析》中报告的成本和质量分析进行计算[表2]。Am J Prev Med 202161:28–36.
图 血清型中包含的肺炎球菌疫苗的先前和目前在美国使用的*
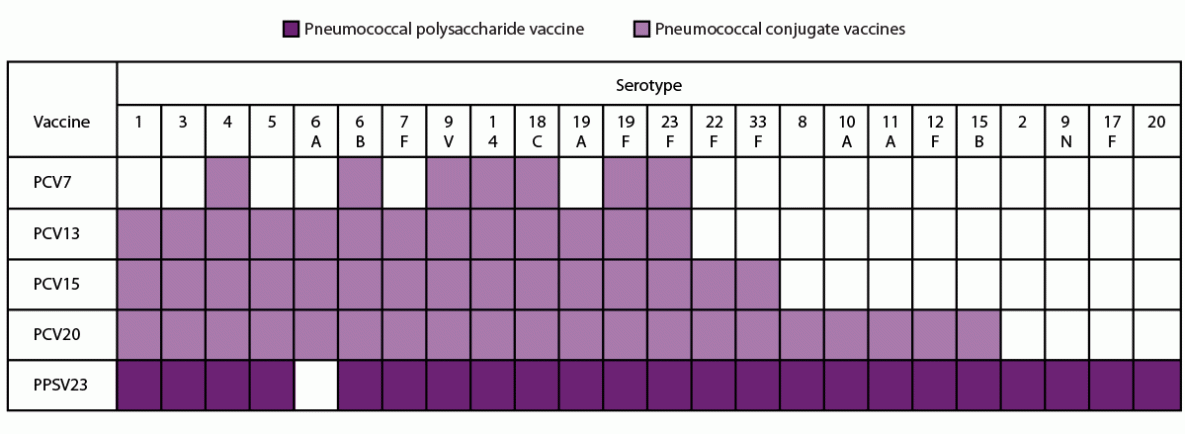
缩写:PCV7 = 7价肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗。
* PCV7已经停产。
表1.许可和可用的肺炎球菌疫苗——美国,2023年
| 疫苗产品 | 制造商 | 商号 | 根据包装说明书批准的适应症和年龄组 | ACIP数量-成人推荐剂量 | 成人获得许可或批准的年份 |
|---|---|---|---|---|---|
| 多糖疫苗 | |||||
| PPSV23 | 默克公司 | 23价肺炎多糖疫苗 | PPSV23型肺炎球菌疾病 年龄≥50岁和年龄≥2岁,患肺炎球菌疾病的风险增加 |
1-3剂,取决于年龄和适应症 | 1983 |
| 结合疫苗 | |||||
| PCV20 | 辉瑞 | PCV13 | PCV13型IPD和PCV7型中耳炎 6周至5岁 PCV13型IPD 6至17岁 PCV13型IPD与肺炎 年龄≥18岁 |
1剂 | 2011 |
| PCV15 | 默克公司 | 有或没有潜在的条件 | PCV15型IPD 年龄≥6周 |
1剂 | 2021 |
| PCV20 | 辉瑞 | 普雷瓦尔20 | PCV20型IPD和PCV型耳炎 6周至5岁 PCV20型IPD 6至17岁 PCV20型IPD与肺炎 年龄≥18岁 |
1剂 | 2021 |
缩写:ACIP =免疫实践咨询委员会;IPD =侵袭性肺炎球菌疾病;PCV7 = 7价肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗。
表2.美国免疫实践咨询委员会,2023年,按潜在条件划分的≥65岁成人肺炎球菌疫苗接种计划
| 以前在任何年龄接种过疫苗 | 有或没有潜在的条件 | 无特定的免疫妥协情况,*脑脊液漏或耳蜗植入 | 特定的免疫妥协状况、*脑脊液漏或耳蜗植入 |
|---|---|---|---|
| 附表选项A (提供PCV20) |
附表选项B (提供PCV15和PPSV23) |
附表选项B (提供PCV15和PPSV23) |
|
| 无/未知†或仅PCV7§ | 注射一剂PCV20 | 接种单剂PCV15,然后在接种PCV15后间隔≥1年后,接种单剂PPSV23 | 接种单剂量的PCV15,然后在接种PCV 15≥8周后,接种单剂量的PPSV23 |
| 仅限PPSV23§ | 自最后一次接种PPSV23后,间隔≥1年,接种单剂PCV20 | 自最后一次接种PPSV23后,间隔≥1年接种一次PCV15 | 自最后一次接种PPSV23后,间隔≥1年接种一次PCV15 |
| 仅PCV13 | 自最后一次注射PCV13后,间隔≥1年,注射一次PCV20¶ | 自最后一次注射PCV13后,间隔≥1年后注射一次PPSV23 | 在最后一次接种PCV13后≥8周,接种单剂PPSV23 |
| PCV13和PPSV23(任何接收顺序),但在年龄≥65岁时尚未接种PPSV23剂量 | 自最后一次注射PCV13或PPSV23后,间隔≥5年,注射单剂PCV20¶ | 在最后一次注射PCV13后间隔≥1年以及最后一次注射PPSV23后间隔≥5年后,给予单剂PPS v23 * * | 在最后一次注射PCV13后≥8周以及最后一次注射PPSV23后≥5年后,给予单剂PPS v23 * * |
| PCV13和PPSV23(任何顺序),PPSV23在年龄≥65岁时接种 | 与患者一起,疫苗提供者可以选择给年龄≥65岁的成年人注射单剂量的PCV20,这些成年人在任何年龄已经注射了PCV13(但不是PCV15或PCV20 ),在年龄≥65岁时注射了PPSV23。自最后一次注射PCV13或PPSV23后,间隔时间应≥5年。,†† | 不适用的 | 不适用的 |
缩写:ACIP =免疫实践咨询委员会;CSF =脑脊液;不适用=不适用;PCV7 = 7价肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗。
*慢性肾衰竭、先天性或获得性无脾症、先天性或获得性免疫缺陷(包括B-[体液]或T-淋巴细胞缺乏症、补体缺乏症[特别是C1、C2、C3和C4缺乏症]和吞噬细胞疾病[不包括慢性肉芽肿性疾病])、全身恶性肿瘤、HIV感染、霍奇金病、医源性免疫抑制(包括需要用免疫抑制药物疫苗的疾病,如长期全身性皮质类固醇和放射疫苗)、白血病、淋巴瘤、多发性骨髓瘤、肾病综合征、镰状细胞病或其他血红蛋白病,以及实体器官移植。不包括接种造血干细胞移植的人(来源:Matanock A,Lee G,Gierke R,Kobayashi M,Leidner A,Pilishvili T .年龄≥65岁的成人使用13价肺炎球菌结合疫苗和23价肺炎球菌多糖疫苗:免疫实践咨询委员会的最新建议。MMWR Wkly Rep 2019;68:1069–75)。
†新ACIP建议书(2021年10月) (来源:小林制药、法勒·JL、吉尔克·R等,《美国成人使用15价肺炎球菌结合疫苗和20价肺炎球菌结合疫苗:美国免疫实践咨询委员会的最新建议》, 2022年。MMWR Wkly Rep 2022;71:109–17)。
§疾控中心指导实施(来源: https://www . CDC . gov/vaccines/acip/meetings/downloads/slides-2022-10-19-20/04-肺炎球菌-Kobayashi-508.pdf)。
¶新ACIP建议(2022年10月)。
** 来源:Matanock A,Lee G,Gierke R,Kobayashi M,Leidner A,Pilishvili T .年龄≥65岁的成人使用13价肺炎球菌结合疫苗和23价肺炎球菌多糖疫苗:免疫实践咨询委员会的最新建议。MMWR Wkly Rep 2019;68:1069–75.
在默克模型中,对42岁免疫功能低下的成年人进行了单年龄队列研究,与目前推荐的使用PPSV23完成肺炎球菌疫苗接种系列的策略相比,在使用PCV13和PPSV23后5年使用PCV20导致了更高的费用和更差的健康结果。值得注意的是,该模型假设对照组在52岁和65岁时接种PPSV23剂量,这是当前推荐的剂量,但由于时间跨度较长,其他模型没有考虑这一点。此外,QALY的增量变化很小。 来源:疾控中心。共享临床决策:65岁以上成人接种PCV20疫苗。共享临床决策的考虑因素可能包括单个患者因基础医疗条件导致的肺炎球菌疾病风险、自上次接种肺炎球菌疫苗以来的时间或暴露于PCV20中所含肺炎球菌血清型的风险。https://www . CDC . gov/vaccines/hcp/admin/downloads/job-aid-scdm-PC v20-508 . pdf
表3.19-64岁患有特定免疫缺陷疾病的成人的肺炎球菌疫苗接种计划* —美国免疫实践咨询委员会,2023年
| 以前在任何年龄接种过疫苗 | 附表选项A (提供PCV20) |
附表选项B (提供PCV15和PPSV23) |
|---|---|---|
| 无/未知†或仅PCV7§在任何年龄 | 注射一剂PCV20 | 接种单剂PCV15,然后在接种PCV15后间隔≥8周,接种单剂PPSV23 |
| 仅限PPSV23§ | 自最后一次接种PPSV23后,间隔≥1年,接种单剂PCV20 | 自最后一次接种PPSV23后,间隔≥1年接种一次PCV15 |
| 仅PCV13 | 自最后一次注射PCV13后,间隔≥1年,注射一次PCV20¶ | 自最后一次接种PCV13后,间隔≥8周,接种单剂PPSV23。自上次注射PPSV23后,间隔≥5年再注射第二次PPSV23。当患者年满65岁时,再次回顾肺炎球菌疫苗建议。** |
| PCV13和1剂PPSV23(任何接收顺序) | 自最后一次注射PCV13或PPSV23后,间隔≥5年,注射单剂PCV20¶ | 在最后一次注射PCV13后间隔≥8周以及最后一次注射PPSV23后间隔≥5年后,给予单剂PPSV23。当患者年满65岁时,再次回顾肺炎球菌疫苗建议。** |
| PCV13和2剂PPSV23(任何接收顺序) | 自最后一次注射PCV13或PPSV23后,间隔≥5年,注射单剂PCV20¶ | 当患者年满65岁时,再次审查肺炎球菌疫苗建议** |
缩写:ACIP =免疫实践咨询委员会;CSF =脑脊液;PCV7 = 7价肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗。
*慢性肾衰竭先天性或获得性无脾症、先天性或获得性免疫缺陷(包括B-[体液]或T-淋巴细胞缺乏症、补体缺乏症[特别是C1、C2、C3和C4缺乏症]和吞噬细胞疾病[不包括慢性肉芽肿性疾病])、全身性恶性肿瘤、HIV感染、霍奇金病、医源性免疫抑制(包括需要用免疫抑制药物疫苗的疾病,如长期全身性皮质类固醇和放射疫苗)、白血病、淋巴瘤、多发性骨髓瘤、肾病综合征、镰状细胞病和其他血红蛋白病,以及实体器官移植。不包括接种造血干细胞移植的人。
†新ACIP建议书(2021年10月) (来源:小林制药、法勒·JL、吉尔克·R等,《美国成人使用15价肺炎球菌结合疫苗和20价肺炎球菌结合疫苗:美国免疫实践咨询委员会的最新建议》, 2022年。MMWR Wkly Rep 2022;71:109–17)。
§疾控中心指导实施(来源: https://www . CDC . gov/vaccines/acip/meetings/downloads/slides-2022-10-19-20/04-肺炎球菌-Kobayashi-508.pdf)。
¶新ACIP建议(2022年10月)。
** 来源:Matanock A,Lee G,Gierke R,Kobayashi M,Leidner A,Pilishvili T .年龄≥65岁的成人使用13价肺炎球菌结合疫苗和23价肺炎球菌多糖疫苗:免疫实践咨询委员会的最新建议。MMWR Wkly Rep 2019;68:1069–75.
表4.脑脊液漏或人工耳蜗植入的19-64岁成年人的肺炎球菌疫苗接种计划——美国免疫实践咨询委员会,2023年
| 以前接种的疫苗 | 附表选项A (提供PCV20) |
附表选项B (提供PCV15和PPSV23) |
|---|---|---|
| 无*或仅PCV7†在任何年龄 | 注射一剂PCV20 | 接种单剂PCV15,然后在接种PCV15后间隔≥8周,接种单剂PPSV23 |
| 仅限PPSV23† | 自最后一次接种PPSV23后,间隔≥1年,接种单剂PCV20 | 自最后一次接种PPSV23后,间隔≥1年接种一次PCV15 |
| 仅PCV13 | 在最后一次接种间隔≥1年后,给予单剂PCV20§ | 自最后一次接种PCV13后,间隔≥8周,接种单剂PPSV23。当患者年满65岁时,再次回顾肺炎球菌疫苗建议。¶ |
| PCV13和1剂PPSV23 | 在最后一次接种间隔≥5年后,给予单剂PCV20§ | 当患者年满65岁时,再次审查肺炎球菌疫苗建议¶ |
缩写:ACIP =免疫实践咨询委员会;PCV7 = 7价肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗。
*新ACIP建议书(2021年10月) (来源:小林制药、法勒·JL、吉尔克·R等,《美国成人使用15价肺炎球菌结合疫苗和20价肺炎球菌结合疫苗:美国免疫实践咨询委员会的最新建议》, 2022年。MMWR Wkly Rep 2022;71:109–17)。
†疾控中心指导实施(来源: https://www . CDC . gov/vaccines/acip/meetings/downloads/slides-2022-10-19-20/04-肺炎球菌-Kobayashi-508.pdf)。
§新ACIP建议(2022年10月)。
¶ 来源:Matanock A,Lee G,Gierke R,Kobayashi M,Leidner A,Pilishvili T .年龄≥65岁的成人使用13价肺炎球菌结合疫苗和23价肺炎球菌多糖疫苗:免疫实践咨询委员会的最新建议。MMWR Wkly Rep 2019;68:1069–75.
表5.患有慢性疾病的19-64岁成年人的肺炎球菌疫苗接种计划* —美国免疫实践咨询委员会,2023年
| 以前接种的疫苗 | 附表选项A (提供PCV20) |
附表选项B (提供PCV15和PPSV23) |
|---|---|---|
| 没有†或仅PCV7§在任何年龄 | 注射一剂PCV20 | 接种单剂量的PCV15,然后在最后一次接种后间隔≥1年后,接种单剂量的PPSV23 |
| 仅限PPSV23§ | 自最后一次接种PPSV23后,间隔≥1年,接种单剂PCV20 | 自最后一次接种PPSV23后,间隔≥1年接种一次PCV15 |
| 仅PCV13, | 在最后一次接种间隔≥1年后,给予单剂PCV20 | 自最后一次接种PCV13后,间隔≥1年,接种单剂PPSV23。当患者年满65岁时,再次回顾肺炎球菌疫苗建议。 |
| PCV13和PPSV23, | 目前不推荐使用疫苗。当患者年满65岁时,再次回顾肺炎球菌疫苗建议。 | |
缩写:ACIP =免疫实践咨询委员会;PCV7 = 7价肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗。
*酗酒;慢性心脏病,包括充血性心力衰竭和心肌病;慢性肝病;慢性肺病,包括慢性阻塞性肺病、肺气肿和哮喘;吸烟;或糖尿病。
†新ACIP建议书(2021年10月) (来源:小林制药、法勒·JL、吉尔克·R等,《美国成人使用15价肺炎球菌结合疫苗和20价肺炎球菌结合疫苗:美国免疫实践咨询委员会的最新建议》, 2022年。MMWR Wkly Rep 2022;71:109–17)。
§CDC实施指南(来源: https://www . CDC . gov/vaccines/VPD/pneumo/downloads/pneumo-vaccine-timing . pdf)。
¶不建议患有慢性疾病的19-64岁成年人接种PCV13(来源:Matanock A,Lee G,Gierke R,Kobayashi M,Leidner A,Pilishvili T .年龄≥65岁的成人使用13价肺炎球菌结合疫苗和23价肺炎球菌多糖疫苗:免疫实践咨询委员会的最新建议。MMWR Wkly Rep 2019;68:1069–75)。
表6.接种造血干细胞移植的19岁以上成人的肺炎球菌疫苗接种时间表——美国免疫实践咨询委员会,2023年
| 以前接种的疫苗 | 附表选项A (提供PCV20) |
附表选项B (提供PCV15和PPSV23) |
|---|---|---|
| HSCT之后没有 | 从HSCT后3-6个月开始,间隔4周接种3剂PCV20。第三剂PCV20后≥6个月,或HSCT后≥12个月,以较晚者为准,给予第四剂PCV20。* | 如果没有慢性GVHD,在HSCT后3-6个月开始给予3剂PCV15,间隔4周,然后在HSCT后≥12个月给予PPSV23。如果患者患有慢性GVHD,则使用第四剂PCV15代替PPSV23。* |
| HSCT后接种了≥1剂PCV13或PCV15,但未接种全部4剂肺炎球菌疫苗 | 接种≥1剂的PCV20以完成4剂PCV系列。HSCT后3-6个月开始,间隔4周给予前3剂PCV。第三剂PCV后≥6个月,或HSCT后≥12个月,以较晚者为准,给予单剂PCV20。* | 从HSCT后3-6个月开始,间隔4周,共给予3剂PCV,如果没有慢性GVHD,则在HSCT后≥12个月给予PPSV23。如果患者患有慢性GVHD,则使用第四剂PCV15代替PPSV23。* |
缩写:ACIP =免疫实践咨询委员会;GVHD =移植物抗宿主病;HSCT =造血干细胞移植;PCV =肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗。
*最好告知患者的临床团队,以确定接种疫苗的适当时机。
表7.肺炎球菌结合疫苗中使用PCV15或PCV20的建议——年龄≥19岁的成年人——美国免疫实践咨询委员会,2023年
| 医学指征组 | 特定的潜在医疗状况 | 年龄组,岁 | |
|---|---|---|---|
| 19–64 | 糖尿病 | ||
| 没有人 | 没有人 | 没有人 | 1剂单独的PCV20,或1剂PCV15,1年后再接种1剂PPSV23 * |
| 潜在的医疗条件或其他风险因素 | 酗酒 慢性心脏病† 慢性肝病 慢性肺病§ 慢性肾功能衰竭¶ 吸烟 耳蜗植入物-假耳 先天性或获得性无脾症¶ 先天性或获得性免疫缺陷,** 脑脊液漏 糖尿病 全身恶性肿瘤¶ 艾滋病毒感染 霍奇金病¶ 医源性免疫抑制,†† 白血病¶ 淋巴瘤¶ 多发性骨髓瘤¶ 肾病综合征¶ 镰状细胞病或其他血红蛋白病¶ 实体器官移植¶ |
1剂单独的PCV20或1剂PCV15,1年后再接种1剂PPSV23 * | 1剂单独的PCV20或1剂PCV15,1年后再接种1剂PPSV23 * |
缩写:CSF =脑脊液;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗。
*患有免疫功能低下、脑脊液漏或耳蜗植入的成人可能受益于较短的间隔时间(例如≥8周)。如果在年龄< 65岁时接种,这些疫苗剂量不需要在年龄≥65岁时重复。
†包括充血性心力衰竭和心肌病。
§包括慢性阻塞性肺病、肺气肿和哮喘。
¶表明免疫系统受损
**包括B-(体液)或T-淋巴细胞缺乏症、补体缺乏症(尤其是C1、C2、C3和C4缺乏症)和吞噬细胞疾病(不包括慢性肉芽肿性疾病)。
在默克模型中,对42岁免疫功能低下的成年人进行了单年龄队列研究,与目前推荐的使用PPSV23完成肺炎球菌疫苗接种系列的策略相比,在使用PCV13和PPSV23后5年使用PCV20导致了更高的费用和更差的健康结果。值得注意的是,该模型假设对照组在52岁和65岁时接种PPSV23剂量,这是当前推荐的剂量,但由于时间跨度较长,其他模型没有考虑这一点。此外,QALY的增量变化很小。需要用免疫抑制药物疫苗的疾病,包括长期全身性皮质类固醇和放射疫苗。
表8.成本效益分析模型的选定特征和结果评估了以前未接种疫苗的成年人使用PCV15或PCV20的情况,调整到2022美元
| 特性 | 杜兰疾病控制中心 | 默克公司 | 辉瑞 |
|---|---|---|---|
| 模型类型 | 单一群组,终生 | 多短,生命周期 | 多短,生命周期 |
| 一个基本案例或场景 | 一个基本案例 | 四种情况 | 一个基本案例 |
| 社会视角或卫生保健部门 | 社会的 | 社会的 | 两者 |
| 不良事件 | 不 | 不 | 不 |
| 基于年龄和风险的综合评估 | 是 | 不 | 是 |
| 从低风险到高风险的转变(例如,从健康到慢性疾病) | 是 | 不 | 是 |
| 潜在儿科接种新疫苗的间接影响 | 在场景中 | 未包括在内 | 在基本情况下 |
| 与其它PCV血清型相比,抗血清型3疾病的PCV VE较低 | 在基本情况下 | 在基本情况下 | 在场景中 |
| PPSV对NBPP的VE> 0% | 在基本情况下 | 在基本情况下 | 不 |
| 干预措施中的疫苗接种覆盖率与当前建议 | 视情况而定 | PCV覆盖率更高 | PCV覆盖率更高 |
| 基于风险的分析中的比较器 | 基于年龄的使用(增量) | 现状* | 现状* |
| 基于可用敏感性分析的重要输入和假设 | 间接影响;VE(初始,减弱) | VE(初始,减弱) | 间接影响 VE(初始,减弱) NBPP发生率 |
| PCV20适用于所有年龄≥65岁的成年人,与目前的建议相比 | 成本节约† | 成本节约†涨到了42000美元§每QALY获得 | 成本节约 |
| PCV15与PPSV23串联使用,适用于所有年龄≥65岁的成年人,与目前的建议相比 | 成本节约† | $260,000–$309,000§每QALY获得;成本节约†在敏感性分析中 | 未评估 |
| 19-64岁成年人基于风险的PCV20使用 | $320,000§每QALY获得 | $63,000–$201,000§每QALY获得 | $13,000¶每QALY获得 |
| 19-64岁成人基于风险的PCV15与PPSV23系列使用 | $718,000§每QALY获得 | $274,000–$342,000§每QALY获得 | 未评估 |
缩写:NBPP =非细菌性肺炎球菌肺炎;PCV =肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗;QALY =质量调整寿命年;USD =美元;VE =疫苗效力。
* 来源:Matanock A,Lee G,Gierke R,Kobayashi M,Leidner A,Pilishvili T .年龄≥65岁的成人使用13价肺炎球菌结合疫苗和23价肺炎球菌多糖疫苗:免疫实践咨询委员会的最新建议。MMWR Wkly Rep 2019;68:1069–75.
†与以前的建议相比,成本更低,健康结果更好。
§原始报告以2021年美元为单位,乘以1.10调整为2022年美元。
¶原始报告以2020年美元为单位,乘以1.15以调整到2022年美元。
表9.成本效益分析模型的选定特征和结果,用于评估年龄≥65岁且以前接种过13价肺炎球菌结合疫苗的成人使用20价肺炎球菌结合疫苗的情况,调整至2022美元
| 特性 | 杜兰疾病控制中心 | 默克公司 | 辉瑞 |
|---|---|---|---|
| 模型类型 | 单一群组,*终生 | 单一群组,*终生 | 多缩写,†一生 |
| 远景 | 社会的§ | 卫生保健§ | 卫生保健 |
| 不良事件 | 不 | 不 | 不 |
| 敏感性分析 | 单变量、情景和概率敏感性分析 | 单变量、情景和概率敏感性分析 | 单变量和情景分析 |
| 儿科疫苗接种的间接影响 | 是¶ | 不 | 是¶ |
| 与其它PCV血清型相比,抗血清型3疾病的PCV VE较低 | 在基本情况下 | 在基本情况下 | 在场景中 |
| PPSV23 VE对阵NBPP | 7%–20%** | 3%–67%** | 0% |
| 住院NBPP病死率 | 3%–5%在默克模型中,对42岁免疫功能低下的成年人进行了单年龄队列研究,与目前推荐的使用PPSV23完成肺炎球菌疫苗接种系列的策略相比,在使用PCV13和PPSV23后5年使用PCV20导致了更高的费用和更差的健康结果。值得注意的是,该模型假设对照组在52岁和65岁时接种PPSV23剂量,这是当前推荐的剂量,但由于时间跨度较长,其他模型没有考虑这一点。此外,QALY的增量变化很小。 | 7%–12%在默克模型中,对42岁免疫功能低下的成年人进行了单年龄队列研究,与目前推荐的使用PPSV23完成肺炎球菌疫苗接种系列的策略相比,在使用PCV13和PPSV23后5年使用PCV20导致了更高的费用和更差的健康结果。值得注意的是,该模型假设对照组在52岁和65岁时接种PPSV23剂量,这是当前推荐的剂量,但由于时间跨度较长,其他模型没有考虑这一点。此外,QALY的增量变化很小。 | 3%–11%在默克模型中,对42岁免疫功能低下的成年人进行了单年龄队列研究,与目前推荐的使用PPSV23完成肺炎球菌疫苗接种系列的策略相比,在使用PCV13和PPSV23后5年使用PCV20导致了更高的费用和更差的健康结果。值得注意的是,该模型假设对照组在52岁和65岁时接种PPSV23剂量,这是当前推荐的剂量,但由于时间跨度较长,其他模型没有考虑这一点。此外,QALY的增量变化很小。 |
| IPD和QALY的损失 住院NBPP |
0.071 | 0.071 | 0.130 |
| 年龄≥65岁、仅接种PCV13疫苗接种的成年人使用PCV20疫苗,而不额外接种疫苗 | |||
| 自上次接种疫苗以来的时间 | 1年 | 5年 | 7年 |
| 接种PCV20疫苗时的年龄,岁 | 66和76 | 73 | 65–99(平均75) |
| 每QALY获得的成本 | $139,000–$611,000 | $182,000 | $87,000*** |
| 年龄≥65岁的成年人接种PCV13和PPSV23疫苗后使用PCV20,而不接种其他疫苗 | |||
| 自上次接种疫苗以来的时间 | 1岁、5岁和10岁 | 5年 | 7年 |
| 接种PCV20疫苗时的年龄,岁 | 67、71、76、77和81的氨基酸序列(无免疫妥协条件);66、70、75、76和80(具有免疫妥协状况) | 73 | 65–99(平均75) |
| 每QALY获得的成本 | 168,000美元至970,000美元**(无免疫妥协条件);421,000美元至925,000美元**(有免疫妥协情况) | $217,000 | $93,000–$182,000 |
缩写:IPD =侵袭性肺炎球菌疾病;NBPP =非细菌性肺炎球菌肺炎;PCV =肺炎球菌结合疫苗;PCV13 = 13价肺炎球菌结合疫苗;PCV15 = 15价肺炎球菌结合疫苗;PCV20 = 20价肺炎球菌结合疫苗;PPSV23 = 23价肺炎球菌多糖疫苗;QALY =质量调整寿命年;USD =美元;VE =疫苗效力。
*在任何情况下,杜兰疾病预防控制中心和默克公司的模型都是从单一年龄组的个体开始,而不是由许多不同年龄组成的完整人群。因此,这些模型有一个特定的起始年龄。例如,一个年龄为70岁的队列可能用于表示和估计年龄≥65岁的群体中的值。
†辉瑞模型基础案例使用了多种期权模型;然而,在一个场景中提供了单个队列的结果。
§Tulane-CDC模型包括一个社会视角的组成部分(即旅行成本加疫苗接种成本)。默克模型从社会角度提供了一个类似于杜兰-疾病预防控制中心模型的场景。
¶杜兰-CDC和辉瑞的模型包括了儿科疫苗接种不会产生群体效应的情况。
* * Tulane-CDC模型在两个风险组(患有或不患有免疫妥协疾病的成人)中改变了PPSV23 VE对NBPP的作用。默克模型在三个风险组(低风险、有风险和高风险)中改变了PPSV23 VE与NBPP的比值。
在默克模型中,对42岁免疫功能低下的成年人进行了单年龄队列研究,与目前推荐的使用PPSV23完成肺炎球菌疫苗接种系列的策略相比,在使用PCV13和PPSV23后5年使用PCV20导致了更高的费用和更差的健康结果。值得注意的是,该模型假设对照组在52岁和65岁时接种PPSV23剂量,这是当前推荐的剂量,但由于时间跨度较长,其他模型没有考虑这一点。此外,QALY的增量变化很小。杜兰-CDC和默克模型根据年龄改变了住院NBPP病死率。辉瑞模型根据年龄和风险组改变了住院NBPP病死率。
原始报告以2021年美元为单位,乘以1.10调整为2022年美元。
默克模型没有报告用于比较的数值。增量值由CDC团队计算。
***原始报告以2020年美元为单位,乘以1.15以调整到2022年美元。
盒子。 对于年龄≥65岁且已完成13价肺炎球菌结合疫苗和23价肺炎球菌多糖疫苗推荐疫苗系列的成人,关于使用20价肺炎球菌结合疫苗的共享临床决策的考虑
- 20价肺炎球菌结合疫苗(PCV20)是一种安全的免疫原性疫苗,适用于老年人。年龄≥65岁的成年人患13价肺炎球菌结合疫苗(PCV13)型疾病的风险比儿科项目实施前低得多,这是间接PCV13效应的结果(通过防止携带,从而减少PCV13型菌株的传播)。儿童使用PCV20对成人肺炎球菌疾病负担的影响尚不清楚。
- 对于这些已经接种了一剂PCV13和23价肺炎球菌多糖疫苗(PPSV23)的成年人,剩余风险取决于每位患者暴露于PCV20中所含血清型的风险、是否存在增加患肺炎球菌疾病或出现严重疾病症状风险的潜在医学状况或风险因素,以及自上次接种肺炎球菌疫苗以来的时间。
- PCV20型侵袭性肺炎球菌疾病和肺炎的发病率随着年龄的增长而增加,并且在患有一种以上慢性疾病、*脑脊液漏、人工耳蜗植入或免疫低下疾病的人群中发病率更高。†尽管儿科使用PCV13对这些患有增加肺炎球菌疾病风险的潜在疾病的成年人群体有间接影响,但这些群体中残余的PCV13型疾病负担仍然较高。§对于这些肺炎球菌疾病风险增加的人,接种PCV20疫苗可能有额外的益处,特别是如果自上次接种肺炎球菌疫苗以来已经过去了一段时间(即≥5年)。
*酗酒;慢性心脏、肝脏或肺部疾病;吸烟;或糖尿病。
†免疫妥协疾病定义为慢性肾衰竭、肾病综合征、免疫缺陷、医源性免疫抑制、全身性恶性肿瘤、HIV感染、霍奇金病、白血病、淋巴瘤、多发性骨髓瘤、实体器官移植、先天性或获得性无脾症、镰状细胞病或其他血红蛋白病。
§ 来源:Ahmed SS,Pondo T,Xing W,等,《使用13价肺炎球菌结合疫苗对有或无基础疾病的成人侵袭性肺炎球菌疾病的早期影响》——美国。Clin Infect Dis 202070:2484–92.
疾病预防控制中心采纳ACIP建议MMWR建议和报告,MMWR政策说明和免疫计划(儿童/青少年、成人)
免疫实践咨询委员会(ACIP)制定了儿童、青少年和成人常规使用疫苗的建议。ACIP是一个联邦咨询委员会,为疾病预防控制中心主任提供关于在美国平民中使用疫苗和相关制剂控制疫苗可预防疾病的外部专家建议和指导。儿童和青少年常规使用疫苗的建议尽可能与美国儿科学会(AAP)、美国家庭医师学会(AAFP)和美国妇产科医师学会(ACOG)的建议保持一致。成人常规使用疫苗的建议与AAFP、ACOG和美国内科医师学会(ACP)的建议一致。ACIP的建议被转发给疾病预防控制中心主任,一旦被采纳,将成为疾病预防控制中心的官方政策。这些建议随后发表在疾病控制中心的发病率和死亡率周报(MMWR)。更多信息请访问官方文本、图表和表格的印刷版本。.
Suggested citation for this article: Kobayashi M, Pilishvili T, Farrar JL, et al. Pneumococcal Vaccine for Adults Aged ≥19 Years: Recommendations of the Advisory Committee on Immunization Practices, United States, 2023. MMWR Recomm Rep 2023;72(No. RR-3):1–39. DOI: http://dx.doi.org/10.15585/mmwr.rr7203a1.
1National Center for Immunization and Respiratory Diseases, CDC, Atlanta, Georgia; 2National Center for Emerging and Zoonotic Infectious Diseases, CDC, Atlanta, Georgia; 3University of Arizona College of Medicine, Phoenix, Arizona; 4Department of Health Research Methods, Evidence and Impact, McMaster University, Hamilton, Ontario, Canada; 5Drexel University College of Medicine, Drexel University, Philadelphia, Pennsylvania; 6Wake Forest School of Medicine, Wake Forest University, Winston-Salem, North Carolina
Conflicts of Interest
All authors have completed and submitted the International Committee of Medical Journal Editors form for disclosure of potential conflicts of interest. Katherine A. Poehling reports institutional support from Safe Sleep for All Newborns, Love Out Loud Early Childhood Fellow, Intimate Partner Violence Collaborative Project, Because You Matter: Conversations You Want about COVID-19, text messaging follow-up for patients who missed well-child visits, and Reimagining Health and Wellness by Mothers for Our Babies, Families, and Communities. No other potential conflicts of interest were disclosed.
* Serotypes 15B and 15C are identified together as 15B/15C in the SSUAD test used in this study.
† Primary noninferiority hypothesis was lower bound of the two-sided 95% CI of the IgG GMC ratio (PCV15/PPSV23) of the 14 shared serotypes to be >0.5; secondary noninferiority hypothesis was lower bound of the two-sided 95% CI of the OPA GMT ratio (PCV15/PPSV23) of the 14 shared serotypes to be >0.33.
§ Lower bound of the two-sided 95% CI of the OPA GMT ratio (PCV15/PCV13) to be >0.5.
¶ For PCV15-unique serotypes 22F and 33F, lower bound of the two-sided 95% CI of the OPA GMT ratio (PCV15/PCV13) to be >2.0 and the lower bound of the two-sided 95% CI of the differences (PCV15 − PCV13) between the percentages of participants with at least a fourfold rise to be >0.1. For serotype 3, lower bound of the two-sided 95% CI of the OPA GMT ratio (PCV15/PCV13) to be >1.2 and the lower bound of the two-sided 95% CI of the differences (PCV15 − PCV13) between the percentages of participants with at least a fourfold rise to be >0.
** Range reflects the difference in results across studies. For example, in one study, the group that received PCV15 may have numerically similar or higher OPA geometric mean antibody titers for nine of 13 shared serotypes compared with the group that received PCV13. In another study, the group that received PCV15 might have numerically similar or higher OPA GMT for 13 of 13 shared serotypes. The specific serotypes with numerically similar or higher OPA GMT might vary.
†† These incremental cost-effectiveness ratios (PCV15 + PPSV23 versus early 2021 recommendations) were not directly reported in the study, but were calculated on the basis of costs and QALYs reported in Smith KJ, Wateska AR, Nowalk MP, et al. Higher-valency pneumococcal conjugate vaccines: an exploratory cost-effectiveness analysis in U.S. seniors [Table 2]. Am J Prev Med 2021;61:28–36.
References
- Weiser JN, Ferreira DM, Paton JC. Streptococcus pneumoniae: transmission, colonization and invasion. Nat Rev Microbiol 2018;16:355–67. https://doi.org/10.1038/s41579-018-0001-8 PMID:29599457
- Bogaert D, De Groot R, Hermans PW. Streptococcus pneumoniae colonisation: the key to pneumococcal disease. Lancet Infect Dis 2004;4:144–54. https://doi.org/10.1016/S1473-3099(04)00938-7 PMID:14998500
- Bonten MJ, Huijts SM, Bolkenbaas M, et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med 2015;372:1114–25. https://doi.org/10.1056/NEJMoa1408544 PMID:25785969
- Gingerich AD, Mousa JJ. Diverse mechanisms of protective anti-pneumococcal antibodies. Front Cell Infect Microbiol 2022;12:824788. https://doi.org/10.3389/fcimb.2022.824788 PMID:35155281
- Ganaie F, Saad JS, McGee L, et al. A new pneumococcal capsule type, 10D, is the 100th serotype and has a large cps fragment from an oral streptococcus. MBio 2020;11:e00937–20. https://doi.org/10.1128/mBio.00937-20 PMID:32430472
- Werren JP, Troxler LJ, Oyewole OR, et al. Carbon source-dependent changes of the structure of Streptococcus pneumoniae capsular polysaccharide with serotype 6F. Int J Mol Sci 2021;22:4580. https://doi.org/10.3390/ijms22094580 PMID:33925509
- Ganaie F, Maruhn K, Li C, et al. Structural, genetic, and serological elucidation of Streptococcus pneumoniae serogroup 24 serotypes: discovery of a new serotype, 24C, with a variable capsule structure. J Clin Microbiol 2021;59:e0054021. https://doi.org/10.1128/JCM.00540-21 PMID:33883183
- Advisory Committee on Immunization Practices. Preventing pneumococcal disease among infants and young children. Recommendations of the Advisory Committee on Immunization Practices (ACIP)。 MMWR Recomm Rep 2000;49(No. RR-9):1–35. PMID:11055835
- Whitney CG, Farley MM, Hadler J, et al.; Active Bacterial Core Surveillance of the Emerging Infections Program Network. Decline in invasive pneumococcal disease after the introduction of protein-polysaccharide conjugate vaccine. N Engl J Med 2003;348:1737–46. https://doi.org/10.1056/NEJMoa022823 PMID:12724479
- Nuorti JP, Whitney CG. Prevention of pneumococcal disease among infants and children—use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine—recommendations of the Advisory Committee on Immunization Practices (ACIP)。 MMWR Recomm Rep 2010;59(No. RR-11):1–18. PMID:21150868
- CDC. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP)。 MMWR Morb Mortal Wkly Rep 2012;61:816–9. PMID:23051612
- Tomczyk S, Bennett NM, Stoecker C, et al. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine among adults aged ≥65 years: recommendations of the Advisory Committee on Immunization Practices (ACIP)。 MMWR Morb Mortal Wkly Rep 2014;63:822–5. PMID:25233284
- Bonten MJM, Huijts SM, Bolkenbaas M, et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med 2015;372:1114–25. https://doi.org/10.1056/NEJMoa1408544 PMID:25785969
- Matanock A, Lee G, Gierke R, Kobayashi M, Leidner A, Pilishvili T. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine among adults aged ≥65 years: updated recommendations of the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep 2019;68:1069–75. https://doi.org/10.15585/mmwr.mm6846a5 PMID:31751323
- Kroger A, Bahta L, Hunter P. Vaccine recommendations and guidance of the ACIP: general best practice guidelines for immunization: altered immunocompetence. Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/immunocompetence.html
- Kobayashi M, Farrar JL, Gierke R, et al. Use of 15-valent pneumococcal conjugate vaccine and 20-valent pneumococcal conjugate vaccine among U.S. adults: updated recommendations of the Advisory Committee on Immunization Practices—United States, 2022. MMWR Morb Mortal Wkly Rep 2022;71:109–17. https://doi.org/10.15585/mmwr.mm7104a1 PMID:35085226
- Kobayashi M, Bennett NM, Gierke R, et al. Intervals between PCV13 and PPSV23 vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP)。 MMWR Morb Mortal Wkly Rep 2015;64:944–7. https://doi.org/10.15585/mmwr.mm6434a4 PMID:26334788
- CDC; Advisory Committee on Immunization Practices. Updated recommendations for prevention of invasive pneumococcal disease among adults using the 23-valent pneumococcal polysaccharide vaccine (PPSV23)。 MMWR Morb Mortal Wkly Rep 2010;59:1102–6. PMID:20814406
- CDC. Evidence-based recommendations—GRADE. Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/vaccines/acip/recs/grade/about-grade.html
- CDC. New framework (GRADE) for development of evidence-based recommendations by the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep 2012;61:327. PMID:22572979
- CDC. GRADE: 20-valent pneumococcal conjugate vaccine (PCV20) for adults aged 19–64 years with underlying medical conditions or other risk factors. Atlanta, GA: US Department of Health and Human Services, CDC; 2022. https://www.cdc.gov/vaccines/acip/recs/grade/pneumo-PCV20-risk-based.html
- CDC. GRADE: 20-valent pneumococcal conjugate vaccine (PCV20) for adults aged ≥65 years. Atlanta, GA: US Department of Health and Human Services, CDC; 2022. https://www.cdc.gov/vaccines/acip/recs/grade/pneumo-PCV20-age-based.html
- CDC. GRADE: 15-valent pneumococcal conjugate vaccine (PCV15) in series with 23-valent pneumococcal polysaccharide vaccine (PPSV23) for adults aged 19–64 years with underlying medical conditions or other risk factors. Atlanta, GA: US Department of Health and Human Services, CDC; 2022. https://www.cdc.gov/vaccines/acip/recs/grade/pneumo-PCV15-PPSV23-risk-based.html
- CDC. GRADE: 15-valent pneumococcal conjugate vaccine (PCV15) in series with 23-valent pneumococcal polysaccharide vaccine (PPSV23) for adults aged ≥65 years. Atlanta, GA: US Department of Health and Human Services, CDC; 2022. https://www.cdc.gov/vaccines/acip/recs/grade/pneumo-PCV15-PPSV23-age-based.html
- Lee G, Carr W, Reingold A, et al.; ACIP Evidence-Based Recommendations Work Group. Updated framework for development of evidence-based recommendations by the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep 2018;67:1271–2. https://doi.org/10.15585/mmwr.mm6745a4 PMID:30439877
- CDC. Evidence to recommendations frameworks. Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/vaccines/acip/recs/grade/etr.html
- Shimabukuro TT, Nguyen M, Martin D, DeStefano F. Safety monitoring in the Vaccine Adverse Event Reporting System (VAERS)。 Vaccine 2015;33:4398–405. https://doi.org/10.1016/j.vaccine.2015.07.035 PMID:26209838
- CDC. Vaccine Safety Datalink (VSD)。 Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/vaccinesafety/ensuringsafety/monitoring/vsd/index.html
- Perniciaro S, van der Linden M, Weinberger DM. Reemergence of invasive pneumococcal disease in Germany during the spring and summer of 2021. Clin Infect Dis 2022;75:1149–53. https://doi.org/10.1093/cid/ciac100 PMID:35136983
- Bertran M, Amin-Chowdhury Z, Sheppard CL, et al. Increased incidence of invasive pneumococcal disease among children after COVID-19 pandemic. England. Emerg Infect Dis 2022;28:1669–72. https://doi.org/10.3201/eid2808.220304 PMID:35876698
- Obaro S, Adegbola R. The pneumococcus: carriage, disease and conjugate vaccines. J Med Microbiol 2002;51:98–104. https://doi.org/10.1099/0022-1317-51-2-98 PMID:11863272
- Smith EL, Wheeler I, Adler H, et al. Upper airways colonisation of Streptococcus pneumoniae in adults aged 60 years and older: a systematic review of prevalence and individual participant data meta-analysis of risk factors. J Infect 2020;81:540–8. https://doi.org/10.1016/j.jinf.2020.06.028 PMID:32562794
- Brueggemann AB, Jansen van Rensburg MJ, Shaw D, et al. Changes in the incidence of invasive disease due to Streptococcus pneumoniae, Haemophilus influenzae, and Neisseria meningitidis during the COVID-19 pandemic in 26 countries and territories in the Invasive Respiratory Infection Surveillance Initiative: a prospective analysis of surveillance data. Lancet Digit Health 2021;3:e360–70. https://doi.org/10.1016/S2589-7500(21)00077-7 PMID:34045002
- Brueggemann AB, Spratt BG. Geographic distribution and clonal diversity of Streptococcus pneumoniae serotype 1 isolates. J Clin Microbiol 2003;41:4966–70. https://doi.org/10.1128/JCM.41.11.4966-4970.2003 PMID:14605125
- Rybak A, Levy C, Angoulvant F, et al. Association of nonpharmaceutical interventions during the COVID-19 pandemic with invasive pneumococcal disease, pneumococcal carriage, and respiratory viral infections among children in France. JAMA Netw Open 2022;5:e2218959. https://doi.org/10.1001/jamanetworkopen.2022.18959 PMID:35763298
- Danino D, Ben-Shimol S, van der Beek BA, et al. Decline in pneumococcal disease in young children during the coronavirus disease 2019 (COVID-19) pandemic in Israel associated with suppression of seasonal respiratory viruses, despite persistent pneumococcal carriage: a prospective cohort study. Clin Infect Dis 2022;75:e1154–64. https://doi.org/10.1093/cid/ciab1014 PMID:34904635
- Isturiz R, Grant L, Gray S, et al. Expanded analysis of 20 pneumococcal serotypes associated with radiographically confirmed community-acquired pneumonia in hospitalized US adults. Clin Infect Dis 2021;73:1216–22. https://doi.org/10.1093/cid/ciab375 PMID:33982098
- Tong S, Amand C, Kieffer A, Kyaw MH. Trends in healthcare utilization and costs associated with pneumonia in the United States during 2008–2014. BMC Health Serv Res 2018;18:715. https://doi.org/10.1186/s12913-018-3529-4 PMID:30217156
- McLaughlin JM, Khan FL, Thoburn EA, Isturiz RE, Swerdlow DL. Rates of hospitalization for community-acquired pneumonia among US adults: a systematic review. Vaccine 2020;38:741–51. https://doi.org/10.1016/j.vaccine.2019.10.101 PMID:31843272
- Gierke R, Matanock A, Shang N, et al. Impact of 13-valent pneumococcal conjugate vaccine (PCV13) on non-bacteremic pneumococcal pneumonia (NBPP) among adults in the United States, 2013–2017. Open Forum Infect Dis 2020;7(Suppl 1):S738–9. https://doi.org/10.1093/ofid/ofaa439.1655
- Self WH, Whitney C, Baughman AL, et al. Incidence of pneumococcal pneumonia hospitalizations during the COVID-19 pandemic in Tennessee and Georgia: results from the PNEUMO study. Presented at 12th International Symposium on Pneumococci and Pneumococcal Diseases; Toronto, ON, Canada, June 21, 2022. https://info.kenes.com/flip/isppd22/
- CDC. Active Bacterial Core surveillance (ABCs): methodology. Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/abcs/methodology/index.html
- Ahmed SS, Pondo T, Xing W, et al. Early impact of 13-valent pneumococcal conjugate vaccine use on invasive pneumococcal disease among adults with and without underlying medical conditions—United States. Clin Infect Dis 2020;70:2484–92. https://doi.org/10.1093/cid/ciz739 PMID:31402387
- Gierke R. Current epidemiology of pneumococcal disease, United States—2019 updates. Presented at the Advisory Committee of Immunization Practices meeting, Atlanta, GA, June 25, 2021. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-06/02-Pneumococcal-Gierke-508.pdf
- CDC. ABCs Bact Facts interactive data dashboard [Internet]. Atlanta, GA: US Department of Health and Human Services, CDC; 2023. https://www.cdc.gov/abcs/bact-facts-interactive-dashboard.html
- Isturiz RE, Ramirez J, Self WH, et al. Pneumococcal epidemiology among US adults hospitalized for community-acquired pneumonia. Vaccine 2019;37:3352–61. https://doi.org/10.1016/j.vaccine.2019.04.087 PMID:31072732
- Prasad N, Rhodes J, Deng L, et al. Changes in the incidence of invasive bacterial disease during the COVID-19 pandemic in the United States, 2014–2020. J Infect Dis 2023;227:907–16. https://doi.org/10.1093/infdis/jiad028 PMID:36723871
- Hoehner J, Razzaghi H, Williams WW, et al. Pneumococcal vaccination among U.S. Medicare beneficiaries aged ≥65 years, 2010–2019. Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/vaccines/imz-managers/coverage/adultvaxview/pubs-resources/PCV13-medicare-beneficiaries-2010-2019.html
- Lu PJ, Hung MC, Srivastav A, et al. Surveillance of vaccination coverage among adult populations—United States, 2018. MMWR Surveill Summ 2021;70(No. SS-3):1–26. https://doi.org/10.15585/mmwr.ss7003a1 PMID:33983910
- Ostropolets A, Shoener Dunham L, Johnson KD, Liu J. Pneumococcal vaccination coverage among adults newly diagnosed with underlying medical conditions and regional variation in the U.S. Vaccine 2022;40:4856–63. https://doi.org/10.1016/j.vaccine.2022.06.068 PMID:35803847
- McLaughlin JM, Swerdlow DL, Khan F, et al. Disparities in uptake of 13-valent pneumococcal conjugate vaccine among older adults in the United States. Hum Vaccin Immunother 2019;15:841–9. https://doi.org/10.1080/21645515.2018.1564434 PMID:30676236
- Torres A, Blasi F, Dartois N, Akova M. Which individuals are at increased risk of pneumococcal disease and why? Impact of COPD, asthma, smoking, diabetes, and/or chronic heart disease on community-acquired pneumonia and invasive pneumococcal disease. Thorax 2015;70:984–9. https://doi.org/10.1136/thoraxjnl-2015-206780 PMID:26219979
- Marques Antunes M, Duarte GS, Brito D, et al. Pneumococcal vaccination in adults at very high risk or with established cardiovascular disease: systematic review and meta-analysis. Eur Heart J Qual Care Clin Outcomes 2021;7:97–106. https://doi.org/10.1093/ehjqcco/qcaa030 PMID:32259237
- Inghammar M, Engström G, Kahlmeter G, Ljungberg B, Löfdahl CG, Egesten A. Invasive pneumococcal disease in patients with an underlying pulmonary disorder. Clin Microbiol Infect 2013;19:1148–54. https://doi.org/10.1111/1469-0691.12182 PMID:23464817
- Torén K, Blanc PD, Qvarfordt I, Aspevall O, Schiöler L. Inhaled corticosteroids use and risk of invasive pneumococcal disease in a population-based study. Ann Am Thorac Soc 2020;17:1570–5. https://doi.org/10.1513/AnnalsATS.202004-352OC PMID:32649216
- Ramirez JA, Wiemken TL, Peyrani P, et al.; University of Louisville Pneumonia Study Group. Adults hospitalized with pneumonia in the United States: incidence, epidemiology, and mortality. Clin Infect Dis 2017;65:1806–12. https://doi.org/10.1093/cid/cix647 PMID:29020164
- Bordon J, Slomka M, Gupta R, et al.; University of Louisville Pneumonia Study Group. Hospitalization due to community-acquired pneumonia in patients with chronic obstructive pulmonary disease: incidence, epidemiology and outcomes. Clin Microbiol Infect 2020;26:220–6. https://doi.org/10.1016/j.cmi.2019.06.025 PMID:31254714
- CDC. Prevention of pneumococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP)。 MMWR Recomm Rep 1997;46(No. RR-8):1–24. PMID:9132580
- Talbot TR, Hartert TV, Mitchel E, et al. Asthma as a risk factor for invasive pneumococcal disease. N Engl J Med 2005;352:2082–90. https://doi.org/10.1056/NEJMoa044113 PMID:15901861
- CDC; Advisory Committee on Immunization Practices. Updated recommendations for prevention of invasive pneumococcal disease among adults using the 23-valent pneumococcal polysaccharide vaccine (PPSV23)。 MMWR Morb Mortal Wkly Rep 2010;59:1102–6. PMID:20814406
- Kornum JB, Thomsen RW, Riis A, Lervang HH, Schønheyder HC, Sørensen HT. Diabetes, glycemic control, and risk of hospitalization with pneumonia: a population-based case-control study. Diabetes Care 2008;31:1541–5. https://doi.org/10.2337/dc08-0138 PMID:18487479
- Dowey R, Iqbal A, Heller SR, Sabroe I, Prince LR. A bittersweet response to infection in diabetes; targeting neutrophils to modify inflammation and improve host immunity. Front Immunol 2021;12:678771. https://doi.org/10.3389/fimmu.2021.678771 PMID:34149714
- Peleg AY, Weerarathna T, McCarthy JS, Davis TM. Common infections in diabetes: pathogenesis, management and relationship to glycaemic control. Diabetes Metab Res Rev 2007;23:3–13. https://doi.org/10.1002/dmrr.682 PMID:16960917
- Mehta AJ, Guidot DM. Alcohol abuse, the alveolar macrophage and pneumonia. Am J Med Sci 2012;343:244–7. https://doi.org/10.1097/MAJ.0b013e31823ede77 PMID:22173040
- Siggins RW, Melvan JN, Welsh DA, Bagby GJ, Nelson S, Zhang P. Alcohol suppresses the granulopoietic response to pulmonary Streptococcus pneumoniae infection with enhancement of STAT3 signaling. J Immunol 2011;186:4306–13. https://doi.org/10.4049/jimmunol.1002885 PMID:21357267
- Raasch CE, Zhang P, Siggins RW 2nd, LaMotte LR, Nelson S, Bagby GJ. Acute alcohol intoxication impairs the hematopoietic precursor cell response to pneumococcal pneumonia. Alcohol Clin Exp Res 2010;34:2035–43. https://doi.org/10.1111/j.1530-0277.2010.01291.x PMID:20659065
- Torres A, Peetermans WE, Viegi G, Blasi F. Risk factors for community-acquired pneumonia in adults in Europe: a literature review. Thorax 2013;68:1057–65. https://doi.org/10.1136/thoraxjnl-2013-204282 PMID:24130229
- Samokhvalov AV, Irving HM, Rehm J. Alcohol consumption as a risk factor for pneumonia: a systematic review and meta-analysis. Epidemiol Infect 2010;138:1789–95. https://doi.org/10.1017/S0950268810000774 PMID:20380771
- Shea KM, Edelsberg J, Weycker D, Farkouh RA, Strutton DR, Pelton SI. Rates of pneumococcal disease in adults with chronic medical conditions. Open Forum Infect Dis 2014;1:ofu024. https://doi.org/10.1093/ofid/ofu024 PMID:25734097
- Ekpanyapong S, Reddy KR. Infections in Cirrhosis. Curr Treat Options Gastroenterol 2019;17:254–70. https://doi.org/10.1007/s11938-019-00229-2 PMID:30980335
- Piano S, Brocca A, Mareso S, Angeli P. Infections complicating cirrhosis. Liver Int 2018;38(Suppl 1):126–33. https://doi.org/10.1111/liv.13645 PMID:29427501
- Reefhuis J, Honein MA, Whitney CG, et al. Risk of bacterial meningitis in children with cochlear implants. N Engl J Med 2003;349:435–45. https://doi.org/10.1056/NEJMoa031101 PMID:12890842
- CDC. Pneumococcal vaccination for cochlear implant recipients. MMWR Morb Mortal Wkly Rep 2002;51:931. PMID:12408148
- Biernath KR, Reefhuis J, Whitney CG, et al. Bacterial meningitis among children with cochlear implants beyond 24 months after implantation. Pediatrics 2006;117:284–9. https://doi.org/10.1542/peds.2005-0824 PMID:16390918
- ter Horst L, Brouwer MC, van der Ende A, van de Beek D. Community-acquired bacterial meningitis in adults with cerebrospinal fluid leakage. Clin Infect Dis 2020;70:2256–61. https://doi.org/10.1093/cid/ciz649 PMID:31300817
- ter Horst L, Brouwer MC, van der Ende A, van de Beek D. Recurrent community-acquired bacterial meningitis in adults. Clin Infect Dis 2021;73:e2545–51. https://doi.org/10.1093/cid/ciaa1623 PMID:33751028
- Baxter R, Yee A, Aukes L, et al. Risk of underlying chronic medical conditions for invasive pneumococcal disease in adults. Vaccine 2016;34:4293–7. https://doi.org/10.1016/j.vaccine.2016.07.003 PMID:27396493
- Di Sabatino A, Carsetti R, Corazza GR. Post-splenectomy and hyposplenic states. Lancet 2011;378:86–97. https://doi.org/10.1016/S0140-6736(10)61493-6 PMID:21474172
- Kato S, Chmielewski M, Honda H, et al. Aspects of immune dysfunction in end-stage renal disease. Clin J Am Soc Nephrol 2008;3:1526–33. https://doi.org/10.2215/CJN.00950208 PMID:18701615
- Goonewardene ST, Tang C, Tan LT, et al. Safety and efficacy of pneumococcal vaccination in pediatric nephrotic syndrome. Front Pediatr 2019;7:339. https://doi.org/10.3389/fped.2019.00339 PMID:31456997
- Kidney Disease: Improving Global Outcomes. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl 2013;3:1–150. https://kdigo.org/wp-content/uploads/2017/02/KDIGO_2012_CKD_GL.pdf
- Mahmoodi M, Aghamohammadi A, Rezaei N, et al. Antibody response to pneumococcal capsular polysaccharide vaccination in patients with chronic kidney disease. Eur Cytokine Netw 2009;20:69–74. https://doi.org/10.1684/ecn.2009.0153 PMID:19541592
- Krueger KM, Ison MG, Ghossein C. Practical guide to vaccination in all stages of CKD, including patients treated by dialysis or kidney transplantation. Am J Kidney Dis 2020;75:417–25. https://doi.org/10.1053/j.ajkd.2019.06.014 PMID:31585683
- Mitra S, Stein GE, Bhupalam S, Havlichek DH. Immunogenicity of 13-valent conjugate pneumococcal vaccine in patients 50 years and older with end-stage renal disease and on dialysis. Clin Vaccine Immunol 2016;23:884–7. https://doi.org/10.1128/CVI.00153-16 PMID:27581438
- Shigayeva A, Rudnick W, Green K, et al.; Toronto Invasive Bacterial Diseases Network. Invasive pneumococcal disease among immunocompromised persons: implications for vaccination programs. Clin Infect Dis 2016;62:139–47. https://doi.org/10.1093/cid/civ803 PMID:26354970
- van Aalst M, Lötsch F, Spijker R, et al. Incidence of invasive pneumococcal disease in immunocompromised patients: a systematic review and meta-analysis. Travel Med Infect Dis 2018;24:89–100. https://doi.org/10.1016/j.tmaid.2018.05.016 PMID:29860151
- Papadatou I, Spoulou V. Pneumococcal vaccination in high-risk individuals: are we doing it right? Clin Vaccine Immunol 2016;23:388–95. https://doi.org/10.1128/CVI.00721-15 PMID:27009210
- Pedersen RH, Lohse N, Østergaard L, Søgaard OS. The effectiveness of pneumococcal polysaccharide vaccination in HIV-infected adults: a systematic review. HIV Med 2011;12:323–33. https://doi.org/10.1111/j.1468-1293.2010.00892.x PMID:21059168
- David Morgan M, Richter A, Al-Ali S, et al. Association of low B cell count and IgG levels with infection, and poor vaccine response with all-cause mortality in an immunosuppressed vasculitis population. Arthritis Care Res (Hoboken) 2016;68:853–60. https://doi.org/10.1002/acr.22757 PMID:26474373
- Dendle C, Stuart RL, Mulley WR, Holdsworth SR. Pneumococcal vaccination in adult solid organ transplant recipients: a review of current evidence. Vaccine 2018;36:6253–61. https://doi.org/10.1016/j.vaccine.2018.08.069 PMID:30217523
- Kotton CN, Kroger AT, Freedman DO. Travelers with additional considerations [Chapter 5]. In: CDC Yellow Book 2020. New York, NY: Oxford University Press; 2019.
- Rubin LG, Levin MJ, Ljungman P, et al.; Infectious Diseases Society of America. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis 2014;58:309–18. https://doi.org/10.1093/cid/cit816 PMID:24421306
- Hales C, Burnet L, Coombs M, Collins AM, Ferreira DM. Obesity, leptin and host defence of Streptococcus pneumoniae: the case for more human research. Eur Respir Rev 2022;31:220055. https://doi.org/10.1183/16000617.0055-2022 PMID:36002169
- Frasca D, McElhaney J. Influence of obesity on pneumococcus infection risk in the elderly. Front Endocrinol (Lausanne) 2019;10:71. https://doi.org/10.3389/fendo.2019.00071 PMID:30814978
- Tyrrell G, Lee C, Eurich D. Is there a need for pneumococcal vaccination programs for the homeless to prevent invasive pneumococcal disease? Expert Rev Vaccines 2021;20:1113–21. https://doi.org/10.1080/14760584.2021.1966301 PMID:34365882
- Beall B, Walker H, Tran T, et al. Upsurge of conjugate vaccine serotype 4 invasive pneumococcal disease clusters among adults experiencing homelessness in California, Colorado, and New Mexico. J Infect Dis 2021;223:1241–9. https://doi.org/10.1093/infdis/jiaa501 PMID:32798216
- Mosites E, Zulz T, Bruden D, et al. Risk for invasive streptococcal infections among adults experiencing homelessness, Anchorage, Alaska, USA, 2002–2015. Emerg Infect Dis 2019;25:1911–8. https://doi.org/10.3201/eid2510.181408 PMID:31538562
- Palmer KT, Cosgrove MP. Vaccinating welders against pneumonia. Occup Med (Lond) 2012;62:325–30. https://doi.org/10.1093/occmed/kqs055 PMID:22764269
- Donoghue AM, Wesdock JC. Pneumococcal vaccination for welders: global deployment within a multi-national corporation. Am J Ind Med 2019;62:69–73. https://doi.org/10.1002/ajim.22934 PMID:30536869
- Wong A, Marrie TJ, Garg S, Kellner JD, Tyrrell GJ; SPAT Group. Welders are at increased risk for invasive pneumococcal disease. Int J Infect Dis 2010;14:e796–9. https://doi.org/10.1016/j.ijid.2010.02.2268 PMID:20637673
- Fleming-Dutra K, Mbaeyi C, Link-Gelles R, et al. Streptococcus pneumoniae serotype 15A in psychiatric unit, Rhode Island, USA, 2010–2011. Emerg Infect Dis 2012;18:1889–93. https://doi.org/10.3201/eid1811.120454 PMID:23092658
- Sanchez GV, Bourne CL, Davidson SL, et al. Pneumococcal disease outbreak at a state prison, Alabama, USA, September 1–October 10, 2018. Emerg Infect Dis 2021;27:1949–52. https://doi.org/10.3201/eid2707.203678 PMID:34152958
- Hoge CW, Reichler MR, Dominguez EA, et al. An epidemic of pneumococcal disease in an overcrowded, inadequately ventilated jail. N Engl J Med 1994;331:643–8. https://doi.org/10.1056/NEJM199409083311004 PMID:8052273
- Gleich S, Morad Y, Echague R, et al. Streptococcus pneumoniae serotype 4 outbreak in a home for the aged: report and review of recent outbreaks. Infect Control Hosp Epidemiol 2000;21:711–7. https://doi.org/10.1086/501717 PMID:11089655
- Tan CG, Ostrawski S, Bresnitz EA. A preventable outbreak of pneumococcal pneumonia among unvaccinated nursing home residents in New Jersey during 2001. Infect Control Hosp Epidemiol 2003;24:848–52. https://doi.org/10.1086/502148 PMID:14649774
- Nuorti JP, Butler JC, Crutcher JM, et al. An outbreak of multidrug-resistant pneumococcal pneumonia and bacteremia among unvaccinated nursing home residents. N Engl J Med 1998;338:1861–8. https://doi.org/10.1056/NEJM199806253382601 PMID:9637804
- Amin-Chowdhury Z, Iyanger N, Ramsay ME, Ladhani SN. Outbreaks of severe pneumococcal disease in closed settings in the conjugate vaccines era, 2010–2018: a systematic review to inform national guidance in the UK. J Infect 2019;79:495–502. https://doi.org/10.1016/j.jinf.2019.10.009 PMID:31629865
- Basarab M, Ihekweazu C, George R, Pebody R. Effective management in clusters of pneumococcal disease: a systematic review. Lancet Infect Dis 2011;11:119–30. https://doi.org/10.1016/S1473-3099(10)70281-4 PMID:21272792
- Siegel J, Rhinehart E, Jackson M, Chlarello L; Healthcare Infection Control Practice Advisory Committee. 2007 guideline for isolation precautions: preventing transmission of infectious agents in healthcare settings. Atlanta, GA: US Department of Health and Human Services, CDC; 2007. https://www.cdc.gov/infectioncontrol/guidelines/isolation/index.html
- Jochems SP, Weiser JN, Malley R, Ferreira DM. The immunological mechanisms that control pneumococcal carriage. PLoS Pathog 2017;13:e1006665. https://doi.org/10.1371/journal.ppat.1006665 PMID:29267378
- Collins AM, Wright AD, Mitsi E, et al. First human challenge testing of a pneumococcal vaccine. Double-blind randomized controlled trial. Am J Respir Crit Care Med 2015;192:853–8. https://doi.org/10.1164/rccm.201503-0542OC PMID:26114410
- Tomczyk S, Arriola CS, Beall B, et al. Multistate outbreak of respiratory infections among unaccompanied children, June 2014–July 2014. Clin Infect Dis 2016;63:48–56. https://doi.org/10.1093/cid/ciw147 PMID:27001799
- Pollard AJ, Perrett KP, Beverley PC. Maintaining protection against invasive bacteria with protein-polysaccharide conjugate vaccines. Nat Rev Immunol 2009;9:213–20. https://doi.org/10.1038/nri2494 PMID:19214194
- Durando P, Faust SN, Fletcher M, Krizova P, Torres A, Welte T. Experience with pneumococcal polysaccharide conjugate vaccine (conjugated to CRM197 carrier protein) in children and adults. Clin Microbiol Infect 2013;19(Suppl 1):1–9. https://doi.org/10.1111/1469-0691.12320 PMID:24083785
- Kelly DF, Snape MD, Clutterbuck EA, et al. CRM197-conjugated serogroup C meningococcal capsular polysaccharide, but not the native polysaccharide, induces persistent antigen-specific memory B cells. Blood 2006;108:2642–7. Erratum in: Blood 2007;109:1849. https://doi.org/10.1182/blood-2006-01-009282 PMID:16675705
- Vaxneuvance [Package Insert]. Rahway, NJ: Merck; 2022.
- 佩儿20 [Package Insert]. New York, NY: Pfizer; 2021.
- 佩儿13 [Package Insert.] New York, NY: Pfizer; 2017.
- Cook IF, Pond D, Hartel G. Comparative reactogenicity and immunogenicity of 23 valent pneumococcal vaccine administered by intramuscular or subcutaneous injection in elderly adults. Vaccine 2007;25:4767–74. https://doi.org/10.1016/j.vaccine.2007.04.017 PMID:17512098
- Pneumovax23 [Package Insert.] Rahway, NJ: Merck; 2020.
- Falkenhorst G, Remschmidt C, Harder T, Hummers-Pradier E, Wichmann O, Bogdan C. Effectiveness of the 23-valent pneumococcal polysaccharide vaccine (PPV23) against pneumococcal disease in the elderly: systematic review and meta-analysis. PLoS One 2017;12:e0169368. https://doi.org/10.1371/journal.pone.0169368 PMID:28061505
- Alfageme I, Vazquez R, Reyes N, et al. Clinical efficacy of anti-pneumococcal vaccination in patients with COPD. Thorax 2006;61:189–95. https://doi.org/10.1136/thx.2005.043323 PMID:16227328
- Honkanen PO, Keistinen T, Miettinen L, et al. Incremental effectiveness of pneumococcal vaccine on simultaneously administered influenza vaccine in preventing pneumonia and pneumococcal pneumonia among persons aged 65 years or older. Vaccine 1999;17:2493–500. https://doi.org/10.1016/S0264-410X(99)00069-9 PMID:10418894
- Maruyama T, Taguchi O, Niederman MS, et al. Efficacy of 23-valent pneumococcal vaccine in preventing pneumonia and improving survival in nursing home residents: double blind, randomised and placebo controlled trial. BMJ 2010;340:c1004. https://doi.org/10.1136/bmj.c1004 PMID:20211953
- Ortqvist A, Henckaerts I, Hedlund J, Poolman J. Non-response to specific serotypes likely cause for failure to 23-valent pneumococcal polysaccharide vaccine in the elderly. Vaccine 2007;25:2445–50. https://doi.org/10.1016/j.vaccine.2006.09.018 PMID:17052816
- Farrar JL, Childs L, Ouattara M, et al. Systematic review and meta-analysis of the efficacy and effectiveness of pneumococcal vaccines in adults. Pathogens 2023;12:732. https://doi.org/10.1101/2022.10.06.22280772 PMID:37242402
- Kim JH, Chun BC, Song JY, et al. Direct effectiveness of pneumococcal polysaccharide vaccine against invasive pneumococcal disease and non-bacteremic pneumococcal pneumonia in elderly population in the era of pneumococcal conjugate vaccine: a case-control study. Vaccine 2019;37:2797–804. https://doi.org/10.1016/j.vaccine.2019.04.017 PMID:31005428
- Heo JY, Seo YB, Choi WS, et al. Effectiveness of pneumococcal vaccination against pneumococcal pneumonia hospitalization in older adults: a prospective, test-negative study. J Infect Dis 2022;225:836–45. https://doi.org/10.1093/infdis/jiab474 PMID:34537847
- Ochoa-Gondar O, Vila-Corcoles A, Rodriguez-Blanco T, et al. Effectiveness of the 23-valent pneumococcal polysaccharide vaccine against community-acquired pneumonia in the general population aged ≥60 years: 3 years of follow-up in the CAPAMIS study. Clin Infect Dis 2014;58:909–17. https://doi.org/10.1093/cid/ciu002 PMID:24532544
- Vila-Corcoles A, Salsench E, Rodriguez-Blanco T, et al. Clinical effectiveness of 23-valent pneumococcal polysaccharide vaccine against pneumonia in middle-aged and older adults: a matched case-control study. Vaccine 2009;27:1504–10. https://doi.org/10.1016/j.vaccine.2009.01.013 PMID:19171174
- French N, Nakiyingi J, Carpenter LM, et al. 23-valent pneumococcal polysaccharide vaccine in HIV-1-infected Ugandan adults: double-blind, randomised and placebo controlled trial. Lancet 2000;355:2106–11. https://doi.org/10.1016/S0140-6736(00)02377-1 PMID:10902624
- Breiman RF, Keller DW, Phelan MA, et al. Evaluation of effectiveness of the 23-valent pneumococcal capsular polysaccharide vaccine for HIV-infected patients. Arch Intern Med 2000;160:2633–8. https://doi.org/10.1001/archinte.160.17.2633 PMID:10999977
- Hung C-C, Chen M-Y, Hsieh S-M, Hsiao C-F, Sheng W-H, Chang S-C. Clinical experience of the 23-valent capsular polysaccharide pneumococcal vaccination in HIV-1-infected patients receiving highly active antiretroviral therapy: a prospective observational study. Vaccine 2004;22:2006–12. https://doi.org/10.1016/j.vaccine.2003.10.030 PMID:15121313
- Grau I, Pallares R, Tubau F, et al.; Spanish Pneumococcal Infection Study Network (G03/103)。 Epidemiologic changes in bacteremic pneumococcal disease in patients with human immunodeficiency virus in the era of highly active antiretroviral therapy. Arch Intern Med 2005;165:1533–40. https://doi.org/10.1001/archinte.165.13.1533 PMID:16009870
- Barry PM, Zetola N, Keruly JC, Moore RD, Gebo KA, Lucas GM. Invasive pneumococcal disease in a cohort of HIV-infected adults: incidence and risk factors, 1990–2003. AIDS 2006;20:437–44. https://doi.org/10.1097/01.aids.0000206507.54901.84 PMID:16439878
- Veras MA, Enanoria WT, Castilho EA, Reingold AL. Effectiveness of the polysaccharide pneumococcal vaccine among HIV-infected persons in Brazil: a case control study. BMC Infect Dis 2007;7:119. https://doi.org/10.1186/1471-2334-7-119 PMID:17956620
- Andrews NJ, Waight PA, George RC, Slack MP, Miller E. Impact and effectiveness of 23-valent pneumococcal polysaccharide vaccine against invasive pneumococcal disease in the elderly in England and Wales. Vaccine 2012;30:6802–8. https://doi.org/10.1016/j.vaccine.2012.09.019 PMID:23000122
- Djennad A, Ramsay ME, Pebody R, et al. Effectiveness of 23-valent polysaccharide pneumococcal vaccine and changes in invasive pneumococcal disease incidence from 2000 to 2017 in those aged 65 and over in England and Wales. EClinicalMedicine 2019;6:42–50. https://doi.org/10.1016/j.eclinm.2018.12.007 PMID:31193709
- Rudnick W, Liu Z, Shigayeva A, et al.; Toronto Invasive Bacterial Diseases Network. Pneumococcal vaccination programs and the burden of invasive pneumococcal disease in Ontario, Canada, 1995–2011. Vaccine 2013;31:5863–71. https://doi.org/10.1016/j.vaccine.2013.09.049 PMID:24099873
- Suzuki M, Dhoubhadel BG, Ishifuji T, et al.; Adult Pneumonia Study Group-Japan (APSG-J)。 Serotype-specific effectiveness of 23-valent pneumococcal polysaccharide vaccine against pneumococcal pneumonia in adults aged 65 years or older: a multicentre, prospective, test-negative design study. Lancet Infect Dis 2017;17:313–21. https://doi.org/10.1016/S1473-3099(17)30049-X PMID:28126327
- Kolditz M, Schmitt J, Pletz MW, Tesch F. Impact of pneumococcal polysaccharide vaccine on incidence and mortality after pneumonia in adults aged ≥60 years—a population-based retrospective cohort study. Clin Microbiol Infect 2018;24:500–4. https://doi.org/10.1016/j.cmi.2017.08.010 PMID:28830805
- O’Brien KL, Hochman M, Goldblatt D. Combined schedules of pneumococcal conjugate and polysaccharide vaccines: is hyporesponsiveness an issue? Lancet Infect Dis 2007;7:597–606. https://doi.org/10.1016/S1473-3099(07)70210-4 PMID:17714673
- Remschmidt C, Harder T, Wichmann O, Bogdan C, Falkenhorst G. Effectiveness, immunogenicity and safety of 23-valent pneumococcal polysaccharide vaccine revaccinations in the elderly: a systematic review. BMC Infect Dis 2016;16:711. https://doi.org/10.1186/s12879-016-2040-y PMID:27887596
- Cripps AW, Folaranmi T, Johnson KD, Musey L, Niederman MS, Buchwald UK. Immunogenicity following revaccination or sequential vaccination with 23-valent pneumococcal polysaccharide vaccine (PPSV23) in older adults and those at increased risk of pneumococcal disease: a review of the literature. Expert Rev Vaccines 2021;20:257–67. https://doi.org/10.1080/14760584.2021.1889374 PMID:33567914
- Miller ER, Moro PL, Cano M, Lewis P, Bryant-Genevier M, Shimabukuro TT. Post-licensure safety surveillance of 23-valent pneumococcal polysaccharide vaccine in the Vaccine Adverse Event Reporting System (VAERS), 1990–2013. Vaccine 2016;34:2841–6. https://doi.org/10.1016/j.vaccine.2016.04.021 PMID:27087150
- McNeil MM, Weintraub ES, Duffy J, et al. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol 2016;137:868–78. https://doi.org/10.1016/j.jaci.2015.07.048 PMID:26452420
- Lewis N, Hsiao A, Hansen J, et al. Effectiveness of 13-valent pneumococcal conjugate vaccine against invasive pneumococcal disease in older adults. Open Forum Infect Dis 2019;6(Suppl 2):S953–4. https://doi.org/10.1093/ofid/ofz360.2388
- Pilishvili T, Almendares O, Xing W, et al. Effectiveness of pneumococcal vaccines against invasive pneumococcal disease (IPD) among adults ≥65 years old in the United States. Presented at the International Symposium on Pneumococci and Pneumococcal Diseases, Melbourne, Australia, April 15–19, 2018.
- Pilishvili T, Almendares OM, Nanduri S, et al. Evaluation of pneumococcal vaccine effectiveness against invasive pneumococcal disease among US Medicare beneficiaries ≥65 years old. Open Forum Infect Dis 2018;5(Suppl 1):S10–1. https://doi.org/10.1093/ofid/ofy209.021
- McLaughlin JM, Jiang Q, Isturiz RE, et al. Effectiveness of 13-valent pneumococcal conjugate vaccine against hospitalization for community-acquired pneumonia in older US adults: a test-negative design. Clin Infect Dis 2018;67:1498–506. https://doi.org/10.1093/cid/ciy312 PMID:29790925
- Prato R, Fortunato F, Cappelli MG, Chironna M, Martinelli D. Effectiveness of the 13-valent pneumococcal conjugate vaccine against adult pneumonia in Italy: a case-control study in a 2-year prospective cohort. BMJ Open 2018;8:e019034. https://doi.org/10.1136/bmjopen-2017-019034 PMID:29581200
- Vila-Corcoles A, Ochoa-Gondar O, de Diego C, et al. Evaluating clinical effectiveness of 13-valent pneumococcal conjugate vaccination against pneumonia among middle-aged and older adults in Catalonia: results from the EPIVAC cohort study. BMC Infect Dis 2018;18:196. https://doi.org/10.1186/s12879-018-3096-7 PMID:29699550
- Lewnard JA, Bruxvoort KJ, Fischer H, et al. Effectiveness of 13-valent pneumococcal conjugate vaccine against medically attended lower respiratory tract infection and pneumonia among older adults. Clin Infect Dis 2022;75:832–41. https://doi.org/10.1093/cid/ciab1051 PMID:34967907
- Kobayashi M, Spiller MW, Wu X, et al. Association of pneumococcal conjugate vaccine use with hospitalized pneumonia in Medicare beneficiaries 65 years or older with and without medical conditions, 2014 to 2017. JAMA Intern Med 2023;183:40–7. https://doi.org/10.1001/jamainternmed.2022.5472 PMID:36469350
- Kolditz M, Schmitt J, Pletz MW, Tesch F. Impact of the 13-valent pneumococcal conjugate vaccine on the incidence of all-cause pneumonia in adults aged ≥60 years: a population-based, retrospective cohort study. Clin Infect Dis 2019;68:2117–9. https://doi.org/10.1093/cid/ciy993 PMID:30462172
- Hsiao A, Hansen J, Timbol J, et al. Incidence and estimated vaccine effectiveness against hospitalizations for all-cause pneumonia among older US adults who were vaccinated and not vaccinated with 13-valent pneumococcal conjugate vaccine. JAMA Netw Open 2022;5:e221111. https://doi.org/10.1001/jamanetworkopen.2022.1111 PMID:35302634
- Gessner BD, Jiang Q, Van Werkhoven CH, et al. A public health evaluation of 13-valent pneumococcal conjugate vaccine impact on adult disease outcomes from a randomized clinical trial in the Netherlands. Vaccine 2019;37:5777–87. https://doi.org/10.1016/j.vaccine.2018.05.097 PMID:29861177
- Suaya JA, Jiang Q, Scott DA, et al. Post hoc analysis of the efficacy of the 13-valent pneumococcal conjugate vaccine against vaccine-type community-acquired pneumonia in at-risk older adults. Vaccine 2018;36:1477–83. https://doi.org/10.1016/j.vaccine.2018.01.049 PMID:29429807
- Patterson S, Webber C, Patton M, et al. A post hoc assessment of duration of protection in CAPiTA (Community Acquired Pneumonia immunization Trial in Adults)。 Trials Vaccinol 2016;5:92–6. https://doi.org/10.1016/j.trivac.2016.04.004
- Haber P, Arana J, Pilishvili T, Lewis P, Moro PL, Cano M. Post-licensure surveillance of 13-valent pneumococcal conjugate vaccine (PCV13) in adults aged ≥19 years old in the United States, Vaccine Adverse Event Reporting System (VAERS), June 1, 2012–December 31, 2015. Vaccine 2016;34:6330–4. https://doi.org/10.1016/j.vaccine.2016.10.052 PMID:27836437
- Tseng HF, Sy LS, Qian L, et al. Pneumococcal conjugate vaccine safety in elderly adults. Open Forum Infect Dis 2018;5:ofy100. https://doi.org/10.1093/ofid/ofy100 PMID:29977960
- Ermlich SJ, Andrews CP, Folkerth S, et al. Safety and immunogenicity of 15-valent pneumococcal conjugate vaccine in pneumococcal vaccine–naïve adults ≥50 years of age. Vaccine 2018;36:6875–82. https://doi.org/10.1016/j.vaccine.2018.03.012 PMID:29559167
- Platt HL, Cardona JF, Haranaka M, et al. A phase 3 trial of safety, tolerability, and immunogenicity of V114, 15-valent pneumococcal conjugate vaccine, compared with 13-valent pneumococcal conjugate vaccine in adults 50 years of age and older (PNEU-AGE)。 Vaccine 2022;40:162–72. https://doi.org/10.1016/j.vaccine.2021.08.049 PMID:34507861
- Said MA, O’Brien KL, Nuorti JP, Singleton R, Whitney CG, Hennessy TW. The epidemiologic evidence underlying recommendations for use of pneumococcal polysaccharide vaccine among American Indian and Alaska Native populations. Vaccine 2011;29:5355–62. https://doi.org/10.1016/j.vaccine.2011.05.086 PMID:21664217
- Hammitt LL, Quinn D, Janczewska E, et al. Immunogenicity, safety, and tolerability of V114, a 15-valent pneumococcal conjugate vaccine, in immunocompetent adults aged 18–49 years with or without risk factors for pneumococcal disease: a randomized phase 3 trial (PNEU-DAY)。 Open Forum Infect Dis 2021;9:ofab605. https://doi.org/10.1093/ofid/ofab605 PMID:35146039
- Mohapi L, Pinedo Y, Osiyemi O, et al.; V114–018 (PNEU-WAY) Study Group. Safety and immunogenicity of V114, a 15-valent pneumococcal conjugate vaccine, in adults living with HIV. AIDS 2022;36:373–82. https://doi.org/10.1097/QAD.0000000000003126 PMID:34750291
- Song JY, Chang CJ, Andrews C, et al.; V114–016 (PNEU-PATH) Study Group. Safety, tolerability, and immunogenicity of V114, a 15-valent pneumococcal conjugate vaccine, followed by sequential PPSV23 vaccination in healthy adults aged ≥50 years: a randomized phase III trial (PNEU-PATH)。 Vaccine 2021;39:6422–36. https://doi.org/10.1016/j.vaccine.2021.08.038 PMID:34489128
- Peterson JT, Stacey HL, MacNair JE, et al. Safety and immunogenicity of 15-valent pneumococcal conjugate vaccine compared to 13-valent pneumococcal conjugate vaccine in adults ≥65 years of age previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. Hum Vaccin Immunother 2019;15:540–8. https://doi.org/10.1080/21645515.2018.1532250 PMID:30427749
- Food and Drug Administration. July 16, 2021 summary basis for regulatory action (Vaxneuvance)。 Silver Spring, MD: US Department of Health and Human Services, Food and Drug Administration; 2021. https://www.fda.gov/media/151201/download
- Essink B, Sabharwal C, Cannon K, et al. Pivotal phase 3 randomized clinical trial of the safety, tolerability, and immunogenicity of 20-valent pneumococcal conjugate vaccine in adults aged ≥18 years. Clin Infect Dis 2022;75:390–8. https://doi.org/10.1093/cid/ciab990 PMID:34940806
- Klein NP, Peyrani P, Yacisin K, et al. A phase 3, randomized, double-blind study to evaluate the immunogenicity and safety of 3 lots of 20-valent pneumococcal conjugate vaccine in pneumococcal vaccine–naive adults 18 through 49 years of age. Vaccine 2021;39:5428–35. https://doi.org/10.1016/j.vaccine.2021.07.004 PMID:34315611
- Hurley D, Griffin C, Young M Jr, et al. Safety, tolerability, and immunogenicity of a 20-valent pneumococcal conjugate vaccine (PCV20) in adults 60 to 64 years of age. Clin Infect Dis 2021;73:e1489–97. https://doi.org/10.1093/cid/ciaa1045 PMID:32716500
- Cannon K, Elder C, Young M, et al. A trial to evaluate the safety and immunogenicity of a 20-valent pneumococcal conjugate vaccine in populations of adults ≥65 years of age with different prior pneumococcal vaccination. Vaccine 2021;39:7494–502. https://doi.org/10.1016/j.vaccine.2021.10.032 PMID:34839993
- Safety and immunogenicity of 20vPnC coadministered with SIIV in adults ≥65 years of age. https://clinicaltrials.gov/study/NCT04526574
- Kobayashi M. Evidence to recommendations framework: PCV20 use among adults who previously received PCV13. Presented at the Advisory Committee on Immunization Practices meeting, Atlanta, GA, October 19, 2022. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2022-10-19-20/03-Pneumococcal-Kobayashi-508.pdf
- Food and Drug Administration. June 8, 2021 summary basis for regulatory action (佩儿20)。 Silver Spring, MD: US Department of Health and Human Services, Food and Drug Administration; 2021. https://www.fda.gov/media/150388/download
- Greenberg RN, Gurtman A, Frenck RW, et al. Sequential administration of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine in pneumococcal vaccine–naïve adults 60–64 years of age. Vaccine 2014;32:2364–74. https://doi.org/10.1016/j.vaccine.2014.02.002 PMID:24606865
- Juergens C, de Villiers PJ, Moodley K, et al. Safety and immunogenicity of 13-valent pneumococcal conjugate vaccine formulations with and without aluminum phosphate and comparison of the formulation of choice with 23-valent pneumococcal polysaccharide vaccine in elderly adults: a randomized open-label trial. Hum Vaccin Immunother 2014;10:1343–53. https://doi.org/10.4161/hv.27998 PMID:24576885
- Jackson LA, Gurtman A, van Cleeff M, et al. Influence of initial vaccination with 13-valent pneumococcal conjugate vaccine or 23-valent pneumococcal polysaccharide vaccine on anti-pneumococcal responses following subsequent pneumococcal vaccination in adults 50 years and older. Vaccine 2013;31:3594–602. https://doi.org/10.1016/j.vaccine.2013.04.084 PMID:23688525
- Frenck RW Jr, Fiquet A, Gurtman A, et al.; B1851020 Study Group. Immunogenicity and safety of a second administration of 13-valent pneumococcal conjugate vaccine 5 years after initial vaccination in adults 50 years and older. Vaccine 2016;34:3454–62. https://doi.org/10.1016/j.vaccine.2016.04.093 PMID:27155493
- Jackson LA, Gurtman A, Rice K, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in adults 70 years of age and older previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. Vaccine 2013;31:3585–93. https://doi.org/10.1016/j.vaccine.2013.05.010 PMID:23688527
- Pfizer. B7471004—Post hoc analysis by vaccination history. New York, NY: Pfizer; 2022.
- Glesby MJ, Watson W, Brinson C, et al. Immunogenicity and safety of 13-valent pneumococcal conjugate vaccine in HIV-infected adults previously vaccinated with pneumococcal polysaccharide vaccine. J Infect Dis 2015;212:18–27. https://doi.org/10.1093/infdis/jiu631 PMID:25395187
- Bhorat AE, Madhi SA, Laudat F, et al. Immunogenicity and safety of the 13-valent pneumococcal conjugate vaccine in HIV-infected individuals naive to pneumococcal vaccination. AIDS 2015;29:1345–54. https://doi.org/10.1097/QAD.0000000000000689 PMID:25888646
- Hammarström V, Pauksen K, Azinge J, Oberg G, Ljungman P. Pneumococcal immunity and response to immunization with pneumococcal vaccine in bone marrow transplant patients: the influence of graft versus host reaction. Support Care Cancer 1993;1:195–9. https://doi.org/10.1007/BF00366446 PMID:8193881
- Tomblyn M, Chiller T, Einsele H, et al. Guidelines for preventing infectious complications among hematopoietic cell transplant recipients: a global perspective. Preface. Bone Marrow Transplant 2009;44:453–5. https://doi.org/10.1038/bmt.2009.254 PMID:19861977
- Cordonnier C, Labopin M, Chesnel V, et al. Immune response to the 23-valent polysaccharide pneumococcal vaccine after the 7-valent conjugate vaccine in allogeneic stem cell transplant recipients: results from the EBMT IDWP01 trial. Vaccine 2010;28:2730–4. https://doi.org/10.1016/j.vaccine.2010.01.025 PMID:20117269
- Merck. A study to evaluate the safety, tolerability, and immunogenicity of V114 in allogeneic hematopoietic stem cell transplant recipients (V114–022/PNEU-STEM)。 Rahway, NJ: Merck; 2018. https://clinicaltrials.gov/study/NCT03565900
- Merck. Merck data on file, P022 clinical study report table 14.2–6 summary of IgG antibody responses at month 12 and month 13 after allo-HSCT. Rahway, NJ: Merck; 2022.
- Merck. Merck data on file, P022 clinical study report table 14.2–7 summary of OPA antibody responses at month 12 and month 13 after allo-HSCT. Rahway, NJ: Merck; 2022.
- Langedijk AC, van Aalst M, Meek B, et al. Long-term pneumococcal vaccine immunogenicity following allogeneic hematopoietic stem cell transplantation. Vaccine 2019;37:510–5. https://doi.org/10.1016/j.vaccine.2018.11.053 PMID:30502071
- Cordonnier C, Labopin M, Chesnel V, et al.; Infectious Diseases Working Party of the European Group for Blood and Marrow Transplantation. Randomized study of early versus late immunization with pneumococcal conjugate vaccine after allogeneic stem cell transplantation. Clin Infect Dis 2009;48:1392–401. https://doi.org/10.1086/598324 PMID:19368505
- Garcia Garrido HM, Haggenburg S, Schoordijk MCE, et al. Immunogenicity of a 5-dose pneumococcal vaccination schedule following allogeneic hematopoietic stem cell transplantation. Am J Hematol 2022;97:592–602. https://doi.org/10.1002/ajh.26493 PMID:35147238
- Cordonnier C, Ljungman P, Juergens C, et al.; 3003 Study Group. Immunogenicity, safety, and tolerability of 13-valent pneumococcal conjugate vaccine followed by 23-valent pneumococcal polysaccharide vaccine in recipients of allogeneic hematopoietic stem cell transplant aged ≥2 years: an open-label study. Clin Infect Dis 2015;61:313–23. https://doi.org/10.1093/cid/civ287 PMID:25870329
- Buchwald UK, Andrews CP, Ervin J, et al.; V110–029 Study Group. Sequential administration of 佩儿 13™ and PNEUMOVAX™ 23 in healthy participants 50 years of age and older. Hum Vaccin Immunother 2021;17:2678–90. https://doi.org/10.1080/21645515.2021.1888621 PMID:34019468
- Nguyen MTT, Lindegaard H, Hendricks O, Jørgensen CS, Kantsø B, Friis-Møller N. Initial serological response after prime-boost pneumococcal vaccination in rheumatoid arthritis patients: results of a randomized controlled trial. J Rheumatol 2017;44:1794–803. https://doi.org/10.3899/jrheum.161407 PMID:28966211
- Miernyk KM, Butler JC, Bulkow LR, et al. Immunogenicity and reactogenicity of pneumococcal polysaccharide and conjugate vaccines in Alaska Native adults 55–70 years of age. Clin Infect Dis 2009;49:241–8. https://doi.org/10.1086/599824 PMID:19522655
- Severance R, Schwartz H, Dagan R, et al. Safety, tolerability, and immunogenicity of V114, a 15-valent pneumococcal conjugate vaccine, administered concomitantly with influenza vaccine in healthy adults aged ≥50 years: a randomized phase 3 trial (PNEU-FLU)。 Hum Vaccin Immunother 2022;18:1–14. https://doi.org/10.1080/21645515.2021.1976581 PMID:34726574
- Ofori-Anyinam O, Leroux-Roels G, Drame M, et al. Immunogenicity and safety of an inactivated quadrivalent influenza vaccine co-administered with a 23-valent pneumococcal polysaccharide vaccine versus separate administration, in adults ≥50 years of age: results from a phase III, randomized, non-inferiority trial. Vaccine 2017;35:6321–8. https://doi.org/10.1016/j.vaccine.2017.09.012 PMID:28987445
- Safety and immunogenicity study of 20vPnC when coadministered with a booster dose of BNT162b2. https://clinicaltrials.gov/study/NCT04887948
- Safety, tolerability, and immunogenicity of V110 or V114 co-administered with a booster dose of mRNA-1273 in healthy adults (V110–911)。 https://clinicaltrials.gov/study/NCT05158140
- Maréchal C, Lal H, Poder A, et al. Immunogenicity and safety of the adjuvanted recombinant zoster vaccine co-administered with the 23-valent pneumococcal polysaccharide vaccine in adults ≥50 years of age: a randomized trial. Vaccine 2018;36:4278–86. Erratum in: Vaccine 2019;37:1252–3. https://doi.org/10.1016/j.vaccine.2018.05.110 PMID:29903674
- Leidner A. Summary of three economic models assessing pneumococcal vaccines in US adults. Presented at the Advisory Committee for Immunization Practices meeting. Atlanta, GA, September 29, 2021.
- Smith KJ, Wateska AR, Nowalk MP, et al. Cost-effectiveness of newly recommended pneumococcal vaccination strategies in older underserved minority adults in the USA. Infect Dis Ther 2022;11:1683–93. https://doi.org/10.1007/s40121-022-00669-x PMID:35831685
- Smith KJ, Wateska AR, Nowalk MP, et al. Higher-valency pneumococcal conjugate vaccines: an exploratory cost-effectiveness analysis in U.S. seniors. Am J Prev Med 2021;61:28–36. https://doi.org/10.1016/j.amepre.2021.01.023 PMID:34148625
- Pelton SI, Bornheimer R, Doroff R, Shea KM, Sato R, Weycker D. Decline in pneumococcal disease attenuated in older adults and those with comorbidities following universal childhood PCV13 immunization. Clin Infect Dis 2019;68:1831–8. https://doi.org/10.1093/cid/ciy800 PMID:30239637
- Deb A, Mohanty S, Ou W, Rajagopalan S, Johnson KD. Pneumococcal vaccination coverage among adults aged 19 to 64 years with immuno-compromising conditions, cerebrospinal fluid (CSF) leaks, or cochlear implants in the US. Expert Rev Vaccines 2021;20:331–45. https://doi.org/10.1080/14760584.2021.1898377 PMID:33724134
- CDC. Evidence to recommendations for PCV15 use among adults 19–64 years old. Atlanta, GA: US Department of Health and Human Services, CDC; 2022. https://www.cdc.gov/vaccines/acip/recs/grade/pneumo-PCV15-PPSV23-risk-based-etr.html
- CDC. Evidence to recommendations for PCV20 use among adults 19–64 years old. Atlanta, GA: US Department of Health and Human Services, CDC; 2022. https://www.cdc.gov/vaccines/acip/recs/grade/pneumo-PCV20-risk-based-etr.html
- Kroger A, Bahta L, Long S, Sanchez P. Timing and spacing of immunobiologics. Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/timing.html
- CDC. Interim clinical considerations for use of COVID-19 vaccines currently approved or authorized in the United States. Atlanta, GA: US Department of Health and Human Services, CDC; 2022. https://www.cdc.gov/vaccines/covid-19/clinical-considerations/interim-considerations-us.html#timing-spacing-interchangeability
- Kroger A, Bahta L, Hunter P. Contraindications and precautions. Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/contraindications.html
- Duarte G, Muresan P, Ward S, et al. Immunogenicity of conjugated and polysaccharide pneumococcal vaccines administered during pregnancy or postpartum to women with HIV. J Infect Dis 2022;225:1021–31. https://doi.org/10.1093/infdis/jiab567 PMID:34791324
- Quiambao BP, Nohynek HM, Käyhty H, et al. Immunogenicity and reactogenicity of 23-valent pneumococcal polysaccharide vaccine among pregnant Filipino women and placental transfer of antibodies. Vaccine 2007;25:4470–7. https://doi.org/10.1016/j.vaccine.2007.03.021 PMID:17442467
- Lehmann D, Pomat WS, Combs B, Dyke T, Alpers MP. Maternal immunization with pneumococcal polysaccharide vaccine in the highlands of Papua New Guinea. Vaccine 2002;20:1837–45. https://doi.org/10.1016/S0264-410X(02)00040-3 PMID:11906773
- McHugh L, Binks M, Ware RS, et al. Birth outcomes in Aboriginal mother-infant pairs from the Northern Territory, Australia, who received 23-valent polysaccharide pneumococcal vaccination during pregnancy, 2006–2011: the PneuMum randomised controlled trial. Aust N Z J Obstet Gynaecol 2020;60:82–7. https://doi.org/10.1111/ajo.13002 PMID:31198999
- Weinberg A, Muresan P, Laimon L, et al.; NICHD P1091 Study Team. Safety, immunogenicity, and transplacental antibody transport of conjugated and polysaccharide pneumococcal vaccines administered to pregnant women with HIV: a multicentre randomised controlled trial. Lancet HIV 2021;8:e408–19. https://doi.org/10.1016/S2352-3018(20)30339-8 PMID:33915104
- Quiambao BP, Nohynek H, Käyhty H, et al. Maternal immunization with pneumococcal polysaccharide vaccine in the Philippines. Vaccine 2003;21:3451–4. https://doi.org/10.1016/S0264-410X(03)00349-9 PMID:12850358
- Mussi-Pinhata MM, Ward S, Laimon L, et al. Effect of maternal immunization with 10-valent pneumococcus conjugate vaccine (PCV-10), 23-valent pneumococcus polysaccharide vaccine, or placebo on the immunogenicity of PCV-10 in human immunodeficiency virus-exposed uninfected infants: a randomized clinical trial. Clin Infect Dis 2022;75:996–1005. https://doi.org/10.1093/cid/ciac026 PMID:35037049
- Obaro SK, Deubzer HE, Newman VO, Adegbola RA, Greenwood BM, Henderson DC. Serotype-specific pneumococcal antibodies in breast milk of Gambian women immunized with a pneumococcal polysaccharide vaccine during pregnancy. Pediatr Infect Dis J 2004;23:1023–9. https://doi.org/10.1097/01.inf.0000143651.54880.09 PMID:15545857
- O’Dempsey TJ, McArdle T, Ceesay SJ, et al. Immunization with a pneumococcal capsular polysaccharide vaccine during pregnancy. Vaccine 1996;14:963–70. https://doi.org/10.1016/0264-410X(96)00009-6 PMID:8873389
- Zaman K, Roy E, Arifeen SE, et al. Effectiveness of maternal influenza immunization in mothers and infants. N Engl J Med 2008;359:1555–64. Erratum in: N Engl J Med 2009;360:648. https://doi.org/10.1056/NEJMoa0708630 PMID:18799552
- Lopes CR, Berezin EN, Ching TH, Canuto JS, Costa VO, Klering EM. Ineffectiveness for infants of immunization of mothers with pneumococcal capsular polysaccharide vaccine during pregnancy. Braz J Infect Dis 2009;13:104–6. https://doi.org/10.1590/S1413-86702009000200006 PMID:20140352
- Shahid NS, Steinhoff MC, Hoque SS, Begum T, Thompson C, Siber GR. Serum, breast milk, and infant antibody after maternal immunisation with pneumococcal vaccine. Lancet 1995;346:1252–7. https://doi.org/10.1016/S0140-6736(95)91861-2 PMID:7475716
- Munoz FM, Englund JA, Cheesman CC, et al. Maternal immunization with pneumococcal polysaccharide vaccine in the third trimester of gestation. Vaccine 2001;20:826–37. https://doi.org/10.1016/S0264-410X(01)00397-8 PMID:11738746
- Almeida VC, Mussi-Pinhata MM, De Souza CB, et al. Immunogenicity of 23-valent pneumococcal polysaccharide vaccine in HIV-infected pregnant women and kinetics of passively acquired antibodies in young infants. Vaccine 2009;27:3856–61. https://doi.org/10.1016/j.vaccine.2009.04.018 PMID:19443091
- Binks MJ, Moberley SA, Balloch A, et al. PneuMum: impact from a randomised controlled trial of maternal 23-valent pneumococcal polysaccharide vaccination on middle ear disease amongst Indigenous infants, Northern Territory, Australia. Vaccine 2015;33:6579–87. https://doi.org/10.1016/j.vaccine.2015.10.101 PMID:26529076
- National Institute for Allergy and Infectious Diseases. Division of AIDS (DAIDS) table for grading the severity of adult and pediatric adverse events. Version 2.0. Bethesda, MD: US Department of Health and Human Services, National Institutes of Health, National Institute for Allergy and Infectious Diseases; 2014. https://rsc.niaid.nih.gov/sites/default/files/daids-ae-grading-table-v2-nov2014.pdf
- Kobayashi M, Farrar JL, Gierke R, et al.; ACIP Pneumococcal Vaccines Work Group; CDC Contributors. Use of 15-valent pneumococcal conjugate vaccine among U.S. children: updated recommendations of the Advisory Committee on Immunization Practices—United States, 2022. MMWR Morb Mortal Wkly Rep 2022;71:1174–81. https://doi.org/10.15585/mmwr.mm7137a3 PMID:36107786
- CDC. Advisory Committee on Immunization Practices (ACIP)。 Atlanta, GA: US Department of Health and Human Services, CDC; 2023. https://www.cdc.gov/vaccines/acip/recommendations.html
- Chichili GR, Smulders R, Santos V, et al. Phase 1/2 study of a novel 24-valent pneumococcal vaccine in healthy adults aged 18 to 64 years and in older adults aged 65 to 85 years. Vaccine 2022;40:4190–8. https://doi.org/10.1016/j.vaccine.2022.05.079 PMID:35690500
- Platt H, Omole T, Cardona J, et al. Safety, tolerability, and immunogenicity of a 21-valent pneumococcal conjugate vaccine, V116, in healthy adults: phase 1/2, randomised, double-blind, active comparator-controlled, multicentre, US-based trial. Lancet Infect Dis 2023;23:233–46. https://doi.org/10.1016/S1473-3099(22)00526-6 PMID:36116461
- Sanofi. Study of a pneumococcal conjugate vaccine in adults aged 50 to 84 years. https://clinicaltrials.gov/study/NCT04583618
- Jatlaoui TC, Hung M-C, Srivastav A, et al. Vaccination coverage among adults in the United States, National Health Interview Survey, 2019–2020. Atlanta, GA: US Department of Health and Human Services, CDC. https://www.cdc.gov/vaccines/imz-managers/coverage/adultvaxview/pubs-resources/vaccination-coverage-adults-2019-2020.html#print