20价肺炎球菌结合疫苗在美国儿童中的使用:美国免疫实践咨询委员会的最新建议,2023年
疾病预防控制中心詹妮弗·法勒;疾控中心的瑞安·吉尔克;美国疾病控制中心克里斯汀·安德列科;疾病控制中心;林赛·杰林斯基,EISO疾病预防控制中心;疾病预防控制中心亚当·科恩;安大略省汉密尔顿麦克马斯特大学丽贝卡·摩根;Doug Campos- Outcalt,亚利桑那大学医学院,亚利桑那州凤凰城;宾夕法尼亚州费城德雷克塞尔大学医学院Sarah S. Long北卡罗来纳州温斯顿-塞勒姆威克森林医学院凯瑟琳·a·波灵;小林美和子,美国疾病控制中心
摘要
本报告汇编并总结了美国疾病预防控制中心免疫实践咨询委员会(ACIP)发布的关于美国19岁以下儿童和青少年使用肺炎球菌疫苗的建议。该报告还包括CDC新的或更新的临床指南。
13价肺炎球菌结合疫苗(PCV13 [Prevnar 13,Wyeth Pharmaceuticals,Inc,Pfizer,Inc的子公司])、15价肺炎球菌结合疫苗(PCV15 [Vaxneuvance,Merck Sharp & Dohme LLC])和23价肺炎球菌多糖疫苗(PPSV23 [Merck Sharp & Dohme LLC])已被推荐用于美国儿童。2023年4月,食品药品监督管理局(FDA)批准扩大20价肺炎球菌结合疫苗(PCV20 [Prevnar 20,Wyeth Pharmaceuticals,Inc,辉瑞公司的子公司])的使用范围,以包括6周至17岁的人群。除了包括在PCV15中的血清型之外,PCV20还包括与CRM197(遗传解毒白喉毒素)结合的血清型8、10A、11A、12F和15B。2023年6月22日,疾病预防控制中心的ACIP建议使用PCV20作为PCV15的一个选项,用于:所有2-23个月大的儿童的常规疫苗接种;为年龄在24-59个月的健康儿童进行补充疫苗接种,这些儿童没有接受适合其年龄的剂量;年龄在24-71个月的儿童,患有某些潜在疾病,但未接受适龄剂量的疫苗,患肺炎球菌疾病的风险较高。此外,更新了针对2-18岁有任何风险状况的儿童的建议。基于风险的肺炎球菌疫苗建议的适应症扩大到包括患有慢性肾病(即使未进行维持性透析或肾病综合征)、慢性肝病和中度持续性或重度持续性哮喘(无论是否使用高剂量口服皮质类固醇)的儿童。
介绍
尽管肺炎球菌疫苗计划在美国取得了成功,但肺炎链球菌仍然是19岁以下人群急性呼吸道感染的常见细菌病原,包括肺炎和急性中耳炎(AOM),以及侵袭性疾病,如菌血症和脑膜炎。在新冠肺炎疫情之前,美国2018-2019年侵袭性肺炎球菌疾病(IPD)的发病率为每10万名5岁以下儿童7.2例,每10万名5-18岁儿童1.5例。在< 5岁的儿童中,PCV13血清型占IPD的21%;包含在PCV20中但不包含在PCV13中的其他血清型(PCV20-非PCV13血清型)占5岁以下儿童IPD的32%。在5-18岁的儿童中,由PCV13血清型和PCV20非PCV13血清型引起的IPD分别占IPD的34%和29%(1)。估计非侵袭性肺炎球菌疾病在儿童中的发病率高于侵袭性疾病,据估计,PCV20非PCV13(包括在某些实验室方法中可能无法与血清型15B区分的血清型15C)血清型的儿科AOM医疗访问发病率为每1000人-年5.4-7.4例(2)。
PCV13于2010年获得许可并被推荐用于儿童,取代了2000年首次推出的7价肺炎球菌结合疫苗(PCV13)。2022年,FDA批准扩大儿童使用PCV15,ACIP推荐PCV15作为肺炎球菌结合疫苗接种PCV13的一种选择。建议2至59个月大的儿童常规使用PCV13或PCV15。这些疫苗还被推荐用于患有肺炎球菌疾病风险增加的某些潜在疾病的60至71个月的儿童(以下称为风险状况*)以及患有免疫功能低下、脑脊液漏或耳蜗植入的6至18岁儿童;PPSV23已被推荐用于2至18岁有风险状况的儿童。2023年4月27日,基于对PCV20和PCV13的安全性和抗体反应进行比较的研究,FDA批准扩大PCV20的使用范围,以包括6周至17岁的人(4)。
2023年6月22日,ACIP投票批准了以下关于使用PCV20替代PCV15的建议:
根据目前推荐的PCV剂量和时间表,建议所有以前没有接种过PCV疫苗的2-23个月的儿童接种PCV15或PCV20。
根据目前推荐的PCV剂量和时间表,建议使用PCV13、PCV15或PCV20的24-71个月的不完全疫苗接种状态的儿童接受PCV15或PCV20。
o建议年龄在24-59个月的健康儿童在最后一剂PCV疫苗接种后至少8周接受单剂PCV15或PCV20。
o年龄为24-71个月、有任何风险状况且之前未接受过PCV或在24个月大时接受过任何< 3次剂量的不完整方案的儿童,建议在两次PCV剂量之间至少间隔8周注射2次PCV15或PCV20。
o年龄为24-71个月、有任何风险状况且在12个月前接种过3剂PCV的儿童,建议在最后一剂PCV后至少8周接种一剂PCV15或PCV20。
对于在6岁前完成推荐PCV系列的2-18岁有任何风险状况的儿童,
o如果推荐的PCV剂量是用≥1剂PCV20完成的,则不需要额外剂量的任何肺炎球菌疫苗。随着更多数据的出现,本建议可能会更新。
o如果使用PCV13或PCV15(无PCV20)完成了推荐的PCV剂量,则推荐使用一剂PCV20或≥1剂PPSV23来完成推荐的疫苗系列。
当使用PPSV23代替PCV20治疗2-18岁的免疫功能低下儿童时,建议在第一剂PPSV23后≥5年使用PCV20或第二剂PPSV23。
对于未接受过任何剂量的PCV13、PCV15或PCV20的6-18岁儿童,建议在最近一剂肺炎球菌疫苗接种后≥8周注射一剂PCV15或PCV20。
o当使用PCV15时,如果之前没有接种,应在最后一次PCV接种后至少8周再接种一次PPSV23。
基于风险的建议的适应症扩大到包括:患有慢性肾脏疾病(即使没有进行维持性透析或肾病综合征)、慢性肝脏疾病和中度持续性或重度持续性哮喘(无论是否使用高剂量口服皮质类固醇)的儿童。
以下是新的CDC实施指南:
如果当儿童预定接受PCV时只有PCV13可用,PCV13可以按照先前的建议接种。
如果儿童从PCV13开始PCV系列,儿童可以用PCV15或PCV20完成该系列,而无需给予额外剂量;PCV系列不需要重启。
对于24-59个月大的健康儿童,如果他们完成了PCV13的推荐PCV疫苗接种系列(即4剂PCV13或另一种适合年龄的PCV13方案),则不需要补充PCV15或PCV20的剂量。
对于仅在6岁或之后接受过PCV13的6-18岁有风险状况的儿童,建议在最后一剂PCV13后至少8周接受一剂PCV20或≥1剂PPSV23。
o当使用PPSV23代替PCV20治疗6-18岁的免疫功能低下儿童时,建议在第一剂PPSV23后≥5年使用PCV20或第二剂PPSV23。
接受造血干细胞移植(HSCT)的19岁以下儿童,建议在HSCT后3-6个月开始接种4剂PCV20。从HSCT后3-6个月开始,间隔4周接种3剂PCV20。第三剂PCV20后≥6个月或HSCT后≥12个月,以较晚者为准,给予第四剂PCV20。
o如果PCV20不可用,可给予间隔4周的3剂PCV15,然后在HSCT后≥1年给予单剂PPSV23。对于正在接受PCV15治疗的慢性移植物抗宿主病(GVHD)患者,可以使用第四剂PCV15代替PPSV23,因为这些儿童对PPSV23的反应较低。
o最好通知患者的临床团队来确定接种疫苗的适当时机。
方法
在2023年2月至6月期间,ACIP审查了肺炎球菌疾病的流行病学和儿童使用PCV20的考虑因素。ACIP肺炎球菌疫苗工作组定义评估儿童使用PCV20利弊的关键结果。在对文献进行系统综述后,工作组使用建议、评估、开发和评价(等级)的分级来评估PCV20免疫原性和安全性证据的确定性,从高确定性到非常低确定性。文献检索方案,包括数据库、检索年份和用于选择研究的标准在评分表中有描述。ACIP采用证据到建议(EtR)框架来指导其关于使用PCV20的审议,并考虑了公共健康问题的重要性、益处和危害、目标人群的价值观和偏好、资源使用、公平性、可接受性以及使用PCV20的可行性。该报告更新了之前推荐用于儿童的肺炎球菌疫苗(3,5)。
19岁以下人群的肺炎球菌疾病流行病学
新冠肺炎疫情后的侵袭性肺炎球菌疾病
来自CDC主动细菌核心监测的数据显示,在新冠肺炎疫情发作时,与2018-2019年相比,2020年儿童的IPD总发病率下降了50%以上,这与可能由于掩蔽和物理距离措施而减少的细菌感染一致(6)。与2020年相比,2021年< 5岁儿童的IPD发病率有所增加,尽管发病率仍低于疫情前的基线;2021年5-18岁儿童的发病率保持不变(1)。
2022年的初步IPD发病率数据显示,11月和12月的发病率与2018年至2019年相比,两个年龄组的发病率都超过了≥50%(7)。
儿童急性呼吸道疾病的估计负担
南肺炎是儿童急性呼吸道疾病(ARI)的常见细菌原因,如肺炎和急性中耳炎(AOM) (8,9)。ARI是儿童门诊医疗保健利用和抗生素使用的主要原因(10,11);然而,关于肺炎球菌疫苗可预防的负担的数据是有限的。使用全国代表性调查和保险索赔数据来估计2016-2018年美国18岁以下儿童的门诊肺炎就诊负担。发表的文献被用来估计肺炎球菌疫苗血清型引起的肺炎就诊比例(2)。在新冠肺炎疫情之前,任何肺炎球菌血清型导致的门诊肺炎就诊的估计发病率为每1000人-年5.5例,2岁以下儿童的发病率高于2-4岁儿童(分别为每1000人-年11.5例和0.3例);可归因于PCV20非PCV13血清型(包括血清型15C)的肺炎就诊的估计发生率为每1000人-年0.6至0.9(2)。后新冠肺炎疫情时代的数据还不可用。尽管可获得全因肺炎的血清型分布数据,但由于诊断能力的限制,美国儿童非菌血症肺炎球菌肺炎的数据有限。
在上述评估美国儿童门诊肺炎就诊负担的分析中,也研究了AOM;可归因于PCV20非PCV13血清型的AOM就诊率估计为每1000人-年5.4至7.4例(2)。一项评估2015年至2019年纽约< 3岁儿童AOM的前瞻性纵向研究估计,24%的临床诊断AOM归因于肺炎链球菌;其中,28%是由PCV20非PCV13血清型(包括血清型15C)引起的(8)。
高危儿童肺炎球菌疾病的流行病学
后PCV13时代患肺炎球菌疾病儿童的数据有限。一项使用2007年至2010年期间医疗保健索赔数据的研究发现,有风险状况的儿童,特别是那些有免疫妥协状况或人工耳蜗植入的儿童,患肺炎球菌疾病的比率增加。在该风险组中小于5岁的儿童中,IPD发生率比无风险因素的同龄儿童高11.2倍;肺炎球菌肺炎的发病率为有风险状况的儿童比无风险状况的儿童高6.8倍。在同一风险类别的5-17岁儿童中,与无风险状况的儿童相比,IPD发病率高40倍,肺炎球菌性肺炎发病率高10倍。(12)
根据先前的建议(13 ),患有某些基础疾病但不属于肺炎球菌疫苗接种适应症的儿童患肺炎球菌疾病的风险增加。未使用口服皮质类固醇的哮喘儿童的肺炎球菌肺炎发生率是无风险儿童的1.8-2.2倍(12)。一项对年龄在2-49岁的田纳西州医疗补助接受者的病例对照研究报道,哮喘是IPD的一个独立危险因素(校正比值比:2.4;95%可信区间[CI]:1.9–3.1)(14)。在一项针对3-59个月儿童的病例对照研究中,与年龄匹配的社区对照相比,IPD病例患者患慢性肾脏疾病(未进行透析)的几率为3.6倍(15)。使用医疗保健索赔数据进行的分析表明,与无风险条件的同年龄组儿童相比,年龄< 5岁的慢性肝病儿童患IPD的风险是18.5倍,年龄< 18岁的儿童患肺炎球菌肺炎的风险是7.0-7.8倍(12)。EtR文献中总结了19岁以下人群中有无风险状况的IPD、肺炎和AOM肺炎球菌疾病的流行病学情况[https://www.cdc.gov/vaccines/acip/recs/grade/PCV20-child-risk-based-etr.html;https://www.cdc.gov/vaccines/acip/recs/grade/PCV20-child-etr.html].
PCV20免疫原性
一项II期和一项III期随机对照试验(RCT)评估了与PCV13相比,PCV20在4个剂量系列中对2岁以下健康儿童的免疫原性(16,17)。在同意时年龄为42-98天的健康婴儿被招募,并在2、4、6和12-15个月时给予一定剂量的PCV20或PCV13。在第3次和第4次接种后30天,测量血清型特异性免疫球蛋白G (IgG)的几何平均浓度(GMCs)和调理吞噬细胞活性(OPA)滴度(在随机选择的参与者亚组中,因为没有确定的儿童OPA抗体保护相关性)。RCT显示,与PCV13相比,PCV20组中针对PCV13血清型的抗体应答在数字上较低。在II期RCT中,与PCV13组相比,第3剂和第4剂后PCV20组的IgG GMCs在13种共有血清型中数值较低,而在7种PCV20非PCV13血清型中数值较高(17)。在III期试验中,PCV20符合非劣效性标准**,对于13种PCV13血清型中的8种(遗漏了血清型1、3、4、9V和23F)和7种PCV20非PCV13血清型中的6种(遗漏了血清型12F ),这通过在第3次接种后IgG浓度高于预定浓度的参与者的百分比来测量;PCV20符合所有13种共有血清型和7种独特血清型的非劣效性标准,如在第3剂和第4剂后通过IgG GMC比率测量的。对于5种共有血清型(1、3、4、9V和23F ),第3次接种后的OPA几何平均滴度(GMT)在各研究组中数值相似,这5种血清型不符合基于应答者百分比的第3次接种后非劣效性标准终点。血清型12F产生了OPA抗体反应。第4次接种后,OPA GMTs在数值上相似(95%置信区间重叠),介于13种共有血清型的PCV20和PCV13组,除了在PCV20组中血清型1和3较低(16)。
一项在15个月至17岁的健康儿童(所有< 5岁的儿童都有以前接受过≥3剂PCV13的记录)中进行的单剂量PCV20的单组III期临床试验表明,对于13种共有血清型和7种独特血清型,在PCV20接种后1个月,血清型特异性IgG GMCs在数字上高于接种前(18)。在所有组中随机选择的参与者子集中,测量13种共有血清型的血清型特异性OPA GMTs。对于7种额外的PCV20非PCV13血清型,在15个月至< 5岁年龄组的参与者和5至17岁年龄组的所有参与者的随机子集中测量OPA GMTs。与接种前相比,接种一剂PCV20疫苗后一个月,所有年龄组的所有20种血清型的OPA GMTs数值均较高。没有研究评估PCV20在高危儿童中的免疫原性。
PCV20安全性
在四项临床试验中评估了PCV20的安全性,其中三项在3,949名年龄小于2岁的健康儿童中进行(2,232名接受PCV20,1,717名接受PCV13) (16,17,19),一项在831名年龄为15个月至17岁的健康儿童中进行(18)。在健康婴儿的III期RCT中,PCV20组和PCV13组分别有44.8%至59.8%和45.9%至56.5%的婴儿在每次接种后≤7天出现任何诱发性局部反应(即注射部位发红、肿胀和疼痛);在PCV20和PCV13组中,分别有35.1%至40.7%和33.8%至41.0%的患者报告了每次接种后≤7天的任何诱发全身反应(即发热、食欲下降、易怒、困倦/睡眠增加)(16,20)。大多数不良反应为轻至中度;≤0.4%和≤4.5%分别为严重、局部和全身反应。在评估4剂PCV系列在2岁以下儿童中的安全性的三项试验中,PCV20组2232名参与者中的101名(4.5%)和PCV13组1717名参与者中的64名(3.7%)报告了第4剂PCV后≤6个月的严重不良事件(SAEs对于特定类别的SAE,疫苗组之间没有明显的模式或不平衡,这表明与PCV20有因果关系。没有因接种疫苗而死亡的报告(16,17,19)。在15个月至18岁的儿童中进行的单组试验中,831名儿童中有5名(0.6%)在接种PCV20疫苗后≤6个月报告了SAEs没有因接种PCV20疫苗而死亡的报告(18)。在评估健康婴儿或儿童安全性的所有四项试验中,PCV20组报告了7例(0.2%)热性惊厥,PCV13组报告了2例(0.1%)。两次热性惊厥被认为可能与接种PCV20疫苗有关:一次热性惊厥发生在接种第四剂PCV20疫苗(麻疹、腮腺炎、风疹和水痘疫苗)后14天;另一名被诊断患有新冠肺炎的儿童在第四剂PCV20后7天出现热性惊厥;所有其他热性惊厥都发生在接种疫苗后> 30天。
成本效益
三个经济模型(Tulane-CDC、Merck和Pfizer模型)评估了使用PCV20的成本效益(21)。在对所有2岁以下儿童的4剂系列的评估中,将PCV20分别与PCV15和PCV13进行比较;用PCV20替代PCV13或PCV15的基本情况成本效益估计范围从成本节约到125,000美元,以获得额外的质量调整寿命年(QALY)https://www . CDC . gov/vaccines/acip/RECs/grade/PCV20-child-ETR . html)。在对2-18岁有风险的儿童使用PCV20的评估中,这些模型的比较各不相同。杜兰-cdc和默克模型比较了4剂量的PCV20和4剂量的PCV13或PCV15和1-2剂量的PCV20和PPSV23。辉瑞模型在一组6岁儿童中比较了1剂PCV20和1-2剂PPSV23,这些儿童患有接受PCV13治疗的风险疾病。所有三种模型的基础案例结果发现,使用PCV20可以节约成本(https://www.cdc.gov/vaccines/acip/recs/grade/PCV20-child-etr.html).
建议的理由
将PCV20作为儿童肺炎球菌疫苗接种的一个选项,有望提供针对导致疾病的其他疫苗血清型的保护,并降低PCV20型IPD、肺炎和AOM的发病率。评价PCV20免疫原性的RCT显示,与PCV13相比,PCV20组中针对PCV13血清型的抗体应答在数字上较低,尽管临床意义尚不清楚。PCV20组报告的安全性与PCV13组相当。没有研究直接比较PCV20和PCV15的安全性和免疫原性。在有风险的儿童中,与PCV13和PCV15相比,仅使用PPSV23的PCV20的基本病例成本效益估计节省了成本,其次是PPSV23;然而,由于没有PCV20用于风险儿童的数据,估计仍存在不确定性。工作组总结了关于使用PCV20进行儿童肺炎球菌疫苗接种的讨论。
PCV的使用建议
2023年6月22日,CDC的ACIP一致投票通过了关于使用PCV20作为儿童肺炎球菌结合疫苗接种选项的建议;这些建议概述如下。根据之前推荐的PCV剂量和方案,建议所有2-23个月的儿童使用PCV15或PCV20。更新了基于风险的肺炎球菌疫苗在PCV未接种儿童中使用的建议。
从未接种过PCV疫苗的2-23个月的儿童
根据目前推荐的PCV剂量和方案,建议所有2-23个月的儿童使用PCV15或PCV20。(表1)
基本原理
一项III期临床试验评估了在小于2岁的健康儿童中,与PCV13相比,PCV20在4个剂量系列中的免疫原性(16,17)。在同意时年龄为42-98天的健康婴儿被招募,并在2、4、6和12-15个月时给予一定剂量的PCV20或PCV13。PCV20在6周至15个月大的个体中的有效性(针对由20种疫苗血清型引起的侵袭性肺炎球菌疾病和由血清型4、6B、9V、14、18C、19F和23F引起的中耳炎)是基于PCV20后的血清型特异性抗体应答与用PCV13接种后的抗体应答的比较来证明的。在三项试验中对小于2岁的健康儿童进行了安全性评估,安全性被认为与PCV13相当。一个严重的热性惊厥事件被认为可能与PCV20有关;没有死亡与PCV20疫苗接种相关。将PCV20作为儿童肺炎球菌疫苗接种的一种选择,有望提供针对导致疾病的其他疫苗血清型的保护。
根据经济模型评估,与PCV13或PCV15相比,在2岁以下儿童中使用PCV20作为4个剂量系列的基础病例估计值从节省成本到获得额外QALY的125,000美元不等。
24-71个月的儿童,PCV疫苗接种不完全
对于年龄为24-59个月的健康儿童,如果使用PCV13、PCV15或PCV20进行的PCV疫苗接种不完全,建议使用单剂PCV15或PCV20。不建议年龄≥5岁的健康儿童常规使用PCV(表2)。
对于年龄在24-71个月、有任何风险状况(表3)且之前未接受过PCV或在24个月大时未接受过任何< 3剂的不完整方案的儿童,建议在PCV剂量间隔至少8周的时间内注射2剂PCV15或PCV20。
对于年龄为24-71个月、患有任何风险疾病且在12个月前接种过3剂PCV的儿童,建议在最后一剂PCV后至少8周接种一剂PCV15或PCV20。
基本原理
一项在15个月至17岁健康儿童中进行的单组III期临床试验评估了单剂量PCV20的免疫原性和安全性。所有小于5岁的儿童都有以前接受过≥3剂PCV13的记录。对于13种共有血清型和7种独特血清型,PCV20接种后1个月,血清型特异性IgG GMCs在数字上高于接种前。OPA GMTss是5至17岁儿童的主要终点,与接种前相比,接种一剂PCV20疫苗后一个月,所有20种血清型的OPA GMT在数字上都较高。在接种PCV20疫苗后≤6个月的831名参与者中,有5名(0.6%)报告了SAEs没有因接种PCV20疫苗而死亡的报告。
在评估有风险的儿童使用PCV20时,经济模型在比较中有所不同。然而,所有三种模型的基础案例结果发现,使用PCV20可以节约成本。
2-18岁患有任何风险状况的儿童,在6岁前完成了推荐的PCV系列(表3)
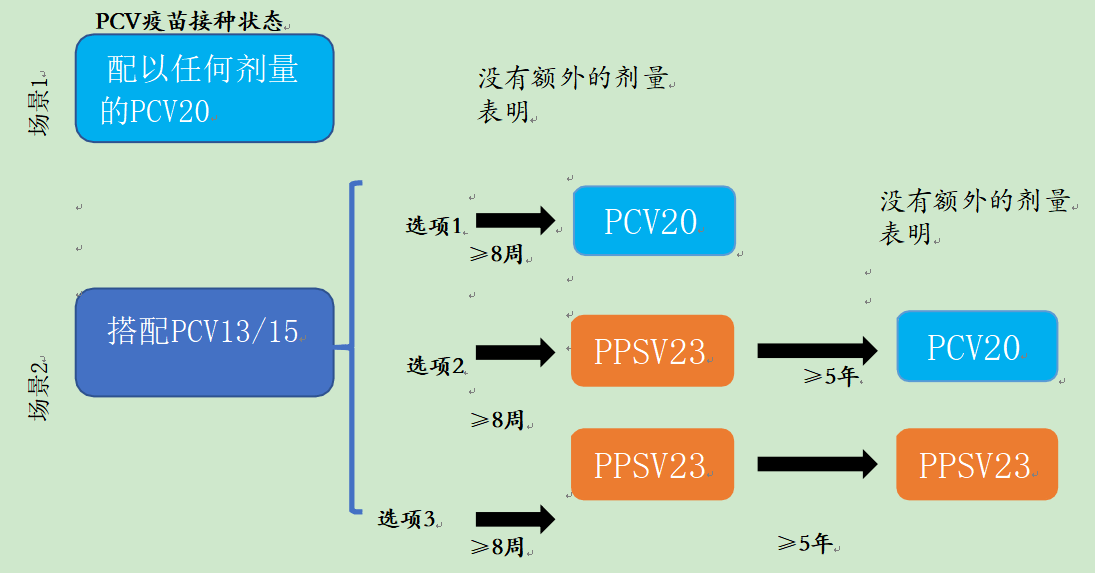
对于年龄为2-18岁、患有任何风险疾病且在6岁前接受了所有PCV推荐剂量(包括≥1剂PCV20)的儿童,不需要额外剂量的任何肺炎球菌疫苗(图1和图2)。随着更多数据的出现,本建议可能会更新。
对于具有任何风险状况的2-18岁儿童,如果他们使用PCV13或PCV15(无PCV20)接种了所有推荐剂量的PCV,则建议在最后一剂PCV后至少8周接种一剂PCV20或≥1剂PPSV23,以完成推荐的疫苗系列(表3和图1)。
当使用PPSV23代替PCV20治疗2-18岁患有免疫功能低下疾病的儿童时,建议在第一剂PPSV23后≥5年使用PCV20或第二剂PPSV23(图2)。
基本原理
没有在有风险状况的儿童中进行PCV20期和III期试验。在一项评估15个月至17岁儿童单剂量PCV20免疫原性的单组临床试验中,PCV20后血清特异性IgG GMCs在数量上高于PCV20前剂量。
类似地,与接种前相比,接种一剂PCV20疫苗一个月后,所有20种血清型的OPA GMT(5-17岁儿童的主要终点)在数字上更高。
关于安全性,0.6%(831例中的5例)的SAE发生在接种PCV20疫苗后≤6个月;没有与PCV20疫苗接种相关的死亡报告。观察性研究中有限的PCV13有效性数据(包括患有潜在疾病的儿童)显示,PCV13可预防PCV13型IPD (22)和PCV13型肺炎(23)。
经济模型显示,在2-18岁有风险状况的儿童中,仅使用PCV20而不使用PPSV23的基础病例成本效益估计值比使用PCV13或PCV15后使用PPSV23更节省成本;然而,由于没有风险儿童使用PCV20的数据,估计值仍存在不确定性。
6-18岁的儿童,患有任何风险疾病,之前未接种过PCV13、PCV15或PCV20疫苗(表3)
对于未接种任何剂量的PCV13、PCV15或PCV20的6-18岁儿童,建议在最近一次接种肺炎球菌疫苗后≥8周接种单剂PCV15或PCV20,无论该儿童以前是否接种过PPSV23,即使接种了PCV7。当使用PCV15时,如果之前没有接种,应在使用后接种一剂PPSV23。当使用PCV20时,不需要随后接种PPSV23。
基本原理
以前,不建议6-18岁有风险状况但未接受PCV的儿童接受PCV,除非他们有免疫缺陷状况、脑脊液漏或耳蜗植入。相反,建议他们接受单剂PPSV23 (5)。尽管美国的PCV覆盖率较高(24),但一项使用管理数据的研究报告称,与无这些疾病的儿童相比,患有非免疫妥协风险疾病(如哮喘、慢性心脏病、慢性肝病、慢性肺病、糖尿病)的5-17岁儿童患IPD的风险是其2-10倍,患肺炎球菌肺炎的风险是其3-7倍(12)。虽然6-18岁有危险状况的儿童未接受过PCV的比例被认为很小,但推荐PCV有望为这些肺炎球菌疾病风险增加的儿童提供额外的保护。此外,更新后的建议协调了不同风险群体的建议,并与当前针对19-64岁成人的肺炎球菌疫苗建议保持一致,这些成人具有基于风险的建议指征(25)。
表1.CDC免疫实践咨询委员会关于儿童使用PCV的建议,2023年6月
| 年龄和风险群体 | 推荐 |
| 24个月以下的儿童 | 根据之前所述推荐的PCV剂量和时间表,建议所有2-23个月的儿童使用PCV15或PCV20
如果当儿童预定接受PCV时只有PCV13可用,PCV13可以按照先前的建议接种。 如果儿童从PCV13开始PCV系列,儿童可以用PCV15或PCV20完成该系列,而无需给予额外剂量;PCV系列不需要重启。 对于接受了所有推荐剂量和方案的PCV13或PCV15的儿童,不需要补充PCV20剂量。 |
| 年龄在24-59个月的健康儿童,PCV疫苗接种不完全* | 建议使用单剂量的PCV15或PCV20。
已接受4剂PCV13或已完成另一个适合年龄的PCV13计划的健康儿童不需要补充PCV15或PCV20剂量。 |
| 24-71个月的儿童,有任何风险状况 | 根据之前推荐的PCV剂量和时间表,使用PCV15或PCV20。
如果当儿童预定接受PCV时只有PCV13可用,PCV13可以按照先前的建议接种。 |
| 在6岁前完成推荐的PCV系列的2-18岁有任何风险状况的儿童 | 完整系列包括≥1剂PCV20:
没有显示任何肺炎球菌疫苗的额外剂量。 随着更多数据的出现,本建议可能会更新。使用PCV13或PCV15(无PCV20)的完整系列: 建议使用以前推荐的剂量和方案单剂量注射PCV20或PPSV23,以完成推荐的疫苗系列。 |
| 6-18岁的儿童,患有任何风险疾病,之前未接种过PCV13、PCV15或PCV20疫苗 | 对于未接受任何剂量PCV (PCV13、PCV15或PCV20)的6-18岁儿童,建议使用单剂PCV15或PCV20。
如果儿童以前接受过PCV7和/或PPSV23,则单剂量的PCV15或PCV20 建议在最近一剂肺炎球菌疫苗接种后≥8周。 o如果之前没有接种,PCV15之后应接种PPSV23。 oPCV20后不需要接种PPSV23。 |
| 接受过HSCT的孩子 | 接受HSCT的儿童被建议接受三剂PCV20,间隔4周,从HSCT后3-6个月开始。
建议在第三次PCV20接种后≥6个月,或HSCT后≥12个月进行第四次PCV20接种。 以较晚者为准。 已开始接种PCV13或PCV15肺炎球菌疫苗系列的HSCT接种者可在不给予额外剂量的情况下完成其4剂PCV20肺炎球菌疫苗系列。 如果PCV20不可用,则在HSCT后3-6个月开始,间隔4周,接种3剂PCV15,然后接种 可给予HSCT后≥12个月的PPSV23剂量。 对于正在接受PCV15治疗的慢性移植物抗宿主病患者,可以用第四剂PCV15代替PPSV23,因为这些儿童对PPSV23的反应较低。患者的临床团队最适合决定接种疫苗的适当时机。 |
缩写:PCV =肺炎球菌结合疫苗;PCV13 = 13价PCV PCV15 = 15价PCV PCV20 = 20价PCV PPSV23 = 23价肺炎球菌多糖疫苗;HSCT =造血干细胞移植。
*不建议年龄≥5岁的健康儿童常规使用PCV
风险状况包括:脑脊液漏;慢性心脏病;慢性肾脏疾病(不包括维持性透析和肾病综合征,它们包括在免疫妥协情况中);慢性肝病;慢性肺部疾病(包括中度持续性或重度持续性哮喘);人工耳蜗;糖尿病;免疫妥协状况(维持性透析或肾病综合征;先天性或获得性无脾症或脾功能障碍;先天性或获得性免疫缺陷;用免疫抑制药物或放射疗法治疗的疾病和病症,包括恶性肿瘤、白血病、淋巴瘤、霍奇金病和实体器官移植;艾滋病毒感染;和镰状细胞病或其他血红蛋白病)。患有这些疾病的儿童,如果接种了PCV13或PCV15,也建议接种23价肺炎球菌多糖疫苗。
表2.按就诊年龄、健康状况和疫苗接种史对儿童接种肺炎球菌结合疫苗*的建议——美国,2023年
| 就诊年龄/健康状况 | 之前收到的PCV13/PCV15/PCV20剂量的数量 | 推荐的PCV15/PCV20疗法*,† | PCV13/PCV15/的数量
24月龄前完成系列所需的PCV20剂量 |
| 所有儿童(健康儿童和有风险的儿童) | |||
| 2到6个月 | 0 | 4剂:3剂,间隔8周;12-15月龄时的最后一剂 | 4 |
| 1 | 3次额外剂量:2次剂量,间隔8周;12-15月龄时的最后一剂 | 4 | |
| 2 | 2次额外剂量:最近8周后1次剂量
剂量;最后一次接种≥8周后,12-15月龄 |
4 | |
| 3 | 12-15月龄时增加1剂 | 4 | |
| 7到11个月 | 0(年龄小于7个月) | 3剂:2剂,间隔8周;12-15月龄时的最后一剂 | 3 |
| 1或2(年龄小于7个月) | 2次额外剂量:最近8周后1次剂量
剂量;最后一次接种≥8周后,12-15月龄 |
3或4 | |
| 3(年龄小于7个月) | 12-15月龄时增加1剂 | 4 | |
| 1(年龄≥7个月) | 2次额外剂量:最近8周后1次剂量
剂量;最后一次接种≥8周后,12-15月龄 |
3 | |
| 2(年龄≥7个月) | 12-15个月大时,8周后追加1次剂量 | 3 | |
| 12到23个月 | 0(年龄小于12个月) | 2剂:2剂,间隔8周 | 2 |
| 1(年龄小于12个月) | 2次额外剂量:1次剂量≥最近一次剂量后8周;最后一次接种≥8周后 | 3 | |
| 2或3岁(年龄小于12个月) | 最近一次接种后≥8周,追加1次接种 | 3或4 | |
| 1(年龄≥12个月) | 最近一次接种后≥8周,追加1次接种† | 2 | |
| 健康的儿童 | |||
| 24至59个月 | 24个月内无既往剂量或任何不完整的时间表 | 最近一次接种后≥8周,追加1次接种 | NA |
| 5-18岁 | 24个月内无既往剂量或任何不完整的时间表 | 无额外剂量¶ | NA |
| 有风险状况的儿童和青少年 | |||
| 24到71个月** | 无既往用药史或任何不完整的用药时间表,24月龄前< 3次用药 | 2次接种:最近一次接种后第1次接种≥8周;最后的
剂量≥8周后 |
NA |
| 3人(年龄均小于12个月) | 最近一次接种后≥8周,追加1次接种 | NA | |
| 6-18岁 | 没有以前的剂量 | 1剂§§†† | NA |
缩写:NA =不适用;PCV =肺炎球菌结合疫苗;PCV15 = 15价PCVPCV20 = 20价PCV。
*PCV15或PCV20可用于完善推荐的PCV系列。如果当儿童计划接受PCV时只有13价PCV (PCV13)可用,则可按照之前的建议给予PCV13。
†最小剂量间隔为8周,1岁以下接种疫苗的儿童除外,他们的最小剂量间隔为4周。首次接种的最小年龄为6周。
§危险情况包括:脑脊液漏;慢性心脏病;慢性肾脏疾病(不包括维持性透析和肾病综合征,它们包括在免疫妥协情况中);慢性肝病;慢性肺部疾病(包括中度持续性或重度持续性哮喘);人工耳蜗;糖尿病;免疫妥协状况(维持性透析或肾病综合征;先天性或获得性无脾症或脾功能障碍;先天性或获得性免疫缺陷;用免疫抑制药物或放射疗法治疗的疾病和病症,包括恶性肿瘤、白血病、淋巴瘤、霍奇金病和实体器官移植;艾滋病毒感染;和镰状细胞病或其他血红蛋白病)。
¶不建议年龄≥5岁的健康儿童常规使用PCV
* *如果PCV20未作为PCV推荐剂量的一部分,也建议这些儿童接种一剂PCV20或≥1剂23价肺炎球菌多糖疫苗。
††请参见“24月龄前完成系列的PCV13/PCV15/ PCV20剂量数”一栏,以确定24月龄前< 3次剂量的不完整方案。
§§当使用PCV15时,如果之前没有接种,则应在PCV15接种后≥8周接种PPSV23。当…的时候
使用的是PCV20,不需要再接种PPSV23。
表3.基于风险的肺炎球菌疫苗推荐给有风险状况的PCV未接种儿童和青少年——美国,2023年
| 风险群体/状况 | 儿童专用PCV*
年龄小于6岁 |
PCV*用于人员
6-18岁 |
PPSV23适用于年龄≥2岁的儿童,无
以前的PCV20接种 |
|
| 被推荐的 | 被推荐的 | 被推荐的 | 第一剂疫苗接种后5年进行一次复种 | |
| 患有慢性疾病的儿童 | ||||
| 慢性心脏病 | Y | Y | 仅当使用PCV13或PCV15时 | N |
| 慢性肾脏疾病(不包括维持性透析和肾病综合征,它们包括在免疫妥协疾病中) | Y | Y | 仅当使用PCV13或PCV15时 | N |
| 慢性肝病 | Y | Y | 仅当使用PCV13或PCV15时 | N |
| 慢性肺病(包括中度持续性或重度持续性哮喘) | Y | Y | 仅当使用PCV13或PCV15时 | N |
| 糖尿病 | Y | Y | 仅当使用PCV13或PCV15时 | N |
| 脑脊液漏 | Y | Y | 仅当使用PCV13或PCV15时 | N |
| 耳蜗植入物-假耳 | Y | Y | 仅当使用PCV13或PCV15时 | N |
| 患有免疫缺陷疾病的儿童 | ||||
| 维持性透析或肾病综合征 | Y | Y | 仅当使用PCV13或PCV15时 | 仅在之前没有接种PCV20的情况下 |
| 先天性或获得性无脾症,或脾功能障碍 | Y | Y | 仅当使用PCV13或PCV15时 | 仅在之前没有接种PCV20的情况下 |
| 先天性或获得性免疫缺陷 | Y | Y | 仅当使用PCV13或PCV15时 | 仅在之前没有接种PCV20的情况下 |
| 用免疫抑制药物或放射疗法治疗的疾病和病症 | Y | Y | 仅当使用PCV13或PCV15时 | 仅在之前没有接种PCV20的情况下 |
| 艾滋病毒感染 | Y | Y | 仅当使用PCV13或PCV15时 | 仅在之前没有接种PCV20的情况下 |
| 镰状细胞病或其他血红蛋白病 | Y | Y | 仅当使用PCV13或PCV15时 | 仅在之前没有接种PCV20的情况下 |
| 实体器官移植 | Y | Y | 仅当使用PCV13或PCV15时 | 仅在之前没有接种PCV20的情况下 |
缩写:N =否;PCV =肺炎球菌结合疫苗;PCV15 = 15价PCV PCV20 = 20价PCV PPSV23 = 23价肺炎球菌多糖疫苗;Y =是。
*可使用PCV15或PCV20。
建议对患有紫绀型先天性心脏病和心力衰竭的儿童尤为重要。
包括B-(体液)或T-淋巴细胞缺乏;补充不足,特别是C1、C2、C3和C4的不足;和吞噬细胞疾病(不包括慢性肉芽肿疾病)。
包括恶性肿瘤、白血病、淋巴瘤和霍奇金病。
图1.肺炎球菌疫苗推荐给2-18岁患有慢性疾病、脑脊液漏或耳蜗植入的儿童,他们在6岁前接受了所有推荐的PCV剂量

CMC =慢性医学疾病,包括慢性肾脏疾病(不包括维持性透析和肾病综合征,它们包括在免疫妥协疾病中)、慢性心脏病、慢性肝病、慢性肺病(包括中度持续性或重度持续性哮喘)、糖尿病;脑脊液=脑脊髓液
图2.世卫组织针对2-18岁免疫功能低下儿童的肺炎球菌疫苗建议,这些儿童在6岁前已完成所有PCV剂量
免疫妥协状况:维持性透析或肾病综合征;先天性或获得性无脾症或脾功能障碍;先天性或获得性免疫缺陷;用免疫抑制药物或放射疗法治疗的疾病和病症,包括恶性肿瘤、白血病、淋巴瘤、霍奇金病和实体器官移植;艾滋病毒感染;和镰状细胞病或其他血红蛋白病。
疾控中心临床实施指南
当PCV15和PCV20都不可用时,使用PCV13
如果当儿童预定接受PCV时只有PCV13可用,PCV13可以按照先前的建议接种。
从PCV13开始PCV系列的儿童
如果儿童从PCV13开始PCV系列,儿童可以用PCV15或PCV20完成该系列,而无需给予额外剂量;PCV系列不需要重启。
年龄在24-59个月的健康儿童,他们完成了推荐的PCV13系列疫苗接种
已接受4剂PCV13或已完成另一个适合年龄的PCV13计划的健康儿童不需要补充PCV15或PCV20剂量。
仅在6岁或6岁以后接种过PCV13的6-18岁有风险状况的儿童
在最后一剂PCV13后至少8周,建议接种一剂PCV20或≥1剂PPSV23。当使用PPSV23代替PCV20治疗6-18岁的免疫功能低下儿童时,建议在第一剂PPSV23后≥5年使用PCV20或第二剂PPSV23。
接受造血干细胞移植的儿童(HSCT)
接受HSCT的儿童被建议接受三剂PCV20,间隔4周,从HSCT后3-6个月开始。建议在注射第3剂PCV20后≥6个月注射第4剂PCV20,或
HSCT之后≥12个月,以较晚者为准。已开始接种PCV13或PCV15肺炎球菌疫苗系列的HSCT接种者可在不给予额外剂量的情况下完成其4剂PCV20肺炎球菌疫苗系列。
如果PCV20不可用,可在HSCT后≥12个月给予三剂PCV15,然后给予一剂PPSV23。对于正在接受PCV15治疗的慢性移植物抗宿主病患者,可以用第四剂PCV15代替PPSV23,因为这些儿童对PPSV23的反应较低。最好通知患者的临床团队来确定接种疫苗的适当时机。
疫苗管理
PCV15和PCV20可在单剂量预填充注射器中以0.5毫升的剂量进行肌肉注射。任何PCV都可以与其他常规儿童疫苗接种同时进行,包括新冠肺炎疫苗(26),使用不同的注射器和不同的注射部位。研究了PCV20与包含白喉、破伤风、无细胞百日咳、灭活脊髓灰质炎病毒、乙型流感嗜血杆菌、乙型肝炎、麻疹、腮腺炎、风疹、轮状病毒和水痘的疫苗同时接种(16,17)。当与PCV20或PCV13同时接种时,这些抗原的免疫原性相似(16,17)。尚未研究PCV20与脑膜炎球菌疫苗的联合用药。当使用PCV20时,应采用与PCV13和A、C、W和Y群脑膜炎球菌多糖白喉类毒素结合疫苗(Menactra,Sanofi Pasteur)联合用药相同的预防措施(27)。在同时接受PCV20和流感疫苗的儿童中(10- 20%的试验参与者),没有热性惊厥的报告(辉瑞,未发表的数据)。
在接种PCV或PPSV23之前,医疗保健提供者应查阅相关包装说明书,了解注意事项和禁忌症(20、28、29)。接种疫苗后发生的不良事件应报告给疫苗不良事件报告系统(VAERS)。有关VAERS和提交报告的更多信息,请访问https://vaers.hhs.gov。
未来的研究和监测重点
CDC和ACIP将继续评估肺炎球菌疫苗的安全性,并监测新疫苗建议实施后肺炎球菌疾病发病率和血清型分布的变化。随着更多证据的获得或FDA对当前批准的修订,CDC和ACIP将更新肺炎球菌疫苗接种建议。
致谢
免疫实践咨询委员会投票成员(除列出的作者外):Kevin A. Ault,堪萨斯大学医学中心;明尼苏达州卫生部Lynn Bahta贝丝
页(page的缩写)华盛顿大学贝尔;奥利弗·布鲁克斯,瓦茨医疗保健公司;马里兰大学医学院的Wilbur H. Chen布朗大学Warren Alpert医学院Sybil Cineas马修·f·戴利,科罗拉多州凯撒医疗机构;卡米尔·纳尔逊·科顿,哈佛医学院;斯坦福大学医学院Grace M. LeeJamie Loehr,Cayuga家庭医学;Veronica V. McNally,Franny Strong基金会;Pablo J. Sánchez,全国儿童医院研究所;海伦·凯普·塔尔博特,范德比尔特大学。
ACIP肺炎球菌疫苗工作组
Katherine A. Poehling,维克森林医学院;德雷克塞尔大学医学院萨拉·s·朗;Jeffrey Kelman,医疗保险和医疗补助服务中心;露西亚·李,蒂娜·蒙高,美国食品药品监督管理局;Uzo Chukwuma,印度卫生局;Kristina Lu,Mamodikoe Makhene,国立卫生研究院;Lynn Fisher,美国家庭医师学会;马克·索耶,美国儿科学会,传染病委员会;詹森·高德曼,美国内科医师学会;David Nace,美国老年医学会,急性和长期护理医学学会;Cora Hoover,Emily Messerli,免疫管理者协会;Aleksandra Wierzbowski,加拿大国家免疫咨询委员会;詹姆斯·麦考利,美国传染病学会;William Schaffner,国家传染病基金会;弗吉尼亚·凯恩,国家医学协会;亚利桑那大学Doug Campos-out calt;埃默里大学亚特兰大退伍军人事务医疗中心Monica M. Farley基思·克鲁格曼,比尔和梅林达·盖茨基金会;麦克马斯特大学丽贝卡·摩根;亚瑟·莱因戈尔德,加州大学伯克利分校;纽约科恩儿童医疗中心的劳里·鲁宾;匹兹堡大学理查德·k·齐默曼。
疾控中心捐助者
艾玛阿科尔西,艾莉森阿尔伯特,马克费舍尔,凯蒂汉密尔顿,安吉拉吉利斯,佩德罗莫罗,纳姆拉塔普拉萨德,利兹贝拉斯克斯,诺埃尔索博特卡,诺埃尔纳尔逊。
脚注
*风险情况包括:脑脊液漏;慢性心脏病;慢性肾脏疾病(不包括维持性透析和肾病综合征,它们包括在免疫妥协情况中);慢性肝病;慢性肺部疾病(包括中度持续性或重度持续性哮喘);人工耳蜗;糖尿病;免疫妥协状况(维持性透析或肾病综合征;先天性或获得性无脾症或脾功能障碍;先天性或获得性免疫缺陷;用免疫抑制药物或放射疗法治疗的疾病和病症,包括恶性肿瘤、白血病、淋巴瘤、霍奇金病和实体器官移植;艾滋病毒感染;和镰状细胞病或其他血红蛋白病)。在基于风险的建议的适应症中增加了粗体条件。
†免疫抑制状况:维持性透析或肾病综合征;先天性或获得性无脾症或脾功能障碍;先天性或获得性免疫缺陷;用免疫抑制药物或放射疗法治疗的疾病和病症,包括恶性肿瘤、白血病、淋巴瘤、霍奇金病和实体器官移植;艾滋病毒感染;和镰状细胞病或其他血红蛋白病。
§https://www.cdc.gov/vaccines/acip/recs/grade/PCV20-child-risk-based.html;
https://www.cdc.gov/vaccines/acip/recs/grade/PCV20-child.html
¶https://www.cdc.gov/vaccines/acip/recs/grade/downloads/acip-evidence-recs-framework.pdf
* *如果参与者与预定义IgG浓度的百分比差异(PCV20减去PCV13)的双侧置信区间下限为
对于该血清型来说大于-10%。除血清型5、6B、12F和19A分别为≥0.23 g/mL、≥0.10 g/mL、≥0.69 g/mL和≥0.12 g/mL外,所有血清型的预定义IgG浓度均≥0.35 g/mL。对于另外7种血清型,在计算百分比差异时,使用了PCV13组中具有针对血清型23F(具有最低百分比的PCV13血清型,不包括血清型3)的预定IgG浓度的参与者的百分比。
††以下情况除外血清型5≥0.23g/ml,血清型6B≥0.10g/ml,血清型19A≥0.23g/ml,以符合IgG阈值≥0.35 g/mL的参与者比例衡量。用于测量IgG浓度的直接结合Luminex免疫测定法(dLIA)与世界卫生组织酶联免疫吸附测定法相结合,为每种疫苗血清型建立dLIA特异性阈值,该阈值对应于已建立的≥0.35 g/mL世卫组织ELISA阈值。
§§如果某一血清型的IgG GMC比值(PCV20/PCV13)的双侧置信区间下限> 0.5,则该血清型符合非劣效性。对于另外7种血清型,在计算第3次接种后的GMC比率时,使用了PCV13组中IgG GMC与血清型19A(IgG GMC最低的PCV13血清型,不包括血清型3)的比率。对于另外7种血清型,在计算第4次接种后的GMC比率时,使用了PCV13组中与血清型1(具有最低IgG GMC的PCV13血清型,不包括血清型3)的IgG GMC。
¶¶与比较者相比,成本节约意味着干预措施的成本更低,健康结果更好
参考
- 美国儿科肺炎球菌疾病的当前流行病学。美国免疫实践咨询委员会。佐治亚州亚特兰大2023年2月22日。
- 儿科门诊ARI就诊和抗生素使用归因于高效价pcv的血清型。美国免疫实践咨询委员会。佐治亚州亚特兰大2023年2月22日。
- 疾病控制和预防中心。13价肺炎球菌结合疫苗(PCV13)的许可和儿童使用建议-免疫实践咨询委员会(ACIP),2010年。MMWR莫尔布凡人周刊代表2010年3月12日;59(9):258-61.
- 美国食品药品监督管理局。批准函:PREVNAR 20。马里兰州银泉市:美国卫生与公众服务部,美国食品药品监督管理局;;2023年[引用2023年5月19日];可从以下位置获得:https://www.fda.gov/media/167637/download.
- Kobayashi M,法勒·JL,Gierke R,Leidner AJ,Campos-Outcalt D,Morgan RL等.美国儿童使用15价肺炎球菌结合疫苗:美国免疫实践咨询委员会的最新建议,2022年。MMWR莫尔布凡人周代表2022年9月16日;71(37):1174-81.
- Sarmiento Clemente A,Kaplan SL,,Lin PL,Romero JR,Bradley JS,等,“新冠肺炎期间儿童侵袭性肺炎球菌疾病减少”。儿科感染疾病学会。2022年9月29日;11(9):426-8.
- 建议框架和政策选择的证据:美国儿童20价肺炎球菌结合疫苗的使用。美国免疫实践咨询委员会。佐治亚州亚特兰大2023。
- 考尔R,富士N,Pichichero我。2015-2019年期间接种13价(PCV13)肺炎球菌结合疫苗后,寄居鼻咽并导致儿童急性中耳炎的耳病原体的动态变化。欧洲临床微生物感染疾病杂志。2022年1月;41(1):37-44.
- 美国儿童中需要住院治疗的社区获得性肺炎。新英格兰医学杂志。2015年2月26日;372(9):835-45.
- Fleming-Dutra KE,Hersh AL,Shapiro DJ,Bartoces M,Enns EA,File TM,Jr .等,《2010-2011年美国门诊患者抗生素处方不当的患病率》。贾马。2016年5月3日;315(17):1864-73.
- Ray KN,Shi Z,Ganguli I,Rao A,Orav EJ,mehr otra A . 2008-2016年美国商业保险儿童儿科初级保健就诊趋势。JAMA Pediatr。2020年4月1日;174(4):350-7.
- Pelton SI,Weycker D,Farkouh RA,Strutton DR,Shea KM,Edelsberg J .肺炎球菌结合疫苗时代患有慢性疾病的儿童患肺炎球菌疾病的风险。临床感染疾病。2014年9月1日;59(5):615-23.
- 努瓦蒂JP,惠特尼CG。预防婴幼儿肺炎球菌疾病-使用13价肺炎球菌结合疫苗和23价肺炎球菌多糖疫苗-免疫实践咨询委员会的建议(ACIP)。MMWR推荐代表2010年12月10日;59(Rr-11):1-18。
- 塔尔伯特TR,哈特特TV,米切尔E,哈拉萨NB,阿波加斯特PG,波赫林卡,等。哮喘是侵袭性肺炎球菌疾病的一个危险因素。新英格兰医学杂志。2005;352(20):2082-90.
- Pilishvili T,Zell ER,Farley MM,Schaffner W,Lynfield R,Nyquist AC,等。结合疫苗使用时代儿童侵袭性肺炎球菌疾病的危险因素。儿科。2010年7月;126(1):e9-17。
- 惠氏制药有限公司。20价肺炎球菌结合疫苗的安全性和免疫原性研究:健康婴儿的4剂系列。纽约州纽约市:惠氏制药有限责任公司;2020.
- Senders S,Klein NP,Lamberth E,Thompson A,Drozd J,Trammel J,等。20价肺炎球菌结合疫苗在美国健康婴儿中的安全性和免疫原性。儿科传染病杂志2021年10月1日;40(10):944-51.
- 惠氏制药有限公司。20vPnC在15个月至17岁健康儿童中的安全性和免疫原性研究。纽约州纽约市:惠氏制药有限责任公司;2020.
- 惠氏制药有限公司。20价肺炎球菌结合疫苗对健康婴儿的安全性研究。纽约州纽约市:惠氏制药有限责任公司;2020.
- 美国食品药品监督管理局。包装说明:PREVNAR 20。马里兰州银泉市:美国卫生与公众服务部,美国食品药品监督管理局;2022年[2023年5月23日];可从以下位置获得:https://www.fda.gov/media/149987/download.
- 对美国儿童使用20价肺炎球菌结合疫苗(PCV20)的三项经济分析的总结。美国免疫实践咨询委员会。佐治亚州亚特兰大2023年6月22日。
- Moore MR,Link-Gelles R,Schaffner W,Lynfield R,Holtzman C,Harrison LH,等. 13价肺炎球菌结合疫苗预防美国儿童侵袭性肺炎球菌疾病的有效性:一项匹配的病例对照研究柳叶刀呼吸医学。2016年5月;4(5):399-406.
- 张涛,张军,邵,冯,徐,郑波,等。13价肺炎球菌结合疫苗预防儿童社区获得性肺炎的效果观察性队列研究。疫苗。2021年7月30日;39(33):4620-7.
- 疾病控制和预防中心。幼儿(0-35个月)的疫苗接种覆盖率。2020年【引用2023年8月12日】;可从以下位置获得:https://www.cdc.gov/vaccines/imz-manager/coverage/child VAX view/interactive-reports/index . html
- 小林制药、法勒·JL、吉尔克·R、布里顿·A、查尔兹·L、雷德纳·AJ等。美国成人使用15价肺炎球菌结合疫苗和20价肺炎球菌结合疫苗:美国免疫实践咨询委员会的最新建议,2022年。MMWR莫尔布凡人周代表2022年1月28日;71(4):109-17.
- 疾病控制和预防中心。美国目前批准或授权使用新冠肺炎疫苗的临时临床考虑。亚特兰大,ga 2022[2023年5月24日];可从以下位置获得:https://www.cdc.gov/vaccines/covid-19/clinical-considerations/interim-considerations-us.html #定时-间隔-互换性。
- Mbaeyi SA,Bozio CH,Duffy J,Rubin LG,Hariri S,Stephens DS,等。脑膜炎球菌疫苗接种:免疫实践咨询委员会的建议,美国,2020年。MMWR建议2020年9月25日;69(9):1-41.
- 美国食品药品监督管理局。包装说明:Pneumovax 23。马里兰州银泉市:美国卫生与公众服务部,美国食品药品监督管理局;2020年【2023年5月23日】;可从以下位置获得:https://www.fda.gov/media/80547/download.
- 美国食品药品监督管理局。包装插页:Vaxneuvance。马里兰州银泉市:美国卫生与公众服务部,美国食品药品监督管理局;2022年[2023年5月23日];可从以下位置获得:https://www.fda.gov/media/150819/download.




