第35章:黄热病
2020年1月
黄热病 须呈报
疾病
黄热病是一种急性黄病毒感染,由受感染的蚊子叮咬传播。这种疾病发生在非洲、南美洲和中美洲(包括特立尼达岛)的部分热带和亚热带地区黄热病区科在国家旅行健康网络和中心的网站上,https://travelhealthpro.org.uk/);尽管存在这种病媒,但在亚洲从未报道过。黄热病有三种流行病学模式——城市、热带草原和丛林——尽管这种疾病在临床和病原学上是相同的。在城市黄热病中,病毒宿主是人,该疾病主要通过与人类密切生活和繁殖的埃及伊蚊在人类之间传播。在非洲,存在一个中间(热带草原)循环,涉及病毒从蚊子传播到生活或工作在丛林边界地区的人。在这个循环中,病毒可以通过蚊子从猴子传播给人类或从人类传播给人类。丛林黄热病通过森林蚊子在非人宿主(主要是猴子)中传播。当人类进入森林栖息地时,他们可能会被感染,并可能成为城市疫情的源头。在长时间的明显平静之后,黄热病可能会以爆发的形式再次出现。农村人口患黄热病的风险最大,但在非洲确实发生了城市疫情。南美洲和中美洲的城市人口也面临风险,因为城市中心再次被埃及伊蚊感染,进出流行区的人口流动增加。
黄热病的严重程度从发热、不适、畏光和头痛的非特异性、自限性症状,到突然发作的发热、呕吐和虚脱,可发展为黄疸和出血。在流行地区的当地人群中,总病死率约为5%,一旦出现黄疸和严重症状,病死率可上升至20%至30%。在非免疫旅行者和移民中,以及在黄热病活动水平低的地区流行期间,病死率可超过50% (Monath,2004)。潜伏期一般为三到六天,但也可能更长。死亡通常发生在发病后的七到十天。感染导致痊愈者终身免疫。
黄热病没有特效疗法。诸如消灭伊蚊、防止蚊虫叮咬和免疫接种等预防措施可降低风险。由于蚊虫媒介和哺乳动物宿主的广泛分布,丛林黄热病只能通过黄热病免疫接种和防止蚊虫叮咬的个人防护来预防。
由于英国不存在蚊媒,因此在英国不存在从输入病例传播的风险。
疾病的历史和流行病学
病毒基因组的序列分析表明,黄热病病毒起源于大约3000年前的非洲(Zanotto et al., 1996)。然而,最早的流行病记录是1648年在墨西哥的尤卡坦半岛。“黄热病”一词首次用于1750年发生在巴巴多斯的一次疫情。该疾病在18世纪成为美洲和西非殖民地的主要问题,并在此期间多次被引入美国和欧洲的海港(Monath,2004)。
1848年约西亚·克拉克·诺特首次提出通过蚊子传播黄热病的假设,1900年沃尔特·里德及其同事在古巴证实了这一假设。今天仍在使用的减毒活疫苗是在20世纪30年代开发的。对城市病媒的控制,加上高效疫苗,已经减少了人类病例,特别是在南美洲,但在过去十年中,该疾病又死灰复燃,估计每年至少发生200,000例病例(Robertson et al., 1996; Monath, 2001)。一项更近期的非洲疾病负担研究估计,2013年有130,000例(95%可信区间为51,000-380,000)严重YF病例,导致78,000例(95%可信区间为19,000-180,000)死亡(Garske et al.,2014)。
黄热病疫苗接种
黄热病疫苗是在无特定病原体的鸡胚中生长的17D黄热病毒株的减毒活制剂。每0.5毫升剂量含有不少于1000个小鼠LD50单位。
储存
疫苗应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
剂型
黄热病疫苗可作为用稀释剂重新配制的冻干粉末获得。
黄热病疫苗不含硫柳汞。它们包含已经减毒(修饰)的活生物体。
剂量和时间表
首剂为0.5毫升重组疫苗。如果需要,应在推荐的时间间隔内给予更多剂量。
接种
疫苗应该用制造商提供的稀释剂重新配制,要么在一小时内使用,要么丢弃。
无论年龄大小,均应通过皮下或肌肉注射给予0.5毫升剂量的黄热病疫苗。
黄热病疫苗可随时与其他灭活疫苗和大多数活疫苗一起接种(英国公共卫生部门,2015年),但MMR除外,这两种疫苗应间隔28天接种。这是因为有一些数据表明,当黄热病疫苗与MMR疫苗联合施用时,对黄热病、腮腺炎和风疹抗原的抗体反应次优(Nascimento et al., 2011)。在需要快速保护的情况下,应每隔一段时间注射两种疫苗。应考虑增加MMR的剂量,并重新接种黄热病疫苗
对于那些有持续风险的人,也可以根据具体情况考虑接种疫苗。对于没有禁忌症的人来说,再接种疫苗没有额外的风险。疫苗应该在不同的部位注射,最好是在不同的肢体。如果给药在同一个肢体,它们应该至少分开2.5厘米(美国儿科学会,2003)。每种疫苗的注射部位应在患者记录中注明。
处理
用于接种疫苗的设备,包括用过的小瓶、安瓿或注射器,应根据地方当局法规和卫生技术备忘录07-01:医疗废物的安全管理(卫生部,2013年)中的指导,通过将其放置在适当的防穿刺“锐器”箱中进行处置。
疫苗使用建议(包括再免疫)
免疫接种计划的目标是为有黄热病危险的个人提供至少一剂黄热病疫苗,并防止黄热病的国际传播。后者的目的是防止受感染的个体将病毒引入存在蚊虫媒介和合适宿主的地区,这些媒介和宿主可能支持黄热病的形成。
正确接种一次剂量可使95%至100%的受者产生免疫力。数据表明,除了一些例外情况,大多数疫苗接种者在接种疫苗后将保持潜在的几十年,或可能终生的保护性抗体滴度(世卫组织战略咨询专家小组(SAGE),2013年)。
下列人群应进行免疫接种:
- 处理受感染材料的实验室工作人员
- 前往或居住在需要国际疫苗接种或预防证书才能入境的国家(ICVP)的9个月或以上的人
- 年龄在9个月或9个月以上、正在有黄热病传播风险的地区或国家旅行或居住的人(见YF疫苗接种地图在https://travelhealthpro.org.uk/),即使这些国家不要求入境时提供免疫证明。
在注射疫苗前,应进行仔细的风险评估——参见下面的禁忌症和注意事项。应在前往流行地区前至少10天进行免疫接种,以形成保护性免疫力,并使ICVP(如果需要)生效。
然而,仍应考虑为最后一刻的旅行者接种疫苗,还应告知他们预防昆虫叮咬的重要性以及无效ICVP的可能影响。
加强免疫
世卫组织免疫战略咨询专家小组(SAGE)指出(根据现有数据,单剂黄热病疫苗似乎可提供针对黄热病的终生保护性免疫。因此,除了一些例外,不需要加强剂量的黄热病疫苗来维持免疫力(世卫组织战略咨询专家组,2013年)。
应向一小部分处于持续风险中的个体提供强化免疫,这些个体可能没有从最初的黄热病疫苗接种中获得长期保护(见图35.1)。这包括首次接种黄热病疫苗的人:
- 当年龄小于两岁时
- 怀孕期间
- 同时感染了艾滋病毒
- 当免疫受到抑制时
- 在接受骨髓移植之前
图35.1加强免疫接种
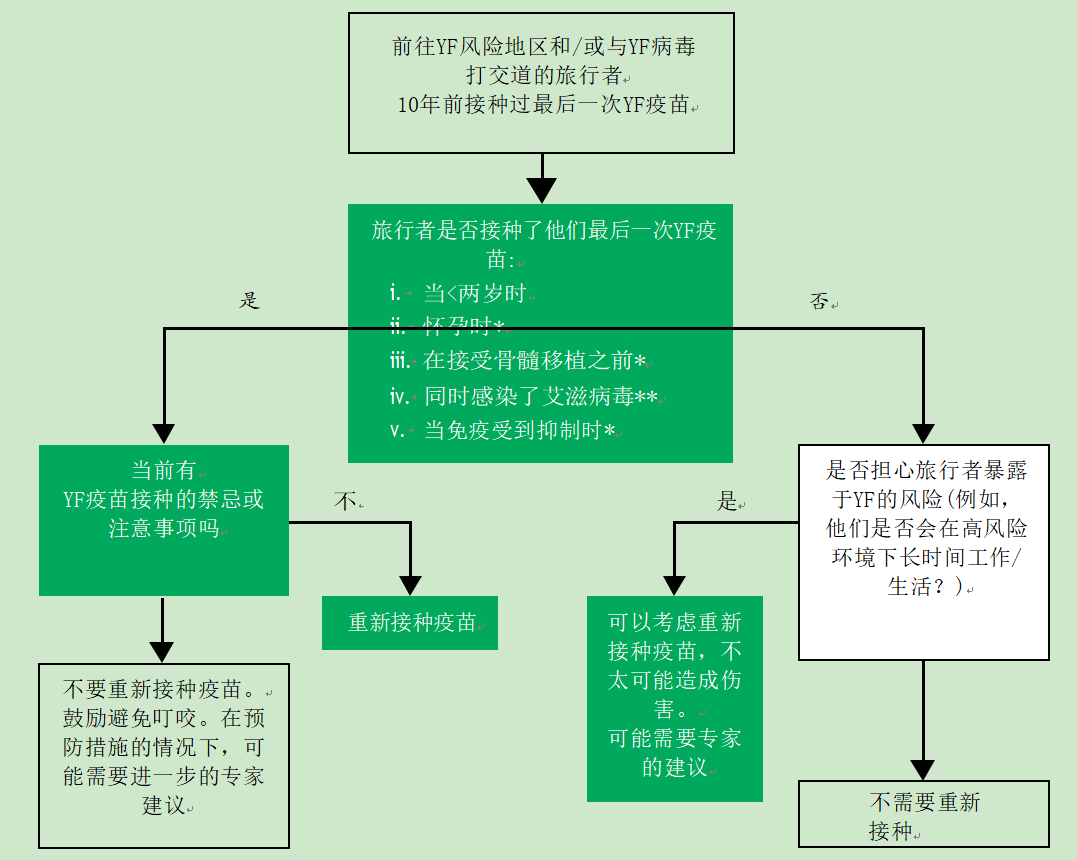
*注意再次接种的时间应基于对持续风险的个人评估,如果没有禁忌症,可在10年前考虑
* *另请参考BHIVA指南
在担心旅行者暴露于黄热病风险的某些情况下(例如,在高风险环境下长时间工作/生活),可以考虑加强剂量的YF疫苗——可以向NaTHNaC寻求专家建议(https://travelhealthpro.org.uk/)或苏格兰健康保护(www。Travax.nhs.uk)
自2016年7月11日起(适用于所有国家),黄热病疫苗证书(ICVP)将在接种疫苗者的一生中有效。世卫组织指出,不能以证件上注明的疫苗接种生效日期已经过去十年以上为由,拒绝接受抵达旅客出示的有效证件;并且不能要求加强或再接种(世卫组织,2016)。
旅行风险评估
黄热病是一种威胁生命的病毒感染,对任何去有感染风险的地区旅行的人来说,预防该疾病的保护措施是必不可少的。黄热病疫苗非常有效,是保护旅行期间有患病风险的人的最佳方式。由于疫苗接种导致严重不良事件的风险很小,对大多数人来说,疫苗的益处和可能的副作用之间的平衡仍然是压倒性有利的(CHM,2019)。然而,由于疫苗含有活的、减毒的黄热病毒株,严格遵守禁忌症和预防措施对于降低那些因年龄、免疫系统减弱或潜在疾病而具有较高风险的人的严重副作用风险至关重要(见下面的预防措施和禁忌症一节)。
随着对与黄热病疫苗相关的罕见严重不良事件的认识(疾病控制和预防中心(CDC),2002;基奇纳,2004;CHM,2019),在接种疫苗之前进行仔细的风险评估,权衡获得感染的风险和疫苗引起的严重不良事件的风险,这一点至关重要。应仔细检查行程,以确保疫苗只接种给那些被认为有感染风险的人和需要ICVP的人(见下文)。一般来说,前往非洲流行地区旅行的黄热病风险被认为比前往南美洲旅行的风险高十倍(世卫组织,2013年),然而,旅行者感染的风险取决于他们的行程、旅行季节和计划的活动,并且在疫情爆发期间会更高,正如最近在安哥拉(2016年)和巴西(2017/18年)爆发期间所显示的那样(见世卫组织黄热病网页:https://www.who.int/csr/disease/yellowfev/en/).
关于给旅行者的建议的更多细节可以在NaTHNaC网站上找到,https://travelhealthpro.org.uk/.
国际疫苗接种或预防证书
根据《2005年国际卫生条例》,成员国可能要求将黄热病免疫接种作为入境条件。需要有效的ICVP作为证据。世卫组织每年在《国际旅行与健康》上公布国家要求(可在www.who.int/ith),以及NaTHNaC国家信息页面http://travelhealthpro.org.uk/countries.
自2016年7月11日起,ICVP自初次免疫接种后第10天起对接种者终身有效。
禁忌症
当推荐接种黄热病疫苗时,极少数人不能接种。标准化清单可从NaTHNaC获得(https://travelhealthpro.org.uk/)或苏格兰健康保护局(www.Travax.nhs.uk)并应在接种黄热病疫苗前使用。如有疑问,应向旅行健康专家寻求适当的建议。
疫苗不应用于:
- 六个月以下的婴儿
- 对先前剂量的黄热病疫苗有过敏反应的人
- 对疫苗的任何成分(包括鸡蛋)有过敏反应的人
- 有胸腺疾病史或因任何原因进行胸腺切除术(包括附带的胸腺切除术)的人(例如,在心脏手术期间)
- 由于先天条件或疾病过程导致的原发性或获得性免疫缺陷,包括有症状的HIV感染,以及伴随免疫功能受损证据的无症状HIV感染
- 因接受治疗(包括高剂量全身性类固醇、免疫抑制生物疗法、放疗或细胞毒性药物)而导致免疫抑制的患者(参见第6章第4页和下文的注意事项部分)
- 前往世卫组织一般不建议接种黄热病疫苗的地区的60岁或以上老人
- 有YEL一级家族史(AVD或YEL)并接种了与已知医疗风险因素无关的疫苗的人
患有上述任何疾病且必须旅行的患者应被告知黄热病的风险,并被告知避免蚊虫叮咬的措施。对于那些打算访问需要黄热病预防ICVP才能入境的国家的人,黄热病疫苗接种中心或治疗病人的医生应出具一份豁免书。目的地的港口卫生当局应考虑到这一点。
没有发烧或全身不适的小病不是推迟免疫接种的正当理由
如果个人急性不适,应推迟免疫接种,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
预防措施
60岁或以上的人
由于60岁或60岁以上的人发生威胁生命的神经和内脏不良事件(见下文)的风险更大,因此只有当存在重大且不可避免的感染黄热病的风险时,例如旅行到当前或定期存在黄热病传播风险的地区时,才应给这些人接种疫苗。
世卫组织指定为“一般不”推荐或不推荐接种疫苗的国家和地区应被视为不存在“重大且不可避免的风险(英国人类药物委员会,2019年).请参阅上的疫苗推荐地图黄热病区关于的部分https://travelhealthpro.org.uk).
怀孕
黄热病疫苗一般不应给孕妇接种,因为理论上存在活病毒疫苗导致胎儿感染的风险。应该建议孕妇不要去高风险地区旅行。当旅行不可避免时,疾病的风险和疫苗的理论风险必须根据个人情况进行评估。两项孕妇接种疫苗的研究表明,对胎儿没有不良影响(Nasidi et al., 1993; Tsai et al., 1993),但经胎盘传播已在妊娠早期发生(Tsai et al.,1993)。世卫组织表示,在黄热病流行的地区,或在疫情爆发期间,接种疫苗的益处可能远远超过疫苗的风险。孕妇应被告知疫苗接种的潜在益处和风险,以便她们可以做出知情决定(世卫组织,2013年)。妊娠结束后仍有风险的妇女应再次接种疫苗。
母乳喂养
有证据表明,两个月以下的婴儿可以通过母乳感染活疫苗病毒。对于正在哺乳9个月以下婴儿的妇女,应向NaTHNaC寻求专家建议(https://travelhealthpro.org.uk/)或苏格兰健康保护(www。Travax.nhs.uk)接种黄热病疫苗前。
婴儿
虽然风险很小,但9个月以下的婴儿患疫苗相关脑炎的风险较高,风险与年龄成反比。六个月以下的婴儿不应接种疫苗(Tsai et al.,1993)。应给出避免蚊虫叮咬的建议(参见上述禁忌)。六至九个月大的婴儿只应在详细的风险评估后进行免疫接种。对于这一年龄组,通常仅在黄热病感染风险被认为较高时,如在流行病/疫情期间,才建议接种疫苗。如果旅行,旅行期间感染黄热病的风险是不可避免的;应就是否接种疫苗征求专家意见。
免疫抑制和艾滋病毒感染
黄热病疫苗接种禁忌用于原发性或获得性免疫缺陷患者和免疫抑制治疗,包括生物制剂(见绿皮书第6章,禁忌症和特殊考虑,免疫抑制的细节和例子)。如果医疗保健医生担心治疗的性质(包括免疫抑制或免疫调节的生物制剂)或免疫抑制的程度,他们应寻求专家的建议。
除非感染黄热病的风险不可避免,否则无症状的艾滋病毒感染者不应接种疫苗。目前没有足够的数据来确定免疫学参数,这些参数可以区分可以安全接种疫苗的人和可以产生保护性免疫反应的人,以及接种疫苗既危险又无效的人。然而,来自数据的有限证据表明,黄热病疫苗可以安全地给予CD4计数大于200且病毒载量被抑制的HIV感染者(Receveur et al., 2000; Tattevin et al., 2004)。在这些情况下,应该寻求专家的建议。HIV阳性者的抗体反应可能减弱(Sibailly et al., 1997)(参见加强免疫图35.1和Chapter 6).
皇家儿科和儿童健康学院(www.rcpch.ac.uk),英国HIV协会2015年HIV感染成人免疫指南(BHIVA,2015:http://bhiva.org/vaccination-guidelines.aspx)以及英国和爱尔兰儿童艾滋病协会(CHIVA)免疫指南(http://www.chiva.org.uk/指南/免疫接种/)。
许多患有慢性炎症性疾病(如类风湿性关节炎、炎症性肠病、银屑病、肾小球肾炎)的成年人将接受稳定的长期低剂量皮质类固醇治疗(定义为成人每天高达20mg泼尼松龙超过14天,或20kg以下的儿童每天1mg/kg ),单独或与其他免疫抑制药物联合使用。单独或与低剂量非生物口服免疫调节药物联合的长期稳定的低剂量皮质类固醇疗法(如成人每周25毫克的甲氨蝶呤或儿童高达15毫克/平方米的甲氨蝶呤,硫唑嘌呤3.0毫克/千克/天或6-巯基嘌呤1.5毫克/千克/天),被认为是不够的免疫抑制,这些患者通常可以接种活疫苗。然而,就黄热病疫苗而言,数据有限,建议采取谨慎的方法。在这种情况下,可以寻求专家的建议。
不良反应
黄热病疫苗后的不良反应通常是轻微的,包括头痛、肌痛、低烧和/或注射部位疼痛,10%至30%的受试者会出现这种不良反应((Freestone et al., 1977; Lang et al., 1999; Monath et al., 2002)。注射部位反应往往发生在免疫接种后的第一至第五天。全身性副作用也会在早期出现,但可能会持续长达两周(Monath et al., 2002)。多达1%的人可能需要改变日常活动。反应更可能发生在先前对黄热病病毒没有免疫力的人身上(Monath et al., 2002;Moss-Blundell et al., 1981)。
皮疹、荨麻疹、支气管痉挛和过敏反应很少发生。在美国的被动监测系统中,估计了黄热病疫苗接种后过敏反应的报告率每100,000剂分发量为1.3(Lindsey et al., 2016)。反应很可能与疫苗中的鸡蛋蛋白有关。有些人可能对某些黄热病疫苗以及其他疫苗中用作稳定剂的明胶敏感并产生反应。
自从早期使用疫苗以来,疫苗后脑炎被认为是一种罕见的事件。这尤其见于婴儿(见上文),早期报告表明,六个月以下婴儿的发病率为每1000名婴儿0.5至4例(Tsai et al.,1993)。自2001年以来,一种新的神经系统不良事件被认为发生在老年人身上(CDC,2002;Kitchener,2004)。认识到这一点后,一项回顾性调查揭示了20世纪90年代发生的其他案例。这些事件现在被称为黄热病疫苗相关神经系统疾病(YEL-AND)。这种新的神经事件模式的临床表现在接种疫苗后2至56天开始,出现发热和头痛,可能进展为包括一种或多种意识模糊、局灶性神经缺损、昏迷和格林-巴利综合征。这些病例的脑脊液显示出蛋白增多的嗜酸性粒细胞增多症,并且在检测时出现黄热病病毒特异性IgM抗体。临床课程通常是为了完全康复。几乎所有病例都发生在没有潜在黄热病免疫的初级疫苗接种者中。
黄热病疫苗相关的嗜内脏疾病(YEL-AVD)是一种发热和多器官衰竭的综合征,类似于2001年首次描述的严重黄热病(CDC, 2001; Chan et al., 2001; Martin et al., 2001a; Vasconcelos et al., 2001)。接种疫苗后1至18天,患者出现发热、不适、头痛和肌痛,并发展为肝炎、低血压和多器官衰竭;在60%以上的报告病例中出现了死亡。已从几个病例中分离出疫苗衍生病毒,并在尸检样本中检测到黄热病病毒抗原(Martin et al., 2001a)。与YEL和一样,所有病例都发生在没有潜在黄热病免疫的初级疫苗接种者中。在内脏型疾病的报告中,23例中有4例(17%)有胸腺疾病史,随后行胸腺切除术(Barwick Eidex,2004)。因此,所有患有胸腺疾病或做过胸腺切除术的患者都不应接种疫苗(参见上文禁忌症一节)。
根据报告的病例和分发的黄热病疫苗剂量数量,美国神经系统疾病和内脏营养疾病的报告率分别为每100,000剂0.8和0.3(Lindsey et al., 2016)。这些估计与基于欧洲报告病例的估计相似(Kitchener,2004)。根据目前的证据,对于60岁或以上的个体,神经和内脏不良事件的风险增加数倍,据报道分别为每100,000剂约2.2和1.2(Lindsey et al., 2016)。
继2018年和2019年英国发生两起黄热病疫苗致命不良反应后,英国人类药物委员会(CHM)成立了一个专家工作组,就应采取的措施提出建议,以优化疫苗的效益和风险之间的平衡。EWG建议,当按照产品特性概要(SmPC)中当前授权的适应症使用时,黄热病疫苗的益处和风险的平衡对大多数旅行者仍然有利。CHM建议采取强化措施,最大限度地降低免疫系统脆弱人群(尤其是60岁或以上的老年人以及患有以下疾病的人)与黄热病疫苗接种相关的罕见但严重且致命的不良事件的潜在风险
他们的胸腺被切除(见上文禁忌症一节)。有关更多详细信息,请参见报告(人类药物委员会,2019年)。
可疑的不良反应应通过黄卡计划报告给MHRA药品和保健品管理局(https://yellowcard.mhra.gov.uk/).
黄热病疫苗接种中心
黄热病疫苗只能在根据世卫组织国际卫生条例建立的“指定”黄热病疫苗接种中心进行接种。
在英格兰、威尔士和北爱尔兰,卫生部、威尔士议会政府和北爱尔兰卫生、社会服务和公共安全部已将管理青年旅舍的责任移交给国家旅行卫生网络和中心(NaTHNaC),该组织成立于2003年,致力于为卫生专业人员提供信息并制定旅行医学标准。
在英格兰、威尔士和北爱尔兰(EWNI)获得批准的YFVCs列表可在以下网址找到:http://nathnacyfzone.org.uk/search-centres
关于成为EWNI的YFVC的信息,包括关于旅行医学的强制性黄热病疫苗培训临床信息,可在NaTHNaC网站上获得,网址为https://travelhealthpro.org.uk/
苏格兰的从业者应申请:
健康保护苏格兰旅行健康科(黄热病)苏格兰国民保健服务
格拉斯哥加多根街5号Meridian Court 4楼G2 6AT
行政查询:电话- 0141 300 1948电邮:nss.hps.yellowfever@nhs.net
供应
所有用于预防黄热病的疫苗都必须得到世卫组织的批准。目前在英国有一种世卫组织批准的许可疫苗——Stamaril(赛诺菲巴斯德,电话01483 505515,http://www.sanofi.co.uk)
疫苗以冻干粉和溶剂的形式供应给指定的中心,仅供注射用。
疫苗以冻干粉和溶剂的形式提供给指定的注射中心。
参考
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red Book: 2003 Report of
the Committee on Infectious Diseases, 26th edition. Elk Grove Village, IL: American Academy of Pediatrics, p33.
Barwick Eidex R (2004) History of thymoma and yellow fever vaccination (letter) for the Yellow Fever Vaccine
Safety Working Group. Lancet 364: 931.
British HIV Association guidelines for immunization of HIV-infected adults 2008. HIV Medicine (2008), 9,
795–848
CDC (2001) Fever, jaundice, and multiple organ system failure associated with 17D-derived yellow fever
vaccination, 1996–2001. MMWR 50: 643–5
CDC (2002) Adverse events associated with 17D-derived yellow fever vaccination – United States, 2001–
2002. MMWR 51: 989–93.
Cetron MS, Marfin AA, Julian KG et al., (2002) Yellow fever vaccine. Recommendations of the Advisory
Committee on Immunization Practices (ACIP). MMWR 51 (No. RR-17): 1–10.
Chan RC, Penney DJ, Little D et al., (2001) Hepatitis and death following vaccination with 17D-204 yellow
fever vaccine. Lancet 358: 121–2.
Commission on Human Medicines (2019). Report of the Commission on Human Medicine’s Expert Working
Group on benefit-risk and risk minimisation measures. Published 21 November 2019. Available at : https://
www.gov.uk/government/publications/report-of-the-commission-on-human-medicines-expert-working-groupon-benefit-risk-and-risk-minimisation-measures-of-the-yellow-fever-vaccine
Department of Health (2001) Health information for overseas travel, 2nd edition. London: TSO.
Department of Health (2013) Health Technical Memorandum 07-01: Safe management of healthcare waste.
https://www.gov.uk/government/uploads/system/uploads/attachment_ data/file/167976/HTM_07-01_Final.pdf.
Accessed December 2013.
Freestone DS, Ferris RD, Weinberg AL and Kelly A (1977) Stabilized 17D strain yellow fever vaccine: dose
response studies, clinical reactions and effects on hepatic function. J Biol Stand 5: 181–6.
Garske T, Van Kerkhove MD, Yactayo S, Ronveaux O, Lewis RF, et al., (2014) Yellow Fever in Africa:
Estimating the Burden of Disease and Impact of Mass Vaccination from Outbreak and Serological Data.
PLoS Med 11(5): e1001638. doi:10.1371/journal. pmed.1001638
Kengsakul K, Sathirapongsasuti K and Punyagupta S (2002) Fatal myeloencephalitis following yellow fever
vaccination in a case with HIV infection. J Med Assoc Thai 85: 131–4.
Kitchener S (2004) Viscerotropic and neurotropic disease following vaccination with the 17D yellow fever
vaccine, ARILVAX((R)). Vaccine 22: 2103–5.
Lang J, Zuckerman J, Clarke P et al., (1999) Comparison of the immunogenicity and safety of two 17D yellow
fever vaccines. Am J Trop Med Hyg 60: 1045–50.
Lindsay NP Rabe IB, Miller IR, Fischer M, and Staples JE (2016) Adverse event reports following yellow fever
vaccination, 2007–13. J. of Trav. Med. Vol. 23, No. 5.
Martin M, Tsai TF, Cropp B et al., (2001a) Fever and multisystem organ failure associated with 17D-204
yellow fever vaccination: a report of four cases. Lancet 358: 98–104.
Monath TP (2001) Yellow fever: an update. Lancet Infect Dis 1: 11–20.
Monath TP (2004) Yellow fever vaccine. In: Plotkin SA and Orenstien WA (eds) Vaccines, 4th edition
Philadelphia: Elsevier WA , pp 1095–176.
Monath TP, Gershman M, Staples JE, Barrett AD (2013) Yellow fever vaccine. In: Plotkin SA, Orenstien WA
and Offit PA (eds) Vaccines, 6th edition Philadelphia: ElsevierSaunders, pp 870-968.
Monath TP, Nichols R, Archambault WT et al., (2002) Comparative safety and immunogenicity of two yellow
fever 17D vaccines (ARILVAX and YF-VAX) in a phase III multicenter, double-blind clinical trial. Am J Trop Med
Hyg 66: 533–41.
Moss-Blundell AJ, Bernstein S, Shepherd WM et al., (1981) A clinical study of stabilized 17D strain live
attenuated yellow fever vaccine. J Biol Stand 9: 445–52.
Nascimento Silva JR Camacho LA, Siqueira MM, et al., (2011) Mutual interference on the immune response
to yellow fever vaccine and a combined vaccine against measles, mumps and rubella. Vaccine. 29:6327-34
Nasidi A, Monath TP, Vandenberg J et al., (1993) Yellow fever vaccination and pregnancy: a four-year
prospective study. Trans R Soc Trop Med Hyg 87: 337–9.
Public Health England (2015) Revised recommendations for administering more than one live vaccine, 24
April 2015, PHE publications gateway number: 2015015.
Receveur MC, Thiebaut R, Vedy S et al., (2000) Yellow fever vaccination of human immunodeficiency virusinfected patients: report of two cases. Clin Infect Dis 31: E7–8.
Robertson SE, Hull BP, Tomori O et al., (1996) Yellow fever. A decade of re-emergence. JAMA 276: 1157–62.
Sibailly TS, Wiktor SZ, Tsai TF et al., (1997) Poor antibody response to yellow fever vaccination in children
infected with Human Immunodeficiency Virus Type 1. Pediatr Infect Dis J 16: 1177–9.
Tattevin P, Depatureaux AG, Chapplain JM et al., (2004) Yellow fever vaccine is safe and effective in HIVinfected patients. AIDS 18: 825–7.
Tsai TF, Paul R, Lynberg MC and Letson GW (1993) Congenital yellow fever virus infection after immunization
in pregnancy. J Infect Dis 168: 1520–3.
Vasconcelos PF, Luna EJ, Galler R et al., (2001) Serious adverse events associated with yellow fever 17DD
vaccine in Brazil: a report of two cases. Lancet 358: 91–7.
World Health Organization (2013) Vaccines and vaccination against yellow fever WHO Position Paper – June
2013, Weekly Epidemiological Record, 5 July, No. 27, 88, 269–284
World Health Organization (2016) Amendment to International Health Regulations (2005), Annex 7 (yellow
fever)
World Health Organization SAGE working group (2013) Backgroud paper on yellow fever vaccine, 19 March
2013.
Zanotto PM, Gould EA, Gao GF et al., (1996) Population dynamics of flaviviruses revealed by molecular
phylogenies. Proc Natl Acad Sci USA 93: 548–53.




