第34章:水痘
2015年8月 应通知
疾病
水痘是由水痘带状疱疹(VZ)病毒引起的急性、高度传染性疾病。
这种疾病通常开始于一至两天的发烧和不适,尽管这可能不存在,特别是在幼儿中。面部和头皮开始出现水疱,扩散到躯干和腹部,最终扩散到四肢。三或四天后,水疱变干,形成颗粒状痂,随后通常会出现新的水疱。水疱可能少到被遗漏,也可能多到汇合,覆盖身体的大部分。在最初的几天里,病毒在鼻咽中以及在它们干涸之前的小泡中大量存在;感染期是皮疹出现前的一到两天,直到水疱变干。免疫抑制患者的这一过程可能会延长。用高剂量口服阿昔洛韦和类似物或全身性阿昔洛韦的早期治疗缩短了囊泡的持续时间和数量(Balfour et al., 1992; Dunkle et al., 1991)。
带状疱疹(shingles)是由患者水痘病毒的重新激活引起的。来自病灶的病毒可传播给易感个体,导致水痘,但没有证据表明带状疱疹可从另一个水痘患者身上获得。虽然多见于老年人,但也可发生于儿童,尤其常见于任何年龄的免疫抑制个体。囊泡出现在皮区,代表病毒一直处于休眠状态的颅神经节或脊神经节。受影响的地区可能会非常疼痛,并伴有感觉异常。
水痘通过个人接触或飞沫传播直接传播。潜伏期为一至三周。与水痘病例有家庭接触的二次感染率可高达90%。这种感染在10岁以下的儿童中最常见,通常会导致轻微的疾病。
这种疾病在成人中可能更严重,特别是孕妇和吸烟者,因为他们有更大的爆发水痘肺炎的风险。怀孕妇女在第二孕期后期或第三孕期早期面临的风险最大;1985年至1998年间,英格兰和威尔士因妊娠水痘死亡的9人中,有7人发生在妊娠27至32周之间(Enders and Miller, 2000)。对于新生儿和免疫抑制个体,播散性或出血性水痘的风险大大增加。
母亲水痘对胎儿和新生儿的风险与母亲感染的时间有关(Enders et al., 1994; Miller et al., 1990):
怀孕前20周——先天性(胎儿)水痘综合征,包括肢体发育不全、小头畸形、白内障、生长迟缓和皮肤结疤。死亡率很高。从现有的最大的前瞻性研究来看,估计怀孕前12周的发病率低于1%,怀孕13至20周的发病率约为2%(Endersetal.,1994)。在这项研究中,在妊娠20周后发生水痘的477例妊娠中,没有先天性水痘综合征病例发生。
妊娠中期和晚期——健康婴儿出现带状疱疹。偶尔的胎儿损伤包括视网膜脉络膜损伤,小头畸形和皮肤疤痕后母亲水痘在20到28周的妊娠被报道(Tan and Koren, 2005),但风险可能大大低于典型的先天性水痘综合征发生后母亲水痘在前20周的妊娠。
- 分娩前一周到分娩后一周——新生儿出现严重甚至致命的疾病。在英国引入人类水痘带状疱疹免疫球蛋白(VZIG)之前,一岁以下婴儿死亡中有一半发生在小于三周的婴儿中,这些婴儿在出生前或出生时或出生后第一周内感染。
疾病的历史和流行病学
水痘的发病率是季节性的,通常在3至5月达到高峰,尽管近年来季节性不太明显。由于水痘在儿童时期非常常见,在英国长大的成人中有90%是免疫的。
带状疱疹不如水痘常见,在老年人中发病率最高。带状疱疹的发病率随着年龄的增长而增加,大约四分之一的成年人在其一生中将经历一次发作(Miller et al., 1993)。
水痘疫苗接种
水痘疫苗是冻干制剂,含有来自水痘带状疱疹病毒Oka株的减毒活病毒。目前有两种疫苗:Varilrix (Oka-RIT)和Varivax (Oka/Merck)。复溶时,两种制剂的剂量都应为0.5毫升。虽然没有关于可互换性的数据,但使用不同的疫苗很可能可以有效地完成一个疗程。
水痘疫苗不含硫柳汞。它们含有已经减毒的活生物体。
疫苗病毒从具有免疫能力的接种者向易感的密切接触者的传播偶尔有记录,但风险非常低。在没有疫苗接种后皮疹的情况下的传播还没有记录(Annunziato and Gershon, 2000)。
两剂疫苗接种方案为儿童提供了约98%的保护(Shapiro et al., 2011),为青少年和成人提供了约75%的保护(Annunziato and Gershon, 2000)。在这两个年龄组中,大多数突破性感染都得到改善,接种疫苗的水痘患者比未接种疫苗的患者病变更少,全身不适也更少。
人水痘带状疱疹免疫球蛋白
在英国有两种许可的VZIG制剂:在英国和威尔士销售的VZIG由Elstree的生物产品实验室(BPL)生产;在苏格兰和北爱尔兰,它是由爱丁堡的蛋白质分离中心(PFC)提供的。
VZIG是从具有适当高滴度的VZ抗体的非英国献血者的混合血浆中制备的。VZIG的供应受限于是否有合适的捐赠者,其使用仅限于风险最大的人群和有证据表明可能有效的人群。
由于理论上存在从血浆产品传播vCJD的风险,英国使用的VZIG现在是从英国以外的血浆中制备的,并且供应稀缺。所有献血者都要接受艾滋病毒、乙型肝炎和丙型肝炎的筛查,所有血浆库都要检测是否存在这些病毒的RNA。生产过程中包括包膜病毒的溶剂去污剂灭活步骤。
储存
未配制的疫苗及其稀释液应储存在+2℃至+8℃的原包装中,并避光保存。所有疫苗在某种程度上都对冷热敏感。高温加速了大多数疫苗效力的下降,从而缩短了它们的保质期。除非储存在正确的温度下,否则无法保证疫苗的有效性。冷冻可能导致某些疫苗的反应原性增加和效力丧失。它还会在容器中产生细小的裂纹,导致内容物被污染。
VZIG应储存在+2℃至+8℃的冰箱中。这些产品可耐受环境温度长达一周。如果需要,可以在冷链外用坚固的包装分发。
剂型
水痘疫苗可作为用稀释剂重构的冻干制剂获得。
- Varilrix是一种粉红色的颗粒,复溶后可能会从粉红色变为红色。
- Varivax是一种灰白色粉末,复溶后会产生透明、无色至淡黄色的液体。
冻干悬浮液复溶后,疫苗必须在一小时内使用。重构后一小时丢弃任何未使用的疫苗。
VZIG是一种清澈的淡黄色或浅棕色溶液,分装在小瓶中,含有250毫克蛋白质,溶解在大约2-3毫升液体中(最低效价为每毫升100国际单位的VZ抗体),并添加了氯化钠。
剂量和时间表
水痘疫苗接种
一岁以上的儿童和成人
一岁或一岁以上的儿童和成人应接种两剂水痘疫苗,间隔4至8周(当然间隔不得少于4周)。
水痘带状疱疹免疫球蛋白
BPL和PFC产品的剂量均为:
- 0-5岁,250毫克(一小瓶)
- 6-10岁,500毫克(两小瓶)
- 11-14岁,750毫克(三小瓶)
- 15岁或以上,1000毫克(四小瓶)。
如果三周后出现第二次暴露,则需要增加剂量。
不能进行肌内注射的出血性疾病接触者应改为静脉注射正常免疫球蛋白,剂量为0.2g体重(即5%溶液为4ml/kg)。这将产生相当于用VZIG达到的血清VZ抗体水平(Paryani et al., 1984)。
接种
Varilrix只能通过深层皮下注射给药。
Varivax可通过肌肉注射或深层皮下注射给药。
水痘疫苗可以并且理想地应该(见下文)与MMR等其他活疫苗同时接种。疫苗应该在不同的部位注射,最好是在不同的肢体。如果给药在同一个肢体,它们应该至少分开2.5厘米(美国儿科学会,2003)。应在个人记录中注明每种疫苗的注射地点。
如果同时给予活疫苗,那么每种疫苗病毒将开始复制,并对每种疫苗产生适当的免疫反应。接种活疫苗后,会产生天然干扰素作为对疫苗的反应。如果在这种反应期间给予第二种活疫苗,干扰素可以防止第二种疫苗病毒的复制。这可能会减弱对第二种疫苗的反应。基于MMR疫苗可导致水痘疫苗反应减弱的证据(Mullooly and Black, 2001),目前推荐的活疫苗间隔为4周。因此,如果不能同时接种活疫苗,建议间隔四周。
VZIG通过在臀部或大腿前外侧的上外象限进行肌肉注射。
当VZIG用于预防水痘时,必须记住它可能会干扰活病毒疫苗的主动免疫的后续发展。如果已经首先注射了免疫球蛋白,那么在注射活病毒疫苗之前应该间隔三个月。如果在接种活疫苗的三周内注射了免疫球蛋白,则应在三个月后再次接种。这不适用于黄热病疫苗,因为VZIG不含大量针对该病毒的抗体。
处理
根据地方当局法规和技术备忘录07-01(卫生部,2006年)中的指导,用于疫苗接种的设备,包括用过的小瓶、安瓿或部分卸出的疫苗,应在一次治疗结束时通过密封在适当的、防刺穿的“锐器”盒中进行处置。
疫苗使用建议
暴露前疫苗接种
水痘免疫接种的目的是保护那些最有可能患严重疾病的人免受感染。这是通过对与高危人群经常或密切接触的特定个人进行免疫接种来实现的。自2003年以来,这一建议包括为非免疫医护人员接种疫苗,他们自己也将受益,因为他们将受到保护,不会与传染性患者接触。水痘疫苗也推荐用于免疫功能低下患者的健康易感的密切家庭接触者。
建议非免疫组接受暴露前疫苗接种
医护人员(见图34.1)
医护人员的定义包括在普通诊所和医院工作并与患者接触的人员,如病房清洁工、餐饮人员、救护人员、普通诊所接待员以及医疗和护理人员,无论是直接雇用还是通过合同雇用。
有明确水痘或带状疱疹病史者可考虑保护。有水痘或带状疱疹阴性或不确定病史的医护人员应进行血清学检测,疫苗仅提供给没有VZ抗体的人。最近的一项调查显示,在海外出生和长大的个人中,水痘病史是一个不太可靠的免疫预测指标(MacMahon et al., 2004),应考虑常规检测。
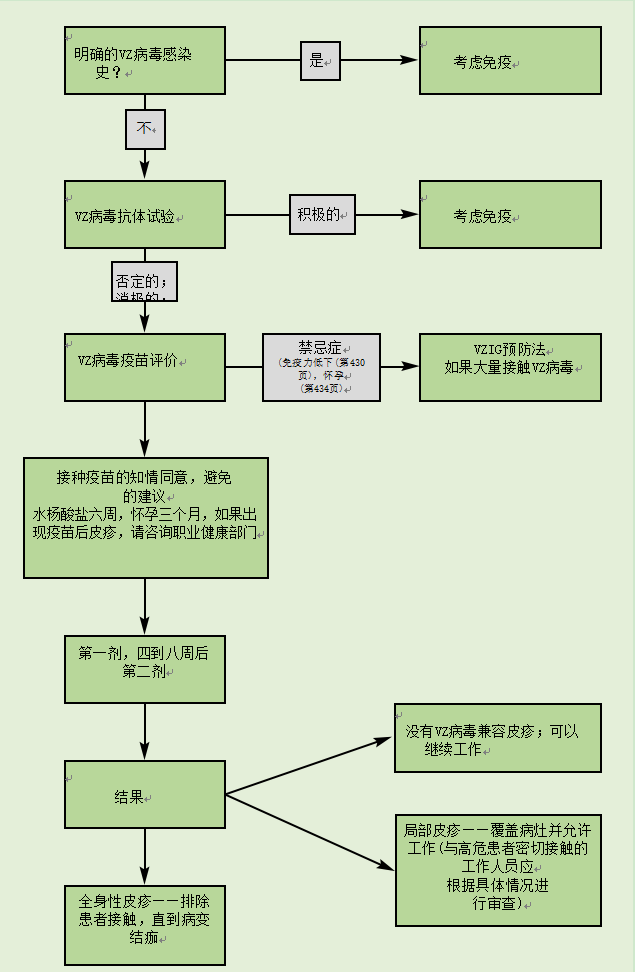
图34.1医护人员接种疫苗的程序
应在接种疫苗时告知医护人员,他们可能会在注射部位周围出现局部皮疹,或在接种疫苗后一个月内出现更广泛的皮疹。在这两种情况下,他们都应该在开始工作前向职业健康部门报告,进行评估。如果皮疹是全身性的,并且与疫苗相关的皮疹(丘疹或水疱)一致,医务人员应避免接触患者,直到所有病变结痂。患有局部疫苗皮疹的医护人员可以用绷带和/或衣服覆盖,应允许他们继续工作,除非与免疫功能低下或怀孕的患者接触。在后一种情况下,应进行个体风险评估。
疫苗接种后的血清学检测通常不被推荐,但对于处理高危患者的医疗单位(如移植单位)的医护人员是可取的(Breuer, 2003)。
职业卫生部门应访问健康保护局(HPA)、水痘带参考服务、巴茨和伦敦NHS信托(www.clinical-virology.org/pages/vzrl/vzrl_summary.的网站提供关于医疗保健工作者与无法进行血清转化的脆弱患者一起工作的建议。职业卫生部门还可从巴茨和伦敦国民保健服务信托基金的参考实验室获得关于疫苗皮疹管理的建议(疫苗接种后的皮疹样本可送到水痘带状疱疹参考服务中心的HPA进行分析)。样品的说明和表格可在www.clinical-virology.org/pages/vzrl/ vzrl _summary.html上找到
实验室工作人员
应在病毒学实验室和临床传染病单位向工作过程中可能接触水痘病毒的个人提供疫苗接种。
免疫受损患者的接触者
水痘疫苗目前不推荐在儿童中常规使用。但是,建议免疫功能低下患者的健康易感接触者(如白血病患儿的兄弟姐妹,或父母正在接受化疗的患儿)继续密切接触。
大量暴露于水痘或带状疱疹后的高危个体的管理
暴露后管理的目的是保护患有严重水痘的高危人群(见下文)以及可能将感染传播给高危人群的人群(如医护人员)。
建议符合以下三个标准的个人使用VZIG预防法:
- 大量接触水痘或带状疱疹
- 增加严重水痘风险的临床病症;这包括免疫抑制患者、新生儿和孕妇(见下文)
- 没有VZ病毒抗体(见下文)。
免疫抑制患者、新生儿和孕妇的暴露后管理算法以及抗体检测建议总结如下,见图34.2、34.3和34.4。
VZ病毒重大暴露的定义
暴露的三个方面是相关的:
- 指示病例中的VZ感染类型:从具有非暴露带状疱疹损伤(例如胸腰段(躯干))的免疫活性个体获得感染的风险很小。VZIG的发放应限于与水痘接触的人,或与以下人员接触的人:
 播散性带状疱疹
播散性带状疱疹 具有暴露病变(如眼部带状疱疹)的免疫活性个体
具有暴露病变(如眼部带状疱疹)的免疫活性个体 身体任何部位出现局部带状疱疹的免疫抑制患者(其中病毒脱落可能更多)。
身体任何部位出现局部带状疱疹的免疫抑制患者(其中病毒脱落可能更多)。
- 指示病例中与皮疹发作相关的暴露时间:VZIG通常应限于在皮疹发作前48小时至皮损结痂之间暴露于水痘或播散性带状疱疹病例的患者,或暴露于局部带状疱疹的患者在皮疹发作当天至结痂。
- 接触的密切程度和持续时间:除了母亲/新生儿和持续的家庭接触之外,以下应作为需要VZIG预防的暴露类型的指南:
-
 在同一房间(例如,在一所房子或教室或有两到四张床位的医院病房)内长时间接触(15分钟或以上)。
在同一房间(例如,在一所房子或教室或有两到四张床位的医院病房)内长时间接触(15分钟或以上)。 面对面接触,例如在交谈时
面对面接触,例如在交谈时 在大型开放式病房的情况下,偶尔会有远距离空气传播的报告,应考虑向所有易感的高风险接触者提供VZIG(特别是在接触程度可能难以确定的儿科病房)。
在大型开放式病房的情况下,偶尔会有远距离空气传播的报告,应考虑向所有易感的高风险接触者提供VZIG(特别是在接触程度可能难以确定的儿科病房)。
免疫抑制患者的管理
免疫抑制患者在第6章有详细描述。它们包括:
- 具有严重原发性免疫缺陷证据的患者,例如,严重联合免疫缺陷(SCID)、Wiskott-Aldrich综合征和其他联合免疫缺陷综合征
- 所有目前正在接受免疫抑制化疗或放疗的恶性疾病患者,且在终止此类治疗后至少六个月
- 所有接受实体器官移植且目前正在接受免疫抑制治疗的患者
- 接受骨髓移植的病人至少要等到完成所有免疫抑制治疗后12个月,或患者出现移植物抗宿主病的更长时间。接种疫苗的决定应取决于移植类型和患者的免疫状态。在欧洲血液和骨髓移植小组(www.ebmt.org)和皇家儿科和儿童健康学院(www.rcpch.ac.uk)编制的最新指南中可以找到进一步的建议
- 所有接受系统性高剂量类固醇的患者,直到治疗停止后至少三个月。这将包括接受泼尼松龙口服或直肠给药的儿童,每日剂量(或其等价物)为2mg/kg/天,持续至少一周,或1mg/kg/天,持续一个月。对于成人来说,相当的剂量很难确定,但对于每天接受40毫克泼尼松龙超过一周的人,应考虑免疫抑制。偶尔,使用较低剂量类固醇的人可能会受到免疫抑制,感染风险增加。因此,在与相关的专科医生讨论时,应谨慎考虑活疫苗
- 接受其他类型免疫抑制药物(如硫唑嘌呤、环孢素、氨甲喋呤、环磷酰胺、来氟米特和较新的细胞因子抑制剂)的患者单独或与较低的类固醇的剂量。治疗后至少六个月内应征求主管医师或免疫学家的意见
- 因HIV感染而免疫抑制的患者(见下一节)。
注意:正在接受静脉注射正常免疫球蛋白替代治疗的丙种球蛋白缺乏症患者不需要VZIG(见下文)。
VZ免疫状态的确定
无论是否有水痘史,只要有可能,都应检测免疫抑制接触者。然而,在初次接触后7天内进行抗体检测时,不应延迟VZIG给药。在这些情况下,应在水痘阴性史的基础上给予VZIG。如果患者有水痘阳性病史,等待抗体结果。敏感试验未检测到VZ抗体的阳性患者应注射VZIG。
VZIG不适用于与可检测抗体的免疫抑制接触,因为VZIG提供的抗体量不会显著增加已呈阳性者的VZ抗体滴度。水痘的二次发作偶尔会发生在免疫抑制的VZ抗体阳性患者中,但这些很可能与细胞介导的免疫缺陷有关。
新生儿管理
对于母亲在分娩前7天至分娩后7天期间出现水痘(但不是带状疱疹)的婴儿,建议使用VZIG。可以在不对婴儿进行抗体检测的情况下注射VZIG。
对于母亲水痘发作后超过7天出生的婴儿或其母亲在分娩前后出现带状疱疹的婴儿,通常不需要VZIG,因为这些婴儿将具有母亲抗体。
VZIG还推荐用于:
- VZ抗体阴性的婴儿在出生后的前七天内暴露于水痘或带状疱疹(母亲除外)
- 任何年龄的VZ抗体阴性婴儿,暴露于水痘或带状疱疹,但仍需要加强或延长特殊护理。
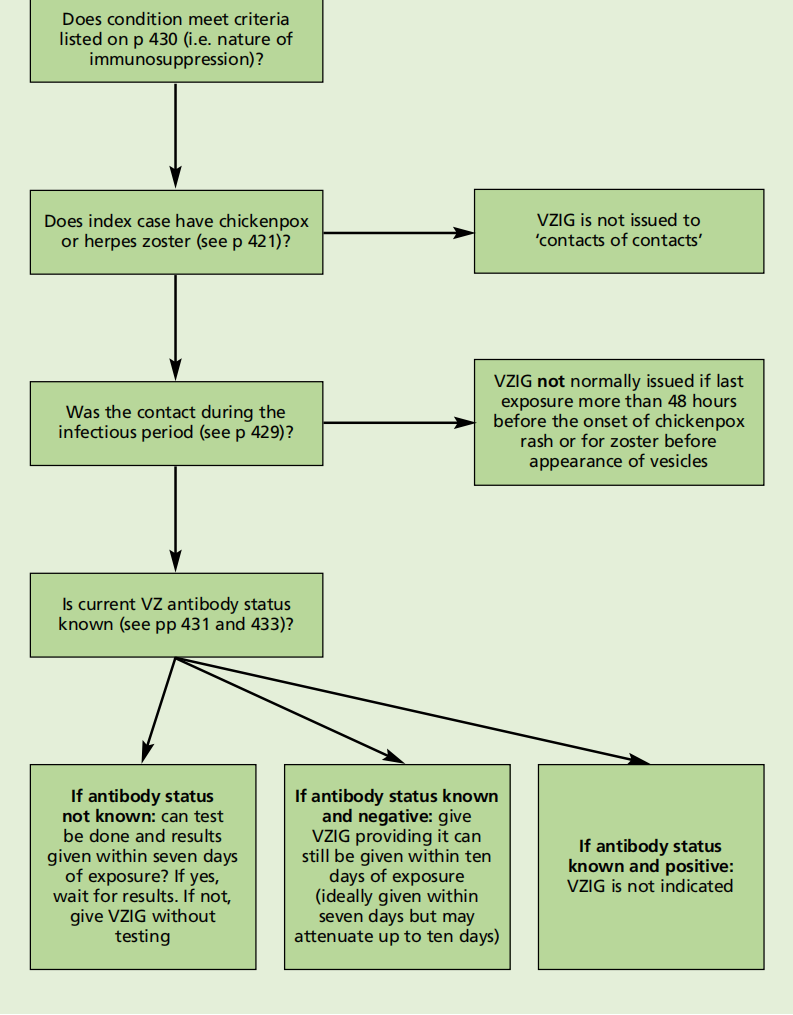
图34.2暴露于水痘带状疱疹的免疫低下患者的VZIG算法
对于这两个暴露组中在妊娠28周之前出生的婴儿,或出生时体重低于1000克的婴儿,或出生后超过60天的婴儿,或重复进行了用浓缩红细胞输注替代的血液取样的婴儿,尽管母亲有水痘阳性病史,但母亲抗体可能不存在(Patou et al., 1990; Gold et al., 1993)。建议在可能的情况下,对这些婴儿进行检测,以确定他们在接触时的VZ抗体状况。母亲有水痘阳性病史和/或VZ抗体阳性结果的其他婴儿通常会有母体抗体,不需要接种VZIG。
孕妇管理
建议在怀孕的任何阶段接触VZ抗体阴性的孕妇使用VZIG,前提是可在接触后十天内使用VZIG。然而,当VZIG供应不足时,向孕妇发放的疫苗可能会受到限制。建议临床医生在向孕妇提供VZIG之前检查其可用性(见下面的“用品”)。
有水痘阳性病史的孕妇接触者不需要接种VZIG。在注射VZIG前,有阴性病史者必须接受VZ抗体检测(见下文)。如果在初次接触后推迟10天给予VZIG,孕妇的结果不会受到不利影响(Enders and Miller, 2000; Miller et al., 1993)。即使妇女在接触后相对较晚才出现,仍有时间检测VZ抗体。
VZ免疫状态的确定
没有明确水痘病史的大多数成人和相当比例的儿童将呈VZ抗体阳性。一项英国研究发现,11%的1至5岁儿童、37%的6至16岁儿童和89%的成人在水痘阴性史的基础上接种VZIG后,VZ抗体呈阳性(Evans et al., 1980)。为了防止VZIG的浪费,所有被考虑进行VZIG的个体都应该进行VZ抗体的血清样本测试;只有没有抗体的才需要VZIG。如果需要对晚到的患者进行紧急VZ抗体检测,可在抽血检测的同时订购VZIG(见下面的“耗材”),如果结果为阳性,可将其退回。VZ抗体检测应在24至48小时内可用-向当地HPA或NHS实验室寻求建议。
在过去三个月内接受输血或静脉注射免疫球蛋白的患者中检测到的VZ抗体可能是被动获得的。尽管在以下情况下没有指示VZIG
来自其他血液制品的抗体是可检测的,在随后的暴露事件中需要重新检测,因为患者可能已经成为抗体阴性。
接受VZIG治疗的患者中,约有15%在家庭接触后仍无症状,他们可能患有亚临床感染,并且会无症状地血清转化(Evans et al., 1980;米Miller et al., 1993)。密切接触后接受过VZIG治疗的患者应在再次接触时再次接受VZ抗体检测。
VZIG预防免疫抑制患者的有效性
尽管进行了VZIG预防,但大约一半的易感免疫抑制家庭接触者将发展为临床水痘,另外15%将被亚临床感染(Evans et al., 1980)。尽管进行了VZIG预防,仍可能发生严重或致命的水痘。给予VZIG的免疫受损接触者仍应接受监测,并应在首次出现疾病迹象时使用阿昔洛韦。
新生儿
尽管进行了VZIG预防,但大约一半暴露于母亲水痘的新生儿将被感染(Miller et al., 1990))。在这些婴儿中,多达三分之二的婴儿感染轻微或无症状,但尽管在分娩前4天至分娩后2天期间出现母亲水痘发作的婴儿中进行了VZIG预防,仍有罕见的死亡病例报告。对于这种暴露类别的婴儿,尽管使用了VZIG预防,但仍发展为水痘,建议早期静脉注射阿昔洛韦进行治疗。
孕妇
孕妇使用VZIG预防的基本原理有两个方面:降低母体疾病的严重程度和降低妊娠前20周感染水痘的妇女胎儿感染的风险。据估计,怀孕的成人患致命水痘的风险比未怀孕的成人高约五倍,致命病例集中在妊娠中期晚期或妊娠晚期早期(Enders and Miller, 200)。
一项研究表明,与未进行VZIG预防的水痘患者相比,进行VZIG预防的水痘患者中先天性VZ病毒感染的风险显著降低;然而,该研究规模太小,无法评估先天性水痘综合征的风险是否降低(Enders et al.,1994)。
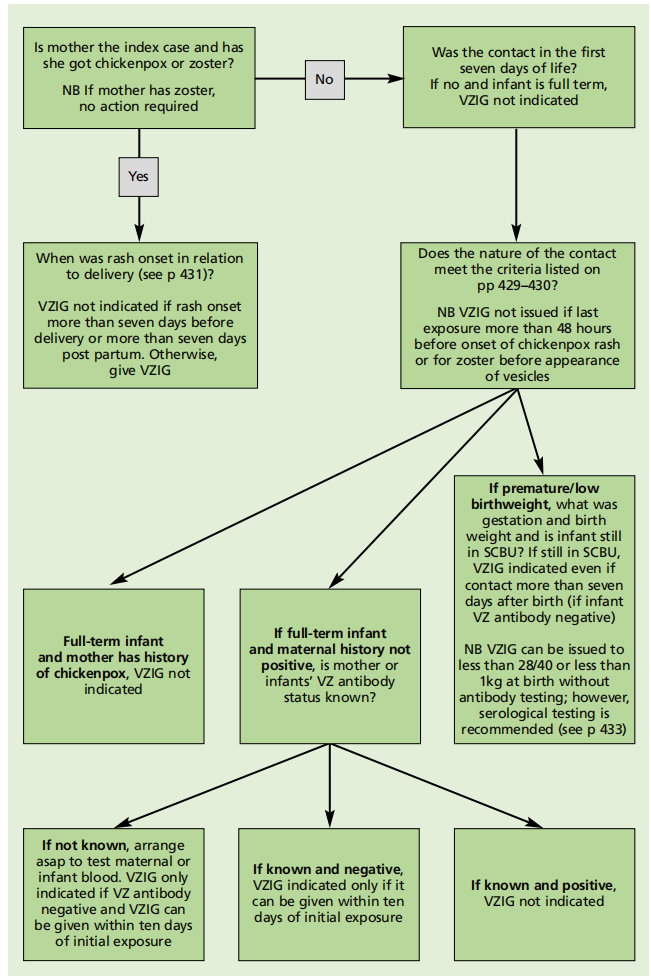
图34.3新生儿的VZIG算法
据报道,一例在妊娠11周暴露的妇女的婴儿出现先天性水痘综合征,尽管在暴露后使用VZIG预防后仍出现临床水痘(Pasturszak et al., 1994)。
在家庭暴露于水痘后,约50%的易感孕妇接受VZIG治疗后会发展为临床水痘,尽管该疾病可能会减轻;无论是在接触后72小时内还是4至10天内给予VZIG,临床发作率都是相似的(Enders and Miller, 2000;Miller et al., 1993)。另有四分之一将被感染为亚临床感染(Miller et al., 1993)。尽管进行了VZIG预防,仍可能发生严重的母体水痘。在这种情况下,应立即使用阿昔洛韦进行治疗。
暴露于VZ病毒感染的医护人员的管理
已接种疫苗的医护人员或明确有水痘或带状疱疹病史并大量接触VZ病毒的人员(如上所述,包括在身体非暴露区域包扎局部带状疱疹的人员)应被视为受到保护,并允许继续工作。由于他们极有可能患上水痘,因此如果他们感到不适或出现发烧或皮疹,应建议他们在接触病人之前向职业卫生部门报告,以进行评估。
没有明确水痘或带状疱疹病史并大量接触VZ病毒(见上文)的未接种疫苗的医护人员应在接触后8至21天内避免与高危患者接触,或者如果他们感到不适或出现发烧或皮疹,应建议他们在接触患者前向职业卫生部门报告。有证据表明,暴露后三天内接种水痘疫苗可以有效预防水痘(Ferson,2001)。(Varivax获准用于暴露后预防。)在任何情况下,无论暴露的时间间隔如何,都应该提供疫苗以降低医护人员将来将患者暴露于VZ病毒的风险(见上文)。
患有带状疱疹的医护人员的管理
身体部位有局部带状疱疹、可覆盖绷带和/或衣服的医疗保健工作者应被允许继续工作,除非他们与高危患者有接触,在这种情况下,应进行个人风险评估。
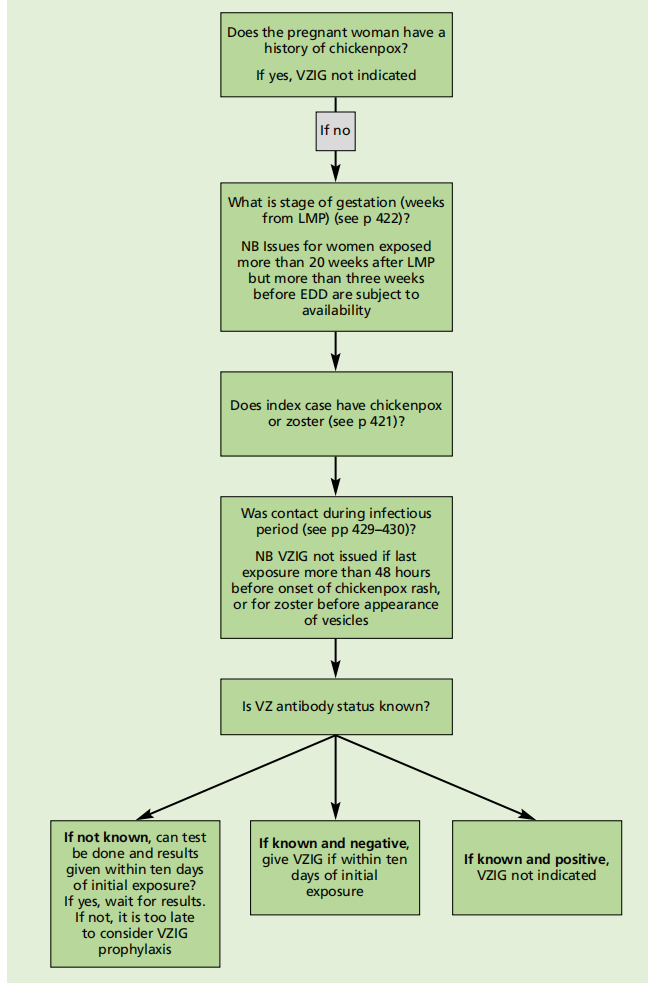
图34.4孕妇的VZIG算法
禁忌症
疫苗不应用于:
- 免疫抑制患者。对于需要水痘保护的患者,向专家寻求建议
- 怀孕的妇女。接种最后一剂水痘疫苗后一个月内应避免怀孕(见下文)
或者对那些有过:
- 对前一剂疫苗的确认过敏反应
- 对疫苗的任何成分(包括新霉素或明胶)产生过敏反应。
预防措施
除非急需保护,否则急性不适的人应推迟免疫接种,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
怀孕和母乳喂养
怀孕妇女不应接种水痘疫苗,并且在最后一次接种后一个月内应避免怀孕。
研究表明,疫苗病毒不会通过母乳传播给婴儿(Bohlke et al., 2003),因此,如果有需要,哺乳期妇女可以接种疫苗。
怀孕期间意外接种疫苗
在美国,对怀孕期间意外接种疫苗病例的监测未发现对胎儿有任何特定风险。2002年3月对美国697名孕妇接种Oka/Merck毒株(Varivax)疫苗的妇女进行了随访,未发现任何活产婴儿患有先天性水痘。此外,先天性异常的发生率与一般人群中报告的发生率相似(Merck Research Laboratories,2003)。然而,记录这些病例和记录妊娠结果是很重要的。HPA免疫部传染病中心正在对怀孕期间意外接种疫苗的情况进行监测,应向其报告此类情况(电话:020 8200 6868,分机:74405)。在苏格兰,任何此类病例应报告给苏格兰健康保护局(HPS)(电话:0141 300 1191),在威尔士,病例应报告给国家公共健康服务局
威尔士(电话:01352 700227转4055)。反过来,这些将通过HPA的免疫部门对英国的数字做出贡献。
免疫抑制和艾滋病毒感染
免疫抑制患者禁用水痘疫苗。对于需要水痘保护的患者,向专家寻求建议。
皇家儿科和儿童健康学院(www.rcpch.ac.uk)、英国艾滋病毒协会(BHIVA)艾滋病毒感染成人免疫指南(BHIVA,2006)和英国和爱尔兰儿童艾滋病毒协会(CHIVA)免疫指南(www.bhiva.org/chiva)。
水杨酸盐的使用
阿司匹林和全身水杨酸盐不应用于16岁以下的儿童,除非有医疗监督。16岁或以上需要服用阿司匹林的人并不禁止接种水痘疫苗。
不良反应
水痘疫苗耐受性良好。来自美国的大量临床和上市后安全性监测数据(Oka/Merck菌株,Varivax)显示,最常报告的反应发生在注射部位(疼痛、发红和皮疹)。全身症状,如发烧和皮疹,也可能发生,但频率较低。医护人员对这些反应的管理详述如下。
在免疫接种后一个月内,多达10%的成人和5%的儿童出现疫苗相关皮疹,这些皮疹要么位于注射部位,要么遍布全身(Annunziato and Gershon, 2000)。水痘疫苗皮疹可能是丘疹或水疱。与疫苗相关的疾病可以用阿昔洛韦治疗。重要的是要确定皮疹是由于疫苗病毒还是巧合的野生型水痘。接种疫苗后的皮疹样本应送至Barts的HPA水痘带状疱疹参考服务中心和伦敦NHS信托基金Trust (www.clinical-virology. org/
pages/vzrl/vzrl_summary.html)。
疫苗病毒株可在免疫活性个体中建立潜伏感染并重新激活以引起带状疱疹,但其风险显著低于野生水痘感染。应调查接种者中出现的带状疱疹病例,并将样本送至HPA水痘带状疱疹参考服务,如上所述。
疫苗病毒从具有免疫能力的接种者向易感的密切接触者的传播偶尔有记录,但风险非常低。在没有疫苗接种后皮疹的情况下的传播还没有记录(Annunziato and Gershon, 2000)。
所有儿童的可疑反应和成人的严重可疑反应都应使用黄卡计划报告给人类药物委员会。
VZIG的安全性
VZIG的耐受性很好。具有IgA抗体的低丙种球蛋白血症患者或对输血有非典型反应的患者很少出现过敏样反应。
任何国家都没有通过肌内使用的免疫球蛋白制剂获得血源性感染的病例记录。
治疗
VZIG在严重疾病的治疗中没有地位。
供应
疫苗
- Varivax®–由赛诺菲巴斯德MSD公司生产(电话:0800 085 5511)。
- Varilrix®–由葛兰素史克公司生产(电话:0808 100 9997)。
VZIG
英格兰和威尔士:可从HPA Colindale(电话:020 8327 7471)、HPA实验室和选定的NHS医院获得。
北爱尔兰:可从贝尔法斯特BT12 6BA Grosvenor Road皇家医院信托集团药房专业药品处获得(电话:028 9063 5872)。
苏格兰:可从地区输血中心获得。
阿伯丁和苏格兰输血中心东北福雷斯特希尔路
阿伯丁福雷斯特希尔AB9 2ZW(电话:01224 685685)
苏格兰北部输血中心雷莫尔医院
因弗内斯IV2 3UJ(电话:01463 704212)
邓迪和苏格兰东部输血中心九井医院
邓迪DD1 9SY(电话:01382 645166)
苏格兰西部输血中心Gartnavel综合医院
格拉斯哥雪莉路25号G12 0XB(电话:0141 357 7700)
爱丁堡和苏格兰东南部输血中心爱丁堡皇家医院
爱丁堡小法兰西新月街51号EH16 4SA
(电话:0131 242 7520(艾琳·麦肯尼))
VZIG免费发放给符合上述标准的患者。希望为不符合这些标准的患者发放VZIG的临床医生应直接联系制造商购买剂量。
除了BPL和PFC产品,在英国没有其他许可的肌肉注射用VZIG制剂。
参考
American Academy of Pediatrics (2003) Active immunization. In: Pickering LK (ed.) Red
Book: 2003 Report of the Committee on Infectious Diseases, 26th edition. Elk Grove
Village, IL: American Academy of Pediatrics, p 33.
Annunziato PW and Gershon AA (2000) Primary vaccination against varicella. In: Arvin
AM and Gershon AA (eds) Varicella-zoster virus. Cambridge: Cambridge University Press.
Balfour HH, Rotbart HA, Feldman S et al. (1992) Aciclovir treatment of varicella in
otherwise healthy adolescents. The Collaborative Aciclovir Varicella Study Group. J
Pediatr 120: 627–33.
Bohlke K, Davis RL, DeStefano F et al. (2003) Vaccine Safety Datalink Team. Postpartum
varicella vaccination: is the vaccine virus excreted in breast milk? Obstet Gynecol 102
(5 Pt 1): 970–7.
Breuer J (2003) Monitoring virus strain variation following infection with VZV: is there
a need and what are the implications of introducing the Oka vaccine? Commun Dis Public
Health 6(1): 59–62.
British HIV Association (2006) Immunisation guidelines for HIV-infected adults:
www.bhiva.org/pdf/2006/Immunisation506.pdf.
Department of Health (2006) Health technical memorandum 07-01: Safe management of
healthcare waste. http://www.dh.gov.uk/en/Publicationsandstatistics/Publications/
PublicationsPolicyAndGuidance/DH_063274. Accessed: Feb. 2008.
Dunkle LM, Arvin AM, Whitley RJ et al. (1991) A controlled trial of aciclovir for
chickenpox in normal children. N Engl J Med 325: 1539–44.
Enders G and Miller E (2000) Varicella and herpes zoster in pregnancy and the newborn.
In: Arvin AM and Gershon AA (eds) Varicella-zoster virus. Cambridge: Cambridge
University Press.
Enders G, Miller E, Cradock-Watson JE et al. (1994) The consequences of chickenpox and
herpes zoster in pregnancy; a prospective study of 1739 cases. Lancet 343: 1548–51.
Evans EB, Pollock TM, Cradock-Watson JE and Ridehalgh MK (1980) Human antichickenpox immunoglobulin in the prevention of chickenpox. Lancet i: 354–6.
Ferson MJ (2001) Varicella vaccine in post-exposure prophylaxis. Commun Dis Intell
25: 13–15.
Gold WL, Boulton JE, Goldman C et al. (1993) Management of varicella exposures in the
neonatal intensive care unit. Pediatr Infect Dis J 12: 954–5.
MacMahon E, Brown LJ, Bexley S et al. (2004) Identification of potential candidates for
varicella vaccination by history: questionnaire and seroprevalence study. BMJ 329 (7465):
551–2.
Merck Research Laboratories (2003) Pregnancy registry for Varivax®: The 7th annual
report, 2002.
Miller E, Cradock-Watson JE and Ridehalgh MK (1990) Outcome in newborn babies
given anti-varicella zoster immunoglobulin after perinatal infection with varicella-zoster
virus. Lancet ii: 371–3.
Miller E, Marshall R and Vurdien JE (1993) Epidemiology, outcome and control of
varicella-zoster infection. Rev Med Microbiol 4: 222–30.
Mullooly J and Black S (2001) Simultaneous administration of varicella vaccine and other
recommended childhood vaccines – United States, 1995–9. MMWR 50(47): 1058–61.
Paryani SG, Arvin AM, Koropchak CM et al. (1984) Comparison of varicella-zoster
antibody titres in patients given intravenous immune globulin or varicella-zoster immune
globulin. J Pediatr 105: 200–5.
Pasturszak AL, Levy M, Schick B et al. (1994) Outcome of maternal varicella infection
in the first 20 weeks of pregnancy. N Engl J Med 330: 901–5.
Patou G, Midgely P, Meurisse EV and Feldman RG (1990) Immunoglobulin prophylaxis
for infants exposed to varicella in a neonatal unit. J Infection 29: 207–13.
Shapiro ED, Vazquez M, Esposito D et al. (2011) Effectiveness of 2 doses of varicella
vaccine in children. J Infect Dis 203(3): 312-5.
Tan MP and Koren G (2006) Chickenpox in pregnancy: Revisited. Reprod Toxicol 21(4):
410–20.




