轮状病毒疫苗RotaTeq FDA
RotaTeq (Rotavirus Vaccine, Live, Oral, Pentavalent)
Oral Solution
Initial U.S. Approval: 2006
处方信息的重点
这些重点并不包括安全有效地使用RotaTeq所需的所有信息。参见RotaTeq的完整处方信息。
———适应症和用法———
RotaTeq是一种用于预防轮状病毒的疫苗 由G1、G2、G3、G4和G9型引起的胃肠炎。( 1)
———剂量和用法———
疫苗接种系列包括从6至12周龄开始口服三剂随时可用的液体RotaTeq,随后每隔4至10周注射一剂。第三剂不应在32周龄后接种。(2)
————剂型和强度————
用于口服5种活的人-牛重配体的2 mL溶液,根据重配情况,每重配剂量至少包含2.0–2.8 x 106感染单位(IU),且每总剂量不超过116 x 106 IU的轮状病毒。(3)
———禁忌症———
对疫苗或疫苗的任何成分有明显的过敏史。(4.1)
严重联合免疫缺陷病(SCID)病史。(4.2, 6.2)
肠套叠病史。(4.3)
———警告和注意事项———
尚无关于对可能免疫功能低下(如艾滋病毒/艾滋病)的婴儿使用RotaTeq的安全性或有效性临床试验数据。(5.2)
在一项上市后研究中,在第一剂RotaTeq后21天内观察到肠套叠病例,前7天出现病例聚集。(5.3, 6.2)
尚无关于对有胃肠道疾病史(如活动性急性胃肠道疾病、慢性腹泻、发育不良、先天性腹部疾病史和腹部手术史)的婴儿使用RotaTeq的安全性或有效性数据。(5.4)
已有疫苗接种者向未接种疫苗的接触者传播疫苗病毒的报告。在考虑是否对免疫缺陷接触者使用RotaTeq时,建议谨慎。(5.5)
———不良反应———
最常见的不良事件包括腹泻、呕吐、易怒、中耳炎、鼻咽炎和支气管痉挛。(6.1)
要报告可疑的不良反应,请联系默克公司的子公司默克夏普公司(Merck Sharp & Dohme Corp .),电话号码为1-877- 888-4231,或VAERS公司(Chrysler),电话号码为1-800-822-7967或www.vaers.hhs.gov4
———在特定人群中使用————
儿科使用:对于小于6周或大于32周的婴儿,安全性和有效性尚未确定。临床研究数据支持RotaTeq用于:
早产儿,根据出生后数周的年龄
患有可控胃食管反流病的婴儿。(8.4)
有关患者咨询信息和FDA批准的患者标签,请参见第17节。
修订日期:XX/20XX
| 完整的处方信息:内容* | 7药物相互作用
*未列出完整处方信息中省略的章节或小节。 |
完整的处方信息
1适应症和用法
RotaTeq适用于预防由G1、G2、G3、G4和G9型引起的婴幼儿轮状病毒胃肠炎,适用于6至32周的婴幼儿。第一剂RotaTeq应在6至12周龄之间施用【参见剂量和给药(2)】.
2剂量和用法
仅供口服使用。不用于注射。
疫苗接种系列包括从6至12周龄开始口服三剂随时可用的液体RotaTeq,随后每隔4至10周给药一剂。32周龄后不应接种第三剂疫苗【参见临床研究(14)】.
在接种RotaTeq疫苗之前或之后,对婴儿食用食物或液体(包括母乳)没有限制。
请勿将RotaTeq疫苗与任何其他疫苗或溶液混合。不要复原或稀释【参见剂量和给药(2.2)】.
关于存储说明【参见如何供应/储存和搬运(16.1)】.
每剂药物都装在一个容器中,该容器由一个带旋盖的可挤压塑料给药管组成,可直接口服给药。定量管装在一个袋子里【参见剂量和给药(2.2)】.
2.1与其他疫苗一起使用
在临床试验中,RotaTeq与其他已获许可的儿科疫苗同时使用【参见不良反应(6.1)、药物相互作用(7.1)和临床研究(14)】.
2.2使用说明
| 要接种疫苗: | |
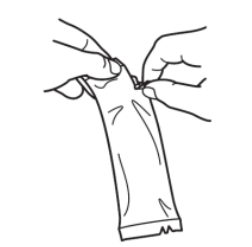 |
撕开袋子,取出加药管。 |
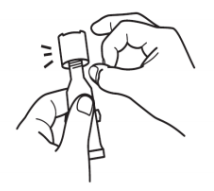 |
垂直握住试管并轻敲盖子,清除分液吸头中的液体。 |
| 按2个简单的动作打开给药管: | |
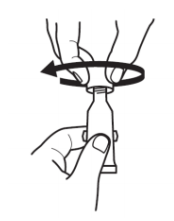 |
1.拧动盖子刺破分装头顺时针方向的直到它变紧。 |
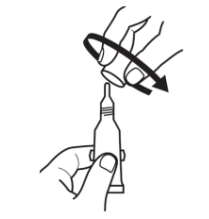 |
2.转动盖子,将其取下反时针方向. |
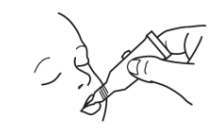 |
给药时,将液体轻轻挤向婴儿口腔内侧脸颊,直到给药管排空。(试管尖端可能会残留一滴。) |
如果由于任何原因给药剂量不完整(例如婴儿呕吐或反流疫苗),则不建议更换剂量,因为临床试验中没有研究过这种剂量。婴儿应继续接受推荐系列中的任何剩余剂量。
根据当地法规,将空试管和盖子丢弃在批准的生物废弃物容器中。
3剂型和强度
RotaTeq,2 mL口服,是一种含有G1、G2、G3、G4和P1A的重组轮状病毒活病毒的即用型溶液【8】,根据重组情况,每个重组剂量至少含有2.0–2.8 x 106个感染单位(IU),每个总剂量不超过116 x 106个IU。
每剂药物都装在一个容器中,该容器由一个带旋盖的可挤压塑料给药管组成,可直接口服给药。定量管装在一个袋子里。
4禁忌症
4.1过敏
对疫苗的任何成分有明显的过敏史。
接受一剂RotaTeq后出现过敏症状的婴儿不应再接受更多剂量的RotaTeq。
4.2严重的联合免疫缺陷病
患有严重联合免疫缺陷病(SCID)的婴儿不应接受RotaTeq。上市后报告显示,服用RotaTeq的婴儿出现肠胃炎,包括严重腹泻和疫苗病毒持续脱落,后来被确认为患有SCID【参见不良反应(6.2)】.
4.3肠套叠病史
有肠套叠病史的婴儿不应接受RotaTeq。
5警告和注意事项
5.1控制过敏反应
必须提供适当的医疗和监督,以控制接种疫苗后可能出现的过敏反应。
5.2免疫缺陷人群
尚无关于对可能免疫功能低下的婴儿使用RotaTeq的临床试验的安全性或有效性数据,包括:
•患有血液病、白血病、任何类型的淋巴瘤或其他影响骨髓或淋巴系统的恶性肿瘤的婴儿。
•接受免疫抑制治疗的婴儿(包括大剂量全身皮质类固醇)。正在接受局部皮质类固醇或吸入性类固醇治疗的婴儿可服用RotaTeq。
•患有原发性和获得性免疫缺陷病的婴儿,包括艾滋病毒/艾滋病或感染人体免疫缺陷病毒的其他临床表现;细胞免疫缺陷;以及低丙种球蛋白血症和异常丙种球蛋白血症。没有足够的临床试验数据支持对患有艾滋病毒/艾滋病的母亲所生的艾滋病毒状况不明的婴儿使用RotaTeq。
•在42天内接受输血或血液制品,包括免疫球蛋白的婴儿。。
据报道,疫苗病毒从疫苗接受者传播到未接种疫苗的接触者【参见警告和注意事项(5.5)】。
5.3肠套叠
在使用之前获得许可的活恒河猴轮状病毒重组疫苗后,观察到肠套叠的风险增加。1
在美国的一项上市后观察性研究中,观察到在接种第一剂RotaTeq后21天内出现肠套叠病例,并在前7天出现病例聚集。【参见不良反应(6.2)。]
在全球被动上市后监测中,有与RotaTeq暂时相关的肠套叠病例报告。【参见不良反应(6.2)。]
5.4肠胃疾病
尚无关于对有胃肠道疾病史的婴儿(包括患有活动性急性胃肠道疾病的婴儿、患有慢性腹泻和发育不良的婴儿以及有先天性腹部疾病和腹部手术史的婴儿)使用RotaTeq的安全性或有效性数据。考虑对这些婴儿使用RotaTeq时,建议谨慎。
5.5脱落和传播
在轮状病毒有效性和安全性试验(研究006,也称为REST)中,在每次给药后4至6天的受试者子集以及在任何时间提交粪便抗原轮状病毒阳性样本的所有受试者中评估疫苗病毒的脱落。在第1剂疫苗接种后接受检测的360名疫苗接受者中,有32名【8.9%,95%可信区间(6.2%,12.3%)】的患者的粪便中出现 RotaTeq;在第2剂疫苗接种后接受检测的249名疫苗接种者中有0名【0.0%,95%置信区间(0.0%,1.5%)】;在385名【0.3%,95%可信区间(<0.1%,1.4%)】疫苗接种者中,有1名在第3剂后接种。在3期研究中,最早在给药后1天,最晚在15天观察到脱落。在3期研究中未评估疫苗病毒的传播。
上市后观察到疫苗病毒株从接种者传播到未接种疫苗的接触者。
应权衡疫苗病毒传播的潜在风险与获得和传播天然轮状病毒的风险。
在考虑是否对以下患者使用RotaTeq时,建议谨慎
免疫缺陷密切接触者,如:
•患有恶性肿瘤或免疫功能低下的个人;
•患有原发性免疫缺陷的个人;或者
•接受免疫抑制治疗的个人。
5.6发热性疾病
发热性疾病可能是推迟使用RotaTeq的原因,除非医生认为暂停接种疫苗会带来更大的风险。低烧(<100.5℉【38.1℃】)本身和轻度上呼吸道感染不排除接种RotaTeq疫苗。
5.7不完整的方案
这些临床研究并不是为了评估一剂或两剂RotaTeq的保护水平而设计的。
5.8疫苗有效性的局限性
RotaTeq可能无法保护所有疫苗接种者免受轮状病毒感染。
5.9暴露后预防
暴露于轮状病毒后服用RotaTeq尚无临床数据。
6不良反应
6.1临床研究经验
在3项安慰剂对照临床试验中评估了71,725名婴儿,包括接受RotaTeq治疗组的36,165名婴儿和接受安慰剂治疗组的35,560名婴儿。每次给药后第7、14和42天联系家长/监护人,了解肠套叠和任何其他严重不良事件。种族分布如下:白人(两组均为69%);西班牙裔美国人(两个群体均为14%);黑人(两组均为8%);多种族(两组均为5%);亚裔(两组均为2%);印第安人(RotaTeq 2%,安慰剂1%);和其他(两组均<1%)。两个疫苗接种组的性别分布分别为51%的男性和49%的女性。
由于临床试验是在临床实践中可能不典型的条件下进行的,因此下面列出的不良反应率可能无法反映临床实践中观察到的不良反应率。
严重不良事件
在RotaTeq的3期临床研究中,在服用一剂药物的42天内,RotaTeq的接受者中有2.4%发生严重不良事件,而安慰剂接受者中有2.6%发生严重不良事件。与安慰剂相比,RotaTeq最常报告的严重不良事件为:
细支气管炎(0.6% RotaTeq对0.7%安慰剂),
肠胃炎(0.2% RotaTeq对0.3%安慰剂),
肺炎(0.2% RotaTeq对0.2%安慰剂),
发烧(0.1% RotaTeq对比0.1%安慰剂),以及
尿路感染(0.1% RotaTeq对0.1%安慰剂)。
死亡
在整个临床研究中,报告了52例死亡。RotaTeq组有25例死亡,而安慰剂组有27例死亡。最常报告的死亡原因是婴儿猝死综合征,在RotaTeq的8名受试者和9名安慰剂受试者中观察到这种情况。
肠套叠
在研究006中,通过主动监测对34,837名疫苗接受者和34,788名安慰剂接受者进行了监测,以在每次给药后的第7、14和42天发现潜在的肠套叠病例,并在第一次给药后的1年内每6周进行一次监测。
对于主要安全性结果(任何剂量42天内发生的肠套叠病例),RotaTeq接受者中有6例,安慰剂接受者中有5例(见表1)。数据并未表明与安慰剂相比肠套叠的风险增加。
表1:研究006期间RotaTeq受试者与安慰剂受试者的肠套叠确诊病例对比
| RotaTeq(n = 34837) | 安慰剂(n = 34,788) | |
| 在任何剂量后42天内确诊的肠套叠病例* | 6 | 5 |
| 相对风险(95% CI) | 1.6 (0.4, 6.4) | |
| 接种第1剂后365天内确诊的肠套叠病例 | 13 | 15 |
| 相对风险(95% CI) | 0.9 (0.4, 1.9) | |
*相对风险和95%置信区间基于研究006中采用的分组序贯设计停止标准。
在疫苗接受者中,在第一剂疫苗接种后的42天内没有确诊肠套叠病例,这是恒河猴轮状病毒产品的最高风险时期(见表2)。
表2:研究006中与剂量相关的日范围内的肠套叠病例
| 剂量1 | 剂量2 | 剂量3 | 任何剂量 | |||||
| 日期范围 | RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | RotaTeq | 安慰剂 |
| 1-7 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 |
| 1-14 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 |
| 1-21 | 0 | 0 | 3 | 0 | 0 | 1 | 3 | 1 |
| 1-42 | 0 | 1 | 4 | 1 | 2 | 3 | 6 | 5 |
所有发生肠套叠的儿童均痊愈且无后遗症,但一名9个月大的男性除外,他在注射第3剂后98天发生肠套叠并死于术后败血症。在1期和2期研究中,2470例RotaTeq受体中有一例肠套叠,患者为7个月大的男性(716例安慰剂受体)。
便血
在任何剂量的42天内,0.6%(39/6,130)的疫苗受试者和0.6%(34/5,560)的安慰剂受试者报告了便血这一不良经历。在任何剂量的42天内,作为严重不良反应报告的便血发生在<0.1%(4/36,150)的疫苗接受者和<0.1%(7/35,536)的安慰剂接受者中。
癫痫发作
RotaTeq的3期试验中报告的所有癫痫发作(按接种组和给药后间隔时间)见表3。
表3 RotaTeq的3期试验中按日范围报告的与任何剂量相关的癫痫发作
| 日期范围 | 1-7 | 1-14 | 1-42 |
| RotaTeq | 10 | 15 | 33 |
| 安慰剂 | 5 | 8 | 24 |
报告为严重不良反应的癫痫发作发生在<0.1%(27/36,150)的疫苗接受者和<0.1%(18/35,536)的安慰剂接受者中(不显著)。10例高热惊厥被报告为严重不良反应,其中5例发生在疫苗接受者中,5例发生在安慰剂接受者中。
川崎病
在3期临床试验中,对婴儿进行了长达42天的疫苗剂量随访。36,150名疫苗接受者中有5名报告了川崎病,35,536名安慰剂接受者中有1名报告了川崎病,未调整相对风险为4.9(95% CI为0.6,239.1)。
最常见的不良事件引发的不良事件
从11,711名婴儿(6,138名RotaTeq接受者)中收集了详细的安全性信息,其中包括研究006中的受试者子集以及研究007和009中的所有受试者(详细安全性队列)。在每次接种疫苗后的第一周内,父母/监护人使用疫苗接种报告卡记录儿童的体温以及每天的腹泻和呕吐情况。
表4总结了这些不良事件和易怒的频率。
表4:第1、2和3剂后第一周内征集的不良经历(详细的安全性队列)
| 不良反应 | 剂量1 | 剂量2 | 剂量3 | |||
| RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | |
| 高烧* | n = 5,616 | n = 5,077 | n = 5,215 | n = 4,725 | n = 4,865 | n = 4,382 |
| 17.1% | 16.2% | 20.0% | 19.4% | 18.2% | 17.6% | |
| 呕吐 | n = 6,130 | n = 5,560 | n = 5,703 | n = 5,173 | n = 5,496 | n = 4,989 |
| 6.7% | 5.4% | 5.0% | 4.4% | 3.6% | 3.2% | |
| 腹泻 | 10.4% | 9.1% | 8.6% | 6.4% | 6.1% | 5.4% |
| 过敏 | 7.1% | 7.1% | 6.0% | 6.5% | 4.3% | 4.5% |
*温度≥100.5℉【38.1℃】直肠当量,通过将耳温和口腔温度加1℉和腋温加2℉获得
其他不良事件
11,711名婴儿的父母/监护人还被要求在每剂疫苗接种后42天内在疫苗接种报告卡上报告其他事件的存在。
疫苗(N=6,138)和安慰剂(N=5,573)接受者的发热率相似(42.6%比42.8%)。与安慰剂接受者相比,RotaTeq接受者在任何剂量的42天内发生的不良事件的发生率在统计学上更高(即双侧p值<0.05),见表5。
表5:与安慰剂接受者相比,RotaTeq接受者在任何剂量的42天内发生的不良事件的发生率在统计学上更高
| 不良反应 | RotaTeq N = 6,138 | 安慰剂N=5,573 |
| n (%) | n (%) | |
| 腹泻 | 1,479 (24.1%) | 1,186 (21.3%) |
| 呕吐 | 929 (15.2%) | 758 (13.6%) |
| 中耳炎 | 887 (14.5%) | 724 (13.0%) |
| 鼻咽炎 | 422 (6.9%) | 325 (5.8%) |
| 支气管痉挛 | 66 (1.1%) | 40 (0.7%) |
早产儿的安全性
在研究006中,根据早产儿出生后的周数,对2070名早产儿(胎龄25至36周,中位34周)服用RotaTeq或安慰剂。对所有早产儿进行随访,以了解严重的不良经历;对308名婴儿的所有不良经历进行监测。在整个研究中有4例死亡,其中2例发生在疫苗接受者中(1例婴儿猝死综合症和1例机动车事故),2例发生在安慰剂接受者中(1例婴儿猝死综合症和1例原因不明)。没有肠套叠的病例报告。5.5%的疫苗接受者和5.8%的安慰剂接受者发生了严重的不良经历。最常见的严重不良反应是细支气管炎,1.4%的疫苗接种者和2.0%的安慰剂接受者发生了细支气管炎。父母/监护人被要求在接种疫苗后的第一周内每天记录孩子的体温和任何呕吐和腹泻事件。表6总结了第1剂给药后一周内这些不良反应和过敏反应的发生频率。
表6:早产儿在接种第1剂、第2剂和第3剂疫苗的第一周内出现的不良反应
| 不良事件 | 剂量1 | 剂量2 | 剂量3 | |||
| RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | |
| 高温* | N=127 | N=133 | N=124 | N=121 | N=115 | N=108 |
| 18.1% | 17.3% | 25.0% | 28.1% | 14.8% | 20.4% | |
| N=154 | N=154 | N=137 | N=137 | N=135 | N=129 | |
| 呕吐 | 5.8% | 7.8% | 2.9% | 2.2% | 4.4% | 4.7% |
| 腹泻 | 6.5% | 5.8% | 7.3% | 7.3% | 3.7% | 3.9% |
| 过敏性 | 3.9% | 5.2% | 2.9% | 4.4% | 8.1% | 5.4% |
*温度≥100.5℉【38.1℃】直肠当量,通过将耳温和口腔温度加1℉和腋温加2℉获得
6.2上市后体验
从疫苗不良事件报告系统(VAERS)的报告中发现RotaTeq在上市后使用期间出现以下不良事件。
向VAERS报告免疫接种后的不良事件是自愿的,接种的疫苗剂量数目不详;因此,并不总是能够使用VAERS数据可靠地估计不良事件频率或建立与疫苗暴露的因果关系。
在上市后经验中,使用RotaTeq后报告了以下不良事件:
免疫系统疾病:
过敏反应
胃肠疾病:
肠套叠(包括死亡)便血
患有严重联合免疫缺陷病(SCID)的婴儿的胃肠炎伴疫苗病毒脱落
皮肤和皮下组织疾病:
荨麻疹
血管性水肿
感染和侵扰:
川崎氏病
疫苗病毒株从疫苗接受者向未接种疫苗的接触者的传播。
上市后观察性安全监督研究
上市后快速免疫安全监测(PRISM)计划2评估了RotaTeq疫苗接种与肠套叠之间的时间相关性。PRISM是一项电子主动监测计划,由3项美国健康保险计划组成。
对5至36周大的婴儿接种的120多万剂RotaTeq疫苗(其中507,000剂为第一剂)进行了评估。从2004年到2011年,通过电子程序和诊断代码识别了住院或急诊科以及疫苗暴露中的潜在肠套叠病例。审查医疗记录以确认肠套叠和轮状病毒疫苗接种状态。
采用自身对照风险区间和队列设计评估肠套叠的风险,并对年龄进行调整。评估了1-7天和1-21天的风险窗口。接种第一剂RotaTeq后21天内观察到肠套叠病例,前7天出现病例聚集。根据研究结果,在接种第一剂RotaTeq疫苗后的21天内,每10万名接种疫苗的美国婴儿中约有1至1.5例肠套叠。据估计,在出生后第一年,美国肠套叠住院率约为每100,000名婴儿34例。3
在一项使用大型美国医疗索赔数据库进行的早期前瞻性上市后观察队列研究中,分析了2006年2月至2009年3月期间接受一剂或多剂RotaTeq疫苗的85,150名婴儿在接种任何剂量疫苗后30天内发生肠套叠或川崎病导致急诊或住院的风险。审查医疗图表以确认这些诊断。评估包括同时(n = 62,617)和历史(n=100,000,从2001年至2005年)接受白喉、破伤风和无细胞百日咳疫苗(DTaP)但未接种RotaTeq的婴儿对照组。
RotaTeq组中确诊的肠套叠病例与并发DTaP对照组和历史对照组中的病例进行了比较。在7天和30天的风险窗口中,分析了第1剂后和任何剂量后的数据。未观察到RotaTeq疫苗接种后肠套叠风险有统计学显著增加。
在接种RotaTeq疫苗的婴儿中发现一例川崎病确诊病例(第3剂后23天),在同时进行的DTaP对照中发现一例川崎病确诊病例(第2剂后22天)(相对风险= 0.7;95%置信区间:0.01-55.56)。
此外,通过在自动记录数据库中电子搜索每剂RotaTeq后30天内的所有急诊科就诊和住院情况来监测一般安全性,与1)每剂RotaTeq后31-60天(自身匹配对照)和2)每剂DTaP疫苗后30天(2004-2005年的历史对照子集,n=40,000)进行比较。在评估疫苗接种后多个随访窗口(第0-7天、第1-7天、第8-14天和第0-30天)的安全性分析中,与自身匹配对照组和历史对照组相比,未发现接种RotaTeq疫苗的婴儿存在安全性问题。
报告不良事件
应指示父母或监护人向其医疗保健提供者报告任何不良反应。
卫生保健提供者应向美国卫生与公众服务部的疫苗不良事件报告系统(VAERS)报告所有不良事件。
VAERS接受任何疫苗接种后的所有疑似不良事件报告,包括但不限于1986年<国家儿童疫苗伤害法案》要求的事件报告。有关疫苗报告表的信息或副本,请拨打VAERS免费电话1- 800-822-7967或在线报告至www.vaers.hhs.gov.4
7药物相互作用
免疫抑制疗法包括放疗、抗代谢药、烷化剂、细胞毒性药物和皮质类固醇(使用剂量超过生理剂量),可能会降低对疫苗的免疫反应。
7.1伴随疫苗给药
在临床试验中,RotaTeq与白喉和破伤风类毒素以及无细胞百日咳(DTaP)、灭活脊髓灰质炎疫苗(IPV)、B型流感嗜血杆菌结合物(Hib)、乙型肝炎疫苗和肺炎球菌结合疫苗同时给药【参见临床研究(14)】。可用的安全性数据在不良反应部分【参见不良反应(6.1)】。没有证据表明与RotaTeq同时接种疫苗会降低抗体反应。
8在特定人群中使用
8.1怀孕
RotaTeq不适用于32周及以上的个体。没有可用的人类或动物数据来评估怀孕期间与疫苗相关的风险。
8.2哺乳
没有可用的人类或动物数据来评估RotaTeq对产奶量的影响、其在母乳中的存在或其对母乳喂养婴儿的影响。
8.4儿科使用
尚未确定RotaTeq在小于6周或大于32周的婴儿中的安全性和有效性。
临床研究数据支持根据早产儿出生后数周的年龄使用RotaTeq【参见不良反应(6.1)】。
临床研究数据支持在患有胃食管反流病的婴儿中使用RotaTeq。
10用药过量
有上市后报告称,婴儿在反胃后接受了不止一剂或替代剂量的RotaTeq【参见剂量和给药(2.2)】。在有限的报告用药过量的上市后经验中,不正确服用高于推荐剂量的RotaTeq后报告的不良事件与使用批准剂量和时间表观察到的不良事件相似。
11描述
RotaTeq是一种口服五价活疫苗,含有5种重组轮状病毒。重配的轮状病毒亲本株是从人类和牛宿主中分离出来的。四种重配轮状病毒表达人轮状病毒亲本株的一种外壳蛋白(G1、G2、G3或G4)和牛轮状病毒亲本株的附着蛋白(P7型)。第五种重配病毒表达来自人轮状病毒亲本株的附着蛋白P1A(基因型P【8】)(本文称为P1A【8】型)和来自牛轮状病毒亲本株的G6型外壳蛋白(见表7)。
表7
| 重配株名 | 人轮状病毒
亲代毒株和外表面蛋白质成分 |
牛轮状病毒
亲代毒株和外表面蛋白质成分 |
重组体外表面蛋白组成(粗体中的人轮状病毒成分) | 最低剂量水平(106个传染单位) |
| G1 | WI79 – G1P1A[8] | WC3–G6,P7【5】 | G1p7【5】 | 2.2 |
| G2 | SC2 – G2P2[6] | G2 p7【5】 | 2.8 | |
| G3 | WI78 – G3P1A[8] | G3p7【5】 | 2.2 | |
| G4 | BrB – G4P2[6 | G4p7【5】 | 2.0 | |
| P1A【8】 | WI79 – G1P1A[8] | G6P1A【8】 | 2.3 |
在不存在抗真菌剂的情况下,使用标准细胞培养技术在Vero细胞中繁殖重配体。
重配体悬浮在缓冲稳定剂溶液中。每剂疫苗含有蔗糖、柠檬酸钠、磷酸二氢钠一水合物、氢氧化钠、聚山梨醇酯80、细胞培养基和微量胎牛血清。RotaTeq不含防腐剂。
RotaTeq是淡黄色透明液体,可能带有粉红色。塑料定量管和盖子不含乳胶。
12临床药理学
轮状病毒是婴幼儿严重急性胃肠炎的主要原因,超过95%的婴幼儿在5岁时感染。5最严重的病例发生在6个月至24个月的婴幼儿中。6
12.1作用机制
RotaTeq预防轮状病毒胃肠炎的确切免疫机制尚不清楚【参见临床研究(14.6)】。RotaTeq是一种在小肠中复制并诱导免疫的活病毒疫苗。
13非临床毒理学
13.1致癌、诱变、生育能力受损
尚未评估RotaTeq的致癌或致突变潜力或损害生育能力的潜力。
14临床研究
总体而言,73,086名婴儿在4个安慰剂对照的3期研究中被随机分配到4个大洲的12个国家。证明RotaTeq预防轮状病毒胃肠炎功效的数据来自7744名来自美国(包括纳瓦霍和白山)的婴儿阿帕奇民族)、芬兰和日本,他们参加了其中3项研究:研究006、研究007和研究029。第四项试验研究009提供了支持生产一致性的临床证据,并为总体安全性评估提供了数据。
疗效子集的种族分布如下:白人(RotaTeq 61%,安慰剂62%);西班牙裔美国人(RotaTeq 9%,安慰剂8%);黑人(两组均为2%);多种族(两组均为4%);亚裔(两组均为10%);美洲原住民(两个群体中均为13%);和其他(两组均<1%)。两个疫苗接种组的性别分布分别为52%的男性和48%的女性。
这些研究中的疗效评估包括:1)预防任何严重程度的轮状病毒胃肠炎;2)预防由临床评分系统定义的严重轮状病毒胃肠炎;和3)由于轮状病毒胃肠炎而住院的减少。
该疫苗分三剂系列接种给健康婴儿,第一剂在6至12周大时接种,随后每隔4至10周再接种两剂。接种第三剂疫苗的婴儿年龄为32周或更小。不允许口服脊髓灰质炎疫苗;然而,其他儿童疫苗可以同时使用。所有研究都允许母乳喂养。
用于确定疫苗效力的轮状病毒胃肠炎病例定义要求受试者同时满足以下临床和实验室标准:(1)24小时内出现3次以上水样便或稀便和/或强烈呕吐;和(2)通过酶免疫测定法(EIA)在症状发作14天内采集的粪便标本中检测轮状病毒抗原。轮状病毒急性胃肠炎的严重程度由临床评分系统确定,该系统考虑了发热、呕吐、腹泻和行为变化症状的强度和持续时间。
主要疗效分析包括由G1型、G2型、G3型、G4型(和含P1A8的G型(仅在研究029中)引起的轮状病毒胃肠炎病例,这些病例在接种第三剂疫苗后的第一个轮状病毒季节发生至少14天。
还进行了分析,以评估RotaTeq在接受至少一次疫苗接种(意向性治疗,ITT)的婴儿接种第一剂疫苗后的第一个轮状病毒季节的任何时间对由G1、G2、G3和G4型(以及含P1A8的G型(仅在研究029中)引起的轮状病毒胃肠炎的疗效。
14.1轮状病毒功效和安全性试验(研究006)
在疫苗接种后的第一个轮状病毒季节,针对由自然发生的G1、G2、G3或G4型引起的任何严重程度的轮状病毒胃肠炎的主要疗效为74.0%(95% CI:66.8,79.9),ITT疗效为60.0%(95% CI:51.5,67.1)。在疫苗接种后的第一个轮状病毒季节,针对由自然发生的G1、G2、G3或G4型轮状病毒引起的严重轮状病毒胃肠炎的主要有效率为98.0%(95% CI:88.3,100.0),ITT有效率为96.4%(95% CI:86.2,99.6)。见表8。
表8:在研究006中接种轮状病毒疫苗后的第一个轮状病毒季节,RotaTeq对任何严重程度和严重* G1-4轮状病毒胃肠炎的疗效
| 根据协议 | 意向治疗† | |||
| RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | |
| 接种疫苗的受试者 | 2,834 | 2,839
肠胃炎病例 |
2,834 | 2,839 |
| 任何严重程度 | 82 | 315 | 150 | 371 |
| 严重* | 1 | 51 | 2 | 55 |
| 功效估计%和(95%置信区间) | ||||
| 任何严重程度 | 74.0
(66.8, 79.9) |
60.0
(51.5, 67.1) |
||
| 严重* | 98.0
(88.3, 100.0) |
96.4
(86.2, 99.6) |
||
*由临床评分系统根据发热、呕吐、腹泻和行为变化症状的强度和持续时间定义的严重胃肠炎
† ITT分析包括效力队列中至少接种了一剂疫苗的所有受试者。
研究006中所有受试者因轮状病毒胃肠炎住院的减少也证明了RotaTeq对严重疾病的疗效。在接种第三剂疫苗后的前两年内,RotaTeq将G1、G2、G3和G4型轮状病毒胃肠炎的住院率降低了95.8%(95% CI:90.5,98.2)。如表9所示,减少住院的ITT疗效为94.7%(95%置信区间:89.3,97.3)。
表9:研究006中RotaTeq减少G1-4轮状病毒相关住院的疗效
| 根据协议 | 意向治疗* | |||
| RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | |
| 接种疫苗的受试者 | 34,035 | 34,003 | 34,035 | 34,003 |
| 住院人数 | 6 | 144 | 10 | 187 |
| 功效估计值%和(95%置信区间) | 95.8
(90.5, 98.2) |
94.7
(89.3, 97.3) |
||
* ITT分析包括至少接种一剂疫苗的所有受试者。
14.2研究007
在疫苗接种后的第一个轮状病毒季节,针对由自然发生的G1、G2、G3或G4型引起的任何严重程度的轮状病毒胃肠炎的主要疗效为72.5%(95% CI:50.6,85.6),ITT疗效为58.4%(95% CI:33.8,74.5)。如表10所示,在疫苗接种后的第一个轮状病毒季节,针对由自然发生的G1、G2、G3或G4型轮状病毒引起的严重轮状病毒胃肠炎的主要疗效为100%(95% CI:13.0,100.0),针对严重轮状病毒疾病的ITT疗效为100%(95% CI:30.2,100.0)。
表10:在研究007中接种轮状病毒疫苗后的第一个轮状病毒季节,RotaTeq对任何严重程度和严重* G1-4轮状病毒胃肠炎的疗效
| 根据协议 | 意向治疗† | |||
| RotaTeq | 安慰剂 | RotaTeq | 安慰剂 | |
| 接种胃肠炎疫苗的受试者 | 650 | 660 | 650 | 660 |
| 任何严重程度 | 15 | 54 | 27 | 64 |
| 严重* | 0 | 6 | 0 | 7 |
| 功效估计%和(95%置信区间) | ||||
| 任何严重程度 | 72.5
(50.6, 85.6) |
58.4
(33.8, 74.5) |
||
| 严重* | 100.0
(13.0, 100.0) |
100.0
(30.2, 100.0) |
||
*由临床评分系统根据发热、呕吐、腹泻和行为变化症状的强度和持续时间定义的严重胃肠炎
† ITT分析包括效力队列中至少接种了一剂疫苗的所有受试者。
14.3多个轮状病毒季节
在一项研究中评估了RotaTeq在第二个轮状病毒季节的疗效(研究006)。在接种疫苗后的两个轮状病毒季节中,针对由轮状病毒G1型、G2型、G3型和G4型引起的任何严重程度的轮状病毒胃肠炎的有效率为71.3%(95% CI:64.7,76.9)。RotaTeq预防仅在疫苗接种后第二个轮状病毒季节发生的病例的有效性为62.6%(95% CI:44.3,75.4)。未评估RotaTeq在疫苗接种后第二个季节后的功效。
14.4轮状病毒胃肠炎,无论何种类型
研究006和研究007的疗效亚组中确定的轮状病毒类型为 G1P1A[8]; G2P1[4]; G3P1A[8]; G4P1A[8]; 和 G9P1A[8].。
在研究006中,RotaTeq对任何严重程度的自然发生的轮状病毒胃肠炎(无论何种类型)的疗效为71.8%(95% CI:64.5,77.8),对严重轮状病毒疾病的疗效为98.0%(95% CI:88.3,99.9)。对于任何严重程度的轮状病毒疾病,从第1剂开始的ITT疗效为50.9%(95% CI:41.6,58.9),对于严重轮状病毒疾病的疗效为96.4%(95% CI:86.3,99.6)。
在研究007中,RotaTeq对任何严重程度的轮状病毒胃肠炎的主要疗效为72.7%(95% CI:51.9,85.4),对严重轮状病毒疾病的疗效为100%(95% CI:12.7,100)。对于任何严重程度的轮状病毒疾病,从第1剂开始的ITT疗效为48.0%(95% CI:21.6,66.1),对于严重的轮状病毒疾病为100%(95% CI:30.4,100.0)。
14.5轮状病毒胃肠炎的类型
研究006和研究029对不同类型的轮状病毒严重性胃肠炎进行了疗效评估。研究006的疗效队列分析见表11。
表11:RotaTeq对婴幼儿轮状病毒胃肠炎任何严重程度的类型特异性疗效 研究006疫苗接种后第一个轮状病毒季节的疗效队列(根据方案)
| PCR鉴定的类型 | 病例数 | 功效百分比
(95%置信区间) |
|
| RotaTeq(N = 2,834) | 安慰剂(N = 2,839) | ||
| G1P1A〔8〕 | 72 | 286 | 74.9 (67.3, 80.9) |
| G2P1[4] | 6 | 17 | 63.4 (2.6, 88.2) |
| G3P1A[8] | 1 | 6 | NS |
| G4P1A[8] | 3 | 6 | NS |
| G9P1A[8] | 1 | 3 | NS |
| 身份不明* | 11 | 15 | NS |
| n =接种疫苗的人数NS =不显著 | |||
*包括轮状病毒抗原阳性样本,其中无法通过PCR鉴定具体类型
进行了额外的分析以评估预防G9P1A引起的轮状病毒胃肠炎的功效【8】。
•在研究029(一项在日本进行的3期随机、盲法、安慰剂对照研究)中,对预先指定的主要终点(由G1、G2、G3、G4和与血清型P1A【8】(如G9)相关的G-血清型引起的轮状病毒胃肠炎)的疗效为74.5%(95% CI:39.9,90.6)。RotaTeq组和安慰剂组分别有0/356和5/354名受试者出现G9P1A【8】相关性胃肠炎(100%(95%可信区间:-9.0,100)。
•在研究006中对68,038名婴儿(RotaTeq 34,035名和安慰剂34,003名)的医疗保健利用数据进行的事后分析中,使用的病例定义包括轮状病毒胃肠炎的培养确认、住院和急诊科就诊,G9P1A【8】导致的病例减少了100%(RotaTeq 0例:安慰剂14例)(95% CI: 69.6,100.0)。
14.6免疫原性
对RotaTeq的抗体反应和对轮状病毒胃肠炎的保护之间的关系尚未确定。在3期研究中,与397名安慰剂接受者中的12.3%-20.0%相比,439名RotaTeq接受者中的92.9%-100%在三剂方案后血清抗轮状病毒IgA升高了3倍或更多。
15参考文献
1.接受口服轮状病毒疫苗的婴儿发生肠套叠。英国医学杂志2001;344:564-572.
2.美国婴儿接种轮状病毒疫苗后的肠套叠风险。迷你哨兵。迷你sentinel.org。
3.泰特·JE,西蒙森L,维博德C等:1993-2004年美国婴儿肠套叠住院趋势:监测新轮状病毒疫苗接种计划安全性的意义儿科学2008;121(5):e 1125-e 1132。
4.疾病控制和预防中心。关于免疫的一般性建议:免疫实践咨询委员会(ACIP)和美国家庭医生学会(AAFP)的建议。MMWR 2002年;51(RR-2):1-35。
5.帕拉沙尔·UD等。轮状病毒疾病导致的全球儿童疾病和死亡。2003年紧急传染病;9(5):565-572.
6.帕拉沙UD,霍尔曼RC,克拉克MJ,布雷西JS,玻璃RI。1993年至1995年美国与轮状病毒腹泻相关的住院治疗:基于新的ICD-9CM轮状病毒特异性诊断编码的监测。j传染疾病研究所1998年;177:13-7.
16如何供应/储存和搬运
RotaTeq,2 mL,一种口服溶液,是淡黄色透明液体,可能带有粉红色。其供应方式如下:
NDC0006-4047-41 10支独立袋装单剂量管包装。NDC0006-4047-20每包25支独立袋装单剂量试管。塑料定量管和盖子不含乳胶。
16.1储存和搬运
在2-8℃(36-46℉)下冷藏储存和运输。RotaTeq从冰箱中取出后应尽快服用。有关在非推荐条件下稳定性的信息,请拨打1-800-MERCK-90。
避光。
根据当地法规,RotaTeq应丢弃在经批准的生物废物容器中。产品必须在有效期前使用。
17患者咨询信息
建议患者阅读FDA批准的患者标签(患者信息)。
应向父母或监护人提供一份所需疫苗信息的副本,并向其提供附于本插页的“患者信息”。应鼓励父母和/或监护人阅读描述疫苗相关益处和风险的患者信息,并在就诊期间提出任何问题【参见警告和注意事项(5)和患者信息】。
专利信息:www.merck.com/product/patent/home.html
版权2006-20XX默克夏普和多默公司,是默克公司版权所有
uspi-v260-os-XXXXrXXX




