第32章:结核病
2018年8月
结核病 应呈报
疾病
人类结核病(TB)是由结核分枝杆菌复合体(结核分枝杆菌、牛分枝杆菌、非洲分枝杆菌或田鼠分枝杆菌)的细菌感染引起的,并且可以影响身体的几乎任何部分。最常见的形式是肺结核,占英国所有病例的近55%(表32.1)。
结核病的症状多种多样,取决于感染的部位。一般症状可能包括发烧、食欲不振、体重减轻、盗汗和乏力。肺结核通常会引起持续的咳嗽,并伴有血丝样痰,或更罕见的明显咯血。未经治疗,大多数健康成人的结核病是一种缓慢进展的疾病,最终可能致命。
在英国,几乎所有的结核病病例都是通过呼吸途径获得的,即通过呼吸传染性呼吸道结核病患者的受感染呼吸道飞沫。当指示病例的痰在显微镜下呈杆菌涂片阳性时,传播是最有可能的,并且通常是在长期密切接触后,如生活在同一家庭中。
最初的感染可能:
- 被淘汰
- 保持潜伏状态——患者没有症状,但结核杆菌仍留在体内,或
- 在接下来的几周或几个月内进展为活动性结核
潜伏的结核感染可能在以后的生活中重新激活;特别是当个体的免疫系统变得虚弱时,例如由于疾病(例如HIV)、某些药物治疗(例如癌症化疗、皮质类固醇、抗TNF)或年老。
表32.1按发生频率排列的英国结核病病例的发病部位(2015年数据,英格兰公共卫生部、强化结核病监测(ETS)(英格兰威尔士和北爱尔兰)和强化分枝杆菌感染监测(ESMI)(苏格兰)
| 疾病部位* | 案例数量 | 案例百分比** |
| 肺的 | 3,330 | 53.5 |
| 栗粒状的 | 192 | 3.1 |
| 喉部 | 19 | 0.3 |
| 肺外的 | 2,894 | 46.5 |
| 胸外淋巴结 | 1,420 | 22.8 |
| 胸内淋巴结 | 810 | 13.0 |
| 未知肺外 | 592 | 9.5 |
| 胸膜的 | 507 | 8.2 |
| 其他肺外 | 422 | 6.7 |
| 胃肠的 | 361 | 5.8 |
| 骨刺 | 278 | 4.5 |
| 骨头-不是脊椎 | 144 | 2.3 |
| 中枢神经系统-脑膜炎 | 160 | 2.6 |
| 泌尿生殖器的 | 131 | 2.1 |
| 中枢神经系统-其他 | 122 | 2.0 |
| 隐蔽传播的 | 57 | 0.9 |
- 在另一个位置有或没有疾病
* *已知发病部位的病例比例(6,224例),总数超过100%,原因是不止一个部位的疾病
CNS-中枢神经系统
疾病的历史和流行病学
在上个世纪的大部分时间里,英国的结核病报告数量有所下降(图32.1)。1913年,即法定报告的第一年,英格兰和威尔士记录了117,139例新的结核病病例,这一数字逐渐下降到1987年的5,086例。20世纪80年代末,这一趋势发生逆转,结核病活动上升了65%,2011年达到8,411例新报告结核病病例的峰值。自那以来,活动再次下降,2015年英格兰和威尔士报告了5874例新病例。在英国,2011年至2015年间,结核病病例数量和发病率逐年下降,发病率降至每10万人9.6例(6240例)。
20世纪80年代末,结核病在英国某些地区的重新流行与流行病学的变化有关。在过去的50年里,结核病的负担已经从全体人口转移到特定的高危人群。在一些非英国出生的社区,结核病发病率较高,主要是因为这些社区与世界上结核病高度流行的地区相连。2015年,近四分之三被诊断患有结核病的英国患者出生在国外,病例主要集中在城市地区。无家可归、酒精滥用、药物滥用和监禁史等社会因素也显著增加了患结核病的风险。在过去25年中,英国的流行病学变化是在世界许多地区结核病控制恶化的背景下发生的,这导致世界卫生组织(WHO)于1993年宣布结核病为全球公共卫生紧急事件。自那时以来,已经启动了几项全球结核病战略,近年来,全球在结核病控制方面取得了一些进展。
在英国,自20世纪40年代出现有效的化疗和1953年引入常规青少年卡介苗(BCG)接种计划后,结核病死亡率迅速下降。然而,在2001年至2014年期间,英国每年仍有387至518人死于结核病(数据来自英国公共卫生部)。
虽然英国的耐药和耐多药(MDR)结核病水平仍然较低,但耐MDR/利福平(RR)结核病的比例在2000年(1.3%)和2011年(1.8%)之间略有上升,但此后在2015年降至1.5%(英国公共卫生,2016年)。
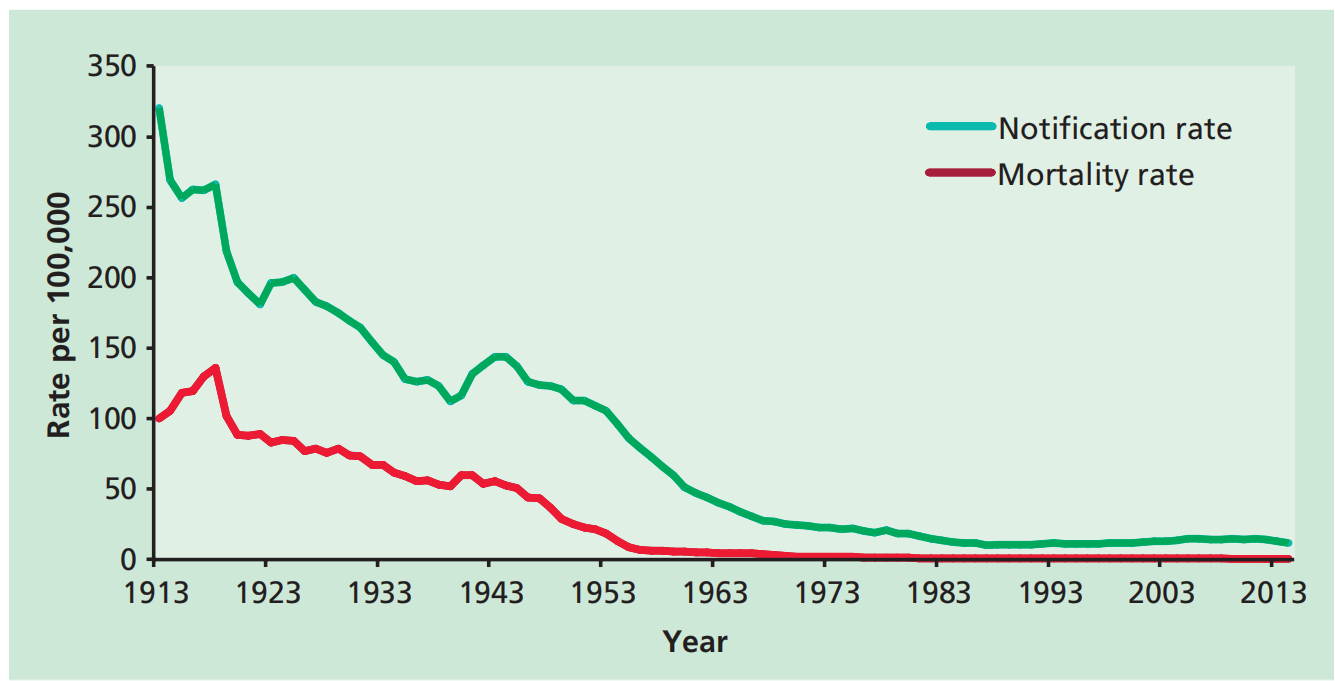
图32.1:英格兰和威尔士每年每100,000人的结核病报告和死亡率
卡介苗免疫接种计划
卡介苗免疫接种计划于1953年引入英国,并根据结核病流行病学的变化趋势经历了几次变革。该规划最初针对的是离校年龄(当时为14岁)的儿童,因为年轻的工作年龄的成年人是结核病的高发人群。
到20世纪60年代,英国出生人口的结核病发病率显著下降,结核病负担转移到来自高流行国家的新移民及其家庭。因此,建议尽早保护新加入者的子女,无论他们在哪里出生。作为其中的一部分,引入了选择性新生儿卡介苗免疫接种计划,通过在出生后不久接种疫苗来保护父母来自高流行国家的在英国出生的婴儿。
到20世纪90年代,10-14岁学龄儿童的卡介苗接种率约为70%;另有8%的人由于结核菌素呈阳性而免于免疫接种(卫生部)。2005年,随着英国出生人口中结核病发病率的持续下降,青少年项目被叫停。卡介苗免疫接种计划现在是一个基于风险的计划,其关键部分是一个新生儿计划,针对那些最有可能接触结核病的儿童,旨在保护他们免受更严重的儿童期疾病的影响。
卡介苗疫苗
卡介苗含有来自牛分枝杆菌的减毒活菌株。AJV卡介苗(AJ疫苗)是英国唯一获得许可的疫苗。它含有丹麦菌株1331。卡介苗不含硫柳汞或任何其他防腐剂。
关于卡介苗有效性的国际研究给出了广泛不同的结果,从没有保护到在英国学龄儿童中评估的70-80%的保护(Sutherland and Springett, 1987, Rodrigues et al., 1991)。然而,荟萃分析表明,该疫苗对最严重形式的疾病有70%至80%的有效性,如儿童结核病脑膜炎(Rodrigues et al., 1993)。它在预防呼吸系统疾病方面效果较差,而呼吸系统疾病在成人中更为常见。
保护作用已被证明可持续至少15年(世卫组织,1999年),最近的研究表明保护作用可持续长达60年(Aronson et al., 2004, NguipdopDjomo et al., 2016)。此后的保护期限数据有限,但保护可能会随着时间的推移而减弱。
关于成人(16岁或16岁以上)接种卡介苗后的保护作用的数据很少,关于35岁或35岁以上人群的数据几乎没有。
通常不建议16岁以上的人接种卡介苗,除非暴露风险很大(例如,医护人员或实验室工作人员因与确诊为结核病的患者直接临床接触或接触传染性结核病材料而面临职业风险)
AJV卡介苗的储存
未配制的疫苗及其稀释液应储存在原包装中
+2℃至+8℃,避光保护。如果疫苗和/或稀释剂已被冷冻,则不得使用。
疫苗应该用制造商提供的稀释剂重新配制,并立即使用。未使用的重组疫苗应在四小时后丢弃。重组后,疫苗在室温下可使用长达4小时。
AJV卡介苗剂型
该疫苗为冻干粉针剂。AJV卡介苗装在玻璃瓶中,相当于10个成人剂量或20个婴儿剂量,配有不含乳胶的溴化丁基橡胶塞。粉末必须用单独提供的1毫升稀释的Sauton AJV稀释剂重新配制。
接种卡介苗
在所有情况下,卡介苗必须严格皮内注射,通常在左上臂外侧三角肌插入处注射(就在左上臂中部上方——世卫组织推荐)。手臂上较高的部位,尤其是肩膀的尖端,更有可能导致瘢痕疙瘩的形成,应该避免。不应使用喷射注射器和多种穿刺装置。
为了确保正确的皮内给药,针的尺寸很重要。皮内技术是最精确的给药方法,因为可以精确地测量剂量,并且可以控制给药。正确给药可确保不良反应降至最低
上臂应该与身体成大约45度角。如果将手放在臀部,手臂从身体向外伸展,这在较大的儿童和成人中可以实现,但是在婴儿和较小的儿童中这是不可能的。对于这个年龄组,手臂必须牢牢保持在伸展位置(见第4章)。
如果皮肤看起来很脏,应该用肥皂和水清洗。通过特定的结核菌素注射器或配有26G±10mm(0.45mm×10mm)针头的1ml刻度注射器给每个人注射疫苗。正确剂量(见下文)的卡介苗应注入结核菌素注射器,并连接26G短斜面针头进行注射。必须牢固地连接针头,并以斜面朝上的方式进行皮内注射。
免疫接种者应拉伸一只手的拇指和食指之间的皮肤,用另一只手慢慢地将针插入,斜面向上,进入真皮浅层约3毫米,几乎与表面平行。通常可以透过表皮看到针。正确的皮内注射导致紧张、发白、凸起的气泡,并且在注射流体时会感觉到相当大的阻力。0.1毫升皮内注射后的气泡直径通常为7毫米,0.05毫升皮内注射后的气泡直径为3毫米。如果注射时感觉到很小的阻力,并且出现了与紧张的发白的水泡相反的扩散性肿胀,则针太深。在注射更多疫苗之前,应该将针头抽出并重新插入皮内
由于局部淋巴结炎的风险,至少三个月内不应在用于卡介苗免疫接种的手臂上进行进一步免疫接种。必须始终告知个人/父母/护理人员对注射的正常反应以及如何护理接种部位(见下文)。
轮状病毒、减毒流感活疫苗(LAIV)、口服伤寒疫苗、黄热病、水痘、带状疱疹和MMR等活疫苗可在卡介苗接种之前或之后的任何时间接种(英国公共卫生,2015年)。(参见第6章)
AJV卡介苗接种剂量和时间表
一剂:
0.05毫升 12个月以下婴儿
0.1毫升 12个月或以上的儿童和成人
一小瓶重组卡介苗AJV疫苗的容量足以提供10或20个申报剂量,尽管实际可提取的实际剂量可能更低。可从药瓶中取出的可提取剂量数
AJV重组卡介苗取决于所用注射器和针头的具体类型,以及疫苗接种期间由疫苗管理员移除的剩余疫苗。
处理
卡介苗废弃物应根据分类为潜在细胞毒性/抑制细胞生长的废弃物的建议进行处理(在紫色盖子的容器中)。
根据地方当局法规和技术备忘录07-01:医疗废物的安全管理(卫生部,2013年)中的指导,用于免疫接种的设备,包括用过的小瓶、安瓿或注射器中排出的疫苗,应在联合国批准的防穿刺“锐器”箱中安全处置。
疫苗使用建议
英国卡介苗免疫接种计划的目的是对那些发展为严重疾病和/或暴露于结核病感染风险增加的人进行免疫接种。
卡介苗免疫接种应提供给:
- 父母或祖父母出生在结核病年发病率为40/100,000或更高的国家的所有婴儿(0至12个月)
- 居住在英国结核病年发病率为40/100,000或更高的地区的所有婴儿(0至12个月)
- 出生在结核病年发病率为40/100,000或更高的国家的父母或祖父母以前未接种疫苗的1至5岁儿童。这些儿童应在适当的时机得到识别,通常无需结核菌素试验即可接种疫苗
- 6至16岁以前未接种疫苗的结核菌素阴性儿童,其父母或祖父母出生在结核病年发病率为40/100,000或更高的国家。应在适当的时机识别这些儿童,对其进行结核菌素测试,如果测试结果为阴性,则进行疫苗接种(参见“卡介苗接种前结核菌素测试”一节)
- 之前未接种过结核菌素阴性的16岁以下个体,痰涂片阳性的肺部或喉部结核病病例的家庭或同等密切接触者(遵循推荐的接触管理建议-参见美国国家健康与临床卓越研究所(NICE),2016年)
- 16岁以下以前未接种过疫苗的结核菌素阴性个体,他们出生在或长期居住在年结核病发病率为40/100,000或更高的国家(至少三个月)。
- 在全国结核病发病率为40/100,000或更高的地区实行普遍接种。这是出于操作原因,因为这些地理区域通常高度集中了来自世界上结核病发病率为40/100,000或更高的地区的家庭,因此传播事件的可能性更高。在一个地区引入普遍疫苗接种的决定是基于地理位置,以便以有效的方式将疫苗接种针对可能具有增加的结核病风险的儿童。这并不意味着生活在结核病发病率为40/100,000或更高的地区会增加儿童感染结核病的风险。这是因为大多数儿童感染可能发生在家庭环境中。此外,在英国,几乎没有证据表明结核病在学校传播。
有关流行率的国家信息,请参见:https://www。政府.uk/government/publications/tuberculosis-tb-按国家/地区/每100000人的比率
面临职业风险的个人
下列职业人群中,与结核病人直接接触或接触传染性物质的人,应接种卡介苗。
- 与结核病患者或潜在传染性临床材料或衍生分离物有直接接触的医护人员(HCW)或实验室工作人员。
- 兽医和工作人员,如处理动物或动物材料的屠宰场工人,他们可能会感染结核病。
在这些职业中,卡介苗被推荐用于未接种疫苗的结核菌素阴性个体。35岁以上成年人的卡介苗疗效数据很少。然而,由于这些人群有很高的暴露风险,并且没有安全问题,对35岁以上的人接种卡介苗可能是利大于弊。此外,有许多职业团体正在与更容易感染结核病的人一起工作。这些人包括为囚犯、无家可归者、滥用药物和酗酒者工作的人员以及为难民和寻求庇护者工作的人员。这些人群也可以考虑接种卡介苗。
应当注意的是,除了上述类别中所列的那些之外,接触HCW的风险不太可能超过一般人群的结核病背景风险,因此不需要常规接种疫苗。
旅行者和那些要去国外定居的人
根据旅行的目的地和性质,以前未接种过结核菌素阴性的人可能需要接种卡介苗(Cobelens et al., 2000)(Abubakar et al., 2011)。
旅行者感染结核病的风险取决于几个因素,包括该国的结核病发病率、旅行持续时间、与当地人口的接触程度、旅行者的工作环境(如果有)、旅行原因以及旅行者的易感性和年龄。游客感染结核病的风险很低,如果没有其他因素,就不需要接种卡介苗。
建议前往结核病年发病率为40/100,000或更高和/或耐多药结核病(MDR-TB)风险高的国家旅行3个月以上的以下人群接种该疫苗:
- 与朋友/家人或当地人一起旅行的16岁以下儿童
- 被诊断患有结核病(尤其是耐多药结核病)的患者的高风险暴露环境中的医务工作者
关于耐多药结核病高发国家的信息,请参见:http://www.who.int/tb/publications/global_report/en/
卡介苗接种的个人请求
为自己或孩子寻求疫苗接种的人应该接受结核病特定风险因素的评估。没有危险因素的人不应接种卡介苗,但应告知他们当前的政策并提供书面信息。更多信息请访问https://www.gov.uk/government/collections/immunisation#tuberculosis.
有危险因素的人应该进行结核菌素试验,并根据当地服务安排接种卡介苗。
重复接种卡介苗
虽然卡介苗疫苗提供的保护可能会随着时间的推移而减弱,但没有证据表明重复接种疫苗提供了显著的额外保护,因此不建议重复接种卡介苗疫苗。
禁忌症
疫苗不应用于:
- 那些已经接种过卡介苗的人
- 有结核病病史的人
- Mantoux(AJV)结核菌素皮肤试验后出现5毫米或以上硬结者
- 那些已经证实对疫苗成分有过敏反应的人
- 疑似或确诊活动性结核病例的家庭中两岁以下的儿童
- 母亲在怀孕期间接受免疫抑制生物疗法所生的婴儿(见下文)
- 正在接受或在过去6个月内已经接受,
- 用于恶性疾病或非恶性疾病免疫抑制化学疗法或放射疗法
- 实体器官移植的免疫抑制疗法(根据移植类型和患者的免疫状态有例外)
- 正在接受或在过去12个月内已经接受
- 免疫抑制生物疗法(例如抗TNF疗法,如阿仑单抗、ofatumumab和利妥昔单抗),除非专家另有指示。
- 正在接受或在过去3个月内接受过免疫抑制治疗的患者,包括:
- 服用高剂量皮质类固醇的成人和儿童(每天> 40毫克泼尼松龙或
20公斤以下儿童> 2毫克/公斤/天)超过1周
-
- 服用较低剂量皮质类固醇的成人和儿童(每天> 20mg泼尼松龙或
20公斤以下儿童> 1毫克/公斤/天)超过14天
-
- 非生物口服免疫调节药物,如甲氨蝶呤>每周25毫克、硫唑嘌呤> 3.0毫克/千克/天或6-巯基嘌呤> 1.5毫克/千克/天
- 对于使用非生物口服免疫调节药物的儿童(除了低剂量的药物,参见第6章),应在接种疫苗前寻求专家建议
更多信息见第6章-禁忌症和特殊注意事项
无论CD4细胞计数、ART使用、病毒载量和临床状况如何,所有HIV阳性患者绝对禁止接种卡介苗(BHIVA 2015)。只有当纯配方奶粉喂养的婴儿在12-14周时被确认未感染艾滋病毒时,艾滋病毒阳性母亲所生的婴儿才应接种卡介苗。然而,被认为艾滋病毒传播风险较低(孕36周或之后,母体VL <50个艾滋病毒RNA拷贝/毫升)但结核病暴露风险较高的婴儿可在出生时接种卡介苗(英国艾滋病毒协会,2014年)。
一些婴儿在子宫内暴露于肿瘤坏死因子拮抗剂后致死性卡介苗感染的病例已经通过黄卡计划进行了报道。对于在妊娠期间接受免疫抑制生物治疗的母亲所生的孩子,应推迟6个月接种包括卡介苗在内的活疫苗。如果对即将接种减毒活疫苗的婴儿是否会因母亲的治疗(包括通过母乳喂养暴露)而出现免疫抑制有任何疑问,应寻求专家建议。
更多信息见第6章-禁忌症和特殊注意事项
禁忌
没有发烧或全身不适的小病不是推迟免疫接种的正当理由。
如果个人急性不适,应推迟免疫接种,直到他们完全康复。这是为了避免由于错误地将任何体征或症状归因于疫苗的副作用而混淆任何急性疾病的鉴别诊断。
患有全身感染性皮肤病的人不应接种疫苗。如果存在湿疹,应选择无皮肤损伤的免疫部位。
怀孕和母乳喂养
怀孕期间不应接种卡介苗。尽管没有观察到卡介苗接种对胎儿的有害影响,但需要进一步的研究来证明其安全性(世卫组织,2004年)。
母乳喂养不是卡介苗的禁忌症,但是,如果对接受卡介苗接种的婴儿是否会因母亲的治疗(包括通过母乳喂养)而受到免疫抑制有任何疑问,应寻求专家的建议。
早产儿
根据时间表,早产儿在适当的年龄接种疫苗是很重要的。当对极早产儿(出生时≤ 28孕周)给药时,应考虑窒息的潜在风险和对48-72小时呼吸监测的需要,尤其是对那些有呼吸不成熟病史的婴儿。由于这一组婴儿接种疫苗的益处很大,因此不应停止或推迟接种疫苗。
以前接种过卡介苗
卡介苗不应用于之前接种过疫苗的个体,因为不良反应的风险增加,且没有证据表明有额外的保护作用。以前接种过卡介苗的证据包括:书面证据;清晰、可靠的疫苗接种史;或者是典型伤疤的证据。
确定可靠的卡介苗接种史可能因以下原因而变得复杂:
- 文件证据缺失或有限
- 不可靠的疫苗召回
- 在一些皮内接种的个体中没有特征性疤痕
- 经皮接种疫苗的高比例个体中没有疤痕
- 使用非标准接种点
先前卡介苗接种史不确定的个体应在接种卡介苗前进行结核菌素试验。在可能有既往疫苗接种史但没有证据的情况下,是否提供卡介苗的最终决定必须权衡可能再次接种的风险与疫苗接种的潜在益处以及个人暴露于结核病的风险,特别是在职业环境中。
免疫反应和免疫部位的护理
在90-95%的接受者中观察到的对成功的卡介苗接种的预期反应是在注射部位出现硬结,随后是在接种后两周或更长时间开始出现丘疹的局部病变。它可能会溃烂,然后在几周或几个月内慢慢消退愈合,留下一个小而平的疤痕。也可能包括局部淋巴结肿大到小于1cm。
没有必要在清洗和洗澡时保护该部位不被弄湿。注射部位最好不要覆盖,以利于愈合。应鼓励溃疡干燥,并应避免擦伤(如紧身衣服)。
如果出现任何渗出,可以使用临时干敷料,直到结痂形成。不排除空气是很重要的。如果绝对必要(例如允许游泳),可以使用防渗敷料,但只能短期使用,因为它可能会延迟愈合并导致更大的疤痕。应考虑排出病灶中细菌重复感染的可能性。
常规接种卡介苗后的进一步观察是不必要的,除了作为监测项目质量的一部分,也不建议进一步的结核菌素试验。
不良反应
严重的注射部位反应、大的局部排出性溃疡、脓肿和瘢痕疙瘩是最常见的由错误的注射技术、过量剂量或结核菌素阳性的接种个体引起的。所有卫生专业人员都必须在结核菌素皮肤试验和卡介苗接种过程的各个方面接受适当的培训。
其他不良反应
对疫苗的不良反应包括头痛、发烧和局部淋巴结肿大到1cm以上,可能会溃疡。
过敏反应(包括过敏反应)、更严重的局部反应(如脓肿形成)和播散性卡介苗并发症(如骨炎或骨髓炎)很少见,应由专家处理。
应记录所有可能与卡介苗接种相关的严重或异常不良反应(包括脓肿和瘢痕疙瘩),并通过黄卡计划向人类药物委员会报告,还应审查接种方案和技术。应尽一切努力从任何构成严重并发症的病变中恢复并鉴定致病微生物。
不良反应的管理
接种卡介苗后出现严重局部反应(大于1cm的溃疡、干酪样病变、脓肿或注射部位的引流液)或伴有引流窦的区域性化脓性淋巴结炎的患者,应转诊至结核病医生或儿科医生处进行调查和处理。
粘连的、化脓的或成瘘的淋巴结可被吸出,并让其愈合(Cuello-Garcia et al., 2013) (Hart et al., 2013)。几乎没有证据支持局部滴注抗分枝杆菌药物或全身治疗严重持续病变的患者。
播散性卡介苗感染应转介给结核病医生或儿科医生,以获得专家建议,通常需要按照当前牛分枝杆菌感染管理指南进行系统性抗结核治疗(英国胸科协会联合结核病委员会,2000年,NICE,2016年)。
卡介苗与所有牛分枝杆菌菌株一样,对吡嗪酰胺具有内在抗性。体外试验表明,卡介苗对利福平敏感,尽管一些卡介苗菌株对异烟肼表现出低水平的耐药性,但这可能没有临床意义。
建议治疗卡介苗菌株感染病例的临床医生寻求专家建议。
过量
用药过量会增加严重局部反应和化脓性淋巴结炎的风险,并可能导致过度瘢痕形成。反应的程度很可能取决于是否有或有多少疫苗是通过皮下或肌肉注射而不是皮内注射。
应根据当地政策记录任何导致接种过量卡介苗的事件。应告知疫苗接种者或其护理者以及当地结核病医生/儿科医生。临床医生应决定是否需要预防性化疗,并确保对不良反应的早期迹象进行适当的监测。
卡介苗免疫接种前的结核菌素皮肤试验——Mantoux测试卡介苗不应用于结核菌素试验阳性的个体——这是不必要的,可能会导致更严重的局部反应。那些带一个
Mantoux(AJV)结核菌素皮肤试验硬结达到5毫米或更大时,应转到结核病诊所,以评估是否需要进一步调查和治疗
在接种卡介苗之前,结核菌素皮肤试验对以下人群是必要的:
- 六岁或六岁以上的所有人
- 在年结核病发病率为40/100,000或更高的国家有居住或长期停留史(超过3个月)的婴儿和6岁以下儿童
- 与已知患有结核病的人有过密切接触的人
- 过去五年内有结核病家族史的人
在结核菌素试验阴性后的三个月内可以接种卡介苗。
Mantoux试验用作结核病感染或疾病的筛选试验,并作为诊断的辅助手段。对注射入皮肤的结核菌素纯化蛋白衍生物(PPD)的局部皮肤反应用于评估个体对结核菌素蛋白的敏感性。反应越强烈,个人被感染或患有活动性结核病的可能性就越大。
在英国使用的标准试验是Mantoux试验,使用2TU/0.1ml结核菌素PPD。
纯化蛋白质衍生物储存
结核菌素PPD AJV应储存在原包装中,温度为+2℃至+8℃,并避光保存。冷冻可能会导致活性丧失。
剂型
英国使用的结核菌素PPD由AJ疫苗公司提供。AJ疫苗是一种无菌制剂,由7种选定的结核分枝杆菌菌株培养而成。它是一种无色至淡黄色的注射用溶液。它装在玻璃瓶中,带有不含乳胶的氯化丁基橡胶塞
剂量
0.1毫升适当的结核菌素PPD制剂。
在英国,标准浓度的纯化蛋白衍生物(PPD) 2TU/0.1ml用于常规Mantoux检测,以识别活动性结核病例的接触者、移民和接受免疫抑制治疗前的个体中的潜在结核感染。
如果第一次Mantoux克斯试验(PPD 2TU)呈阴性(直径小于5毫米),且认为再次试验适合于临床目的(例如,在免疫功能低下的患者/接触者中,Mantoux试验反应被认为不可靠),PHE建议将干扰素γ释放试验(IGRA)与使用PPD 2TU的Mantoux试验结合使用。
有关IGRA测试的更多信息,请访问at: https://www.gov.uk/government/publications/tuberculosis-tb-interferon-gamma-release-assay-tests
Mantoux测试的管理
在所有情况下,Mantoux试验通常应在左前臂屈肌表面的上三分之一处与下三分之二处进行皮内注射(有时称为皮内注射)。
如果皮肤看起来很脏,应该用肥皂和水清洗。曼托氏试验使用0.1毫升结核菌素注射器进行,或者使用配有短斜面26G(0.45毫米±10毫米)针头的1毫升刻度注射器进行。每个对象必须使用单独的注射器和针头,以防止交叉感染。应将0.1毫升PPD吸入结核菌素注射器,并连接25克或26克短斜面针头进行注射。必须牢固地连接针头,并且在实施皮内注射时使斜面朝上。
操作者拉伸一只手的拇指和食指之间的皮肤,用另一只手慢慢地将针插入,使斜面向上,进入真皮的表层大约3毫米,几乎与表面平行。通常可以透过表皮看到针。正确的皮内注射导致紧张、发白、凸起的气泡,并且在注射流体时会感觉到相当大的阻力。在0.1毫升皮内注射后,典型的水泡直径为7毫米。如果注射时几乎感觉不到阻力,并且出现了弥漫性肿胀,而不是紧张、发白的水泡,则表明针头太深。应该将针抽出并重新插入皮内。
Mantoux试验可以在接种灭活疫苗的同时进行。活病毒疫苗可以抑制结核菌素反应,因此在接受可注射的活病毒后四周内不应进行试验疫苗如MMR。如果不迫切需要MMR,则应将其延迟到读取完Mantoux之后(见下文)。
处理
用于Mantoux测试的设备,包括用过的小瓶或安瓿,应在测试结束时密封在一个合适的防刺穿“锐器”盒中进行处理
(未经批准,BS 7320)。
阅读Mantoux测试
应该在测试后48到72小时读取结果,但有效读数通常可以在96小时后获得。用直尺测量注射部位硬化区域的横向直径,结果以毫米为单位记录。由于有几个因素会影响对测试的解释,因此应该记录硬结的大小,而不仅仅是作为阴性或阳性结果。红斑的面积无关紧要。
测试产生最大反应的时间存在一定的可变性。大多数结核菌素敏感受试者在推荐的阅读时间将呈阳性。然而,少数可能在标准时间之前或之后达到最大响应。
解读Mantoux测试
为方便起见,对Mantoux测试的响应分为如下几类:
| 硬结直径 | 解释 | 行动 |
| 小于5毫米 | 阴性–对结核菌素蛋白无明显过敏反应 | 如果没有禁忌症,以前未接种的人可以接种卡介苗 |
| 5毫米或更大* | 阳性–对结核菌素蛋白过敏 | 不应接种卡介苗
应根据NICE的指导对该个人进行进一步调查 |
*先前接种卡介苗可能导致结核菌素皮试结果呈弱阳性。然而,NICE的经济模型表明,对所有Mantoux检测呈阳性的个体进行潜伏性结核治疗,无论先前是否接种卡介苗,都具有成本效益。
为了评估一个人是否能从卡介苗接种中获益,Mantoux试验或γ干扰素释放试验(IGRA)阳性表明既往致敏是不接种卡介苗的指征。硬结小于5毫米的Mantoux表明一个人将受益于卡介苗,而干扰素γ释放试验阴性不应作为决定给予卡介苗的唯一依据。在没有Mantoux试验的情况下,IGRA阴性的患者只能在没有卡介苗既往记录、卡介苗疤痕或可靠的卡介苗接种史的情况下接受卡介苗治疗。
影响结核菌素试验结果的因素
对结核菌素蛋白的反应可通过以下方式抑制:
- 腺热
- 病毒感染,如麻疹和水痘带状疱疹(水痘),但不包括上呼吸道感染或肠胃炎 (Starr et al.,1964) (Mitchell et al.,1935)
- 活病毒疫苗(接受可注射的活病毒疫苗后四周内不应进行结核菌素试验)
- 肉状瘤病
- 皮质类固醇疗法
- 疾病或治疗引起的免疫抑制,包括HIV感染
如果受试者的检测结果为阴性,但在检测时或阅读时可能患有严重感染(如麻疹、水痘带状疱疹(水痘)、猩红热、腺热),则应在临床痊愈后两到三周内再次检测,然后再接种卡介苗。如果有必要进行第二次结核菌素试验,则应在另一只手臂上进行:在一个部位重复试验可能会改变反应性,可能是皮肤过敏,也可能是皮肤过敏,反应的改变可能仅反映皮肤敏感性的局部变化。
肺/喉结核接触者的管理
应根据NICE指南管理家庭接触或与痰涂片阳性肺结核或喉结核病例的家庭接触或同等接触的接触者。
与涂片阳性的肺结核或喉结核病例有过接触的2岁以下儿童应立即给予化学预防,即使他们最初的结核菌素皮肤试验是阴性的,然后在6周后进行结核菌素试验。如果皮试呈阴性,就注射卡介苗
与非涂片阳性结核病例接触的新生儿应立即接种卡介苗。
供应
卡介苗在英格兰、威尔士和苏格兰可从以下渠道获得:
即时联系电话:0844 376 0040。网址:www.immform.dh.gov.uk
如果尚未在ImmForm上注册,您需要在下订单前及时注册。
在北爱尔兰,应通过正常的儿童疫苗分发安排获得供应,详情请致电028 9442 4089与地区药品采购处联系。
参考
Abubakar I, Matthews T, Harmer D, Okereke E, Crawford K, Hall T, Collyns T, Smith G, Barrett A, Baugh S.
Assessing the effect of foreign travel and protection by BCG vaccination on the spread of tuberculosis in a
low incidence country, United Kingdom, October 2008 to December 2009 . Euro Surveill.
2011;16(12):pii=19826. Available online: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19826
Aronson NE, Santosham M, Comstock GW, Howard RS, Moulton LH, Rhoades ER, et al. Long-term efficacy of
BCG vaccine in American Indians and Alaska Natives: a 60-year follow-up study. Jama 2004; 291(May 5
(17):2086–91
British HIV Association Guidelines for the Management of HIV Infection in Pregnant Women (2014). Available
online from:
http://www.bhiva.org/documents/Guidelines/Pregnancy/2012/BHIVA-Pregnancy-guidelines-update-2014.pdf
BHIVA guidelines on the use of vaccines in HIV-positive adults (2015). Available online from: http://www.
bhiva.org/vaccination-guidelines.aspx
Cobelens FG, van Deutekom H, Draayer-Jansen IW et al. (2000) Risk of infection with Mycobacterium
tuberculosis in travellers to areas of high tuberculosis endemicity. Lancet 356: 461–5.
Cuello-García CA1, Pérez-Gaxiola G, Jiménez Gutiérrez C (2013) Treating BCG-induced disease in children.
Cochrane Database Syst Rev. 2013 Jan 31;(1):CD008300
Global TB report 2016 Available online http://www.who.int/tb/publications/global_report/en/
Hart N, Broomfield C (2013) Management of BCG Related Lymphadenitis. http://bestbets.org/bets/bet.
php?id=2449
Joint Tuberculosis Committee of the British Thoracic Society (2000) Control and prevention of tuberculosis in
the United Kingdom: Code of Practice 2000. Thorax 55: 887–901.
Klein NP, Massolo ML, Greene J et al. (2008) Risk factors for developing apnea after immunization in the
neonatal intensive care unit. Pediatrics 121(3): 463-9.
Medicines and Healthcare products Regulatory Agency. (2016) Drug Safety Update. Available online from:
https://www.gov.uk/drug-safety-update/live-attenuated-vaccines-avoid-use-in-those-who-are-clinicallyimmunosuppressed
Mitchell AG , Nelson WE, LeBlanc TJ (1935) Studies in immunity. V. Effect of acute diseases on the reaction of
the skin to tuberculin. Am J Dis Child 49:695-702,
National Institute for Health and Clinical Excellence (2006) Tuberculosis: Clinical diagnosis and management
of tuberculosis, and measures for its prevention and control (CG33). www.nice.org.uk/page.aspx?o=CG033.
National Institute for Health and Clinical Excellence (2016) Tuberculosis: Clinical diagnosis and management
of tuberculosis, and measures for its prevention and control (NG33). Available online from: https://www.nice.
org.uk/guidance/ng33/resources/tuberculosis-1837390683589
Nguipdop-Djomo P, Einar H, Rodrigues LC et al. (2016) Duration of BCG protection against tuberculosis and
change in effectiveness with time since vaccination in Norway: a retrospective population-based cohort study.
The Lancet Infectious Diseases, 16 (2): 219 – 226
Ohlsson A and Lacy JB (2004) Intravenous immunoglobulin for preventing infection in preterm and/or lowbirth-weight infants. Cochrane Database Syst Rev(1): CD000361.
Pfister RE, Aeschbach V, Niksic-Stuber V et al. (2004) Safety of DTaP-based combined immunization in verylow-birth-weight premature infants: frequent but mostly benign cardiorespiratory events. J Pediatr 145(1):
58-66.
Pourcyrous M, Korones SB, Arheart KL et al. (2007) Primary immunization of premature infants with
gestational age <35 weeks: cardiorespiratory complications and C-reactive protein responses associated with
administration of single and multiple separate vaccines simultaneously. J Pediatr 151(2): 167-72.Public Health
England (2016)
Reports of cases of tuberculosis to enhanced tuberculosis surveillance systems: UK, 2000 to 2015.Available
online:https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/555298/TB_Official_
Statistics_2016_GTW2309.pdf
Public Health England (2015) Revised recommendations for the administration of more than one live vaccine.
Available online: https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/422798/PHE_
recommendations_for_administering_more_than_one_live_vaccine_April_2015FINAL_.pdf
Rodrigues LC, Gill ON and Smith PG (1991) BCG vaccination in the first year of life protects children of Indian
subcontinent ethnic origin against tuberculosis in England. Epidemiol Community Health 45: 78–80.
Rodrigues LC, Diwan VK and Wheeler JG (1993) Protective effect of BCG against tuberculous meningitis and
military tuberculosis: a meta-analysis. Int J Epidemiol 22: 1154–8.
Schulzke S, Heininger U, Lucking-Famira M et al. (2005 ) Apnoea and bradycardia in preterm infants
following immunisation with pentavalent or hexavalent vaccines. Eur J Pediatr 164(7): 432-5.
Starr S, Berkovich S (1964) The depression of tuberculin reactivity during chickenpox. Pediatrics 33:769-72.
Sutherland I and Springett VH (1987) Effectiveness of BCG vaccination in England and Wales in 1983.
Tubercle 68: 81–92.
World Health Organization (1999) Issues relating to the use of BCG in immunization programmes. A
discussion document by Paul EM Fine, Ilona AM Carneiro, Julie B Milstien and C John Clements. www.who.
int/entity/vaccine_research/documents/en/bcg_vaccines.pdf
World Health Organization (2004) Weekly epidemiological record. Available online:
http://www.who.int/wer/2004/en/wer7904.pdf?ua=1
Tubercu




