第8章:疫苗安全性和免疫接种后不良事件的管理
2012年8月
介绍
疫苗通过引发针对特定抗原的主动免疫反应来诱导保护。可能会有可预见的不良反应(副作用):大多数是轻微的,很快解决。然而,并不总是能够预测对疫苗可能有轻微或严重反应的个体。本章建议使用世界卫生组织(世卫组织)的免疫接种后不良事件分类(AEFIs)。它概述了与疫苗相关的常见副作用和严重不良反应(如过敏反应)的管理。第9章描述了英国疫苗安全性监测流程以及通过黄卡计划报告疑似疫苗引起的药物不良反应(ADRs)。
免疫接种后的不良事件
AEFIs可能是疫苗固有的真正的不良反应,也可能是由给药方式引起的,或者与接受者的潜在状况有关。其他AEFIs可能是巧合,无论是否接种疫苗都会发生。
世卫组织将AEFIs分为四大类:
- 与方案有关的
- 疫苗诱导的
- 巧合的
- 未知。
与方案有关的免疫不良事件
这些不良事件是由疫苗接种过程中的不当做法造成的。这些可能包括:
- 注射了错误剂量的疫苗
- 使用过期的疫苗
- 在不适当的时间间隔使用疫苗
- 给药途径、部位或技术不当
- 用不正确的稀释剂重新配制的疫苗
- 使用了错误的稀释剂数量
- 疫苗准备不正确
- 混合成不适当的组合
- 替代疫苗或稀释剂的药物
- 疫苗或稀释剂被污染
- 疫苗或稀释剂储存不正确
- 禁忌症没有被引出或忽略
- 复原疫苗保存时间超过建议期限。
一些AEFIs可由疫苗接种过程本身诱发。施用疫苗而非任何疫苗成分会导致AEFI:例如,在1999-2000年C型脑膜炎免疫接种活动期间,年龄较大的儿童和成人出现昏厥(Medicines Control Agency, 2000)。
疫苗诱导的不良事件
这些是由特定疫苗或其组成部分在个体中特别引起的反应。这些可能是疫苗或其成分之一的诱导、直接作用,和/或由于潜在的医学状况或接受者的特异反应。
疫苗的直接作用包括,例如,DTaP/IPV/Hib后48小时内的局部反应和发热,MMR后7-10天的皮疹和发热,以及MMR后3周的腮腺炎。
由基础疾病引起的AEFI的一个例子是疫苗相关瘫痪,这种情况在对以前未发现的严重联合免疫缺陷的儿童使用口服脊髓灰质炎减毒活疫苗后非常罕见。
特异性反应包括MMR后30天内的特发性血小板减少性紫癜(ITP ),以及接种疫苗后立即出现的过敏反应。
当已确认对前一剂相同疫苗有过敏反应,则禁止再次接种相同疫苗或该疫苗的成分。
这一类别还包括在个体的某个时间点已经发生但由疫苗接种更早触发的医学状况。这可能包括有热性惊厥家族史的儿童,或婴儿痉挛发作(Bellman et al., 1983)。
巧合事件
这些不是对免疫或疫苗的真正不良反应,只是因为它们发生的时间而有联系。当AEFI是巧合时,即使个体没有免疫,该事件也会发生。一个例子是接种流感疫苗后出现感冒症状的人。流感疫苗不能预防普通感冒,而感冒在冬季人们接种流感疫苗时是很常见的。
未知不良事件
定义为AEFIs,但没有足够的证据将其归类为上述情况之一。
常见疫苗诱导的不良事件
常见的疫苗诱发的不良事件包括:
- 注射部位疼痛、肿胀或发红。这些通常发生在免疫接种后,应该预料到
- 通常在注射后几小时内开始的局部不良反应,通常是轻微的和自限性的。虽然这些通常被称为“超敏反应”,但它们并非过敏原,而是可能是由于高滴度的抗体或疫苗产品的直接作用,例如全细胞细菌疫苗中的内毒素。这种局部反应的发生或严重程度并不意味着禁止使用相同疫苗或含有相同抗原的疫苗进行进一步的免疫接种
- 全身不良反应,包括发热、不适、肌痛、易怒、头痛和食欲不振。全身反应的时间将根据所接种疫苗的特性、接受者的年龄和对该疫苗的生物反应而变化。例如,发烧可能在接种含破伤风疫苗的几小时内开始,但在接种含麻疹疫苗后7至10天出现。这种全身性反应的发生并不意味着禁止使用更多剂量的相同疫苗或含有相同抗原的疫苗。
常规和其他儿童免疫接种后常见的副作用类型在相关章节中有所描述,并详细说明了最有可能发生的时间。
管理常见疫苗诱导的不良事件
应该向父母提供关于他们可以预期的不良事件以及如何处理这些事件的建议。卫生署提供的疫苗单张提供有关急性免疫缺陷综合征的资料,并包括有关管理的建议。
超过37.5℃的发烧在儿童中很常见,而且通常很轻微。应在免疫接种时提供关于治疗发烧的扑热息痛或布洛芬液体的用法和适当剂量的建议。国家健康和临床卓越研究所关于五岁以下儿童发热疾病治疗的指导可在以下网址找到: http://www.nice.org.uk/nicemedia/live/11010/30523/30523.pdf。局部反应通常是自限性的,不需要治疗。如果出现不适,可使用扑热息痛或布洛芬。
虽然扑热息痛和布洛芬可以缩短发热持续时间并减轻痛苦,但没有证据表明它们可以预防热性惊厥。因此,不建议在接种疫苗后常规使用这些药物来预防发热,因为有证据表明,在接种疫苗期间预防性施用退热药物可能会降低对某些疫苗的抗体反应(Prymula et al., 2009)。
阿司匹林或含有阿司匹林的药物不应给16岁以下的儿童服用,因为有患雷氏综合征的风险。
硫柳汞
硫柳汞是一种汞基化合物,多年来一直被用作制造某些疫苗的防腐剂。在英国,没有一种常规的儿童疫苗含有硫柳汞。两种疫苗(炭疽和绿十字日本脑炎疫苗)添加了硫柳汞以保持批次无菌,少量其他疫苗(Engerix B、Twinrix、Ambirix、Fendrix和Fluvirin)在生产中使用硫柳汞,
因此可能含有痕量的化合物。这些疫苗将在后面的相关章节中介绍。
理论上,人们对儿童通过接种疫苗接触硫柳汞产生了担忧。这种担忧主要基于相关物质甲基汞的急性毒性数据,以及食物链中汞的慢性接触数据。然而,疫苗中低水平的硫柳汞从未与这些或类似情况相关联,包括儿童或孕妇。硫柳汞与局部过敏反应的风险极低有关((Leventhal et al., 2012),局部过敏反应可表现为注射部位的发红、肿胀或皮疹。
自1999年以来,在公布的流行病学证据的支持下,一些监管机构和科学委员会审查了疫苗中硫柳汞的安全性。这些机构包括英国药品安全委员会(CSM)、世界卫生组织、美国医学研究所和欧洲药品管理局。这些审查一致认为,没有证据表明含有硫柳汞的疫苗与神经发育障碍(包括自闭症)之间存在关联。
罕见疫苗引起的AEFIs
其他一些AEFIs很少发生,包括神经或免疫介导的AEFIs。实例包括癫痫发作、低渗-低反应性发作(HHE)、特发性血小板减少性紫癜(ITP)、急性关节病、过敏反应和过敏反应。
过敏性
对疫苗的过敏反应极其罕见,但有可能致命。在1997年和2003年之间,向药品和保健产品管理局(MHRA)报告了130例免疫接种后的过敏反应或过敏型反应(不包括脑膜炎C疫苗接种),尽管没有因该反应导致死亡的报告。在此期间,约有1.17亿剂疫苗供应给了医院和全科医生。这一比率(大约每百万疫苗剂量中有一个)与其他国家报告的比率相似(Bohlke et al., 2003; Canadian Medical Association, 2002)。
过敏反应发作迅速,通常在几分钟内,其临床过程不可预测,具有不同的严重程度和临床特征。由于过敏反应的不可预测性,不可能定义
免疫接种后应观察所有个体的特定时间段,以确保他们不会出现过敏反应。
大多数过敏反应发生在没有已知危险因素的个体中。一套标准不能识别所有的过敏反应。有一系列的迹象和症状,其中没有一个是完全特定的过敏反应;然而,某些体征的组合使得过敏反应的诊断更有可能(Brown,2004)。在识别和治疗任何急性疾病患者时,必须遵循合理的气道、呼吸、循环、残疾、暴露(ABCDE)方法,并在发现威胁生命的问题时进行治疗(Resuscitation Council UK, 2008)。
混淆是因为一些患者有不太严重的全身过敏反应。例如,全身性荨麻疹、血管性水肿和鼻炎不会被描述为过敏性反应,因为危及生命的特征-气道问题、呼吸困难(呼吸问题)和低血压(循环问题)-不存在。
当满足以下三个标准时,可能会出现过敏反应:
- 症状的突然发作和快速发展
- 危及生命的呼吸道和/或呼吸和/或循环问题
- 皮肤和/或粘膜变化(潮红、荨麻疹、血管性水肿)。
以下内容支持该诊断:
- 暴露于已知的过敏原,而已知患者已经过敏。
请记住:
- 皮肤或粘膜变化本身并不是过敏反应的迹象
- 在高达20%的反应中,皮肤和粘膜变化可能是细微的或不存在的(一些患者可能只有血压下降,即循环问题)
- 也可能有胃肠道症状(如呕吐、腹痛、失禁)。
大多数过敏反应发生在没有已知危险因素的个体中。
所有参与免疫接种的医护人员都应该能够区分过敏反应与昏厥(晕厥)和恐慌发作。
接种疫苗时,成人和青少年晕倒相对常见,但婴儿和儿童很少晕倒。幼儿突然失去知觉应被认为是过敏反应,特别是如果没有强有力的中枢脉搏。在昏厥或癫痫发作期间,强有力的中枢脉冲持续存在。
表8.1中列出的特征区分了过敏反应和昏厥。如果诊断不明确,应假定为过敏反应,并给予适当的处理。
昏厥后应该会很快恢复。尽管身体不适的症状可能会持续,但病人应该会在几分钟内恢复知觉。
惊恐发作也应与过敏反应相区别。有些人甚至在接种疫苗之前就可能会惊恐发作。症状包括过度换气,可能导致手臂和腿部感觉异常(麻木和刺痛)。可能会出现与焦虑相关的红斑,但不会出现低血压、苍白或喘息。
过敏反应管理指南已经修改,以确保英国复苏委员会、英国国家处方集、疫苗和免疫联合委员会以及皇家儿科和儿童健康学院之间的一致(Resuscitation Council UK, 2008)。
所有负责免疫接种的卫生专业人员必须熟悉过敏反应患者的复苏技术,以防止残疾和死亡。无论何时接种疫苗,都必须有过敏反应处理方案和过敏反应包。
表8.1昏厥和过敏反应的临床特征
| 开始 | 昏晕 | 过敏性 |
| 之前,期间
或者在注射疫苗的几分钟内 |
通常在5分钟内,但也可能在接种疫苗后数小时内发生 | |
| 症状/体征 | ||
| 皮肤 | 普遍的苍白,冰冷湿冷的皮肤 | 皮肤瘙痒,
皮肤苍白或潮红,红色或苍白荨麻疹(weals)或血管性水肿 |
| 呼吸的 | 正常呼吸——可能很浅,但不吃力 | 咳嗽、喘息、喘鸣或呼吸窘迫症状(呼吸急促、发绀、肋骨退缩) |
| 心血管的 | 心动过缓,但中枢脉搏强;低血压–
通常是短暂的,仰卧位矫正 |
心动过速,中心脉搏微弱/缺失;低血压–持续 |
| 神经病学的 | 头晕的感觉;意识丧失
–改善仰卧或低头姿势;短暂的肢体抽搐和翻白眼,可能与癫痫发作相混淆;失禁 |
严重的焦虑和痛苦感;
意识丧失——仰卧位或头低位无改善 |
过敏反应包通常包含两安瓿1:1000的肾上腺素(肾上腺素)、四个23G针头和四个1ml刻度注射器,以及适合儿童和成人的Laerdal或等效口罩。应定期检查包装,以确保内容物在有效期内。氯苯那敏(扑尔敏)和氢化可的松不是一线治疗药物,不需要包含在包装中。
立即行动
1请求额外的健康专家协助(见图8.1和8.2)。
2派一个负责任的成年人拨打999,说明有疑似过敏反应的病例。
- 任何时候都要和病人在一起。
- 让病人躺下,最好双腿抬高(除非病人呼吸困难)。
- 如果可能的话,给病人输氧。
- 如果呼吸停止,应该进行口对口人工呼吸。
- 如果没有脉搏,开始心肺复苏。
所有具有休克、气道肿胀或明确呼吸困难临床症状的患者应通过肌肉注射(IM)给予1:1000的肾上腺素(肾上腺素)(切勿皮下注射)。关于给药剂量的信息见下文。首选部位是大腿前外侧的中点(Simons et al.,
1998)。如果没有临床改善,五分钟后可重复该剂量。如果需要,可以给予更大剂量的肾上腺素。
静脉注射(IV)肾上腺素(肾上腺素)是危险的,只有在极度紧急的情况下,当患者深度休克并立即危及生命时,才应考虑使用。只能用稀释的肾上腺素(至少1:10000),注射要慢。静脉注射肾上腺素只能由有经验的人使用,最好是在患者接受监护的情况下使用(至少要进行脉搏血氧测定、血压、心电图检查)。
由于可能会出现延迟反应,出现过敏反应的人应该被送往医院,即使他们可能看起来已经完全康复。
一旦氧气可用,立即给予高流量氧疗。救援人员应该根据他们的训练水平和可用的设备来管理气道。
适当剂量的肾上腺素(肾上腺素)1:1000 (1mg/ml)溶液应立即肌注给药(见表8.2)。如果临床症状没有改善,可以在大约五分钟后重复给药。
在某些情况下,可能需要几个剂量,特别是如果改善是短暂的。
表8.2按年龄划分的肾上腺素(肾上腺素)剂量
| 年龄 | 肾上腺素的剂量(肾上腺素) |
| 体积规定为1:1000肾上腺素 | |
| 6个月以下 | 150微克肌肉注射(0.15毫升)* |
| 6个月以上但6岁以下 | 150微克肌肉注射(0.15毫升)* |
| 6至12岁 | 300微克肌肉注射(0.30毫升) |
| 12岁以上包括成人 | 500微克肌肉注射(0.5毫升) |
自我注射肾上腺素的自动注射器不能代替适当的过敏反应包。然而,如果肾上腺素自动注射器是治疗过敏反应时唯一可用的肾上腺素制剂,卫生保健提供者应该使用它。
警告
因为对肾上腺素的反应存在很大的个体间差异,所以监测反应是很重要的。从推荐剂量开始,如果需要更大的反应,给予更多的剂量;换句话说,根据效果调整剂量(Resuscitation Council UK, 2008)
进一步管理
抗组胺药和/或氢化可的松不是过敏反应紧急处理的一线药物。然而,在由受过适当训练的工作人员进一步处理过敏反应时,应该考虑到它们。
氯苯那敏;扑尔敏
根据年龄,氯苯那敏的适当剂量应通过肌肉注射(或适当时缓慢静脉注射)给药(见表8.3)
表8.3按年龄划分的氯苯那敏剂量
| 年龄 | 氯苯那敏的剂量* |
| 6个月以下 | 250微克/千克 |
| 6个月到6岁以下 | 2.5毫克 |
| 6至12岁 | 5毫克 |
| 12岁以上,包括成人 | 10毫克 |
| *通过肌肉注射或缓慢静脉注射(由于药物控制性低血压的可能性)。 | |
氯苯那敏(缓慢静脉注射)是肾上腺素治疗过敏反应的有效辅助药物。它可以在肾上腺素后给药,并持续24至48小时以防止复发。
氢化可的松
根据年龄,氢化可的松的适当剂量应通过肌肉注射或缓慢静脉注射给药(见表8.4)。
表8.4按年龄划分的氢化可的松剂量
| 年龄 | 氯苯那敏的剂量* |
| 6个月以下 | 25毫克 |
| 6个月到6岁以下 | 50毫克 |
| 6至12岁 | 100毫克 |
| 12岁以上,包括成人 | 200毫克 |
| *缓慢静脉注射或肌肉注射 | |
氢化可的松只能在严重过敏发作后使用,以防止任何晚期症状。
持续恶化需要进一步治疗,包括补液。一旦可以进行静脉注射,晶体溶液(如0.9%氯化钠或哈特曼溶液)可能比胶体溶液更安全,应快速输注1-2l,或对儿童而言,20ml/kg体重,如果没有临床反应,再输注类似剂量。
过敏反应?
气道、呼吸、循环、残疾、暴露
诊断-寻找:
- 疾病的急性发作
- 危及生命的呼吸道和/或呼吸和/或循环问题1
- 通常皮肤会有变化
- 呼救
- 让病人平躺
- 抬高病人的腿
(如果呼吸没有受损)
2肾上腺素
1:1000肾上腺素的肌肉注射剂量(如果没有更好的效果,5分钟后重复)
- 成人500微克肌肉注射(0.5毫升)
- 12岁以上儿童:500微克肌肉注射(0.5毫升)
- 6 -12岁儿童:300微克肌肉注射(0.3毫升)
- 6岁以下儿童:150微克肌肉注射(0.15毫升)
1威胁生命的问题:
气道:肿胀、声音嘶哑、喘鸣
呼吸:呼吸急促、喘息、疲劳、发绀、SpO2 < 92%、意识模糊
循环:苍白、湿冷、低血压、虚弱、昏昏欲睡/昏迷
肌内肾上腺素2
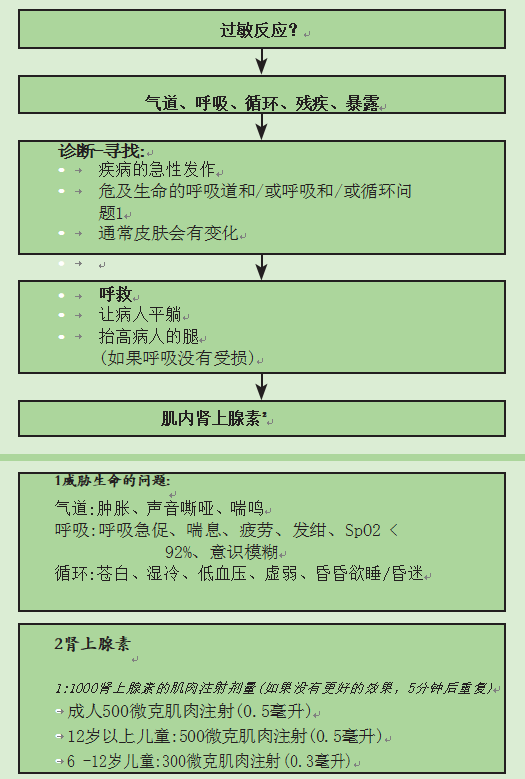
图8.1过敏反应:医疗保健提供者的初始治疗算法(由英国复苏委员会的实物许可复制)
如果支气管痉挛是主要症状,并且对其他治疗没有迅速反应,吸入性支气管扩张剂如沙丁胺醇或特布他林是有用的。
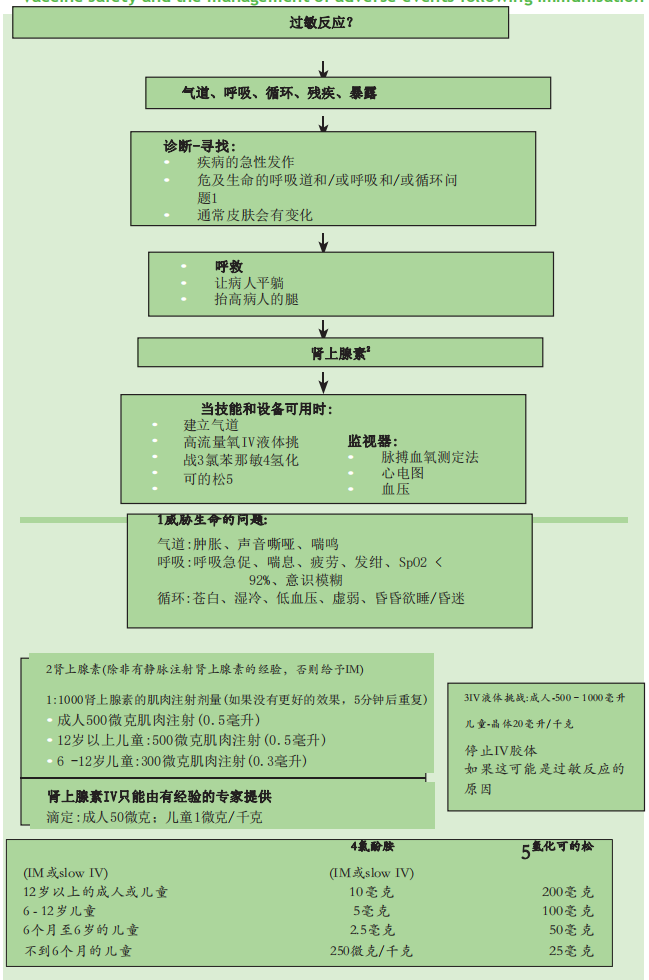
过敏反应?
•当技能和设备可用时:
建立气道
高流量氧IV液体挑战3氯苯那敏4氢化可的松5
监视器:
- 脉搏血氧测定法
- 心电图
- 血压
诊断-寻找:
- 疾病的急性发作
- 危及生命的呼吸道和/或呼吸和/或循环问题1
- 通常皮肤会有变化
气道、呼吸、循环、残疾、暴露
- 呼救
- 让病人平躺
- 抬高病人的腿
肾上腺素2
1威胁生命的问题:
气道:肿胀、声音嘶哑、喘鸣
呼吸:呼吸急促、喘息、疲劳、发绀、SpO2 < 92%、意识模糊
循环:苍白、湿冷、低血压、虚弱、昏昏欲睡/昏迷
2肾上腺素(除非有静脉注射肾上腺素的经验,否则给予IM)
1:1000肾上腺素的肌肉注射剂量(如果没有更好的效果,5分钟后重复)
- 成人500微克肌肉注射(0.5毫升)
- 12岁以上儿童:500微克肌肉注射(0.5毫升)
- 6 -12岁儿童:300微克肌肉注射(0.3毫升)
- 6岁以下儿童:150微克肌肉注射(0.15毫升)
3IV液体挑战:成人-500–1000毫升儿童-晶体20毫升/千克
停止IV胶体
如果这可能是过敏反应的原因
肾上腺素IV只能由有经验的专家提供
滴定:成人50微克;儿童1微克/千克
| 4氯酚胺 | 5氢化可的松 | |
| (IM或slow IV) | (IM或slow IV) | |
| 12岁以上的成人或儿童 | 10毫克 | 200毫克 |
| 6 – 12岁儿童 | 5毫克 | 100毫克 |
| 6个月至6岁的儿童 | 2.5毫克 | 50毫克 |
| 不到6个月的儿童 | 250微克/千克 | 25毫克 |
图8.2过敏反应:医疗服务提供者的全面治疗算法(经英国复苏协会许可复制)
参考
Bellman MH, Ross EM and Miller DL (1983) Infantile spasms and pertussis immunisation.
Lancet 7: 1031–4.
Bohlke K, David RL, Marcy SH et al. (2003) Risk of anaphylaxis after vaccination of
children and adolescents. Pediatrics 112: 815–20.
Brown SG (2004) Clinical features and severity grading of anaphylaxis. J Allergy Clin
Immunol 114(2): 371-6.
Canadian Medical Association (2002) In: Canadian Immunisation Guide, 6th edition.
Canadian Medical Association.
Department of Health (2001) Current Vaccine and Immunisation Issues, 8 March. PL/
CMO/2001/1, PL/CNO/2001/1, PL/CPHO/2001/1.
European Medicines Agency http://www.emea.europa.eu/docs/en_GB/document_library/
Scientific_guideline/2009/09/WC500003904.pdf
Leventhal JS, Berger EM, Brauer JA and Cohen DE (2012) . Hypersensitivity reactions to
vaccine constituents: a case series and review of the literature. Dermatitis 23(3):102-9.
Medicines Control Agency (2000) Safety of meningococcal group C conjugate vaccines.
Current Problems in Pharmacovigilance. 26, September: 14.
Prymula R, Siegrist CA, Chlibek R, et al. (2009) Effect of prophylactic paracetamol
administration at time of vaccination on febrile reactions and antibody responses in
children: two open-label, randomised controlled trials. Lancet 374: 1339-50.
Resuscitation Council UK (2008) Emergency treatment of anaphylactic reactions.
Guidelines for healthcare providers. www.resus.org.uk/pages/reaction.pdf. Accessed: Feb
2009.
Simons FE, Roberts JR, Gu X, Simons KJ (1998) Epinephrine absorption in children with
a history of anaphylaxis. J Allergy Clin Immuno 101: 33–7.
UK Committee on Safety of Medicines http://www.mhra.gov.uk/thiomersal
United States Institute of Medicine http://www.iom.edu/Reports/2004/ImmunizationSafety-Review-Vaccines-and-Autism.aspx
World Health Organization http://www.who.int/biologicals/areas/vaccines/thiomersal/en/
World Health Organization http://www.who.int/vaccine_safety/topics/thiomersal/Jun_2008/
en/index.html




